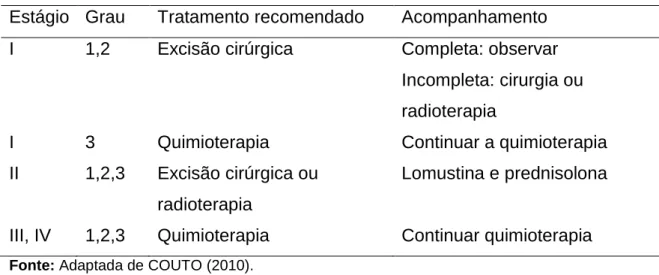
Mast cell tumors are defined as an excessive proliferation of mast cells, arising in the dermis, one of the most common types of canine skin cancer. This study aimed to provide a brief overview of the main clinical and surgical aspects involving cutaneous mast cell tumor in dogs regarding the etiology, epidemiology, clinical presentation, diagnosis, therapeutic management and prognosis. Grade II mastocytoma (Patnaik method) with stroma degradation (circles) and moderate eosinophilia (setas finas) (B).
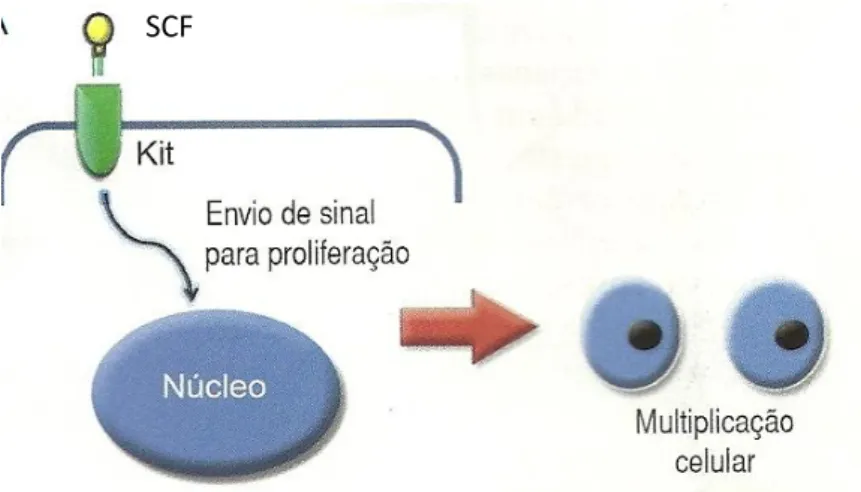
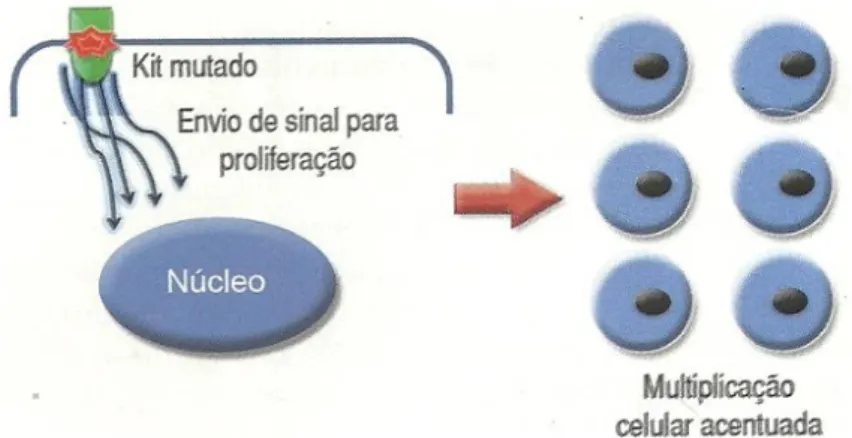
Dentre elas, o mastocitoma (MT) ou mastocitoma é uma das neoplasias cutâneas mais comuns em cães, que se caracteriza pelo crescimento desordenado de mastócitos com alto potencial maligno, ocorrendo quase exclusivamente na pele, embora possa afetam o parênquima, baço, rim e fígado (PINCZOWSKI, 2008; COWELL, 2008; MEIRELLES et al., 2010; PATEL, 2011; BRACARENCE et al., 2012). Vários fatores podem ser úteis na tentativa de avaliar o comportamento biológico da MT, como percentual de crescimento, condições sistêmicas, localização da neoplasia, estágio clínico e grau histopatológico, sendo este último o melhor indicador na determinação do prognóstico (BOSTOCK e DYE, 1973). ; PATNAIK et al., 1984; SIMÕES et al., 1994; THAMM et al., 2006; GRANDES; COSTA, 2014).

ETIOLOGIA
INCIDÊNCIA
A maior incidência nessas raças é atribuída a fatores genéticos, sugerindo maior incidência de mutações no proto-oncogene c-Kit (BENTO et al., 2009). BRACARENSE et al., (2012), em pesquisa mostram maior incidência de MT cutânea em cães sem raça definida (SRD) (36%) e Fila Brasileiro (10%), enquanto foram observados 19,6% de casos na raça Boxer . olhar. Os TM de origem subcutânea são geralmente mal circunscritos, moles, sem sinais de eritema ou úlceras, sendo comumente confundidos com lipomas (CASTRO et al., 2012).
Esses sinais são decorrentes da elevada quantidade sérica de histamina, heparina e outras aminas vasoativas (CASTRO et al., 2012). Porém, se há características da nota III, mesmo que em pequena quantidade, ela domina como nota final (DE NADIR et al., 2002). Isto pode ser realizado para induzir a citorredução de grandes massas neoplásicas (WELLE et al., 2008; LONDRES, 2010).
Os protocolos terapêuticos (Tabela 4) são bastante variados, mas o médico veterinário deve levar em consideração muitos fatores para escolher o protocolo mais adequado (BRACARENSE et al., 2012). E prednisolona para reduzir processos inflamatórios causados pela degranulação (THAMM et al., 2006; GRANT et al., 2008). A crioterapia ou criocirurgia tem demonstrado benefícios no tratamento de TM cutâneas em cães, principalmente em casos de múltiplos tumores com menos de 1 cm de diâmetro (GIUFFRIDA et al., 2003).
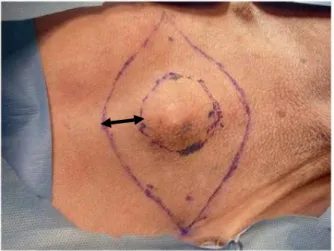
Esta aplicação também deve incluir uma margem de segurança de até 1 cm para reduzir as chances de recorrência (DALECK et al., 2009). O prognóstico pode ser determinado pela relação entre o quadro clínico apresentado e o grau histopatológico do tumor (PATNAIK et al., 1984). Labrador Retriever e Shar-Pei são suscetíveis a desenvolver TMs mais agressivos (PATEL, 2010; MURPHY et al., 2006).
O sistema de classificação de PATNAIK et al. (1984) definem que se estima que os TM Grau I tenham um comportamento menos maligno, uma vez completamente removidos por cirurgia, oferecem um prognóstico favorável, pois são pouco propensos a apresentar recidivas. Os MT grau II podem apresentar complicações, pois são caracterizados por diferenciação intermediária e apresentam comportamento biológico instável, com malignidade progressiva à medida que se tornam indiferenciados (BOSTOCK; DYE, 1973; PATNAIK et al., 1984).
APRESENTAÇÃO CLÍNICA
DIAGNÓSTICO
DIAGNÓSTICO CITOLÓGICO
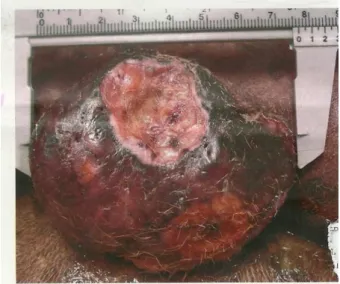
As neoplasias podem ser diagnosticadas ambulatorialmente por exame citológico ou histopatológico. A citologia é realizada por análise microscópica do material coletado do tumor por meio de aspiração com agulha fina (PAAF). A técnica é de fácil execução, pouco traumática, sem necessidade de sedação do animal e não causa grandes danos à massa tumoral (MELO, 2010).
Após a antissepsia preliminar do local com produtos antissépticos (clorexidina e/ou álcool), uma agulha fina acoplada a uma seringa é inserida no nódulo e movida suavemente para frente e para trás, em todas as direções ao longo do comprimento da massa (em um "leque "), ao puxar o êmbolo da seringa cria-se uma pressão negativa, que faz com que o material de dentro da neoplasia seja aspirado. O material coletado é colocado em lâminas pelo método squash, depois corado e analisado ao microscópio (Figura 5). Coleta de material da PAAF (1). Fonte: http://medifoco.com.br/puncao-aspirativa-por-agulha-fina-paaf/, 2016).
Os mastócitos são fáceis de identificar devido à afinidade de seus grânulos por corantes básicos; A coloração de Giemsa é recomendada em citologia quando há suspeita de MT. Embora seja mais utilizado como corante em cortes histológicos, a proporção de coloração da amostra com azul de toluidina é um parâmetro importante no diagnóstico e classificação, uma vez que a coloração em mastócitos neoplásicos bem diferenciados torna-se mais intensa, denotando-a como provável MT baixo. malignidade (SILVA, 2014).
DIAGNÓSTICO HISTOPATOLÓGICO
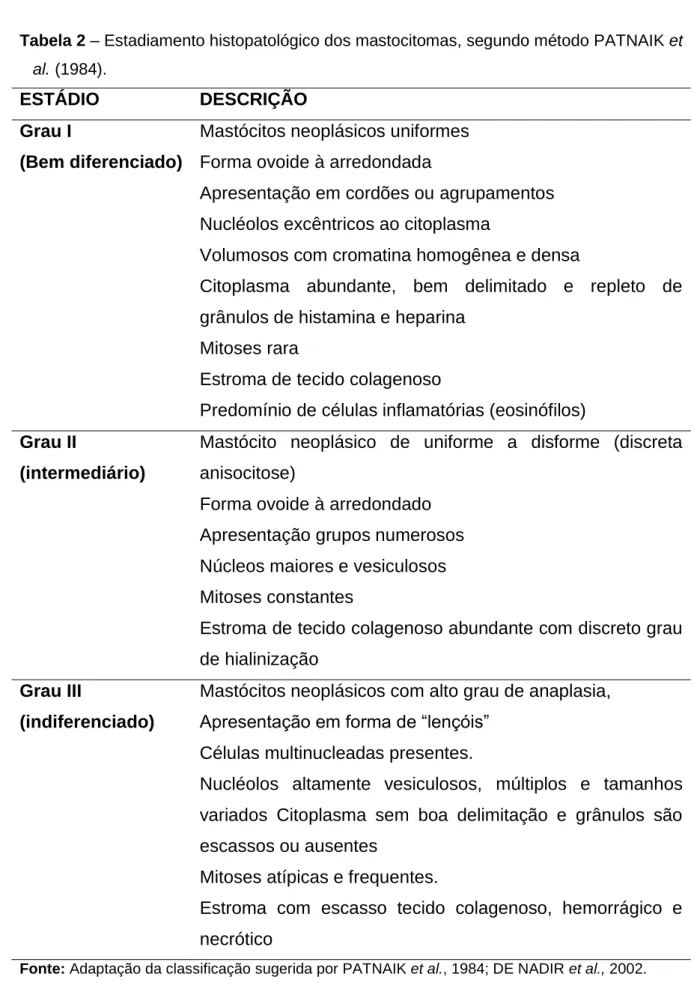
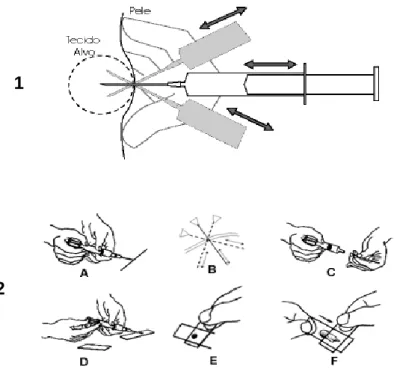
Mastocitoma grau III (método Patnaik) com células aberrantes, citoplasma pálido e sem granulação visível (setas finas) e hialinização do estroma (círculo) (C). Anos mais tarde, PATNAIK et al. 1984), propôs uma nova classificação, determinada de acordo com a observação do comportamento biológico e estrutural dos mastócitos neoplásicos, tais como: extensão do envolvimento tecidual, celularidade e morfologia celular, índice mitótico e reação estromal (Tabela 2). De acordo com a nova classificação, os MT também são divididos em 3 grupos: Grau I, hoje bem diferenciado; Grau II, mastócitos moderadamente diferenciados ou intermediários; e Grau III, mastócitos indiferenciados (Figuras 6 A, B e C).
Estroma com algum tecido colágeno, hemorrágico e necrótico. 1984), que a MT cutânea Grau I é a que apresenta menor potencial metastático e disseminação sistêmica, caracterizada como. É possível, no mesmo corte histológico, encontrar mastócitos neoplásicos em arranjos que se enquadrem nos três tipos de graus, devendo então o MT ser graduado de acordo com o grau mais predominante na amostra. Embora a metodologia de classificação proposta por PATNAIK et al. 1984) é o mais utilizado no diagnóstico histopatológico, desde a publicação de seu estudo, outros autores propõem uma reavaliação do sistema e o estabelecimento de uma nova classificação (KIUPEL et al., 2011) devido à subjetividade do estadiamento, pois é . complexa, podem ocorrer divergências no diagnóstico.
Segundo KIUPEL et al, o alto índice mitótico necessário para classificar a MT como estágio III exclui alguns tumores com índice mais baixo que poderiam representar um comportamento biológico agressivo", por essas razões, diferentes patologistas poderiam interpretar os padrões de forma diferente, indicando imprecisão no sistema de PATNAIK e outros. Na tentativa de padronizar e reduzir interpretações errôneas, KIUPEL et al. 2011) propuseram uma nova classificação histopatológica das MTs utilizando apenas o critério da morfologia celular em dois grupos: as MTs mais ou menos diferenciadas. O maior grau de malignidade é atribuído aos MT menos diferenciados e, inversamente, aos mais diferenciados.
2014) ao comparar os sistemas de classificação PATNAIK et al. 2011) refere-se ao método Kiupel como menos sensível a desvios e com maior precisão nos resultados, mas são necessários mais estudos para padronizá-lo e utilizá-lo.
TRATAMENTO DO MASTOCITOMA
- TRATAMENTO QUIMIOTERÁPICO
- TRATAMENTO CIRÚRGICO
- TRATAMENTO RADIOTERÁPICO
- CRIOTERAPIA
Dentre os quimioterápicos, os agentes alquilantes (lomustina) são os que apresentam melhor resposta no tratamento das MT graus II e III e são seguros para uso. Os alcalóides da vinca (vinblastina, vincristina e vinorelbina) apresentam boa resposta quando usados em combinação com prednisolona, mas podem apresentar alta toxicidade gastrointestinal e estão frequentemente associados à neutropenia (GRANT et al., 2008). O tratamento cirúrgico é considerado a forma de tratamento mais eficiente e é recomendado em todos os casos de TM, onde a localização da neoplasia permite a excisão do tumor (SAKURA et al, 2003).
Essa medida baseia-se na tentativa de remover todo o tecido neoplásico, evitando assim recorrências, pois embora os tumores sejam bem definidos macroscopicamente, microscopicamente a maioria forma áreas de escape além de suas margens palpáveis (DALECK et al., 2009). Nos casos em que o TM está localizado em pontos de difícil acesso, por exemplo nas extremidades dos membros, o estabelecimento de amplas margens de segurança é um fator complicador para o sucesso da excisão tumoral. A radioterapia é bem utilizada no tratamento da TM, principalmente em mastócitos neoplásicos que permanecem após extração incompleta, em metástases, ou quando o volume da TM impede a excisão cirúrgica, promovendo a citorredução (WELLE et al., 2008; DALECK et al., 2009).
O tratamento de grandes massas com radioterapia não é recomendado, pois a radiação pode causar desgranulação dos mastócitos neoplásicos, levando ao surgimento ou agravamento de sinais clínicos sistêmicos, como vômitos e ulcerações gastrointestinais (MAYER, 2006; LONDRES, 2008), que são acompanhados por marca sintomática. é necessário tratamento, com uso de protetores estomacais como Cloridrato de Ranitidina ou Omeprazol (BLACKWOOD et al., 2012). Também deve ser evitado em tratamentos de TM recorrentes, pois a eficácia cai drasticamente em comparação aos resultados do primeiro uso (MISDORP, 2004). Animais com TM graus I e II ressecados sem margem, posteriormente tratados com radioterapia, apresentam sobrevida de até 5 anos em 90% dos casos (MOORE, 2002).
As aplicações são realizadas em 8 a 10 sessões, em ciclos de três a quatro semanas, durante as quais o animal é mantido sob anestesia geral e depois internado para monitoramento dos efeitos colaterais, o que também valoriza seu uso repetido (DALECK et al. , 2009). .
PROGNÓSTICO E SOBREVIDA
De acordo com a localização dos TM, tumores na cavidade oral, cabeça, pescoço, perianal, prepucial, virilha, região subungueal, junções mucocutâneas (como lábios e focinho) tendem a ter prognóstico desfavorável, pois apresentam comportamento muito agressivo, independentemente de sua classificação histológica, que tendem a recidivar ou metastatizar (KIUPEL et al., 2005; THAMM e VAIL, 2007; PATEL et al, 2010; CASTRO, 2012). Em geral, os MT que apresentam crescimento lento e estão presentes por um período mínimo de 6 meses apresentam baixo comportamento maligno, enquanto aqueles que crescem rapidamente e aparecem em até 28 semanas apresentam alto potencial de malignidade (PATEL et al., 2010). Após análise das informações contidas na literatura, concluiu-se que o mastocitoma cutâneo canino consiste em uma neoplasia multifatorial com alto grau de malignidade, mais comum em cães Boxer, que frequentemente desenvolvem sintomas sistêmicos graves.
Embora o comportamento da neoplasia não possa ser previsto com precisão pelo exame histopatológico, é necessário classificar o mastocitoma e a margem alcançada na remoção do tumor. Marcação dupla de c-kit e mib e sua relação com a sobrevivência em cães Boxer afetados por mastocitoma cutâneo. ESTUDO RETROSPECTIVO DO MASTOCITOMA CANINO NO SERVIÇO CIRÚRGICO DE PEQUENOS ANIMAIS - HOSPITAL VETERINÁRIO DA.
Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior. Impact of tumor depth, tumor location, and multiple synchronous measures on the prognosis of canine cutaneous mast cell tumors. Effects of tumor stage and number on the prognosis of dogs with cutaneous mast cells.
Multivariate survival analysis of histological parameters and clinical presentation in canine cutaneous mast cell tumors.