Die Produkte müssen charakterisiert und die erhaltenen Schwingungsspektren mit den Ergebnissen quantenmechanischer Berechnungen verglichen und diskutiert werden. Am Ende der Arbeit soll versucht werden festzustellen, ob ein Halogen-/Pseudohalogen-Austausch mit NSCl2- möglich ist. Auch hier sollte versucht werden, die resultierenden Produkte mittels Einkristallstrukturanalyse zu kristallisieren und zu charakterisieren.
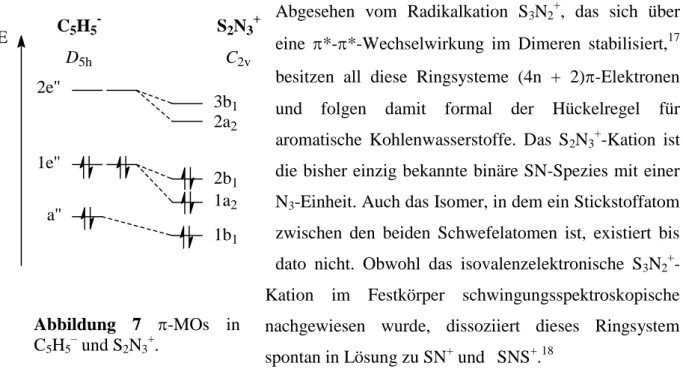
Es gibt mehrere SN-Verbindungen (siehe Tabelle 3) unterschiedlicher Zusammensetzung, stellvertretend ist Tetraschwefeltetranitrid S4N4 zu nennen. In der Gasphase bei Raumtemperatur und Drücken über 1 bar polymerisiert das Monomer zu thermodynamisch instabilem (NSF)4, das ebenfalls eine Ringstruktur aufweist. Nach quantenmechanischen Berechnungen greift Chlorid NCl ohne Barrieren an; Es entsteht das stark polarisierte Anion [NSCl2]-.
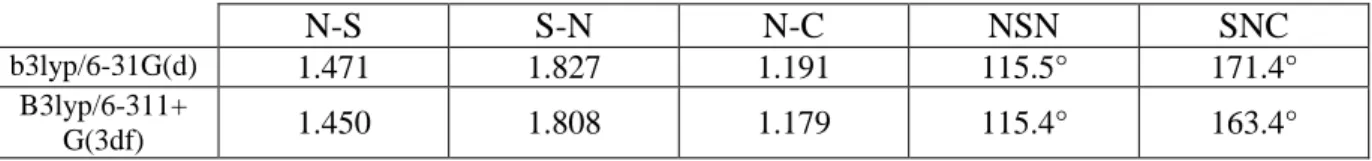
Der NSCl-Winkel beträgt 112,8° aufgrund abstoßender Wechselwirkungen zwischen der S-N--Bindung und den S-Cl--Bindungen. In Lösung (14N NMR) kann neben NSCl oder NSCl)3 nur NS+ nachgewiesen werden, ein Hinweis darauf, dass NSCl bei dieser Reaktion als Cl--Donor fungiert (HgCl2 ist in CH2Cl2 nur wenig löslich).
Reaktion von S 2 2+
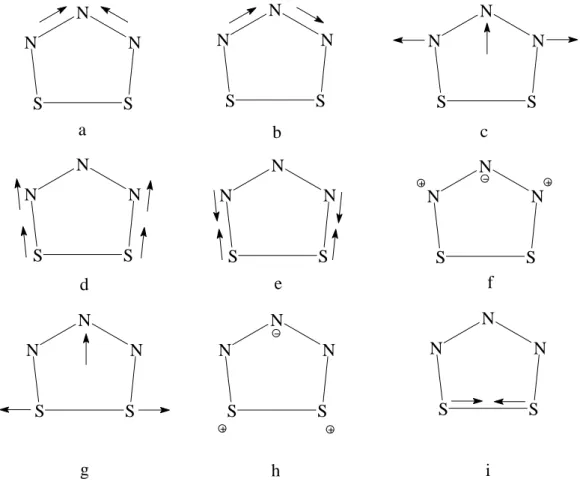
Da die Berechnung nur ein isoliertes Molekül in der Gasphase berücksichtigt, tatsächlich aber an einem Kristall, also einem Festkörper, gemessen wird, weichen Berechnung und Messung teilweise deutlich voneinander ab. Dennoch sind quantenmechanische Berechnungen ein wertvolles Werkzeug, wenn es um die Zuordnung der einzelnen Schwingungsfrequenzen geht. Pfeile stellen die Richtung der Schwingung dar, + oder – beschreiben eine Bewegung außerhalb der Molekülebene.
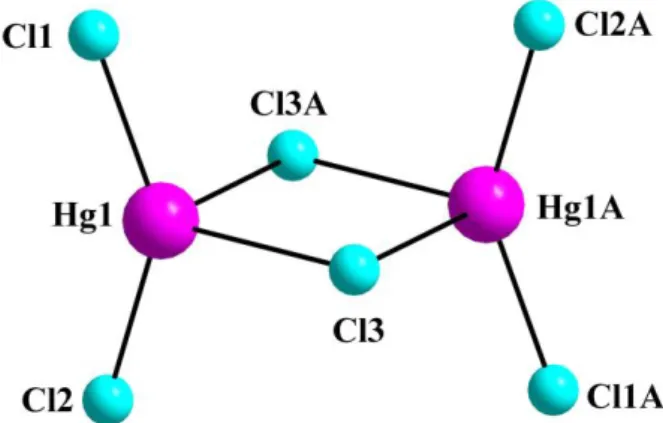
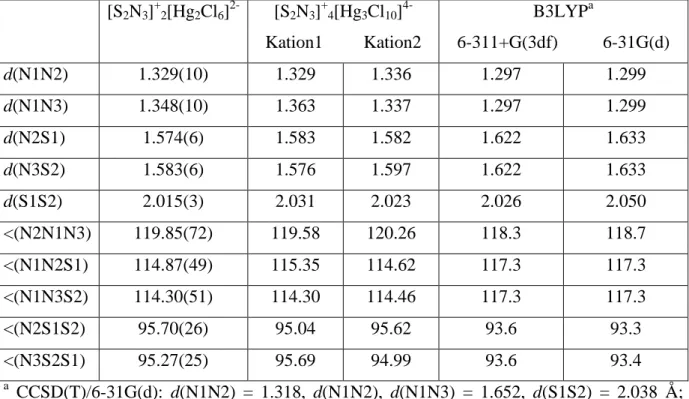
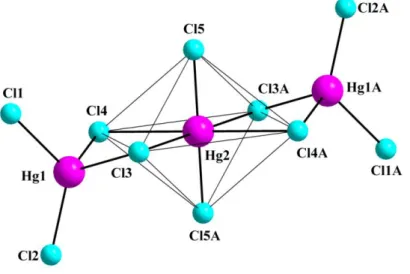
In einem polaren Lösungsmittel kristallisiert CH2Cl2 das Anion Hg2Cl62–, was bereits in vielen Verbindungen beobachtet wurde,18,19 während die Überlagerung von CH2Cl2 mit Hexan das komplexere neue Anion Hg3Cl104– kristallisiert.

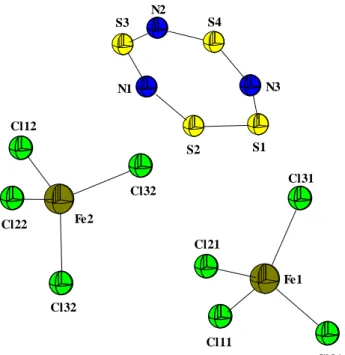
Das S4N32+ [FeCl4]2- kristallisiert monoklin in Form gelber Plättchen in der Raumgruppe P21/m mit vier Formeleinheiten pro Elementarzelle. Die Winkel sind nahezu ideal tetraedrisch (ungefähr und entsprechen denen, die in der Literatur veröffentlicht wurden.21 Weitere Daten finden Sie unter 7.3.
Berechnungen zu Thiazylverbindungen
- Das Thiazylkation NS +
- Das Cyanidion CN -
- Thiazylnitril NSCN
- Thiazylisonitril NSNC
- Thiazyldiisonitril-Anion [NS(NC) 2 ] -
- Thiazyldinitril-Anion [NS(CN) 2 ] -
- Rhodanid-Anion SCN -
- Thiazylthiocyanat NSSCN
- Thiazylisothiocyanat NSNCS
Wenn wir die S-C-Bindung (1,870 Å) mit der Summe der kovalenten Radien von S und C (1,810 Å) vergleichen, sehen wir, dass die S-C-Bindung verlängert ist.28 Dies erklärt die instabile Bindung und die Schwierigkeit in Experimenten, Moleküle zu isolieren. Der NSC-Winkel ist im Vergleich zu NSCI kleiner, die --Abstoßung ist aufgrund des geringeren -Beitrags der NS-Bindung geringer. Wenn wir die S-N-Bindung (1,827 Å) mit der Summe der kovalenten Radien von S und N (1,740 Å) vergleichen, sehen wir, dass die S-N-Bindung verlängert ist.28 Dies erklärt die instabile Bindung und die Schwierigkeit im Experiment, das Molekül isolieren. .
Die S-N-Bindung ist relativ lang und hat eine kleine Schwingungswellenzahl, der NSN-Winkel ist etwas größer als bei Thiazylnitril und die Reaktionsenergie ist stärker exotherm. Im Vergleich zu Thiazylnitril ist die N-S-Bindung etwas kürzer und etwas stärker, aber viel schwächer als im Thiazyldiisonitril-Isomer. Der Winkel NSC ist größer als im Thiazylnitril (stärkere --Abstoßung), der Winkel SCN ist kleiner.
Der NSC-Winkel ist etwas kleiner, der CSC deutlich kleiner im Vergleich zum vorherigen Ergebnis. Die S-N-Bindung ist relativ lang (1.872 Å im Gegensatz zur Summe der kovalenten Radien von 1.740 Å).28 Diese schwache S-N-Bindung erklärt die Schwierigkeiten bei der experimentellen Isolierung des Moleküls.
Zusammenfassung
Die Bindungslängen und -winkel der Produkte, die aus der Cl-Substitution durch Pseudohalogenide resultieren, wurden durch quantenmechanische Berechnungen bestimmt. Beim Ersatz von Cl- durch Pseudohalogenide an [NSCl2]- konnten Hinweise auf die gebildete Spezies [NSX2]- nur im 14N-NMR-Experiment gefunden werden. Weder starke Verdünnung noch der Einsatz von Kältebädern (-70°C) verhinderten die Polymerisationsreaktionen.
Das gebildete [NSX2]- konnte selbst durch den Einsatz von Abfangreagenzien (CuNO3*4MeCN, (PdCl2PEt3)2) nicht stabilisiert werden.
Experimenteller Teil
Arbeitstechnik
Ausgangsverbindungen und Lösemittel
Analysemethoden
Darstellung der Ausgangschemikalien
- AgSCN
- AgOCN
- CuNO 3 * 4MeCN
Es bildet sich ein weißer Niederschlag von AgCN, die Suspension wird 2 Stunden unter Lichtausschluss gerührt und anschließend abfiltriert. Durch Zugabe von AgCN unter Rühren entsteht sofort ein weißer Niederschlag von AgCl, der im Licht schnell schwarz wird. Die Zugabe von AgSCN unter Rühren erzeugt sofort einen weißen Niederschlag von AgCl, der im Licht schnell schwarz wird.
[Ph4P]+[Cl]- wird in 15 ml CH2Cl2 in einem Schlenk-Kolben gelöst und frisch zubereitetes Silberisocyanat wird langsam zugegeben. Es bildet sich ein rötlicher Niederschlag aus AgCl, der nach 30-minütigem Rühren bei Raumtemperatur mit einer A4-Fritte abgetrennt wird. Zu dieser Mischung wird unter Rühren und Abkühlen im Eisbad langsam festes AgNO3 zugegeben, wobei sich vorübergehend eine grünblaue Farbe bildet.
Die Mischung wird 30 Minuten lang unter Rühren auf 100 °C am Rückfluss erhitzt und die heiße Lösung mit einer G3-Fritte vom gebildeten Kupfer- und Silberniederschlag abgetrennt.
Untersuchte Reaktionen
- Darstellung von Hg(NSCl 2 ) 2
- Darstellung von [S 2 N 3 ] + 4 [Hg 3 Cl 10 ] 4-
- NaN 3 und S 2 Cl 2
Im Gegensatz zu allen anderen Reaktionen verfärbt sich die Lösung auch nach mehreren Wochen nicht. Der klaren gelben Lösung wird Hexan zugesetzt und nach einigen Tagen kristallisieren gelbe Nadeln. Nach 5-minütigem Rühren ist die Lösung grünlich, was auf das (NSCl)3 (gelb)/3NSCl (grün)-Gleichgewicht hinweist.
An der Tropfstelle dunkelt die Lösung kurzzeitig nach, wird aber nach einigen Minuten wieder klar gelb. Die Lösung wird dunkler, nach einigen Tagen bilden sich am Boden des Reaktionsgefäßes rotbraune Kristalle. Die klare orangefarbene Lösung wird mit Hexan beschichtet, was zu einer Verdunkelung der Farbe führt.
Die gelbe Lösung wird auf 0°C abgekühlt und 0,5 ml BCl3-Lösung (1,0 molar in Hexan) werden langsam tropfenweise über eine Spritze unter Rühren zugegeben. Die Lösung wird eingeengt und nach einigen Tagen erhält man wiederum farblose Kristalle, die durch Röntgenstrukturanalyse charakterisiert werden. Die klare gelbe Lösung (Farbe analog zu 4.6.17) wird mit gekühltem Hexan überschichtet und bei -15°C kristallisieren gelassen.
Wird der gelben Lösung AgSCN zugesetzt, verfärbt sich die Lösung braun, teilweise aufgrund von unlöslichem AgSCN und teilweise aufgrund von AgCl. (PdCl2PEt3)2 wird zu der klaren gelben Lösung gegeben, die Lösung färbt sich sofort orange und es wird ein feiner Niederschlag beobachtet. Der gelb-orangen Komplexbildnerlösung wird eine äquimolare Menge festes Tetrakis(acetonitril)kupfer-I-nitrat CuNO3 * 4 MeCN zugesetzt.
Wird der gelben Lösung AgCN zugesetzt, bildet sich unter einer rotbraunen Lösung ein heller, „käsiger“ Niederschlag (AgCl). Aus der erhaltenen klaren rotbraunen Lösung wird ein 14N-NMR erstellt und anschließend mit Hexan überschichtet. Die Lösung wurde zur Kristallisation mit einer äquivalenten Menge Hexan überschichtet und bei RT stehen gelassen.
Bereits nach wenigen Stunden bildete sich ein feiner gelber Niederschlag und die Lösung wurde immer dunkler (braun).
Anhang
Literatur