Alexandre Guimarães de Almeida Barros
Regulação da homeostase energética pelo sistema dopaminérgico no modelo
Caenorhabditis elegans
Regulação da homeostase energética pelo sistema dopaminérgico no modelo
Caenorhabditis elegans
Tese apresentada à Faculdade de Medicina da Universidade Federal de Minas Gerais como requisito parcial para obtenção do grau de Doutor em Medicina;
área de concentração: Medicina Molecular.
Orientador: Marco Aurélio Romano-Silva
Universidade Federal de Minas Gerais Faculdade de Medicina
Somos capazes de feitos que vão desde a desintegração do átomo até o lançamento de objetos tripulados ao espaço. Movida pela inquietação da alma, a ciência imita o sonho e redefine os limites do corpo. O conhecimento nos deixa mais próximos da fronteira infinita da imaginação, entretanto, compreendê-lo explicita nossa condição.
Agradeço a todos aqueles que me mostraram, de uma forma ou de outra, que o homem continua humano, com seus vícios e virtudes. Sou grato, em especial, aos meus pais, fonte inesgotável de amor, a Luzia e a Elza, sempre presentes, e aos mestres, Marco e Kaveh, por iluminarem os caminhos para ser um cientista.
“Science is a way of thinking much more than it is a body of knowledge.”
A regulação da homeostase energética, refletida no conteúdo de gordura, envolve uma complexa integração, por circuitos neuronais, de informações internas e externas sobre a demanda energética e a disponibilidade de alimentos. Evidências sugerem o neurotransmissor dopamina como importante componente na regulação do peso corporal. No geral, o sistema dopaminérgico tem sido associado a alterações no comportamento de busca pelo alimento e integração dos fatores relacionados à saciedade. Entretanto, lacunas ainda existem sobre os mecanismos através dos quais a dopamina regula a homeostase energética. Este trabalho mostrou que a sinalização
dopaminérgica regula as reservas lipídicas no verme Caenorhabditis elegans. As
análises revelaram que a regulação não é secundária a modificações no comportamento alimentar, movimento ou reprodução. Observou-se que o efeito de redução da reserva energética induzida pela dopamina foi dependente dos receptores dopaminérgicos e de algumas enzimas catalisadoras da oxidação lipídica. Em congruência com este fato, verificou-se que a dopamina aumenta o fluxo através das vias de oxidação lipídica. Os achados indicam uma função primária do sistema dopaminérgico na regulação do conteúdo lipídico, sugerindo que a dopamina ativa cascatas de sinalização que, no final, mobilizam os estoques periféricos de gordura.
Palavras-chave: dopamina, metabolismo, Caenorhabditis elegans, sistema
The regulation of energy balance, as reflected in fat content, involves an intricate interplay between neural mechanisms that respond to internal and external cues of energy demand and food availability. Compelling data have implicated the neurotransmitter dopamine as an important component of body weight regulation. Overall, the dopaminergic system has been linked to alteration in food seeking and satiety behaviors. However, the precise mechanisms through which dopamine regulates energy homeostasis remain poorly understood. Here, we show that dopamine signaling
regulates fat reservoirs in Caenorhabditis elegans. Our analyses revealed that the
metabolic modulation could not be accounted for by changes in animal feeding behavior, movement or reproductive rate. Instead, we found that the fat reducing effects of dopamine were dependent on dopaminergic receptors and a set of fat oxidation enzymes. Accordingly, we show that excess dopamine signaling causes increased rates of fat oxidation. Together, our findings reveal an ancient role for dopaminergic regulation of fat and suggest that dopamine signaling elicits this outcome through cascades that, ultimately, mobilizes peripheral fat storage depots.
Keywords: dopamine, metabolism, Caenorhabditis elegans, dopaminergic system,
Figura 1 – Riscos relativos de morte por doença cardiovascular, câncer e outras causas relacionados com o índice de massa corporal.
Figura 2 – Mecanismo proposto para manutenção da homeostase energética.
Figura 3 – Efeito da administração de leptina em paciente com deficiência do hormônio. Figura 4 – Diagrama mostrando a multiplicidade de sinais integrados pelo SNC.
Figura 5 – Representação de parte da circuitaria neuronal do sistema integrador de manutenção da homeostase energética no SNC.
Figura 6 – Os receptores dopaminérgicos e as vias de transdução de sinal. Figura 7 – O verme Caenorhabditis elegans.
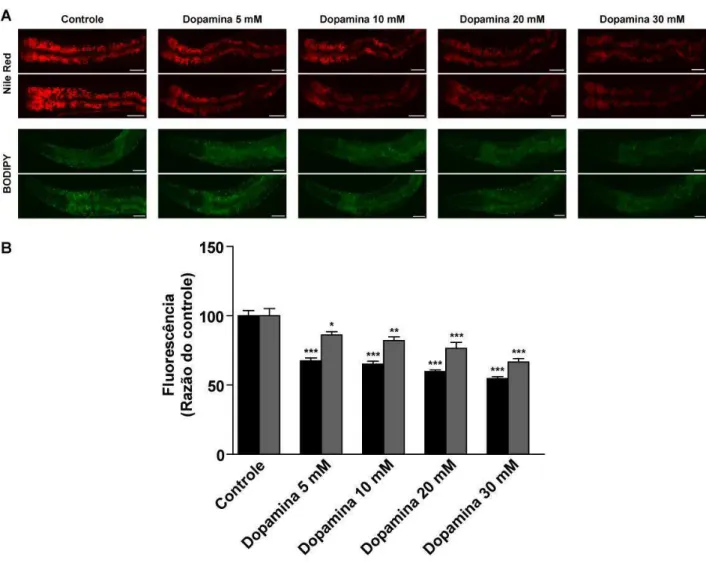
Figura 8 – Exposição à dopamina exógena reduz o conteúdo lipídico nos animais selvagens. Figura 9 – A redução da gordura induzida pela dopamina é independente do estágio larval e condição de cultivo.
Figura 10 – A redução lipídica induzida pela dopamina requer a continua exposição ao neurotransmissor.
Figura 11 – A dopamina reduz a quantidade de triglicérides no verme selvagem.
Figura 12 – O efeito dopamina na homeostase energética depende dos receptores dopaminérgicos.
Figura 13 – Marcação com o corante Sudan Black dos mutantes com perda de função para os
receptores dopaminérgicos DOP-1 e DOP-3.
Figura 14 – A redução lipídica induzida pela dopamina não é secundária a outros comportamentais.
Tabela 1 – Classificação da obesidade baseada no Índice de Massa Corporal. Tabela 2 – Cepas mutantes utilizadas.
-MSH -Hormônio estimulador de melanócito
(db/db) “diabetic/diabetic”
(ob/ob) “obese/obese”
AADC Decarboxilase de aminoácido aromático
AgRP Proteína relacionada à agouti
AMP Monofosfato de adenosina
AMPK Proteína quinase ativada por AMP
ATP Trifosfato de adenosina
ATV Área Tegmentar Ventral
BAR Busca em Área Restrita
BDNF Fator neurotrófico derivado do cérebro
BLAST “Basic Local Aligment Search Tool”
BSA Albumina do soro bovino
BSR “Basal Slowing Response”
CART Transcrito regulado por cocaína e anfetamina
CATIE “Clinical Antipsychotic Trials of Intervention Effectiveness”
CCK Colecistocinina
CGC “Caerhabditis Genetic Center”
CHAPS “3-[(3-Cholamidopropyl)dimethylammonio]-1-propanesulfonate”
D1R Receptor de dopamina D1
D2R Receptor de dopamina D2
D3R Receptor de dopamina D3
D4R Receptor de dopamina D4
D5R Receptor de dopamina D5
DAT Transportador de dopamina
DIC “Differential Interference Contrast” DTT “Dithiothreitol”
EDTA “Ethylenediaminetetraacetic acid”
EGTA “Ethylene-bis(oxyethylenenitrilo)tetraacetic acid”
EPM Erro Padrão da Média
ESR “Enhanced Slowing Response” FITC Isotiocinanato de fluoresceína
GABA Ácido-aminobutírico
GFP “Green Fluorescent Protein”
Gi Proteína G da classe i
Gq Proteína G da classe q
Gs Proteína G da classe s
GTP Trifosfato de guanosina
Gs Subunidade da Proteína G da classe s
“Isopropyl β thiogalactopyranoside” KD “Knockdown”
KO “Knockout”
LDL Lipoproteína de baixa densidade
LHA Área Hipotalâmica Lateral
MC3 Receptor de Melanocortina do tipo 3
MC4 Receptor de Melanocortina do tipo 4
MCH Hormônio Concentrador de Melanina
NDM Núcleo Dorso-medial
NHR Receptor de Hormônio Nuclear
NPY Neuropeptídeo Y
NSQ Núcleo Supra-quiasmático
NVM Núcleo Ventro-medial
PET Tomografia por emissão de pósitrons
PIPES “1,4-Piperazinediethanesulfonic acid”
PKA Proteína quinase A
PLC- Fosfolipase C beta
POMC Proopiomelanocortina
PTP1B Fosfotirosina fosfotase 1B
PYY Peptídeo YY
SN Substância nigra
SNC Sistema Nervoso Central
SOCS-3 Supressor da sinalização da citocina 3
SREBP Proteína de ligação no elemento regulatório do esterol
STAT3 Transdutor de sinal e ativador da transcrição 3
TAG Triglicérides
TCEP “tris(2-carboxyethyl)phosphine”
TGF- Fator de crescimento tumoral beta
TGI Trato Gastrointestinal
TH Tirosina hidroxilase
TLC Cromatografia de camada fina
TOR Alvo da Rapamicina
TPH-1 Triptofano hidroxilase 1
TrkB Receptor tirosina quinase B
1 Introdução ... 14
1.1 Obesidade ... 14
1.1.1 Definição de obesidade ... 14
1.1.2 Prevalência ... 16
1.2 Homeostase energética e sua regulação ... 17
1.2.1 Regulação da homeostase energética: um processo ativo ... 18
1.2.2 Genética da homeostase energética ... 19
1.2.3 Sistema integrado de manutenção da homeostase energética ... 19
1.2.4 Sistema nervoso central: o maestro da homeostase energética ... 20
1.2.5 Sinais carreadores das informações metabólicas ... 21
1.2.6 Transdução e integração das informações metabólicas pelo SNC ... 27
1.3 Sistema dopaminérgico ... 35
1.3.1 Anatomia e fisiologia do sistema dopaminérgico nos mamíferos ... 36
1.3.2 Dopamina e a homeostase energética ... 39
1.3.3 Homeostase energética nos camundongos KOpara a enzima tirosina hidroxilase ... 40
1.3.4 Neurônios dopaminérgicos monitoram o estado metabólico ... 42
1.3.5 Envolvimento do sistema dopaminérgico na recompesa e suas implicações para a homeostase energética ... 45
1.3.6 Receptores dopaminérgicos e a homeostase energética ... 47
1.3.7 Esquizofrenia, antipsicóticos e homeostase energética ... 49
1.3.8 A questão sobre a dopamina e o metabolismo ... 51
1.4 O modelo Caenorhabditis elegans ... 52
1.4.1 O sistema dopaminérgico no verme ... 54
1.4.1.1 Anatomia, síntese, armazenamento e recaptação ... 55
1.4.1.2 Comportamentos que envolvem o sistema dopaminérgico do verme ... 57
1.4.1.3 Receptores dopaminérgicos no verme ... 61
1.4.2 O verme: modelo para estudo do metabolismo ... 67
1.4.2.1 Composição lipídica ... 68
2.2 Objetivos específicos ... 73
3 Métodos ... 74
3.1 Manutenção e cultura do verme C. elegans ... 74
3.2 Tratamento com dopamina exógena... 76
3.3 Ensaio de batimento faríngeo ... 77
3.4 Ensaio de movimento ... 77
3.5 Ensaio de defecação ... 78
3.6 Ensaios de reprodução... 78
3.7 Marcação lipídica com corantes vitais e aquisição das imagens ... 79
3.8 Marcação de vermes fixados pelo Sudan Black... 79
3.9 Knockdown por alimentação com RNA de interferência (RNAi) ... 80
3.10 Extração lipídica e medição de triglicérides através de cromotografia de camada fina (TLC) ... 81
3.11 Ensaio da velocidade de oxidação lipídica ... 83
3.12 Programas utilizados para análise de imagens e estatística ... 84
4 Resultados e discussão ... 85
4.1 Exposição crônica à dopamina exógena causa redução dos triglicérides no verme C. elegans ... 85
4.2 A síntese de dopamina regula o perfil lipídico no C. elegans ... 96
4.3 Receptores dopaminérgicos regulam os níveis de gordura no C. elegans ... 98
4.4 A redução do conteúdo lipídico pela dopamina exógena é dependente dos receptores dopaminérgicos ...101
4.5 O efeito de redução lipídica pela dopamina não pode ser atribuído à alterações no comportamento...102
4.6 A dopamina causa redução dos estoques energéticos através do aumento da oxidação lipídica ...105
4.7 Discussão final ...108
5 Conclusão ...112
6 Referências ...114
1 Introdução
1.1 Obesidade
A habilidade de estocar o excesso energético é essencial para a sobrevivência em ambiente onde a alimentação é intermitente. Os adipócitos são células adaptadas para armazenar o excesso calórico como triglicérides, liberando-os para uso em outros tecidos e órgãos quando necessário. O funcionamento do sistema é orquestrado por circuitos neuronais e eixos endócrinos, permitindo a sobrevivência por meses sem a ingestão de alimentos. Entretanto, a abundância atual de alimentos com alto valor energético, associada a hábitos de vida sedentários e influenciados, ainda, pela carga genética, torna distorcida a função do sistema de conservação de energia, resultando no acúmulo calórico excessivo, com consequências adversas para a saúde.
1.1.1 Definição de obesidade
à insulina, neoplasias e a mortalidade geral são exemplos de condições influenciadas
pelo excesso de peso (Figura 1) (Ogden et al., 2007).
O índice de massa corporal (IMC = peso (Kg) / altura2 (m)) é o método mais
adotado para a expressão do peso corporal. Baseado em estudos epidemiológicos, determinou-se que IMC acima de 30 aumenta consideravelmente a morbidade e mortalidade associadas à várias condições, sendo este valor considerado o parâmetro antropológico para o diagnóstico de obesidade em ambos os sexos. Outros estudos mostraram que o aumento na morbidade e mortalidade já ocorre nos valores do IMC acima de 25, sugerindo que este ponto deve ser considerado. Atualmente, baseado nos
valores do IMC, o peso corporal é agrupado da seguinte forma: < 18.5 kg/m2 baixo
peso, entre 18.5 e 24.9 kg/m2 peso normal, entre 25 e 29.9 kg/m2 sobrepeso, ≥ 30 kg/m2
obesidade (Tabela 1) (Figura 1).
Figura 1 – Riscos relativos de morte por doença cardiovascular, câncer e outras causas relacionados com o índice de massa corporal.
Riscos relativos de morte por (...) doença cardiovascular, (--) câncer e (–) outras causas plotados contra o índice de massa corporal em ambos os sexos. Adaptado de Calle et al., 1999.
1.1.2 Prevalência
O aumento na prevalência da obesidade é uma tendência da população mundial (Flier, 2004). Especificamente nos adultos americanos, mostrou-se o aumento na prevalência de sobrepeso e obesidade de 13% para 33% nos últimos 20 anos (Ogden
et al., 2006; Flegal et al., 2002). Neste período, a análise da curva global de distribuição
do IMC mostra achatamento associado a um deslocamento para a direta, o que indica
Flegal et al., 2002; Ogden et al., 2007). A prevalência da obesidade difere entre as
diversas etnias e sexo. Por exemplo, afrodescendentes, nativos americanos e mulheres
têm maior tendência de aumento no IMC (Ogden et al., 2006; Flegal et al., 2002; Ogden
et al., 2007). Este fenômeno é observado em outros países do mundo, apesar da
velocidade de ocorrência maior nos países desenvolvidos (Ogden et al., 2007; James,
2008).
1.2 Homeostase energética e sua regulação
Independentemente das variações diárias entre a quantidade de energia ingerida e gasta pelo organismo, um balanço preciso iguala a quantidade de energia adquirida do ambiente, através da alimentação, com a utilizada para manutenção das necessidades fisiológicas essenciais e voluntárias. Este fenômeno é reflexo de um
processo regulatório ativo, denominado homeostase energética (Schwartz et al., 2000;
Morton et al., 2006). Através deste processo, a ingestão e o gasto calórico são
1.2.1 Regulação da homeostase energética: um processo ativo
Alterações do peso ocorrem em consequência da ingestão calórica superior ou inferior àquela requerida pelo organismo. Entretanto, adaptações fisiológicas às alterações do peso são robustas. O organismo é protegido contra a expansão ou redução do peso corporal causadas, por exemplo, por excessos alimentares ou doença, indicando que mecanismos adaptativos operam tanto para limitar o ganho como a perda de peso (Morton et al., 2006).
A avaliação do metabolismo energético em indivíduos obesos e magros revelou que a perda ou ganho de peso voluntários resultam em alterações compensatórias similares. Observou-se que o aumento ou redução em 10 % do peso original é acompanhado de 16 % de aumento ou 15 % de redução, respectivamente, no gasto energético total de 24 horas durante todo o período de manutenção voluntária do novo
peso (Leibel et al., 1995). Não foram observadas alterações compensatórias no gasto
energético quando a perda foi superior a 10% do peso original, o que sugere limite na atuação dos mecanismos adaptativos (Leibel et al., 1995). Sugere-se que o aumento ou redução do peso corporal desencadeiam modificações adaptativas no gasto calórico, através da modulação do gasto energético basal ou ativo, objetivando trazer o estoque
energético corporal para o nível anterior (Leibel et al., 1995). O fato da resposta
adaptativa ser semelhante em indivíduos obesos ou magros, sugere sistema regulatório único atuando para manter a composição corporal.
1.2.2 Genética da homeostase energética
Embora alterações ambientais, como mudanças no padrão dietético e de atividade física, tenham contribuído peremptoriamente para o aumento na prevalência
do ganho de peso, é importante considerar a hereditariedade deste fenômeno (Barsh et
al., 2000; Farooqi e O’Rahilly, 2008; Rankinen e Bouchard, 2006). A contribuição
genética nos distúrbios do peso foi estabelecida através de análises familiares, estudos com gêmeos e crianças adotadas e análises populacionais. Acredita-se que a carga
genética contribua entre 50% e 90% para o fenótipo (Barsh et al., 2000; Farooqi e
O’Rahilly, 2008; Rankinen e Bouchard, 2006).
Análise de síndromes raras, caracterizadas por obesidade extrema, elucidou a participação de várias moléculas no controle da homeostase energética. Alguns exemplos são o hôrmonio leptina e seu receptor, o sistema das melanocortinas e a via
de sinalização do fator neurotrófico cerebral (do inglês “Brain-derived Neurotrophic
Factor”(BDNF)). Alterações genéticas brandas nestes e em outros genes foram ligadas
ao quadro poligênico da obesidade comum (Barsh et al., 2000; Farooqi e O’Rahilly,
2008; Rankinen e Bouchard, 2006). Conclui-se que as abordagens genéticas são importantes no entendimento da patogênese do ganho de peso.
1.2.3 Sistema integrado de manutenção da homeostase energética
ambientais, do desenvolvimento, do ritmo circadiano e circanual, do ciclo de vida e lactação, indicando ampla flexibilidade do mesmo (Leibel, 2008; Berthoud, 2002). A disfunção do sistema de integração pode ocorrer como resultado de anormalidades em vários dos seus componentes ou mesmo devido à alteração do próprio “set point”
metabólico (Leibel, 2008).
Estratégias terapêuticas para o tratamento de doenças como anorexia ou obesidade, que envolvam mudanças na ingestão calórica ou no gasto energético, desencadeiam respostas compensatórias coordenadas pelo sistema integrativo. Isto explica a recidiva da obesidade em aproximadamente 95% dos pacientes obesos que emagreceram voluntariamente com sucesso por curto período de tempo (Wing e Phelan, 2005; Leibel, 2008). Entretanto, a manutenção da terapêutica por período
prolongado está associada à baixa recidiva, o que indica plasticidade do “set point”
energético (Wing e Phelan, 2005). Sugere-se que o entendimento do sistema regulatório, nos estados alterados do metabolismo energético e suas causas, permitiria a identificação dos mecanismos moleculares responsáveis pelo mesmo e, consequentemente, o desenvolvimento de métodos eficazes para modificá-lo (Leibel, 2008; Berthoud, 2002).
1.2.4 Sistema nervoso central: o maestro da homeostase energética
lesões nas mesmas regiões resultam em fenótipos parecidos (Leibel, 2008; Berthoud,
2002; Seeley e Woods, 2003; Morton et al., 2006).
A integração dos sinais referentes ao estado metabólico e a elaboração das respostas adaptativas para a manutenção da homeostase energética estão distribuídas por uma rede neuronal que envolve estruturas do tronco encefálico, sistema límbico,
córtex e hipotálamo (Seeley e Woods, 2003; Morton et al., 2006; Schwartz et al., 2000).
Propõe-se que, através de fatores hormonais e sinais neurais aferentes, as informações sobre o estado nutricional são disponibilizadas para o SNC, que as integra com informações cognitivas, visuais, olfatórias e gustatórias, e elabora respostas que
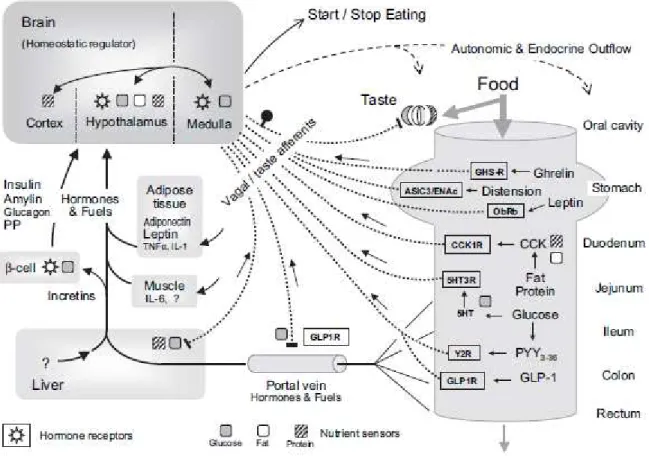
mantêm a homeostase energética (Figura 2) (Morton et al., 2006; Schwartz et al., 2000).
Figura 2 – Mecanismo proposto para manutenção da homeostase energética.
Através de sinais neurais e fatores hormonais, informações sobre o estado metabólico corporal e disponibilidade de fontes alimentares são integradas no sistema nervoso central (SNC), que coordena os mecanismos efetores, mantendo, dessa forma, o balanço energético.
1.2.5 Sinais carreadores das informações metabólicas
O tecido adiposo é o principal sítio de reserva energética. Foi sugerido que sinais inibitórios gerados em proporção à quantidade de gordura corporal agiriam em alças de “feedback” negativo para o SNC, reduzindo, assim, a ingestão calórica. Outros
Sinais neurais e hormonais
Integração e coordenação das respostas
no SNC
postularam a insulina como sinal indicador do nível energético corporal (Seeley e
Woods, 2003; Morton et al., 2006; Schwartz et al., 2000). Experimentos parabióticos
nas cepas de camundongos, fenotipicamente obesos, “obese” (ob/ob) e “diabetic”
(db/db), e em ratos e macacos indicaram a presença de um fator circulante cuja
concentração era proporcional à quantidade de gordura (Friedman e Halaas, 1998). Foi proposto também que sinais metabólicos, derivados, por exemplo, do trato gastrointestinal, proveriam informações para o SNC resultando no término da refeição (Berthoud, 2002; Leibel, 2008). Estas evidências e especulações impulsionaram a identificação de vários fatores peptídicos e hormônios circulantes que funcionam como sinais metabólicos.
O SNC integra cinco tipos de sinais fisiológicos para a manutenção da homeostase energética: sinais derivados do tecido adiposo, provenientes do trato gastrointestinal (TGI), das glândulas endócrinas, elaborados a partir dos nutrientes circulantes e sinais gerados no próprio SNC através do sistema de recompensa e
órgãos sensoriais (Morton et al., 2006).
Os estudos nos modelos de camundongos obesos, ob/ob e db/db, revelaram que
camundongos ob/ob eram deficientes em um fator circulante, enquanto camundongos
db/db produziam o fator em excesso, mas não respondiam ao mesmo (Friedman e
Halaas, 1998). Demonstrou-se que os camundongos ob/ob carregam mutação, com
perda de função, no gene ob, posteriomente identificado como codificador do hormônio
peptídico leptina, produzido com aparente exclusividade no tecido adiposo (Tartaglia et
al., 1995). A concentração de leptina circulante é proporcional à quantidade de tecido
adiposo. Sua administração nos camundongos ob/ob reverte o fenótipo de obesidade,
hiperfagia, hiportemia, atividade motora reduzida e outras anormalidades neuroendócrinas e imunológicas (Freidman e Halaas, 1998). No gene humano, mutações com perda de função, apesar de raras, levam à síndrome semelhante àquela
observada nos camundongos ob/ob (Figura 3) (Farooqi e O’Rahilly, 2006). Da mesma
forma, a administração de leptina exógena reverte o quadro (Farooqi e O’Rahilly, 2006).
expressão do receptor de leptina hipotalâmico e aumento do panículo adiposo. Mais ainda, a administração de leptina reverte o estado metabólico alterado dos pacientes com lipodistrofia, síndrome marcado pela ausência do tecido adiposo (Oral, 2002; Coll
et al., 2007; Seeley e Woods, 2003; Leibel, 2008). Sugere-se assim que a leptina
sinaliza nas vias de informação utilizadas pelo SNC para monitorar o estado metabólico e suas transições (Friedman e Halaas, 1998).
Figura 3 – Efeito da administração de leptina em paciente com deficiência do hormônio.
A administração de leptina recombinante reverte o fenótipo da síndrome de deficiência de leptina, marcado, principalmente, pela obesidade. Adaptado de Farooqi e O’Rahilly, 2006.
falha da regulação energética nas formas comuns de obesidade. Os mecanismos propostos incluem alteração do transporte hormonal pela barreira hematoencefálica e alterações das vias de sinalização, como mudanças na expressão das proteínas SOCS-3 e PTP1B, que estão relacionadas com a sensibilidade ao hormônio (Munzberg e
Myers, 2005; Margetic et al., 2002). Outros fatores, como adiponectina e
interleucina-6, são secretados pelo tecido adiposo. Entretanto, o papel destes na
regulação da homeostase energética ainda é motivo de debate (Coll et al., 2007).
Os sinais provenientes do TGI agem diretamente no SNC ou através da modulação da atividade de neurônios sensoriais. Serão revisadas a função de três peptídeos relacionados com a homeostase energética, lembrando que outros fatores podem estar relacionados.
A colecistocinina (CCK) é um peptídeo intestinal secretado pelas células enteroendócrinas do duodeno e jejuno em resposta aos ácidos graxos da dieta. Liga-se nos receptores dos terminais vagais aferentes e funciona como sinal de saciedade
(Chaudhri et al., 2006). A administração periférica do hormônio levou à ativação de
neurônios no núcleo do trato solitário. O peptídeo é ineficaz em reduzir a ingestão de
alimentos nos camundongos “knockout” (KO) para o receptor de melanocortina 4
(MC4), sugerindo que a sinalização através do receptor é necessária para a saciedade
induzida pela CCK (Coll et al., 2007).
O peptídeo YY (PYY) é uma sequência de 36 aminoácidos secretada pelas
celulas endócrinas L do intestino, em duas formas PYY1-36 e PYY3-36. O PYY3-36 é
agonista específico dos receptores Y2 (Cone, 2005). Seus níveis estão baixos durante o jejum e aumentam rapidamente no período pós-prandial. A administração periférica reduz a ingestão calórica e sua concentração aumenta em doenças associadas à perda
de peso (Coll et al., 2007). Foi proposto que o PYY3-36 aumentaria a atividade de
neurônios melanocortinérgicos hipotalâmicos, diminuindo dessa forma a ingestão calórica. Entretanto, a inibição da alimentação induzida pelo peptídeo foi observada em
camundongos KO para o receptor MC4 e para o gene precursor das melanocortinas,
tornando o modelo improvável (Halatchev et al., 2004). O PYY3-36 também ativa
(Cone, 2005). Observou-se que indivíduos com sobrepeso têm redução na
concentração do PYY3-36 pós-prandial e que seu nível é elevado após cirurgia bariátrica,
o que explicaria parcialmente o sucesso na manutenção do peso a longo prazo pelo
procedimento (Le Roux et al., 2006).
A grelina é um peptídeo de 28 aminoácidos secretado por células presentes nas glândulas oxínticas do estômago. Sua expressão e secreção aumentam com a perda
de peso, jejum e hipoglicemia (Coll et al., 2007; Cummings et al. 2001). A administração
periférica aumenta o apetite e reduz a utilização de gordura, o que é inibido por
antagonistas dos receptores para o neuropeptídeo “neuropeptídeo-Y” (NPY) e nos
camundongos KO para NPY (Cone, 2005). Sugere-se que a grelina atua como sinal
entérico envolvido na homeostase energética, sendo singular, até o momento, na capacidade de estimular o apetite. Entretanto, camundongos KO para o peptídeo ou seu receptor não apresentaram redução no peso. Apesar disso, ratos vacinados contra
o peptídeo grelina têm menor ganho de peso comparado aos controles (Coll et al.,
2007).
Dentre os fatores produzidos por glândulas endócrinas, a insulina é sintetizada
pelas células -pancreáticas e secretada em resposta a alterações no fluxo de energia
celular (Seeley e Woods, 2003). Detectou-se que a concentração plasmática média de insulina em animais magros é mais baixa que nos obesos e, apesar da ampla variação nos níveis do hormônio em resposta à ingestão de nutrientes, a área total da curva de concentração de insulina em 24 h é indicativa da quantidade de energia armazenada no tecido adiposo (Seeley e Woods, 2003). O hormônio cruza a barreira hematoencefálica e seus receptores estão presentes no SNC, em especial no núcleo arqueado do hipotálamo (Seeley e Woods, 2003). A administração sistêmica desencadeia a entrada de glicose no tecido muscular e adiposo. Já a administração no SNC reduz a ingestão
de alimentos e o peso corporal em roedores (Air et al., 2002; Chavez et al., 1995). A
inativação do receptor de insulina no SNC resulta no aumento da ingestão calórica, acúmulo de gordura e susceptibilidade para o ganho de peso induzido pela dieta
(Bruning et al., 2000). Camundongos “knockdown” (KD) para os receptores de insulina
expressão do NPY e da proteína relacionada à proteína agouti (AgRP), enquanto a administração central do hormônio reduziu a expressão dos neuropeptídeos citados no
animal selvagem (Cone, 2005; Obici et al., 2002). Sugere-se que a insulina, juntamente
com a leptina, sinaliza o nível da reserva energética do organismo para o SNC.
Os níveis circulantes de corticóides também afetam o apetite. A insuficiência adrenal é marcada pela anorexia, enquanto o excesso de corticóides causa hiperfagia.
A adrenalectomia reverte o fenótipo obeso nos camundongos ob/ob, normaliza o
aumento na expressão de AgRP e a redução da expressão do gene precursor das
melanocortinas, restaurando o tônus do sistema melanocortinérgico (Coll et al., 2007).
Os esteróides gonadais também têm papel na modulação da homeostase energética. Mostrou-se que o estradiol é capaz de aumentar o número de sinapses excitatórias no corpo dos neurônios hipotalâmicos que expressam o gene precursor das melanocortinas, resultando na redução da ingestão calórica e aumento do gasto
energético (Gao et al., 2007).
Informações sobre a homeostase energética são transmitidas, ainda, por outros sinais hormonais e neuronais, que carreiam informações aparentemente redundantes.
Figura 4 – Diagrama mostrando a multiplicidade de sinais integrados pelo SNC. Adaptado de Berthoud e Morrison, 2008.
1.2.6 Transdução e integração das informações metabólicas pelo SNC
Esforços têm sido direcionados para a identificação e caracterização dos circuitos neuronais que fazem a transdução e integração dos sinais relacionados com a homeostase energética, assim como das respostas neuronais que desencadeiam as
mudanças no comportamento alimentar e no metabolismo (Abizaid et al., 2006). É
relacionados com a homeostase energética está organizada para que se esclareça a patogênese das alterações metabólicas (Seeley e Woods, 2003).
O hipotálamo está envolvido no controle da ingestão de líquidos, no comportamento sexual, defensivo e agressivo, na regulação da temperatura corporal, dos eixos neuroendócrinos e do sistema imunológico (Berthoud 2002). O envolvimento de várias regiões hipotalâmicas na regulação da homeostase energética foi demonstrado através dos estudos de lesões cerebrais específicas que revelaram que a destruição dos núcleos hipotalâmicos ventromedial, paraventricular e dorsomedial induzia à hiperfagia, enquanto a lesão do hipotálamo lateral reduzia a ingestão
alimentar (Abizaid et al., 2006). Entre os vários núcleos hipotalâmicos, dois grupos
neuronais no núcleo arqueado foram relacionados ao balanço energético.
A ativação de uma destas populações leva à redução da ingestão calórica e ao aumento do gasto energético. Estes neurônios expressam o gene precursor das
melanocortinas, pró-opiomelanocortina (POMC), e o gene “transcrito regulado pela
cocaína-anfetamina” (CART). A proteína precursora POMC é clivada nos hormônios
estimuladores de melanócitos (-MSH), hormônio adrenocorticotrófico e
-endorfina (Cone, 2005). A administração no SNC da e-MSH leva à redução da
ingestão calórica e do peso corporal, além de aumentar o gasto energético em animais,
através da ligação nos receptores de melanocortina 3 (MC3) e 4 (Lee et al., 2006). A
ausência dos peptídeos derivados do POMC leva ao desenvolvimento de fenótipo caracterizado por hiperfagia e obesidade em camundongos (Coll, 2004). Sugere-se que o sistema melanocortinérgico funciona como um dos transdutores centrais dos sinais relacionados com o metabolismo (Cone, 2005). Nos roedores com perdas de função dos genes codificadores para POMC e receptores MC4 e MC3 observa-se fenótipo obeso. Já os pacientes com mutações de perda de função no gene POMC desenvolvem insuficiência adrenal, obesidade e cabelos ruivos, o que demonstra o papel do sistema melanocortinérgico humano no controle metabólico e na estimulação
da produção de melanina (Vaisse et al., 1998). Ainda, a haploinsuficiência do gene para
o receptor MC4 é a causa mais comum de obesidade monogênica em humanos
associada à estado energético favorável e o fenótipo desencadeado pela sua ativação ocorre através do sistema melanocortinérgico. A atividade deste grupo neuronal está relacionada com a sensação de saciedade (Berthoud, 2002).
A ativação da outra população neuronal resulta em fenótipo caracterizado por hiperfagia, ganho de peso e redução no gasto energético total. Estes neurônios expressam NPY e AgRP. Observou-se que a administração central de NPY estimula o consumo calórico enquanto reduz o gasto energético em camundongos (Seeley e
Woods, 2003). E mais, nos camundongos obesos ob/ob e db/db, como também nos
animais em balanço energético negativo, a expressão de NPY está elevada no núcleo
arqueado (Hahn et al., 1998). Verificou-se que o padrão de atividade espontânea dos
neurônios NPY/AgRP está elevado durante o jejum (Cone, 2005). A proteína AgRP é um antagonista de alta afinidade para os receptores MC3 e MC4, e no camundongo transgênico, expressando a proteína Agouti, homóloga à AgRP, observa-se o desenvolvimento de hiperfagia e obesidade (Cone, 2005). Dessa forma, esses neurônios estão associados à estado energético desfavorável, controlando outros circuitos neuronais, que desencadeiam a busca e o consumo de alimentos, e diminuindo a atividade do sistema melanocortinérgico. Entretanto, os camundongos KO para NPY ou AgRP ou ambos não exibiram os fenótipos metabólicos esperados a partir
do modelo proposto (Erickson et al., 1996; Qian et al., 2002; Wortley et al., 2005).
Postula-se a ocorrência de adaptações nos circuitos centrais associados ao metabolismo na ausência dessas moléculas. Estas observações levantam, ainda, questões sobre as funções dessas moléculas na regulação do balanço energético no adulto. Ao contrário dos camundongos KO, a morte seletiva dos neurônios NPY, em
animais adultos, resulta em hipofagia e perda de peso (Gropp et al., 2005; Luquet et al.,
2005; Flier, 2006). Consequentemente, sugere-se que o sistema de integração metabólica no SNC é susceptível à neuroplasticidade, fato evidenciado pela ausência de anormalidades quando as alterações moleculares estão presentes desde o início do
desenvolvimento (Gropp et al., 2005; Luquet et al., 2005; Flier, 2006).
As duas populações neuronais descritas projetam para praticamente todas as
amigdalóide, regiões do tálamo e do tronco encefálico. Os neurônios que recebem as
projeções, geralmente, expressam o receptor MC4 (Seeley e Woods, 2003; Morton et
al., 2006; Schwartz et al., 2000; Coll et al., 2007). Através do uso de técnicas
neuroanatômicas, foi demonstrado que os neurônios que expressam NPY/AgRP projetam colaterais para os neurônios que expressam POMC no núcleo arqueado,
inibindo-os através da liberação do neurotransmissor ácido-aminobutírico (GABA)
(Cowley et al., 2001). Sugere-se que a unidirecionalidade das projeções dos neurônios
NPY/AgRP para POMC representa organização evolutiva que favorece a inibição tônica dos sinais de saciedade, vantajoso em ambiente com escassez de alimento.
Demonstrou-se a presença de receptores funcionais para leptina, insulina, grelina, entre outros sinais carreadores de informações metabólicas periféricas, nessas
populações neuronais no núcleo arqueado (Seeley e Woods, 2003; Morton et al., 2006;
Schwartz et al., 2000; Coll et al., 2007). Tal fato corrobora a função de transdução das
informações metabólicas desses neurônios no SNC.
A leptina inibe os neurônios NPY/AgRP. O cruzamento dos camundongos ob/ob
com camundongos KO para NPY levou à redução do fenótipo obeso do primeiro em
aproximadamente 50% (Erickson et al., 1996). O jejum eleva a expressão de NPY, o
que é normalizado pela administração de leptina (Cone, 2005). Insulina e leptina estimulam a atividade dos neurônios que expressam POMC, enquanto o jejum diminui a expressão do gene, o que é revertido pela administração do segundo hormônio (Mizuno
et al., 1998; Cowley et al., 2001; Niswender et al., 2004; Benoit et al., 2002). Propõe-se
que a ativação dos neurônios que expressam POMC pela leptina e insulina resulta na
liberação de -MSH que, através da ligação no receptor MC4, é necessário para a
manifestação do fenótipo de redução da ingestão calórica e perda de peso. Consistente com isto, observou-se que os efeitos catabólicos da leptina e insulina são atenuados pelo pré-tratamento com baixas doses de antagonistas para as melanocortinas (Seeley
et al., 1997).
Estudos eletrofisiológicos mostraram que camundongos ob/ob têm aumento nas
conexões excitatórias para os neurônios NPY/AgRP e diminuição nos neurônios POMC
de leptina exógena. Observou-se também que o aumento na concentração de leptina durante o período pós-natal precoce é importante para o desenvolvimento neuronal
hipotalâmico em camudongos (Pinto, 2004; Coll et al., 2007). Levanta-se a hipótese da
importância deste período do desenvolvimento para o adequado estabelecimento dos
mecanismos reguladores e do “set point” da homeostase energética.
Os receptores para grelina são expressos nos neurônios NPY/AgRP (Shintani et
al., 2001; Nakazato et al., 2001). Em ratos, doses farmacológicas do hormônio,
administradas na periferia ou diretamente no hipotálamo, ativaram c-Fos, um marcador
de atividade neuronal, nestes neurônios (Wang et al., 2002). Os tratamentos também
estimularam a ingestão calórica e o ganho de peso (Wang et al., 2002). Sugere-se a
inibição dos neurônios anorexigênicos POMC pela grelina através do aumento da liberação de GABA pelos colaterais dos neurônios NPY/AgRP (Cone, 2005). Entretanto,
foi observado que a vagotomia reverte o fenótipo induzido pela grelina (Date et al.,
2002). Considerando que o nervo vago expressa receptores para o hormônio, talvez as projeções do núcleo do trato solitário para o hipotâlamo sejam necessárias para a presença do fenótipo.
Juntamente com o núcleo arqueado, outros núcleos hipotalâmicos são importantes na transdução e integração dos sinais metabólicos no SNC.
A ativação de neurônios no núcleo ventromedial (NVM) do hipotálamo está relacionada com a inibição da alimentação e elevação do gasto energético basal
(Dhillon et al., 2006; Majdic et al., 2002; Xu et al., 2003). O NVM parece ser um núcleo
que integra sinais orexigênicos e anorexigênicos no sistema de integração do SNC. Os neurônios no NVM expressam receptores para leptina e são ativados pela mesma
(Dhillon et al., 2006). A funcionalidade desta sinalização é observada nos animais KO
condicionais para o receptor que exibem fenótipo obeso e hiperfágico (Dhillon et al.,
2006). Os neurônios no NVM são sensíveis também ao peptídeo orexigênico NPY. Através dos receptors Y1, o peptídeo diminui a excitabilidade dos neurônios e reduz o
tônus anorexigênico do núcleo (Kumarnsit et al., 2003; Chee et al., 2010). Outra
crescimento da família das neurotrofinas que regula o desenvolvimento neuronal e a plasticidade sináptica através dos receptores tirosina kinase TrkB (Huang e Reichardt, 2001). Os camundongos heterozigotos para o gene do BDNF, com alelo mutado
disfuncional, são obesos (Xu et al., 2003; Lyons et al., 1999). Já a administração central
e periférica do fator diminuiu a ingestão calórica e aumentou o gasto energético nos
camundongos db/db (Nonomura et al., 2001). Observa-se uma redução de 60% nos
níveis de expressão de BDNF no NVM de camundongos selvagens em jejum, e camundongos hipomorfos para o gene codificador de TrkB são obesos e hiperfágicos,
com consumo calórico diário 75% maior que os controles (Xu et al., 2003). Observou-se
também que os níveis de BDNF estão reduzidos em camundongos transgênicos
expressando a proteína agouti e nos camundongos KO para o receptor MC4, enquanto
a administração de agonista para o receptor MC4 elevou os níveis do fator neurotrófico
em camundongos (Xu et al., 2003). Estas evidências sugerem que a via de sinalização
do BDNF pode ser um componente através do qual o sistema melanocortinérgico regula o balanço energético. Postula-se que a expressão do BDNF no NVM, induzida pelo receptor MC4, é regulada por projeções dos neurônios POMC e NPY/AgRP do núcleo arqueado. Entretanto, ainda não se sabe quais neurônios expressando o receptor TrkB são responsáveis pela transdução do sinal do BDNF relacionado com o comportamento alimentar.
A lesão da área hipotalâmica lateral (LHA) resulta em quadro marcado por
anorexia em animais (Seeley e Woods, 2003; Morton et al., 2006; Berthoud, 2002).
Duas populações neuronais foram identificadas na LHA. A primeira contém o peptídeo orexina, implicado no ciclo sono-vigília e na hiperfagia, e a segunda expressa o hormônio concentrador de melanina (MCH), também estimulador da ingestão calórica
(Seeley e Woods, 2003; Morton et al., 2006; Berthoud, 2002). A expressão de orexina,
MCH e a atividade dos neurônios na LHA aumentam no jejum (Diano et al., 2003).
Camundongos KO para o gene codificador do MCH apresentam fenótipo de hipofagia e
aumento do gasto metabólico (Shimada et al., 1998).
hormônios até o controle da temperatura corporal (Berthoud, 2002). Evidências sugerem ainda sua participação na homeostase energética. Este núcleo recebe projeções de áreas do hipotálamo e tronco encefálico sabidamente relacionadas com o comportamento alimentar e, quando lesionadas, resultam em hipofagia (Berthoud, 2002). Animais com acesso padronizado restritivo ao alimento apresentaram aumento
na expressão de c-Fos no NDM quando comparado a animais alimentados ad libitum, o
que sugere que a atividade neuronal do núcleo está envolvida na sincronização entre o
ciclo circadiano e o padrão da alimentação (Gooley et al., 2006).
O núcleo supraquiasmático (NSQ) hipotalâmico é o principal núcleo de controle do ciclo circadiano. Estudo recente observou que a mutação com perda de função do
gene “clock”, amplamente expresso no NSQ, além das alterações no ciclo circadiano,
também resulta em obesidade (Turek et al., 2005).
O papel de outros núcleos hipotalâmicos na transdução dos sinais metabólicos,
bem como na integração com os núcleos descritos e na organização das respostas efetoras, que mantêm a homeostase energética, ainda não está claro (Berthoud, 2002).
Além da transdução de sinais metabólicos carreados por hormônios e neuropeptídeos, alguns neurônios detectam e respondem a alterações no estado
energético intracelular (Seeley e Woods, 2003; Morton et al., 2006). Postula-se que
alguns neurônios monitoram e respondem ao conjunto de combustíveis celulares – que
refletem o estado metabólico global – e usam esta informação para influenciar o
consumo de nutrientes e o gasto energético (Seeley e Woods, 2003). A administração intracérebro-ventricular (ICV) de ácido oleico (C18:1) inibe a ingestão calórica e a produção de glicose, e animais alimentados com dieta rica em gordura tornam-se
resistentes aos efeitos anoréticos do ácido oleico (Obici et al., 2002; Morgan et al.,
2004). Ainda, a inibição central da enzima limitante da oxidação dos ácidos graxos,
carnitina-palmitoiltransferase-1, também diminui a ingestão alimentar (Obici et al.,
que funcionam como sensores de energia ou para quais outros neurônios eles projetam (Seeley e Woods, 2003).
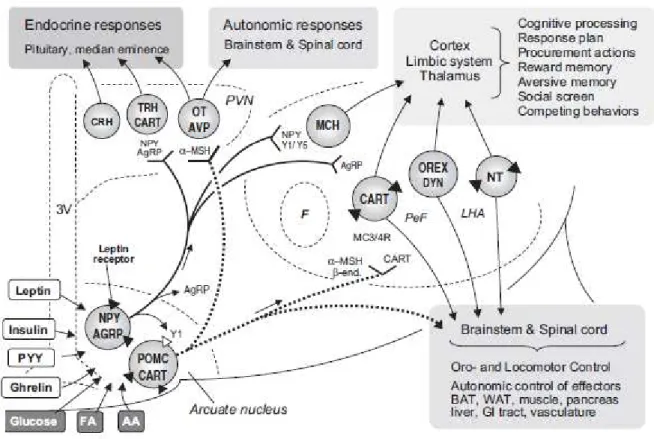
Conclui-se que o balanço energético é mantido através da monitoração simultânea da quantidade de energia estocada no tecido adiposo e imediatamente disponível para as células, gerando respostas que evitam e, se preciso, corrigem alterações no estado metabólico (Seeley e Woods, 2003). O sistema de integração e resposta é complexo (Figura 5). O hipotâlamo tem sido amplamente estudado e verificou-se que integra vários sinais humorais e neuronais importantes para a regulação do apetite e metabolismo.
Circuitos neuronais, classicamente relacionados a outras funções, também integram este sistema (Figura 5). O sistema dopaminérgico tem sido implicado na recompensa e nos aspectos motivacionais do comportamento alimentar. Evidências sugerem que sinais metabólicos, inicialmente relacionados à sinalização através do hipotálamo, como leptina, insulina e grelina, também modulam a função dos neurônios
dopaminérgicos mesencefálicos (Palmiter, 2007; Berthoud, 2002; Figlewicz et al., 2003;
Hommel et al., 2006; Fulton et al., 2006; Figlewicz et al., 1994). Entretanto a função da
Figura 5 – Representação de parte da circuitaria neuronal do sistema integrador de manutenção da homeostase energética no SNC.
Adaptado de Berthoud e Morrison, 2008.
1.3 Sistema dopaminérgico
A atividade anormal do sistema dopaminérgico foi descrita nas doenças de Parkinson, Alzheimer, esquizofrenia, transtorno bipolar, transtorno de déficit de atenção e hiperatividade, síndrome de Tourette entre outras. As evidências do envolvimento dopaminérgico nessas doenças provêm de dados empíricos relacionados com mecanismos de ação dos fármacos usados na terapêutica e de modelos experimentais
1.3.1 Anatomia e fisiologia do sistema dopaminérgico nos mamíferos
Os neurônios contendo dopamina estão agrupados em nove grupos celulares distribuídos entre o mesencéfalo e o tubérculo olfatório em humanos. Três grupos, contendo entre 400 e 600 mil neurônios, estão localizados bilateralmente no mesencéfalo. Suas projeções são agrupadas em três vias anatômicas e funcionalmente distintas: mesostriatal, mesolímbica e mesocortical. Os neurônios que compõem as vias
mesolímbica e mesocortical têm seus corpos localizados na substância nigra (SN) pars
compacta e, principalmente, na área tegmentar ventral (ATV), projetando para
estruturas do sistema límbico e córtex, respectivamente. A via mesostriatal engloba
células localizadas na SN pars compacta que projetam para o striatum dorsal, estando
relacionada com a função motora. Os neurônios dopaminérgicos mesencefálicos projetam ainda para outras estruturas dos núcleos da base, entre elas o globo pálido
ventral, o núcleo subtalâmico e a SN pars reticulata (Bjorklund e Dunnett, 2007).
Neurônios dopaminérgicos também estão localizados e projetam na via túbero-infundibular no hipotálamo. Detectou-se a co-localização com vários neuropeptídeos (hormônio liberador do hormônio de crescimento, neurotensina, galanina, encefalina e dinorfina) e com o neurotransmissor GABA. Postula-se que a atividade dopaminérgica hipotalâmica está relacionada com a regulação neuroendócrina (Bjorklund e Dunnett, 2007).
A dopamina é sintetizada no citosol dos terminais neuronais dopaminérgicos, em uma sequência de duas reações a partir do aminoácido tirosina. A primeira reação é limitante na síntese do neurotransmissor. Consiste na hidroxilação do anel aromático do aminoácido, catalisada pela enzima tirosina hidroxilase (TH), formando o precursor L-DOPA e requer a coenzima tetra-hidrobiopterina. A segunda reação é catalisada pela enzima aminoácido aromático decarboxilase e remove o grupo carboxil da L-DOPA,
produzindo dopamina que finaliza a síntese (Siegel et al., 2005).
transportador vesicular de monoaminas. Em resposta à elevação na concentração de cálcio intracelular, as vesículas liberam o neurotransmissor que, então, pode se ligar nos seus receptores. O término da transmissão dopaminérgica ocorre, principalmente, através da recaptação do neurotransmissor, pelo transportador de dopamina (DAT), de volta para o terminal neuronal. O neurotransmissor é bombeado novamente para a vesícula sináptica para ser reutilizado ou é degradado pela enzima monoamina-oxidase
(Siegel et al., 2005). Parte da dopamina que se difunde da fenda sináptica ou é liberada
da forma não clássica, chamada transmissão por volume, sofre degradação pela enzima catecol-O-metiltransferase (Rice, 2000).
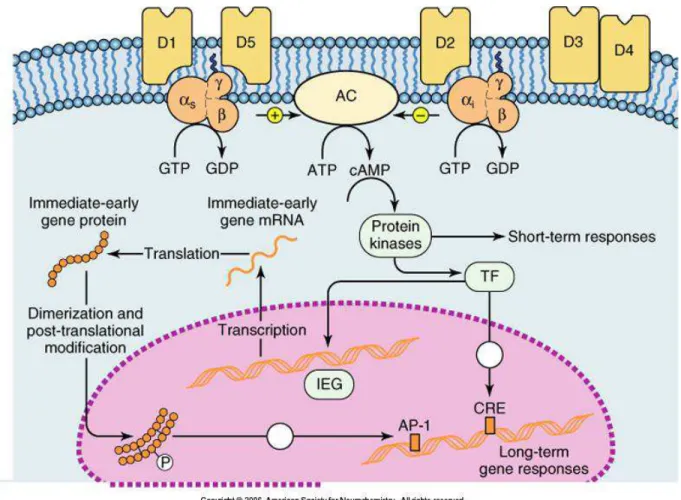
Os efeitos da dopamina são mediados através da ligação em cinco subtipos de receptores. Todos possuem sete domínios transmembrana e são membros da superfamília de receptores acoplados à proteína G. Baseado em características
estruturais e bioquímicas, os receptores são classificados em dois grupos D1-like e
Figura 6 – Os receptores dopaminérgicos e as vias de transdução de sinal. Adaptado de Siegel et al., 2005.
O grupo D1-like inclui os receptores dopaminérgicos D1 (D1R) e D5 (D5R), que
são acoplados à proteína G estimulatória (Gs) (Figura 6). A ativação dos receptores
aumenta a atividade da enzima adenilato ciclase e, consequentemente, eleva a concentração de AMP-cíclico, que ativa a proteína quinase A (PKA). Os receptores
D1-like modulam o funcionamento do córtex pré-frontal. Estão presentes também no corpo
estriado, no hipotálamo e em outras regiões do córtex cerebral (Siegel et al., 2005).
O grupo D2-like inclui os receptores dopaminérgicos D2 (D2R), nas isoformas
longa e curta, D3 (D3R) e D4 (D4R). Os receptores são acoplados à proteína G
Consequentemente, a ativação dos receptores reduz a concentração de AMP-cíclico e a atividade das enzimas dependentes deste segundo mensageiro. Os receptores
D2-like são alvo dos fármacos antipsicóticos, o que sugere sua relação com processos
cognitivos, motores e afetivos. Estão distribuídos no corpo estriado, córtex cerebral,
tronco encefálico e na medula espinhal (Siegel et al., 2005).
1.3.2 Dopamina e a homeostase energética
Evidências experimentais sugerem a participação do sistema dopaminérgico no controle da homeostase energética corporal (Palmiter, 2007; Figlewicz e Benoit, 2008; Figlewicz, 2003). Considerando que a dopamina está envolvida em vários comportamentos, é possível que a participação ocorra de diversas formas. A associação do sistema dopaminérgico com comportamentos motores, controle neuroendócrino e modulação do sistema de recompensa sugere meios através dos quais as respostas envolvidas na manutenção da homeostase energética podem ser moduladas. Mais ainda, evidências indicam que neurônios dopaminérgicos monitoram diretamente o estado metabólico do organismo através da transdução direta de sinais hormonais e indiretamente através de conexões com áreas envolvidas no controle metabólico no SNC (Palmiter, 2007; Figlewicz e Benoit, 2008; Figlewicz, 2003).
1.3.3 Homeostase energética nos camundongos KOpara a enzima tirosina hidroxilase
Camundongos KO para a enzima limitante na síntese de dopamina, TH, não
produzem dopamina e apresentam fenótipo de hipofagia extrema, que resulta no óbito
em algumas semanas (Szczypka et al., 1999a; Szczypka et al., 1999b; Zhou e Palmiter,
1995). Os animais sobrevivem através da suplementação com L-DOPA, que restaura nas primeiras horas os níveis de dopamina para aproximadamente 38% do normal, período em que os animais ingerem a maior parte das calorias diárias (Zhou e Palmiter,
1995; Szczypka et al., 1999a). Esses camundongos não respondem com aumento da
ingestão calórica em situações desencadeantes do comportamento, como hipoglicemia
ou administração do peptídeo PYY3-36 (Hnasko et al., 2004). Cruzados com os
camundongos ob/ob, a ausência de dopamina reverte parcialmente o fenótipo de
hiperfagia e obesidade (Szczypka et al., 2000). Estas evidências indicam que a
ausência do neurotransmissor perturba a homeostase energética em camundongos.
Através do resgate da produção do neurotransmissor em sítios específicos, foram explorados os circuitos cerebrais envolvidos no controle da homeostase energética pelo sistema dopaminérgico.
O striatum ventral é uma região integrante do sistema de recompensa cerebral
onde a liberação de dopamina, através da via mesolímbica, está relacionada com o grau de prazer dos comportamentos. Postula-se que a relação da dopamina com a homeostase energética possa ocorrer por esta via. Entretanto, o resgate da produção
de dopamina no striatum ventral não reverteu o fenótipo anorético dos camundongos
KO para TH (Szczypka et al., 2001). Da mesma forma, a lesão das fibras
dopaminérgicas projetando para o striatum ventral não resultou em redução da ingestão
calórica, entretanto reduziu a motivação dos animais para a busca do alimento
(Salamone et al., 2005). Isto indica a necessidade da sinalização dopaminérgica em
Classicamente, a projeção dos neurônios dopaminérgicos mesencefálicos para o
striatum dorsal está associada ao controle motor. Isto porque a sintomatologia da
doença de Parkinson tem como substrato a degeneração dos neurônios dopaminérgicos projetando para esta área (Iversen e Iversen, 2007). A recuperação da
produção de dopamina nas fibras projetando para o striatum dorsal resgatou a ingestão
calórica nos camundongos KO para TH (Szczypka et al., 2001). O resultado indica que
o striatum dorsal e não ventral está relacionado com a modulação do comportamento
alimentar pela dopamina. Entretanto, esses camundongos não normalizaram completamente o comportamento alimentar, permanecendo com ingestão calórica
deficiente após o jejum e induzida por hipoglicemia (Hnasko et al., 2006). Corrobora-se
que a modulação do comportamento alimentar pelo sistema dopaminérgico envolve a sinalização através de vários núcleos.
Outra interpretação para o fenótipo observado nos camundongos deficientes na produção de dopamina envolve o fenômeno da neuroadaptação. Devido à ausência do neurotransmissor durante o desenvolvimento, funções antes moduladas pelo sistema dopaminérgico podem sofrer adaptação e serem assumidas por outros circuitos neuronais. Talvez o resgate do fenótipo, através da recuperação da produção de
dopamina no striatum dorsal, não corresponda as suas funções fisiológicas no
desenvolvimento normal.
A administração de anfetamina, cocaína, apomorfina e a inibição da recaptação de dopamina são manipulações que acentuam a sinalização no sistema dopaminérgico e que resultam na inibição da ingestão calórica (Palmiter, 2007). Apesar da hipótese de envolvimento do sistema dopaminérgico hipotalâmico no fenótipo, os camundongos KO
para TH, com recuperação da atividade enzimática no striatum dorsal, apresentaram
hipofagia induzida pela anfetamina e apomorfina, o que enfraquece o mecanismo
sugerido (Cannon et al., 2004; Sotak et al., 2005). Talvez a liberação fásica de
dopamina no striatum dorsal seja importante para a ingestão calórica, e a interrupção
deste padrão pelos fármacos resulta em hipofagia (Floresco et al., 2003). Entretanto, a
ausência de hipofagia nos camundongos KOpara o DAT indica algum outro mecanismo
1.3.4 Neurônios dopaminérgicos monitoram o estado metabólico
Evidências recentes mostram que neurônios dopaminérgicos mesencefálicos expressam receptores para os hormônios leptina, insulina e grelina e que peptídeos
hipotalâmicos, envolvidos na integração metabólica, como NPY, -MSH, AgRP, orexina
e MCH, modulam a atividade dos neurônios dopaminérgicos que projetam para o
striatum ventral (Abizaid et al., 2006; Jerlhag et al., 2006; Wellman et al., 2005;
Figlewicz, 2003; Zigman et al., 2006; Berthoud, 2002). Sugere-se que o sistema
dopaminérgico é necessário para a homeostase energética, em especial nas respostas envolvendo o comportamento alimentar, situando-se como alvo dos sinais metabólicos
e das projeções hipotalâmicas (Fulton et al., 2000; Figlewicz, 2003).
Receptores para grelina são expressos e estimulam a atividade do sistema
dopaminérgicos (Abizaid et al., 2006). Nos camundongos KO para o receptor de leptina,
os neurônios dopaminérgicos da ATV não aumentaram a atividade após a administração do hormônio, o que demonstra especificidade na ativação neuronal
(Abizaid et al., 2006). Observou-se também que a redução da expressão do receptor de
grelina nestes neurônios reduz a ingestão calórica induzida pela grelina (Abizaid et al.,
2006). Já o aumento da ingestão calórica em animais, induzida pela grelina administrada na ATV, foi revertido pelo tratamento concomitante de antagonista
específico para o receptor do hormônio (Toshinai et al., 2003). Apesar das evidências
apontarem para uma ação direta da grelina nos neurônios dopaminérgicos, estudos mostraram que a administração periférica do hormônio não levou ao aumento da ingestão calórica em camundongos deficientes em orexina, NPY, AgRP ou com
bloqueio vagal (Luquet et al., 2007; Date et al., 2006). E mais, o tratamento com grelina
aumentou o número de conexões excitatórias e diminuiu as inibitórias na ATV em camundongos, sugerindo que o aumento da atividade neuronal pode ser decorrente de
processos plásticos (Abizaid et al., 2006). Sugere-se que o efeito da grelina no
A expressão de receptores de leptina foi observada em neurônios dopaminérgicos mesencefálicos, o que sugere a possibilidade de o sistema
dopaminérgico também transduzir este sinal metabólico (Figlewicz et al., 2003; Hommel
et al., 2006). O receptor de leptina ativa a cascata de sinalização JAK-STAT (Morton et
al., 2006). Mutações no gene que codifica a proteína componente da via STAT3
mimetizam o fenótipo dos camundongos ob/ob (Bates et al., 2003). A análise da
fosforilação do resíduo de tyr705 da proteína STAT3 mostrou que a injeção intraperitoneal ou direta de leptina na ATV eleva o nível de fosforilação da proteína nos
neurônios dopaminérgicos, o que indica a funcionalidade dos receptores (Hommel et
al., 2006). A administração de leptina na ATV reduziu também a ingestão calórica em
paralelo à diminuição da atividade dos neurônios dopaminérgicos nos ratos (Hommel et
al., 2006). A relação direta entre fenótipo hipofágico induzido pela leptina e o sistema
dopaminérgico foi observada através do KD do gene para o receptor do hormônio nos
neurônios dopaminérgicos da ATV de ratos. A redução da expressão do receptor levou
ao aumento da ingestão calórica (Hommel et al., 2006). Apesar do maior consumo de
alimentos, os animais não ganharam peso, o que pode ser justificado pela maior movimentação noturna ou por alterações compensatórias no gasto energético basal. Os ratos apresentaram ainda maior preferência por solução de sacarose e por dieta
palatável (Hommel et al., 2006). Considerando que a regulação da ingestão calórica
pela leptina envolve a modulação direta da função dos neurônios dopaminérgicos na ATV, sugere-se que a leptina sinaliza tanto através do hipotálamo como do sistema dopaminérgico para regular a homeostase energética nos roedores.
A administração de leptina nos camundongos ob/ob também aumentou a
fosforilação da proteína STAT3 nos neurônios dopaminérgicos da ATV (Fulton et al.,
2006). Comparado com a fosforilação da proteína no hipotálamo, o aumento foi, em
média, de 63% daquele observado no sítio clássico de ação do hormônio (Fulton et al.,
2006).
camundongos ob/ob, o aumento da locomoção induzida pela anfetamina foi
aproximadamente 36% menor comparado ao controle, o que foi revertido pela
administração de leptina (Fulton et al., 2006). Já a sensibilização a repetidas doses de
anfetamina, que é sabidamente secundária à neuroadaptação dos neurônios
dopaminérgicos, não ocorreu na ausência do hormônio (Fulton et al., 2006), indicando
que a leptina é importante para o funcionamento normal do sistema dopaminérgico.
Análises mostraram que a administração de leptina aumentou a quantidade e a
atividade da enzima TH, o que sugere redução da síntese de dopamina nos
camundongos ob/ob. A medição da quantidade de dopamina total e liberada no striatum
ventral desses camundongos mostrou redução de 47% no neurotransmissor (Fulton et
al., 2006), demonstrando que o tônus leptinérgico é necessário para a síntese de
quantidades adequadas de dopamina.
Entretanto, a quantidade reduzida de dopamina nos camundongos ob/ob pode
ser consequência de adaptações ao fenótipo hiperfágico do animal ou, ainda, consequência do extremo fisiológico criado pela ausência total de leptina, não sendo observado em condições normais de variação na concentração de leptina. O fato da fosforilação de STAT3 na ATV de camundongos selvagens ser baixa sugere que a segunda hipótese pode ser parcialmente verdadeira. Assim, postula-se que a ação dos níveis circulantes de leptina nos neurônios dopaminérgicos é mínima (Palmiter, 2007).
No jejum os níveis circulantes de leptina e insulina estão reduzidos enquanto o de grelina aumenta. De acordo com as evidências apresentadas, este estado fisiológico aumentaria a atividade dos neurônios dopaminérgicos e consequentemente de liberação da dopamina. Entretanto, os níveis extracelulares de dopamina medidos no
striatum ventral de ratos em jejum são similares ou menores quando comparados aos
controles (Pothos et al.,1995; Cadoni et al., 2003). Ressalta-se que talvez o padrão de
Ainda de acordo com as evidências expostas, considerando que a concentração circulante de leptina e insulina está elevada em animais obesos, espera-se uma redução na atividade dos neurônios dopaminérgicos e na concentração de dopamina
extracelular. A análise dos camundongos ob/ob mostrou que, de fato, a atividade do
sistema dopaminérgico está reduzida em animais obesos (Fulton et al., 2006). Esses
animais apresentaram também ingestão calórica acima dos controles, talvez uma forma de elevar o tônus dopaminérgico. Conclui-se que o sistema dopaminérgico é influenciado pelos estados nutricionais e transduz sinais metabólicos; entretanto a revelância funcional e a interação com o sistema de integração do metabolismo não estão completamente esclarecidas.
1.3.5 Envolvimento do sistema dopaminérgico na recompesa e suas implicações para a homeostase energética
O sistema de recompensa favorece comportamentos essenciais, como alimentação e sexo, atribuindo a estes grau intenso de prazer que incentiva a busca e consumação. Evidências sugerem que estados fisiológicos influenciam o processo, aumentando a percepção do prazer e o incentivo associado a determinado comportamento (Kelley e Berridge, 2002; Wise, 2002).
Observou-se que a injeção intraventricular de leptina ou insulina reduziu a
preferência por local condicionado por alimento palatável em ratos (Figlewicz et al.,
2004). E ainda, a leptina reduziu a preferência por locais contendo peletes de sacarose, enquanto a insulina diminuiu a preferência pela ingestão de solução de sacarose
(Sipols et al., 2000; Figlewicz et al., 2001). Os estudos utilizaram técnicas que avaliam o