Variação na estrutura e na composição de Bromeliaceae em cinco zonas de
restinga no Parque Nacional da Restinga de Jurubatiba, Macaé, RJ
LUCIANA COGLIATTI-CARVALHO
1,2, ANDRÉ FELIPPE NUNES DE FREITAS
1,2,
CARLOS FREDERICO DUARTE DA ROCHA
1,3e MONIQUE VAN SLUYS
1(recebido: 31 de janeiro de 2000; aceito: 26 de setembro de 2000)
ABSTRACT- (Variation in structure and composition of Bromeliaceae at five zones of “restinga” in Jurubatiba National Park, Macaé, RJ). We studied the bromeliads at the Jurubatiba National Park in five vegetation zones: psamophilous halophilous creeper vegetation (PHR); closed rear beach (FPP); open shrubbyClusia(AAC); open shrubby Ericaceae (AAE) and temporarily flooded forest (MPI). We sampled 98 plots of 100 m2(10 x 10 m) recording the bromeliad species and abundance, density, mass, richness, species diversity, evenness, and similarity among the zones. We estimated the amount of water reserved inside the bromeliads in each zone and by bromeliad species. We found a total of ten bromeliad species at the Jurubatiba National Park that occurred differently along the vegetation zones, with a total density of 10386 ind.ha-1. No bromeliads were found in the PHR zone. The FPP zone had the highest total mass (7721.2 kg.ha-1) andBromelia antiacanthawas the most abundant, having the highest mass (1366.5 kg.ha-1). The AAE zone had the highest total bromeliad density (15725 ind.ha-1), the highest bromeliad diversity (H’= 2.358), evenness (0.786) and amount of water reserved inside bromeliads (3294.8 L.ha-1). In the MPI zone,Aechmea bromeliifoliawas the most abundant, being found exclusively in this zone. The highest similarity occurred between zones AAC and AAE (88.9%). We conclude that the structure and composition of the bromeliads at the Jurubatiba National Park varied consistently among the vegetation zones of the restinga, and each zone is characterised by a different set of dominant bromeliads and different abundance distribution.
RESUMO- (Variação na estrutura e na composição de Bromeliaceae em cinco zonas de restinga no Parque Nacional da Restinga de Jurubatiba, Macaé, RJ). Estudamos as bromeliáceas do Parque Nacional da Restinga de Jurubatiba, Macaé, RJ, nas cinco diferentes zonas de vegetação: psamófila halófila reptante (PHR), fechada pós-praia (FPP), arbustiva aberta deClusia(AAC), arbustiva aberta de ericácea (AAE) e mata periodicamente inundada (MPI). Analisamos abundância, densidade, biomassa, riqueza, diversidade, equitabi-lidade e similaridade de espécies entre as zonas. Estimamos a quantidade de água reservada no interior das bromélias por zona de restinga e por espécie de bromélia. Em 98 parcelas de 100 m2(10 X 10 m) cada, registramos as espécies de bromélias, a abundância de cada espécie e a zona amostrada. A quantidade de água armazenada e a biomassa das bromélias foram estimadas medindo-se o volume de água reservada no vaso e pesando 10 indivíduos por espécie. Encontramos 10 espécies na restinga de Jurubatiba, com densidade total estimada de 10386 ind.ha-1. Na zona PHR, não ocorreu nenhuma espécie de bromélia. Na FPP, ocorreu a maior biomassa total (7721,2 kg.ha-1), sendoBromelia antiacanthaa mais abundante e com maior biomassa (1366,5 kg.ha-1). Na AAE, ocorreu a maior densidade total (15725 ind.ha-1), diversidade (H’ = 2,358), equitabilidade (0,786) e quantidade de água reservada no interior de bromélias (3294,8 L.ha-1). Na MPI,Aechmea bromeliifoliafoi a mais abundante, sendo exclusiva desta zona. A maior similaridade ocorreu entre AAC e AAE (88,9%). Concluímos que a estrutura e a composição de Bromeliaceae da restinga de Jurubatiba variam fortemente entre as zonas estudadas, com cada zona possuindo um conjunto particular de espécies com diferentes distribuições de abundância.
Key words - Bromeliad species diversity, abundances distribution, Jurubatiba National Park, restinga
Introdução
As restingas recobrem cerca de 79% da costa
brasileira (Lacerda
et al.
1993), onde se estendem
desde estreitas até extensas faixas de areia, como no
litoral norte do Estado do Rio de Janeiro (Martins
et
al.
1993). O bioma de restinga possui uma vegetação
característica devido a uma combinação de fatores
físicos e químicos destas regiões, tais como elevada
temperatura, salinidade, grande deposição de
sal-sugem e alta exposição à luminosidade (Ormond
1960, Franco
et al.
1984, Henriques
et al.
1984). Nas
imediações de fontes de água, como lagoas e braços
das mesmas, a vegetação torna-se mais densa,
for-mando florestas (Araujo
et al.
1998).
As comunidades vegetais das restingas da costa
brasileira são conhecidas quanto a sua composição
florística e às formações vegetais nelas encontradas
(
e.g.
Pfadenhauer 1978, Araujo & Henriques 1984,
Silva & Somner 1984, Henriques
et al.
1986, Araujo
& Oliveira 1988, Pereira & Araujo 1995, Araujo
et
al.
1998), havendo, contudo, poucos trabalhos sobre
1. Universidade do Estado do Rio de Janeiro, IBRAG, Setor de Ecologia, Rua São Francisco Xavier, 524, 20550-011 Rio de Janeiro, RJ.
2. Universidade Federal do Rio de Janeiro, Programa de pós-graduação em Ecologia.
a ecologia das espécies vegetais (Ormond 1960,
Henriques
et al.
1984, Waechter 1985, Zaluar 1997).
Estas comunidades vegetais podem ser subdivididas
em diferentes zonas, caracterizadas pela topografia,
fisionomia e florística local específica de cada zona
(Dansereau 1947, Ormond 1960). Alguns estudos
têm sido realizados com comunidades vegetais em
restingas, buscando compreender o padrão de
zona-ção das espécies (
e.g.
Henriques
et al.
1984) e
dife-rentes fatores tais como a salsugem, a salinidade do
solo e o movimento da areia têm sido sugeridos
como responsáveis pela zonação das espécies
vege-tais (
e.g.
Ormond 1960, Franco
et al.
1984,
Henri-ques
et al.
1986).
O Parque Nacional da Restinga de Jurubatiba
(PNRJ), no litoral norte do Estado do Rio de Janeiro,
ocupa uma extensão de cerca de 60 km ao longo da
costa (Araujo
et al.
1998). Diversos estudos têm sido
realizados na área do PNRJ (
e.g.
Montezuma 1997,
Zaluar 1997, Araujo
et al.
1998), sendo o mesmo
caracterizado fisionômica e floristicamente em dez
zonas.
A família Bromeliaceae é muito representada
em restingas (Silva & Somner 1984, Henriques
et al.
1986, Fontoura
et al.
1991, Araujo 1992), sendo
importante para a comunidade como um todo,
prin-cipalmente pela capacidade de armazenar água em
seu vaso, o que a torna um elemento importante para
a manutenção da diversidade deste habitat (Picado
1913, Lopez 1997, Rocha
et al.
1997). Diversas
espécies animais utilizam as bromélias para
for-rageamento, reprodução e refúgio contra predadores
(Smart 1938, Brito-Pereira
et al.
1988, Rivero 1989,
Oliveira
et al.
1994a, b, Oliveira & Rocha 1997). A
germinação e o desenvolvimento de algumas
espé-cies de plantas podem, também, ocorrer nas
bromé-lias (Fialho 1990, Fialho & Furtado 1993).
Estudou-se a comunidade de bromeliáceas em
uma área da restinga de Jurubatiba, analisando a
distribuição de abundâncias, a densidade, a
biomas-sa, a riqueza e a diversidade da área como um todo
e de cada uma das zonas, estimando, também, a
equitabilidade e a similaridade na composição de
espécies entre as diferentes zonas vegetais desta
restinga. Adicionalmente, para avaliar a importância
das bromélias como reservatórios de água livre nesta
restinga, estimou-se o volume total de água
reser-vado no interior das bromélias em cada zona de
restinga e para cada espécie de bromélia.
Material e métodos
Área de estudo - O estudo foi realizado em março de 1999 e janeiro de 2000 (estações chuvosas), em uma área da restinga próxima à Lagoa de Cabiúnas, no Parque Nacional da Restinga de Juruba-tiba, (22°17’S e 41°41’W), que abrange os município de Macaé, Carapebus e Quissamã, litoral norte do Estado do Rio de Janeiro (figura 1). Esta região é dominada por uma lagoa de água doce (Lagoa Feia) e por uma planície arenosa (Araujoet al.1998). A área de estudo é caracterizada por uma acentuada sazonalidade no regime de chuvas, com precipitação mensal mínima de madamente 40 mm, ocorrendo no inverno, e máxima de aproxi-madamente 190 mm no verão, com uma deficiência de água no solo entre os meses de junho e setembro. A temperatura média anual é de 22,6 °C, com a máxima atingindo 29,7 °C em janeiro e, a mínima, 20,0 °C em julho (Henriqueset al.1986, Araujoet al.1998).
Uma primeira classificação desta restinga foi feita por Hen-riqueset al.(1984), sendo posteriormente modificada e acrescida por Araujoet al.(1998). No presente trabalho, estudaram-se as populações de bromélias em cinco zonas propostas por Araujoet al.(1998): vegetação psamófila e halófila reptante (PHR), que se inicia próxima à escarpa praial, em faixa com largura de aproxi-madamente 5-10 m; arbustiva fechada de pós-praia (FPP), que é vegetação densa e lenhosa de difícil penetração; arbustiva aberta deClusia(AAC), que se limita com a anterior e é composta por moitas densas de variados tamanhos; arbustiva aberta de Eri-caceae (AAE), que apresenta moitas de vários tamanhos e irregu-lares, mais ou menos alinhadas em faixas; e mata periodicamente inundada (MPI), que sofre inundação periódica do solo, com dominância deTabebuia cassinoides. Na área de estudo, estas zonas de vegetação são paralelas à linha de praia e o distancia-mento do mar segue a seqüência em que foram apresentadas (figura 2).
A partir da zona PHR, foram realizadas sete transecções perpendiculares ao mar em direção ao interior da restinga, até atingir o fim da zona MPI, que estabelecia o fim da transecção; cada transecção estava separada de outra paralela por 50 m. Nas
transecções, foram demarcadas parcelas de 100 m2(10 x 10 m) distantes entre si 10 m. Foram estabelecidas 98 parcelas, totali-zando 0,98 ha de área amostrada. As parcelas foram distribuídas nas cinco zonas de vegetação da restinga descritas acima: sete na PHR (total de 0,07 ha), 14 na FPP (total de 0,14 ha), 44 na AAC (total de 0,44 ha), 16 na AAE (total de 0,16 ha) e 17 na MPI (total de 0,17 ha). Em cada parcela, foram registradas as espécies de bromélias presentes e o número de indivíduos de cada uma das espécies encontradas. Para estimar a densidade (ind.ha-1) de bro-mélias por zona, dividiu-se o número total de brobro-mélias amos-tradas nas parcelas de cada zona pela área total amostrada em cada zona (em ha). A diferença entre as densidades de bromélias em cada zona de restinga foi testada através do teste qui-quadrado de aderência (Magurran 1988). Para cada espécie, calculou-se a abundância relativa dividindo-se o número de indivíduos da espé-cie pela abundância total de bromélias amostradas, e a freqüência de ocorrência foi calculada através da divisão do número de parcelas em que a espécie ocorreu pelo número total de parcelas. Calculou-se a diversidade através do índice de Shannon (H’) e a equitabilidade (J) em cada zona analisada (Magurran 1988). A similaridade na composição entre as cinco zonas foi estimada através do índice de similaridade de Jaccard (Magurran 1988).
Para estimar o volume médio de água armazenada no vaso de cada espécie de bromélia, utilizaram-se dez indivíduos de cada uma das espécies, atentando para que fossem amostrados in-divíduos de diferentes tamanhos e que estivessem em locais variados na restinga (sombreados ou mais expostos). A fim de minimizar os efeitos da sazonalidade (estação seca/chuvosa), o estudo foi realizado na época de chuvas. O volume de água no interior de cada bromélia foi obtido invertendo-se a bromélia em um saco plástico de 100 litros até que encerrasse qualquer gote-jamento. O volume de água encontrado foi medido com provetas de 1 litro (com precisão de 10 mL) e de 500 mL (com precisão de 5 mL). Estimou-se a quantidade de água armazenada por cada espécie de bromélia como a média dos 10 volumes medidos. O volume total de água armazenado no interior de bromélias de cada espécie por zona de restinga foi calculado como o volume médio armazenado pela espécie multiplicado pela abundância estimada de indivíduos daquela espécie na respectiva zona. Após a retirada da água, pesaram-se as dez bromélias de cada espécie com balan-ças Pesola com valor máximo de 30, 500 g e 2 kg (com precisão de 1, 5 e 50 g, respectivamente) e com uma balança de valor máximo de 10 kg (precisão de 100 g). A biomassa por zona de
restinga foi estimada pela multiplicação da massa média estimada para cada espécie de bromélia pela abundância estimada de in-divíduos da espécie presente em cada zona. Diferenças no volume de água e na biomassa entre as espécies foram testadas através de ANOVA, seguida do teste de Tukey para comparações múltiplas (Zar 1999).
Resultados
Na área total amostrada da restinga de
Juruba-tiba, encontraram-se dez espécies de bromélias,
per-tencentes a cinco gêneros (tabela 1). As espécies de
bromélias com maior abundância na restinga de
Jurubatiba foram
Aechmea nudicaulis
,
Neoregelia
cruenta
e
Tillandsia stricta
(tabela 1). As dez
espé-cies de bromélias encontradas na área amostrada do
PNRJ utilizam os mais diversos tipos de substratos;
algumas espécies têm hábito epifítico, outras
ocu-pam o solo arenoso das áreas abertas ou o solo
coberto por folhiço da área de mata, havendo aquelas
que ocupam mais de um tipo de substrato (tabela 1).
Com relação à biomassa das bromélias
amos-tradas, houve diferença significativa entre os valores
médios das espécies na área amostrada do PNRJ
(ANOVA; F = 18,445; p < 0,001), sendo
Bromelia
antiacantha
a espécie com maior biomassa (tabela
2). Quando comparadas par a par, os valores de
biomassa foram significativamente diferentes para
algumas espécies (tabela 2). O volume de água no
interior das espécies de bromélia na restinga foram
significativamente diferentes (ANOVA, F = 13,534,
p < 0,001). No teste de comparações múltiplas,
al-gumas espécies diferiram significativamente (tabela
2). A espécie de bromélia que teve o maior volume
de água reservado no interior do vaso foi
Neoregelia
cruenta
(tabela 2).
A composição das espécies de bromélia variou
entre as zonas da restinga, sendo as zonas AAE e
MPI (ambas possuindo nove espécies de bromélias)
as áreas com maior riqueza de espécies, seguidas da
zona AAC, com riqueza de oito espécies. A zona
PHR foi a única das zonas de vegetação da restinga
de Jurubatiba onde não ocorreu nenhuma espécie de
bromélia.
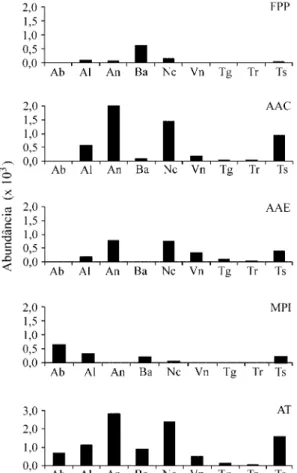
Na área total amostrada na restinga, ocorreu um
total de 10179 indivíduos de bromélias, tendo a
abundância de cada espécie diferido entre as zonas
de vegetação (figura 3). A densidade total de
bromé-lias diferiu estatisticamente (
χ
2= 4422,9; p < 0,001)
entre as zonas. As zonas de vegetação com maior
densidade foram a AAE, com 15725 ind.ha
-1(N = 2516), seguida da zona AAC com 11900
ind.ha
-1(N = 5236).
A zona de vegetação AAE foi a área com a
maior diversidade (H’ = 2,358) e equitabilidade
(0,786), enquanto a zona FPP teve o menor índice de
diversidade (H’ = 1,484) e equitabilidade (0,639)
(tabela 3). A maior biomassa de bromélias por zona
de vegetação foi encontrada na zona FPP (tabela 3),
onde as espécies mais abundantes,
Bromelia
antiacantha
e
Neoregelia cruenta
, possuíram os
maiores valores de biomassa. A zona AAC teve o
menor valor de biomassa total (tabela 3).
A zona de vegetação em que houve maior
volu-me estimado de água reservado no interior de
bromé-lias foi a AAE e a com a menor quantidade de água
estimada no interior de bromélias foi a zona FPP
(tabela 3).
Os valores de similaridade entre as zonas
vari-aram de 0,55 a 0,89, sendo as zonas AAC e AAE as
Tabela 1. Valores de abundância, abundância relativa, freqüência de ocorrência e hábito das espécies de bromélias encontradas no Parque Nacional da Restinga de Jurubatiba, Macaé, RJ.
Espécies Abundância
absoluta
Abundância relativa
Freqüência de ocorrência
Hábito
Aechmea bromeliifolia(Rudge) Baker 657 0,064 0,12 terrestre
Aechmea lingulata(L.) Baker 1122 0,110 0,37 terrestre
Aechmea nudicaulis(L.) Grisebach 2814 0,276 0,65 terrestre
Bromelia antiacanthaBertoloni 911 0,089 0,31 terrestre
Neoregelia cruenta(R. Graham) L.B. Smith 2388 0,235 0,73 terrestre
Vriesea neoglutinosaMez 512 0,050 0,23 terrestre/epífito
Tillandsia gardneriLindley 138 0,013 0,25 epífito
Tillandsia recurvata(L.) L. 50 0,005 0,03 epífito
Tillandsia strictaSoland in Sims 1587 0,158 0,66 epífito
Tillandsia usneoides(L.) L. ___* ___* 0,02 epífito
Total 10179
*Não calculadas devido à dificuldade de contar os indivíduos desta espécie.
Tabela 2. Valores médios (±erro padrão da estimativa - ep) de biomassa (g) e volume de água armazenada (mL) nas espécies de bromélias amostradas no Parque Nacional da Restinga de Juruba-tiba, Macaé RJ. (N = 10). Valores com letras sobrescritas diferen-tes, em cada coluna, indicam haver diferença significativa entre as espécies (comparações múltiplas de Tukey; p < 0,05).
Espécies Biomassa
Média±ep
Volume de água Média±ep
Aechmea bromeliifolia 615±301,89a,b 97±52,66a
Aechmea lingulata 810±508,15a 294±239,73b,c
Aechmea nudicaulis 280±181,35b,c 178±127,08a,b,d
Bromelia antiacantha 1465±671,25 ___**
Neoregelia cruenta 745±462,75a,b 432±290,47c
Vriesea neoglutinosa 615±248,38a,b 48±52,71a,d
Tillandsia gardneri 56,8±27,68c ___**
Tillandsia recurvata ___ * ___**
Tillandsia stricta 28±14,15c ___**
Tillandsia usneoides ___ * ___**
mais similares na composição de espécies de
bromé-lias (tabela 4).
Discussão
A variação espacial indicada pelo crescente
au-mento na riqueza de espécies de bromeliáceas desde
a zona PHR até o cordão de mata (MPI) pode estar
relacionada, em parte, com a diminuição da
salini-dade e da deposição de salsugem, que ocorre em
grande quantidade na zona PHR e decresce em
di-reção às zonas interiores (Hay & Lacerda 1984,
Pammenter 1984, Gómez & Winkler 1991), e com a
variação espacial na disponibilidade de suporte para
as espécies de bromélias epífitas. Os dados no
pre-sente estudo indicam que, para a restinga de
Juruba-tiba, as bromélias não constituem espécies da zona
halófila psamófila. Outros estudos também têm
mos-trado que espécies desta família não são observadas
ne st a z on a d e resti ng a ( Ra witscher 1944 ,
Pfadenhauer 1978, Waechter 1985, Henriques
et al.
1986, Araujo & Oliveira 1988, Araujo
et al.
1998),
a qual está susceptível à ação das ondas em épocas
de tempestades (Araujo 1992) e à alta salinidade
(Pammenter 1984), sendo o solo bastante pobre em
nutrientes e água (Waechter 1985).
A presença de moitas acarreta um aumento de
sombreamento e de porcentagem de cobertura
vege-tal, oferecendo microhabitats com maior
disponibili-dade de nutrientes, umidisponibili-dade e temperatura mais
amena (Franco
et al.
1984, Hay & Lacerda 1984,
Fialho & Furtado 1993, Montezuma 1997, Zaluar
1997) e substratos potenciais para as espécies
epífi-tas. A maior riqueza de bromélias nas zonas de
vegetação AAC, AAE e MPI pode ser explicada pela
maior cobertura do solo pelas moitas (Henriques
et
al.
1986, Montezuma 1997, Araujo
et al.
1998),
altura do dossel e presença de substratos para
epífi-tas, que cria diferentes e particulares condições para
o estabelecimento de maior número de espécies de
bromélias. No entanto, embora a zona FPP também
possua um grande percentual de cobertura vegetal,
com uma vegetação mais fechada e impenetrável
(Henriques
et al.
1986, Araujo
et al.
1998), esta é
mais susceptível aos efeitos do salsugem devido à
maior proximidade da linha de praia, possuindo,
então, menor riqueza e abundância de bromélias.
A espécie heliófila
T. stricta
, que suporta alta
incidência de luz direta (Leme 1984), provavelmente
ocorre no interior das moitas desta restinga por ser
sensível aos efeitos intensos da salinidade e por
encontrar nesses microhabitats substratos
apropria-dos para se estabelecer.
Bromelia antiacantha
ocor-reu basicamente nas zonas FPP e MPI, assim como
no estudo de Araújo
et al.
(1998). A presença de
indivíduos desta espécie na zona FPP sugere maior
tolerância à alta salinidade. As espécies
N. cruenta
e
A. nudicaulis
ocorrem em elevada abundância na
Figura 3. Distribuição de freqüência das espécies de bromélias por zona de vegetação de restinga da área amostrada do Parque Nacional da Restinga de Jurubatiba. Ab =Aechmea bromeliifolia; Al =A. lingulata; An =A. nudicaulis; Ba =Bromelia antiacantha; N c = Neoregelia cruenta; V n = Vriesea neoglutinosa; Tg =Tillandsia gardneri; Tr =T. recurvata; Ts =T. stricta; FPP = área de vegetação fechada do pós-praia; AAC = área aberta de
região entre-moitas das zonas AAC e AAE no PNRJ,
o que também pode ser observado por Henriques
et
al.
(1986). Tal fato sugere que estas duas espécies
possuem capacidade de sobreviver a altas
incidên-cias de luminosidade e elevada temperatura da areia,
pois acumulam uma grande quantidade de água entre
as suas folhas, o que manteria a temperatura mais
amena, além de facilitar a absorção de nutrientes
através de tricomas presentes nas folhas (Benzing
1980). Alguns estudos (Hay & Lacerda 1980, 1984,
Zaluar 1997) mostram que algumas espécies de
bro-mélias em restinga são capazes de se estabelecer nos
primeiros estágios de sucessão do desenvolvimento
de moitas, pois absorvem os nutrientes através de
células especializadas nas folhas (Benzing 1980,
Hay & Lacerda 1984).
Das dez espécies de bromélias ocorrentes no
PNRJ amostradas neste estudo, quatro (
T. stricta
,
T.
usneoides
,
T. gardneri
e
V. neoglutinosa
) possuem
larga distribuição no litoral brasileiro, ocorrendo nas
porções sul e norte do litoral (Aragão 1967). As
espécies
B. antiacantha
e
A. nudicaulis
ocorrem
restritas à porção sul do litoral do Brasil (de Ilhéus
para o sul) (Aragão 1967), sendo a primeira presente
em todo o litoral do Rio de Janeiro (Araujo &
Hen-riques 1984). No estado do Rio de Janeiro, a espécie
A. lingulata
ocorre nas restingas de Cabo Frio
(Fon-toura
et al.
1991), Macaé, Araruama (Araujo &
Henriques 1984) e Massambaba (L.
Cogliatti-Car-valho
et al.
, dados não publicados).
Aechmea
nudicaulis
e
N. cruenta
ocorrem nas restingas de
Macaé, Cabo Frio, Maricá (Araujo & Henriques
1984, Fontoura
et al.
1991) e apenas a segunda
espécie em Grumari (Fontoura
et al.
1991). No
esta-do esta-do Rio de Janeiro,
A. bromeliifolia
tem sua
dis-tribuição nas restingas de São João da Barra e Macaé
(Fontoura
et al.
1991).
Tillandsia recurvata
ocorre,
no estado do Rio de Janeiro, em Macaé, Cabo Frio,
Araruama e Grumari (Araujo & Henriques 1984).
As zonas AAC e AAE foram as mais similares
em termos da composição de espécies de bromélias,
o que seria esperado já que ambas são contínuas e
estruturalmente similares, sendo caracterizadas pela
formação de moitas esparsas. Localidades próximas
Tabela 3. Sumário dos valores de abundância, riqueza, densidade (ind.ha-1), diversidade (H’), equitabilidade, biomassa (kg.ha-1) e volume de água armazenada (litros.ha-1) de Bromeliaceae em cada zona de vegetação de restinga estudada no Parque Nacional da Restinga de Jurubatiba, Macaé, RJ. O valor entre parênteses indica a área amostrada em cada zona: FPP = fechada de pós-praia; AAC = área aberta deClusia; AAE = área aberta de Ericácea; MPI = mata periodicamente inundada.
Parâmetros FPP (0,14 ha) AAC (0,44 ha) AAE (0,16 ha) MPI (0,17 ha)
Abundância 907 5236 2516* 1520
Riqueza 5 8 9 9
Densidade total 6478 11900 15725* 8941*
Diversidade de Shannon (H’) 1,484 2,174 2,358 2,102
Equitabilidade (J) 0,639 0,725 0,786 0,701
Biomassa total 7721,2 5337,6** 7129,6** 6080,7**
Volume de água 671,8 2597,7 3294,8 1105,4
*T. usneoidesnão incluída devido à dificuldade de contagem dos indivíduos.
**T. usneoideseT. recurvatanão incluídas devido à dificuldade de medir a massa dos indivíduos no campo.
Tabela 4. Valores do índice de similaridade de Jaccard entre as quatro zonas de vegetação de restinga estudadas no Parque Nacional da Restinga de Jurubatiba, Macaé, RJ. FPP = fechada de pós-praia; AAC = área aberta deClusia; AAE = área aberta de Ericácea; MPI = mata periodicamente inundada.
Zonas AAC AAE MPI
FPP 0,62 0,56 0,55
AAC 0,89 0,70
geralmente refletem maior similaridade florística
(Pereira & Araujo 1995). Embora na zona AAC
tenha ocorrido a maior abundância total de espécies,
a zona AAE teve a maior densidade total. A AAE
sofre menos influência do mar e está mais protegida
da ação do vento quando comparado à AAC, o que
pode amenizar a ação deletéria destes fatores ao
desenvolvimento da vegetação (Montezuma 1997).
Além disso, a presença do lençol freático pouco
profundo na zona AAE propicia a formação de
moi-tas (Henriques
et al.
1986, Pereira & Araujo 1995,
Montezuma 1997), criando microhabitats com
con-dições de luminosidade, temperatura, umidade e
sa-linidade mais favoráveis para o estabelecimento das
espécies de bromélias. Em áreas mais abertas como
a AAC, o espaçamento entre as manchas de
vege-tação é maior (Zaluar 1997), elevando os níveis de
incidência luminosa e de temperatura, o que pode
representar condições adversas para a sobrevivência
de diversas espécies vegetais (Fialho 1990). Além
disso, a AAC possui um menor percentual de matéria
orgânica e nutrientes no solo do que a AAE, embora
estes sejam, de modo geral, baixos nestas duas zonas
(Hay & Lacerda 1984). A abundância, a diversidade
e a densidade de bromélias são menores na MPI do
que em AAC e AAE, provavelmente devido à maior
discrepância entre as abundâncias de bromélias
ter-restres e epífitas naquela zona. Na zona de MPI, a
dominância é de espécies terrestres, com maior
re-presentatividade de apenas duas espécies (
A.
lingulata
e
A. bromeliifolia
), enquanto as densidades
das espécies epífitas são bastante baixas. A MPI
possui maior quantidade de nutrientes e água no
solo, sendo uma zona supostamente mais úmida
quando comparada à região de moitas e entre moitas
nas zonas AAC e AAE (Henriques
et al.
1986).
Algumas espécies (
V. neoglutinosa
) são inexistentes
na MPI, enquanto que nas demais zonas (AAC e
AAE) a presença de epífitas promove maior
verti-calização na utilização do ambiente pelas plantas. As
áreas com menor índice de similaridade de
bromé-lias (FPP e MPI) foram as mais distantes entre si, e
são compostas por tipos de vegetação, condições
edáficas e de salinidade bastante peculiares a cada
zona (Araujo
et al.
1998).
A maior biomassa de bromélias encontrada na
zona FPP ocorreu provavelmente devido à elevada
densidade nesta zona da espécie
B. antiacantha
, que
possui o maior valor de biomassa entre as espécies
de bromélias amostradas. AAE foi a zona de
vege-tação que possuiu o maior volume de água
armaze-nado por hectare, e este fato provavelmente se deve
à presença das espécies de bromélia-tanque
N.
cruenta
,
A. nudicaulis
e
A. lingulata
, que ocorreram
em alta densidade nesta zona e possuem elevada
capacidade de reserva de água. Diversos estudos têm
indicado que as bromélias-tanque são uma
impor-tante fonte de recursos para várias espécies que
vivem diretamente associadas a elas (Picado 1913,
Lopez 1997, Oliveira & Rocha 1997, Richardson
1999) ou que passarão parte do dia ou da noite no
interior do vaso (Britto-Pereira
et al.
1988),
especial-mente em locais onde o ambiente externo é pouco
favorável ao desenvolvimento e sobrevivência
des-tes organismos (Fialho 1990, Fialho & Furtado 1993,
Oliveira
et al.
1994 a, b, Oliveira & Rocha 1997). O
volume de água armazenado no vaso de bromélias
depende da forma da roseta, da disposição das folhas
e do tamanho e grau de dilatação das bainhas foliares
(Leme 1984), características que, no caso de
N.
cruenta
,
A. nudicaulis
e
A. lingulata
, permitem o
acúmulo de um grande volume de água. Além disso,
na AAE, o nível do lençol freático é mais alto,
chegando a tornar o terreno alagado em épocas de
chuva (Henriques
et al.
1986, Montezuma 1997), o
que pode provavelmente contribuir para o maior
volume de água no vaso das bromélias-tanque nesta
zona, já que torna o ambiente menos xérico. Em
ambientes como as restingas, em que as condições
ambientais são extremas devido à alta temperatura e
à alta exposição à luz solar (Fialho 1990), as espécies
de bromélias que armazenam grandes volumes de
água, como
N. cruenta
,
A. nudicaulis
e
A. lingulata
,
tornam-se uma importante fonte deste recurso para
diversas outras espécies animais e vegetais.
Bromeliaceae dominantes em cada zona entre
aque-las existentes nesta restinga.
Agradecimentos - Este estudo é parte da tese de Doutorado do primeiro autor no Programa de Pós-Graduação em Ecologia da UFRJ, dentro do Projeto Ecologia de Restingas Brasileiras, do Programa de Ecologia, Conservação e Manejo de Ecossistemas do Sudeste Brasileiro e do Projeto Vertebrados do Leste Brasi-leiro, Setor de Ecologia, Instituto de Biologia Roberto Alcântara Gomes, da Universidade do Estado do Rio de Janeiro e foi parcialmente subvencionado com Auxílio à Pesquisa da Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (FAPERJ), processo noE-26/171.885/1999 e do CNPq (46197/00-7). E. Leme e A. Costa identificaram as espécies de Bromeliáceas. Durante o estudo, A.F.N. Freitas (Registro CAPES no990207-7) e L. Cogliatti-Carvalho (Processo CNPq no. 140727/1999-0) re-ceberam bolsas de mestrado. C.F.D. Rocha (Processo no300 819/94-3) e M. Van Sluys (Processo no301117/95-0) receberam bolsas de produtividade em pesquisa do Conselho Nacional do Desenvolvimento Científico e Tecnológico - CNPq.
Referências bibliográficas
ARAGÃO, M.B. 1967. Condições de habitat e distribuição geográfica de algumas Bromeliaceae. Sellowia 19:83-95. ARAUJO, D.S.D., SCARANO, F.R., SÁ, C.F.C., KURTZ, B.C.,
ZALUAR, H.L.T., MONTEZUMA, R.C.M. & OLIVEIRA, R.C. 1998. Comunidades vegetais do Parque Nacional da Restinga de Jurubatiba.InEcologia das lagoas costeiras do Parque Nacional da Restinga de Jurubatiba e do Município de Macaé (RJ) (F.A. Esteves, ed.). Universidade Federal do Rio de Janeiro, Rio de Janeiro, p.39-62.
ARAUJO, D.S.D. & HENRIQUES, R.P.B. 1984. Análise florística das restingas do Estado do Rio de Janeiro. In
Restingas: origem, estrutura, processos (L.D. Lacerda, D.S.D. Araujo, R. Cerqueira & B. Turcq, orgs.). CEUFF, Niterói, p.159-193.
ARAUJO, D. & OLIVEIRA, R. 1988. Reserva Biológica Estadual da Praia do Sul (Ilha Grande, Estado do Rio de Janeiro): lista preliminar da flora. Acta Botânica Brasilica 1:83-94.
ARAUJO, D.S.D. 1992. Vegetation types of sandy coastal plains of tropical Brazil: a first approximation.InCoastal plant communities of Latin America (U. Seelinger, ed.). Academic Press, San Diego, p.337-347.
BENZING, D.H. 1980. The Biology of bromeliads. Mad River Press, California.
BRITTO-PEREIRA, M.C., CERQUEIRA, R., SILVA, H.R. & CARAMASCHI, U. 1988. Anfíbios anuros da restinga de Barra de Maricá, RJ: levantamento e observações preliminares sobre a atividade reprodutiva das espécies registradas.InAnais do V seminário regional de ecologia. Universidade de São Carlos, São Carlos, p.295-306. DANSEREAU, P. 1947. Zonation et succession sur la restinga de
Rio de Janeiro. - I. Halosère. Revue Canadienne de Biologie 6:448-477.
FIALHO, R.F. 1990. Seed dispersal by a lizard and a treefrog -Effect of dispersal site on seed survivorship. Biotropica 22:423-424.
FIALHO, R.F & FURTADO, A.L.S. 1993. Germination of
Erythroxylum ovalifolium (Erythroxylaceae) seeds within the terrestrial bromeliad Neoregelia cruenta. Biotropica 25:359-362.
FONTOURA, T., COSTA, A. & WENDT, T. 1991. Preliminary checklist of the Bromeliaceae of Rio de Janeiro State, Brazil. Selbyana 12:5-45.
FRANCO, A.C., VALERIANO, D.M., SANTOS, F.M., HAY, J.D., HENRIQUES, R.P.B. & MEDEIROS, R.A. 1984. Os microclimas das zonas de vegetação da praia da restinga de Barra de Maricá, Rio de Janeiro. InRestingas: Origem, estrutura e processos. (L.D. Lacerda, D.S.D. Araujo, R. Cerqueira & B. Turcq, orgs.). CEUFF, Niterói, p.413-425. GÓMEZ, M.A. & WINKLER, S. 1991. Bromelias en manglares
del Pacífico de Guatemala. Revista de Biologia Tropical 39:207-214.
HA Y, J.D. & LACERD A, L.D. 1980. Alter ações nas características do solo após a fixação deNeoregelia cruenta
(R. Gran.) L. Smith (Bromeliaceae) em um ecossistema de restinga. Ciência e Cultura 32:863-867.
HAY, J.D. & LACERDA, L.D. 1984. Ciclagem de nutrientes no ecossistema de restinga.InRestingas: Origem, estrutura e processos (L.D. Lacerda, D.S.D. Araujo, R. Cerqueira & B. Turcq, orgs.). CEUFF, Niterói, p.459-473.
HENRIQUES, R.P.B., MEIRELLES, M.L. & HAY, J.D. 1984. Ordenação e distribuição de espécies das comunidades vegetais na praia da restinga de Barra de Maricá, Rio de Janeiro. Revista Brasileira de Botânica. 7:27-36. HENRIQUES, R.P.B., ARAUJO, D.S.D. & HAY, J.D. 1986.
Descrição e classificação dos tipos de vegetação da restinga de Carapebus, Rio de Janeiro. Revista Brasileira de Botânica. 9:173-189.
LACERDA, L.D., ARAUJO, D.S.D. & MACIEL, N.C. 1993. Dry coastal ecosystems of the tropical Brazilian coast. In Dry coastal-ecosystems: Africa, Asia, Oceania (E. Van der Maarel, ed.). Elsevier, Amsterdam, p.477-493.
LEME, E.M.C. 1984. Bromélias. Ciência Hoje 3:66-72. LOPEZ, L.C.S. 1997. Comunidades aquáticas em tanques de
bromélias: zonação e sucessão. Dissertação de mestrado, Universidade Federal do Rio de Janeiro, Rio de Janeiro. MAGURRAN, A.E. 1988. Ecological diversity and its
measurement. Cambridge University Press, Cambridge. MARTINS, L., SUGUIO, K. & FLEXOR, J.M. 1993. As
flutuações de nível do mar durante o quaternário superior e a evolução geológica de “deltas” brasileiros. Boletim do Instituto de Geologia - USP, Publicações Especiais 15:1-186.
MONTEZUMA, R.C.M. 1997. Estrutura da vegetação de uma restinga de Ericaceae no município de Carapebus, RJ. Dissertação de mestrado, Universidade Federal do Rio de Janeiro, Rio de Janeiro.
OLIVEIRA, M.G.N., ROCHA, C.F.D. & BAGNALL, T. 1994a. Bromélias-tanque servem de abrigo para espécies. Ciência Hoje 17:21-22.
OLIVEIRA, M.G.N., ROCHA, C.F.D. & BAGNALL, T. 1994b. A comunidade animal associada à bromélia-tanque
OLIVEIRA, M.G.N. & ROCHA, C.F.D. 1997. O efeito da complexidade da bromélia-tanqueNeoregelia cruenta(R. Graham) L.B. Smith sobre a comunidade animal associada. Bromélia 4:13-22.
ORMOND, W.T. 1960. Ecologia das restingas do Sudeste do Brasil: comunidades vegetais das praias arenosas. Parte I. Arquivos do Museu Nacional 50:185-236.
PAMMENTER, N.W. 1984. Ecological and physiological aspects of plant communities of the sand dunes of the east coast of Sothern Africa.InRestingas: Origem, estrutura e processos (L.D. Lacerda, D.S.D. Araujo, R. Cerqueira & B. Turcq, orgs.). CEUFF, Niterói, p.425-440.
PEREIRA, O.J. & ARAUJO, D.S.D. 1995. Estrutura da vegetação de entre moitas da formação aberta de Ericaceae no Parque Estadual de Setiba, ES. Oecologia Brasiliensis. Estrutura, Funcionamento e Manejo de Ecossistemas Brasileiros 1:245-257.
PETRUCIO, M.M. & FARIA, M.F. 1998. Concentrações de carbono orgânico, nitrogênio total e fósforo disponível no sedimento das Lagoas Cabiúnas e Comprida. Comunidades Vegetais do Parque Nacional da Restinga de Jurubatiba.In
Ecologia das Lagoas Costeiras do Parque Nacional da Restinga de Jurubatiba e do Município de Macaé (RJ) (F.A. Esteves, ed.). Universidade Federal do Rio de Janeiro, Rio de Janeiro, p.135-144.
PFADENHAUER, J. 1978. Contribuição ao conhecimento da vegetação e de suas condições de crescimento nas dunas costeiras do Rio Grande do Sul, Brasil. Revista Brasileira de Biologia 38:827-836.
PICADO, C. 1913. Les broméliacées épiphytes considérées comme milieu biologique. Bulletin Scientifique France et Belgique 5:215-360.
RAWITSCHER, F.K. 1944. Algumas noções sobre a vegetação do litoral brasileiro. Boletim da Associação dos Geógrafos Brasileiros 5:13-28.
RICHARDSON, B.A. 1999. The bromeliad microcosm and the assessment of faunal diversity in a Neotropical Forest. Biotropica 31:321-336.
RIVERO, J.A. 1989. Two beautiful bromeliad frogs from Andes of Venezuela. Journal of Bromeliad Society 39:26-27. ROCHA, C.F.D., COGLIATTI-CARVALHO, L., ALMEIDA,
D.R. & FREITAS, A.F.N. 1997. Bromélias: ampliadoras da biodiversidade. Bromélia 4:7-10.
SILVA, J.G. & SOMNER, G.V. 1984. A vegetação de restinga na Barra de Maricá, RJ.InRestingas: origem, estrutura, processos (L.D. Lacerda, D.S.D. Araujo, R. Cerqueira & B. Turcq, orgs.). CEUFF, Niterói, p.217-225.
SMART, J. 1938. Note on the insect fauna of the bromeliad
Brocchinia micrantha (Baker) Mez of British Guyana. Entomological Monographies 74:198-200.
WAECHTER, J.L. 1985. Aspectos ecológicos da vegetação de restinga no Rio Grande do Sul, Brasil. Comunidade do Museu Científico. PUCRS, Série Botânica, Porto Alegre 33:49-68.
ZALUAR, H.L.T. 1997. Espécies focais e a formação de moitas na restinga aberta deClusia, Carapebus, RJ.Dissertação de mestrado, Universidade Federal do Rio de Janeiro, Rio de Janeiro.