FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA
AVALIAÇÃO CLÍNICA, DE PROGESTERONA E DA
EXPRESSÃO GÊNICA DE RECEPTORES
ESTERÓIDES DOS TUMORES DE MAMA EM
CADELAS
RENATA DOS SANTOS RAMOS
FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA
AVALIAÇÃO CLÍNICA, DE PROGESTERONA E DA
EXPRESSÃO GÊNICA DE RECEPTORES
ESTERÓIDES DOS TUMORES DE MAMA EM
CADELAS
RENATA DOS SANTOS RAMOS
Orientador: Profª Titular Maria Denise Lopes
Botucatu - SP Março 2011
FICHA CATALOGRÁFICA ELABORADA PELA SEÇÃO TÉC. AQUIS. TRATAM ENTO DA INFORM . DIVISÃO DE BIBLIOTECA E DOCUM ENTAÇÃO - CAM PUS DE BOTUCATU - UNESP
BIBLIOTECÁRIA RESPONSÁVEL: ROSEM EIRE APARECIDA VICENTE Ramos, Renata dos Santos.
Avaliação clínica, de progesterona e da expressão gênica de receptores esteróides dos tumores de mama em cadelas / Renata dos Santos Ramos - Botucatu, 2011
Dissertação (mestrado) – Faculdade de M edicina Veterinária e Zootecnia, Universidade Estadual Paulista, 2011
Orientador: M aria Denise Lopes
Capes: 50504002
1. Reprodução animal. 2. M amas – Câncer. 3. Estrógenos – Receptores.
Nome do(a) autor(a): Renata dos Santos Ramos
Título: Avaliação clínica, de progesterona e da expressão gênica de receptores esteróides dos tumores de mama em cadelas
25 de Março de 2011
Comissão Examinadora:
Profª. Titular Maria Denise Lopes
Profª. Adj. Noeme Souza Rocha
“Temos aprendido a voar como os pássaros,
a nadar como os peixes, mas ainda não aprendemos
a sensível arte de viver como irmãos.”
Martin Luther King
”A paz em nós não resulta de circunstâncias externas e sim da
nossa tranquilidade de consciência no dever cumprido.”
Chico Xavier
“A sabedoria inferior é dada pelo quanto uma pessoa sabe e a
superior é dada pelo quanto ela tem consciência de que não
sabe”.
“A sabedoria superior tolera, a inferior julga; a superior alivia, a
inferior culpa; a superior perdoa, a inferior condena. Tem coisas
que o coração só fala para quem sabe escutar!”
Dedico este trabalho:
AGRADECIMENTOS
Primeiramente agradeço a Deus pela oportunidade de aprendizado em mais uma existência. Agradeço pela bênção de ter pessoas tão especiais caminhando ao meu lado.
À Faculdade de Medicina Veterinária e Zootecnia, UNESP - Botucatu, por fazer parte da minha vida e contribuir para meu crescimento profissional e pessoal.
À Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) pela concessão da bolsa de Mestrado que possibilitou a execução deste trabalho. À minha orientadora Profª Maria Denise Lopes por ter aceitado o desafio de me orientar, mesmo atuando em outra área, respeitando a minha paixão pela Oncologia Veterinária. Espero poder ter correspondido à altura e saiba que serei eternamente grata pela oportunidade de aprendizado.
Á Profª Eunice Oba, pela realização das dosagens hormonais e, principalmente, por todo carinho, disponibilidade e atenção que demonstrou em me ajudar na execução deste trabalho.
Ao professor Nereu Carlos Prestes pelas conversas, risadas e conselhos. Aos professores Sony, Fernanda, João e demais professores do Departamento de Reprodução Animal pelo carinho e respeito.
Ao professor Luiz Henrique de Araújo Machado por sempre acreditar em mim, já no período da residência na Clínica Médica de Pequenos Animais. À Profª Maeli Dal Pai Silva por abrir as portas de seu laboratório do Departamento de Morfologia, no Instituto de Biociências da Unesp, Botucatu. À pós-doutoranda Fernanda Alves da Costa e ao doutorando Eduardo Castan que me auxiliaram na execução do projeto. Obrigada por toda a dedicação, paciência e carinho nos ensinamentos da Biologia Molecular. À Fernanda Viau, responsável pelo laboratório de Dosagens Hormonais da USP – São Paulo, pelas dosagens hormonais, atenção e conselhos.
À profª Luzia Trinca pela atenção, disponibilidade e paciência durante a realização das análises estatísticas.
Aos colegas Bruno Watanabe Minto, Rodrigo Volpato e Wangles Pignaton pela amizade, atenção e ensinamentos durante os procedimentos cirúrgicos e anestésicos das cadelas do projeto.
Aos funcionários do Departamento de Reprodução Animal. Agradeço o carinho em especial do Walter, Edílson, dona Raquel e dona Cida.
Aos funcionários da Pós-Graduação, em especial o Zé Roberto pela atenção, ajuda e paciência.
Aos funcionários da biblioteca pela ajuda nas pesquisas bibliográficas e requisições de trabalhos.
Aos meus colegas do REPAS Guta, Ana Izabel, Rodrigo, Bethânia, Luis, Camila e Priscila pela ajuda e convivência.
À minha família por sempre acreditar em mim e permanecer ao meu lado em todos os momentos da minha vida. Ao meu pai, meu exemplo, meu herói; minha mãe, meu porto-seguro, minha verdadeira amiga; minhas irmãs Rosana e Roberta; meus sobrinhos Ana Beatriz e Marcellinho. Tudo que eu fizer para retribuir todo o amor que vocês me dão será pouco. Agradeço também o carinho dos avós, tios, tias, primos e primas e cunhado. Que Deus abençoe vocês.
Ao meu namorado Bruno que sempre esteve ao meu lado ao longo desses anos, me ensinado os valores mais bonitos e importantes que a vida tem. Agradeço a Deus pela sua existência e por tê-lo colocado em meu caminho. Aos meus gatos Ricky e Joinha pelo amor mais puro e incondicional. Ao Ursus e Arthur por compartilhar amor e dedicação.
LISTA DE ABREVIATURAS
CAAF --- Citologia Aspirativa por Agulha Fina DNA --- Ácido desoxirribonucleico 17 E2 --- Estradiol EGF --- Fator de crescimento epidermal ER --- Receptor de estrógeno ERα --- Receptor de estrógeno alfa
LISTA DE TABELAS
Tabela 1: Diagnóstico citológico das neoplasias mamárias dos animais atendidos (n=26) no setor de Reprodução Animal do Hospital Veterinário da FMVZ – Unesp . Botucatu, 2011...28 Tabela 2: Sequência dos oligonucleotídeos iniciadores utilizados no PCR em tempo real para amplificação dos genes ERα, ERβ, PR e GAPDH. Botucatu, 2011...34 Tabela 3: Classificação das células do epitélio vaginal em células parabasais (PB), intermediárias (interm), superficiais nucleadas (SN) e superficais anucleadas (SA), presença ou ausência de neutrófilos (N), progesterona sérica (unidade: ng/mL) e fase do ciclo estral em exame de citologia vaginal realizado em 31 cadelas. Dosagem hormonal de progesterona através de radioimunoensaio (P4 sérico em ng/mL). Botucatu, 2011...35 Tabela 4: Diagnóstico histopatológico das biópsias mamárias de 31 fêmeas atendidas no setor de Reprodução Animal do Hospital Veterinário da FMVZ – Unesp. Botucatu, 2011...35 Tabela 5: Frequência do estadiamento das neoplasias mamárias das cadelas atendidas (n=28) no setor de Reprodução Animal do Hospital
Veterinário da FMVZ – Unesp. Botucatu,
2011...37
Tabela 8: Uso de hormônios esteróides nas cadelas (n=26) atendidas no setor de Reprodução Animal do Hospital Veterinário da FMVZ – Unesp. Botucatu, 2011 ...39 Tabela 9: Dieta utilizada pelos animais do estudo, segundo o questionário respondido pelos proprietários de 26 cadelas atendidas no setor de Reprodução Animal do Hospital Veterinário da FMVZ – Unesp. Botucatu, 2011...39 Tabela 10: Valores mínimo, mediana e máximo da progesterona tecidual em ng/mL dos grupos benignos, malignos e controle (n=31). Botucatu, 2011...39
Tabela 11: Valores mínimo, mediana e máximo da progesterona tecidual em µg/g de tecido dos grupos benignos, malignos e controle (n=31). Botucatu, 2011...40
Tabela 12: Valores mínimo, mediana e máximo do estrógeno tecidual em pg/mL dos grupos benignos, malignos e controle (n=31). Botucatu, 2011...40
Tabela 13: Valores mínimo, mediana e máximo da quantificação relativa (QR) dos receptores de estrógeno alfa (ERα) dos grupos benignos, malignos
e controle (n=31). Botucatu,
2011...41
Tabela 14: Valores mínimo, mediana e máximo da quantificação relativa (QR) dos receptores de estrógeno beta (ERβ) dos grupos benignos,
malignos e controle (n=31). Botucatu,
2011...41
Tabela 16: Valores das medianas das quantificações relativas (QRs) dos receptores de progesterona (PR), estrógeno alfa (ERα) e beta (ERβ) das neoplasias malignas de origem epitelial (n=10) ou mista (epitelial e mesenquimal) (n=14). Botucatu, 2011...42
LISTA DE FIGURAS
Figura 1: Cadela nº 1, 13 anos, raça Cocker Spaniel, tamanho do tumor < 3cm. Linfonodos regionais e metástases a distância ausentes. Tumor classificado como estadio I (T1). Botucatu, 2010 ...25 Figura 2: Cadela nº 16, 9 anos, raça Cocker Spaniel, tamanho do tumor 4x6cm, linfonodos regionais e metástases a distância ausentes. Tumor
classificado como estadio III (T3). Botucatu, 2010...26 Figura 3: Cadela nº 7, 5 anos, SRD, tamanho do tumor 15x8cm,
envolvimento de linfonodos regionais e metástases a distância ausentes. Tumor classificado como estadio IV (T4). Botucatu, 2010...26 Figura 4: Cadela nº 4, 7 anos, SRD, após realização de mastectomia unilateral radical. Botucatu, 2010...29
LISTA DE GRÁFICOS
Gráfico 1: Representação da distribuição dos tumores malignos e benignos das cadelas estudadas (n=26). Botucatu, 2011...37
LISTA DE QUADROS
SUMÁRIO
RESUMO ABSTRACT
1. Introdução...1
2. Revisão de literatura...3
2.1. Aspectos gerais...3
2.2. Etiologia...6
2.2.1. Fatores hormonais...6
2.2.2. Dieta ...14
2.3. Epidemiologia...15
2.4. Diagnóstico...17
2.4.1. Estadiamento dos tumores mamários caninos ...19
2.5. Tratamento...21
2.6. Prognóstico...23
3. Objetivos ...24
4. Material e métodos ...24
4.1. Atendimento dos animais com neoplasia mamária...24
4.2. Coleta de material...26
4.2.1. Sangue...26
4.2.2. Citologia vaginal esfoliativa ...27
4.2.3. CAAF das neoplasias mamárias...27
4.2.4. Mastectomia...28
4.2.5. Protocolo anestésico...29
4.2.6. Procedimento cirúrgico...29
4.2.7. Pós-operatório...29
4.2.8. Amostras dos tecidos mamários...30
4.3. Armazenamento dos tecidos para dosagem hormonal...30
4.5. Dosagem hormonal...31
4.6. Receptores de hormônios esteróides por meio de RT-PCR...31
4.6.1. Avaliação da expressão gênica dos receptores hormonais por meio de PCR em tempo real ...31
4.6.2. Extração do RNA e reação de transcrição reversa...31
4.6.3. Caracterização do perfil de expressão gênica por PCR em tempo real...33
5. Análise estatística...34
6. Resultados...34
7. Discussão...42
8. Conclusões...49
9. Referências ...50
RAMOS, R.S. Avaliação clínica, de progesterona e da expressão gênica de receptores esteróides dos tumores de mama em cadelas. 2011. 63f. Dissertação (Mestrado) - Faculdade de Medicina Veterinária e Zootecnia, Universidade Estadual Paulista, Botucatu.
Resumo
Os tumores mamários constituem as neoplasias de maior ocorrência nas cadelas e os hormônios são apontados como um dos principais fatores etiológicos. Foram utilizadas 26 cadelas portadoras de neoplasias mamárias e cinco cadelas sem afecções mamárias para o grupo controle. Através de um questionário respondido pelos proprietários das cadelas, parâmetros como pseudogestação, histórico de prenhez, uso de contraceptivos e tipo de alimentação foram analisados. Foram realizadas dosagens hormonais séricas e teciduais, através da técnica de radioimunoensaio, além da expressão de receptores de estrógeno e progesterona por meio da técnica de q-PCR. Os resultados obtidos demonstraram que há uma maior incidência das neoplasias malignas em relação às benignas na cidade de Botucatu e região. Em relação aos aspectos clínicos, a nuliparidade ou o pequeno número de gestações compreenderam a maioria dos animais com neoplasia mamária. Além disso, o estudo demonstrou um nível de conscientização dos proprietários da região, já que poucos utilizaram meios contraceptivos em seus animais. Em relação à dieta, a maioria dos animais estudados recebia carne bovina e suína. Foi observado que as neoplasias (benignas ou malignas) sintetizam uma quantidade maior de progesterona em relação à glândula mamária normal. Por fim, os três grupos de animais estudados (tumor maligno, benigno e controle) expressaram receptores de estrógeno alfa, beta e progesterona. A quantificação relativa mostrou uma tendência para expressão maior dos receptores no grupo controle e menor no grupo dos animais com neoplasias malignas. Além disso, houve uma expressão maior de ERα em relação ao ERβ e as neoplasias malignas de
origem mista apresentaram maiores concentrações dos receptores PR, ERα
e ERβ, comparadas às neoplasias de origem epitelial.
RAMOS, R.S. Clinical, progesterone and steroids receptors gene expression evaluation of female dogs mammary tumors. 2011. 63f. Dissertação (Mestrado) - Faculdade de Medicina Veterinária e Zootecnia, Universidade Estadual Paulista, Botucatu.
Abstract
Mammary gland tumors are the neoplasms most common in female dogs and the hormones may be one of the principal etiologic factors. Twenty six female dogs with mammary neoplasias and five female dogs without mammary afeccions for the control group were used. Through questionary answered by female dogs owners, the variables as pseudopregnancy, pregnancy history, contraceptives use and diet were analyzed. It was done serum and tissue hormonal content by the radioimmunoassay technique, besides the estrogen and progesterone receptors expression by q-PCR technique. The results obtained showed higher incidence of malignant tumors in respect to benign tumors at Botucatu city and region. About clinical aspects the nulliparity or a small number of pregnancy are the major of animals with mammary tumors. Besides the study showed that owners have knowledge about the incorrect use of contraceptives in their animals. About the diet the major of animals analyzed received beef or pork. It was observed that tumors (benign or malignant) synthesize major progesterone amount in respect to the normal mammary gland. Finally the three animals groups evaluated (malignat tumor, benign tumor and control) expressed alpha and beta estrogen and progesterone receptors. The relative quantification showed a tendency for a higher expression of receptors from the controle group and smaller in the malignat tumors animal group. Besides there was a major ERα expression in respect to ERβ and the malignat tumors from mixed
origin presented higher concentrations of receptors PR, ERα and ERβ, in
compared to tumors from epithelial origin.
1. Introdução
O crescimento e o desenvolvimento da prática médico-veterinária no setor de animais de companhia, nos últimos trinta anos, têm refletido um incremento na importância dos cães na sociedade. Dessa forma, tem-se observado um aumento na longevidade dos pacientes, podendo esse fato ser explicado por melhorias na qualidade de vida dos animais. Por outro lado, observa-se uma elevação na incidência de doenças crônicas, como é o caso das neoplasias. As neoplasias, em cães, correspondem a um dos processos que possuem uma maior interferência na saúde e no bem estar dos animais (RICHARDS et al., 2001).
Dentre as neoplasias mais frequentes na espécie canina, destacam-se as neoplasias mamárias, as quais repredestacam-sentam um total de 25 a 50% de todas as neoplasias nas cadelas. No que diz respeito às neoplasias relacionadas com o aparelho reprodutor feminino da cadela, aquelas que afetam as glândulas mamárias correspondem a 82% (DONNAY et al., 1989).
Os tumores mamários de cães têm interesse especial para os pesquisadores que trabalham com neoplasias devido a algumas similaridades com o câncer de mama humano. Inclusive tem sido proposto, em muitos trabalhos, o estudo dessas lesões na espécie canina como modelo comparativo para espécie humana (SCHNEIDER, 1970; PELETEIRO, 1994).
As hipóteses etiológicas da neoplasia mamária envolvem a origem viral, influência da dieta e obesidade, componentes genéticos, estresse oxidativo e, principalmente, influência hormonal (PELETEIRO, 1994; FONSECA e DALECK, 2000; ZUCARI et al.,2001; SILVA et al., 2004).
Na espécie humana, autores determinam alguns fatores de risco para o câncer de mama como a hereditariedade, genética, nuliparidade, obesidade, dieta gordurosa, terapia de reposição hormonal prolongada e ingestão alcoólica (BARBATO et al., 2005).
ciclo estral (8,0%) e o segundo (26%). A proteção conferida pela castração desaparece após os dois anos e meio de idade, quando nenhum efeito é obtido (SCHNEIDER et al., 1970; Mac EWEN e WITHROW, 1996; ZUCCARI et al., 2001). O risco do câncer de mama foi significativamente reduzido em cadelas castradas até, ou antes, dos 2,5 anos de idade. Nem uma dieta rica em gordura, nem a obesidade um ano antes do diagnóstico aumentaram o risco do câncer de mama. Entretanto, o risco de câncer de mama entre cadelas castradas foi significativamente reduzido na idade entre nove e 12 anos. Esse estudo sugere que fatores nutricionais funcionando no início da vida podem ser importantes na etiologia do câncer de mama canino (SONNENSCHEIN et al., 1991).
Os hormônios estão dentre os vários fatores promotores da carcinogênese. Sejam endógenos ou exógenos, eles estimulam a proliferação celular predispondo às alterações genéticas (HENDERSON e FEIGELSON, 2000). O câncer é causado, na maioria dos casos, por mutação ou ativação anormal dos genes que controlam o crescimento celular, resultando em modificações progressivas da biologia celular caracterizadas por alterações na taxa de proliferação, diferenciação e na interação das células com o meio extracelular (COTRAN et al., 2000).
Os hormônios esteróides sexuais (estrógeno e progesterona), prolactina (PRL), hormônio de crescimento (GH), fatores de crescimento (fator de crescimento tumoral - TGF e fator de crescimento epidermal - EGF) e os hormônios tireoidianos estão envolvidos na carcinogênese mamária (NOGUEIRA e BRENTANI, 1996; FERREIRA, 2005; VERSTEGEN e ONCLIN, 2006). Para Carreño e colaboradores (1999), a participação dos hormônios na carcinogênese se restringe à proliferação das células já transformadas por outros carcinógenos.
Receptores para estrógeno, progesterona, andrógenos, prolactina e para o fator de crescimento epidermal já foram demonstrados nos tumores de mama de cadelas, havendo também a coexistência desses receptores numa mesma neoplasia (MEUTEN, 2002).
2. Revisão de literatura 2.1. Aspectos gerais
O estudo dos tumores de mama que afetam as fêmeas caninas tem ganhado importância, por um lado devido às semelhanças em alguns aspectos com as neoplasias mamárias que acometem a mulher, sendo importantes aliados na compreensão dos mesmos, e por outro lado, pela frequência com que surgem na clínica (FERRI, 2003). Trabalhos experimentais, in vitro e in vivo, de neoplasias mamárias caninas demonstram semelhanças com tumores mamários humanos no que se refere ao comportamento biológico, resposta a agentes citotóxicos, bem como características histológicas. Desta forma, as neoplasias mamárias em cadelas são úteis na pesquisa do câncer mamário nas mulheres, em relação a diagnósticos mais precisos, buscando assim um prognóstico mais exato, além da obtenção de procedimentos terapêuticos mais eficientes (MARTINS et al., 2002).
O conceito da influência hormonal no tumor de mama em mulheres foi primeiramente descrito por Cooper em 1836, o qual observou que os tumores variavam em tamanho durante o ciclo menstrual, apresentando tamanho pequeno no início do ciclo menstrual e na menopausa. Em 1896, Beatson observou remissão dos tumores mamários em mulheres submetidas à ovariectomia (FONSECA e DALECK, 2000).
A hipótese de que alguns hormônios aumentam a incidência das neoplasias em cadelas foi postulada pela primeira vez por Bittner et al. (1948). Ainda há controvérsias sobre a gênese das neoplasias hormônio-dependentes. Pressupõe-se que, na carcinogênese hormonal, diferente daquela induzida por vírus ou agentes químicos, a proliferação celular não necessita de um agente iniciador específico. Os hormônios induzem proliferação celular com consequentes mutações genéticas que darão origem à célula neoplásica (MEUTEN, 2002).
função é atribuída aos estrógenos, sustentados pelas observações de que o câncer de mama não se desenvolve na ausência dos ovários (RUSSO e RUSSO, 1998).
O longo período de tempo necessário para o desenvolvimento de tumor de mama, em animais submetidos à terapia hormonal, indica que os hormônios agem como promotores e não iniciadores no desenvolvimento da neoplasia mamária. Quando as neoplasias são influenciadas por hormônios esteróides, geralmente se tornam dependentes de altos níveis desses hormônios para sua multiplicação, essa é a fase de dependência do tumor. Finalmente, todos os tumores cuja indução tenha ocorrido através de um suporte hormonal, tendem a se tomar autônomos. Essa autonomia, a fase final desse tipo de carcinogênese, é característica comum aos tumores hormônio-dependentes. Quando essa fase ocorre, já houve perda das características de diferenciação celular da linhagem de origem e, morfologicamente, as células tumorais tornam-se indiferenciadas (GERALDES et al., 2000; PENÃ et al., 2003; SILVA et al., 2004).
Os hormônios esteróides desempenham uma função importante no desenvolvimento normal e possivelmente ainda para a formação tumoral na mama, atuando no estágio precoce do desenvolvimento tumoral pela estimulação da proliferação do epitélio normal, levando ao aumento no número de células suscetíveis (RUTTEMAN, 1986). Nas mulheres, há evidência de que a prolactina e os hormônios esteróides podem atuar sinergicamente no aumento do crescimento da mama, desenvolvimento e diferenciação (GUTZMAN et al., 2004). Baseado nessa evidência, os hormônios esteróides têm sido estudados para determinar sua função no desenvolvimento e progressão do câncer de mama humano (THIJSSEN et al., 1986) e nos tumores mamários caninos (PEÑA et al., 2003).
(localmente produzidos ou não) é crucial no crescimento neoplásico e progressão do câncer de mama, devido a sua interação com seus receptores específicos. Tem sido demonstrado que o estradiol aumenta o fator de crescimento endotelial vascular (VEGF), um fator chave para a angiogênese (ILLERA et al., 2006).
Receptores de estrógeno e de progesterona têm sido identificados nas cadelas em mama normal, neoplasias benignas e carcinomas. A presença desses receptores no núcleo de células tumorais é sinal claro da dependência hormonal dessas neoplasias, principalmente quando há presença dos dois receptores ao mesmo tempo (MOULTON, 1990; PELETEIRO, 1994).
Foi observada uma forte associação entre os níveis de hormônios esteróides analisados e o tamanho e taxa de crescimento tumoral. Da mesma forma, os níveis de hormônios esteróides também são significativamente associados com características clínicas dos tumores (ulceração de pele, aderência à pele ou aos tecidos de sustentação). Isso pode indicar, como observado para prolactina no câncer de mama humano (VONDERHAAR, 1998), que os hormônios esteróides e a prolactina atuam como fatores de crescimento local nos tumores malignos caninos, estimulando sua proliferação (QUEIROGA et al., 2005).
Conceitos sobre os mecanismos de formação tumoral sugerem que a transformação neoplásica seja fenômeno compreendido por vários estágios, com diferentes fatores exercendo influências nestes estágios, sendo que deve ser considerado um longo período entre a exposição a esses fatores e o desenvolvimento de uma massa clinicamente detectável (FONSECA e DALECK, 2000).
Também é essencial no estudo de lesões precoces se essas alterações foram induzidas por carcinógenos que podem ser distinguidos de variações normais no desenvolvimento da glândula (RUSSO e RUSSO, 1996).
tumor consiste de uma população heterogênea de células com diferentes características, incluindo expressão de receptor de estrógeno. É, portanto, possível que o ambiente endócrino possa ter influência se o tumor da glândula mamária é receptor-estrógeno positivo ou negativo (DONNEY et al., 1995).
O cão que permanece intacto até o momento da remoção cirúrgica do tumor pode ser mais predisposto a ter um tumor receptor-estrógeno positivo e, portanto, ter um benefício maior na terapia hormonal. Há uma relação entre o status hormonal do receptor e o status hormonal do cão; cães intactos na fase luteal do estro tem concentrações significativamente maiores de receptores de estrógeno em seus tumores que cães castrados ou cães em anestro (DONNEY et al., 1995).
O possível papel da glândula pituitária (hipófise) no tumor de mama canino também tem recebido atenção especial, sendo que alguns relatos conflitantes foram publicados sobre a elevação dos níveis de prolactina em cães portadores de neoplasia. Sabe-se que a prolactina é necessária para a manutenção da atividade secretória, não desempenhando papel sobre a proliferação celular da glândula mamária. Entretanto, a prolactina estimula o crescimento do tumor mamário devido à sensibilização celular aos efeitos do estrógeno, promovendo um aumento no número de receptores de estrógeno (FONSECA e DALECK, 2000).
2.2. Etiologia
2.2.1. Fatores hormonais Hormônios esteróides
concentrações mais elevadas, nas fases do proestro e estro do ciclo estral da cadela. A proliferação do sistema alveolar é dependente da progesterona. Tal esteróide ovariano é predominante nas fases de metaestro e, principalmente, no diestro (DONNAY et al., 1989).
Entretanto, é necessário determinar o papel do estrógeno e da progesterona como promotores do desenvolvimento dos tumores mamários. Em contraste com a afirmação de outros autores, esses hormônios não são mutagênicos, e parece razoável assumir que eles inserem seus efeitos carcinogênicos, não causando algum dano direto ao DNA, mas aumentando ou diminuindo as taxas de proliferação, atrofia ou diferenciação de células tronco ou intermediárias (AMORIM e FERREIRA, 2001).
O estrógeno e a progesterona atuam nas células alvo durante os estádios iniciais da carcinogênese mamária, mas parecem perder seus efeitos estimulatórios durante os estádios finais da doença (FERRI, 2003).
Lespagnard et al. (1987) estudaram a influência dos hormônios estrógeno e progesterona sobre os parâmetros cinéticos celulares em tumores de mama, induzidos in vitro, e concluíram que o estrógeno e, em menor grau, a progesterona podem estimular a replicação celular tanto em tumores que expressam ER e PR, quanto naqueles que não os expressam.
Estrógeno
Os estrógenos, o estradiol em particular, desempenham uma função importante na etiologia do câncer de mama das mulheres. Os estrógenos devem exercer sua ação em várias etapas promovendo o desenvolvimento da manifestação clínica dos tumores, por exemplo, desde a iniciação até a promoção e um dos principais acessos terapêuticos é alcançado na interferência com a ação estrogênica. Essa interferência é exercida em dois níveis, pela prevenção da interação dos estrógenos com as células pelo bloqueio do receptor de estrógeno com anti-estrógenos, ou pela interferência na biossíntese de estrógenos através da administração dos inibidores das enzimas que levam a biossíntese de estradiol (BLANKENSTEIN et al., 1999).
pelo recrutamento de células não cíclicas dentro do ciclo celular. Além disso, alguns proto-oncogenes nucleares são regulados por transcrição pelos estrógenos, o que sugere uma contribuição direta dos estrógenos na carcinogênese (SCHMITT, 1995).
O estrógeno também promove o crescimento celular por estimular a liberação do fator de crescimento tumoral alta (TGF-alfa) e do fator de crescimento semelhante à insulina (IGF-I) e por inibir o fator de crescimento tumoral β (TGF-β), além de estimular o crescimento ductal (MacEWEN e WITHROW, 1996) e estimular a secreção de PRL em ratos (RUSSO e RUSSO, 1996; DAS e VONDERHAAR, 1997). Entretanto, o risco de desenvolvimento de neoplasias malignas tem sido observado na administração continua e em altas doses de estrógeno associado à progesterona (MacEWEN e WITHROW, 1996; NORMAN e LITWACK, 1997).
Tem sido demonstrado que o estradiol aumenta o fator de crescimento endotelial vascular (VEGF), um fator chave para a angiogênese (ILLERA et al., 2006).
A síntese local de estrógenos na mama normal e nos tumores tem sido observada. A concentração do estradiol do tecido tumoral encontrada foi independente do nível de estradiol plasmático. Não apenas na mama, mas em outras partes do corpo, foi considerada uma grande reserva de estrógeno metabolicamente ativo (BLANKENSTEIN et al., 1999).
O conteúdo de estradiol em tumores mamários malignos em cães foi significativamente maior que na mama normal. As concentrações de estradiol no carcinoma mamário inflamatório foram também significativamente maiores que nos tumores mamários malignos não inflamatórios (PEÑA et al., 2003).
Progesterona
As principais funções fisiológicas da progesterona nos mamíferos na glândula mamária são o desenvolvimento lóbulo-alveolar em preparação para a secreção láctea e supressão da síntese da proteína do leite antes do parto (GRAHAM e CLARKE, 1997).
genético celular, fatores de crescimento e receptores dos fatores de crescimento (GRAHAM e CLARKE, 1997).
A progesterona através da via da isoforma A de PR (PR-A) tem uma ação claramente inibitória sobre o crescimento celular no útero, mas tem um efeito proliferativo através da via da isoforma B de PR (PR-B) no desenvolvimento da mama (CONNEELY et al., 2003).
Em cães, a progesterona exógena estimula a síntese de hormônio do crescimento na glândula mamária com proliferação lóbulo-alveolar e consequente hiperplasia de elementos mioepiteliais e secretórios, induzindo a formação de nódulos benignos em animais jovens (MOL et al., 1997; RUTTEMAN et al., 2001; MEUTEN, 2002). Tais alterações, no entanto, podem predispor o tecido a uma transformação maligna (ZUCCARI et al., 2001). A utilização regular desses fármacos, em fêmeas ou em machos, aumenta em três vezes o risco de aparecimento de carcinomas e tumores benignos (FERREIRA e AMORIM, 2003).
Apesar de haver evidência no apoio da função da progesterona na proliferação celular no tecido mamário, os mecanismos envolvidos não estão totalmente elucidados, e a falta de modelos apropriados tem progredido de forma lenta nessa área. Muitos dos dados sobre os mecanismos da ação progestágena na mama são derivados de estudos de células cancerígenas mamárias em cultura: apesar de isso fornecer informações importantes, a validação da extensão dessa informação para o tecido mamário precisa ainda ser completamente testada (GRAHAM e CLARKE, 1997).
Em um estudo foi encontrado que 91% dos cães com tumores da glândula mamária que receberam tratamento a base de progestágenos tiveram tumores malignos (STOVRING et al., 1997).
Estudos em cães fêmeas da raça Beagle demonstraram que os progestágenos aumentam a formação dos tumores mamários e induzem a síndrome do excesso de hormônio de crescimento (GH), conhecido como acromegalia (CONCANNON et al., 1980) e produção local de IGF-I (MOL et al., 1996).
atividade progestagênica. Tais efeitos são menos acentuados pela utilização do proligestone, um progestágeno de atividade principalmente antigonadotrópica (VALLE e MARQUES JÚNIOR, 1999).
A progesterona, apesar de não ser considerada isoladamente como carcinogênica, pode apresentar um papel muito importante no desenvolvimento dos tumores mamários já que cria um ambiente altamente proliferativo, estimulando o crescimento dos tumores ocasionados por outros fatores (MARTINS e LOPES, 2005).
A progesterona provavelmente aumenta a produção de GH autócrino que pode estimular diretamente a síntese local ou sistêmica da secreção de IGF-I. Adicionalmente, o efeito do IGF-I pode ser influenciado por níveis locais de 17-E2. Esses resultados sugerem que todos esses hormônios e fatores podem atuar como fatores de crescimento local estimulando o desenvolvimento e/ou manutenção dos tumores mamários caninos em um modo autócrino/parácrino (QUEIROGA et al., 2008).
Receptores hormonais
Receptores de progesterona e estrógeno (PR e ER) estão presentes tanto no tecido neoplásico quanto no tecido normal (MOULTON, 1990; RUTTEMAN, 1990; DONNAY et al., 1995). Mais de 50% dos tumores mamários caninos e 65-70% dos tumores de mama humanos expressam ER e PR (THURÓCZY et al., 2007).
Animais com tumores de mama contendo ER e PR, ou somente ER, apresentam melhor prognóstico que aqueles que possuem somente PR, visto que a presença dos primeiros correlaciona-se com tumores bem diferenciados (MIALOT et al., 1981; SARTIN et al., 1992). A diminuição da relação ER/PR em carcinomas mamários, que originariamente continham esses receptores, tem sido associada com diminuição da diferenciação celular e progressão da doença, tanto em cães, quanto em humanos (SARTIN et al., 1992).
ambos os tipos de receptores, e menos de 20% apresentam somente um tipo de receptor (DONNAY et al.,1995).
A função dos receptores hormonais nas neoplasias tem sido exaustivamente estudada. Acredita-se que exista relação entre o número desses receptores e a capacidade proliferativa das células neoplásicas (COSTA et al., 2002).
A dependência hormonal dos tumores mamários caninos geralmente diminui com o aumento da malignidade e alta proliferação celular, ocorrendo em tumores malignos com baixa expressão de receptores de progesterona (GERALDES et al., 2000).
Receptores para hormônios tireoidianos também já foram observados na glândula mamária normal e neoplásica, sugerindo a participação dos hormônios da tireóide no câncer de mama da mulher (NOGUEIRA e BRENTANI, 1996). No hipotireoidismo, o aumento da secreção de prolactina (PRL) tem sido incriminado como um dos fatores que agravam o prognóstico da neoplasia mamária (SMYTH, 1997).
De forma geral, nos tumores malignos, a expressão dos genes que codificam os receptores desses hormônios pode estar diminuída, em particular nas neoplasias de maior grau de malignidade ou nas fases mais avançadas da doença (MIALOT et al.,1981; PELETEIRO, 1994). A presença de ER no citoplasma de células tumorais é sinal claro da dependência hormonal dessas neoplasias, e a presença simultânea de ER e PR, considerado como marcador da ação estrogênica, reforça ainda mais essa dependência. Em cadelas, o aumento de estradiol sérico associado ao proestro pode estimular as células que expressam ER a sintetizarem PR (SARTIN et al., 1992).
Dentre os adenocarcinomas mamários caninos, 50 a 53 % são ricos em receptores de estrógeno e 44% são ricos, tanto em receptores de estrógeno, como de progesterona (JOHNSTON, 1998). A concentração de receptores para progesterona pode ser aumentada em animais tratados com o progestágeno acetato de medroxiprogesterona (DONNAY et al., 1993).
Em cadelas, tumores mamários benignos têm demonstrado uma alta proporção de receptores de estrógeno, progesterona e prolactina. Entretanto, em tecidos mamários malignos, pesquisas demonstram haver uma menor quantidade destes receptores. Isso pode ser explicado pelo fato que em estados avançados de câncer mamário, é possível um modelo de crescimento autônomo da neoplasia maligna (RUTTEMAN e MISDORP, 1993).
A pesquisa de receptores esteróides, no estudo dos tumores mamários em seres humanos, pode ser realizada em casos de tumores em animais da espécie canina, embora haja limitação de muitos laboratórios em determinar a presença destes receptores hormonais e os custos podem ser bastante elevados (JOHNSTON, 1998; QUEIROGA e LOPES, 2002a).
Na tentativa de estabelecer novos meios de diagnóstico e prognóstico, têm sido desenvolvidos estudos na área da biologia molecular. Tais procedimentos são realizados, ao calcular-se o índice de proliferação tumoral e a quantificação do grau de microvascularização dos tumores mamários caninos (QUEIROGA e LOPES, 2002b).
Ao contrário do que ocorre na mulher, a determinação de ER e PR ainda não é utilizada rotineiramente no prognóstico de carcinomas mamários caninos e felinos, e nenhuma terapia endócrina é normalmente dada a esses animais. O diferente padrão de expressão dos hormônios esteróides nos tumores mamários caninos e felinos pode ser relevante para selecionar as pessoas que podem se beneficiar da terapia endócrina e estudar protocolos terapêuticos baseados na administração de antagonistas de receptores de hormônios esteróides (MILANTA et al., 2005).
Pseudogestação
atividade do miométrio, crescimento das glândulas endometriais e promoção do desenvolvimento das glândulas mamárias. Após sete dias do final dessa fase haverá diminuição da concentração da progesterona e um aumento da concentração de estrógeno e prolactina (GOBELLO et al., 2001; MARTINS e LOPES, 2005).
Nos casos de pseudogestação recorrentes ou após a lactação as concentrações de prolactina estão elevadas, o que causa retenção láctea predispondo à formação de neoplasias mamárias (MARTINS e LOPES, 2005). A prolactina estimula o crescimento do tumor mamário através da sensibilização celular aos efeitos do estrógeno, promovendo aumento no número de receptores de estrógeno (MORRISON, 1998; FONSECA e DALECK, 2000). Tem sido demonstrado em alguns estudos que a PRL – de uma maneira independente do estrógeno – exerce efeitos proliferativo, anti-apoptótico, migratório e angiogênico nas células in vitro e in vivo do câncer de mama humano e esses efeitos são independentes de sua origem (glândula pituitária anterior ou produção autócrina/parácrina na própria glândula mamária) (BEN-JONATHAN et al., 2002; CLEVENGER et al., 2003; QUEIROGA et al., 2005).
A pseudogestação pode ter relação com neoplasias mamárias, embora alguns autores afirmem que essa condição não predispõe ao desenvolvimento tumoral. É conhecido que em cadelas com pseudogestação recorrente, os níveis de prolactina estão altos, predispondo à formação de tumores de mama; o leite retido cronicamente pode conter compostos químicos que possuam efeito carcinogênico sobre o epitélio adjacente (ZUCCARI et al., 2001). Além disso, a hipóxia celular, resultante da distensão dos ácinos, repletos de secreção láctea, leva à formação de radicais livres, os quais possuem efeito na carcinogênese (PRIGENT, 1998).
Outros fatores hormonais
Entretanto, a pseudogestação assim como a idade à primeira prenhez, número de gestações, ciclos estrais irregulares são fatores contraditórios e ainda não foram determinadas às influências na carcinogênese mamária (FERRI, 2003).
2.2.2. Dieta
Segundo Barbato e colaboradores (2005), em mulheres o peso está diretamente correlacionado ao risco de câncer de mama na pós-menopausa e maior índice de massa corpórea (IMC) nesta faixa etária pode apresentar associação com o câncer. Essas mulheres sofrem transformação no tecido adiposo da androstenediona em estrona e consequentemente em estrógeno, elevando a concentração plasmática deste hormônio e desencadeando a proliferação celular na glândula mamária, aumentando a probabilidade de mutação (YOO et al., 2001; SILVA et al., 2004).
Em cães foi demonstrado que animais magros possuem menor ocorrência de câncer que os obesos. Desse modo, fatores nutricionais podem ter papel no desenvolvimento do tumor de mama, em particular antes do primeiro ciclo estral, nos primeiros meses de vida (SONNENSCHEIN et al, 1991). Pesquisadores constataram que a obesidade no primeiro ano de vida, assim como um ano antes do diagnóstico pode predispor as fêmeas às neoplasias e piorar seu prognóstico (PEREZ ALENZA et al, 2000; MOORE, 2006). Em um estudo, Sirivaidyapong (2003) demonstrou que, dentre as cadelas com tumores de mama, 91,3% foram alimentadas com comida caseira, enquanto que aquelas que não apresentavam tumor mamário apenas 10% foram alimentadas com comida caseira. Estudos indicam que a alimentação caseira, principalmente no que se refere à alta ingestão de carnes bovinas, suínas e gordura animal e a obesidade aumentam o desenvolvimento das neoplasias mamárias, tendo esses fatores atuação maior como promotor e não iniciador da carcinogênese (PELETEIRO, 1994; CONTRAN et al, 2000; RAY et al., 2001; SIRIVAIDYAPONG, 2003; MOORE, 2006).
caninas (ZUCCARI et al., 2001b; FERRI, 2003). Já uma dieta com restrição calórica, tem sido associada a uma redução no desenvolvimento de tumores mamários em animais (WILLETT, 2000).
Muitos trabalhos foram conduzidos para avaliar a associação entre ingestão de alimentos ricos em gordura, gordura total e alguns tipos de ácidos graxos com risco de câncer, inclusive o de mama. Esses achados sugerem que a ligação entre gordura e risco de câncer depende do tipo de gordura consumida ou até mesmo do total de gordura ingerida (GREENWALD et al, 2001; BARBATO et al., 2005). Ainda não se sabe exatamente como os ácidos-graxos podem influenciar na carcinogênese mamária, mas modelos experimentais de ratos comprovaram a existência de correlação positiva. As quebras cromossômicas e peroxidação dos ácidos graxos poliinsaturados levam à superprodução de espécies reativas de oxigênio (EROs). Quando há elevação na concentração desses compostos, seja por aumento ou diminuição da produção de antioxidantes disponíveis, ocorre a lesão tissular e a neoplasia (RAY et al, 2001).
Em um estudo realizado por Toríbio (2008), a maioria dos animais eram alimentados com acréscimo de comida caseira e este fator apresentou correlação com a obesidade, a raça e com fatores sócio-econômicos relacionados aos proprietários.
2.3. Epidemiologia
A prevalência de neoplasias está intimamente relacionada com a maior longevidade observada nesses animais (PELETEIRO, 1994; WITHROW, 2001; DE NARDI et al., 2002; DAGLI, 2008).
Quando comparado com os felinos, as tumorações mamárias caninas são relativamente mais comuns e demonstram uma grande variedade de tipos morfológicos. Os tumores da mama, em particular na cadela, constituem um desafio para clínicos, cirurgiões e patologistas, por apresentarem muitas diversidades em relação à sua patogênese e padrões histológicos (FERRI, 2003).
PIRES et al., 2003), exceto aqueles que apresentam hiperestrogenismo decorrente de sertolioma (MEUTEN, 2002). Na espécie canina, é o segundo tumor mais observado, precedido apenas pelos tumores cutâneos. Quando consideradas somente as fêmeas, é a neoplasia de maior ocorrência (MOULTON, 1990; PELETEIRO, 1994; DALECK, 1996; MISDORP et al., 1999; RUTTEMAN et al., 2001; SOUZA et al., 2001b; DE NARDI et al., 2002).
A frequência dos tumores de mama aumenta a partir dos seis anos de idade, com rara ocorrência em cães com menos de dois anos (MOULTON, 1990; PELETEIRO, 1994).
A idade média de ocorrência dos tumores mamários é de nove a 11 anos (BENJAMIN et al., 1999; RUTTEMAN et al., 2001; CASSALI, 2002; DE NARDI, et al., 2002; OLIVEIRA et al., 2003; PIRES et al., 2003; CAVALCANTI e CASSALI, 2006; FURIAN et al., 2007). A princípio não existe predileção racial, mas alguns trabalhos apontam as raças Poodle, Dachshund, Pointer e Retrievers como mais frequentemente acometidas (PELETEIRO, 1994; MEUTEN, 2002; RUTTEMAN et al., 2001; CASSALI, 2002; CAVALCANTI e CASSALI, 2006; FURIAN et al., 2007). Segundo o estudo realizado por Toríbio (2008), a faixa etária de maior acometimento foi de oito a 12 anos e os cães da raça Poodle e racialmente indefinidos (SRD) apresentaram maior incidência.
A maior incidência de tumores mamários na cadela ocorre nas mamas inguinais e abdominais, possivelmente por essas apresentarem um parênquima mamário mais desenvolvido e, consequentemente, mais exposto á ação hormonal (PELETEIRO, 1994; RUTTEMAN et al., 2001; QUEIROGA e LOPES, 2002; BERGMAN, 2004). A mesma glândula pode apresentar mais de um tipo de tumor (tumores múltiplos) e a maioria das vezes os tumores mamários acometem mais de uma mama (tumores multicêntricos) (PELETEIRO, 1994; BENJAMIN et al., 1999; BERGMAN, 2004).
1994). Estudos observaram que a procura tardia dos pacientes ao serviço médico veterinário pode ser responsável pela maior malignidade dos tumores mamários, pois os tumores benignos podem evoluir e se transformarem em malignos (OLIVEIRA et al., 2003; BERTAGNOLLI et al., 2005).
A distribuição dos focos tumorais é determinada, em grande parte, pelas características anatômicas das veias e dos vasos linfáticos que drenam os locais onde se situam os tumores primários (CONTRAN et al., 2000). A maioria dos tumores malignos nos animais, no entanto, resulta em metástase para os pulmões (SOUZA et al., 2001a; QUEIROGA e LOPES, 2002; MOORE, 2006). Isto ocorre devido ao intenso fluxo de sangue que passa por este órgão. A grande trama de capilares torna a circulação mais lenta e atua como um filtro para os agregados de células tumorais, que se alojam na árvore vascular, inserindo pseudópodos entre as células endoteliais e migrando para o parênquima pulmonar (CONTRAN et al, 2000).
Em mulheres o câncer de mama é o principal responsável por efusões pleurais malignas e é a segunda causa mais frequente de ascite (MONTE et al., 1987). Cassali e colaboradores (1999) observaram efusão pleural em uma cadela portadora de tumor de mama, cujo diagnóstico foi realizado a partir da citologia desse derrame, demonstrando metástase antes mesmo do diagnóstico de neoplasia mamária.
2.4. Diagnóstico
Neoplasias mamárias se apresentam como nódulos, usualmente circunscritos e de dimensões variáveis. Cerca de 90% destas lesões são detectadas pelo exame clínico (PELETEIRO, 1994; MISDORP et. al., 1999).
O exame físico é constituído de duas etapas fundamentais, a inspeção e a palpação. Os procedimentos fornecerão dados sobre o tumor, linfonodos regionais e aspecto geral do animal, que devem ser detalhadamente especificados (BERGMAN, 2004).
Tumores da glândula mamária podem ocorrer em qualquer um dos cinco pares de glândula mamária, mas são mais comuns nos dois pares caudais e múltiplas lesões de diferentes tipos histológicos geralmente coexistem. Os linfonodos axilares e inguinais também devem ser examinados; citologia aspirativa por agulha fina desses nódulos pode ser útil no diagnóstico de metástase (GOBELLO e CORRADA, 2001).
Embora lesões com determinadas características, como maior diâmetro, forma irregular e presença de ulceração e aderência, tenham maior probabilidade de serem malignas, o exame físico apenas não consegue determinar este diagnóstico (KIRPENSTEIJN e RUTTEMAN, 2006; NOVELLAS et al., 2007), fazendo-se sempre necessário o exame citológico e histopatológico (ZUCCARI, 1999; KIRPENSTEIJN e RUTTEMAN, 2006).
2.4.1. Estadiamento dos tumores mamários caninos
Os tumores mamários são classificados pelo sistema TNM (tumor-linfonodo-metástase), proposto pela organização mundial da saúde e aplicado apenas aos carcinomas (OWEN, 1980). (Quadro 1). Essa classificação foi determinada, principalmente, para que o clínico se torne capaz de estabelecer um prognóstico e planejar a terapêutica mais adequada (PELETEIRO, 1994; MOORE, 2006; DAGLI, 2008).
Quadro 1: Estadiamento dos tumores mamários caninos Sistema modificado
T - Tumor primário
T1 <3 cm máximo de diâmetro T2 3-5 cm máximo de diâmetro T3 >5 cm máximo de diâmetro N – Linfonodos regionais
N0 Histologia ou citologia – Ausência de metástases N1 Histologia ou citologia – Metástase presente M – Metástase distante
M0 Metástase à distância não detectada M1 Metástase à distância detectada Estágios
I: T1 N0 M0 II: T2 N0 M0 III: T3 N0 M0
IV: Qualquer T N1 M0
V: Qualquer T Qualquer N M1
Modificado de Owen LN: Classificação dos tumores em animais domésticos, Geneva, 1980, World Health Organization.
Tumores menores de 3 cm, sem invasão linfática apresentam melhor prognóstico que aqueles maiores ou que já apresentam alguma metástase para linfonodos (QUEIROGA e LOPES, 2002; BALDIN et al., 2005; MOORE, 2006; HENRY, 2007). Philibert e colaboradores (2003) demonstraram em seus estudos aumento de sobrevida de aproximadamente oito meses em cadelas com tumor mamário menor que 3 cm, resultados semelhantes ao de Queiroga e Lopes (2002), o qual os animais com grandes massa tumorais apresentaram uma menor sobrevida.
Tumores com tamanho maior que 3 cm foram também relacionados com menor tempo livre da doença, diminuição nos marcadores de estrógeno e mutação no gene p53, fatores esses relacionados com a piora no diagnóstico da doença (CHIARELLI et al., 2000; CAVALCANTI, 2006).
linfonodos axilares ou inguinais são parâmetros clínicos associados a um pior prognóstico, com menor chance de sobrevivência após a excisão cirúrgica de tumores de mama em cadelas (PEREZ ALENZA et al., 2000; BERGMAN, 2004; MOORE, 2006; HENRY, 2007).
Tumores malignos geralmente metastatizam em até dois anos após a cirurgia (geralmente um a nove meses). Apesar de o pulmão ser o local de maior frequência de metástase, outros locais incluindo cérebro, fígado, rins, linfonodos abdominais, coração, glândulas adrenais e ossos pode ser acometidos. Além disso, cães que desenvolveram tanto tumores de mama benignos quanto malignos apresentam um risco maior de desenvolver tumores malignos (MOULTON, 1990; MacEWEN e WITHROW, 1996); portanto, um acompanhamento periódico é indicado em todos os casos (frequência de 3 a 6 meses para tumores malignos e benignos, respectivamente) (GOBELLO e CORRADA, 2001).
2.5. Tratamento
Na Medicina, assim como na Medicina Veterinária, preconiza-se a cirurgia como tratamento da neoplasia mamária (HEDLUND, 2002; QUEIROGA e LOPES, 2002; BERGMAN, 2004; RASSNICK, 2005; STRAW, 2005; MOORE, 2006), com exceção dos carcinomas inflamatórios (HEDLUND, 2002; QUEIROGA e LOPES, 2002; RASSNICK, 2005, STRAW, 2005; GOMES et al., 2006), que podem ser tratados, apenas paliativamente, com antiinflamatórios esteróides ou não esteróides, não sendo observado relação com a taxa de sobrevida (RASSNICK, 2005).
O importante é que seja feita exérese da lesão e de todo o tecido interposto entre a mama e a drenagem linfática (MORRISON, 1998).
A excisão cirúrgica pode ser curativa em cães com estádio I de doença e com tumores pequenos, não invasivos e carcinomas bem diferenciados. Cães com tumores grandes e de alto grau, com maior propensão para desenvolvimento de metástase podem se beneficiar com uma terapia adicional (SORENMO, 2003).
O trabalho publicado por Stratmann et al. (2008) defendem a necessidade de sempre remover todo a cadeia mamária independente do número e tamanho das lesões ao longo desta cadeia. Os autores relatam uma maior frequência do aparecimento de novas lesões neoplásicas no tecido mamário remanescente de cadelas submetidas à mastectomia regional, 57 das 99 (58%). A mastectomia radical é então indicada pelos autores como única opção de tratamento em cadelas portadoras de neoplasia mamária baseada em exérese tumoral e prevenção de novas lesões, não considerando a avaliação de fatores prognósticos já bem estabelecidos na literatura e descritos neste documento.
Os linfonodos inguinais são extraídos durante o procedimento cirúrgico de retirada da mama inguinal juntamente com o segmento cutâneo e tecido adiposo dessa região, caso o procedimento seja realizado de forma adequada (HARVEY, 1996; RUTTEMAN et al., 2001; HEDLUND, 2002).
Quando for necessário proceder a uma mastectomia total (ou completa) bilateral, esta deverá ser efetuada em dois tempos operatórios, intercalados se possível de três a quatro semanas, uma vez que a cicatrização será mais fácil e as complicações pós-cirúrgicas menores (QUEIROGA e LOPES, 2002a).
realização da OSH antes da mastectomia, em tempos operatórios distintos, evitando que células neoplásicas sejam introduzidas de forma iatrogênica na cavidade abdominal.
Yamagami et al. (1996) pesquisaram o papel da OSH, quando realizada no momento da mastectomia, em cadelas portadoras de neoplasias mamarias, e os resultados obtidos demonstraram que essa prática não tem efeito sobre o prognóstico e sobrevida dos animais com tumores. Morris et al (1998) também relataram que a ovariohisterectomia no momento que os tumores mamários são removidos não tem o efeito significante na progressão da doença maligna e quase uma em quatro cadelas com tumor mamário benigno é predisposta a desenvolver outros tumores em outras glândulas.
Um estudo indica que a ovariectomia realizada juntamente com a remoção do tumor mamário prolonga o tempo de sobrevida não apenas em pacientes com tumores benignos, mas também aqueles com tumores de mama malignos (SORENMO et al., 2000). Em cadelas castradas em até dois anos antes ou concomitante a cirurgia, a sobrevida foi de 45% mais longa em relação as que não foram castradas. Portanto, a castração de todas as cadelas no momento da remoção dos tumores de mama deve ser considerada (GOBELLO e CORRADA, 2001).
2.6. Prognóstico
O prognóstico, para cadelas portadoras de neoplasias mamárias, é influenciado pelas dimensões do tumor, tipo histológico, modo de crescimento e estágio clínico. Infiltração linfática, metástases, rápido crescimento tumoral e recidivas, levam a um prognóstico reservado a ruim (JOHNSTON, 1998).
Obesidade e dieta altamente gordurosa em idade mais jovem também estão associadas com um prognóstico pobre e aumento no risco de tumor de mama, respectivamente (SONNENSCHEIN et al., 1991).
Em estudo realizado por Chang e colaboradores (2005), os resultados sugerem que o estágio tumoral, tamanho do tumor e status de OSH são fatores prognósticos significantes associados com sobrevida de dois anos após cirurgia em cães com tumores mamários malignos. Além disso, tanto os cães com tumores maiores que 5 cm de diâmetro ou cães apresentando tumores há mais de seis meses antes da cirurgia tiveram um risco maior em ter metástase em linfonodos.
3. Objetivos:
• Avaliar a proporção dos tumores de mama malignos e benignos nas cadelas estudadas da cidade de Botucatu e região;
• Relacionar fatores como pseudogestação, número de gestações, administração de fármacos contraceptivos e alimentação no surgimento das neoplasias;
• Realizar dosagens hormonais de estrógeno e progesterona no soro sanguíneo e tecido tumoral das cadelas com tumor da mama;
• Avaliar a expressão gênica dos receptores de estrógeno e progesterona nos tumores;
4. Material e Métodos
4.1. Atendimento dos animais com neoplasia mamária
Foram selecionados 3 grupos de animais. Vinte e quatro (24) animais com tumores malignos pertenceram ao grupo dos “malignos”, dois (2) animais com lesões mamárias benignas pertenceram ao grupo dos “benignos” e cinco (5) animais sem evidência de afecções mamárias fizeram parte do grupo controle.
Os animais que apresentavam afecções mamárias foram encaminhados ao setor de Reprodução Animal a fim de realizar exames clínicos para avaliação do estado geral. Os proprietários responderam ao questionário (Anexo) sobre aspectos como alimentação, atividade reprodutiva e histórico da doença.
Em se suspeitando de neoplasia mamária, o animal era submetido à citologia aspirativa por agulha fina (CAAF), citologia vaginal e dosagem de progesterona sérica para identificação da fase do ciclo estral e exames pré-operatórios (hemograma, exame de creatinina e raio-x torácico).
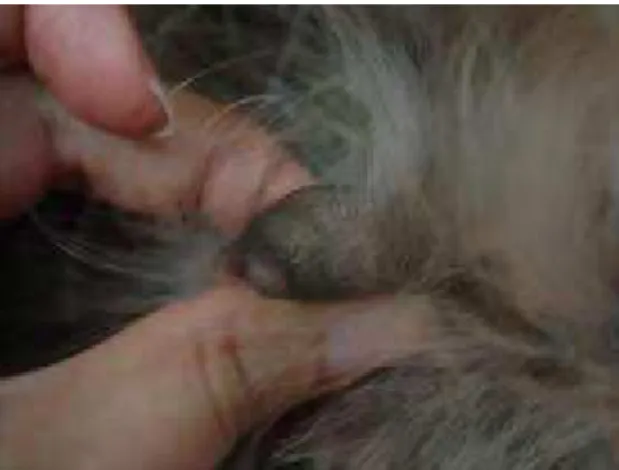
Além disso, foi realizada a classificação do estadio clínico do tumor mamário das cadelas, segundo a O.M.S. (OWEN, 1980) (Figuras 1, 2 e 3).
Figura 2. Cadela nº 16, 9 anos, raça Cocker Spaniel tamanho do tumor 4x6cm, linfonodos regionais e metástases a distância ausentes. Tumor classificado como estadio III (T3). Botucatu, 2010.
Figura 3. Cadela nº 7, 5 anos, SRD, tamanho do tumor 15x8cm, envolvimento de linfonodos regionais e metástases a distância ausentes. Tumor classificado como estadio IV (T4). Botucatu, 2010.
Os linfonodos satélites foram avaliados por meio de exame histopatológico. Nos casos em que foram constatados metástase pulmonar (animais 27 e 28), através do exame de radiografia torácica, os animais não foram submetidos à cirurgia e receberam tratamento paliativo a base de antiinflamatórios não esteroidais e analgésicos.
4.2. Coleta de material
4.2.1. Sangue
- 20°C. Este soro foi utilizado para mensuração dos hormônios esteróides (estrógeno e progesterona) através da técnica de radioimunoensaio (Tabela 2).
4.2.2. Citologia vaginal esfoliativa
O exame foi realizado com o auxílio de escova ginecológica previamente umidificada com solução fisiológica e, posteriormente, introduzida pela comissura dorsal da vulva, em um ângulo de 45°. A escova coletora foi introduzida o mais profundo possível e rotacionada nas paredes da vagina em sentido horário. O material foi imediatamente transferido para duas lâminas histológicas limpas, em sentido anti-horário. A fixação das lâminas foi realizada em álcool absoluto e, posteriormente, as lâminas foram coradas com Panótico Rápido®. As amostras foram examinadas em microscopia de luz, com objetiva de 40x e 200 células foram quantificadas e classificadas de acordo com a sua morfologia em células parabasais, intermediárias, superficiais nucleadas e anucleadas (escamas) de acordo
com Johnston et al. (2001) e presença ou ausência de neutrófilos.
4.2.3. Citologia aspirativa por agulha fina (CAAF) das neoplasias mamárias
Tabela 1. Diagnóstico citológico das neoplasias mamárias dos animais atendidos (n=26) no setor de Reprodução Animal do Hospital Veterinário da FMVZ – Unesp . Botucatu, 2011.
Animal Citologia
1 Carcinoma complexo de alto grau
2 Carcinoma simples
3 Tumor misto benigno
4 Tumor complexo
5 Tumor misto maligno
6 Carcinoma simples
7 Carcinoma complexo
8 Carcinoma complexo
9 Carcinoma complexo
10 Tumor misto maligno
11 Carcinoma complexo
12 Carcinoma simples
13 Neoplasia benigna com atipia
14 Carcinoma complexo
15 Tumor misto maligno
16 Carcinoma complexo
17 Carcinoma complexo
18 Tumor misto maligno
19 Carcinoma simples
20 Tumor misto maligno
21 Carcinoma complexo
22 Tumor misto maligno
23 Sugestivo de carcinoma mamário
24 Processo inflamatorio agudo
25 Tumor misto benigno
26 mastopatia cistica + hiperplasia/displasia
Dos diagnósticos realizados pela CAAF, cinco cadelas apresentaram afecções mamárias benignas e 21 fêmeas diagnosticadas com neoplasias malignas.
4.2.4.Mastectomia
4.2.5. Protocolo anestésico
Foi utilizado como medicação pré-anestésica (MPA): Morfina 0,5mg/kg, IM e Meloxicam 0,2mg/kg, IM. A indução foi realizada com Cetamina 5mg/kg, IV e Diazepam 0,25mg/kg, IV e manutenção com Isoflurano + infusão contínua de MLK (morfina 200mcg/kg/h, lidocaína 3000mcg/kg/h e cetamina 600mcg/kg/h) e Fentanila em bólus (antes da remoção da cadeia mamária) na dose de 5mcg/kg, IV.
4.2.6.Procedimento cirúrgico
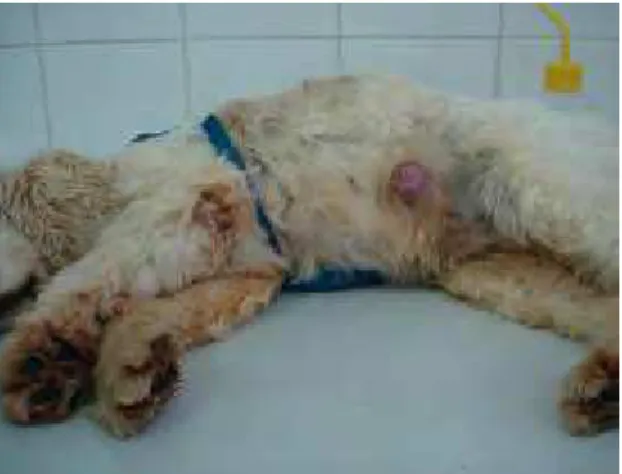
As cadelas foram submetidas à mastectomia radical unilateral; aquelas que possuíam neoplasia nas duas cadeias mamárias foram submetidas a uma nova cirurgia (2ª etapa) após 45 dias (Figura 4. Cadela nº 4)
Figura 4. Cadela nº 4, 7 anos, SRD, após realização de mastectomia unilateral radical Botucatu, 2011.
4.2.7. Pós-operatório
diluído em solução Fisiológica NaCl 0,9% (1%). A retirada dos pontos era realizada após 10 dias.
4.2.8.Amostras dos tecidos mamários
Após a cirurgia, todos os tumores foram separados em três fragmentos para determinação hormonal, histopatológica e de receptores de hormônios esteróides.
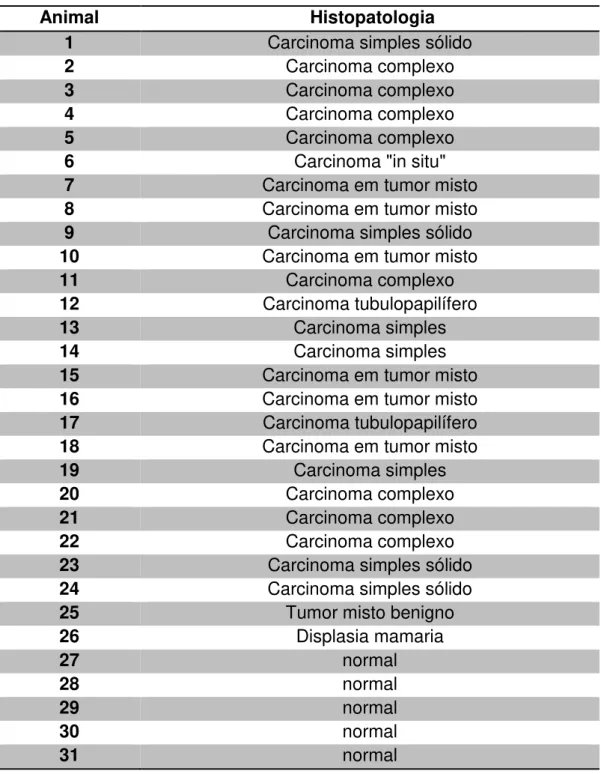
As amostras de tumor mamário e glândula mamária normal foram fixadas em solução tamponada a 10% de fosfato de formoldeído e enviadas ao Serviço de Patologia Veterinária do Departamento de Clínica Veterinária da FMVZ – Unesp, Botucatu, onde foram processados rotineiramente para análise histológica (Tabela 5).
4.3. Armazenamento dos tecidos para dosagem hormonal
Aproximadamente 0,3g de tecido mamário foram colocados em criotubos e armazenados em nitrogênio líquido (-196°C) para posterior análise de estrógeno e progesterona.
4.4. Extração hormonal do tecido
4.5. Dosagem hormonal
As dosagens hormonais teciduais e sanguíneas foram realizadas através da técnica de radioimunoensaio em fase sólida, por meio dos kits comerciais de Progesterona e Estradiol COAT-A-COAT (Siemens®) com
adaptação do Programa GW Basic.
4.6. Receptores de hormônios esteróides por meio de RT-PCR
Fragmentos das amostras pesando 50 a 100mg foram transferidos para criotubos e armazenados em nitrogênio líquido (-196°C) para posterior análise.
4.6.1. Avaliação da expressão gênica dos receptores hormonais por meio de PCR em tempo real
As análises de expressão gênica dos receptores de estrógeno e progesterona foram realizadas no Departamento de Morfologia, no Instituto de Biociências da Unesp, Botucatu.
4.6.2. Extração do RNA e reação de transcrição reversa
O RNA total foi recuperado a partir de 50-100mg de tecido mamário ou neoplásico imerso em 1mL de solução Trizol (Invitrogen®). Cada amostra de tecido foi triturada em microtriturador de tecidos (Polytron) e adicionou-se 200µL de clorofórmio. Após centrifugação durante 15 minutos a 12000g a 4°C, a fase aquosa foi transferida, com auxílio de uma pipeta, para outro tubo contendo 0,5mL de álcool isopropílico e posterior centrifugação durante 10 minutos a 12000g e 4°C.
Adicionou-se 1 mL de etanol 75% (diluído em água com dietilpirocarbonato – DEPC) e realizou-se a centrifugação durante 5 minutos a 7500g a 4°C. Após descartar o sobrenadante, o “pellet” foi dissolvido em água – Rnase free (“pellet” pequeno – 15 a 20µL; “pellet” grande – 30 a 40µL) e colocado no gelo. Por fim, a amostra foi incubada por 10 minutos a 60°C em banho-maria e armazenada no freezer a -70°C.
razão da OD 260/280 foi por volta de 2,0. Para cada amostra, cDNA foi sintetizado a partir de 2 µg de RNA total utilizando os componentes do High Capacity cDNA archive kit (Applied Biosystems, Foster City, CA, EUA).
A amostra continha 10 µL de 10x Reverse Transcription Buffer, 4 µL 25X dNTPs, 10 µL 10X random primers, 100 unidades de RNase inhibitor (Invitrogen Life Technologies, Carlsbad, CA, USA) , 250 unidades de MultiScribe™ Reverse Transcriptase, e o volume final foi ajustado para 100 µL com água livre de nuclease. Os primers se anelaram por 10 minutos a 25°C antes de proceder a reação por 2 horas a 37°C. Controles de reação “No RT” foram feitos por meio da omissão da enzima transcriptase reversa. Estas reações foram amplificadas por PCR para garantir que não houve contaminação das amostras por DNA.
As amostras de cDNA resultantes foram aliquotadas e armazenadas a -20°C. 2µL de cDNA, correspondentes aos 20 ng de RNA total, da reação de RT, foram utilizados como template nas reações de PCR em tempo real subsequentes que foram feitas no 7300 Real-Time PCR System (Applied Biosystems, Foster City, CA, USA) com condições universais de termociclagem do equipamento: 95 °C por 10 min, 40 ciclos de 95 °C por 15 s, e então 60 °C por 1 min. As reações foram feitas em duplicatas utilizando 0,4 µM de cada primer e 2X Power SYBR Green PCR master mix (Applied Biosystems, Foster City, CA, USA) em um volume final de 25 µL.
4.6.3. Caracterização do perfil de expressão gênica por PCR em tempo real
A exatidão da quantificação do RNA mensageiro depende da linearidade e eficiência da amplificação da PCR, a qual foi validada e determinada pelo método do CT comparativo ou ΔΔCq (WONG e
MEDRANO, 2005; Applied Biosystems User Bulletin N° 2). Foi constituída uma série de seis diluições (10x) a partir do produto de PCR diluído 500 vezes, referente a cada gene, de uma mistura inicial contendo quantidades iguais de cDNA das três amostras de padronização, gerando assim seis pontos de uma curva padrão, para cada um dos conjuntos de primers escolhidos inicialmente para a RT-PCR em tempo real.
A linearidade e a eficiência da PCR em tempo real foram deduzidas a partir da inclinação da curva-padrão gerada pelo software 7300 System SDS (Applied Biosystems, Foster City, CA, EUA) para cada um dos genes analisados. A análise de todas as curvas-padrão demonstrou uma alta linearidade (r2 = 0,99). A eficiência da PCR (Ex) foi calculada a partir da
equação Ex = 10 -1-1/inclinação -1. Uma inclinação de -3,32 implica numa
eficiência de reação de 100%. Todos os genes apresentaram valores de inclinação próximos de -3,32 e as estimativas de eficiência ficaram entre 99,5 % e 100,5%.
Foi realizada a validação do método ∆∆Cq para todos os genes, e todos foram validados. Analisamos a possibilidade de validação do método do CT comparativo, de acordo com o User Bulletin #2 (Applied Biosystems,