Aplicação da tecnologia eletroquímica para a remoção e monitoramento
de metais pesados em efluentes aquosos
Maria Maésia Soares Gomes Eiband
____________________________________________
Tese de Doutorado
Natal/RN, janeiro de 2015
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS EXATAS E DA TERRA
INSTITUTO DE QUÍMICA
1
MARIA MAÉSIA SOARES GOMES EIBAND
APLICAÇÃO DA TECNOLOGIA ELETROQUÍMICA PARA A REMOÇÃO E MONITORAMENTO DE METAIS PESADOS EM EFLUENTES AQUOSOS
Orientador: Dr. Carlos Alberto Martinez-Huitle Co-orientador: Dr. Jailson Vieira de Melo.
Natal/RN, 2015
UFRN / Biblioteca Central Zila Mamede. Catalogação da Publicação na Fonte.
Eiband, Maria Maésia Soares Gomes
Aplicação da tecnologia eletroquímica para a remoção e monitoramento de metais pesados em efluentes aquosos / Maria Maésia Soares Gomes Eiband. – Natal, RN, 2015.
108 f. : il.
Orientador: Prof. Dr. Carlos Alberto Martinez-Huitle. Co-Orientador: Prof. Dr. Jailson Vieira de Melo.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Ciencias Exatas e da Terra. Instituto de Química. Programa de Pós-Graduação em Química.
1. Metais pesados – Tese. 2. Cádmio - Tese. 3. Chumbo - Tese. 4. Eletrocoagulação - Tese. 5. Eletroanálise - Tese. I. Martinez-Huitle, Carlos Alberto. II. Melo, Jailson Vieira de. III. Universidade Federal do Rio Grande do Norte. IV. Título.
4
AGRADECIMENTOS
A DEUS que guiou-me rumo a essa realização;
Ao Programa de Pós-graduação em Química (PPGQ) pela oportunidade acadêmica; A Coordenação de Aperfeiçamento de Pessoal de Nível Superior– Capes, pela bolsa concedida;
Ao meu orientador professor Dr. Carlos Alberto Martinez Huitle, pela relevante contribuição na minha formação profissional;
Ao professor Dr. Jailson Vieira de Melo pela recepção e encaminhamentos para que tudo se tornar-se possível;
A professora Dra. Nedja Suely Fernandes pela colaboração e incentivo;
A professora Dra. Maria de Fátima Vitória de Moura por gentilmente ceder equipamentos importantes do seu laboratório para as análises complementares;
Aos alunos de Iniciação Científica Kelvin e Kamélia pela contribuição no desenvolvimento do trabalho;
Aos amigos do Laboratório de Eletroquímica Ambiental e Aplicada pelos momentos compartilhados;
A minha família amada pela compreensão e apoio incondicional.
5 Vivo extraviado em meu tempo por acreditar em valores que a maioria julga ultrapassados. Entre esses, o amor, a honra e a beleza que ilumina caminhos da retidão, da superioridade moral, da elevação, da delicadeza, e não da vulgaridade dos sentimentos.
6
RESUMO
EIBAND, M. M. S. G. Aplicação da tecnologia eletroquímica para a remoção e monitoramento de metais pesados em efluentes aquosos. 2015, janeiro. Tese de Doutorado
– Universidade Federal do Rio Grande do Norte.
Os metais pesados estão presentes em resíduos industriais. Estes metais podem gerar um grande impacto ambiental contaminando água, solos e plantas. A ação química de metais pesados tem despertado grande interesse ambiental. Neste contexto, esta pesquisa teve como objetivo principal testar o desempenho de tecnologias eletroquímicas para a remoção e quantificação de metais pesados. Primeiramente, a técnica eletroanalítica de voltametria de redissolução anódica (Adsortion stripping voltammetry, em inglês) com eletrodo de carbono vítreo (GC) foi padronizada a fim de usar essa metodologia para a quantificação dos metais durante sua eliminação mediante o processo de eletrocoagulação (EC). As curvas analíticas necessárias foram avaliadas visando obter confiabilidade na determinação e quantificação de Cd2+ e Pb2+ separadamente ou em uma mistura (soluções sintéticas contendo Cd2+ e Pb2+). Entretanto, o processo de remoção mediante a EC foi desenvolvido empregando uma célula eletroquímica em fluxo contínuo (EFC) para a remoção de Cd2+ e Pb2+. Os experimentos foram realizados utilizando eletrodos em placas paralelas de Al com 10 cm de diâmetro e área de 63,5 cm2. A otimização das condições para a remoção de Cd2+ e Pb2+ no tratamento de 2 L de solução, com fluxo de 151 L h-1 foram estudadas em função de diferentes valores de corrente aplicada durante 30 min. A remoção dos íons de Cd2+ e Pb2+ da solução foram monitoradas durante a eletrólise utilizando a voltametria de redissolução empregando o GC como sensor. Os resultados mostraram que a eliminação de Pb2+é eficiente quando o processo de EC é utilizado, obtendo valores de remoção de 98% em 30 min. Este comportamento é dependente da corrente aplicada, o que implica num aumento do consumo de energia. A partir dos resultados também verificou-se que a voltametria de redissolução (AdSV) é bastante confiável na determinação da concentração de Pb2+, quando comparada com a técnica de absorção atômica (AA). Diante disto, como segundo objetivo deste trabalho foi avaliar a remoção de Cd2+ e Pb2+ mediante a EC, acomplando esta tecnologia eletroquímica com a metodologia eletroanalítica para a quantificação destes metais durante sua remoção de efluentes sintéticos. A eficiência de remoção, com o aumento da corrente foi confirmada, obteve-se remoção 93% e 100% de Cd2+ e Pb2+ respectivamente, após 30 min de EC. O aumento da corrente promove a oxidação dos eletrodos de sacrifício, e consequentemente o aumento da quantidade de coagulantes, que influencia a eliminação dos metais em solução. A AdSV é uma maneira rápida, confiável, econômica e simples para determinar íons de Cd2+ e Pb2+ durante suas remoções, o método eletroanalítico pode ser utilizado com confiança aceitável, assegurando a precisão da quantificação e uma boa sensibilidade e, além disso, é mais econômico do que os normalmente usados, que requerem a utilização de reagentes tóxicos e mais caros. Os nossos resultados demonstraram o potencial das técnicas eletroanalíticas para monitorar o curso de intervenções ambientais. Assim, a aplicação das duas técnicas associadas pode ser um caminho confiável para monitoramento de impactos ambientais devido a contaminação de ecossistemas aquáticos por metais pesados.
7
ABSTRACT
EIBAND, M. M. S. G. Application of electrochemical technology for removing and
monitoring heavy metals in wastewater. 2015, January. Doctoral Thesis – Universidade Federal do Rio Grande do Norte.
Heavy metals are present in industrial waste. These metals can generate a large environmental impact contaminating water, soil and plants. The chemical action of heavy metals has attracted environmental interest. In this context, this study aimed to test the performance of electrochemical technologies for removing and quantifying heavy metals. Firstly, the electroanalytical technique of stripping voltammetry with glassy carbon electrode (GC) was standardized in order to use this method for the quantification of metals during their removal by electrocoagulation process (EC). Analytical curves were evaluated to obtain reliability of the determination and quantification of Cd2+ and Pb2+ separately or in a mixture. Meanwhile, EC process was developed using an electrochemical cell in a continuous flow (EFC) for removing Pb2+ and Cd2+. These experiments were performed using Al parallel plates with 10 cm of diameter (63.5 cm2). The optimization of conditions for removing Pb2+ and Cd2+, dissolved in 2 L of solution at 151 L h-1, were studied by applying different values of current for 30 min. Cd2+ and Pb2+ concentrations were monitored during electrolysis using stripping voltammetry. The results showed that the removal of Pb2+ was effective when the EC process is used, obtaining removals of 98% in 30 min. This behavior is dependent on the applied current, which implies an increase in power consumption. From the results also verified that the stripping voltammetry technique is quite reliable determining Pb2+ concentration, when compared with the measurements obtained by atomic absorption method (AA). In view of this, the second objective of this study was to evaluate the removal of Cd2+ and Pb2+ (mixture solution) by EC. Removal efficiency increasing current was confirmed when 93% and 100% of Cd2+ and Pb2+ was removed after 30 min. The increase in the current promotes the oxidation of sacrificial electrodes, and consequently increased amount of coagulant, which influences the removal of heavy metals in solution. Adsortive voltammetry is a fast, reliable, economical and simple way to determine Cd2+ and Pb2+ during their removal. It is more economical than those normally used, which require the use of toxic and expensive reagents. Our results demonstrated the potential use of electroanalytical techniques to monitor the course of environmental interventions. Thus, the application of the two techniques associated can be a reliable way to monitor environmental impacts due to the pollution of aquatic ecosystems by heavy metals.
Keywords: cádmium, lead, electrocoagulation, electroanalysis.
8
LISTA DE FIGURAS
CAPÍTULO 3
Figura 3.1 Processo de eletrocoagulação... 27
Figura 3.2 Voltametria de redissolução anódica, indicando o processo de eletrodeposição com potencial constante, seguido de uma varredura linear para redissolução dos metais depositados previamente...
31
CAPÍTULO 4
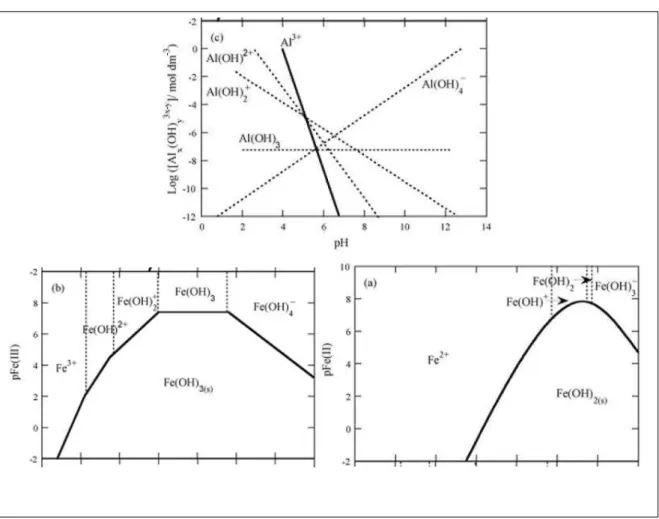
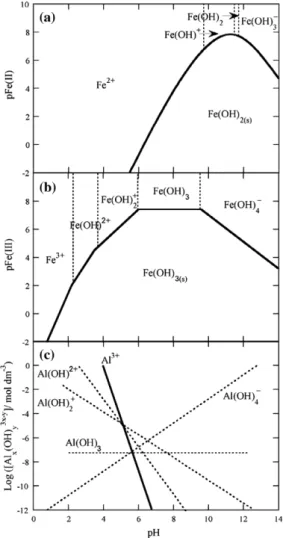
Figura 4.1 Predominance-zone diagrams for (a) Fe(II) and (b) Fe(III) chemical species in aqueous solution; the straight lines represent the solubility equilibrium for insoluble Fe(OH)2 and Fe(OH)3, respectively, and the dotted lines represent the predominance limits between soluble chemical species. (c) Diagram of solubility of Al(III) species as a function of pH………...
42
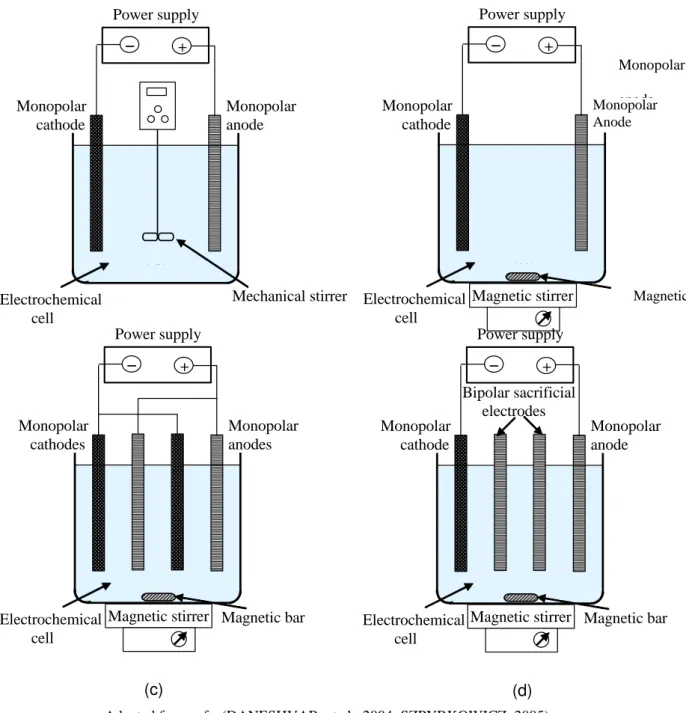
Figura 4.2 Schemes of bench-scaled electrochemical cells with stirred tank reactors for treating dyes by electrocoagulation in batch operation mode. Two-electrode cell with: (a) mechanical stirrer and (b) magnetic bar stirrer. Electrochemical cell with: (c) monopolar electrodes in parallel
connection and (d) bipolar sacrificial
electrodes……….
45
CAPÍTULO 5
Figura 5.1 Predominance-zone diagrams for (a) Fe(II) and (b) Fe(III) chemical species in aqueous solution; the straight lines represent the solubility equilibrium for insoluble Fe(OH)2 and Fe(OH)3, respectively, and the dotted lines represent the predominance limits between soluble chemical species. (c) Diagram of solubility of Al(III) species as a function of pH………...
62
Figura 5.2 Electrochemical flow cell for the EC process using sacrificial Al and Fe electrodes: (a) Set-up used: (1) thermoregulated reservoir; (2) electrochemical cell; (3) power supply; (4) pump. (b) Electrochemical cell: (1) inlet; (2) anode; (3) cathode; (4) electrolysis compartment; (5
and 6) electrical contacts and (7)
outlet………
66
Figure 5.3 (a) AdSV curves recorded at a GC electrode in 0.5 mol L-1 NaNO3 (as supporting electrolyte) and after the addition of different amounts of Pb2+. Inset: linear dependence on the peak current on Pb2+ concentration. (b) Graphic representation of the residuals behavior, which confirms the goodness of the calibration
curve………
9
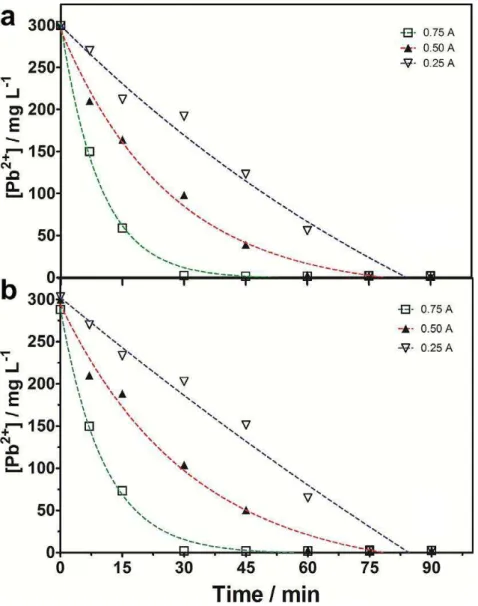
Figure 5.4 Comparison of Pb2+ removal, as a function of time, between Al and Fe electrodes during its elimination by EC process. Experimental conditions: [Pb]0 = 15 mg L-1 , applied currents: 0.05 and 0.1 A; tests have been carried out at 25°C………
69
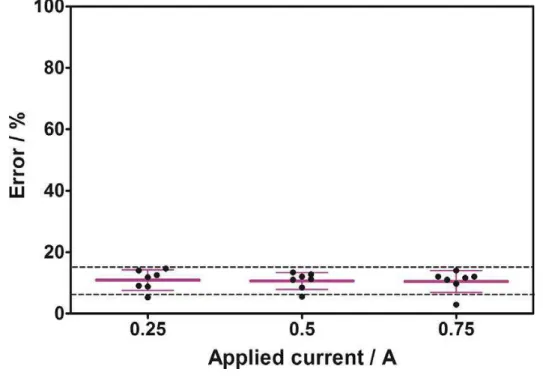
Figure 5.5 Statistical error (dashed lines), mean (pink full lines marked in bold) and standard deviation (pink full lines, indicating ± standard deviation) for the mea- surements performed using AdSV (blackpoints), withrespect to results providedby AAS. (For interpretation of the references to color in this figure legend, the reader is referred to the web version of this article……….
71
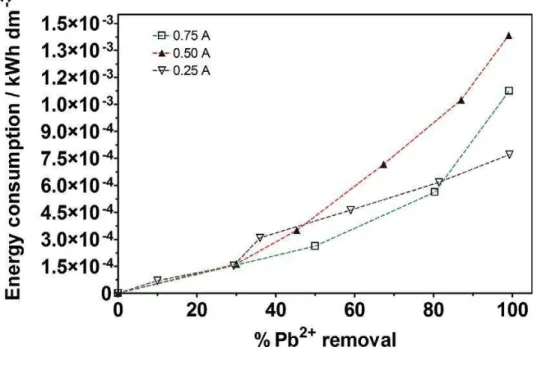
Figure 5.6 Evolution of the energy consumption against the Pb2+ removal (%), during electrocoagulation using sacrificial Al electrodes…….
72
CAPÍTULO 6
Figure 6.1 A: 1) Anodic part; 2) electric support to anode; 3) anode (Aluminium disk); 4) reaction compartment, 5) cathode (Aluminium disk); 6) Metallic support to electrical contact with cathode and 7) cathodic part. B) Electrochemical system: 1) Reservoir, 2) thermometer, 3) electrochemical cell e 4) peristaltic pump. C: Image of electrochemical
cell and with the each one of the
compartments………
80
Figure 6.2 Linear dependence on the peak current on Pb2+ concentration and AdSV curves recorded at a GC electrode in 0.05 mol L-1 KCl (as supporting electrolyte) and after the addition of different amounts of
Pb2+.………..
82
Figure 6.3 Linear dependence on the peak current on Pb2+ concentration and AdSV curves recorded at a GC electrode in 0.05 mol L-1 KCl (as supporting electrolyte) and after the addition of different amounts of
Cd2……….
82
Figure 6.4 (a) Calibration curves of Cd2+ and Pb2+, as a function of current measured and (b) AdSV curves recorded at a GC electrode in 0.05 mol L-1 KCl (assupporting electrolyte) and after the addition of different amounts of Cd2+ and Pb2+. ………
82
Figure 6.5 Comparison of Cd2+ and Pb2+ removal, as a function of time, during its elimination by EC process using Al sacrificial electrodes.. Experimental conditions: [Cd]0 and [Pb]0 = 15 mg L-1 , applied currents: 0.05 and 0.1 A; tests have been carried out at 25°C.
83
Figure 6.6 pH behavior during EC process using Al and Fe electrodes for removing
Pb2+………...………
10
Figure 6.7 Cd2+ and Pb2+ removal, as a function of time, using Al electrodes during its elimination by EC process. Experimental conditions: initial concentration = 15 mg L-1 , applied currents: 0.05 and 0.1 A; tests have been carried out at 25°C………
85
Figure 6.8 Cd2+ and Pb2+ removal, as a function of time, using Al electrodes during its elimination by EC process. Experimental conditions: initial concentration = 15 mg L-1 , applied currents: 0.5 and 1 A; tests have been carried out at 25°C.
86
Figure 6.9 Comparison of Cd2+ and Pb2+ removal, as a function of time, during its elimination by EC process using Al sacrificial electrodes. Experimental conditions: Concentration of Cd2+ and Pb2+ about 15 and 20 mg L-1, respectively, by applying 0.50 and 1.0 A at 25°C.
87
Figure 6.10 Effect of Cd2+ and Pb2+ removal with 75 dm³ h-1, as a function of time, using Al electrodes during its elimination by EC process. Experimental conditions: initial concentration = 15 mg L-1, applied currents: 0.05 and
0.1 A at 25°C……….
88
Figure 6.11 Evolution of the energy consumption against the Cd2+ and Pb2+ removal (%) in a mixture solution, during electrocoagulation using sacrificial Al electrodes
11
LISTA DE TABELAS CAPITULO 4
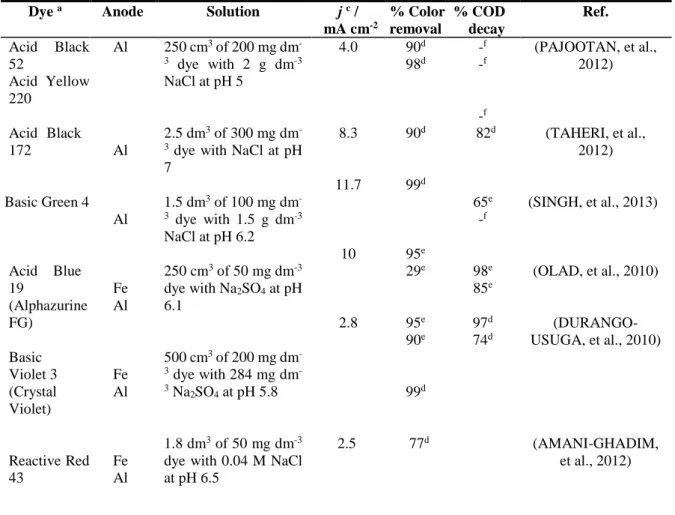
Tabela 4.1 Percentage of color removal and COD decay for the electrocoagulation with Fe and/or Al anodes of several synthetic dyes solutions containing NaCl or Na2SO4 under selected conditions at ambient temperature or 25 ºC………..
51
CAPITULO 5
12
LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS
A Amplitude
AAS Espectrofotometria de absorção atômica
CONAMA Conselho Nacional Meio Ambiente
EC Eletrocoagulação
Ed Potencial de deposição
ER Eletrodo de referência
ET Eletrodo de Trabalho
I Corrente elétrica
J Densidade de corrente
Ld Limite de detecção
pH Potencial hidrogeniônico
r2 Coeficiente de correlação
∆E Variação de potêncial
ADSV Voltametria de redissolução anódica
13
SUMÁRIO
CAPÍTULO 1... 17
1.INTRODUÇÃO... 17
CAPITULO 2... 19
2.OBJETIVOS... 19
2.1. OBJETIVO GERAL... 19
2.2. OBJETIVOS ESPECÍFICOS... 19
CAPITULO 3... 20
3.REFERENCIAL TEÓRICO... 20
3.1 IMPACTO AMBIENTAL DOS METAIS PESADOS... 20
3.1.1 Cádmio... 23
3.1.2 Chumbo... 24
3.2 TRATAMENTO DE EFLUENTES INDUSTRIAIS CONTAMINADOS COM METAIS PESADOS... 25 3.2.1 Voltametria de redissolução anódica... 29
REFERÊNCIAS... 33
CAPITULO 4 ELECTROCOAGULATION: FUNDAMENTS, APPLICABILITY TO WATER TREATMENT AND ASSOCIATION WITH ELECTROANALYTICAL TECHNIQUES……….. 41
Abstract... 41
4.1 FUNDAMENTS... 41
4.1.1. Factors affecting electrocoagulation………... 47
4.1.1.1 Effect of electrode material………. 47
4.1.1.2 Electrode distance……….... 47
4.1.1.3 Electrode arrangements……… 48
4.1.1.4 Effect of pH………. 48
4.1.1.5 Effect of current density……….. 48
4.1.1.6 Reactor design ……….……… 48
14
4.1.2.1 Domestic wastewater treatment……….……... 49
4.1.2.2 Textile dyes……….. 49
4.1.2.3 Heavy metals……… 52
4.1.2.4 Inorganic removal………. 52
4.1.3 Applicability of electroanalysis during electrocoagulation treatment………. 53
REFERENCES……… 54
CAPITULO 5 ELIMINATION OF PB2+ THROUGH ELECTROCOAGULATION: APPLICABILITY OF ADSORPTIVE STRIPPING VOLTAMMETRY FOR MONITORING THE LEAD CONCENTRATION DURING ITS ELIMINATION 60 5.1 Abstract... 60
5.2 Introduction... 61
5.3 Experimental ... 64
5.3.1 Reagents... 64
5.3.2 Analytical methods... 65
5.3.3 Eletrocoagulação do Pb2+... 65
5.4 Results and discussion... 66
5.4.1 Electrocoagulation experiments……….. 68
5.5 Conclusions... 72
REFERÊNCES... 73
CAPITULO 6. ... 77
6. REMOVAL OF HEAVY METALS PB2+ AND CD2+ BY ELECTROCOAGULATION METHOD……….………... 77
6.1 Abstract... ………... 77
6.2 Introduction………....... 78
6.3 Experimental………...... 79
6.3.1 Reagents ………... 79
6.3.2 Analytical methods………...…….. 79
6.3.3 Electrocoagulation of Cd and Pb e binary mixture………. 81
6.4 Results and discussion... 81
15
6.4.2 Electrocoagulation experiments... 83
6.5 Conclusions... 89
REFERÊNCES... 90
CAPITULO 7... 93
7.1 CONCLUSÕES E CONSIDERAÇÕES FINAIS 93 ANEXOS TRABALHOS PUBLICADOS DECORRENTES DA PESQUISA ... 94
Anexo 1 (ANAIS) EA31 SIBEE – 2011... 94
Anexo 2 (ANAIS) MP17 - SIBEE – 2011... 95
Anexo 3 (ANAIS) 3 SIMPÓSIO PPGQ IQ/UFRN 2011... 96
Anexo 4 FUEL PROCESSING TECNOLOGY v. 96, P.80-87, 2012……… 97
Anexo 5 (ANAIS) 4 SIMPÓSIO PPGQ IQ/UFRN 2012... 98
Anexo 6 (ANAIS) 64th Anuual Meeting 2013………....……… 99
Anexo 7 1 Semana de Eletoquímica Ambiental 2013……… 100
Anexo 8 (ANAIS) 5 SIMPÓSIO PPGQ IQ/UFRN 2013... 101
Anexo 9 (ANAIS) XX1 Congresso da Sociedade Iberoamericana de Eletroquímica……… 102
Anexo 10 (ANAIS) 65th Anuual Meeting 2014a……… 104
Anexo 11 (ANAIS) 65th Anuual Meeting 2014b……… 105
16
Anexo 13
Journal of Electroanalytical Chemistry v. 717-718, p. 213-218, 2014... 107
Anexo 14
17
CAPÍTULO 1
1. INTRODUÇÃO
Os graves problemas ambientais gerados pelo aumento considerável dos descartes de efluentes industriais nos rios, lagos e mares, remetem a busca de alternativas de pesquisas que vise à obtenção de métodos eficientes no tratamento desses efluentes.
A ação química dos metais pesados tem despertado grande interesse ambiental. Isso se deve, em parte, ao fato de não possuírem caráter de biodegradação, o que determina que permaneçam em ciclos biogeoquímicos globais nos quais as águas naturais são seus principais meios de condução, podendo-se acumular na biota aquática em níveis elevados. Uma vez no ecossistema aquático, os metais pesados são distribuídos nos diversos compartimentos do ambiente, como solo, sedimento, plantas e animais.
A pesquisa e o desenvolvimento de novas tecnologias de tratamento, monitoramento e avaliação de efluentes que sejam ambientalmente orientadas são cada vez mais estimulados e a Tecnologia Eletroquímica é uma delas, por ser considerada uma alternativa atrativa para o tratamento e avaliação de efluentes da Indústria.
De acordo com a literatura, varias técnicas eletroquímicas tem sido desenvolvidas visando a remediação, detecção e monitoramento dos poluentes em diferentes ambientes (terrestres, aquáticos e atmosféricos). Entre essas tecnologias avançadas destacam-se a eletrocoagulação e técnicas eletroanaliticas para a remoção e detecção de metais pesados, respectivamente, em efluentes e solos. A eletrocoagulação (EC) é um dos métodos utilizados para remover metais pesados, especialmente chumbo e cádmio de efluentes industriais. Esta é uma tecnologia de tratamento de efluentes bastante promissora para remover metais pesados tendo como vantagens o uso de equipamento simples, de fácil operação, alta eficiência de remoção e de compatibilidade ambiental (COMINELLIS, 2010). A EC emprega eletrodos de sacrifício de alumínio e ferro para eletrogerar coagulantes que irão interagir com os metais pesados nas águas, facilitando sua remoção mediante a formação de lodos que irão se sedimentar e poderão ser eliminados dos efluentes. Vários estudos têm sido dedicados ao processo de eletrocoagulação com placas de alumínio e ferro como eletrodos de sacrifício.
18 águas industriais descartadas, antes e após o tratamento do efluente. Mais importante ainda, as técnicas eletroanalíticas diminuem os tempos da análise química e tempo necessário para a obtenção dos resultados.
Neste trabalho estudamos a viabilidade de associação de técnicas eletroquímicas de eliminação e monitoramento para a remoção de metais pesados de efluentes sintéticos. Desta forma, a voltametria de redissolução anódica foi empregada para qualificar e quantificar Pb2+ e Cd2+ durante o tratamento do efluente pelo processo de eletrocoagulação. A tese está dividida em capítulos, sendo o capítulo I uma introdução dos temas abordados, o capítulo II apresentamos os objetivos propostos para o trabalho, o capítulo III abordamos o referencial teórico para o tema, os capítulos IV, V e VI são artigos que foram ou serão submetidos a periódicos especializados e por fim, no capítulo VII apresentamos nossas conclusões e considerações finais.
No capítulo IV, é abordada uma revisão sobre o tema de eletrocoagulação visando expor seus fundamentos e principais aplicações para o tratamento de efluentes. Na parte final é enfatizada a associação das técnicas eletroanalíticas com a eletrocoagulação para determinar a concentração dos metais pesados eliminados. Este trabalho será enviado no formato de revisão ao jornal científico Environmenatl Science and Pollution Research.
No Capítulo V é descrito o estudo do comportamento de eletrocoagulação para remoção Pb+2 em solução utilizando eletrodos de alumínio. Os experimentos foram realizadas por aplicação de densidades de corrente de 0,787 mA cm-2 e 1,57 mA cm-2 durante 30 minutos. A técnica eletroanalítica de voltametria de redissolução anódica foi aplicada para medir a concentração de chumbo em solução durante o tratamento de eletrocagulação. Cabe destacar que estes resultados foram publicados no jornal científico Journal Electroanalytical Chemistry. Por outro lado, apresentamos um método eletroquímico combinado para a detecção e remediação de espécies Cd2+ e Pb2+ em mistura binária (Capitulo VI). O processo da eletrocoagulação para remover Cd2+ e Pb2+ foi estudado, utilizando-se uma célula de fluxo eletrolítico equipado com eletrodos de Al e Fe como ânodos de sacrifício, trabalhando em condições galvanostáticas aplicando correntes de 0.05; 0.1; 0.5 e 1,0 A. As concentrações de Cd2+ e Pb2+ foram monitoradas durante a EC por AdSV. Este trabalho foi enviado ao Journal Electroanalytical Chemistry.
.
19
CAPITULO 2
2.OBJETIVOS
2.1 OBJETIVO GERAL
Este trabalho teve como objetivo avaliar o desempenho do processo de eletrocoagulação utilizando eletrodos de alumínio num reator eletroquímico de fluxo contínuo na remoção de Cd2+ e Pb2+ sendo quantificados mediante voltametria de redissolução anódica.
2.2 OBJETIVOS ESPECÍFICOS
Desenvolver testes preliminares de voltametria de pulso diferencial e varredura linear para investigar a viabilidade de detecção e quantificação de Pb2+ e Cd2+ usando o eletrodo de carbono vítreo;
Obter a curva analítica usando padrões de concentração conhecida de cada metal estudado, visando definir a faixa de trabalho e limites de detecção das técnicas eletroanalíticas;
Identificar a influência da corrente aplicada na eliminação eletroquímica por eletrocoagulação dos metais pesados estudados (Cd2+ e Pb 2+);
Monitoramento da concentração de Cd2+ e Pb2+ durante a eliminação mediante o uso da técnica eletroanalítica de voltametria adsortiva de redissolução (AdSV);
Validar o método eletroanalítico mediante o tratamento estatístico dos dados e comparação das leituras obtidas com a técnica instrumental de absorção atômica;
Avaliar a eficiência de remoção de Cd2+ e Pb2+ mediante diferentes condições experimentais no processo de eletrocoagulação;
20
CAPITULO 3
3. REFERENCIAL TEÓRICO
3.1 IMPACTO AMBIENTAL DOS METAIS PESADOS
Efluentes industriais são lançados ao meio ambiente, e o caráter de não biodegradação de alguns poluentes, como os metais pesados podem causar sérios riscos de contaminação. Segundo Fenglian e Wang (2011), metais pesados não são biodegradáveis, são tóxicos e carcinogênicos, sendo o zinco, cobre, níquel, mercúrio, cádmio, chumbo e cromo os principais metais tóxicos presentes em efluentes.
Para alguns organismos vivos, a contaminação por metais depende da biodisponíbilidade e a necessidade destes organismos, cromo, cobre e zinco são considerados micronutrientes essenciais de organismos vivos, já o chumbo não apresenta essencialidade e ainda em pequenas concentrações pode ser danoso aos organismos (KUMPIENE, et al. 2008) Metais pesados como cádmio e chumbo não são essenciais aos organismos vivos e podem se tornarem muito perigosos devido a sua acumulação no meio.
Metais tóxicos podem causar alterações fisiológicas aos seres vivos através do bloqueio das atividades biológicas, inativando enzimas importantes com a formação de quelatos entre o metal e alguns grupos funcionais das proteínas (VULLO, 2003).
Nos países desenvolvidos, a rápida industrialização prognostica um problema de contaminação por exposição aos metais devido à persistência destes ao meio. Este é o caso do chumbo porque ainda é um problema de exposição ocupacional ou ambiental em países em desenvolvimento (TONG, et al 2000). E as indústrias que mais geram sérios riscos de contaminação de metais ao meio ambiente são as indústrias de mineração, galvanoplastia, têxtil, metalurgia e processamento de metais.
21 et al. (2005), o acúmulo de Cd nos tecidos de espécies vegetais é um fator de risco a cadeia alimentar, uma vez que este pode ser transferido para seres humanos e animais.
Os metais pesados têm influência significativa nas atividades vitais de vários organismos vivos no ecossistema comprometendo suas atividades biológicas e consequentemente poderá alterar a cadeia alimentar. Os níveis de toxicidades dos metais pesados podem variar, dependendo do tipo de metal, das espécies de organismos e o tempo de exposição GÜNDOĞDU e ERDEM, 2008).
Águas subterrâeas contaminadas com metais pesados por fonte antropogênica ou de fontes naturais do solo, pode gerar um problema de saúde pública (HASHIM, et al 2011), já que os metais pesados que se difundem pelas camadas de solo e lençóis freáticos podem interagir com diferentes organismos ou pessoas provocando doenças ou alterações relevantes no metabolismo ou sistemas biológicos.
Alguns casos deste tipo de contaminação podem ser citados, por exemplo, a baía de Sepetiba, na Ilha da Madeira (RJ), apresentou os níveis de Cd, Pb, Zn e Cu acima dos níveis naturais. Um reservatório de resíduos localizado na Ilha foi considerado a principal fonte poluidora (FONSECA, et al 2013). Em outro caso, a água do córrego e do açude da microbacia de Caetés em Paty do Alferes (RJ) apresentou teor total de Cd, Mn e Pb acima dos padrões máximos estabelecidos em água potável pelo Ministério da Saúde. (RAMALHO, et al 2000). Ecossistemas aquáticos em vários países, apresentam poluição de metais pesados, trazendo problemas graves sobre o equilíbrio ecológico dos organismos aquáticos.
Guedes et al. (2005) em estudos no trecho urbano do rio Jundiaí em Macaíba (RN), revelaram um impacto ambiental por metais, com elevadas concentrações de Cd, Pb, Cr, V e Zn, de caráter antropogênico, associadas aos esgotos, despejos industriais e lixo, descartados sem tratamento no leito de drenagem, ao corte indiscriminado do manguezal e queimadas nas margens. Santana e Barroncas, (2007) avaliaram a liberação do chorume no sistema hídrico da bacia do Tarumã-Açu Manaus (AM), em amostras de água e sedimento, detectaram altos teores dos metais pesados Zn, Co, Ni, Cu, Fe, e Pb, mostrando que o Aterro Sanitário é um dos principais responsáveis pelo impacto ambiental.
22 CONAMA 357/05, contaminando as águas subterrâneas. Os resíduos dispostos no aterro industrial apresentaram concentrações consideráveis de manganês e chumbo, que estão sendo liberados continuamente para o meio ambiente, alertando para o risco de bioacumulação destes metais na cadeia trófica expondo a população ribeirinha ao consumo de pescados contaminados (NASCIMENTO et al. 2006).
Segundo Miranda et al. (2011) a Lagoa do Araçá em Recife (PE) é um ecossistema de manguezal e faz parte de uma Área de Preservação Ambiental (APA), entretanto, várias ligações despejam os efluentes domésticos e industriais sendo contaminados pelos metais pesados de ferro, zinco, cromo e manganês os sedimentos da lagoa; levando a degradação dos recursos vivos desse ambiente, pois é utilizada para pesca de subsistência pelos moradores do entorno.
Estudos na Rosetta Filial do Rio Nilo, apresentaram contaminação por metais pesados na água, sedimentos e peixes, em concentrações superiores ao recomendado, colocando em risco a saúde humana e dos ecossistemas (YEHIA e SEBAEE 2012). A bioacumulação de metais pesados em peixes exposto à um sistema de água contaminada, revelou um padrão de acumulação da ordem: Cd > Pb > Ni > Cr e Pb > Cd > Ni > Cr; nas brânquias e fígado, tecidos renais e carne (VINODHINI e NARAYANAN, 2008). Também, os metais pesados, como cádmio, zinco, cobre, cromo, chumbo e mercúrio foram encontrados em vários tecidos de duas espécies de peixe (Labeo rohita e Channa striatus) e nas amostras de água coletadas no lago Kolleru - Andhra Pradesh na Índia (MASTAN, 2014). Este tipo de contaminação dos peixes por metais pesados, pode causar efeitos adversos em seres humanos, pois estes são uma das importantes vias de exposição ao metal pesado, uma vez que é uma fonte valiosa de proteína (NSIKAK et al. 2007). Assim, a toxicidade, bioacumulação e não biodegradação dos metais pesados representam uma ameaça aos ecossitemas naturais e a saúde pública.
23 Estudo para avaliar a presença de chumbo, cádmio, zinco e arsênio no solo em uma área de Mineração por um longo período, no estado de Chihuahua no México, apresentou concentrações acima dos limites recomendados por organizações internacionais, mostrando que as atividades de mineração podem também causar alterações ambientais, gerando solos pobres para a produtividade agrícola e riscos à saúde humana (PUGA, et al. 2006).
O aumento das atividades industriais pode ser responsável pelo agravamento do impacto ambiental, uma vez que, os efluentes gerados podem ser potencialmente poluidores de maneira que podem chegar a comprometer os ecossistemas, provocando danos a qualidade da água, solo e plantas. Descarte de efluentes industriais não tratados, em rios urbanos compromete não só a qualidade da água como também toda a biota (BAI, et al. 2012).
Poluição por metais pesados tem se tornado um dos mais graves problemas ambientais da atualidade. O tratamento de metais pesados é de interesse especial devido ao seu recalcitrante e persistência no meio ambiente. Nos últimos anos, vários métodos para a remoção de metais pesados a partir de águas residuais têm sido extensivamente estudados (FENGLIAN e WANG, 2011), já que os orgãos de controle ambiental estabelem normas de descarte dos efluentes, de modo a minimizar os sérios problemas dos poluentes.
Os efluentes com a presença de metais pesados devem ser tratados, os principais métodos usados para o tratamento destes efluentes são: precipitação química, troca iônica, adsorção, filtração por membranas, coagulação e floculação, flotação e tecnologias eletroquímicas.
3.1.1 Cádmio
O cádmio (do latim, cadmia, e do grego kadmeia, que significa "calamina", o nome que recebia antigamente o carbonato de zinco), apresenta número atômico 48, massa igual 112,4 e número de oxidação +2, podendo apresentar oxidação +1 que é muito instável. É um metal branco azulado, pouco abundante na natureza. É um metal tóxico, teratogênico e carcinogênico, não apresenta biomagnificação mas é cumulativo, podendo atingir níveis de toxicidade crônica. Assim, a Legislação Brasileira, através da Resolução CONAMA nº 357 de 17/03/2005, estabelece como limite máximo para a emissão de cádmio em efluentes o valor de 0,2 mg/L.
24 O cádmio é um elemento natural presente na crosta terrestre, em concentrações que variam de 0,1 a 0,5 mg/kg. Mineração dos metais não ferrosos, refino de metal, fabricação e aplicação de fertilizantes fosfatados, queima de combustíveis fósseis, e incineração de resíduos e disposição são as principais fontes antropogênicas de cádmio no ambiente (ATSDR, 2012). O cádmio é o sétimo na lista ATSDR de elementos que apresentem o potencial ameaça mais significativa para a saúde humana no meio ambiente, e ocupa a terceira posição na subdivisão de metais pesados da mesma lista, atrás de chumbo e mercúrio (ATSDR, 2011).
A poluição indústrial ou insumos agrícolas, especialmente fertilizantes fosfatados, contaminados com cádmio pode acumular-se em solos contaminando as culturas agrícolas devido a sua absorção pelas raízes (LAPORTE, et al. 2015). Os produtos agrícolas são uma fonte importante para a contaminação humana por cádmio. Segundo Simmons et al. (2005), o consumo de arroz contaminado por cádmio, resultou em graves problemas de saúde como a osteomalácea e disfunções renais. Outro exemplo são as crianças que vivem no sudoeste da Espanha, região costeira dominada por intensas atividades industriais de mineração, apresentaram atraso cognitivo em estudo do desenvolvimento neuropsicológico associado a exposição ao cádmio (RODRÍGUEZ-BARRANCO et al. 2014).
3.1.2 Chumbo
O chumbo (do latim plumbum) apresenta número atômico 82 massa atómica igual a 207,2 u e número de oxidação +2. É usado na fabricação de acumuladores, na construção civil, em pigmentos, munições, em ligas metálicas para a produção de soldas suaves, fusíveis, revestimentos de cabos elétricos e compostos organoplúmbicos são aplicados como catalisadores na fabricação de espumas de poliuretano. É um metal tóxico.
O Pb é um elemento metálico sólido, cinza azulado, biologicamente não essencial, extremamente estável no solo, sendo sua meia vida nesse meio estimada em até 5900 anos, e reconhecido a séculos como potencialmente tóxico para o ambiente. Dentre uma lista de 275 substâncias tóxicas consideradas prioritárias para controle nos EUA, o Pb ocupa lugar de destaque, sendo o segundo entre os metais pesados, que representam maior risco à população, principalmente crianças (ATSDR, 2011).
25 do chumbo por exposição ambiental e ocupacional. A contaminação por chumbo é diretamente proporcioanl ao nível e tempo de exposição (MOREIRA e MOREIRA, 2004).
A Legislação Brasileira, através da Resolução CONAMA nº 357 de 17/03/2005, estabelece como limite máximo para a emissão de chumbo em efluentes o valor de 0,5 mg/L.
3.2 TRATAMENTO DE EFLUENTES INDUSTRIAIS CONTAMINADOS COM METAIS PESADOS
O processo produtivo das indústrias têxtil, do petróleo, da mineração e da galvanoplastia, em suas diferentes etapas, tem potencial para provocar grande impacto sobre o ambiente, pois produzem grandes quantidades de efluentes de difícil tratamento. O efluente deve ser tratado, de forma a adquirir um perfil de descarte estabelecido por órgãos ambientais que dispõe sobre padrões e condições para lançamento de efluentes líquidos gerados por fontes poluidoras. As águas residuais da indústria apresentam composição bastante variada, devido aos seus diferentes processos, seus principais poluentes são os produtos químicos orgânicos e inorgânicos; e os metais pesados. A escolha da técnica para o tratamento dos efluentes industriais devem levar em consideração às caracterísiticas deste efluente, como a natureza dos contaminantes, em este caso os metais pesados, sendo diferentes os métodos usados para seu tratamento, como por exemplo: precipitação química, troca iônica, adsorção, filtração por membranas, coagulação e floculação, flotação e técnicas eletroquímicas como a eletrocoagulação, como já mencionado anteriormente.
A precipitação química é realizada em geral, pela adição de uma base ao efluente para que haja formação de um produto insolúvel sob a forma de hidróxidos e óxidos (JIMENEZ et al. 2004). Os produtos químicos reagem com íons de metais pesados para formar precipitados insolúveis (FENGLIAN e WANG, 2011). É uma técnica que apresenta a desvantagem de necessitar de tratamentos subsequentes, como a sedimentação e filtração, tornando inviável para uma escala industrial pelos altos custos e baixa eficiência para baixas concentrações de metais pesados.
26 A adsorção promove a retenção seletiva e reversível de cátions metálicos, esta retenção seletiva pode ocorrer em materiais naturais ou não naturais, dentre os materiais naturais passíveis de utilização, estão as zeólitas, entre os matérias não naturais destaca-se o carbono ativado. A adsorção é reversível, os adsorventes podem ser regenerados por dessorção adequada, no entanto, é um processo caro.
Entretanto, a filtração pode ser uma alternativa adicional a adsorção, com alta eficiência na remoção de metais pesados. Os processos para remover metais de águas residuais através da filtração por membrana são: ultrafiltração, osmose inversa, nanofiltração e electrodiálise (FENGLIAN e WANG, 2011). Para teores muito baixos de metais pesados, a osmose reversa poderá ser o processo usado. Contudo, em condições aeróbicas os óxidos de metálicos podem levar ao entupimento das membranas. A osmose inversa também não será o processo mais eficiente, caso o teor de sais na água não necessitar de ser reduzido.
Segundo Chang e Wang, (2007) a coagulação é a desestabilização de colóides, neutralizando as forças que os mantêm separados. A floculação é a ação de polímeros para formar pontes entre os flocos e ligar as partículas em grandes aglomerados. Efluentes contendo metais pesados não são totalmente tratados apenas por coagulação-floculação, necessitando portanto, de outras técnicas para a eficiência do tratamento. A flotação é um processo onde a suspensão das espécies metálicas nas águas residuais, através da utilização de agentes tensioactivos e a subsequente remoção destas espécies hidrofóbicas por bolhas de ar (POLAT E ERDOGAN, 2007). Yuan e colaboradores (2008) indicaram que as técnicas de flotação mais usadas são: flotação por ar dissolvido (DAF), flotação iônica e precipitação-flotação (FENGLIAN e WANG, 2011).
Cada método mencionado anteriormente apresenta vantagens e desvantagens, sendo que as principais desvantagens estão em elevados custos e baixa eficiência. Entretanto, nas últimas duas décadas, as técnicas eletroquímicas vêm se destacando pela versátilidade para o tratamento de diversos tipos de efluentes, por serem ambientalmente orientadas, seguras, rápidas e de baixos custos. Dentro dessas tecnologias, a eletrocoagulação recebeu um destaque significativo quando usada para o tratamento de águas contaminadas por metais pesados.
27 sólido os metais pesados) enquanto que o gás hidrogênio é liberado no cátodo. Além disso, os hidróxidos metálicos podem reagir também com os contaminantes presentes no meio aquoso, eliminando-os.
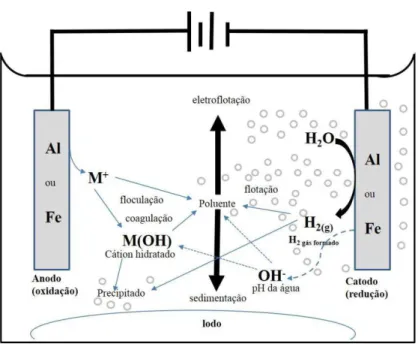
Fe/Al é dissolvido do ânodo gerando hidróxidos metálicos correspondentes do metal, que podem continar sendo hidrolisados a hidróxido polimérico de ferro ou de alumínio. Estes hidróxidos poliméricos são agentes coagulantes excelentes. A coagulação ocorre quando estes cátions do metal se combinam com as partículas negativas carregadas para o ânodo pelo movimento eletroférico. Os contaminantes presentes na corrente de água residuária são tratados tanto por reações químicas e precipitação ou ligação física e química aos materiais coloidais que estão sendo gerados pela descaste do eletrodo. Eles são removidos por eletroflotação, ou sedimentação e filtração. Assim, ao invés da adição de produtos químicos coagulantes como no processo convencional de coagulação, estes agentes coagulantes são gerados in situ, como indicado na Figura 3.1. Mais detalhes serão abordados sobre as condições experimentais e aplicações no capitulo 4.
Figura 3.1 - Processo de eletrocoagulação
Fonte: Adaptado de Holt, 2002.
28 aplicada que determina a quantidade de íons Fe2+ ou Al 3+ liberados dos respectivos eletrodos usados no processo de eletrocoagulação (Chen, 2004; MOLLAH, et al. 2004). Alguns exemplos da aplicação são citados em seguida:
Zodi, et al. (2011) testaram a eficácia do processo como um tratamento terciário para o efluente industrial de uma fábrica de papel, os resultados mostraram que o tratamento de eletrocoagulação foi muito eficaz melhorarando a qualidade dos efluentes. A eletrocoagulação também foi aplicada para o tratamento de efluentes da indústria têxteis, para estudar a redução da demanda química de oxigênio (DQO, a turbidez, a eficiência de remoção de lodos totais e a velocidade de decantação das lamas, utilizando elétrodos de alumínio (ZODI, et al. 2010). Por outro lado, Al-Shannag, et al. (2014) demostraram que a EC para o tratamento de efluente da galvanoplastia, contendo íons de Cu2+, Cr3+, Ni2+ e Zn2+, reduziu eficientemente a concentração dos íons desses metais pesados. Hamdan e El-naas (2014), avaliaram a eletrocoagulação para a remoção do Cr (VI) a partir de água subterrânea salobra, os resultados mostraram que o proccesso da EC é uma técnica confiável para a purificação das águas subterrâneas com um baixo consumo de energia. Heidmann e Calmano (2008b) investigaram também a remoção do Cr por eletrocoagulação com eletrodos de ferro e relataram que o processo de remoção é muito eficiente e aplicável para a remoção do Cr (VI) em efluentes industriais.
Estudos do mecanismo de remoção dos íons dos metais Zn2+, Cu2+, Ni2+, Ag+, Cr6+ no processo de eletrocoagulação com eletrodos de alumínio mostrou que os íons de Zn, Cu, Ni e Ag são hidrolisados e co-precipitados como hidróxidos, já o Cr (VI) é reduzido primeiro a Cr (III) no cátodo antes da precipitação como hidróxido. (HEIDMANN e. CALMANO, 2008).
29 O desempenho de electrocoagulação, com ânodo de alumínio, para o tratamento de íons metálicos (Cu2+, Zn2+ e Cr6+) em águas residuais da galvanoplastia foi investigado, obtendo uma redução efetiva de Cu2+, Zn2+ e Cr (VI), após 20 minutos (ADHOUM, et al. 2004).
Zewail e Yousef (2014) estudaram a eletrocoagulação com ânodo de ferro para a remoção de ions Cr3+ e Cr6+ e obtiveram 80,0% e 98,2% respectivamente quando a concentração inicial era de 100 ppm. Verma et al. (2013) usaram eletrodos de ferro para remover o cromo em efluente da industria de galvanoplastia, a partir de uma solução sintética contendo cromo hexavalente, a eficiência de remoção foi de 100,0% para um tempo de eletrólise de 15 minutos e para o efluente real a remoção foi de 100,0% em 45 minutos.
O desempenho da eletrocoagulação (CE) com eletrodos de ferro com configuração monopolar foi estudado para a remoção simultânea de cobre (Cu), níquel (Ni), zinco (Zn) e manganês (Mn), a partir de uma água residual, obtendo 96,0% de remoção foi atingido para todos os metais estudados, com exceção de Mn que foi de 72,6% (AL AJI, et al. 2012). No entanto, a remoção de cobre (Cu), cromo (Cr) e níquel (Ni) de águas residuais da galvanoplastia por eletrocoagulação com eletrodos de ferro e alumínio com configurações monopolares, mostraram que electrocoagulação com um par de eletrodos de Fe-Al foi muito eficiente e é capaz de atingir 100% de remoção de Cu, Cr e Ni a um tempo de eletrocoagulação de 20 minutos a uma densidade de corrente de 10 mA/cm 2 (AKBALe CAMCI, 2011). A tecnologia de eletrocoagulação também foi empregada para avaliar o tratamento de soluções sintéticas contendo mercúrio (II), a eliminação dos íons de mercúrio (II) é melhor realizada com ferro, mais de 99% do poluente foi eliminado (NANSEU-NJIKIA et al. 2009).
3.2.1 Voltametria de redissolução anódica
30 No caso das técnicas eletroanaliticas, novas técnicas voltametricas destinadas à análise de traços foram desenvolvidas, um exemplo é, a voltametria de redissolução. Apesar da sensibilidade e confiabilidade da técnica de espectrometria de absorção atômica e outras para análise de traços, fatores, tais como alto custo de instrumentação, extensiva preparação das amostras e seletividade limitada, reduzem a eficácia destas técnicas principalmente quando aplicadas à análise de multi-componentes em matrizes de amostras complexas.
De modo geral, a sensibilidade de toda técnica analítica pode ser aumentada introduzindo uma etapa preliminar de pré-concentração no preparo de amostra. Na voltametria de redissolução, uma pré-concentração eletroquímica é usada, anterior a varredura de potencial. A etapa de pré-concentração ou de deposição consiste na eletrodeposição, a potencial constante, da espécie de interesse em um eletrodo estacionário ou rotatório, sob agitação da solução, durante um tempo pré-determinado (Skoog et al, 2002).
Após a eletrodeposição, a solução é deixada em repouso por alguns segundos (tempo de repouso ou de equilíbrio), antes da varredura do potencial. Isto consiste numa redissolução eletrolítica, voltando a espécie depositada à solução de onde havia sido retirada.
Os eletrodos mais populares são gotejante de mercúrio, filme de mercúrio, pasta do carbono e carbono vítreo. A faixa de potencial em que esses eletrodos podem ser usados em solução aquosa depende tanto do material do eletrodo como da composição do eletrólito suporte (Skoog et al, 2002). Os eletrodos do mercúrio oferecem a vantagem na análise de determinados íons metálicos, devido a formação de uma amalgama pela dissolução do metal reduzido no mercúrio.
31
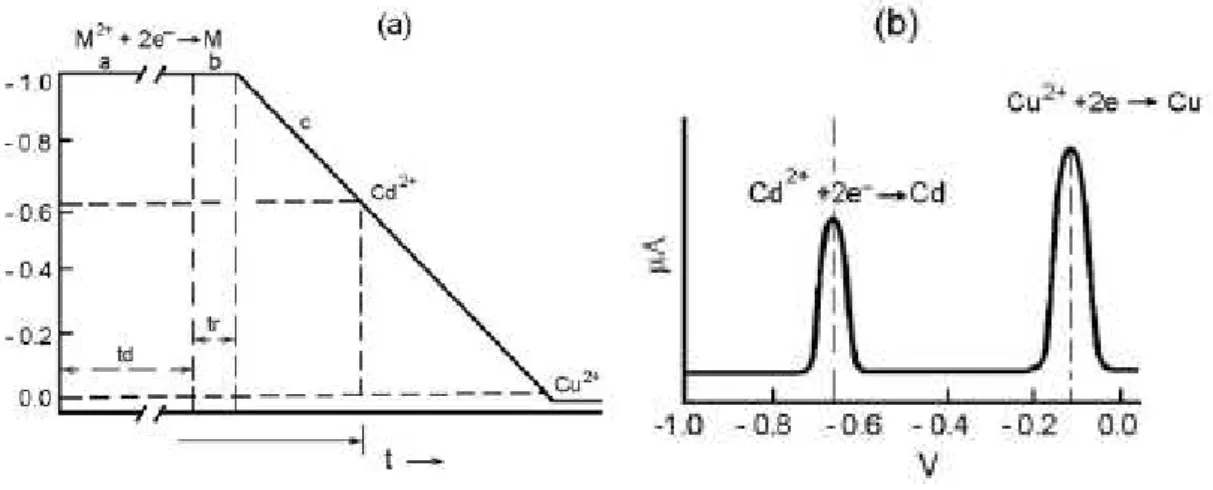
Figura 3.2 - Voltametria de redissoluçao anodica, indicando o processo de eletrodeposição com potencial
constante, seguido de uma varredura linear para redissoluçao dos metais depositados previamente.
Fonte: Skoog et al, 2002
A Figura 3.2a ilustra a forma do sinal de excitação de potencial usualmente aplicado no método de redissolução anódica de varredura linear para a determinação de cádmio e cobre em soluções aquosas. Inicialmente é aplicado, no microeletrodo, um potencial catódico de –1,0 V por um tempo definido e sob agitação. Após um tempo de repouso ou equilíbrio, sem agitação, o potencial do eletrodo é alterado linearmente para valores menos negativos e a corrente é registrada em função do potencial. A Figura 3.2 b mostra o voltamograma resultante (Skoog et al, 2002).
A sensibilidade da voltametria de redissolução depende da combinação da pré-concentração obtida na etapa de deposição e da técnica voltamétrica empregada na etapa de redissolução. Entre as técnicas voltamétricas, a de pulso diferencial permite registrar maiores intensidades de corrente para uma mesma concentração de analito frente à de corrente contínua ou pulso normal. De modo geral, a sensibilidade é elevada e é limitada freqüentemente pela pureza dos reagentes, técnicas de amostragem e abertura da amostra. Os limites típicos da detecção para as técnicas de redissolução situam-se na faixa de 10-12 - 10-10 mol L-1. O processo de deposição e a quantidade da espécie acumulada na superfície do eletrodo depende do material do eletrodo, solvente, pH, potencial, tempo, força iônica, transporte de massa e temperatura.
32 redissolução anódica é muito utilizada na determinação de metais pesados, uma vez que vários deles podem ser depositados no eletrodo de trabalho através de eletrólise de soluções de seus íons, o tempo de deposição depende da espécie eletroativa, sendo geralmente entre 30 s e 3 min. Porém, a escolha do eletrodo usado em conjunto com a técnica de redissoluçao, pode incrementar a seletividade e sensibilidade da detecção. Diante disso, o eletrodo de mercúrio sempre foi preferencialmente usado, no entanto, esse metal líquido é bastante toxico, sendo evitado seu uso. Assim, o uso e desenvolvimento de novos materiais como eletrodos visando substituir o mercúrio têm sido favorecidos. As medidas voltamétricas para detecção de metais pesados podem ser feitas através da voltametria usando o eletrodo de carbono vítreo, no entanto, a literatura reporta muitas análises feitas com modificações do eletrodo. A sensibilidade de detecção para baixas concentrações é importante, uma vez que, alta sensibilidade significa baixas concentrações detectadas.
Monteiro e colaboradores (2014) determinaram chumbo em água potável, com eletrodo de pasta de carbono modificado com filme de bismuto, por voltametria de redissolução anódica e relataram que, quando comparada com outras técnicas, a voltametria de redissolução é a mais sensível para a quantificação de íons metálicos. Oliveira e colaboradores (2002) determinaram íons de zinco em amostra de álcool combustível, por voltametria de redissolução anódica com eletrodo modificado com filme de mercúrio, obtendo alta sensibilidade e reprodutibilidade nas medidas. Bergamini et al. (2006) determinaram chumbo em amostra de álcool combustível por voltametria de redissolução anódica utilizando um eletrodo de pasta de carbono modificado com resina de troca iônica Amberlite IR 120. Entretanto, íons de cobre em águas residuais foram determinados usando a mesma técnica usando o eletrodo de pasta de carbono modificado com quitosana. Tonietto e Grassi (2012) empregaram a voltametria de redissolução anódica com pulso diferencial para análise de especiação de cobre e zinco em amostra de água.
Fungaro, (2004), determinou Cádmio e chumbo em amostra de água com eletrodo de carbono vítreo modificado com filme de mercúrio e polianilina sulfonada, por voltametria de redissolução anódica. McGaw e Swain (2006) avaliaram a detecção dos íons de Zn2+, Cd2+, Pb2+, Cu2+ e Ag+ comparando o eletrodo BDD com o carbono vítreo modificado com filme de mercúrio (Hg-GC) e observaram que a sensibilidade do Hg-GC foi entre três a cinco vezes maior do que o BDD.
33 eletrodo de carbono vítreo modificado com ácido benzóico para determinar Cd2+ e Pb2+ em amostras de efluente residuais.
REFERÊNCIAS
ABDEL-GHANI, N.T.; ELCHAGHABY, G.A. Influence of operating conditions on the removal of Cu, Zn, Cd and Pb ions from wastewater by adsorption International Journal of
Environmental Science & Technology v. 4, p. 451–456, 2007. Disponível em: http://link.springer.com/article/10.1007%2FBF03325980> Acesso em: 10 fev. 2013.
ADHOUM, N.; MONSER, L.; BELLAKHAL, N.; BELGAIED, J-E.; Treatment of
electroplating wastewater containing Cu2+, Zn2+ and Cr(VI) by electrocoagulation. Journal of
Hazardous Materials v. 112, n. 3, p. 207–213, 30 August 2004. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0304389404002092# Acesso em: 10 fev. 2013.
AL AJI, B.; YAVUZ, Y.; KOPARAL, A. S. Electrocoagulation of heavy metals containing model wastewater using monopolar iron electrodes. Separation and Purification
Technology. v. 86, n. 15, p. 248–254, February 2012. Disponível em:
http://www.sciencedirect.com/science/article/pii/S1383586611006551# Acesso em: 15 fev 2013.
AL-SHANNAG, M.; AL-QODAH, Z.; BANI-MELHEM, K.; QTAISHAT, M. R.; ALKASRAWI, M. Heavy metal ions removal from metal plating wastewater using
electrocoagulation: kinetic study and process performance. Chemical Engineering Journal, Available online 21 September 2014. Disponível em:
http://www.sciencedirect.com/science/article/pii/S1385894714012212. Acesso em 25 de set. de 201
ALYÜZ, B. e VELI, S. Kinetics and equilibrium studies for the removal of nickel and zinc from aqueous solutions by ion exchange resins. Journal of Hazardous Materials v. 167, n. 1–3, p. 482–488, 15 August 2009. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0304389409000296 Acesso em: 10 de fev. De 2013.
AKBAL, F. e CAMCI, S. Copper, chromium and nickel removal from metal plating
wastewater by electrocoagulation. Desalination. v. 269, n. 1–3, p. 214–222, 15 March 2011. Disponível em: http://www.sciencedirect.com/science/article/pii/S0011916410008064 Acesso em: 15 de fev. De 2013.
ATSDR, 2011 Agency for Toxic Substances and Disease Registry, U.S The Priority List of
Hazardous Substances, 2011 Department of Health and Human Services, Public Health
34 ATSDR, 2012 Agency for Toxic Substances and Disease Registry, U.S. Toxicological
Profile for Cadmium Department of Health and Human Services, Public Health Services,
Atlanta, GA (2012) http://www.atsdr.cdc.gov Acesso em 18.de nov.2013.
BAI, J.; XIAO, R.; ZHANG, K.; GAO, H. Arsenic and heavy metal pollution in wetland soils from tidal freshwater and salt marshes before and after the flow-sediment regulation regime in the Yellow River Delta, China Journal of Hydrology, v. 450–451, p. 244–253, 2012.
http://www.sciencedirect.com/science/article/pii/S0022169412003629 Acesso em: 13 de jan. 2013.
BERGAMINI, M. F.; VITAL, S. I.; SANTOS, A. L.; STRADIOTTO, N. R. Determinação de chumbo em álcool combustível porvoltametria de redissolução anódica utilizando um eletrodo de pasta de carbono modificado com resina de troca iônica Amberlite IR 120. Eclética
Química. V. 31, n. 2, p. 45-52, 2006. Disponível em: www.scielo.br/eq. Acesso em: 20 de
janeiro de 2013.
CHANG, Q. e G. WANG. Study on the macromolecular coagulant PEX which traps heavy metals. Chem. Eng. Sci., v. 62, p. 4636–4643, 2007. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0009250907003971 Acesso em: 05 de março 2013.
CHEN, G. Electrochemical Technologies in Wastewater Treatment. Separation and
Purification Technology, v. 157, n.1, p. 11-41, julho. Hong Kong, China, Elsevier. 2004.
Disponível em: ˂ http://www.sciencedirect.com/science/article/pii/S1383586603002636> Acesso em: 05 de mar. 2012.
COMNINELLIS, C. e GUOHUA CHEN, Electrochemistry for the Enviroment. Editor: Springer, New York, 2010.
CONAMA - Conselho Nacional do Meio Ambiente; Resolução No 357. 2005. Publicado no D.O.U. de 18/03/2005.
DERMENTZIS, K.; CHRISTOFORIDIS, A. VALSAMIDOU, E. Removal of nickel, copper, zinc and chromium from synthetic and industrial wastewater by electrocoagulation.
International Journal of Environmental Sciences. v. 1, n. 5, p. 697-910, 2011. Disponível
em: www.ipublishing.co.in/.../EIJES2026.pdf Acesso em: 08 jan. 2012.
FAN, L.; CHEN, J.; ZHU, S.; WANG, M.; XU, G. Determination of Cd2+ and Pb2+ on glassy carbon electrode modified by electrochemical reduction of aromatic diazonium salts.
Electrochemistry Communications v. 11, n. 9, p. 1823–1825, September 2009. Disponível em: h ttp://www.sciencedirect.com/science/article/pii/S1388248109003555Acesso em: 08 de jan. 2012.
FENGLIAN, F. e WANG, Q. Removal of heavy metal ions from wastewaters: A review.
Journal of Environmental Management. v. 92, n. 3, p. 407-418, March 2011. Disponível
em: ˂http://www.sciencedirect.com/science/article/pii/S0301479710004147 > acesso em: Acesso em: 08 de jan. 2012.
35 Sepetiba Bay, SE, Brazil. Environmental Earth Sciences. V. 70, n. 2, p. 643-650, 2013. Disponível em: ˂http://link.springer.com/article/10.1007/s12665-012-2148-3> Acesso em: 08 de dez. de 2013.
FUNGARO, D. A. Determinação voltamétrica de Cd e Pb usando eletrodo modificado com polianilina sulfonada. Eclética Química. v. 29, n. 1, p. 63-69, 2004. Disponível em:
www.scielo.br/scielo.php?script=sci_arttext&pid=S0100. Acesso em: 08 de dez. de 2013. GUEDES, J. A.; SOUZA, R. F.; LIMA; SOUZA, L. C. Metais pesados em água do rio Jundiaí - Macaíba/RN. Revista de Geologia, v. 18, n. 2, p. 131-142, 2005.Disponível em: http://www.scielo.br/scielo.php?pid=S010040422007000700033 Acesso em: 11 de maio de 2012.
GÜNDOĞDU, A.; ERDEM, M. The accumulation of the heavy metals (copper and zinc) in
the tissues of rainbow trout (onchorhyncus mykiss, walbaum, 1792). Journal of Fisheries
Sciences.com. v. 2, n. 1, p. 41-50, 2008. Disponível em:
www.fisheriessciences.com/tur/.../jfscom2008004.pd... Acesso em: 08 de dez. de 2013. HAMDAN, S. S. e EL-NAAS, M. H. Characterization of the removal of Chromium(VI) from groundwater by electrocoagulation. Journal of Industrial and Engineering Chemistry v. 20, n. 5, p. 2775–2781, 25 September 2014. Dispon´vel em:
http://www.sciencedirect.com/science/article/pii/S1226086X13005613# Acesso em 25 de set. De 2014.
HANAY, Ö.; HASAR, H. Effect of anions on removing Cu2+, Mn2+ and Zn2+ in
electrocoagulation process using aluminum electrodes. Journal of Hazardous Materials v. 189, n. 1–2, p. 572–576, 15 May 2011. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0304389411002743 Acesso em: 08 de dez. de 2013.
HASHIM, M. A.; MUKHOPADHYAY, S.; NARAYAN SAHU, J.; SENGUPTA, B. Remediation technologies for heavy metal contaminated groundwater. Journal of
Environmental Management. v. 92, n. 10, p. 2355–2388, October 2011. Disponível em:
˂http://www.sciencedirect.com/science/article/pii/S0301479711002064#> Acesso em: 08 de dez. de 2013.
HEIDMANN, I. e CALMANO, W. Removal of Zn (II), Cu(II), Ni(II), Ag(I) and Cr(VI) present in aqueous solutions by aluminium electrocoagulation. Journal of Hazardous
Materials, v. 152, n. 3, p. 934-941, 15 April 2008. Disponível em:
http://www.scopus.com/record/display.url?eid=2-s2.0-40749133351&origin=reflist Acesso em: 08 de dez. de 2013.
HEIDMANN, I. e CALMANO, W. Removal of Cr(VI) from model wastewaters by
electrocoagulation with Fe electrodes Separation and Purification Technology v. 61, n. 1, p. 15–21, 6 June 2008b. Disponível em:
http://www.sciencedirect.com/science/article/pii/S1383586607004285 Acesso em: 08 de dez. de 2013.
HOLT, P.K.; BARTON, G.W. WARK, M.; MITCHELL, C. A. ColloidsandSurfaces A:
36 http://www.sciencedirect.com/science/article/pii/S0927775702002856 Acesso em 25 maio de 2013.
ISLAM, M. D. S.; AHMED, M. D. K.; RAKNUZZAMAN, M.; AL- MAMUN, M. D. H.; ISLAM, M. K. Heavy metal pollution in surface water and sediment: A preliminary assessment of an urban river in a developing country. Ecological Indicators v. 48, p. 282– 291, January 2015. Disponível em: http://www.sciencedirect.com/
science/article/pii/S1470160X14003719 Acesso em: 10 de set. de 2014.
JIMENEZ, R. S.; DAL BOSCO, S. M.; CARVALHO, W. A. Remoção de metais pesados de efluentes aquosos pela zeólita natural escolecita - influência da temperatura e do pH na adsorção em sistemas monoelementares. Químia Nova, v. 27, n..5, São
Paulo Sept./Oct. 2004. Disponível em: http://www.scielo.br/scielo.php?pid=S0100-40422004000500011&script=sci_arttext Acesso em: 08 jun. de 2013.
KUMPIENE, J.; LAGERKVIST, A.; , MAURICE, C. Stabilization of As, Cr, Cu, Pb and Zn in soil using amendments – A review. Waste Management v.28, n. 1, p. 215–225, 2008. Disponível em:http://www.sciencedirect.com/science/ article/pii/S0956053X07000165#> Acesso em: 08 de dez. de 2013.
LAPORTE, M. A.; STERCKEMAN, T.; DAUGUET, S.; DENAIX, L.; NGUYEN, C. Variability in cadmium and zinc shoot concentration in 14 cultivars of sunflower (Helianthus
annuus L.) as related to metal uptake and partitioning. Environmental and Experimental Botany v. 109, p. 45–53, January 2015. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0098847214002020# Acesso em: 10 agossto 2014.
MASTAN , S. A. Heavy metals concentration in various tissues of two freshwater fishes, Labeo rohita and Channa striatus. African Journal of Environmental Science and
Technology v.8 n. 2, p. 166-170, February 2014. Disponível em:
http://www.academicjournals.org/journal/AJEST/article-references/C83B13743105 #> Acesso em: 10 abr.2014.
MCGAW, E. A.; SWAIN, G. M. A comparison of boron-doped diamond thin-film and Hg-coated glassy carbon electrodes for anodic stripping voltammetric determination of heavy metal ions in aqueous media. Analytica Chimica Acta. v. 575, n. 2, 11, p. 180–189, August 2006. Disponível em: http://www.sciencedirect.com/science/article/pii/S0003267006011809# Acesso em: 08 de dez. de 2013.
MIRANDA, J. B.; SILVA, H. K. P.; SILVA, E. C. F.; DUARTE, M. M. M. B. Avaliação preliminar das concentrações de metais pesados nos sedimentos da lagoa do araçá, Recife, estado de Pernambuco. Arquivos de Ciências do Mar, Fortaleza, v. 44, n. 2, p. 12 – 20, 2011. Disponível em: http://www.repositorio.ufc.br/handle/riufc/8399 Acesso em: 06 de abr. 2013.
MOLLAH, M. Y. A.; SCHENNACH, R.; PARGA, J. R.; COCKE, D. L. Electrocoagulation (EC) — science and applications. Journal of Hazardous Materials v. 84, n. 1, 1 p. 29–41, June 2001. Disponível em:
37 MOLLAH, M. Y. A.; Morkovsky, P.; Gomes, J. A. G.; Kesmez, M.; PARGA, J.; COCKE, D. L. Fundamentals, present and future perspectives of electrocoagulation Journal of
Hazardous Materials. v. 114, n. 1-3, p. 199-210, 18 October 2004 Disponível em: ˂
http://www.sciencedirect.com/science/article/pii/S0304389404004170> Acesso em: 16 de out de 2013.
MONTEIRO, S. P.: LEANDRO A. R. R.; FONSECA, W. T.; TAKEUCHI, R. M.; SANTOS, A. L. Determinação de Chumbo em Águas de Abastecimento Utilizando Filmes de Bismuto Crescidos in situ Sobre Eletrodos de Pasta de Carbono. Orbital: The Electronic Journal of
Chemistry. v. 6, n. 1, January-March 2014. Disponível em:
http://www.orbital.ufms.br/index.php/Chemistry/article/view/568 Acesso em: 08 jun. de 2014.
MOREIRA, F. R.; E MOREIRA, J. C. Os efeitos do chumbo sobre o organismo humano e seu significado para a saúde. Revista Panamericana de Salud Pública / Pan American Journal of Public Health v.15, n. 2, p. 119-129, 2004. Disponível em:
http://www.scielosp.org/scielo.php?pid=S102049892004000200007&script=sci_arttext. Acesso em: 08 jan. 2013.
MORILLO, J.; USERO, J.; GRACIA, I. Heavy metal distribution in marine sediments from the southwest coast of Spain Chemosphere, v. 55, p. 431–442, 2004. Disponível
em:http://www.sciencedirect.com/science/article/pii/S0045653503010610#> Acesso em: 15 de jun. 2013.
NASEEM, R.; and TAHIR, S. S. Removal of Pb(II) from aqueous solution by using bentonite as an adsorbent. Water Research. v. 35, n. 16, p. 3982–3986, 2001
Disponível em:http://www.sciencedirect.com/science/article/pii/S0043135401001300 Acesso em: 15 de jun. 2013.
NANSEU-NJIKI, C. P; TCHAMANGO, S. R.; NGOM, P. C.; DARCHEN, A.; NGAMENI, E. Mercury(II) removal from water by electrocoagulation using aluminium and iron
electrodes. Journal of Hazardous Materials v.168,n. 2–3, p. 1430–1436, 15 September 2009. Disponível em http://www.sciencedirect.com/science/article/pii/S0304389409004270# Acesso em: 15 de jun. 2013.
NASCIMENTO, S. C.; HYPOLITO, R.; RIBEIRO, A. A. Disponibilidade de metais pesados em aterro de indústria siderúrgica. Engenharia Sanitária e ambiental. v. 11, n. 3, p. 196-202, - jul/set 2006. Disponível em:www.scielo.br/pdf/esa/v11n3/a02v11n3 Acesso em: 15 de jun. 2013.
NORDBERG, G. F.; NOGAWA, K.; NORDBERG, M. Handbook on the Toxicology of
Metals (Fourth Edition), Chapter 32 – Cadmium. V. II:, p. 667–716, Specific Metals 2015. Disponível em: http://www.sciencedirect.com/science/ article/pii/B9780444594532000329 Acesso em: 05 de set. de 2014.
38 OLIVEIRA, M. F.; SACZK, A. A.; OKUMURA, L. L.; STRADIOTTO, N. R. Determinação de zinco em álcool combustível opr voltametria de redissolução anódica. Eclética
Química. v.27 n. special, São Paulo 2002. Disponível em:
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-46702002000200013 Acesso em: 20 de jan. 2013.
OZTEKIN, Y.; VICIENE, A. R.; RYSKEVIC, N.; YAZICIGIL, Z.; ÜSTÜNDAĞ, Z.;
SOLAK, A. O.; RAMANAVICIUS, A. 1,10-Phenanthroline modified glassy carbon electrode for voltammetric determination of cadmium(II) ions. Sensors and Actuators B: Chemical v. 157, n. 1, p. 146–153, 20 September 2011. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0925400511002371# Acesso em: 15 de jan. 2013.
POCIECHA, M. e LESTAN, D. Using electrocoagulation for metal and chelant separation from washing solution after EDTA leaching of Pb, Zn and Cd contaminated soil. Journal of
Hazardous Materials v. 174, n.1–3, p. 670–678, 15 February 2010. Disponível em:
http://www.sciencedirect.com/science/article/pii/S0304389409015647 Acesso em: 20 de jan. 2013.
POLAT, H. e ERDOGAN, D. Heavy metal removal from waste waters by ion flotation
Journal of Hazardous Materials v. 148, n. 1-1, p. 267–273, , 5 September 2007. Disponível em: http://www.sciencedirect.com/science/article/pii/S0304389407002634 Acesso em: 20 de jan. 2013.
PUGA, S.; SOSA, M.; LEBGUE, T.; QUINTANA, C.; CAMPOS, A. Contaminación por metales pesados en suelo provocada por la industria minera: Heavy metals pollution in soils damaged by mining industry Ecología Aplicada, v. 5, n. 1,2, p. 149-155 2006. Disponível em:
http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1726-22162006000100020&lang=pt Acesso em: 20 de jan. 2013.
RAMALHO, J. F. G. P.; AMARAL SOBRINHO, N. M. B.; VELLOSO, A. C. X. Contaminação da microbacia de caetés com metais pesados pelo uso de agroquímicos.
Pesquisa agropecuararia Brasileira. v.
35 n.7 Brasília July 2000.http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-204X2000000700002&lng=en&nrm=iso&tlng=pt Acesso em: 20 de jan. de 2013.
RODRÍGUEZ-BARRANCO, M.; LACASAÑA, M.; GIL, F.; LORCA, A.; ALGUACIL, J.; ROHLMAN, D. S.; GONZÁLEZ-ALZAGA, B.; MOLINA-VILLALBA, I.; MENDOZA, R.; AGUILAR-GARDUÑO, C. Cadmium exposure and neuropsychological development in school children in southwestern Spain. Environmental Research. v. 134, p. 66–73, October 2014. Disponível em: http://www.sciencedirect.com/science/article/pii/S0013935114002229# Acesso em: 20 de set. 2014.
SANTANA, G. P. e BARRONCAS, P. S. R. Estudo de metais pesados (Co, Cu, Fe, Cr, Ni, Mn, Pb e Zn) na Bacia do Tarumã-Açu Manaus – (AM). Acta Amazonica, v. 37, n. 1, p. 111