DHIONNE CORRÊIA GOMES
PRODUÇÃO DE ESCLEROTIORINA POR
Penicillium sclerotiorum
E OBTENÇÃO DE
DERIVADOS COM APLICAÇÃO POTENCIAL EM
ALIMENTOS
Faculdade de Farmácia da UFMG Belo Horizonte, MG
2
DHIONNE CORRÊIA GOMES
PRODUÇÃO DE ESCLEROTIORINA POR
Penicillium sclerotiorum
E OBTENÇÃO DE
DERIVADOS COM APLICAÇÃO POTENCIAL EM
ALIMENTOS
Dissertação apresentada ao Programa de Pós-Graduação em Ciência de Alimentos da Faculdade de Farmácia da Universidade Federal de Minas Gerais, como requisito parcial à obtenção do grau de Mestre em Ciência de Alimentos
Orientadora: Profª. Drª. Jacqueline A. Takahashi
Faculdade de Farmácia da UFMG Belo Horizonte, MG
5
AGRADECIMENTOS
Primeiramente a Deus, pois sem Ele nada é possível, e somente nEle se encontram as respostas.
À Professora Jacqueline, por ter acreditado e confiado em mim desde quando este projeto estava somente no papel. Por ser sempre exemplo de dedicação, de
inteligência, mas também de respeito, honestidade e fé.
À minha mãe Helena, por ter me dado não somente o dom da vida, mas também por ter instigado em mim a curiosidade, e me transmitido a sabedoria e inteligência. Aos meus irmãos Diego e Diogo, meus melhores amigos, meus pilares, meu apoio. A meu pai.
Aos colegas de laboratório, em especial aos mais presentes: Fabiana, Karine, Ana Sarah, Adriana, Ana Paula, Willian, Bruna, Erick, Rafael, Camila, Paulo e Isabela pelo auxílio e por fazer com que o ambiente de trabalho, e consequentemente a realização deste projeto, se tornasse mais agradável.
Aos meus amigos do CEFET e da graduação por estarem sempre presentes em minhas conquistas.
Ao Philipe, pelo apoio, sensatez e compreensão nos momentos difíceis.
Aos professores do Programa de Pós-Graduação em Ciência de Alimentos, pela contribuição em minha formação científica, em especial à professora Evelyn, presente em minha formação desde a época da graduação.
Aos amigos do laboratório de Microbiologia Industrial, em especial à Raquel e à Ana Diolina, que foram parte fundamental na minha caminhada até aqui.
À Ivana e à Vany, pelo auxílio na obtenção e interpretação dos espectros de RMN e dos cromatogramas.
À Professora Cidinha, pelo auxílio com a identificação de fungos.
Ao CNPQ e FAPEMIG, por terem fornecido os recursos necessários para a realização deste projeto.
6
“Só sabemos com exatidão quando sabemos pouco. À medida que vamos adquirindo conhecimento, instala-se a dúvida”
7
SUMÁRIO
LISTA DE TABELAS ... 8
LISTA DE FIGURAS ... 9
LISTA DE SIGLAS ... 10
RESUMO ... 11
ABSTRACT ... 12
1 INTRODUÇÃO ... 13
2 REVISÃO DA LITERATURA ... 14
2.1 Biotecnologia ... 14
2.1.1 Biotecnologia da indústria de alimentos ... 15
2.2 Fungos ... 15
2.2.1 Metabólitos secundários ... 16
2.2.2 Azafilonas ... 18
2.3 Penicillium sclerotiorum ... 19
2.3.1 Esclerotiorina ... 21
2.4 Corantes naturais ... 23
2.4.1 Corantes naturais usados em alimentos ... 24
2.5 Biotransformações ... 29
2.5.1 Beauveria bassiana ... 30
3 MATERIAL ... 34
4 MÉTODOS ... 38
4.1 Manutenção dos micro-organismos ... 38
4.2 Preparo do extrato de Penicillium sclerotiorum ... 38
4.3 Purificação da esclerotiorina ... 39
4.4 Biotransformação da esclerotiorina pelo Beauveria bassiana ... 40
4.4.1 Cultivo do B. bassiana e biotransformação ... 40
4.4.2 Análise e purificação do biotransformado ... 41
4.5 Obtenção de produtos de síntese com diazometano ... 42
4.5.1 Síntese ... 42
4.5.2 Análise e purificação ... 42
4.6 Biotransformação do 1-metil-esclerotiorina pelo Beauveria bassiana ... 42
4.6.1 Cultivo do B. bassiana e biotransformação ... 42
4.6.2 Análise e purificação do produto biotransformado ... 42
4.7 Obtenção de outros derivados da esclerotiorina ... 43
4.7.1 Triagem de fungos ... 43
4.7.2 Análise de CLAE ... 44
4.8 Identificação do Cladosporium sphaerospermum ... 45
5 RESULTADOS E DISCUSSÃO ... 47
5.1 Produção e extração da esclerotiorina de Penicillium sclerotiorum ... 47
5.2 Purificação da esclerotiorina ... 48
5.3 Biotransformação da esclerotiorina pelo Beauveria bassiana ... 50
5.3.1 Cultivo de Beauveria bassiana ... 50
5.3.2 Obtenção dos produtos biotransformados ... 52
5.3.3 Elucidação estrutural do Biotransformado 1 ... 53
5.3.4 Elucidação estrutural dos outros biotransformados ... 58
5.4 Síntese da 1-metil-esclerotiorina ... 62
5.4.1 Elucidação estrutural do Produto 1 ... 63
5.5 Biotransformação da 1-metil-esclerotiorina pelo Beauveria bassiana ... 65
8
5.6.1 Identificação do Cladosporium sphaerospermum ... 68
5.6.2 Análise por CLAE ... 69
5.6.3 Interpretação dos resultados da triagem ... 70
5.6.4 Interpretação dos resultados da biotransformação em uma etapa de B. bassiana ... 73
5.6.5 Extrato de P. sclerotiorum ... 74
5.7 Projeção para uso dos resultados em alimentos ... 75
6 CONCLUSÕES ... 77
7 REFERÊNCIAS BIBLIOGRÁFICAS ... 79
8 APÊNDICES E ANEXOS ... 87
LISTA DE TABELAS
1 Corantes naturais autorizados e suas principais fontes ... 252 Meio de cultura utilizado no crescimento de Penicillium sclerotiorum ... 36
3 Meio de cultura utilizado no crescimento de Beauveria bassiana ... 36
4 Eluentes utilizados na coluna cromatográfica de purificação da esclerotiorina . 39 5 Gradientes de eluição utilizados na análise do HPLC ... 44
6 Informações obtidas a partir dos espectros de RMN de 1H e de 13C, sub-espectro DEPT e mapa de contornos HSQC para a esclerotiorina ... 51
7 Massas das substâncias isoladas da biotransformação da esclerotiorina por B. bassiana e respectivos rendimentos ... 53
8 Deslocamentos químicos dos átomos de carbono inseridos na molécula de esclerotiorina pela biotransformação ... 54
9 Resultado da análise elementar do biotransformado 1, e número de átomos correspondentes, levando-se em conta a massa obtida no espectro de massas ESI-MS ... 55
10 Propriedades físico-químicas do biotransformado 1 ... 60
11 Propriedades físico-químicas do biotransformado 4 ... 61
12 Propriedades físico-químicas do biotransformado 5 ... 61
13 Propriedades físico-químicas da 1-metil-esclerotiorina ... 66
14 Algumas referências bibliográficas sobre biotransformações realizadas pelos fungos utilizados neste experimento ... 67
9
LISTA DE FIGURAS
1 Classes de metabólitos secundários fúngicos ... 17
2 Fruto de Garcinia atroviridis ... 20
3 Metabólitos secundários isolados de P. sclerotiorum ... 20
4 Dimerização do herbertenediol ... 21
5 Estrutura molecular da esclerotiorina ... 21
6 Corantes produzidos por fungos ... 24
7 Possíveis mudanças estruturais das antocioanidinas em meio aquoso em função do pH ... 27
8 Estrutura básica do corante Arpink Red e estruturas das Monascusonas A e B ... 28
9 Estruturas da Ankaflavina e Monascina ... 28
10 Redução assimétrica do naftalenan-6-ona por B. bassiana ... 30
11 Oxidação da benzidrilsulfanil acetamida por B. bassiana ... 31
12 Hidroxilação de um derivado do adamantano por B. bassiana ... 31
13 4´-O-metil-glicosilação do composto CGP-62706 por B. bassiana ... 32
14 Hidrólise do composto CGP-291 por B. bassiana ... 32
15 Acetilação da 3,4-dicloroanilina pelo B. bassiana ... 32
16 Produtos formados pela desmetilação do Diuron por B. bassiana ... 33
17 Montagem das vidrarias na preparação de diazometano ... 37
18 Penicillium sclerotiorum em ágar batata inclinado após 3 dias. Frente (A) e verso (B) do tubo ... 47
19 Estrutura molecular da esclerotiorina ... 48
20 Cromatografia em camada delgada comparativa do padrão de esclerotiorina (A) e o extrato de Penicillium sclerotiorum (B) ... 49
21 Coluna cromatográfica de purificação da esclerotiorina em três etapas de eluição ... 49
22 Beauveria bassiana em ágar batata inclinado após 3 dias. Frente (A) e verso (B) do tubo ... 52
23 Comparação entre os deslocamentos químicos de RMN de 13C da esclerotiorina (em preto) e do biotransformado 1 (em vermelho) ... 54
24 Comparação entre os deslocamentos químicos de RMN de 13C da isocromofilona VI (em preto) e do biotransformado 1 (em vermelho) ... 55
25 Estruturas da esclerotiorina (1) e da isocromofilona VI (2), mostrando os diferentes cromóforos ... 56
26 Correlações observadas no espectro bidimensional de HMBC para o biotransformado 1 ... 57
27 Correlações observadas no espectro bidimensional de HMBC para o biotransformado 1 ... 57
28 Estrutura molecular proposta para o Biotransformado 1 ... 57
29 Fragmento estrutural comum nos biotransformados 1, 4 e 5 ... 58
30 Provável estrutura do biotransformado 4 ... 59
31 Provável estrutura do biotransformado 5 ... 59
32 Mecanismo proposto para a reação entre azafilonas e aminas primárias ... 62
33 Reação de formação do diazometano ... 62
34 Comparação entre os deslocamentos químicos da esclerotiorina (em preto) e do Produto 1 (em vermelho) ... 64
35 Correlações observadas no mapa de contornos HMBC para o produto 1 ... 64
10 37 Microcultivo de Cladosporium sphaerospermum ... 68 38 Cladosporium sphaerospermum inoculado em tubo inclinado. Frente (A) e
verso (B) ... 68 39 Características microscópicas do Cladosporium sphaerospermum.
Conidióforos (a), hifas septadas (b), esporos sexuais (c), detalhe da
reprodução assexuada (d) ... 69 40 Cromatograma da biotransformação em duas etapas em contraste com o
cromatograma dos biotransformados isolados ... 74 41 Cromatograma do extrato de Penicillium sclerotiorum ... 75
LISTA DE SIGLAS
CCD Cromatografia em coluna delgada
CEPT Proteína de transferência de colesterol esterificado CLAE Cromatografia líquida de alta eficiência
COSY Correlation spectroscopy
DEPT Distortionless enhancement by polarization transfer ESI-MS Espectroscopia de massas por ionização por eletrospray FDA Food and Drug Administration
HDL Lipoproteína de alta densidade HIV Vírus da imunodeficiência humana HMBC Heteronuclear multiple bond correlation HPLC Cromatografia líquida de alta eficiência HSQC Heteronuclear single quantum coherence IV Infravermelho
LDL Lipoproteína de baixa densidade
NADPH Fosfato de dinucleótido de nicotinamida e adenina NOESY Nuclear Overhauser effect spectroscopy
RMN Ressonância magnética nuclear TOCSY Total correlation spectroscopy
UFMG Universidade Federal de Minas Gerais USP Universidade de São Paulo
11
RESUMO
O fungo Penicillium sclerotiorum produz uma grande variedade de metabólitos secundários, entre eles, a esclerotiorina, que tem tido aplicações nas indústrias alimentícia e farmacêutica. Devido à sua forte coloração alaranjada, sua capacidade antioxidante, potencial atividade biológica de redução do colesterol plasmático e no tratamento da diabetes, esta substância tem sido alvo de diversos estudos na área de alimentos. Neste projeto, foram produzidas substâncias através da biotransformação da esclerotiorina com o fungo Beauveria bassiana, obtendo-se cinco produtos de forte coloração avermelhada. A mudança na coloração da substância aconteceu devido à troca de um heteroátomo de oxigênio ligado ao carbono 1 da molécula de esclerotiorina por um átomo de nitrogênio. O experimento de biotransformação foi repetido utilizando, como substrato, a 1-metil-esclerotiorina, uma substância semi-sintética, porém os mesmos resultados não foram obtidos. Após a obtenção destes resultados, foi feita uma triagem com 14 diferentes espécies de fungos, além de Beauveria bassiana, para verificar a capacidade destes fungos em biotransformar a esclerotiorina. Os extratos foram analisados por CLAE e mostraram que, destes 14 fungos, nove foram capazes de biotransformar a molécula de esclerotiorina em uma ou mais substâncias que apresentaram coloração avermelhada.
12
ABSTRACT
The fungus Penicillium sclerotiorum produces a wide variety of secondary metabolites, among them the sclerotiorin, which has many uses in food and pharmaceutical industries. Due to its strong orange color, its antioxidant activity and other functions related to cholesterol reduction and treatment of diabetes, this substance has been subject of extensive studies in food science. In this project, substances were produced by esclerotiorin biotransformation with the fungus Beauveria bassiana. Five new products with strong red color were obtained. The change in coloration of the molecule was due to the exchange of the oxygen heteroatom attached to sclerotiorin carbon 1 by a nitrogen atom. The biotransformation experiment was repeated using, as substrate, 1-methyl-sclerotiorin, a semi-synthetic substance, but the same results were not obtained. After these results, it was performed a screening with 14 different fungi, besides Beauveria bassiana, to evaluate their capacity to biotransform sclerotiorin. The extracts were analyzed by HPLC and showed that, from these 14 fungi, nine were able to transform sclerotiorin molecule in one or more substance with red color.
13
INTRODUÇÃO
Os fungos podem ser utilizados na indústria de duas maneiras: como agentes produtores de alguma substância de interesse ou como promotores de reações para a produção de importantes substâncias, sendo os dois processos conhecidos como, respectivamente, fermentação e biotransformação. Utilizando-se processos fermentativos, podem-se obter substâncias de atividades interessantes como anti-oxidantes, antimicrobianos ou corantes.
Os corantes naturais, isolados de plantas ou micro-organismos, podem apresentar atividades importantes na indústria farmacêutica e de alimentos. Há necessidade constante de estudos nessa área, pois grande parte desse potencial biotecnológico não é explorado.
As biotransformações, por serem regio e estereoespecíficas, são pontos importantes na produção de variadas substâncias. O uso de micro-organismos para a promoção de determinada reação causa redução de tempo e custo, pois dispensa o uso de grandes quantidades de reagentes químicos e controle das condições do meio reativo. Muitos produtos de biotransformação são utilizados na indústria farmacêutica e de alimentos.
O objetivo geral do trabalho foi produzir derivados do corante natural fúngico esclerotiorina que possam posteriormente ser usados como corantes, anti-oxidantes ou conservantes alimentares.
Os objetivos específicos foram:
Produzir esclerotiorina a partir do cultivo do fungo Penicillium sclerotiorum por meio de fermentação em meio submerso;
Extrair e purificar a esclerotiorina do meio de cultivo utilizando técnicas cromatográficas;
Obter derivados da esclerotiorina em reações de síntese com diazometano;
Obter produtos biotransformados da esclerotiorina e de derivados com o emprego do fungo Beauveria bassiana, visando a produção de azafilonas inéditas;
14
REVISÃO DA LITERATURA
2.1
–
Biotecnologia
Biodiversidade ou diversidade biológica refere-se à variedade de vida na Terra, como o resultado de bilhões de anos de evolução, compreendendo um número extraordinário de plantas, animais e micro-organismos. Embora demasiadamente afetada pela intervenção humana, a biodiversidade tem fornecido muitos micro-organismos e moléculas com importantes atividades metabólicas, farmacológicas e grande valor de mercado. Quando corretamente explorada por países de rica biodiversidade (usualmente países em desenvolvimento ou subdesenvolvidos), o uso dos recursos naturais de forma sustentável torna-se ferramenta para a diminuição da pobreza, beneficiando também o planeta como um todo (Rouhi, 2003). Da extensa biodiversidade brasileira, somente uma pequena fração de espécies de plantas e micro-organismos já foi estudada quimicamente (Gottlieb, 1980; Hawksworth, 1991).
Atualmente, a prospecção da biodiversidade tem sido ativamente direcionada ao desenvolvimento de novos fármacos, em processos dinâmicos de monitoramento da atividade biológica, bem como para a descoberta de novos micro-organismos para serem usados em processos industriais visando à produção de alimentos ou aditivos alimentares (Araujo et al., 2006).
A biotecnologia industrial atua no desenvolvimento de produtos e processos utilizando seres vivos, ou parte deles, sendo uma área de grande importância na indústria de alimentos e medicamentos, principalmente quando integrada à prospecção da biodiversidade (Butler, 2004). Processos fermentativos são utilizados na indústria química para a produção de solventes, ácidos orgânicos, principalmente os ácidos cítrico, lático, fumárico e giberélico. Metais diversos, como o cobre, zinco, prata, ouro ou urânio podem ser extraídos com o emprego de micro-organismos, a partir de minérios de baixo teor (Borzani et al., 2008).
15 Processos de tratamento biológico dos resíduos (águas residuais, lixo) também são processos fermentativos. Há, ainda, os processos que tem por objetivo a produção industrial de micro-organismos que podem ser utilizados como fixadores de nitrogênio do ar na agricultura (bactérias do gênero Rhizobium), no controle biológico de pragas (bactérias do gênero Bacillus), na produção de vacinas (Borzani et al., 2008), ou ainda para produção de massa celular como para produção de fermento biológico (levedura prensada) ou de levedura forrageira (“single cell protein”).
2.1.1 – Biotecnologia na indústria de alimentos
A produção de alimentos fermentados, principalmente bebidas, representa o maior uso dos micro-organismos na indústria alimentícia. Há pesquisas consolidadas onde os melhores parâmetros para este tipo de fermentação são descritos, bem como tem sido descrita a utilização de resíduos da indústria de alimentos para a produção destas bebidas (Alvarenga, 2006 e Alvarenga et al., 2008). Os leites fermentados tem sido alvo de grande número de estudos, devido aos benefícios comprovados destes alimentos (Gonzáles-Sánchez et al., 2010).
Além disso, destaca-se a produção de vinagres, manteigas, queijos, picles, chucrute, azeitonas, pão e cacau. Concentrados protéico-vitamínicos são produzidos através de algas e leveduras do gênero Candida. O enriquecimento protéico de farinhas e farelos pode ser feito pela ação de bolores (Aquarone et. al., 2008).
Fungos também podem ser utilizados em processos de biorremediação para uso de água proveniente de indústria de alimentos (Azab, 2000).
2.2
–
Fungos
Os fungos são organismos eucariotas, podendo ser unicelulares, como as leveduras, ou pluricelulares, como os cogumelos, sendo diferenciados dos outros reinos por possuírem parede celular contendo quitina, e ausência de clorofila (Tortora et al., 2002). Os fungos filamentosos e leveduras apresentam a vantagem de crescimento relativamente fácil em processos fermentativos, sendo bem adaptáveis à produção industrial (Smedsgaard e Nielsen, 2004).
16 fermentativo; o fato de que mesmo espécies comuns de fungos, como aquelas dos gêneros Penicillium e Aspergillus, conhecidos por sua ubiqüidade, produzem metabólitos bioativos (Takahashi e Lucas, 2008). A produção de antibióticos por fungos tem algumas características, comuns à produção de outros metabólitos secundários: a produção do metabólito é específica da linhagem; há uma instabilidade no processo biossintético, com tendência a uma diminuição com repiques sucessivos usados para a manutenção das linhagens; a produção de antibióticos segue uma cinética de crescimento fúngico associado a um meio de cultura específico (Wijeratne et al., 2004); o aumento da produtividade freqüentemente ocorre na etapa de esporulação do micro-organismo; e a variedade estrutural dos metabólitos biossintetizados pode ser aumentada com pequenas variações das condições de cultivo (Takahashi e Lucas, 2008).
Fungos do filo Basidiomycota e Ascomycota sempre foram utilizados na alimentação humana, principalmente nos países orientais. Estudos sobre o perfil nutricional de fungos filamentosos mostram que a biomassa de alguns fungos inferiores apresenta alto teor de proteínas, com destaque para Penicillium sclerotiorum, Penicillium janthinellum, Syncephalastrum racemosum e Rhizopus stolonifer. Fungos da espécie Penicillium sclerotiorum, P. citrinum e P. pinophillum apresentam boa relação entre ácidos graxos poliinsaturados e saturados, podendo ser considerados alimentos saudáveis (Carvalho, 2009).
2.2.1 – Metabólitos secundários
Metabólitos secundários são diferenciados dos primários por não participarem das reações básicas fundamentais à sobrevivência dos micro-organismos. São geralmente bioativos, de baixa massa molecular e são produzidos como famílias de compostos em partes restritas do ciclo de vida, geralmente na fase exponencial do crescimento fúngico, com a produção geralmente correlacionada a um estado específico de diferenciação morfológica (Keller et al., 2005). Além das plantas, apresentam metabolismo secundário alguns micro-organismos como as bactérias filamentosas, as bactérias formadoras de esporos e os fungos filamentosos.
17
Figura 1 – Classes de metabólitos secundários fúngicos (adaptado de Keller et al.
18 Considerando os vinte medicamentos mais prescritos atualmente, seis são substâncias provenientes do metabolismo secundário de fungos. Levando-se em conta que apenas 5% dos fungos estão descritos, há um potencial muito grande a ser explorado. A busca de metabólitos secundários deve ser feita levando em conta que sua síntese pode corresponder ao nicho ecológico do fungo e que a interação entre metabólitos pode induzir um aumento de sua produção (Schulz et al. 2002).
O primeiro produto cristalino considerado um metabólito bioativo foi o ácido micofenólico, isolado de Penicillium glaucoma, em 1896, por Gosio. Alguns produtos do metabolismo de fungos tem sido usados na prática de diferentes maneiras como, pela aplicação direta do produto na medicina, agricultura ou indiretamente, usando-se o produto original como material de partida para subseqüente modificação química ou microbiológica (biotransformações), ou utilizando-o como composto principal para sínteses químicas de novos análogos (Bérdy, 2005).
A grande maioria dos metabólitos bioativos produzidos por fungos vem de espécies da classe dos ascomicetos e outros fungos filamentosos, além de espécies endofíticas (fungos que vivem associados a plantas). Algumas espécies de basidiomicetos vem sendo estudadas, como o caso do Mycena leaiana, um fungo superior de coloração laranja, cuja substância responsável pela cor apresenta atividade antibiótica. O número total de substâncias bioativas conhecidas produzidas por fungos é de aproximadamente 8600, representando 38% de todos os produtos microbianos (Brizuela et al. 1998; Bérdy, 2005).
Alguns fungos são capazes de produzir metabólitos secundários, muitos dos quais são tóxicos e mesmo cancerígenos tanto para o homem, como para os animais. Fungos que crescem nos alimentos, produtores de metabólitos tóxicos, são chamados toxigênicos e os metabólitos são denominados micotoxinas (Sabino et al., 1982).
Entre as micotoxinas de grande interesse para a Saúde Pública e de importância agroeconômica estão as aflatoxinas, ocratoxinas, tricotecenos, zearalenona, fumonisinas e os alcalóides do ergot. Uma única espécie de fungo é capaz de produzir uma ou várias micotoxinas, e uma mesma micotoxina pode ser produzida por diferentes espécies de fungos (Hussein e Brasel, 2001).
2.2.2 – Azafilonas
Os policetídeos fúngicos podem variar de tetracetídeos a octacetídeos, tendo entre 4 ou 8 unidades C2 que contribuem para a cadeia policetídica. Alguns são
19 ou terpenóides. Esta classe inclui as antraquinonas, hidroxiantraquinonas, naftoquinonas e azafilonas, cada uma contendo grande variedade de cores (Mapari et al. 2010).
As azafilonas são um grupo de substâncias que geralmente apresentam coloração forte. Pertencem a uma classe de metabólitos secundários estruturalmente diversa, com uma estrutura pirona-quinona, contendo um anel bicíclico altamente oxigenado e um centro quaternário quiral (Osmanova et. al., 2010).
Azafilonas exibem uma ampla gama de interessantes atividades biológicas, como atividade antibacteriana, antiviral, antifúngica, antioxidante, citotóxica, nematicida e antiinflamatória. A potente atividade não seletiva das azafilonas pode estar relacionada à formação de -piridonas (Osmanova et. al., 2010).
A maioria das espécies produtoras de azafilonas são pertencentes aos gêneros
Penicillium, Monascus, Chaetomium e Talaromyces (Osmanova et. al., 2010).
Musso e colaboradores investigaram a capacidade de inibição da proteína molecular Hsp90 por azafilonas sintetizadas por Bulgaria inquinans, Monascus purpureus e Arpergillus deflectus, assim como seus derivados semi-sintéticos. A proteína Hsp90 atua na proliferação celular e sua inibição pode ser benéfica no tratamento do câncer (Musso et al. 2010).
2.3
–
Penicillium sclerotiorum
Muitas espécies do gênero Penicillium possuem a capacidade de produzir substâncias bioativas, como a xestodecalactona, que possui propriedades antifúngicas (Edrada et al., 2002) e a metil-acetal-atrovenetinona, substância com atividade anti-HIV (Shiomi et al., 2005).
Penicillium sclerotiorum é um micro-organismo mesófilo, de coloração esverdeada, com aspecto cotonoso. Está presente em solos, porém, já foi isolado do interior da planta Garnicia atroviridis (Figura 2), podendo, portanto, ser também classificado como fungo endofítico. Os extratos isolados com hexano e acetato de etila de P. sclerotiorum apresentam atividade antimicrobiana e anti-HIV.
)-4,6-di-20 metilocta-2,4-dienóico (18) e (5S,6R)-5,6-di-hidro-3,5,6-trimetilpiran-2-ona (19) (Arunpanichlert et al., 2010). Porém, o constituinte em maior concentração nos extratos de P. sclerotiorum é a azafilona esclerotiorina (20) (Arunpanichlert et al., 2010). Lucas e colaboradores descreveram estudos sobre a atividade antimicrobiana de três substâncias isoladas dos extratos de P.sclerotiorum, pencolídeo (21), isocromofilona VI (22), além da esclerotiorina (20). As estruturas moleculares se encontram representadas na Figura 3 (Lucas et. al., 2007; Arunpanichlert et. al., 2010).
Fonte: The Plant Observatory, 2010
Figura 2 – Fruto de Garcinia atroviridis
21 Espécies do gênero Penicillium, além da produção de metabólitos, possuem um longo histórico de uso biotecnológico na produção de enzimas. Knob e Carmona descreveram uma -xilosidase com grande atividade extraída de P. sclerotiorum. Esta enzima degrada a xilana, a mais abundante fonte de carbono não-celulósica presente em madeira e resíduos agroindustriais. A adição desta enzima a rações animais pode aumentar seu valor nutritivo. Outro uso seria na clarificação e maceração de sucos e vinho (Knob e Carmona, 2009).
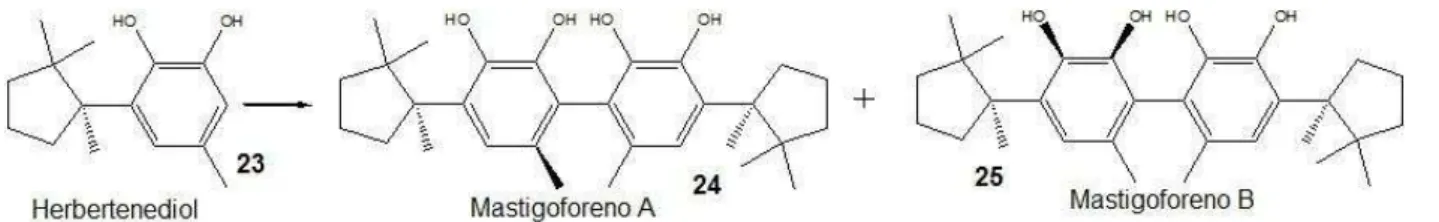
Penicillium sclerotiorum também é relatado na literatura como útil em alguns experimentos de biotransformação, como a dimerização do herbertenediol (23), para formar mastigoforenos A (24) e B (25), como é mostrado na Figura 4 (Harinantenaina et. al., 2005).
Figura 4 – Dimerização do herbertenediol
2.3.1 – Esclerotiorina
O constituinte químico predominante em P. sclerotiorum é a esclerotiorina (20), pigmento contendo um átomo de cloro. A esclerotiorina (20) foi primeiramente isolada em 1940 por MacCurtin (MacCurtin e Reilly, 1940). Estudos vêm mostrando que este pigmento possui algumas atividades biológicas interessantes, como a indução de formação de clamidosporo, célula hifal que se comporta como esporo no fungo, de maior resistência térmica (Weng et al., 2004).
O
O
Cl O
O O
20
22 A esclerotiorina (20) tem tido aplicações importantes na indústria de alimentos, como, por exemplo, a inibição da lipoxigenase. Esta enzima catalisa a oxidação regio e estereoespecífica de ácidos graxos contendo um sistema cis,cis-1,4-pentadieno, formando hidroperóxidos. A peroxidação de ácidos graxos provoca a rancificação de alimentos oleoginosos e gorduras de origem vegetal e animal, alterando o sabor, odor, coloração e reduzindo seu valor nutritivo. Em mamíferos, os produtos das reações catalisadas pela lipoxigenase são responsáveis por uma grande variedade de desordens, como aterosclerose, alergias, inflamação, asma e hipersensibilidade. Por esse motivo, inibidores da lipoxigenase podem ser usados tanto em indústria de alimentos, como antioxidantes; ou em setores de saúde, graças a seus benefícios farmacológicos (Chidananda e Sattur, 2007).
Sabe-se também que a esclerotiorina (20) é capaz de inibir a proteína de transferência de colesterol esterificado (CETP). A CETP é conhecida por transferir colesterol esterificado entre as lipoproteínas do plasma. Vários fatores indicam a importância desta proteína no desenvolvimento da aterosclerose, pois ela diminui a concentração do colesterol nas lipoproteínas de alta densidade (HDL). Pessoas com deficiência genética de CETP possuem alto HDL, baixos níveis de lipoproteína de baixa densidade (LDL) e apresentam baixa incidência de aterosclerose (Tomoda et al., 1999). Outra atividade importante da esclerotiorina (20) é a inibição da enzima aldose redutase, uma oxiredutase dependente de NADPH que catalisa a conversão de glicose em álcool, e promove acúmulo de sorbitol em vários tecidos, quando em condições de hiperglicemia, como é o caso da diabetes mellitus. Este nível elevado de sorbitol pode levar a várias complicações como retinopatia, catarata, neuropatia e nefropatia. Os inibidores da aldose redutase podem reverter essa mudança bioquímica ou até prevenir estas complicações (Chidananda et al., 2006).
23
2.4
–
Corantes naturais
Um corante natural é definido como um pigmento que é sintetizado e acumulado ou excretado a partir de células vivas. Certos pigmentos, assim como fenóis oxidados e outros derivados mais simples de fenóis podem ser formados até mesmo por células em processo de morte (Hendry, 1996).
A presença ou ausência de coloração de uma molécula biológica é determinada por sua estrutura, principalmente a estrutura eletrônica, o tamanho da molécula, solubilidade e a composição elementar. Algumas alterações na estrutura de molécula incolores podem fazer com que ela absorva energia em comprimentos de onda menos energéticos, e consequentemente, dão cor à substância. Esta alteração é chamada de mudança batocrômica e pode ser causada por seis modificações estruturais: aumento do tamanho da cadeia, ramificação da cadeia carbônica, rearranjo em um simples anel, adição de nitrogênio ou oxigênio, ligação de dois ou mais anéis e adição de certos metais de transição. Moléculas que já possuem coloração, ao sofrerem uma mudança batocrômica, podem ter sua coloração alterada (Hendry, 1996).
Fungos filamentosos, particularmente ascomicetos e basidiomicetos, e liquens são conhecidos por sintetizarem e secretarem diversas classes de pigmentos, como metabólitos secundários, que possuem uma extraordinária gama de cores. Cogumelos e liquens são difíceis de cultivar em laboratório, e, consequentemente, difíceis de extrapolar a produção de seus metabólitos para escala industrial. Muitos ascomicetos, ao contrário, são adequados à produção industrial pela facilidade de crescimento em laboratório. O controle das condições de cultivo em biorreatores minimiza as variações entre lotes (Mapari et al. 2010).
Diferentemente das plantas, fungos não produzem clorofilas e poucas espécies são produtoras de carotenos. Algumas espécies fúngicas acumulam substâncias pigmentadas que, em geral, estão ausentes ou presentes somente em baixas concentrações em espécies de outros reinos, como é o caso da riboflavina (vitamina B2), que proporciona a coloração amarela a fungos dos gêneros Russula e Lyophyllum. Os únicos pigmentos comuns entre fungos e plantas ou animais são as betalaínas, melaninas, um pequeno número de carotenóides e algumas antraquinonas (Hendry, 1996).
24 derivados fenólicos, como os derivados dos ácidos fenilpropanóico e cinâmicos também são responsáveis pela coloração de alguns fungos (Hendry, 1996).
Os corantes sintetizados por fungos apresentam diversas funções, variando de proteção contra foto-oxidantes letais, como os carotenóides, proteção contra o estresse ambiental, como as melaninas, ou até agindo como cofatores em catálises enzimáticas, como o caso das flavinas (Mapari et al. 2005).
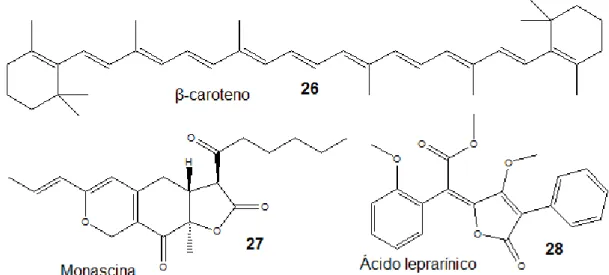
A Figura 6 apresenta a estrutura de algumas classes de corantes produzidos por fungos, o -caroteno (26), um carotenóide, a monascina (27), um policetídeo e o ácido leprarínico (28), uma terfenilquinona.
Figura 6 – Corantes produzidos por fungos (adaptado de Hendry, 1996)
2.4.1 – Corantes naturais usados em alimentos
Corantes utilizados em alimentos são chamados aditivos de cor. Segundo o FDA, aditivo de cor é qualquer corante, pigmento ou substância que, quando adicionado ou aplicado a um alimento, droga ou cosmético, ou até ao corpo humano, é capaz de, sozinho, ou através de reações com outras substâncias, transmitir cor (FDA, 2010).
25 A preferência dos consumidores por corantes extraídos de fontes naturais está associada à imagem de serem produtos saudáveis e de boa qualidade. Corantes sintéticos tendem a ser julgados como indesejáveis e prejudiciais. Alguns são considerados responsáveis por reações alérgicas e intolerâncias (Blenford, 1995).
Os corantes naturais mais utilizados estão listados na Tabela 1:
Tabela 1 – Corantes naturais autorizados e suas principais fontes (adaptado de
Mapari et. al., 2005)
Pigmento Fonte Gama de cor
Ácido carmínico e carmina Cochonilha fêmea – inseto do Peru e Equador
Laranja a vermelho Rosa a vermelho Antocianinas Sabugueiro, uva, cenoura roxa,
repolho
Rosa/vermelho a azul/malva – dependente do pH
Betanina Beterraba Rosa a vermelho
Caramelo Carboidratos comestíveis Marrom
Carbo medicinalis Planta Preto
Carotenóides
-caroteno Óleo de palma Amarelo a laranja Bixina ou norbixina Sementes de urucum (Bixa
orellana) da América do Sul
Laranja
Capsantina e capsorubina
Páprica (Capsicum annum L.) Laranja avermelhado
Licopeno Tomate (Lycopersicum esculentum)
Vermelho alaranjado
Luteína Malmequer (Tagestas erecta) Amarelo dourado Cantaxantina Salmão, camarão e flamingos Rosa alaranjado Clorofila Grama, luzerna e urtiga Verde a oliva Clorofilina (complexo
cúprico da clorofila)
Grama, luzerna e urtiga Verde azulado
Curcumina Rizoma de planta (Curcuma longa) da Índia
Laranja-amarelo
Riboflavina Semi-sintética, usando ribose produzida por fermentação bacteriana
26 Os corantes naturais que são atualmente autorizados para uso na União Européia são derivados de variadas fontes, de plantas a insetos, como o caso do ácido carmínico, derivado da cochonilha, um inseto da família Dactylopiidae. A atual produção de corantes naturais depende do suprimento externo e sazonal de diversos materiais, resultando em variações no perfil do pigmento extraído. Como os corantes são extraídos de fontes naturais, eles são, na maioria dos casos, misturas de composição variada que dependem do cultivar e das condições climáticas, e são difíceis de serem caracterizados no que diz respeito à pureza e presença de contaminantes (Mapari et al. 2010).
27 O OAçúcar OH HO R R' OH O OAçúcar OH O R R' OH O OAçúcar OH HO R R' OH OH O OAçúcar OH O R R' O -O OAçúcar O -O R R' O -O -OAçúcar O --O R R' O -O H+ OH
--H2O
+H2O
H+ OH
--H2O +H2O
H+ OH
-OH
-H+
H+
OH
-pH 1-2
cátion flavílico, vermelho
pH 6,5-8 anidrobase, violeta anidrobases, azul pH 9-12 pH<6 carbinol, incolor pH 13-14
pseudobase chalcona, amarelo
29 30
31 32
33 34
Figura 7 – Possíveis mudanças estruturais das antocioanidinas em meio aquoso
em função do pH (Terci e Rossi, 2002)
28 uso na área de alimentos. No Japão, apenas a espécie Monascus purpureus é autorizada para uso em alimentos (Mapari et. al., 2005 e Mapari et. al., 2010).
Figura 8 – Estrutura básica do corante Arpink Red e estruturas das
Monascusonas A e B
A toxicidade de outros policetídeos produzidos por fungos, principalmente do gênero Monascus, têm sido pesquisada. O pigmento amarelo ankaflavina (38) e seu análogo estrutural, monascina (39) (representados na Figura 9), apresentam baixa ou nenhuma citotoxidade para células, o que indica que são substâncias seguras, se consumidas em doses apropriadas (Mapari et. al., 2010).
Figura 9 – Estruturas da Ankaflavina e Monascina
29 Muitos destes corantes apresentam atividade anti-oxidante e anti-aterogênica, e alguns já possuem estudos sobre sua toxicidade. Além de alguns policetídeos produzidos por
Monascus, corantes laranjas extraídos de P. aculeatum e corantes amarelos extraídos de E. nigrum são potencialmente seguros. Porém, grande parte dos corantes estudados são instáveis à luz, o que pode degradar a coloração apresentada (Mapari et. al., 2010).
2.5
–
Biotransformações
Transformações microbianas ou biotransformações representam uma série de reações biológicas, geralmente de xenobióticos, substâncias estranhas para o organismo, catalisadas por células íntegras ou enzimas isoladas. Devido à sua alta regio e estereosseletividade, transformações microbianas complementam sínteses orgânicas e tem sido muito aplicadas na indústria farmacêutica e de alimentos. As reações de biotransformação, especialmente aquelas que utilizam fungos, também tem sido usadas como modelos in vitro do metabolismo mamífero de uma variedade de compostos bioativos e drogas (Rai, 2009).
As biotransformações podem ser realizadas por bactérias, fungos, leveduras e plantas, e podem envolver diferentes enzimas, como oxigenases, redutases e hidratases (Duetz et al., 2003; Palmqvist et al., 2006).
Biotransformações tem sido usadas na indústria de alimentos para diversos fins. Por exemplo, as catequinas do chá são naturalmente convertidas em teaflavinas durante o seu processamento, através da enzima polifenol oxidase. As teaflavinas são substâncias bioativas, com alta atividade antioxidante, além de propriedades antimutagênicas e antiinflamatórias, e aumentam a qualidade da bebida. Esta conversão acontece naturalmente, porém, pode ser feita com maiores rendimentos utilizando extratos de planta contendo a enzima ou até mesmo utilizando a enzima purificada (Sharma et al., 2009).
30 2.5.1 – Beauveria bassiana
Beauveria bassiana é um fungo filamentoso de ocorrência global em solos. Como um agressivo fungo entomopatogênio e parasita, ele é causador da doença muscardina em insetos. O fungo prolifera no corpo do inseto, produzindo toxinas, como a beauvericina, que enfraquece o sistema imune do hospedeiro, eventualmente matando-o (Rai, 2009).
Beauveria bassiana tem sido frequentemente empregado em estudos de biotransformação devido a seu eficiente sistema enzimático, ampla aceitabilidade de substratos e sua capacidade de realizar diferentes tipos de reação. Tem sido relatado que este fungo é capaz de biotransformar mais de 300 tipos diferentes de substratos (Rai, 2009).
Beauveria bassiana é um importante catalisador microbiano, o segundo micro-organismo mais frequentemente usado como biocatalisador, atrás somente do
Aspergillus niger, e suas aplicações são superadas somente por A. niger,
Pseudomonas putida e Saccharomyces cerevisiae (Rai, 2009).
As principais reações catalisadas por Beauveria bassiana são descritas a seguir. Os exemplos também representam as principais reações de biotransformação realizadas por fungos (Rai, 2009).
Redução
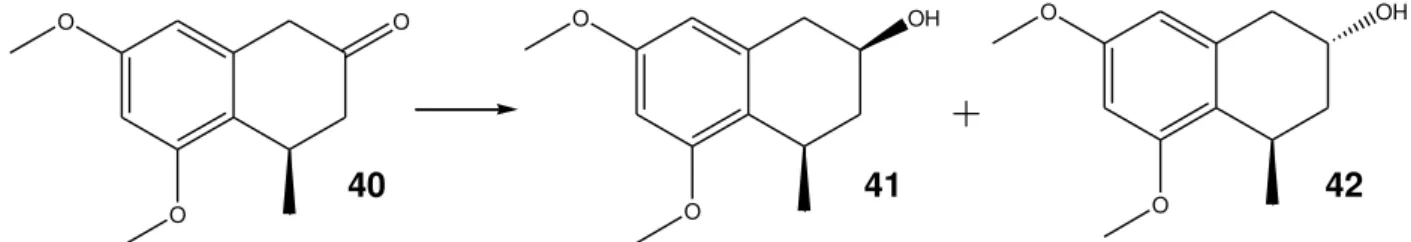
Uma variedade de reduções catalisadas por fungos é conhecida, sendo que a mais comum é a redução do grupo carbonila. A Figura 10 representa a redução assimétrica do naftalenan-6-ona (40) por B. bassiana (Rai, 2009).
O O O O O OH O O OH
40 41 42
Figura 10 – Redução assimétrica do naftalenan-6-ona por B. bassiana
Oxidação
31 um fármaco neurotrópico autorizado para uso nos Estados Unidos para o tratamento da narcolepsia e apnéia do sono (Rai, 2009).
S
NH2
O
S
NH2
O O
43 44
Figura 11 – Oxidação da benzidrilsulfanil acetamida por B. bassiana
Hidroxilação
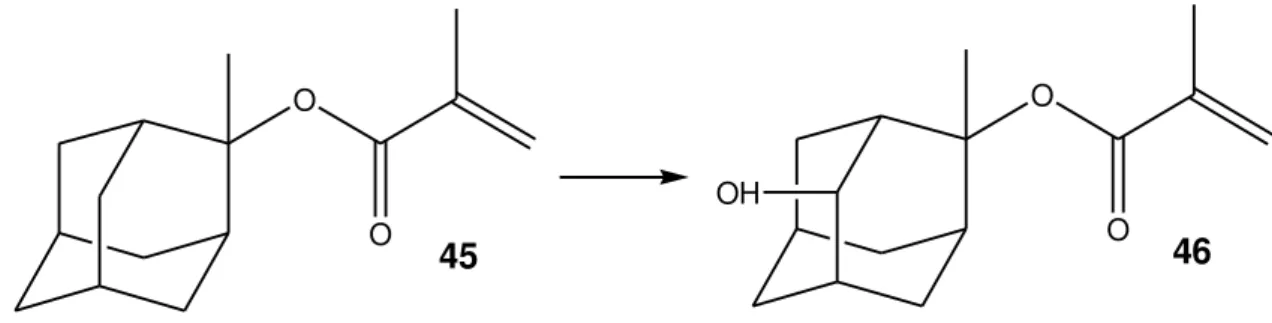
Hidroxilação microbiana é uma das reações de biotransformação mais comuns e importantes. Baseia-se na introdução regio e estereosseletiva de um grupo hidroxila em um carbono não ativado, o que é difícil de se obter pelos métodos químicos tradicionais. A Figura 12 representa a hidroxilação de um derivado éster do adamantano (45) por Beauveria bassiana (Rai, 2009).
O
O
O
O OH
45 46
Figura 12 - Hidroxilação de um derivado do adamantano por B. bassiana
Glicosilação
32
N N
HN HN Cl
N N
HN HN Cl
4'-O-Metil-glicose O
47
48
Figura 13 – 4´-O-metil-glicosilação do composto CGP-62706 por B. bassiana
Hidrólise
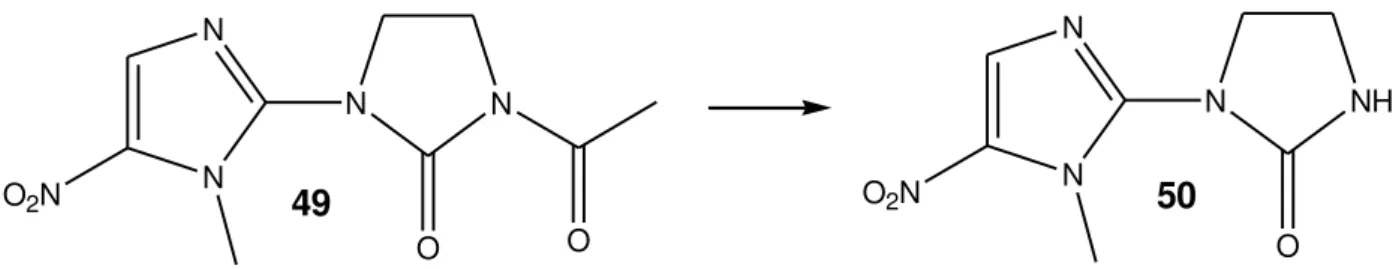
Hidrólise de ésteres e epóxidos são relatadas para Beauveria bassiana. A Figura 14 representa a desacetilação do composto CGP-291 (49), um agente antiprotozoário (Rai, 2009).
N N
N
N O2N
O O
N NH
N
N O2N
O
49 50
Figura 14 – Hidrólise do composto CGP-291 por B. bassiana
Acetilação
A Figura 15 representa a biotransformação da 3,4-dicloroanilina (51) pelo B. bassiana (Rai, 2009).
Cl
Cl
NH2 Cl
Cl
H N
O
51 52
33 Desmetilação
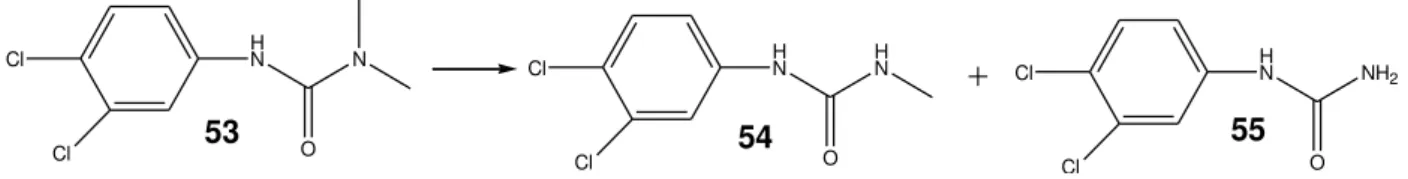
A Figura 16 representa a degradação do herbicida Diuron (53), através de desmetilações. Os produtos formados são menos tóxicos do que o herbicida e, por esta razão, o B. bassiana pode ser utilizado para recuperação de solos contendo este produto tóxico (Rai, 2009).
Cl
Cl
H
N N
O
Cl
Cl
H
N HN
O
Cl
Cl
H
N NH2
O
53 54 55
34
MATERIAL
A maior parte dos materiais utilizados no desenvolvimento do projeto se encontra no La B, Laboratório de Biotecnologia e Bioensaios, do Departamento de Química da UFMG.
As análises de RMN, CLAE e as análises elementares foram feitas no Departamento de Química da UFMG. A identificação do fungo foi feita no Laboratório de Micologia, do Instituto de Ciências Biológicas. As análises por espectrometria de massas foram feitas na Central Analítica, USP. Os fungos utilizados fazem parte da coleção de fungos do La B.
Equipamentos:
Espectrômetro Bruker Avance DRX400 e DPX200 – foram utilizados para registrar espectros de RMN
PE 2400 CHN Elemental Analyzer – foi utilizado para análise elementar
HPLC Shimadzu prominence LC-20AT
Espectometro de massas Burker Daltonics modelo MicroTOF lc
Espectômetro de massas MicroMass Waters Q-TOF-Micro
Infravermelho Perkin Elmer Spectrum BX
Ultravioleta B-380 Micronal
Ponto de fusão Gehaka modelo PF 1000, série 0530/06001020
Autoclave vertical Fanen, modelo 415/3, série J03610
Balança analítica Quimis, modelo Q-ILA2104, 210g/ 0,1mg
Balança eletrônica Digimed KN1000C, classe de exatidão II, série 04G6
Bomba de vácuo e pressão Tecnal TE-0581
Estufa de secagem Fanen Ltda Modelo 002 CB
Estufa para placa cromatográfica Quimis G-317 8122
Evaporador rotativo Fisatom Modelo 803
Capela VECO, modelo JLF 912, série FL 5799
Refrigerador Nuaire -86ºC Ultralow Freezer
Câmera fotográfica Sony Cyber-shot 7.2 mega pixels
Microondas Master Cooking CCE M-500
35
Micropipeta automática Digipet 1-5 mL
Micropipeta automática Digipet 20-200 µL
Incubadora de bancada Cientec CT-712
Microscópio eletrônico Olympus CX 40
Coluna cromatográfica de vidro de 5cm de diâmetro e 100cm de altura
Coluna cromatográfica de vidro de 1,5cm de diâmetro e 100cm de altura
Reagentes e meios de cultura:
D-glicose
Peptona bacteriológica
Fosfato de potássio dibásico
Cloreto de sódio
Ágar batata dextrosado
Extrato de levedura
Sulfato de magnésio hepta-hidratado
Hidróxido de sódio
N-methyl-N-nitroso-p-toluenosulfonamida – Diazald
Acetato de etila
Diclorometano
Hexano
Álcool metílico
d-clorofórmio
Metanol grau HPLC
Acetonitrila grau HPLC
Termômetro Incoterm, série 313675
Sílica gel 60G (Vetec) para cromatografia em camada delgada
Sílica gel (Vetec 70-230 mesh) pra cromatografia em coluna
Sílica gel (Sigma 230-400 mesh) para cromatografia em coluna flash
Preparo de meios de cultura: Meio base 1 (Lucas et al., 2007)
36
Tabela 2 – Meio de cultura utilizado no crescimento de Penicillium sclerotiorum
Ingrediente Concentração (g.L-1)
Glicose 20
Peptona de carne bacteriológica 5 Fosfato de potássio monobásico 1
Cloreto de sódio 5
Sulfato de magnésio hepta-hidratado 0,5
Meio base 2
O meio base 2 foi preparado conforme descrito para o meio base 1, porém, utilizando 50% da concentração dos ingredientes. A solução obtida foi transferida para recipiente adequado e esterilizado em autoclave vertical a 121 ºC por 15 min.
Meio base 3 (Martins, 2009)
Os ingredientes listados na Tabela 3 foram dissolvidos em quantidade suficiente de água para alcançar a concentração desejada. A solução obtida foi transferida para recipiente adequado e esterilizado em autoclave vertical a 121 ºC por 15 min.
Tabela 3 – Meio de cultura utilizado no crescimento de Beauveria bassiana
Ingrediente Concentração (g.L-1)
Glicose 20
Peptona de carne bacteriológica 10
Extrato de levedura 0,5
Ágar batata dextrosado
Foi preparado segundo instruções do fabricante. Em um béquer foram adicionadas quantidades de ágar batata dextrosado e água suficientes para alcançar a concentração de 39 g.L-1. Este béquer foi aquecido em forno de microondas até fusão do ágar. A preparação obtida foi transferida para recipiente adequado e esterilizada em autoclave vertical a 121 ºC por 15 min.
Ágar Sabouraud
37 obtida foi transferida para recipiente adequado e esterilizada em autoclave vertical a 121 ºC por 15 min.
Preparo de diazometano (Hudlicky, 1980)
Em um balão de fundo redondo, foram adicionados 200 mL de etanol P.A. e 100 mL de hidróxido de sódio a 10%. Em um funil de separação foram adicionados 10,4 g de Diazald diluídos em 80 mL de éter etílico P.A.. Conforme a montagem (Figura 17), a solução etérea foi gotejada no balão lentamente, devido ao risco de explosão, em temperatura controlada de 60 ºC. O diazometano, diluído em éter etílico, foi recolhido em um erlenmeyer.
Figura 17 – Montagem das vidrarias na preparação de diazometano
Preparo de solução de esclerotiorina 20 mg.mL-1:
38
MÉTODOS
4.1
–
Manutenção dos micro-organismos
Os fungos da coleção do La B são armazenados como uma suspensão de esporos em glicerol 12% a -86 ºC. Os fungos a serem utilizados foram retirados do armazenamento, transferidos para geladeira (a 8 ºC) onde permaneceram por dois dias. Em seguida, retirou-se uma alíquota desta suspensão e inoculou-se em uma placa de Petri contendo ágar batata dextrosado (Takahashi et al., 2008).
4.2
–
Preparo do extrato de
Penicillium sclerotiorum
Um pedaço do cultivo do Penicillium sclerotiorum no ágar em placa de petri foi recortado e transferido para um tubo contendo ágar batata dextrosado inclinado. Após três dias, a biomassa do fungo foi retirada do meio inclinado por meio de raspagem com alça de platina, utilizando água esterilizada e inoculado em erlenmeyer de 250 mL contendo 100 mL de meio base 1.
Este erlenmeyer foi mantido sob agitação em agitador rotatório a 100rpm, a temperatura ambiente durante 3 dias, e após crescimento, o conteúdo foi transferido para erlenmeyers de maior capacidade, totalizando 7 litros de meio base 2. O crescimento ocorreu durante 21 dias, à temperatura ambiente, sem agitação.
39 Todas as frações orgânicas obtidas, juntamente com o solvente que havia sido deixado em contato com o micélio, foram reunidas e concentradas em evaporador rotativo, a 65 ºC, utilizando vácuo.
4.3
–
Purificação da esclerotiorina
A presença de esclerotiorina (20) no extrato foi comprovada por cromatografia em camada delgada (CCD), sendo purificada por cromatografia em coluna de sílica. O extrato foi solubilizado em diclorometano, e a esta solução foi incorporada uma quantidade de sílica que ocupasse aproximadamente o mesmo volume de extrato utilizado. Após a evaporação do solvente, feita em evaporador rotativo a 50 ºC, a sílica contendo o extrato e foi adicionada lentamente ao topo da coluna.
A partir daí, foi dado início ao processo de eluição, retirando-se frações de 250 mL. A ordem dos eluentes utilizados encontra-se listada na Tabela 4. Cada fração retirada da coluna foi evaporada em evaporador rotativo a 65 º C, utilizando vácuo.
Tabela 4 – Eluentes utilizados na coluna cromatográfica de purificação da
esclerotiorina
Fração Eluente
1 Hexano
2 a 3 Hexano + Diclorometano 85:15 4 a 5 Hexano + Diclorometano 50:50 6 a 7 Hexano + Diclorometano 25:75
8 a 14 Diclorometano
15 a 16 Diclorometano + Acetato de etila 97:3 17 a 20 Diclorometano + Acetato de etila 95:5
21 a 22 Metanol
40 50 mL. Cada fração foi analisada por CCD, constatando-se que as frações 4 a 15 estavam aparentemente puras. Desta forma, elas foram combinadas, analisadas por CCD e uma pequena parte desta amostra foi submetida à análise de ponto de fusão.
Parte desta amostra (20mg) foi enviada para análise por RMN. Como solvente foi utilizado clorofórmio deuterado (CDCl3).
4.4
–
Biotransformação da esclerotiorina pelo
Beauveria bassiana
4.4.1 – Cultivo de B. bassiana e biotransformação
Um frasco de armazenamento contendo o fungo Beauveria bassiana foi retirado do ultra-freezer, transferido para um tubo de ensaio contendo meio ágar batata inclinado, onde ficou por quatro dias, à temperatura ambiente. Após crescimento, a biomassa foi transferida, por meio de raspagem com alça de platina, para erlenmeyer de 250 mL, contendo 100 mL de meio base 1.
Foi feita uma biotransformação em duas etapas, procedimento que consiste em se cultivar o fungo em meio de cultura apropriado e, posteriormente, transferir sua biomassa para um recipiente contendo somente água destilada adicionada do composto a ser biotransformado. Isso permite que as duas etapas sejam otimizadas separadamente.
Em ensaios de biotransformação em duas etapas, na etapa de obtenção de massa celular (fase de cultivo) o meio de cultura pode ser enriquecido de nutrientes, o que permite o desenvolvimento mais rápido do micro-organismo. O meio usado na biotransformação propriamente dita, ao contrário, deve ser bem simples, contendo basicamente um tampão, solução fisiológica, ou apenas água destilada, como foi utilizado no experimento realizado. Nessas condições, não são disponibilizados nutrientes para o micro-organismo, impedindo sua multiplicação (crescimento), mas sua massa celular continua viável por um período, biotransformando compostos que sejam adicionados ao cultivo. Algumas vantagens deste processo em relação ao processo de uma única etapa são: menor tempo de transformação, maior concentração de substrato, controle mais fácil de reações e facilidade na extração e purificação do produto (Medeiros, 2002).
41 agitação, à temperatura ambiente, o conteúdo de cada erlenmeyer foi filtrado a vácuo, em funil de Buchner, e o micélio foi transferido para um outro erlenmeyer de 500 mL contendo apenas 200 mL de água destilada esterilizada.
Dos onze erlenmeyers contendo o micélio do fungo imerso em água destilada, um foi utilizado como controle do fungo e dez foram utilizados para a realização da biotransformação, sendo que nesses, foi adicionado 1 mL de solução de esclerotiorina (20) em acetato de etila na concentração de 20 mg.mL-1. Também foi adicionado 1 mL desta solução em outro erlenmeyer de 500 mL contendo 200 mL água destilada estéril, de modo a servir como controle do substrato. Todos os erlenmeyers utilizados, os dez do experimento da biotransformação e os dois controles foram incubados sob agitação a 100 rpm durante 14 dias, à temperatura ambiente.
Após este período, em cada erlenmeyer o micélio foi separado por filtração a vácuo em funil de Buchner. O filtrado foi transferido para um funil de separação e extraído 3 vezes utilizando 60 mL de acetato de etila. O solvente foi removido em evaporador rotativo a 65 ºC a vácuo
4.4.2 – Análise e purificação de biotransformado
O extrato foi analisado por CCD, primeiramente utilizando como solvente diclorometano e, depois, diclorometano/acetato de etila 98:2. Nenhum produto com Rf próximo ao da esclerotiorina (20) foi observado, porém, observou-se uma mancha vermelha mais polar, perto do ponto de aplicação da amostra. Desta forma, foi feita outra CCD, utilizando como solvente acetato de etila e como eluente diclorometano/acetato de etila 75:25, sendo observadas cinco manchas vermelhas. Estas manchas não foram encontradas no perfil cromatográfico dos dois controles, e foram classificadas como produtos novos, provavelmente, produtos de biotransformação.
42
4.5
–
Obtenção de produtos de síntese com diazometano
4.5.1 – Síntese
Foram adicionados 900 mg de esclerotiorina (20) em um balão de fundo redondo, e 100 mL de éter etílico. Após a dissolução total da amostra, o diazometano previamente preparado foi adicionado lentamente até se verificar o desaparecimento total das bolhas. A amostra foi deixada em repouso por 10 min e, em seguida, levada ao evaporador rotativo para evaporação do solvente e, consequentemente, o término da reação (Hudlicky, 1980).
4.5.2 – Análise e purificação
O produto da reação foi analisado por CCD, utilizando diclorometano como solvente e diclorometano/acetato de etila 98:2 como eluente, em comparação com um padrão de esclerotiorina (20). Estas condições evidenciaram a formação de dois novos compostos com o RF próximo ao da esclerotiorina (20), um mais polar e outro menos polar, sendo que este último estava em maior quantidade.
O derivado sintético mais polar que a esclerotiorina (20) foi separado através de cromatografia em coluna. Foram retiradas 18 frações, sendo que o derivado foi eluído com diclorometano. Análises de CCD mostraram que o derivado estava puro. Desta forma, uma parte foi separada para análise do ponto de fusão. O material foi enviado para análise por RMN, utilizando clorofórmio deuterado (CDCl3) como solvente. O
produto teve sua estrutura determinada como sendo o 1-metil-esclerotiorina (64).
4.6
–
Biotransformação do 1-metil-esclerotiorina pelo
Beauveria bassiana
4.6.1 – Cultivo do B. bassiana e biotransformação
O procedimento utilizado para a biotransformação do 1-metil-esclerotiorina (64) foi o mesmo utilizado no item 4.4.1.
4.6.2 – Análise e purificação do produto biotransformado
43 Através de cromatografia em coluna de sílica flash (230-400 mesh), foi possível isolar o produto vizualizado por CCD nas frações coletadas com diclorometano/acetato de etila 80:20.
4.7
–
Obtenção de outros derivados da esclerotiorina
4.7.1 – Triagem de fungos
Para verificar outras possibilidades de produção de novos biotransformados, foram selecionadas 14 espécies de fungos da coleção do LaB , e, juntamente com o
Beauveria bassiana, foi feita uma triagem. Os fungos utilizados foram:
Absidia cylindrospora
Aspergillus parasiticus
Beauveria bassiana
Cladosporium sphaerospermum
Clonostachys rosea f catenulata
Microsporum gypseum
Mucor plumbeus
Paecilomyces lilacinus
Paecilomyces varioti
Penicillium janthinellum
Pestalotiopsis palustris
Rhizopus oryzae
Rhizopus stolonifer
Syncephalastrum racemosum
Thamnostylum sp.
44 dos erlenmeyers contendo cada fungo. O segundo erlenmeyer não recebeu a substância e foi utilizado como controle. Foi adicionado 0,5 mL de solução de esclerotiorina (20) em acetato de etila (20 mg.mL-1). Os erlenmeyes foram deixados sob as mesmas condições de agitação e temperatura durante 14 dias.
Após este período, o conteúdo de cada frasco foi filtrado a vácuo com funil de Buchner, o micélio foi separado, e o meio foi transferido para um funil de separação. Procedeu-se uma extração com três volumes de 30 mL de acetato de etila, que foi posteriormente evaporado, dando origem aos extratos. O extrato de cada fungo, assim como seus respectivos controles, foram analisados por CLAE.
O extrato da biotransformação da esclerotiorina (20) pelo Beauveria bassiana
em duas etapas obtido no item 4.4.1 também foi analisado por CLAE. Este resultado foi comparado com o resultado do ensaio do B. bassiana descrito neste tópico para estimar qual dos experimentos (o primeiro, em duas etapas, ou o segundo, em uma etapa) alcançou maior rendimento. Um extrato do Penicillium sclerotiorum (item 4.2) também foi analisado por CLAE para obter o tempo de retenção dos metabólitos deste fungo, inclusive o tempo de retenção da esclerotiorina (20).
4.7.2 – Análise por CLAE
Cada extrato em metanol (1 mg.mL-1) foi filtrado com uma membrana com poros de 0,45 µm de tamanho e transferido para frasco devidamente identificado. Foram injetados 20 µL de cada amostra no cromatógrafo. Como fase estacionária foi utilizada uma coluna de polaridade inversa (C18). Como fase móvel, foi utilizado um gradiente de misturas de acetonitrila e água deionizada, contendo 0,05% de ácido fórmico (conforme Tabela 5), com um fluxo constante de 1 mL/min. Foram utilizados solventes de grau HPLC para a eluição e preparo das amostras. Os solventes, assim como a água, passaram por processo de desgaseificação anterior ao seu uso.
Tabela 5 – Gradientes de eluição utilizados na análise do HPLC
Tempo de análise (min) Acetonitrila (%) Água (%)
0 50 50
30 100 0
45 O detector foi ajustado para os comprimentos de onda 470 e 530 nm. Entre uma análise e outra, a coluna foi lavada por 15 min com acetonitrila/água (1:1) (Castro, 2008).
Para comparação dos tempos de retenção entre diferentes amostras, foi calculado o intervalo de confiança da média dos tempos de retenção da esclerotiorina (20) nas diferentes amostras, e este foi extrapolado como o intervalo de confiança do método. O intervalo de confiança é calculado pela fórmula:
Equação 1 – Intervalo de confiança
onde é a média dos tempos de retenção da esclerotiorina (20), t é o coeficiente de t student e EPM é o erro padrão da média. O erro padrão da média pode ser calculado pela fórmula a seguir, onde é o desvio padrão populacional e n é o número de amostras.
Equação 2 – Erro padrão da média
O coeficiente t é obtido da tabela de distribuição de t student (Anexo 1), levando-se em conta a confiabilidade e o número de graus de liberdade, obtido por GL = n-1. (Pimentel-Gomes, 2000)
4.8
–
Identificação do
Cladosporium sphaerospermum
No início deste trabalho, o fungo C. sphaerospermum era o único que ainda não tinha tido sua taxonomia determinada. Sua identificação foi realizada no Instituto de Ciências Biológicas da UFMG, sob a supervisão da Profª Drª Maria Aparecida de Resende, como descrito a seguir, a partir de seu microcultivo em ágar sabouraud.
46 armazenado a 37 ºC em uma placa de Petri estéril com um pedaço de algodão embebido em água glicerinada (Funder, 1968).
47
RESULTADOS E DISCUSSÃO
5.1
–
Produção e extração da esclerotiorina de
Penicillium sclerotiorum
Penicillium sclerotiorum é um fungo filamentoso que apresenta coloração esverdeada. Geralmente, o meio utilizado para seu cultivo fica alaranjado após alguns dias, devido à produção de metabólitos secundários. Após três dias de cultivo em tubo com ágar batata inclinado, o fungo apresentou bom crescimento e esporulação (Figura 18).
Figura 18 – Penicillium sclerotiorum em ágar batata inclinado após 3 dias. Frente
(A) e verso (B) do tubo.
O meio base 1 foi escolhido por ter apresentado resultados satisfatórios em outros trabalhos desenvolvidos no laboratório relacionados a crescimento de fungos filamentosos (Bracarense, 2008; Carvalho, 2009). Este meio possui quantidades suficientes de fontes de carbono, nitrogênio, além de minerais necessários para o crescimento deste fungo. Após três dias neste meio, o fungo apresentava quantidade satisfatória de biomassa, sem indícios aparentes de contaminação. Os micélios estavam homogêneos, e o meio apresentava coloração alaranjada, sem turvação, o que, caso acontecesse, poderia ser um indício de contaminação por leveduras e/ou bactérias.
48 ter uma superfície de contato do meio de cultura com o ar maior, uma vez que o P. sclerotiorum é um micro-organismo aeróbio. O meio foi preparado com metade da concentração dos constituintes, com o objetivo de que os nutrientes se esgotassem mais rapidamente e os micro-organismos alcançassem mais rapidamente a fase estacionária, onde acontece a produção de metabólitos secundários. O crescimento foi realizado até o 21º dia, quando o meio de cultura apresentou uma forte coloração alaranjada.
Após a extração do conteúdo total de meio de cultura, foram obtidos 3,07 g de extrato.
5.2
–
Purificação da esclerotiorina
A estrutura da esclerotiorina (20), assim como a numeração dos átomos de carbono, encontra-se na Figura 19.
Figura 19 – Estrutura molecular da esclerotiorina
A presença de esclerotiorina (20) no extrato foi averiguada por cromatografia em camada delgada utilizando diclorometano como solvente e diclorometano/acetato de etila (98:2) como eluente. Um padrão de esclerotiorina (20) pura também foi aplicado na placa. Como o composto pesquisado possui uma forte coloração alaranjada, neste caso não foi necessária a utilização de agentes reveladores (Figura 20). Nestas condições, a esclerotiorina (20) apresentou um fator de retenção Rf = 0,37.
49
Figura 20 – Cromatografia em camada delgada
comparativa do padrão de esclerotiorina (A) e o extrato de
Penicillium sclerotiorum (B)
Figura 21 – Coluna cromatográfica de purificação da esclerotiorina em três