CAMPUS
JABOTICABAL
AVALIAÇÃO DA FUNÇÃO RENAL DE CÃES SADIOS E
NEFROPATAS CRÔNICOS SOB DIFERENTES BLOQUEIOS
MEDICAMENTOSOS DO SISTEMA
RENINA-ANGIOTENSINA-ALDOSTERONA
Alexandre Martini de Brum
Medico VeterinárioCAMPUS
JABOTICABAL
AVALIAÇÃO DA FUNÇÃO RENAL DE CÃES SADIOS E
NEFROPATAS CRÔNICOS SOB DIFERENTES BLOQUEIOS
MEDICAMENTOSOS DO SISTEMA
RENINA-ANGIOTENSINA-ALDOSTERONA
Alexandre Martini de Brum
Orientador: Profa. Dra. Marileda Bonafim Carvalho
7HVHDSUHVHQWDGDj)DFXOGDGHGH&LrQFLDV$JUiULDV
H 9HWHULQiULDV ± 8QHVS&DPSXV GH -DERWLFDEDO
FRPR SDUWH GDV H[LJrQFLDV SDUD D REWHQomR GR WtWXORGH'RXWRUHP0HGLFLQD9HWHULQiULDiUHDGH FRQFHQWUDomRHP&OtQLFD0pGLFD9HWHULQiULD
Brum, Alexandre Martini de
B893a Avaliação da função renal de cães sadios e nefropatas crônicos sob diferentes bloqueios medicamentosos do sistema renina-angiotensina-aldosterona / Alexandre Martini de Brum. – – Jaboticabal, 2011
xiii, 107 f. ; 28 cm
Tese (doutorado) - Universidade Estadual Paulista, Faculdade de Ciências Agrárias e Veterinárias, 2011
Orientadora: Marileda Bonafim Carvalho
Banca examinadora: Mácia Mery Kogika, Sandra Regina Ribeiro da Silva, Mirela Tinucci Costa, Áureo Evangelista Santana
Bibliografia
1. Sistema renina-angiotensina-aldosterona. 2. Nefropatia. 3. Bloqueio medicamentoso. I. Título. II. Jaboticabal-Faculdade de Ciências Agrárias e Veterinárias.
CDU 619:616.61:636.7
A Deus, por iluminar meu caminho, me dar força para vencer obstáculos e pelas bênçãos recebidas ao longo da vida;
Aos meus pais, pelo exemplo, dedicação e sacrifício para que eu pudesse realizar meus sonhos;
Aos meus irmãos, Angela, Adriana e Roberto, pelo incentivo e força que sempre me deram;
À minha noiva Amanda, pela paciência, apoio, carinho e amor. O teu amor e companheirismo tornaram esta conquista possível;
Às minhas avós, Haydée, Catarina e Carmem, que infelizmente não estão presentes, mas o amor e carinho delas sempre ficarão guardados no meu coração;
À Nádia, pela amizade e carinho em todos esses anos;
À Profa. Dra. Marileda Bonafim Carvalho, pela oportunidade oferecida e orientação;
Aos colegas do “Antro do HV”, João Paulo, Beto, Daniel Gerardi, Gustavinho, Andrigo, Vassora, Bozo, Marcão, Linguiça, Dedo, Serginho, Sandro e Cida, pela amizade. Vocês são verdadeiros irmãos e a nossa amizade sempre ficará guardada no coração;
Aos professores do Departamento de Clínica e Cirurgia Veterinária da FCAV da Unesp – Campus Jaboticabal, pela amizade e conhecimentos transmitidos ao longo da residência e pós-graduação;
Ao Prof. Gener Tadeu, pelo auxílio na análise estatística;
Aos animais, os meus verdadeiros incentivadores, Parkinho, Fausto, Gusmão, Ed, Monique, Thor, Fred, Sansão, Dalila, Cristal, Joca, Kika, entre tantos outros pacientes e animais de experimentação, que muitas vezes me ensinaram lições que nenhum humano seria capaz;
LISTA DE ABREVIATURAS... i
LISTA DE TABELAS... ii
LISTA DE FIGURAS... iii
RESUMO... iv
ABSTRACT... v
CAPITULO I Considerações Gerais... 1
REFERÊNCIAS... 21
CAPÍTULO II - AVALIAÇÃO DA FUNÇÃO RENAL DE CÃES SADIOS SOB DIFERENTES BLOQUEIOS MEDICAMENTOSOS DO SISTEMA RENINA-ANGIOTENSINA-ALDOSTERONA RESUMO... 33
1. INTRODUÇÃO... 33
2. MATERIAL E MÉTODOS... 36
3. RESULTADOS... 41
4. DISCUSSÃO... 48
5. CONCLUSÕES... 55
REFERÊNCIAS... 56
CAPÍTULO III - AVALIAÇÃO DA FUNÇÃO RENAL DE CÃES SADIOS E NEFROPATAS SOB DIFERENTES BLOQUEIOS MEDICAMENTOSOS DO SISTEMA RENINA-ANGIOTENSINA-ALDOSTERONA RESUMO... 61
1. INTRODUÇÃO... 62
2. MATERIAL E MÉTODOS... 65
3. RESULTADOS... 70
4. DISCUSSÃO... 78
5. CONCLUSÕES... 84
REFERÊNCIAS... 85
LISTA DE ABREVIATURAS
AII Angiotensina II
Ccr Clearance de creatinina CFK Carga filtrada de potássio
CFNa Carga filtrada de sódio
CTGF Fator de crescimento do tecido conjuntivo
DRC Doença renal crônica
ECA Enzima conversora da angiotensina EFK Excreção fracionada de potássio
EFNa Excreção fracionada de sódio
ExK Excreção renal de potássio
ExNa Excreção renal de sódio
FSR Fluxo sangüíneo renal
iECA Inibidores da enzima conversora da angiotensina
PAI-1 Inibidor do ativador do plasminogênio tipo 1
PTH Paratormônio
RTK Reabsorção tubular de potássio
RTNa Reabsorção tubular de sódio
SNGFR Taxa de filtração glomerular por nefron isolado
Tf Tempo final
TFG Taxa de filtração glomerular
TGF-ȕ Fator de crescimento transformador-beta
LISTA DE TABELAS
CAPITULO II
1 . Protocolos terapêuticos para inibição do SRAA, visando a produzir bloqueio farmacológico, utilizados no experimento GPNUV-UNESP – Jaboticabal, 2011. 38
2 . Médias ± DP e avaliação estatística de Scr, Sur, Spt, Salb, Sna e Sk de cães sadios submetidos a diferentes protocolos de inibição do SRAA. GPNUV-UNESP – Jaboticabal, 2011.
43
3. Médias ± DP e avaliação estatística de densidade urinária, PU, U-P/C, Ccr e PAS de cães sadios submetidos a diferentes protocolos de inibição do SRAA. GPNUV-UNESP – Jaboticabal, 2011.
44
4. Médias ± DP e avaliação estatística de EFNa, CFNa, ExNa e RTNa de cães sadios submetidos a diferentes protocolos de inibição do SRAA. GPNUV-UNESP – Jaboticabal, 2011.
45
5. Médias ± DP e avaliação estatística de EFK, CFK, ExK e RTK de cães sadios submetidos a diferentes protocolos de inibição do SRAA. GPNUV-UNESP – Jaboticabal, 2011.
46
CAPÍTULO III
1. Protocolos terapêuticos para inibição do SRAA, visando a produzir bloqueio farmacológico, utilizados no experimento GPNUV-UNESP – Jaboticabal, 2011. 67
2. Médias ± DP e avaliação estatística de Scr, Sur, Spt e Salb do GS e GDRC submetidos a diferentes protocolos de inibição do SRAA. GPNUV-UNESP – Jaboticabal, 2011.
73
3. Médias ± DP e avaliação estatística de Sna, Sk, densidade urinária e Pu do GS e GDRC submetidos a diferentes protocolos de inibição do SRAA. GPNUV-UNESP – Jaboticabal, 2011.
74
4. Médias ± DP e avaliação estatística de U-P/C, Ccr e PAS do GS e GDRC submetidos a diferentes protocolos de inibição do SRAA. GPNUV-UNESP – Jaboticabal, 2011.
75
5. Médias ± DP e avaliação estatística EFNA, CFNa, ExNa e RTNa do GS e GDRC submetidos a diferentes protocolos de inibição do SRAA. GPNUV-UNESP – Jaboticabal, 2011.
76
6. Médias, ± DP e avaliação estatística EFK, CFK, ExK e RTK do GS e GDRC submetidos a diferentes protocolos de inibição do SRAA. GPNUV-UNESP – Jaboticabal, 2011.
LISTA DE FIGURAS
CAPITULO II
1 - Representações gráficas das médias, erro padrão e análise estatística
de Pu, U-P/C, Ccr, PAS, ExNa e ExK de cães sadios submetidos a diferentes protocolos de inibição do SRAA. GPNUV-UNESP – Jaboticabal, 2011.
AVALIAÇÃO DA FUNÇÃO RENAL DE CÃES SADIOS E NEFROPATAS CRÔNICOS SOB DIFERENTES BLOQUEIOS MEDICAMENTOSOS DO SISTEMA
RENINA-ANGIOTENSINA-ALDOSTERONA
RESUMO - A função renal está sob influência de diversos hormônios, entre eles
podemos citar o sistema renina-angiotensina-aldosterona (SRAA), que possui importante papel na manutenção do volume circulante e equilíbrio eletrolítico, entretanto também está relacionado com a progressão da doença renal. Entre seus efeitos deletérios, pode-se citar a hipertensão arterial e glomerular, proteinúria e glomeruloesclerose. Em Medicina, o tratamento medicamentoso da doença renal crônica consiste na utilização de inibidores da enzima conversora da angiotensina (iECA), antagonistas dos receptores da angiotensina II (ATAII) e/ou antagonistas da aldosterona, na forma de bloqueios simples, duplo ou triplo. Entretanto, somente o primeiro grupo de medicamentos é utilizado em Medicina Veterinária. Para testar a hipótese, que os bloqueios duplos e triplos possam beneficiar animais portadores de DRC, o presente estudo teve como objetivo avaliar a função renal de cães sadios e nefropatas submetidos a protocolos diferentes de inibição do SRAA. Os animais foram submetidos a terapias isoladas ou combinadas com cloridrato de benazepril, losartan potássico e espironolactona, durante sete dias, sendo avaliados no último dia. As avaliações consistiam em bioquímica sérica, urinálise, U-P/C, Ccr, metabolismo do sódio e potássio, além da PAS. Nos cães sadios, as terapias com benazepril (isolado ou associado) induziram aumento da concentração sérica de potássio, enquanto os bloqueios, duplo e triplo, reduziram a PAS. Nos nefropatas, todas as terapias reduziram a proteinúria, enquanto as terapias associadas reduziram a PAS e a excreção renal de potássio.
EVALUATION OF RENAL FUNCTION OF HEALTHY AND CHRONIC NEPHROPATIC DOGS UNDER DIFFERENT MEDICAMENTOUS INHIBITION OF
RENIN- ANGIOTENSIN- ALDOSTERONE SYSTEM
SUMMARY - The renal function is under several hormones, like
renin-angiotensin-aldosterone system (RAAS), that have an important hole in the control of extravascular volume and electrolytic balance, however is related in the progression of renal disease, with proteinuria, glomerular hyperfiltration and glomerulosclerosis. In Medicine, the medical treatment of chronic renal failure consists in the use of ACE inhibitors, angiotensin II receptors antagonists (AIIRA) and/or aldosterone antagonists, however, only the first group is used in Veterinary Medicine. To prove the hypothesis that double or triple blockade can benefits animals with CRD, this study was conducted to evaluate the renal function of healthy dogs under different protocols of inhibition of RAAS. The dog received isolated ou associated therapies with benazepril, losartan and espironolactone, for seven days, with evaluation on the seventh Day. The evaluations consisted in serum biochemistry, urinalisis, UPC, Ccr, sodium and potassium metabolism, and SAP. In the healthy dog, the therapy with benazepril (isolated or associated) increased serum potassium levels, while the blockaded, duple or triple, decreased SAP. In nephropatic dogs, all therapies decreased proteinuria, while associated therapies decreased SAP and renal excretion of potassium.
Key-words: benazepril, losartan, spironolactone, proteinuria, glomerular filtration rate,
CAPÍTULO I – CONSIDERAÇÕES GERAIS
INTRODUÇÃO
A doença renal crônica (DRC) é uma importante condição encontrada na clínica de pequenos animais. Ela apresenta-se como grande desafio por diversos fatores. Além de haver muitas etiologias possíveis para a doença de base, os mecanismos compensatórios envolvidos na evolução da doença tornam esta condição irreversível e progressiva. Independente do local da injúria no parênquima renal, se ocorrer grande perda de néfrons, haverá resposta adaptativa, na tentativa de manter a taxa de filtração glomerular. Inicialmente, esta resposta é benéfica, mas ocasiona perda adicional de néfrons. Entre os mecanismos, envolvidos na progressão da DRC, podem ser citados a teoria da hiperfiltração glomerular, hiperparatiroidismo renal secundário, proteinúria, hipertensão arterial sistêmica, entre outros.
A teoria da hiperfiltração glomerular, inicialmente descrita em roedores, desempenha papel fundamental na progressão da DRC. Alterações hemodinâmicas nas arteríolas e tufo glomerular acarretam hipertensão no glomérulo e, consequentemente, hiperfiltração glomerular. No início do quadro, esta resposta aumenta a formação de ultrafiltrado de plasma por néfron, fazendo com que a função dos néfrons remanescentes compense a perda de parênquima renal funcional. Entretanto, com a progressão do quadro, também ocorre hipertrofia glomerular e, posteriormente, glomeruloesclerose. Desta forma, a resposta compensatória irá acarretar perda adicional de néfrons e diminuição da capacidade funcional dos rins, culminando em doença renal crônica.
glomerular, a dieta com restrição de proteínas e a terapia anti-hipertensiva, especialmente a direcionada à inibição da angiotensina II (AII).
A ativação do sistema renina-angiotensina-aldosterona (SRAA) parece desempenhar papel importante na progressão da DRC, principalmente em relação à hiperfiltração e hipertrofia glomerular. Os inibidores da enzima conversora da angiotensina (iECA), como benazepril e enalapril, são as medicações utilizadas em Medicina Veterinária, pois impedem a transformação da angiotensina I na sua forma ativa, a AII, reduzindo as ações deletérias deste hormônio. Os iECA são utilizados para reduzir a proteinúria e hipertensão arterial nos pacientes nefropatas. Em Medicina, além do uso de iECA, também há a indicação dos bloqueadores dos receptores de AII. Estas duas classes de fármacos podem ser usadas na forma de bloqueios simples (um fármaco) ou como bloqueio duplo (associação de dois fármacos que apresentem efeito sinérgico sobre a inibição do SRAA).
Estudos mais recentes também demonstraram o papel da aldosterona na progressão da doença renal e antagonistas da aldosterona, como a espironolactona e o eplerone, foram testados na terapia conservativa da DRC. Na Medina Veterinária, o uso de espironolactona está indicado em pacientes cardiopatas crônicos, para impedir a fibrose miocárdica induzida pela aldosterona. Entretanto, seu benefício no retardamento da progressão da DRC canina ainda não foi avaliado. A adição de um antagonista da aldosterona ao a um protocolo terapêutico para bloqueio duplo, caracteriza o bloqueio triplo do SRAA. Estudos atuais demonstraram o efeito benéfico do uso do bloqueio triplo em humanos com DRC.
bloqueio do SRAA, também devem retardara progressão da DRC em pacientes veterinários, principalmente por meio dos efeitos de redução da pressão arterial sistêmica e da proteinúria.
Com base nesta hipótese, o experimento teve como objetivo avaliar a função renal de cães sadios e doentes renais crônicos submetidos a diferentes bloqueios medicamentosos do SRAA, visando a estabelecer o papel destes tratamentos na redução da perda protéica urinária e da pressão arterial sistêmica em cães. Esta tese se compõe além deste, de outros dois capítulos. O segundo se refere à avaliação de função renal de cães sadios submetidos a seis protocolos diferentes de inibição do SRAA, o terceiro à comparação dos resultados de quatro protocolos entre cães sadios e nefropatas. Em cada uma das partes dos estudos realizados são descritos os métodos empregados, bem como os resultados e respectivas discussões e conclusões.
REVISÃO DE LITERATURA
Ações da Angiotensina II e da Aldosterona na Função Renal
Os rins são essenciais à homeostase, não apenas por eliminarem produtos indesejáveis do metabolismo, como também por manterem constante o volume extracelular, a pressão osmótica e o equilíbrio eletrolítico. Como órgãos endócrinos, ativam a vitamina D3 (calcitriol), produzem eritropoetina, renina, prostaglandinas e cininas, além de serem sítios de atuação dos hormônios vasopressina, AII, paratormônio (PTH) e aldosterona (POLZIN; OSBORNE, 1995).
sem alterar a concentração sérica da vasopressina, sugerindo a ação direta deste receptor no controle da reabsorção de água (KEISER et al., 1992). Os receptores AT1A, presentes predominantemente nos rins, apresentam papel fundamental na homeostase do sódio, sendo sua ação mediada somente pela AII, independentemente da presença de mineralocorticóides (OLIVERIO et al., 2000).
As ações hemodinâmicas renais da AII são importantes para o aumento da pressão arterial. A constrição da arteríola eferente, induzida pela AII, aumenta a pressão glomerular e, consequentemente, a filtração glomerular. Desta forma, há um aumento da pressão oncótica e diminuição da pressão hidrostática nos vasos peritubulares, favorecendo a reabsorção de sódio e água no túbulo contorcido proximal. O SRAA também aumenta a reabsorção de sódio e água por ação direta no transporte tubular renal. No túbulo contorcido proximal, os mecanismos de transporte de sódio são estimulados. Na membrana luminal, o antiporte Na+/H+, e na membrana basolateral, o cotransporte Na+/HCO
3- e a bomba Na+-K+ATPase aumentam a reabsorção de sódio e água (BREWSTER; PERAZELLA, 2004). O segmento inicial (S1) do túbulo contorcido proximal possui alta densidade de receptores de AII. Como esta porção é responsável pela reabsorção de 25% de sódio, a AII parece exercer papel importante no equilíbrio deste eletrólito (XIE et al., 1990). A AII também estimula a reabsorção de sódio por meio da ação da Na+-K+ATPase na porção ascendente da alça de Henle e dos canais de sódio nos ductos coletores corticais. A aldosterona ativa os receptores de mineralocorticóides nas células principais da porção distal do néfron, ativando os canais de sódio, aumentando a reabsorção deste eletrólito à custa do aumento da excreção renal de potássio (BREWSTER; PERAZELLA, 2004). O sistema calicreína-cinina contrabalança as ações do SRAA nos rins. Em condições de depleção de sódio, o SRAA estimula a produção renal de bradicinina por uma via não dependente dos receptores AT1 e de prostaglandina E2 por meio da ativação dos receptores AT1 (SIRAGY et al., 1996).
não foi capaz de restaurar a pressão arterial e a função renal. Entretanto, a AII foi capaz de restaurar os valores de pressão e função renal aos valores basais, antes da restrição de sódio e infusão de iECA (HALL et al., 1979).
O SRAA possui um papel importante no controle da taxa de filtração glomerular (TFG), principalmente durante estados de hiperreninemia. Apesar de ação na arteríola aferente, o controle da TFG ocorre por meio da constrição da arteríola eferente (HALL, et al., 1977). A AII pode alterar a função excretora renal modificando a hemodinâmica no órgão, nas condições em que haja hipofluxo sanguíneo para os rins. A AII reduz a TFG na tentativa de filtrar menos sódio, diminuindo a excreção deste eletrólito. Este fenômeno é conhecido como “feedback” túbulo-glomerular. A redução da TFG ocorre pela vasoconstrição renal, pelo aumento do tono simpático renal e facilitação da neurotransmissão adrenérgica (KASTNER et al., 1984). A infusão intra-renal de AII, inicialmente, reduziu a TFG e o fluxo sanguíneo renal de cães, entretanto os valores voltaram ao normal após o décimo dia de infusão. Após o término do período da infusão, os valores de TFG aumentaram, sugerindo que a supressão parcial do SRAA possa estar envolvida neste fenômeno (LOHMEIER; COWLEY, 1979). A redução do fluxo sanguíneo renal (FSR) é superior a queda da TFG, levando a aumento da fração de filtração. Este fenômeno ocorre, pois há constrição preferencial da arteríola eferente. A diminuição da TFG leva a uma redução da excreção de água e eletrólitos, contribuindo para o controle da volemia (LEVENS et al., 1981). Além disso, as células mesangiais são capazes de se contrair em resposta à AII. Este fenômeno diminui a área de superfície do tufo glomerular, desta forma, reduzindo a permeabilidade efetiva dos capilares glomerulares e, consequentemente, a TFG (FINCO, 1995).
Doença Renal Crônica
consequentemente, da função renal (POLZIN; OSBORNE, 1995). As doenças renais crônicas podem acometer os glomérulos ou a região túbulo-intersticial e podem levar a alterações clínicas e laboratoriais distintas (WRIGHT et al., 1976).
A DRC, principal afecção renal dos cães, reflete-se na perda da capacidade excretora e concentradora dos rins, com redução da filtração glomerular e consequente aumento nas concentrações plasmáticas de substâncias normalmente eliminadas (POLZIN et al., 1997). O aumento dessas substâncias causa grande variedade de sinais clínicos conhecida como síndrome urêmica, que incluem o desequilíbrio hídrico, anemia, intolerância a carboidratos, distúrbios neurológicos, distúrbios gastrintéricos, osteodistrofias (FINCO, 1995), deficiência imunológica, acidose metabólica e processos inflamatórios que predispõem fibrose e esclerose renais (OTS et al., 2000).
também levam a mudanças estruturais, como aumento no volume do tufo glomerular e no volume e número de células glomerulares (hipertrofia glomerular), colapso dos capilares glomerulares e aumento na deposição de matriz mesangial (glomeruloesclerose) (HOSTETTER et al., 1981).
As mudanças estruturais e funcionais são conhecidas como teoria da hiperfiltração. Nesta, a hipertensão e hiperfiltração glomerular levam a hipertrofia glomerular e, posteriormente, a glomeruloesclerose (GONIN-JMAA; SENIOR, 1995). A teoria da hiperfiltração, descrita em roedores, não pode ser diretamente extrapolada para os cães. Diversos estudos falharam em demonstrar a progressão da doença renal em cães, na mesma intensidade e com a mesma resposta de roedores (GONIN-JMAA; SENIOR, 1995). Estudos de micropunctura e morfológicos demonstraram hipertensão, hiperfiltração e hipertrofia glomerular, entretanto o desenvolvimento da glomeruloesclerose não foi intenso como em ratos (BROWN et al., 1990). Desta forma, apesar de ocorrer hipertensão, hiperfiltração e hipertrofia glomerular, além de glomeruloesclerose em cães com massa renal reduzida, o papel da hiperfiltração na progressão da doença dos cães ainda não está definida (GONIN-JMAA; SENIOR, 1995). O SRAA, pelo menos em parte, possui papel importante na hiperfiltração glomerular, uma vez que o aumento da concentração local da AII causa constrição da arteríola eferente, aumentando a pressão dentro do glomérulo (hipertensão glomerular), além de induzir hipertrofia glomerular (HOSTETTER et al., 1981).
Papel da AII e Aldosterona na Progressão da Doença Renal Crônica
conhecido como reflexo miogênico. No entanto, em casos de DRC, esse recurso é pouco responsivo, e toda mudança na pressão é transmitida diretamente para os rins. Os mecanismos autorregulatórios, que limitam as alterações da pressão arterial sistêmica na pressão capilar glomerular, evitando lesão glomerular em casos de hipertensão arterial, estão prejudicados em cães com massa renal reduzida. Desta forma, episódios de aumento de pressão sistêmica são transmitidos para os capilares glomerulares, ficando sujeitos a lesão (BROWN et al., 1995). Ademais, é importante ressaltar que animais com a pressão arterial sistêmica dentro da normalidade podem apresentar hipertensão renal (LEFEBVRE; TOUTAIN, 2004).
A vasoconstrição renal, mediada pela AII, é estimulada por, pelo menos, dois mecanismos que aumentam o influxo de cálcio nas células endoteliais, entretanto, um é responsivo aos bloqueadores dos canais de cálcio e o outro é insensível a estas medicações. A resistência da arteríola eferente, sensível à ação da AII, não é responsiva aos bloqueadores dos canais de cálcio, sendo regulada por mecanismos capazes de mobilizar o cálcio intracelular em resposta a AII (NAVAR, et al., 1986). Na condição de hiperfiltração associada com hipertensão glomerular, há aumento na expressão local do SRAA. A estimulação desta cascata, nas estruturas renais, aumenta a pressão capilar glomerular, devido à vasoconstrição da arteríola eferente, mediada pela AII. A hipertensão glomerular leva a um aumento da permeabilidade capilar e a um excesso de proteínas perdidas na urina (BREWSTER; PERAZELLA, 2004).
responsável pela produção do TGF-ȕ, que estimula a produção excessiva de matriz extracelular no mesângio, assim como sua contração (BORDER; NOBLE, 1998). Também ocorre fibrose túbulo-intersticial via TGF-ȕ (LEFEBVRE; TOUTAIN, 2004). Além de estimular a deposição de proteínas na matriz extracelular, a AII também inibe sua degradação ao inibir as proteases renais por meio do inibidor da ativação do plasminogênio tipo-1 (PAI-1) (MEZZANO et al., 2001). Outro mecanismo, indutor de deposição de fibronectina e colágeno tipo I em glomérulos e túbulos renais, são mediados pelo efeito pró-fibrogênico do fator de crescimento do tecido conjuntivo (CTGF) sintetizado a partir do estimulo da AII via receptores AT1 (RUPEREZ et al., 2003). A AII ativa células inflamatórias por quimiotaxia direta ou por produção de mediadores pró-inflamatórios, induzindo fibrose das estruturas renais (RUIZ-ORTEGA et al, 2001).
Os receptores de mineralocorticóides no glomérulo podem mediar ações como fibrogênese e esclerose, uma vez que as células mesangiais in vitro são estimuladas, pela aldosterona, a produzir colágeno tipo IV (HOSTETTER; IBRAHIM, 2003). Em ratos tratados com mineralocorticóides e sal, se desenvolveu hipertensão severa, lesão e inflamação renal, albuminúria e elevada expressão de citocinas pró-inflamatórias. A indução de injúria, inflamação e fibrose renal foi atenuada por um bloqueador seletivo da aldosterona, comprovando o papel deste hormônio na progressão da doença renal (BLASI et al., 2003). No modelo de rim remanescente, grande parte das lesões renais são infligidas pela aldosterona (GREENE, et al., 1996). Em modelo de nefroesclerose induzida por radiação em ratos, a aldosterona regulou a expressão do PAI-1, que está envolvido na progressão das glomerulopatias, por induzir glomeruloesclerose (BROWN et al., 2000). Em outro estudo com ratos, a infusão de aldosterona aumentou a expressão de TGF-ȕ urinário, citocina envolvida na fibrose renal (JUKNEVICIUS et al., 2004). A hipertensão arterial e glomerular, a glomeruloesclerose e a proteinúria são as principais alterações encontradas em modelos experimentais, relacionados à administração de aldosterona, e, consequentemente, estão envolvidos na progressão da doença renal (EPSTEIN, 2001).
Proteinúria e Hipertensão Arterial Sistêmica na Progressão da DRC
lisossomal (MEYER, 2003). Além disso, a exposição de células tubulares proximais à albumina e transferrina, em quantidades superiores a capacidade das células de digeri-las, leva a produção de mediadores que induzem inflamação e fibrose no interstício renal (DONADELLI et al., 2000; BENIGNI; REMUZZI, 2001). Lipídeos de baixo peso molecular ligados a proteínas e componentes do sistema complemento, quando filtrados, podem induzir inflamação e contribuir para fibrose túbulo-intersticial (MEYER, 2003). A dislipidemia leva a formação de apolipoproteinas, que, quando eliminadas pelos rins, causam danos semelhantes à proteinúria (DOWN; KRAWIEC, 1996).
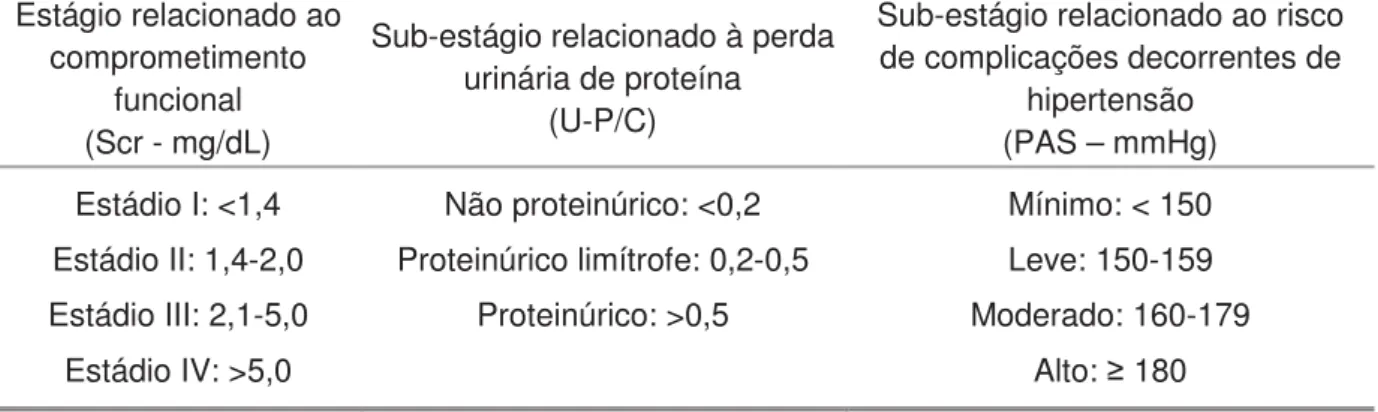
A proteinúria é rotineiramente mensurada por fitas reagentes, contudo essa metodologia pode apresentar erros. Sendo assim, a quantificação da proteína excretada em 24 horas ou o cálculo da U-P/C (razão proteínas/ creatinina urinárias) são métodos mais fidedignos, servindo de parâmetros indicativos da progressão da doença (TRYGGVASON; PETTERSSON, 2003; GRAUER, 2005; BURANAKARL et al., 2007). Valores de U-P/C superiores a 0,5 podem indicar o início de lesão renal (LEES, 2004). Em cães, valores de U-P/C 1 estão associados a um maior risco de desenvolvimento de crise urêmica, progressão da DRC e morte (JACOB et al., 2005).
aumento de U-P/C e maiores escores de lesão renal, que em cães nefropatas normotensos (FINCO, 2004).
Tratamento da DRC
O objetivo do tratamento de pacientes com DRC é retardar a progressão da doença (LEFEBVRE; TOUTAIN, 2004). Atualmente, em medicina veterinária, a terapia se apóia em dois pilares: nutrição e iECA (GONIN-JMAA; SENIOR, 1995). O suporte nutricional tem sido considerado como ponto chave no controle da insuficiência renal canina (REFSAL et al., 2001). Dietas com teores reduzidos de proteína, fósforo, sódio e a suplementação de ácidos graxos ômega-3 podem ser benéficos (POLZIN et al., 1997). As dietas indicadas para nefropatas trazem diversos benefícios aos pacientes. A restrição de proteínas está relacionada com a redução da hiperfiltração glomerular (POLZIN et al., 1983a). Este fenômeno, relacionado à ingestão de proteínas desenvolve papel importante na progressão da doença renal de diversas espécies, e sua inibição por meio de dietas com baixo teor de proteínas é essencial no retardo da progressão da doença renal (GONIN-JMAA; SENIOR, 1995). Além disso, a restrição de proteínas evita o desenvolvimento de crises urêmicas, melhorando a condição clínica dos pacientes (POLZIN et al., 1983a). A restrição de fósforo, que acompanha a restrição protéica, é importante para evitar o desenvolvimento do hiperparatireoidismo renal secundário. A normalização das concentrações séricas de fósforo impede o desenvolvimento da osteodistrofia renal, além de outras complicações graves desta síndrome endócrina (POLZIN et al., 1982). Os benefícios da restrição de fosfatos são evidenciados a longo prazo (POLZIN et al., 1983b).
Utilização do Bloqueio do SRAA no tratamento da DRC
da ECA é a degradação da bradicinina, que possui ação vasodilatadora e natriurética. Desta forma, a ECA age regulando o balanço entre as ações vasodilatadoras e natriuréticas da bradicinina e as vasoconstritoras e anti-natriuréticas da AII (BROWN; VAUGHAN, 1998). Os iECA aumentam o fluxo sanguíneo renal e diminuem a resistência vascular renal, proporcionalmente ao grau de ativação do SRAA. Em nível glomerular, o efeito vasodilatador é mais acentuado nas arteríolas eferentes que nas aferentes. Assim sendo, a pressão hidrostática intraglomerular diminui, induzindo redução na fração de filtração, porém a filtração glomerular é mantida, pois o aumento do FSR compensa o declínio da fração de filtração. A SNGFR diminui com os iECA, entretanto o aumento do FSR compensa a queda na TFG (BATLOUNI et al., 1999).
O benazepril é o pró-fármaco do benazeprilat, que possui a capacidade de inibir a ECA. A biotransformação do benazepril, para benazeprilat ocorre principalmente no fígado. Dose única de 0,5mg/kg, por via oral, possui atividade máxima após uma hora e possui efeito por 72 horas (TOUTAIN et al., 2000). Possui eliminação biliar e renal, diferentemente de outros iECA, que possuem eliminação predominantemente renal. A meia-vida de eliminação é de 3,5 horas, mas fase terminal adicional foi observada em alguns cães (KING et al., 1995). Três dias após o término da administração, por 14 dias consecutivos, a atividade da ECA estava 44% da atividade basal (TOUTAIN et al., 2000). A administração repetida causa bioacumulação moderada de benazeprilat (KING et al., 1997). Após 15 dias, a concentração no pico e a área sob a curva foram 23% e 34% maiores, respectivamente, quando comparados com os valores após administração única (KING et al., 1995). Estudos farmacocinéticos do benazepril e enalapril, e seus metabólitos benazeprilat e enalaprilat, em cães com doença renal induzida, indicaram que há aumento da área sob a curva para o enalaprilat, mas não para o benazeprilat, sugerindo aumento da exposição à droga nos casos de falha renal (LEFEBVRE et al., 1999). O que não deve acontecer com benazepril em pacientes com lesão renal ou hepática, devido a sua meia-vida curta (TOUTAIN et al., 2000). Outros exemplos de iECA são: captopril, lisinopril e ramipril (BATLOUNI et al., 1999).
Entretanto, só há necessidade de interromper a terapia com iECA, se a concentração sérica de creatinina permanecer 30% superior ao basal, após dois meses do início da terapia (BAKRIS et al., 2000b).
Em diversos estudos com roedores nefropatas, terapia com iECA reduziu a hipertensão glomerular e reduziu a progressão da glomeruloesclerose. A redução da pressão glomerular ocorre pela diminuição da pressão arterial sistêmica e por evitar a ação vasoconstritora da AII na arteríola eferente renal (GONIN-JMAA; SENIOR, 1995). Em ratos com vasoconstrição severa da arteríola eferente, os iECA induziram dilatação intensa e queda importante na pressão glomerular. Este efeito foi mediado pelo aumento da concentração de bradicinina, que possui grande efeito vasodilatador na arteríola eferente, pois a administração conjunta de um antagonista específico de bradicinina aboliu o efeito da iECA (KON et al., 1993). Inicialmente, a redução da proteinúria, evidente no uso de iECA, está relacionada à vasodilatação arteriolar eferente induzida pelas bradicinina, e posteriormente, pela redução da deposição de matriz extracelular mesangial e glomeruloesclerose, induzida pela AII (TANAKA et al., 1994).
associado ou não com heparina, aumentou significativamente a TFG e reduziu a proteinúria em cães com DRC (TENHÜNDFELD et al., 2009).
O captopril induziu redução na secreção de aldosterona, retenção de potássio e natriurese em seres humanos hipertensos. O aumento da concentração sérica de potássio, associado ao balanço negativo de sódio, sugere que a natriurese, em parte, é induzida pela inativação do cambiador de Na+/K+, na porção distal do néfron. Este mecanismo de reabsorção de sódio é estimulado pela ação de mineralocorticóides, que, no caso da terapia com captopril, apresentam concentração sérica reduzida. Alterações hemodinâmicas renais causadas pela inibição do SRAA também podem estar envolvidas na natriurese, mas não possuem relação com a retenção de potássio (ATLAS et al., 1979).
A terapia com iECA também possui outros efeitos extra-renais. A utilização do benazepril, em felinos com doença renal induzida, reduziu significativamente a pressão arterial e as concentrações séricas de AII e aldosterona (WATANABE; MISHINA, 2007). Entretanto, com a inibição crônica com iECA, as concentrações séricas de AII e aldosterona podem aumentar, atingindo valores próximos ao do pré-tratamento, evento conhecido como “fenômeno de escape da ECA” (BROWN; VAUGHAN, 1998). Alguns pacientes podem apresentar respostas insuficientes, por não ocorrer bloqueio completo do SRAA na terapia com iECA, pois ocorre formação de AII por vias independentes da ECA (HOLLENBERG et al., 1998).
Em cães, o losartan, nas doses únicas entre 5 e 20 mg/kg, por via oral, apresenta uma biodisponibilidade de 23 a 33% e meia-vida de 108 a 153 minutos. Possui, principalmente, metabolização hepática e excreção biliar, ocorrendo recirculação enteroepática, que aumenta a meia-vida da droga. Após administração intravenosa de 3mg/kg, ocorre inibição de 89% da atividade da AII após cinco minutos, com declínio para 11% após 240 minutos (CHRIST et al., 1994). Outros exemplos de antagonistas dos receptores de AII são: valsartan, candesartan e ibesartan (TAVARES et al, 1999).
Em ratos espontaneamente hipertensivos, o losartan reduziu a pressão arterial e aumentou a TFG, a diurese e a excreção de sódio. A administração concomitantemente de inibidor da síntese de óxido nítrico aboliu ação anti-hipertensiva, assim como o aumento da TFG. Inibidores da ciclooxigenase e antagonistas dos receptores de bradicinina também aboliram o aumento da TFG e inibiram parcialmente a resposta diurética e natriurética do losartan. Desta forma, fica evidente a participação do óxido nítrico na ação anti-hipertensiva e hemodinâmica renal, assim como da bradicinina e prostaglandinas na hemodinâmica renal e excreção renal de água e sódio (MUÑOZ-GARCIA et al., 1995).
O losartan induz menor aumento na concentração sérica de potássio que os iECA, sendo a hipercalemia infrequente na população de risco que recebe antagonistas dos receptores de AII. A concentração sérica e excreção urinária de aldosterona reduzem de forma significante somente com a administração de enalapril, enquanto a administração de losartan possui efeito muito menor. Desta forma, o bloqueio do SRAA parece ser menos marcante com o losartan que com o enalapril, o que pode explicar esta diferença na homeostase de potássio (SCHMIDT et al., 2001). Humanos com baixa TFG, tratados com iECA (lisinopril) durante um mês, também apresentaram maior concentração sérica de potássio e menor de aldosterona, que os pacientes tratados com antagonistas dos receptores de AII (valsartan). Entre as possíveis explicações, estaria a inibição do SRRA mais eficiente pelo lisinopril (BAKRIS et al., 2000a).
observado, de forma significativa, aumento da TFG e diminuição da resistência vascular renal, de forma dose-dependente (BOVEÉ et al., 1991). Infusão contínua, na dose de 30μg/kg/min, reduziu a pressão arterial em cães com depleção de sal e desafiados com infusão de AII (MaCFADYEN et al., 1992). Em cães normotensos anestesiados, não foram evidenciados diminuição da pressão arterial e resistência vascular sistêmica, entretanto foi observado aumento da TFG, FSR, diurese e natriurese, além da diminuição da resistência vascular renal (CHAN et al., 1992). Em cães anestesiados com volume expandido por solução eletrolítica balanceada, a infusão de losartan (100μg/kg/min) aumentou de forma significativa a TFG e excreção fracionada de sódio (EFNa). Em cães sem expansão de volume extracelular, submetidos ao mesmo protocolo, não foram evidenciados aumentos significativos na TFG e EFNa, sugerindo que a ação do losartan não depende da excessiva ativação do SRAA (KREBS et al., 1999). Em cães nefrectomizados e com depleção de sódio, a infusão de losartan (100μg/kg/min) aumentou a TFG, o fluxo plasmático renal, a diurese e a excreção renal de sódio (SIRAGY et al., 1996).
O losartan induz redução marcante na reabsorção de fluidos e eletrólitos na porção proximal do túbulo contorcido proximal, entretanto é menos efetivo na porção distal do túbulo proximal. Em ratos, o losartan (10 mg/kg) inibiu o transporte de cloreto de sódio, de maneira mais eficiente que o captopril (3 mg/kg), mostrando grande potencial diurético, natriurético e clorurético (XIE et al., 1990).
hipertensos e proteinúricos com dose máxima de iECA (40mg/dia de lisinopril) não apresentaram redução da proteinúria ou pressão arterial após um mês da adição do losartan. Entretanto, foi evidenciado aumento na TFG (AGARWAL, 2001). O bloqueio duplo, com metade da dose de benazepril e valsartan, reduziu a proteinúria em humanos nefropatas crônicos não-diabéticos, de forma mais significativa que a dose máxima das medicações isoladas (CAMPBELL et al., 2003).
Em cães, a infusão intrarrenal de metabólito ativo do losartan induziu incremento de 14% no FSR e de 7% na TFG, além de aumentar a excreção renal de água, sódio e uréia. Redução marcante na resistência arteriolar também foi evidente (-25% na arteríola eferente e -14% na arteríola aferente). A administração concomitante (bloqueio duplo) ou posterior de captopril causou um aumento adicional no FSR (+8%) e redução na resistência arteriolar (-6% na arteríola eferente e -8% na aferente), entretanto não houve aumento significativo na TFG. O efeito na vasodilatação renal, causado pelo iECA, foi abolido pela administração de antagonista da bradicinina, evidenciando que a resposta vasodilatadora renal superior dos iECA está relacionada com a ação da bradicinina (HELLER et al., 1997).
Uma das prováveis explicações, para o sinergismo entre iECA e bloqueadores dos receptores de AII, está na redução marcante da concentração tecidual renal de AII. Em ratos, a associação de captopril e losartan resultou em diminuição significativa da concentração plasmática e tecidual renal de AII, quando comparada com as terapias isoladas, mesmo que em doses máximas (KOMINE et al., 2002). O bloqueio duplo também reduz a concentração sérica de aldosterona de forma mais efetiva que os bloqueios simples (BIANCHI et al., 2005).
Estudos atuais tem demonstrado benefícios na adição de antagonistas da aldosterona na terapia dos nefropatas crônicos, pois o fenômeno de escape da aldosterona pode ocorrer em aproximadamente 40% dos pacientes com nefropatia diabética (SCHJOEDT et al., 2004).
aldosterona foi responsável pela diminuição da secreção renal de hidrogênio e potássio e da reabsorção de sódio (HULTER et al., 1981). Entretanto, em doses menores, a espironolactona não demonstrou efeito sobre a diurese e excreção renal de sódio em cães saudáveis, somente houve redução na excreção renal de potássio em 14% e 22%, quando administrada a dose de 1 e 2mg/kg, respectivamente (JEUNESSE et al., 2007). Em cães com doença degenerativa de valva mitral, a associação de iECA com espironolactona não alterou a concentração sérica de sódio e potássio, mas, após 20 semanas de tratamento, observou-se hipermagnesemia leve e, provavelmente, sem importância clínica (THOMASON et al., 2007). Em cães, a dose de 2mg/kg, uma vez ao dia, possui a capacidade de inibir em 88% a ação da aldosterona, enquanto 0,8mg/kg, inibe apenas 27,5% (GUYONNET et al., 2011).
REFERÊNCIAS1
AGARWAL, R. Add-on angiotensin receptor blockade with maximized ACE inhibition.
Kidney Int. Nova York. v. 59, p. 2282–2289, 2001
ATLAS, S. A. et al. Interruption of the renin-angiotensin system in hypertensive patients by captopril induces sustained reduction in aldosterone secretion, potassium retention and natriuresis. Hypertension. Dallas. v.1, p. 274-280, 1979
BAKRIS, G. L. et al. ACE inhibition or angiotensin receptor blockade: Impact on potassium in renal failure. Kidney Int. Nova York. v. 58, p. 2084–2092, 2000a
BAKRIS, G. L. et al.
Angiotensin-Converting Enzyme Inhibitor–Associated Elevations in Serum Creatinine. Is This a Cause for Concern? Arch Intern Med. Chicago. v. 160, p.685-693, 2000bBARTGES, J. W. et al. Hypertension and renal disease. Vet Clin North Am: Small Anim Pract. Filadélfia.v. 26 (6), p.1331-1345, 1996
BATLOUNI, M et al. Inibidores da enzima conversora da angiotensina In: BATLOUNI, M.; RAMIRES, J. A. F. Farmacologia e Terapêutica Cardiovascular. São Paulo, Atheneu, 1999, p. 287-303.
BENIGNI, A.; REMUZZI, G. How renal cytokines and growth factor contribute to renal disease progression. Am J Kidney Dis. Boston. v. 37, p. 21- , 2001
BIANCHI, S. et al. Antagonists of aldosterone and proteinuria in patients with CKD: an uncontrolled pilot study. Am J Kidney Dis. Boston. v. 46 (1), p. 45-51, 2005
BLASI, E. R. et al. Aldosterone/salt induces renal inflammation and fibrosis in hypertensive rats. Kidney Int. Nova York. v. 63, p. 1791-1800, 2003
BORDER, W. A.; NOBLE, N. A. Interactions of transforming growth factor-b and angiotensin II in renal fibrosis. Hypertension. Dallas. v. 31, p. 181–188, 1998
BOVEÉ, K. C. et al. Effects of the nonpeptide angiotensin II receptor antagonist DuP 753 on blood pressure and renal functions in spontaneously hypertensive PH dogs. Am
J Hypertens. Nova York. v. 4, p. 327-333, 1991
BREWSTER, U. C.; PERAZELLA, M. A. The rennin-angiotensin-aldosterone system and the kidney: effects on kidney disease. Am J Med. Tucson. v. 116, p. 263-272, 2004
BROWN, N. J.; VAUGHAN, D. E. Angiotensin-converting enzyme inhibitors. Circulation. Dallas.v. 97, p. 1411-1420, 1998.
BROWN, N. J. et al. Aldosterone modulates plasminogen activator inhibitor-1 and glomerulsclerosis in vivo. Kidney Int. Nova York. v. 58, p. 1219-1227, 2000
BROWN, S. A. et al. Single nephron adaptions to partial renal ablation in the dog. Am J
Physiol. Bethesda. v. 258, p. 495-503, 1990
BROWN, S. A. et al. Long-term effects of antihypertensive regimens on renal hemodynamics and proteinuria. Kidney Int. Nova York. v. 43, p. 1210-1218, 1993
BROWN, S. A. et al. Impaired Renal Autoregulatory Ability in Dogs With Reduced Renal Mass. J Am Soc Nephrol. Gainesville. v. 5, p. 1768-1774, 1995
BROWN, S. A. et al. Effects of the angiotensin converting enzyme inhibitor benazepril in cats with induced renal insufficiency. Am J Vet Res. Schaumburg. v. 62, p. 375–383, 2001.
BURANAKARL, C. et al. Relationships between degree of azotaemia and blood pressure, urinary protein:creatinine ratio and fractional excretion of electrolytes in dogs with renal azotaemia. Vet Res Communic. Edimburgo. v. 31, p. 245-257, 2007.
CAMPBELL, R. et al. Effects of combined ACE inhibitor and angiotensin II antagonist treatment in human chronic nephropathies. Kidney Int. Nova York. v. 63, p. 1094–1103, 2003.
CAREY, R. M. Renal dopamine system: paracrine regulator of sodium homeostasis and blood pressure. Hipertension. Dallas. v. 38, p. 297-302, 2001
CHAN, D. P. et al. Renal-specific actions of angiotensin II receptor antagonism in the anesthetized dog. Am J Hypertens. Nova York. v. 6, p. 354-360, 1992
CHRIST, D. D. et al. The pharmacokinetics and pharmacodynamics of the angiotensin II receptor antagonist losartan potassium (DuP 753/MK 954) in the dog. J Pharmacol Exp Ther. Bethesda. v. 268(3), p. 1199-1205, 1994.
CHRYSOSTOMOU, A. et al. Double-blind, placebo-controlled study on the effect of the aldosterone receptor antagonist spironolactone in patients who have persistent proteinuria and are on long-term angiotensin-converting enzyme inhibitor therapy, with or without an angiotensin II receptor blocker. Clin J Am Soc Nephrol. Gainesville. v. 1, p. 256-262, 2006
COWGILL, L. D.; KALLET, A. J. Systemic hypertension. In: KIRK, R. W. (ed) Current
Veterinary Therapy IX. Filadélfia, WB Saunders, 1986, p. 360-364
DONADELLI, R. et al. Protein traffic activates NF-ڡB gene signaling and promotes MCP-1-dependent interstitial inflammation. Am J Kidney Dis. Boston. v. 36, p. 1226- , 2000
EPSTEIN, M. Aldosterona and the hypertensive kidney: its emerging role as a mediator of progressive renal dysfunction: a paradigm shift. J Hypert. Milão. v. 19, p. 829-842, 2001.
FINCO, D. R., Evaluation of Renal Functions. In: OSBORNE, C. A.; FINCO, D. R.
Canine and Feline Nephrology and Urology. Baltimore: Williams e Wilkins. 1995,
p.29-46.
FINCO, D. R. Association of systemic hypertension with renal injury in dogs with induced renal failure. J Vet Intern Med. Malden. v. 18, p. 289-294, 2004
FURUMATSU, Y. et al. Effect of rennin-angiotensin-aldosterone system triple blockade on non-diabetic renal disease: addition of an aldosterone blocker, spironolactone, to combination treatment with an angiotensin-converting enzyme inhibitor and angiotensin II receptor blocker. Hypert Res. Tóquio. v. 31, p. 59-67, 2008.
GONIN-JMAA, D., SENIOR, D. F. The hyperfiltration theory: Progression of chronic renal failure and the effects of diet in dogs. J Am Vet Med Assoc. Schaumburg. v. 207, n. 11 p. 1411-1415, 1995.
GRAUER, G. F. et al. Effects of enalapril treatment versus placebo as a treatment for canine idiopathic glomerulonephritis. J Vet Intern Med. Malden. v. 14, p. 526-533, 2000
GRAUER, G. F. Canine glomerulonephritis: new thoughts on proteinuria treatment. J
Small An Pratic, Oxford, v. 46, p. 469-478, 2005.
GREENE, E. L. et al. Role of aldosterone in the remnant kidney model in the rat. J Clin Invest. Michigan. v. 98 (4), p. 1063-1068, 1996.
GUYONNET, J. et al. Preclinical pharmacokinetic and pharmacodynamic approach to determine a dose of spironolactone for treatment of congestive heart failure in dog. J
Vet Pharmacol Therap. Bethesda. v. 33 (3), p. 260-267, 2011.
HALL, J. E. et al. Control of glomerular filtration rate by renin-angiotensin system. Am J
Physiol.Renal Phy. Bethesda. v. 233(5), p. 366-372, 1977.
HALL, J. E. et al. Chronic blockade of angiotensin II formation during sodium deprivation. Am J Physiol. Bethesda. v. 237(6), p.424-432, 1979.
HELLER, J. et al. Comparative effects of the angiotensin II receptor blocker EXP 3174 and of the angiotensin-converting enzyme inhibitor captopril on renal glomerular hemodynamics in the dog. Kidney Blood Press Res. Praga. v. 20(6), p. 391-397, 1997.
HOLLENBERG, N. K. Aldosterone in the development and progression of renal injury.
Kidney Int. Nova York. v. 66, p. 1-9, 2004
HOLLENBER, N. K. et al. Pathways for angioten sin II generation in intact human tissue-evidence from comparative pharmacological interruption of the renin system.
Hypertension. Dallas.v. 32, p. 387–392, 1998
HOSTETTER, T. H. et al. Hyperfiltration in remnant nephrons: a potentially adverse response to renal ablation. Am J Physiol. Bethesda. v. 241, p. 85-92, 1981
HOSTETTER, T. H.; IBRAHIM, H. N. Aldosterone in chronic kidney and cardiac disease.
J Am Soc Nephrol. Gainesville. v. 14, p. 2395-2401, 2003
HULTER, H. N. et al. Renal and systemic acid-base effects of chronic spironolactone administration. Am J Physiol Renal Physiol. Bethesda. v. 240, p. 381-387, 1981
JACOB, F. et al. Evaluation of the association between initial proteinuria and morbidity rate or death in dogs with naturally occurring chronic renal failure. J Am Vet Med
JEUNESSE, E. et al. Effect of spironolactone on diuresis and urine sodium and potassium excretion in healthy dogs. J Vet Cardiol. Filadélfia. v. 9, p. 63-68, 2007
JOHNSON, R. J. et al. Renal injury from angiotensin II-mediated hypertension.
Hypertension. Dallas. v. 19, p. 464–474, 1992.
JUKNEVICIUS, I. et al. Effect of aldosterone on renal transforming growth factor-ȕ. Am
J Physiol Renal Physiol. Bethesda. v. 286, p. 1059-1062, 2004
KASTNER, P. R. et al. Control of glomerular filtration rate: role of intrarenally formed angiotensin II. Am J Physiol. Bethesda.v. 246, p. 897-906, 1984.
KAUFMANN, M. J. et al. Functional and hemodynamic adaptation to progressive renal ablation. Circulat Res. Dallas.v. 36, p. 286-293, 1975
KEISER, J. A. et al. Renal hemodynamic and excretory responses to PD 123319 and losartan, nonpeptide AT1 and AT2 subtype-specific angiotensin II ligands. J Pharmacol
Exp Ther. Bethesda. v. 262(3), p. 1154-1160, 1992.
KING, J. N. et al. Pharmacokinetics of the active metabolite of benazepril, benazeprilat, and inhibition of plasma angiotensi-converting enzyme activity after single and repeated administrations to dog. Am J Vet Res. Schaumburg. v. 56(12), p. 1620-1628, 1995.
KING, J. N. et al. Pharmacokinetics of the angiotensin-convertingenzym e inhibitor, benazepril, and its active metabolite, benazeprilat, in dog. Xenobiotica. Zug. v. 27 (8), p. 819-829, 1997
KOMINE, N. et al. Effect of combining an ACE inhibitor and an angiotensin II receptor blocker on plasma and kidney tissue angiotensin II levels. Am J Kidney Dis. Boston. v. 39(1), p.159-164, 2002.
KREBS, M. O. et al. Renal and hemodynamic effects of losartan in conscious dogs during controlled mechanical ventilation. Am J Physiol Renal Physiol. Bethesda. v. 276, p. 425-432, 1999
LEES, G. E. Early diagnosis of renal disease and renal failure. Vet Clin North Am. Small Animal Practice, Filadélfia, v. 34, p.867, 2004.
LEFEBVRE, H. P. et al. Effects of renal impairment on the disposition of orally administered enalapril, benazepril, and their active metabolites. J Vet Intern Med. Malden. v. 13(1), p. 21-27, 1999.
LEFEBVRE, H. P.; TOUTAIN, P. L. Angiotensin-converting enzyme inhibitors in the therapy of renal diseases. J Vet Pharmacol Therap. Bethesa. v. 27, p. 265-281, 2004.
LEVENS, N. R. et al. Role of the intrarenal renin-angiotensin system in the control of renal function. Circ. Res. Dallas. v.48, p. 157-167, 1981
LOHMEIER, T. E..; COWLEY Jr, A. W. Hypertensive and renal effects of chronic low level intrarenal angiotensin infusion in the dog. Circ. Res. Dallas, v. 44, p. 154-160, 1979.
LUÑO, J. et al. Effects of dual blockade of the renin-angiotensin system in primary proteinuric nephropathies. Kidney Inter. Nova York. v. 62, S. 82, p. 47–52, 2002
MA, J. et al. Local actions of endogenous angiotensin II in injured glomeruli. J Am Soc Nephrol. Gainesville. v. 15, p. 1268–1276, 2004
MEYER, T. W. Tubular injury in glomerular disease. Kidney Int. Nova York. v. 63, p. 774–787, 2003.
MEZZANO, S. A.; RUIZ-ORTEGA, M.; EGIDO, J. Angiotensin II and renal fibrosis.
Hypertension, Dallas. v. 38, p. 635–638, 2001.
MILLER, P.L.; et al. Glomerular hypertrophy accelerates hypertensive glomerular injury in rats. Am J Physiol. Bethesda. v. 261, p. 459–465, 1991.
MORI-TAKEYAMA, U. et al. Dual blockade of rennin-angiotensin system versus maximal recommended dose of angiotensin II receptor blockade in chronic glomerulonephritis. Clin Exp Nephrol. Kanagawa. v. 12, p. 33-40, 2008
MUÑOZ-GARCIA, R. et al. Acute renal excretory actions of losartan in spontaneously hypertensive rats: role of AT2 receptors, prostaglandins, kinins and nitric oxide. J
Hypertens. Milão. v. 13, p. 1779-1784, 1995.
NAVAR, L. G. et al. Effects of calcium channel blockade on renal vascular resistance responses to changes in perfusion pressure and angiotensin-converting enzyme inhibition in dogs. Circ Res. Dallas. v. 58, p. 874-881, 1986
OBERLEITHNER, H. Aldosterone makes human endothelium stiff and vulnerable.
Kidney Int. Nova York. v. 67, p. 1680-1682, 2005
OLIVERIO, M. I. et al. Regulation of Sodium Balance and Blood Pressure by the AT1A Receptor for Angiotensin II. Hypertension. Dallas. v. 35, p. 550-554, 2000
OTS, M.; PECHTER, U.; TAMM, A. Characteristics of progressive renal disease. Clin
Chimic Acta; Int J Clinic Chemistry, Amsterdam. v. 297, p. 29-41, 2000.
POLZIN, D. J. et al. Effects of modified protein diets in dogs with chronic renal failure. J
POLZIN, D. J. et al. Influence of modified protein diets on electrolyte, acid base, and divalent ion balance in dogs with experimentally induced chronic renal failure. Am J Vet Res. Schaumburg. v. 43, n. 11, p. 1978-1986, 1982
POLZIN, D. J. et al. Influence of reduced protein diets on morbidity, mortality, and renal function in dogs with induced chronic renal failure. Am J Vet Res. Schaumburg. v. 45, n. 3, p. 506-517, 1983b.
POLZIN, D. J. et al. Insuficiencia renal crônica In: ETTINGER, S. J.; FELDMAN, E. C.
Tratado de medicina interna veterinária, 4 ed. São Paulo: Manole, 1997. p.
2394-2431.
POLZIN, D. J.; OSBORNE, C. A. Pathophysiology of renal failure and uremia. In: OSBORNE, C. A.; FINCO, D. R. Canine and feline nephrology and urology, Williams and Wilkins: Baltimore. 1995. p. 335-367.
PONDA, M. P.; HOSTETTER, T. H. Aldosterone antagonism in chronic kidney disease.
Clin J Am Soc Nephrol. Gainesville. v. 1, p. 668-677, 2006
REFSAL, K. R. et al. Update on the diagnosis and treatment of disorders of calcium regulation. Vet Clin North Am. Small Animal Practice. Filadélfia. v. 31, n. 5, p.1043-1062, 2001.
ROCHA, R. et al. Aldosterone: a mediator of myocardial necrosis and renal arteriopathy.
Endocrinology. Chevy Chase. v. 141, p. 3871-3878, 2000
ROSS, L. A.; FINCO, D. R. Relationship of selected clinical renal function test to glomerular filtration rate and renal blood flow in cats. Am J Vet Res. Schaumburg. v. 42 (10), p. 1704-1710, 1981.
RUIZ-ORTEGA, M.; LORENZO, O.; RUPEREZ, M.; BLANCO, J.; EGIDO, J. Angiotensin II activates nuclear factor-kB via AT1 and AT2 receptors in the kidney. Am J Pathol. Bethesa. v. 158, p. 1743–1756, 2001.
RUPEREZ, M. et al. Angiotensin II increases connective tissue growth factor in the kidney. Am J Pathol. Bethesa. v. 163, p. 1937-1947, 2003
SCHJOEDT, K. J. et al. Aldosterone escape during angiotensin II receptor blockade in diabetic nephropathy is associated with enhanced decline in GFR. Diabetologia. Bristol. v. 47, p. 1936-1939, 2004
SCHMIDT, A. et al. The effect of ACE inhibitor and angiotensin II receptor antagonist therapy on serum uric acid levels and potassium homeostasis in hypertensive renal transplant recipients treated with CsA. Nephrol Dial Transplant. Oxford. v. 16 (5), p. 1034-1037, 2001.
SHEMESH, O. et al. Limitations of creatinine as a filtration marker in glomerulopathic patients. Kidney Int. Nova York. v. 28, p. 830-838, 1985
SHIIGAI, T.; SCHICHIRI, M. Late escape from the antiproteinuric effects of ACE inhibitors in nondiabetic renal disease. Am J Kidney Dis. Boston. v. 37, p. 477-483, 2001
SIRAGY, H. M. et al. Renin-angiotensin system modulates renal bradykinin production.
Am J Physiol. Bethesda
.
v. 271, p. 1090-1095, 1996.TAAL, M. W.; BRENNER, B. M. Renoprotective benefits of RAS inhibition: From ACEI to angiotensin II antagonists. Kidney Int. Nova York. v. 57, p. 1803–1817, 2000
TAVARES, A. et al. Antagonistas dos receptores da angiotensina II In: BATLOUNI, M.; RAMIRES, J. A. F. Farmacologia e Terapêutica Cardiovascular. São Paulo, Atheneu, 1999, p. 305-315
TENHÜNDFELD, J.; WEFSTAEDT, P.; NOLTE, I. J. A randomized controlled clinical trial of the use of benazepril and heparin for the treatment of chronic kidney disease in dogs. J Am Vet Med Assoc. Schaumburg. v.234(8), p.1031-1037, 2009.
THOMASON, J. D. et al. Influence of combined angiotensin-converting enzyme inhibitors and spironolactone on serum K+, Mg2+, and Na+ concentrations in small dogs with degenerative mitral valve disease. J Vet Cardiol. Filadélfia. v. 9, p.103-108, 2007
TOUTAIN, P. L. et al. Benazeprilat disposition and effect in dogs revisited with a pharmacokinetic/pharmacodynamic modeling approach. J Pharmacol Ex Therap. Bethesa. v. 292 (3), p. 1087-1093, 2000
TRYGGVASON, K.; PETTERSSON, E. Causes and consequences of proteinuria: the kidney filtration barrier and progressive renal failure. J Internal Med. Malden. v. 253, p. 216-224, 2003.
WATANABE, T.; MISHINA, M. Effects of benazepril hydrochloride in cats with experimentally induced or spontaneously occurring chronic renal failure. J Vet Med Sci. Tóquio.v. 69(10), p. 1015–1023, 2007
WRIGHT, N. G. et al. Chronic renal failure in dogs: A comparative clinical and morphological study of chronic glomerulonephritis and chronic interstitial nephritis. Vet Rec. Londres. v. 98, p. 288-293, 1976
WOLF, G. AngiotensinII as a mediator of tubulointerstitial injury. Nephorl Dial
WOOD, A. J. J. Angiotensin receptors and their antagonists. N Engl J Med. Massachusetts. v. 334, p. 1649-1654, 1996
CAPITULO II – AVALIAÇÃO DA FUNÇÃO RENAL DE CÃES SADIOS SOB DIFERENTES BLOQUEIOS MEDICAMENTOSOS DO SISTEMA RENINA-ANGIOTENSINA-ALDOSTERONA
RESUMO – A AII e a aldosterona possuem grande influência sobre a função renal. São
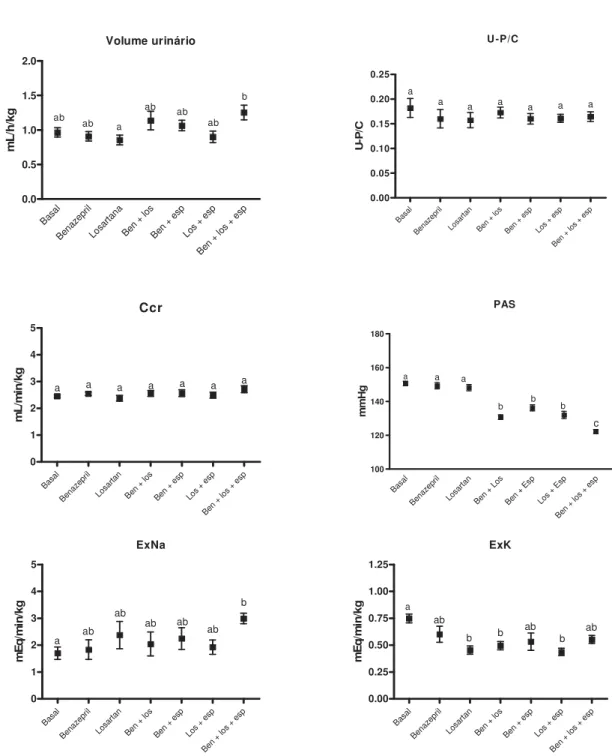
capazes de modular a TFG e a reabsorção tubular para exercer controle sobre a volemia, homeostase do sódio e potássio e pressão arterial sistêmica. Devido ao importante papel do sistema renina-angiotensina-aldosterona (SRAA) sobre o equilíbrio eletrolítico e a pressão arterial, o presente estudo teve como objetivo, avaliar a influência da inibição do SRAA sobre a função renal, equilíbrio eletrolítico e pressão arterial sistólica de cães sadios. Foram utilizados 11 cães, previamente selecionados clínica e laboratorialmente. Os animais foram tratados com cloridrato de benazepril, losartan potássico e espironolactona, de forma isolada ou combinada, durante sete dias, sendo avaliados no sétimo dia. As avaliações consistiam em bioquímica sérica, urinálise, razão proteína/creatinina urinária (U-P/C), clearance de creatinina (Ccr), metabolismo do sódio e potássio, além da pressão arterial sistólica (PAS). Os protocolos medicamentosos não alteraram a U-P/C, o Ccr e o volume urinário, entretanto, os bloqueios duplos e a tripla induziram diminuição da excreção renal de potássio e da PAS.
Palavras-chave: função renal, caninos, cloridrato de benazepril, losartan potássico,
espironolactona, pressão arterial, potássio
1 INTRODUÇÃO
no controle da TFG, por ação da AII na constrição da arteríola eferente (HALL, et al., 1977), e também por contração do mesângio (FINCO, 1995). Para a manutenção do volume circulante, os mecanismos de reabsorção de sódio e água são estimulados. Entre eles, podemos citar o antiporte Na+/H+, o cotransporte Na+/HCO
3-, a bomba Na+ -K+ATPase e os canais de sódio nos ductos coletores corticais. A aldosterona ativa os receptores de mineralocorticóides nas células principais da porção distal do néfron, ativando os canais de sódio, à custa da excreção de potássio e hidrogênio (BREWSTER; PERAZELLA, 2004). A ECA também possui papel importante na função renal, pois além de ativar a AII, também degrada a bradicinina, que possui ação vasodilatadora e natriurética (BROWN; VAUGHAN, 1998).
Medicações, capazes de modular a ação do SRAA, podem exercer influência direta sobre a função renal (BATLOUNI et al., 1999). Os iECA foram desenvolvidos para controle da hipertensão, entretanto, desde essa indicação inicial, várias outras já foram feitas. Em diversos estudos com roedores nefropatas, terapia com iECA apresentou papel importante na redução da hipertensão glomerular e na progressão da glomeruloesclerose. A redução da pressão glomerular ocorre pela diminuição da pressão arterial sistêmica e por evitar a ação vasoconstritora da AII na arteríola eferente renal, reduzindo, desta forma, a proteinúria (GONIN-JMAA; SENIOR, 1995). Inicialmente, a redução da proteinúria, evidente no uso de iECA, está relacionada à vasodilatação arteriolar eferente induzida pela diminuição da degradação das bradicininas, e posteriormente, pela redução da deposição de matriz extracelular mesangial e glomeruloesclerose, induzida pela AII, ambos eventos relacionados à diminuição da atividade da ECA (TANAKA et al., 1994). Em cães com DRC induzida, a terapia a longo prazo com enalapril alterou a hemodinâmica glomerular e a pressão arterial, reduzindo a proteinúria e a hipertensão glomerular, entretanto não teve influência evidente sobre a hipertrofia glomerular (BROWN et al., 2003).
bloqueio completo do SRAA na terapia com iECA, pois ocorre formação de AII por vias independentes da ECA (HOLLENBERG et al., 1998).
Outra modalidade de terapia, para inibição do SRAA, é a utilização de antagonistas dos receptores de AII, que possuem efeito equivalente aos iECAs (TAAL; BRENNER, 2000). O losartan apresentou efeito anti-hipertensivo em cães espontaneamente hipertensos (BOVEÉ et al., 1991). Em cães normotensos anestesiados, não foram evidenciados diminuição da pressão arterial e resistência vascular sistêmica, entretanto foi observado aumento da TFG, FSR, diurese e natriurese, além da diminuição da resistência vascular renal (CHAN et al., 1992).
A associação de iECA e bloqueadores dos receptores de AII recebe o nome de bloqueio duplo, e está indicado em humanos com doença renal diabética e não-diabética. Nos casos de glomerulonefrite crônica, o bloqueio duplo, com candesartan e benazepril, reduziu a proteinúria e a fração de filtração, de forma mais intensa que a terapia com candesartan isolado (MORI-TAKEYAMA et al., 2008). O bloqueio duplo (lisinopril e candesartan) foi avaliado em pacientes com nefropatias proteinúricas primárias, produzindo uma redução de 70% na proteinúria, enquanto bloqueios simples (lisinopril ou candesartan) decaíram os valores em apenas 30% (LUÑO et al., 2002).
Estudos atuais tem demonstrado benefícios na adição de antagonistas da aldosterona na terapia dos nefropatas crônicos, pois o fenômeno de escape da aldosterona pode ocorrer em aproximadamente 40% dos pacientes com nefropatia diabética (SCHJOEDT et al., 2004). O bloqueio triplo (iECA, bloqueadores dos receptores de AII e antagonistas da aldosterona) apresentou efeito superior na redução da proteinúria ao bloqueio duplo, em humanos com nefropatias não diabéticas (FURUMATSU et al., 2008).
2 MATERIAL E MÉTODOS
2.1 Animais
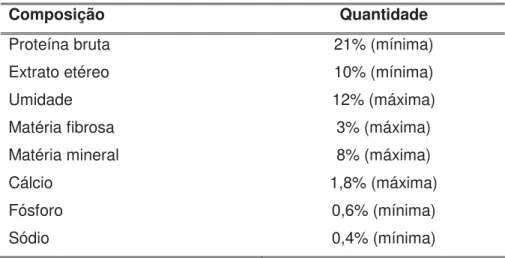
Origem, seleção e manutenção - foram inicialmente elegíveis para o estudo cães aparentemente sadios provenientes do canil mantido pelo Grupo de Pesquisa em Nefrologia e Urologia Veterinária (GPNUV) do Departamento de Clínica e Cirurgia Veterinária da FCAV-UNESP, campus Jaboticabal. Para a inclusão procedeu-se a avaliação inicial que consistiu de exame clínico geral com mensuração da pressão arterial sistêmica em três momentos diferentes e exames laboratoriais complementares. Estes incluíram hemograma, perfil bioquímico sérico (creatinina, uréia, proteínas totais, albumina, alanina-aminotransferase e fosfatase alcalina), urinálise e razão proteína/creatinina urinária (U-P/C). Foram excluídos os animais que apresentaram qualquer anormalidade indicativa ou sugestiva de doença. Os demais foram submetidos à mensuração do clearance de creatinina endógena de 4 horas (Ccr) para completar a verificação da função renal. Os cães que não apresentaram alterações clínicas, bioquímicas ou urinárias e cujos valores de Ccr estavam normais (1,9mL/min/kg), foram incluídos no estudo. Os cães foram mantidos em canil individual durante o período do experimento, com água e ração (tipo Premium) ad libitum. Para a avaliação do Ccr, os animais foram alojados, individualmente, em gaiolas metabólicas, com as dimensões apropriadas para o tamanho do cão, com água ad libitum, durante quatro horas.
Para a utilização dos animais, o projeto de pesquisa foi avaliado e aprovado pela Comissão de Ética no Uso de Animais da FCAV-UNESP (protocolo n°019302-10) (Anexo do certificado de aprovação pelo CEUA – Comissão de ética no Uso de Animais, Apêndice I).
2.2 Metodologia
Protocolo Experimental - Os cães foram submetidos a uma avaliação basal (controle negativo) e a outras seis avaliações, cada qual realizada no sétimo dia de tratamento com um dos seis protocolos terapêuticos de inibição do SRAA. Os fármacos utilizados para compor os protocolos terapêuticos foram cloridrato de benazepril2, como inibidor da enzima conversora da angiotensina (iECA), losartan potássico3, como bloqueador dos receptores da AII e espironolactona4, como antagonista da aldosterona. Os fármacos foram administrados isoladamente e também em combinação de dois ou três, de forma a constituir bloqueio simples, duplo ou triplo (Tabela 1). A duração de sete dias para tratamentos foi uniformizada, baseado no estado de equilíbrio para o benazepril, que é alcançado após uma a seis administrações (KING et al., 1995). O intervalo de sete dias entre os tratamentos foi escolhido, respeitando um intervalo superior a 10 meias-vida do benazepril, de 3,5 horas (KING et al., 1995), e losartan, de 108 a 153 minutos (CHRIST et al., 1994), e o período entre os tratamentos com espironolactona do estudo de GUYONNET et al. (2011). A dose de medicamentos utilizados em cada um dos pacientes está descrita na tabela F2 (apêndices). As medicações sempre foram administradas, pela manhã, entre 8:00 e 9:00. As avaliações, no sétimo dia, iniciavam duas horas após a administração das medicações.
As avaliações consistiram de exame físico com aferição da pressão arterial sistólica, hemograma, perfil bioquímico renal (concentrações séricas de uréia, creatinina, proteína total, albumina, sódio e potássio), urinálise, U-P/C, Ccr, excreção fracionada de sódio (EFNa) e de potássio (EFK), carga filtrada de sódio (CFNa) e de potássio (CFK), excreção renal de sódio (ExNa) e de potássio (ExK) e reabsorção tubular de sódio (RTNa) e de potássio (RTK).
2 Lotensin – Novartis, Jandira, SP, Brasil 3
Cozaar – Merck Sharp, São Paulo, SP, Brasil
Tabela 1. Protocolos terapêuticos para inibição do sistema renina-angiotensina-aldosterona, visando a produzir bloqueio farmacológico, utilizados no experimento. GPNUV-UNESP – Jaboticabal, 2011.
Tipo de
bloqueio Fármacos
Doses
respectivas (1x/dia)
Simples Benazepril 0,5mg/kg
Simples Losartan 5mg/kg
Duplo Benazepril + losartan 0,5mg/kg; 5mg/kg
Duplo Benazepril + espironolactona 0,5mg/kg; 2mg/kg
Duplo Losartan + espironolactona 5mg/kg; 2mg/kg
Triplo Benazepril + losartan + espironolactona 0,5mg/kg; 5mg/kg; 2mg/kg
Avaliação do Clearance de Creatinina Endógena - A avaliação do clearance de creatinina foi realizada por meio da técnica de 4 horas, conforme as recomendações feitas por FINCO (1995), com modificação feita por CARNEIRO (2002) que consistiu na exclusão da administração forçada de água.
Avaliação da Razão Proteínas Totais/Creatinina Urinária - Para a avaliação da razão proteínas totais/creatinina urinária, foram utilizadas as concentrações urinárias de proteínas e creatinina, conforme as recomendações feitas por FINCO (1995).
Avaliação das Excreções Fracionadas, Carga Filtrada, Excreção Renal e Reabsorção Tubular de Sódio e Potássio - Para o cálculo destas variáveis foram utilizadas as concentrações de creatinina e eletrólitos das amostras de urina e sangue coletadas durante o procedimento de clearance de creatinina, conforme as recomendações feitas por FINCO (1995).
Urinálise - O exame físico da urina foi realizado por meio da observação macroscópica, estabelecendo-se resultados para aspecto e cor. A densidade urinária foi mensurada em refratômetro digital5. A análise química da urina foi obtida por meio de fita reagente comercial6. Posteriormente foi realizada avaliação do sedimento urinário.
5Refratômetro de Mesa – UGI (1,000 – 1,050), Atago, Tókio, Japão