Universidade Estadual Paulista “Júlio de Mesquita Filho” - UNESP
Faculdade de Ciências Farmacêuticas de Araraquara - FCFAr
Departamento de Alimentos e Nutrição - DAN
Área de Ciências Nutricionais
JACQUELINE QUEIROZ DA SILVEIRA
BIODISPONIBILIDADE DE FLAVANONAS E ATIVIDADE ANTIOXIDANTE
DO SUCO DE LARANJA FRESCO
VERSUS
SUCO DE LARANJA
PASTEURIZADO EM HUMANOS SAUDÁVEIS
JACQUELINE QUEIROZ DA SILVEIRA
BIODISPONIBILIDADE DE FLAVANONAS E ATIVIDADE ANTIOXIDANTE
DO SUCO DE LARANJA FRESCO
VERSUS
SUCO DE LARANJA
PASTEURIZADO EM HUMANOS SAUDÁVEIS
Tese apresentada ao Programa de
Pós-graduação em Alimentos e Nutrição da
Faculdade de Ciências Farmacêuticas de
Araraquara, UNESP, como requisito para a
obtenção do título de Doutor em Ciências
Nutricionais.
ORIENTADOR: PROF. DR. THAÏS BORGES CÉSAR
Dedico este trabalho aos meus amados:
AGRADECIMENTOS
“Nenhum homem é uma ilha...” (John Donne), partindo desta premissa, quero enaltecer todas as pessoas que, de alguma forma, contribuíram para a realização deste trabalho, sou grata:
Primeiramente e sempre, à DEUS, pela bênção da vida.
À minha querida orientadora Profa. Dra. Thaïs Borges Cesar, pela orientação, dedicação, paciência,
amizade e acima de tudo pela confiança.
À Dra. Elizabeth A. Baldwin, pela oportunidade de realizar o doutorado-sanduíche no U.S. Horticultural Research Laboratory/ USDA. Uma experiência única.
Ao Dr. John A. Manthey pelas valiosas explicações e pela atenção dada a este trabalho.
Às amigas do Laboratório de Nutrição/DAN: Ana Lúcia, Cláudia, Danielle, Grace, Milena, Paula e Sara pelo companheirismo e momentos de descontração. Em especial, à Paula e à Milena, pela inestimável contribuição na execução da fase experimental.
Aos voluntários, pela disposição e generosidade.
À Veronica Cook, técnica do U.S. Horticultural Research Laboratory, pelo apoio e competência.
À comissão examinadora composta pelas Doutoras: Celia M. Sylos, Elizabeth A. Baldwin, Magali Monteiro e Neuza M. A. Hassimotto, pelas valiosas críticas e sugestões.
Às secretárias da pós-graduação, Cláudia, Daniela, Joyce e Flávia, pela atenção e competência.
À equipe do Laboratório de Análises Clínicas São Lucas, em especial ao Sérgio Valadão, pelo suporte durante os procedimentos de coleta das amostras.
À prof. Dra. Elisângela Piccinini, pela disponibilidade do Laboratório de Toxicologia.
Ao Thiago Carandina pela paciência e incentivo.
Ao Sr. Domingos e D. Carminha, pelas palavras de ânimo.
À Elena Branca que apesar do pouco tempo de convivência na Flórida se tornou uma grande amiga.
À Citrosuco S/A, pelo apoio à esta pesquisa, representada pelo Sr. Helton Leão.
SER FAMOSO OU SER IMPORTANTE...
“Você e eu sabemos que vamos morrer um dia. Desse ponto de vista, não é a morte que me importa, porque ela é um fato. O que me importa é o que eu faço da minha vida enquanto a minha morte não acontece, para que essa vida não seja banal, superficial, fútil, pequena…
A esta hora preciso ser capaz de fazer falta. No dia que eu me for eu quero fazer falta. Fazer falta não significa ser famoso, significa ser importante. Há uma diferença entre ser famoso e ser importante. Muita gente não é famosa e é absolutamente importante. Importar significa levar para dentro. Alguém me importa para dentro, me carrega.
Eu quero ser importante. Por isso, para ser importante eu preciso não ter uma vida que seja pequena. E uma vida se torna pequena quando ela é uma vida que só se apoia em si mesmo, fechada em si. Eu preciso transbordar. Eu preciso me comunicar. Eu preciso me juntar. Eu preciso me repartir nessa hora… Minha vida que, sem dúvida é curta, eu desejo que ela não seja pequena…”
LISTA DE ABREVIATURAS
AMU Atomic mass unit
ABTS 2,2 azobis, 3-ethylbenzothiozoline-6-sulphonic acid
AUC Area under the curve
BMI Body mass index
CMAX Concentração máxima
DMSO Dimethyl sulfoxide
DRI Dietary reference intake
FOJ Fresh orange juice
GLUC-HESP Glucuronide hesperitin GLUC-NAR Glucuronide naringenina GLUC-S-HESP Glucuronide sulfate hesperitin GLUC-S-HESP Glucuronide sulfate hesperitin
HMF Heptamethoxyflavone
HPLC High performance liquid chromatography
HPTN Hesperitin
HSP Hesperidin
HSP-S Hesperitin sulfate
ISR Isosakuranetin rutinoside
MDA Malondealdeído
NAR Naringenin
NR Narirutin
NOB Nobelitin
OJ Orange juice
POJ Pasteurized orange juice
SIN Sinensetin
TAN Tangeretin
TBARS Thiobarbituric acid-reactive substances
TMAX Tempo máximo
LISTA DE FIGURAS
Capítulo 1
Figura 1 Estrutura básica dos Flavonoides... 21
Figura 2 Estruturas químicas das subclasses de Flavonoides... 22
Figura 3 Estruturas glicosiladas das Flavanonas... 24
Figura 4 Caminhos metabólicos da Hesperidina e Narirutina... 29
Capítulo 2 Figura 1 The main flavanone glycosides... 73
LISTA DE TABELAS
Capítulo 1
Tabela 1 Estudos da Biodisponibilidade da Hesperitina... 35
Tabela 2 Estudos da Biodisponibilidade da Naringenina... 36
Tabela 3 Composição Nutricional do Suco de Laranja... 38
Capítulo 2
Tabela 1 Concentrations of flavanone glycosides and polymethoxylated flavones (µg
mL-1) in pasteurized orange juice and fresh orange juice... 69
Tabela 2 Contents of hydroxycinnamic acids (µg mL-1) in pasteurized orange juice and
fresh orange juice after saponification………... 69
Tabela 3 Percent of average contents (µg flavonoids) in the insoluble precipitated
pellets and in the soluble serum of pasteurized orange juice and fresh orange
juice………..…………...…..………… 70
Tabela 4 Pharmacokinetics parameters for hesperidin and naringin metabolites after
ingestion of fresh squeezed and commercially processed orange juice
metabolites in blood plasma………..………..……… 71
Tabela 5 Hesperidin and naringin metabolites excreted in urine 24 h by healthy human
after consumption of fresh squeezed and commercially processed orange
Capítulo 3
Tabela 1 Anthropometric and hemodynamic parameters of subjects……….…………... 82
Tabela 2 Dietary intake one week before the experiment with fresh squeezed and
commercially processed orange juice………. 83
Tabela 3 Biochemical parameters of subjects immediately before (time 0) the intake of
fresh squeezed and commercially processed orange juice ………..
84
Tabela 4 Composition of the main flavanones (hesperidin ant narirutin) in the orange
juices………... 85
Tabela 5 Biomarkers of oxidative at baseline, 4, 8 and 24 h post dose, of the intervention
RESUMO
As flavanonas (hesperidina e narirutina) presentes quase exclusivamente em laranjas são associadas
a diversos benefícios à saúde. O objetivo deste estudo foi analisar as diferenças dos parâmetros
farmacocinéticos dos metabólitos das flavanonas e a atividade antioxidante em humanos, após o
consumo de dois tipos de suco de laranja: fresco e pasteurizado. O suco fresco foi extraído com o
auxílio de um espremedor MJ-20 Basic e o pasteurizado (95ºC/15s) foi fornecido pela Citrosuco,
Matão-SP. Ambos os sucos foram obtidos a partir de laranjas Pera Rio do mesmo lote. Participaram
12 homens e 12 mulheres saudáveis, com 27 ± 6 anos, IMC de 24 ± 3 kg/m2, não-fumantes e que não
utilizavam nenhum tipo de hormônio ou suplementos dietéticos. Os voluntários ingeriram 11,5 ml/kg
de peso corporal de suco de laranja fresco e, após washout de 30 dias, ingeriram a mesma quantidade
de suco pasteurizado. Foi solicitado que os voluntários evitassem o consumo de alimentos cítricos
nos 3 dias precedentes aos dias experimentais e as refeições do dia (café da manhã, almoço e lanche
da tarde) foram fornecidas a fim de assegurar a abstenção de alimentos ricos em flavonoides. A urina
foi coletada durante 24 h e o sangue foi coletado em jejum, 3, 4, 5, 6, 7, 8 e 24 h após o consumo do
suco. Os metabólitos foram analisados no plasma sanguíneo e na urina por cromatografia líquida de
alta performance por ionização electrospray acoplada à espectrometria de massa (HPLC-ESI-MS). A
atividade antioxidante foi avaliada no soro sanguíneo por ABTS e TBARS, nos tempos: jejum, 4, 8
e 24 h. As concentrações de hesperidina e narirutina no suco de laranja comercialmente pasteurizado
foram 3,2 e 6,6 vezes maiores do que no suco fresco, respectivamente, e estes compostos foram
encontrados em grande parte na fração insolúvel (pellet) no suco pasteurizado, enquanto que
ocorreram quase completamente na fração solúvel (sobrenadante) no suco fresco. A análise
cromatográfica da urina mostrou concentrações de conjugados de ácido glicurônico e de grupos
metabólitos foram significativamente maiores após o suco de laranja pasteurizado. Os resultados dos
parâmetros farmacocinéticos mostraram que não houve diferenças significativas na Tmax para os
metabólitos de hesperidina e narirutina entre os sucos e, de modo geral, os valores de AUC e Cmax
dos metabólitos detectados foram superiores após a ingestão do suco de laranja pasteurizado
comparado ao suco de laranja fresco. As diferenças na farmacocinética dos metabólitos de flavanonas
não foram substancialmente influenciadas pelas diferentes distribuições nas formas solúveis e
insolúveis destes compostos. Os dois tipos de suco de laranja, fresco e pasteurizado, levaram ao
aumento da capacidade antioxidante e diminuição da concentração de malondialdeído, sugerindo que
o suco de laranja, independente do processamento, pode atuar na prevenção do estresse oxidativo
ABSTRACT
Flavanones (hesperidin and narirutin) present almost exclusively in oranges, are associated with
various health benefits. The aim of this study was to analyze the differences in the pharmacokinetic
parameters of the flavanones metabolites and antioxidant activity in humans after consumption of
two types of orange juice: fresh and pasteurized. Fresh orange juice (FOJ) is extracted with the aid of
a squeezer MJ-20 Basic and pasteurized (95°C/ 15s) was provided by Citrosuco Matão SP. Both
juices were obtained from Pera Rio oranges from the same batch. Participated 12 men and 12 healthy
women, 27 ± 6 years, BMI 24 ± 3 kg/m2, and non-smokers who did not use any hormones or dietary
supplements. Volunteers ingested 11.5 ml/kg body weight of fresh orange juice and after washout of
30 days, they ingested the same amount of pasteurized juice. Volunteers were asked to avoid
consumption of citrus foods in the preceding three days to the experiment and meals of the day
(breakfast, lunch and afternoon snack) were provided to ensure the avoidance of foods rich in
flavonoids. Urine was collected during 24 h and the blood was collected from fasting, 3, 4, 5, 6, 7, 8
and 24 h after the consumption of the juice. The metabolites were analyzed in plasma and urine by
high-performance liquid chromatography- electrospray ionization- mass spectrometry
(HPLC-ESI-MS). The antioxidant activity was evaluated in blood serum by ABTS and TBARS, at fasting, 4, 8
and 24 h. The concentrations of hesperidin and narirutina after the ingestion of commercially
pasteurized orange juice were 3.2 and 6.6 times higher than after fresh juice, respectively, and these
compounds have been found largely in the insoluble fraction (pellet) in pasteurized juice, while
occurred almost entirely in the soluble fraction (supernatant) in fresh juice. The urine
chromatographic analysis showed concentrations of conjugated of glucuronic acid and sulfate groups
significantly greater after the pasteurized orange juice. The results of the pharmacokinetic parameters
showed no significant differences in Tmax for metabolites of hesperidin and narirutin between juices
and, in general, the AUC and Cmax of the metabolites detected were higher after ingestion of
pasteurized orange juice compared to fresh orange juice. The differences in the pharmacokinetics of
metabolites of flavanones were not substantially influenced by different distributions in soluble and
insoluble forms of these compounds. The two types of orange, fresh and pasteurized juice led to
increased antioxidant capacity and decreased concentration of malondialdehyde, suggesting that the
orange juice, independent of processing, can act in the prevention of oxidative stress even after an
S U M Á R I O
INTRODUÇÃO GERAL ... 17
CAPÍTULO 1 – Revisão Bibliográfica ... 21
Flavonoides ... 21
Flavanonas (Hesperidina e Narirutina) ... 23
Efeitos Benéficos das Flavanonas sobre a Saúde ... 25
Metabolismo e Biodisponibilidade dos Flavonoides/ Flavanonas ... 26
Estudos sobre a Biodisponibilidade das Flavanonas ... 29
Polimetoxiflavonas ... 37
Suco de Laranja Fresco x Pasteurizado ... 37
OBJETIVOS ... 39
CAPÍTULO 2 – Pharmacokinetic of flavanones glycosides after ingestion of fresh squeezed versus commercially processed orange juice in healthy humans ... 46
ABSTRACT ... 47
INTRODUCTION ... 48
SUBJECTS AND METHODS ... 49
Subjects ... 49
Study design ... 50
Orange juices ... 51
Extraction of flavonoids in orange juice ... 51
Plasma and urine samples preparation ... 52
Analyses of flavanone metabolites in human plasma and urine ... 53
Plasma metabolites analysis ... 54
Statistical analysis ... 54
RESULTS... 55
Phenolic compounds in FOJ and POJ ... 55
Plasma and urine metabolites ... 56
Plasma kinetic data ... 57
Urine metabolites ... 58
DISCUSSION ... 59
REFERENCES ... 64
CAPÍTULO 3 – A single dose of fresh squeezed and commercially processed orange juices improved biomarkers of oxidative stress in humans ... 75
ABSTRACT ... 76
INTRODUCTION ... 77
CASUISTIC AND METHODOLOGY ... 78
Subjects ... 78
Orange juices ... 78
Study design ... 79
Anthropometric, biochemical, hemodynamic, and dietetic parameters ... 79
Orange juice analysis (flavanones and ascorbic acid) ... 80
Malondialdehyde (TBARS assay) ... 80
Antioxidant capacity (ABTS assay) ... 81
Statistical analysis ... 81
RESULTS... 82
Assessment of anthropometric, metabolic and blood pressure data... 82
DISCUSSION ... 86
CONCLUSION ... 88
REFERENCES ... 89
ANEXOS ... 92
Anexo 1. Aprovação Comitê de Ética ... 93
Anexo 2. Certificate of Approval - Western Institutional Review Board ... 94
APÊNDICES... 95
Apêndice 1. Termo de Consentimento Livre e Esclarecido (TCLE) ... 96
Apêndice 2. Recordatório de 24 horas (Rec24h) ... 99
Apêndice 3. Biodisponibilidade da Hesperitina e Naringenina ... 100
Apêndice 4. Gráfico comparativo da excreção urinária dos metabólitos após a ingestão de suco de laranja fresco e pasteurizado. ... 101
Apêndice 5. Cromatogramas representativos dos metabólitos de hesperitina e naringenina detectados na urina, após ingestão do suco de laranja. ... 102
INTRODUÇÃO GERAL
As frutas e os sucos cítricos possuem grandes quantidades de vitaminas, minerais,
carotenoides e flavonoides, que têm sido associados a benefícios à saúde humana (MARTI et al,
2009; SANCHEZ-MORENO et al, 2003). Os flavonoides cítricos, presentes naturalmente no
alimento ou em formas purificadas, têm efeitos biológicos em seres humanos e animais, como
antioxidantes, anti-inflamatórios, anti-hipertensivos e redução dos níveis de lipídios sanguíneos que,
efetivamente estão relacionados à prevenção de doenças cardiovasculares (RAMPRASATH et al,
2014; ROZA, XIAN-LIU e GUTHRIE, 2007; KUROWSKA e MANTHEY, 2004; KUROWSKA et
al, 2000; BOK et al, 1999). Estudos relatam que o consumo regular de suco de laranja aumenta a
atividade antioxidante do sangue (VAN ACKER et al, 2000) e reduz o nível de radicais livres
(VINSON e JANG, 2001), conferindo proteção contra o câncer e outras doenças crônicas
(MANTHEY, GUTHRIE e GROHMANN, 2001; BORRADAILE, CARROLL e KUROWSKA,
1999).
O suco de laranja é fonte dietética de flavonoides cítricos, as flavanonas (KAWAII et al,
1999), hesperidina e narirutina, os quais têm sido associados a atividades hipolipidêmicas (BOK et
al, 1999; SANTOS et al, 1999), anti-inflamatórias e anticancerígenas (MANTHEY e BENDELE,
2008; TANAKA et al, 1997; YANG et al, 1997). Nos alimentos, as flavanonas são moléculas
glicosiladas que são degradadas pelas enterobactérias presentes no intestino delgado e absorvidas
como compostos aglicona (hesperitina e naringenina) (KANAZE et al, 2007). Estes compostos são
absorvidos pelo cólon intestinal e fígado como evidenciado em estudos prévios de biodisponibilidade
(BRETT et al, 2009; KANAZE et al, 2007; MANACH et al, 2005; FRANKE et al, 2005; ERLUND
et al, 2000). Os monoglicuronídeos de hesperitina são os principais metabólitos das flavanonas
do suco, foram encontrados níveis baixos de hesperitina (<2 �mol/L), indicando uma
biodisponibilidade limitada destes compostose ainda, a excreção urinária relativa foi semelhante para
ambas as flavanonas, independente da dose (MANACH et al, 2003).
O processamento do suco de laranja influencia na concentração dos nutrientes e nas
quantidades dos compostos flavonoides nas frações solúvel e insolúvel (TOMÁZ-NAVARRO et al,
2014; GIL-IZQUIERDO, GIL e FERRERES, 2002). Os sucos de laranja prontos para o consumo
são divididos em categorias, entre elas encontram-se o NFC e o suco natural/fresco. O suco NFC,
termo inglês que significa “non-frozen concentrated”, é o suco pasteurizado que não passou pelo
processo de concentração ou diluição durante a produção, e ainda, não é acrescido de água ou
açúcares. O suco fresco/natural é o suco fornecido imediatamente após a extração, sem pasteurização
ou qualquer outro tratamento físico e químico, e por isso, tem curto prazo de validade (CITRUS BR,
2014).
O suco de laranja fresco apresenta maiores quantidades de vitamina C e ácido fólico, 125 mg
e 76 μg, respectivamente, enquanto os sucos pasteurizados apresentaram 86 mg de vitamina C e 46
μg de folato. Por outro lado, os sucos integrais e industrialmente pasteurizados apresentaram
aproximadamente o dobro da quantidade de flavonoides cítricos quando comparados ao suco fresco
(GIL-IZQUIERDO, GIL e FERRERES, 2002; USDA, 2014).
Existem poucos estudos científicos sobre a biodisponibilidade dos compostos flavonoides
presentes em laranjas e seus sucos, sendo que, a maioria utilizou o tratamento enzimático dos
compostos para melhorar a absorção dos mesmos, e ainda, não há nenhum trabalho mostrando a
farmacocinética dos metabólitos conjugados aos ácidos glicurônicos e grupos sulfatos, investigação
proposta no presente estudo. Os estudos de biodisponibilidade da hesperidina e narirutina, ocorridos
sucos comerciais com e sem o enriquecimento com hesperidina, homogeneizado a alta pressão e até
mesmo com a fruta in natura. A área sob a curva (AUC) da hesperitina variou entre 0,95 a 10,3
�mol/L/h, a concentração máxima (Cmax) apresentaram uma grande faixa, variando de 96 a 2.176
nmol/h, e o tempo de concentração máxima (Tmax) variou entre 4,4 a 7 horas após a ingestão do suco
ou da fruta. A porcentagem de absorção variou entre 0,4 e 2,4% e a excreção urinária relativa foi de
1,7 a 6,6 %, com a dose de hesperitina ingerida variando entre 18.8 a 220 mg. A dose ingerida de
narirutina foi menor em comparação à dose de hesperitina, variando entre 3.3 e 45.2, com uma
absorção de 0,15 a 3,12% e excreção urinária de 0,7 a 12,5% (TOMAZ-NAVARRO et al, 2014;
VALLEJO et al, 2010; BREDSDORFF et al, 2010; BRETT et al, 2009; MULLEN et al, 2008;
MANACH et al, 2003; ERLUND et al, 2000).
Baseados nas evidências dos efeitos benéficos dos flavonoides cítricos na prevenção e
controle de enfermidades crônicas é de interesse quantificar os metabólitos das flavanonas presentes
no sangue e na urina, compreender a diferença dos parâmetros farmacocinéticos e investigar a
capacidade antioxidante destes compostos presentes nos sucos de laranja comparando dois tipos de
CAPÍTULO 1 –
Revisão Bibliográfica
Flavonoides
Polifenóis são compostos fitonutrientes originados do metabolismo secundário dos vegetais,
caracterizados por um anel aromático com um ou mais grupos hidroxila. Existem pelo menos 8.000
compostos polifenólicos na natureza, incluindo flavonoides, álcoois fenólicos, lignanas, estilbenos e
ácidos fenólicos. Estes compostos agem na defesa das plantas contra a radiação ultravioleta, radicais
livres e agentes patogênicos27 e de acordo com estudos epidemiológicos, quando ingeridos exercem
proteção ao organismo humano contra doenças degenerativas (KANAZE et al, 2007; BAHADORAN
et al, 2013; SCALBERT et al, 2005).
Os flavonoides compõem um grupo de polifenóis que contém uma estrutura básica comum
formada por C6-C3-C6. A estrutura consiste em dois anéis aromáticos (A e B) unidos por três
carbonos, formando um anel pirano fechado (C) (Figura 1).
Figura 1 - Estrutura básica dos Flavonoides (Fonte: D'ARCHIVIO et al, 2007)
De acordo com o estado de oxidação do anel pirano os flavonoides são divididos em seis
subclasses: flavonóis, flavonas, flavanonas, isoflavonas, antocianidinas, flavanóis (Figura 2). Mais
FLAVONOL FLAVONA
FLAVANONA ISOFLAVONA
ANTOCIANIDINA FLAVANOL
Vegetais, chás e vinhos são as principais fontes alimentares dos flavonoides e os efeitos
benéficos do seu consumo sobre a saúde são suportados por evidências epidemiológicas. A relação
entre o consumo de flavonoides e a proteção contra doenças cardiovasculares tem sido estudada com
muita ênfase (BHULLAR et al, 2014; QURESHI et al, 2013; PFEUFFERet al, 2013) e, além disso,
os flavonoides tem mostrado capacidade de ação sobre a eliminação de radicais livres, propriedades
anti-inflamatórias, anticarcinogênese, antivirais e prevenção de doenças degenerativas relacionadas
à idade (PUSPARINI et al, 2013; MISHRA et al 2013; BEKING e VIEIRA, 2010).
Flavanonas (Hesperidina e Narirutina)
As flavanonas representam um pequeno grupo de compostos derivados dos flavonoides, que
incluem a hesperidina e a narirutina, presentes em laranjas, e a eriocitrina, encontrada especificamente
em limões. Em frutas cítricas, as flavanonas são responsáveis por aproximadamente 95% do conteúdo
total flavonoides (PETERSON et al, 2006). São caracterizadas pela presença de uma cadeia de três
carbonos saturados e um átomo de oxigênio no C4, sendo geralmente glicosiladas por um dissacarídeo
na posição C7 (D'ARCHIVIO et al, 2007). Este dissacarídeo pode ser uma neohesperidose, que
confere o sabor amargo, encontrada na naringina em grapefruit, ou uma rutinose, insípida, encontrada
na hesperidina em laranjas (CHANET et al, 2012).
As flavanonas contém vários glicosídeos de três principais agliconas: hesperitina, naringenina
e eridictiol que diferem-se pelas substituições de hidroxil e metoxil nos anéis A e B (Figura 1)
(BRETT et al, 2009). Nas laranjas, os principais glicosídeos são hesperidina
naringe-nina-7-O-glicuronídeo, naringenina-4-O-glicuronídeo) (Figura 3) (D'ARCHIVIO et al, 2007; LEUZZI,
2000).
A distribuição das flavanonas nos alimentos é limitada, ocorrendo teores elevados nas frutas
cítricas e seus sucos e sendo encontradas poucas quantidades em tomates e algumas plantas
aromáticas como a hortelã. Desta forma, indivíduos que consomem alimentos cítricos regularmente,
apresentam uma exposição relativamente alta a esta classe de flavonoides (PANDEY e RIZVI, 2009).
A ingestão diária de flavanonas agliconas em adultos foi estimada entre 2,7 e 78,0 mg
(ERDMAN et al, 2007; PEREZ-JIMENEZ, 2011)3, constituindoa maior parte de flavonoides totais
consumidos em diferentes países europeus (KNEKT et al, 2002). As diversas variedades de laranjas
e seus sucos tem sido apontados como os principais contribuintes para a ingestão das flavanonas
(ZAMORA-ROS et al, 2010).
Efeitos Benéficos das Flavanonas sobre a Saúde
Estudos anteriores de suplementação com suco de laranja ou com flavanonas na forma isolada,
tem demonstrado várias propriedades de proteção à saúde, como antioxidantes (SNYDER et al,
2011), hipolipidêmicas (APTEKMANN e CESAR, 2013), anti-hipertensivas (MORAND et al, 2011),
anti-inflamatórias (RIZZA et al, 2011) e antidiabéticas (YOSHIDA et al, 2013).
Os flavonoides presentes na laranja podem reduzir a oxidação pós-prandial, que é um
importante contribuinte para o desenvolvimento do estado de doenças crônicas. Um estudo crossover,
com 16 indivíduos (homens e mulheres), que utilizou 1) placebo (ácido ascórbico e açúcar,
equivalentes ao suco de laranja), 2) placebo mais hesperidina e 3) suco de laranja, mostrou que o
placebo com hesperidina e o suco de laranja aumentaram significativamente a capacidade
antioxidante no soro sanguíneo evidenciando que os compostos fenólicos da laranja contribuem
diretamente para a proteção oxidativa pós-prandial (SNYDER et al, 2011).
Aptekmann e Cesar (2013) compararam o perfil lipídico de homens e mulheres com níveis
sanguíneos de colesterol normais e moderadamente elevados, que consumiam suco de laranja por
longo prazo (≥ 12 meses) a indivíduos com as mesmas características, porém, não consumidores. Os
resultados mostraram que o grupo dos consumidores de suco, com ambos os níveis de colesterol,
apresentaram o colesterol total, LDL-c, ApoB e a razão LDL/HDL significativamente menores do
que os indivíduos homólogos não consumidores, concluindo que o consumo de suco de laranja a
longo termo está associado a baixos fatores de risco para doença cardiovascular.
Estudos sugerem que os efeitos anti-hipertensivos do suco de laranja estão associados às
flavanonas. Basile et al (2010) mostraram que o consumo de 500 mL/dia de suco de laranja
pasteurizado, durante 8 semanas, diminuiu significativamente a pressão arterial diastólica, em
menor (4 semanas) em homens de meia-idade e com excesso de peso, também evidenciou a
diminuição da pressão arterial diastólica.
Rizza et al (2011) elucidaram os mecanismos de ação da hesperitina na estimulação da
produção de NO que pode se opor a ações aterogênicas de citocinas pró-inflamatórias em células
endoteliais vasculares. O estudo demonstrou que o consumo oral diário durante três semanas de
hesperidina melhora a função endotelial, reduz a circulação de biomarcadores da inflamação e altera
favoravelmente o perfil lipídico em indivíduos com síndrome metabólica.
Segundo Yoshida et al (2013), a inflamação induzida pela obesidade contribui para o
desenvolvimento da resistência à insulina e do diabetes mellitus do tipo II e, recentemente, foi
evidenciado que receptores Toll-like (TLR) estão envolvidos neste processo. Assim, a regulação
adequada da expressão ou ativação das TLR’s é uma estratégia importante para melhorar a doenças
relacionadas à obesidade. Os pesquisadores mostraram que a naringenina, suprime a expressão da
TLR durante a diferenciação dos adipócitos e macrófagos e também inibe o fator de necrose
tumoral-α (TNF-tumoral-α). Estes resultados correlacionam-se com a supressão de mediadores inflamatórios e a
melhoria da hiperglicemia e tomados em conjunto, estes dados sugerem que a naringenina exibe
propriedades anti-inflamatórias e antidiabéticas.
Metabolismo e Biodisponibilidade dos Flavonoides/ Flavanonas
O metabolismo, a biodisponibilidade e a atividade biológica dos flavonoides dependem de
fatores como a configuração, o número total de grupos hidroxila e a substituição de grupos funcionais
sobre a sua estrutura nuclear (KUMAR e PANDEY, 2013; QURESHI et al, 2013). A
biodisponibilidade dos diversos polifenóis difere muito de um para outro, de modo que os mais
metabólitos ativos na circulação sanguínea e tecidos alvo. Quando ingeridos, os compostos bioativos
são extensivamente metabolizados por enzimas intestinais e hepáticas e pela microbiota presente no
cólon intestinal, resultando em metabólitos conjugados diferentes dos compostos nativos (KANAZE
et al, 2007).
Como mencionado anteriormente, as flavanonas (hesperidina e narirutina) estão naturalmente
presentes nas frutas cítricas ligadas a moléculas ramnoglicosídeas, como os 7-O-rutinosídeos de
hesperitina e de naringenina. A molécula de glicose é um dos principais determinantes do local de
absorção e da biodisponibilidade dos flavonoides e é reconhecido que a biodisponibilidade dos
monoglicosídeos de flavonoides é muito maior do que os rutinosídeos (MANACH et al, 2005;
NIELSEN et al, 2006; HOLLMAN et al, 1999). Outro fator que pode ser determinante para os
parâmetros farmacocinéticos são as diferenças na microbiota entérica devido a uma grande
variabilidade interindividual (ERLUND et al, 2000).
Os rutinosídeos são absorvidos apenas na parte distal do intestino após hidrólise pela
microbiota do cólon e este processo é provavelmente o passo limitador da velocidade de absorção. A
Cmax da hesperitina tem sido captada em média 6 h após a ingestão do suco de laranja (ERLUND et
al, 2000; MANACH et al, 2003; NIELSEN et al, 2006; HOLMANN et al, 1999). Em contraste, as
agliconas e glicosídeos de flavanonas são absorvidos no intestino delgado, local onde a absorção
ocorre mais rapidamente (Cmax em 1 h para hesperitina) (NIELSEN et al, 2006).
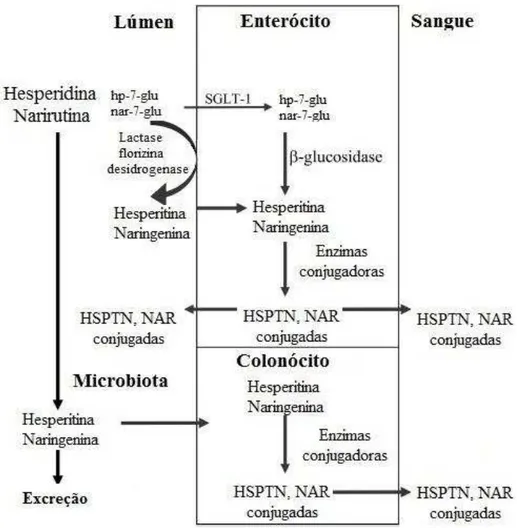
A absorção dos glicosídeos de flavonoides no intestino delgado pode ocorrer de duas
maneiras: 1) o glicosídeo é hidrolisado pela lactase-florizina hidrolase, presente na borda em escova,
e então a aglicona livre difunde-se através das células epiteliais por transporte passivo ou por difusão
facilitada (DAY et al, 2003) e 2) a molécula glicosídica pode ser transportada para o interior do
e deglicosilada pelas β-glicosidases (glicocerebrosidases e glicosidases citosólicas) presentes
intracelularmente. Ambas as vias de absorção originam agliconas intracelulares que, posteriormente,
se tornam conjugados glicurônicos ou sulfatados (Figura 4) (NIELSEN et al, 2006; DAY et al, 2003).
No intestino delgado e no epitélio do cólon, os flavonoides já poderão sofrer reações de
conjugação, como a glicuronidação e a metilação (BRAND et al, 2008; SPENCER et al, 1999). Após
serem transportados dos enterócitos ao fígado pelo sistema-portal ligados à albumina ou via linfática,
os flavonoides sofrem biotransformações por meio das enzimas de conjugação de fase II, UDP’s
glicuronosiltransferases e sulfotransferases, formando uma variedade de metabólitos com ácidos
glicurônicos e grupos sulfatos (SCALBERT et al, 2000; MATSUMOTO et al, 2004). A
glicuronidação e a sulfatação são especialmente importantes porque aumentam substancialmente o
peso molecular e a solubilidade das agliconas dos polifenóis (WILLIAMSON, 2002; WU et al, 2011;
XIAO e HÖGGER, 2013). Finalmente, os metabólitos conjugados aos glicuronídeos e
sulfoglicuronídeos podem ser excretados pela bile e/ou urina, dependendo do metabólito formado
(MANACH et al, 2003; HEIM, TAGLIAFERRO e BOBILVA, 2002).
Os metabólitos conjugados produzidos endogenamente são responsáveis pelos efeitos
sistêmicos dos flavonoides, portanto, o conhecimento sobre a natureza dos metabólitos gerados pelo
metabolismo é fundamental para a realização de estudos sobre os supostos efeitos positivos na saúde
Figura 4. Caminhos metabólicos da Hesperidina e Narirutina (Adaptado de NIELSEN et al, 2006)
Estudos sobre a Biodisponibilidade das Flavanonas
Foi realizado um levantamento de estudos que quantificaram as flavanonas, hesperidina e a
narirutina, após ingestão de suco de laranja fresco, pasteurizado, reconstituído de concentrado,
homogeneizado a alta pressão e a fruta, no qual foram considerados os seguintes dados: autor/ano,
tipo do suco de laranja, quantidade de suco ingerido, de hesperitina e naringenina; e parâmetros
farmacocinéticos: área sobre a curva (AUC), concentração máxima (Cmax), tempo da concentração
máxima (Tmax), excreção urinária relativa à dose ingerida e a porcentagem de absorção (Tabelas 1
Erlund et al (2000) avaliaram as concentrações plasmáticas e urinárias das flavanonas em oito
voluntários saudáveis (cinco mulheres e três homens) que ingeriram uma dose de suco de laranja (8
ml/kg de peso corporal). Foram colhidas onze amostras de sangue e urina de 24 h após a
administração do suco. As concentrações plasmáticas máximas (Cmax) foram 0,6 �mol/L para
naringenina e o valor correspondente para hesperitina foi de 2,2 �mol/L. A excreção urinária relativa
foi de 1,1% para naringenina e 5,3% para hesperitina. Os resultados deste estudo mostraram que as
concentrações de hesperitina e naringenina são relativamente elevados após a ingestão de suco de
laranja e que a variação interindividual na biodisponibilidade é um fator importante. Os autores
concluíram que as atividades biológicas atribuídas as flavanonas podem resultar em efeitos positivos
à saúde de indivíduos que consomem laranja regularmente (Tabelas 1 e 2).
Manach et al (2003) analisaram a cinética plasmática e a excreção urinária das flavanonas,
hesperidina e narirutina. Após o jejum de 12 horas, cinco voluntários saudáveis ingeriram 0,5 mL ou
1 litro de suco de laranja comercial. O sangue foi colhido em 10 tempos diferentes em um período de
24 h. A urina foi coletada durante 48 horas, em cinco frações. Os metabólitos das flavanonas
apareceram no plasma 3 h após a ingestão do suco, atingindo o pico entre 5 e 7 h, em seguida, voltou
à linha de base em 24 h. O pico de concentração plasmática da hesperitina foi de 0,46 �mol/L e 1,28
�mol/L após a ingestão de 0,5 e 1 L, respectivamente. E o pico de concentração da naringenina foi
menor: 0,20�mol/L após a dose de 1 L. As formas de circulação encontradas da hesperitina foram
glicuronídeos (87%) e os sulfoglicuronídeos (13%). Para ambas as flavanonas, a excreção urinária
foi quase completa após 24 h da ingestão do suco de laranja. A excreção urinária relativa foi
semelhante em ambas as flavanonas, não dependendo da dose. A partir do consumo moderado ou
alto de suco de laranja as flavanonas representam uma parte importante do conjunto de polifenóis
A hipótese de que a biodisponibilidade de fitonutrientes dietéticos é influenciada pela matriz
alimentar em que eles são consumidos, fez com que Mullen et al (2008) investigassem o impacto do
iogurte integral na biodisponibilidade e no metabolismo das flavanonas do suco de laranja. Plasma e
urina foram colhidos durante 24 h após o consumo de 250 ml de suco de laranja, contendo um total
de 168 �mol de hesperitina-7-O-rutinosídeo e 12 �mol de naringenina-7-O-rutinosídeo, com e sem
150 ml de iogurte integral. Os resultados revelaram que a hesperitina-7-O-glicuronídeo depois
ingestão de suco de laranja teve uma Cmax de 922 nmol/L e um Tmax de 4,4 h. Quando o suco foi
consumido com iogurte, nem a Cmax de 661 nmol/L nem o Tmax de 5,1 h foram significativamente
diferentes dos obtidos com o suco sem iogurte. O glicuronídeo de hesperitina também foi excretado
na urina juntamente com a hesperitina-O-glicuronídeo, hesperitina-O-glicuronídeo-O-sulfato,
hesperitina-O-diglicuronídeo, naringenina-O-diglicuronídeo, naringenina-7-O-glicuronídeo e
naringenina-4'-O-glicuronídeo. A excreção urinária não foi afetada pela adição de iogurte no suco,
assim, houve pouco impacto do iogurte sobre o destino das flavanonas do suco de laranja. Os autores
comentaram que são necessárias investigações detalhadas sobre a complexidade dos efeitos da matriz
dos alimentos sobre a absorção dos flavonoides quando são consumidos como parte de uma refeição
real, em oposição à ingestão com o estômago vazio de um único item alimentar (Tabelas 1 e 2).
A absorção das flavanonas pode ser afetada pelo processamento do suco e a bioatividade dos
fitonutrientes depende de como eles são metabolizados após a absorção. Brett et al (2009) realizaram
um estudo crossover randomizado com 20 indivíduos que consumiram uma única porção de laranja
(150 g) ou suco (300 g) e um adicional de 109 indivíduos de ampla faixa etária (18-80 anos)
consumidores de suco e avaliaram a relação da absorção das flavanonas com a idade, sexo e índice
de massa corpórea (IMC). Após o consumo da fruta ou do suco, conjugados de flavanonas, mas não
incluem 7- e 4'-O-monoglicuronídeos de naringenina, 7- e 3'-O- monoglicuronídeos de hesperitina,
diglicuronídeos de hesperitina e hesperitina glicuronídeo sulfatado. A análise dos dados da
farmacocinética plasmática e da excreção urinária em uma base ajustada da dose não indicou
diferenças na absorção ou excreção de qualquer flavanona entre as matrizes: fruta ou suco. No
conjunto de dados sobre a excreção urinária a variação individual se mostrou muito grande (de 0 a
59%). Houve uma diminuição significativa na excreção da hesperitina (mas não da naringenina) com
o aumento da idade, e com relação ao sexo e IMC foi demonstrado não haver associação com a
variação na excreção das flavanonas (Tabelas 1 e 2).
Bredsdorff et al (2010) determinaram a absorção, conjugação e excreção da naringenina-7-O-
rutinosídeo (narirutina) em humanos, em comparação com o glicosídeo correspondente em uma
matriz de suco de laranja. O estudo crossover e duplo cego contou com oito voluntários saudáveis
que consumiram (1) suco de laranja com teor natural de naringenina-7-O-rutinoside e (2) suco de
laranja com naringenina-7-O-glicosídeo (obtida por meio de tratamento enzimático com
-ramnosidase). O sangue foi coletado em doze pontos de tempo e três frações de urina foram coletadas
em 24 h. A área sob a curva de naringenina no plasma a partir de suco de laranja enriquecido (2) foi
aumentada em cerca de 4 vezes, a Cmax foi 5,4 vezes mais elevada e Tmax foi diminuída 311 para
92 min em comparação com o suco de laranja (1), indicando a mudança do local de absorção, a partir
do cólon para o intestino delgado. Além disso, a quantidade de metabólitos na urina foi de 7 para
47% da dose, após o consumo do suco de laranja tratado com -ramnosidase (2). Todas as amostras
de urina continham os metabólitos naringenina-7 e 4-O-glicuronídeos. Além disso, para examinar o
efeito da dose e o tratamento com ramnosidase sobre os perfis de hesperitina conjugada, um outro
tratamento suplementar foi realizado em que o suco de laranja foi fortificado com o conteúdo três
de hesperitina (3’-O-glicuronídeo, 7-O-glicuronídeos, 5,7-O-diglicuronídeo, 3’,7-O-diglicuronídeo,
3’-O-sulfato), com o mesmo perfil dos conjugados. Os dados deste estudo mostraram que a
biodisponibilidade da naringenina é aumentada pela conversão do rutinosídeo em glicosídeo, mas o
perfil dos conjugados de flavanonas formados e excretados na urina não foi afetado pelo local de
absorção, nem com o aumento de 3 vezes na dose (Tabelas 1 e 2).
Vallejo et al (2010) estudaram os efeitos da concentração e da solubilidade das flavanonas de
sucos de laranja reconstituídos sobre a sua biodisponibilidade em um estudo crossover com 10
voluntários saudáveis. Foram avaliadas cinco bebidas com diferentes concentrações de flavanonas.
Os sucos de laranja comerciais (29,2-70,3 mg de flavanonas/100 mL) foram comparados a sucos de
laranja experimentais enriquecidos com 110,2 mg/100 mL de flavanonas. Glicuronídeos e sulfatos de
hesperitina e naringenina foram detectados e quantificados no plasma e na urina. O estudo mostrou
que a solubilidade das flavanonas, em particular a da hesperidina, no suco é um fator chave tanto para
a biodisponibilidade como para a excreção das flavanonas e a Cmax no plasma, correlaciona-se bem
com a concentração da flavanona solúvel no suco, enquanto parece não haver qualquer correlação
com a ingestão total das flavanonas. Além disso, foi observada uma grande variação interindividual,
sendo consistente para cada indivíduo depois da ingestão das diferentes bebidas, o que sugere que a
biodisponibilidade das flavanonas é também dependente da ocorrência da microbiota específica que
é capaz de remover os rutinosídeos provenientes do suco, que resulta em agliconas que são, então,
absorvidos no intestino (Tabelas 1 e 2).
Tomás-Navarro et al (2014) avaliaram o efeito da homogeneização de alta pressão
comparando a pasteurização convencional sobre a excreção urinária das flavanonas em 18 voluntários
estratificados em diferentes níveis de absorção/excreção de flavanonas (alta, média e baixa). Os
sucos, enquanto que o suco homogeneizado a alta pressão apresentou partículas (microssuspensões
no pellet - parte insolúvel do suco) de tamanhos menores. A ingestão de quantidades semelhantes de
flavanonas solúveis levou, também, à excreção urinária relativa semelhante de metabólitos. No
entanto, diferenças significativas foram encontradas quando os voluntários foram estratificados por
suas capacidades de excreção (maiores após a ingestão do suco homogeneizado a alta pressão).
Assim, as diferenças observadas para excreção das flavanonas após a ingestão dos sucos pelos
voluntários com alta excreção indicaram claramente que as características do suco, tais como o
tamanho das partículas, pode também ser relevante para a absorção. Os autores concluíram que a
estratificação dos indivíduos por sua capacidade de excreção é mais relevante do que os tratamentos
tecnológicos avaliados em termos de biodisponibilidade das flavanonas, devendo ser considerada em
estudos clínicos com sucos da fruta ou com os compostos isolados, uma vez que poderia explicar a
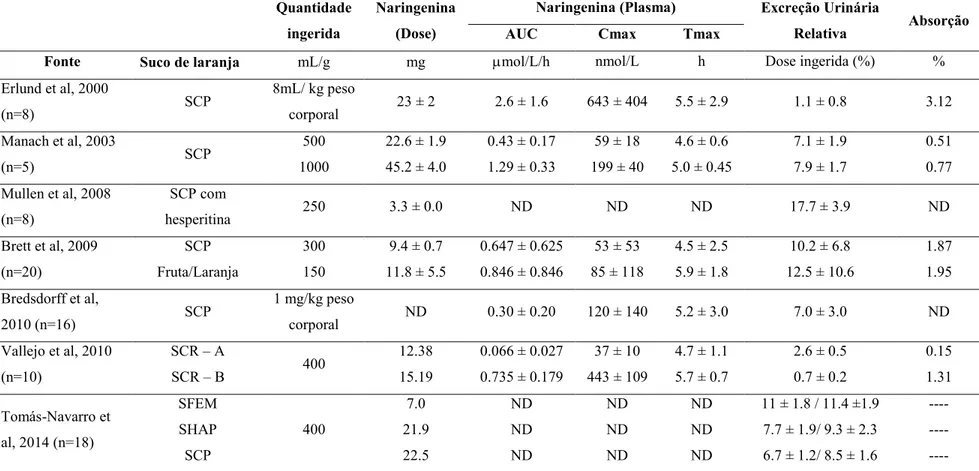
Tabela 1 - Estudos da biodisponibilidade da Hesperitina.
Quantidade ingerida
Hesperitina (Dose)
Hesperitina (Plasma) Excreção Urinária
Relativa Absorção
AUC Cmax Tmax
Fonte Suco de laranja mL/g mg mol/L/h nmol/L h Dose ingerida % % Erlund et al, 2000
(n=8) SCP
8mL/ kg peso
corporal 126 ± 26 10.3 ± 8.2 2176 ± 1591 5.4 ± 1.6 5.30 ± 3.1 2.4 Manach et al, 2003
(n=5) SCP
500 110 ± 3.7 4.2 ± 1.1 462 ± 69 5.4 ± 0.40 4.13 ± 1.18 1.2 1000 220 ± 7.4 9.3 ± 1.9 1286 ± 130 5.8 ± 0.37 6.41 ± 1.32 1.3 Mullen et al, 2008
(n=8)
SCP com
hesperitina 250 50.7 ± 0.0 4.1 ± 2.9 922 ± 224 4.4 ± 0.5 6.30 ± 2.0 2.4 Brett et al, 2009
(n=20)
SCP 300 71.8 ± 8.1 1.1 ± 1.2 103 ± 126 6.2 ± 2.0 4.63 ± 3.05 0.5 Fruta/ Laranja 150 79.7 ± 17.7 1.2 ± 1.7 96 ± 124 7.0 ± 4.23 4.53 ± 3.44 0.5 Bredsdorff et al, 2010
(n=16) SCP
1 mg/kg peso
corporal ND ND ND ND ND ND
Vallejo et al, 2010 (n=10)
SCR – A
SCR – B 400
35.05 1.2 ± 0.3 325 ± 65 4.6 ± 0.7 5.4 ± 1.2 1.03 77.40 0.95 ± 0.23 366 ± 70 6.4 ± 0.7 1.7 ± 0.4 0.40
Tomás-Navarro et al, 2014 (n=18)
SFEM
400
18.8 ND ND ND 8.1 ± 1.4 / 8.4 ±1.5 ----
SHAP 51.6 ND ND ND 4.8 ± 1.1/ 10.1 ± 2.4 ----
SCP 56.2 ND ND ND 3.3 ± 0.5/ 7.7 ± 1.1 ----
ND = Não determinado AUC = Área sob a curva; Cmax = Concentração máxima; Tmax = Tempo de concentração máxima
Tabela 2 - Estudos da biodisponibilidade da Naringenina. Quantidade ingerida Naringenina (Dose)
Naringenina (Plasma) Excreção Urinária
Relativa Absorção
AUC Cmax Tmax
Fonte Suco de laranja mL/g mg mol/L/h nmol/L h Dose ingerida (%) %
Erlund et al, 2000
(n=8) SCP
8mL/ kg peso
corporal 23 ± 2 2.6 ± 1.6 643 ± 404 5.5 ± 2.9 1.1 ± 0.8 3.12 Manach et al, 2003
(n=5) SCP
500 22.6 ± 1.9 0.43 ± 0.17 59 ± 18 4.6 ± 0.6 7.1 ± 1.9 0.51 1000 45.2 ± 4.0 1.29 ± 0.33 199 ± 40 5.0 ± 0.45 7.9 ± 1.7 0.77 Mullen et al, 2008
(n=8)
SCP com
hesperitina 250 3.3 ± 0.0 ND ND ND 17.7 ± 3.9 ND
Brett et al, 2009 (n=20)
SCP 300 9.4 ± 0.7 0.647 ± 0.625 53 ± 53 4.5 ± 2.5 10.2 ± 6.8 1.87 Fruta/Laranja 150 11.8 ± 5.5 0.846 ± 0.846 85 ± 118 5.9 ± 1.8 12.5 ± 10.6 1.95 Bredsdorff et al,
2010 (n=16) SCP
1 mg/kg peso
corporal ND 0.30 ± 0.20 120 ± 140 5.2 ± 3.0 7.0 ± 3.0 ND Vallejo et al, 2010
(n=10)
SCR – A
SCR – B 400
12.38 0.066 ± 0.027 37 ± 10 4.7 ± 1.1 2.6 ± 0.5 0.15 15.19 0.735 ± 0.179 443 ± 109 5.7 ± 0.7 0.7 ± 0.2 1.31
Tomás-Navarro et al, 2014 (n=18)
SFEM
400
7.0 ND ND ND 11 ± 1.8 / 11.4 ±1.9 ----
SHAP 21.9 ND ND ND 7.7 ± 1.9/ 9.3 ± 2.3 ----
SCP 22.5 ND ND ND 6.7 ± 1.2/ 8.5 ± 1.6 ----
ND = Não determinado AUC = Área sob a curva; Cmax = Concentração máxima; Tmax = Tempo de concentração máxima
Polimetoxiflavonas
As polimetoxiflavonas (PMFs) são metabólitos secundários de flavonoides que sofreram
metilações sucessivas em seus grupos hidroxílicos, sendo exclusivos nas espécies cítricas e
encontradas principalmente na casca dos frutos. Assim como os flavonoides, as
polimetoxiflavonas também exercem função de defesa contra diversos patógenos causadores de
doenças nas plantas (DEL RIO et al, 1998).
A tangeritina (TAN) e a nobelitina (NOB) constituem as principais PMFs, sendo
encontradas em maiores quantidades nos frutos cítricos, a isosakuranetina (ISR), a sinensetina
(SIN), a tetrametilescutelareina (TMS) e a heptamethoxiflavona (HMF) representam o grupo em
menor quantidade (MANTHEY et al, 2011). As polimetoxiflavonas têm sido relacionadas a uma
variedade de eventos bioquímicos que beneficiam a saúde, particularmente nas vias associadas ao
câncer (LI et al, 2007); à biossíntese de lipídeos (KUROWSKA e MANTHEY, 2004), à
inflamação (AKAO et al, 2008) e à tolerância à glicose (LI et al, 2008).
Suco de Laranja Fresco x Pasteurizado
A extração e o processamento do suco de laranja alteram as propriedades físico-químicas
gerando diferenças na proporção dos nutrientes do alimento, sendo encontrados conteúdos
distintos de ácido ascórbico, compostos fenólicos totais, carotenoides e flavonoides. Estas
diferenças na produção podem ser impactantes sobre os parâmetros de qualidade e podem
influenciar nas características nutricionais e no sabor destes sucos (BAI et al, 2013; BALDWIN et
al, 2014; PEREZ-CACHO e ROUSEFF, 2008). A Tabela 3 mostra um comparativo entre o
conteúdo dos nutrientes entre os sucos fresco e o comercialmente pasteurizado (USDA, 2008;
Sucos de laranja contêm de 470 a 761 mg/L de hesperidina e de 20 a 86 mg/L de narirutina.
As partes sólidas das laranjas como a porção branca esponjosa (albedo) e as membranas que
separam os segmentos, tem um teor muito elevado de flavanonas; esta é a razão do fruto conter até
cinco vezes mais flavonoides do que o suco de laranja (GIL-IZQUIERDO et al, 2003; BAI et al,
2013; BALDWIN et al, 2014).
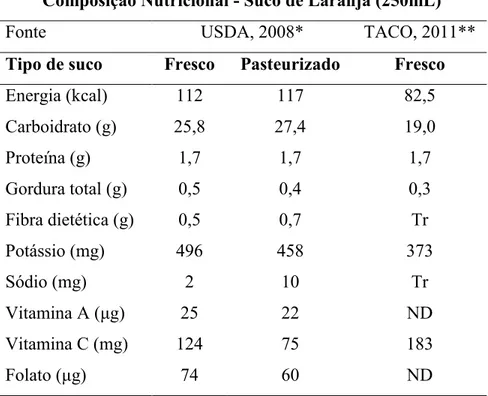
Tabela 3 - Comparação da composição nutricional dos sucos de laranja: Fresco e Pasteurizado.
Composição Nutricional - Suco de Laranja (250mL)
Fonte USDA, 2008* TACO, 2011**
Tipo de suco Fresco Pasteurizado Fresco
Energia (kcal) 112 117 82,5
Carboidrato (g) 25,8 27,4 19,0
Proteína (g) 1,7 1,7 1,7
Gordura total (g) 0,5 0,4 0,3
Fibra dietética (g) 0,5 0,7 Tr
Potássio (mg) 496 458 373
Sódio (mg) 2 10 Tr
Vitamina A (μg) 25 22 ND
Vitamina C (mg) 124 75 183
Folato (μg) 74 60 ND
Tr = traço; ND = não determinado
*USDA, National Nutrient Database for Standard Reference, 2008 **TACO, Tabela de Composição dos Alimentos, 2011
Estudo verificou que o suco fresco apresenta um teor 30% maior de vitamina C do que o
suco pasteurizado. Por outro lado, o suco pasteurizado possui aproximadamente 3,3 vezes maior
Os principais glicosídeos de flavanonas foram encontrados em concentrações duas vezes
mais elevadas no suco de laranja pasteurizado quando comparado ao fresco, indicando que o
processamento comercial leva a maior extração das cascas no suco pasteurizado do que os métodos
de extração de suco fresco. O teor de compostos fenólicos totais nos sucos seguiu um padrão
semelhante ao conteúdo de flavonoides. As polimetoxiflavonas (PMFs), associadas com óleo da
casca, ocorreram nos níveis 2,5 vezes mais altos no suco de laranja fresco, em contraste, os
limonoides e alcaloides ocorreram em níveis mais elevados no suco pasteurizado (MANTHEY et
al, 2011).
OBJETIVOS
Avaliar os parâmetros farmacocinéticos dos compostos do suco de laranja fresco e
comercialmente pasteurizado (flavanonas e metabólitos) em humanos saudáveis;
Avaliar o índice do estresse oxidativo dos indivíduos por meio de análise de hidroperóxidos
e capacidade antioxidante no soro sanguíneo;
Determinar a composição nutricional e o perfil dos compostos fitoquímicos ativos
(fenólicos totais e flavonoides cítricos) no suco fresco e comercialmente pasteurizado;
Caracterizar o estado nutricional dos indivíduos por meio da avaliação antropométrica,
Referências Bibliográficas
AKAO, Y.; ITOH, T.; OHGUCHI, K.; IINUMA, M.; NOZAWA, Y. Interactive effects of polymethoxy flavones from Citrus on cell growth inhibition in human neuroblastoma SH-SY5Y cells, Bioorg. Med. Chem. v.16, p. 2803–2810 2008.
APTEKMANN, N.P.; CESAR, T.B. Long-term orange juice consumption is associated with low LDL-cholesterol and apolipoprotein B in normal and moderately hyperLDL-cholesterolemic subjects. Lipids in Health and Disease, p. 112-119, doi: 10.1186/1476-511X-12-119, 2013.
BAHADORAN, Z.; MIRMIRAN, P.; AZIZI, F. Dietary polyphenols as potential nutraceuticals inmanagement of diabetes: a review. Journal of Diabetes & Metabolic Disorders, p. 12-43, 2013.
BAI, J.; MANTHEY, J.A.; FORD, B.L.; LUZIO, G.; CAMERON, R.G; NARCISO, J.; BALDWIN, EA. Effect of extraction, pasteurization and cold storage on flavonoids and other secondary metabolites in fresh orange juice. Journal of the Science of Food and Agriculture, v. 93, p. 2771–2781, 2013.
BASILE, L.G.; LIMA, C.G.; CESAR, T.B. Daily Intake of Pasteurized Orange Juice Decreases Serum Cholesterol, Fasting Glucose, and Diastolic Blood Pressure in Adults. Florida State Horticultural Society, v. 123, p. 228–233, 2010.
BEKING, K.; VIEIRA, A. Flavonoid intake and disability-adjusted life years due to Alzheimer's and related dementias: a population-based study involving twenty-three developed countries. Public Health Nutrition, v. 13(9), p. 1403-9. doi: 10.1017/S1368980009992990, 2010.
BHULLAR, K.S.; LASSALLE-CLAUX, G.; TOUAIBIA, M.; RUPASINGHE, H.P. Antihypertensive effect of caffeic acid and its analogs through dual renin-angiotensin-aldosterone system inhibition. European Journal of Pharmacology, v. 730, p.125-32. doi: 10.1016/j.ejphar.2014.02.038, 2014.
BOK, S.H.; LEE, S.H.; PARK, Y.B.; BAE, K.H.; SON, K.H.; JEONG, T.S. Plasma and hepatic cholesterol and hepatic activities of 3-hydroxy-3-methylglutaryl-CoA reductase and acyl CoA: cholesteroltransferase are lower in rats fed citrus peel extract or a mixture of citrus bioflavonoids. Journal of Nutrition, v. 129, p. 1182-5, 1999.
BORRADAILE, N.M.; CARROLL, K.K.; KUROWSKA, E.M. Regulation of HepG2 cell apolipoprotein B metabolism by the citrus flavanones hesperetin and naringenin. Lipids, v.34, p. 591-8, 1999.
BRAND, W.; VAN DER WEL, P.A.I.; REIN, M.J.; BARRON, D.; WILLIAMSON, G.; VAN BLADEREN, P.J.; RIETJENS, I.M.C.M. Metabolism and transport of the citrus flavonoid hesperetin in Caco-2 cell monolayers. Drug Metabolism and Disposition, v. 36, p. 1794–1802, 2008.
BREDSDORFF, L.; NIELSEN, I.L.F.; RASMUSSEN, S.E.; CORNETT, C.; BARRON, D.; BOUISSET, F.; OFFORD, E.; WILLIAMSON G. Absorption, conjugation and excretion of the flavanones, naringenin and hesperetin from a-rhamnosidase-treated orange juice in human subjects. British Journal of Nutrition, v. 103, p. 1602–1609, 2010.
CHANET, A.; MILENKOVIC, D.; MANACH, C.; MAZUR, A.; MORAND, C. Citrus Flavanones: What Is Their Role in Cardiovascular Protection? Journal of Agricultural and Food Chemistry, v. 60, p. 8809−8822. dx.doi.org/10.1021/jf300669s, 2012.
CITRUS BR (Associação Nacional dos Exportadores de Sucos Cítricos). Sucos de laranja e suas categorias. Disponível em: http://www.citrusbr.com/exportadores-citricos/setor/artigo150828-2.asp Acessado em 28 agosto, 2014.
D'ARCHIVIO, M.; FILESI, C.; DI BENEDETTO, R.; GARGIULO, R.; GIOVANNINI, C.; MASELLA, R. Polyphenols, dietary sources and bioavailability. Annali dell'Istituto Superiore di Sanità, v. 43(4), p. 348-61, 2007.
DAY, A.J.; GEE, J.M.; DUPONT, M.S.; JOHNSON, I.T.; WILLIAMSON, G. Absorption of quercetin-3-glucoside and quercetin-49-quercetin-3-glucoside in the rat small intestine: the role of lactase phlorizin hydrolase and the sodium-dependent glucose transporter. Biochemical Pharmacology, v. 65, p. 1199-206, 2003.
DEL RIO, J. A.; ARCAS, M. C.; BENAVENTE-GARCIA, O.; SABATER, F.; ORTUNO, A. Changes of polymethoxylated flavones levels during development of Citrus aurantium (cv.Sevillano) fruits. Planta Med. 1998, 64, 575–576.
ERDMAN, J.W.; BALENTINE, J.R.D.; ARAB, L.; BEECHER, G.; DWYER, J.T.; FOLTS, J.; HARNLY, J.; HOLLMAN, P.; KEEN, C.L.; MAZZA, G.; MESSINA, M.; SCALBERT, A.; VITA, J.; WILLIAMSON, G.; BURROWES, J. Flavonoids and heart health: proceedings of the ILSI North America Flavonoids Workshop, May 31−June 1, 2005, Washington, DC. Journal of Nutrition, v. 137, p. 718S−737S, 2007.
ERLUND, I.; MERIRINNE, E.; ALFTHAN, G.; ARO, A. Plasma kinetics and urinary excretion of the flavanones naringenin and hesperetin in humans after ingestion of orange juice and grapefruit juice. Journal of Nutrition, v. 131(2), p. 235-41, 2000.
FRANKE, A.A.; COONEY, R.V.; HENNING, S.M.; CUSTER, L.J. Bioavailability and antioxidant effects of orange juice components in humans. Journal of Agricultural and Food Chemistry, v. 53(13), p. 5170-8, 2005.
GIL-IZQUIERDO, A.; GIL, M.I.; FERRERES, F. Effect of processing techniques at industrial scale on orange juice antioxidants and beneficial health compounds. Journal of Agricultural and Food Chemistry, v. 28:50(18), p. 5107-14, 2002.
HEIM, K.E.; TAGLIAFERRO, A.R.; BOBILVA, D.J. Flavonoid antioxidants: chemistry, metabolism and structure-activity relationships. Journal of Nutritional Biochemistry, v.13, n.10, p. 572-584, 2002.
HOLLMAN, P.C.; BIJSMAN, M.N.; VAN GAMEREN, Y.; CNOSSEN, E.P.; DE VRIES, J.H.; KATAN, M.B. The sugar moiety is a major determinant of the absorption of dietary flavonoid glycosides in man. Free Radical Research, v. 31, p. 569–73, 1999.
KANAZE, F.I.; BOUNARTZI, M.I.; GEORGARAKIS, M.; NIOPAS, I. Pharmacokinetics of the citrus flavanone aglycones hesperetin and naringenin after single oral administration in human subjects. European Journal of Clinical Nutrition, v. 61(4), p. 472-7, 2007.
KNEKT, P.; KUMPULAINEN, J.; JARVINEN, R.; RISSANEN, H.; HELIÖVAARA, M.; REUNANEN, A.; HAKULINEN, T.; AROMAA, A. Flavonoid intake and risk of chronic diseases. American Journal of Clinical Nutrition, v. 76, p. 560–568, 2002.
KUMAR, S.; PANDEY, A.K. Chemistry and biological activities of flavonoids: an overview. Scientific World Journal, doi: 10.1155/2013/162750, 2013.
KUROWSKA, E.M.; SPENCE, J.D.; JORDAN, J.; WETMORE, S.; FREEMAN, D.J.; PICHÉ, L.A. HDL-Cholesterol-raising effect of orange juice in subjects with hypercholesterolemia. American Journal of Clinical Nutrition, v. 72, p. 1095-100, 2000.
KUROWSKA, E.M.; MANTHEY, J.A. Hypolipidemic effects and absorption of citrus polymethoxylated flavones in hamsters with diet-induced hypercholesterolemia. Journal of Agricultural and Food Chemistry, v. 52, p. 2879-86, 2004.
LI, S.; PAN, M. H.; LAI, C.S.; LO, C.Y.; DUSHENKOV, S.; HO, C.T. Isolation and syntheses of polymethoxyflavones and hydroxylated polymethoxyflavones as inhibitors of HL-60 cell lines. Bioorg. Med. Chem. 15 p. 3381–3389, 2007.
LI, R. W.; THERIAULT, A. G.; AU, K.; DOUGLAS, T. D.; CASACHI, A.; KUROWSKA, E. M.; MUKHERJEE, R. Citrus polymethoxylated flavones improve lipid and glucose homeostasis and modulate adipocytokines in fructose-induced insulin resistant hamsters. Life Sci. 2006, 79, 365-373.
LEUZZI, U.; CARISTI, C.; PANZERA, V.; LICANDRO, G. Flavonoids in pigmented orange juice and second-pressure extracts. Journal of Agricultural and Food Chemistry, v. 48, p. 5501-6, 2000.
MANACH, C.; MORAND, C.; GIL-IZQUIERDO, A.; BOUTELOUP-DEMANGE, C.; REMESY, C. Bioavailability in humans of the flavanones hesperidin and narirutin after the ingestion of two doses of orange juice. European Journal of Clinical Nutrition, v. 57, p. 235–42, 2003.
MANACH, C.; WILLIAMSON, G.; MORAND, C.; SCALBERT, A.; RÉMÉSY, C. Bioavailability and bioefficacy of polyphenols in humans. I. Review of 97 bioavailability studies. American Journal of Clinical Nutrition, v. 81, p. 230S– 42S, 2005.
MANTHEY, J. A.; GUTHRIE, N.; GROHMANN, K. Biological Properties of Citrus Flavonoids Pertaining to Cancer and Inflammation. Current Medicinal Chemistry, v. 8, p. 135-153, 2001.
MANTHEY, J.A.; BENDELE, P. Anti-inflammatory activity of an orange peel polymethoxylated flavone, 3',4',3,5,6,7,8-heptamethoxyflavone, in the rat carrageenan/paw edema and mouse lipopolysaccharide-challenge assays. Journal of Agricultural and Food Chemistry, v. 56(20), p. 9399-403, 2008.
MANTHEY, J.A.; CESAR, T.B.; JACKSON, E. AND MERTENS-TALCOTT, S. Pharmacokinetic Study of Nobiletin and Tangeretin in Rat Serum by High-performance Liquid Chromatography-Electrospray Ionization-Mass Spectrometry. J. Agric. Food Chem. 2011, 59, 145–151.
MARTÍ, N.; MENA, P.; CÁNOVAS, J.A.; MICOL, V.; SAURA, D. Vitamin C and the role of citrus juices as functional food. Natural Product Communications, v. 4(5), p. 677-700. Review, 2009.
MISHRA, A.; SHARMA, A.K.; KUMAR, S.; SAXENA, A.K.; PANDEY, A.K. Bauhinia variegata leaf extracts exhibit considerable antibacterial, antioxidant and anticancer activities. BioMed Research International, Article ID 915436, 10 pages, 2013.
MORAND, C.; DUBRAY, C.; MILENKOVIC, D.; LIOGER, D.; MARTIN, J.F.; SCALBERT, A.; MAZUR, A. Hesperidin contributes to the vascular protective effects of orange juice: a randomized crossover study in healthy volunteers. American Journal of Clinical Nutrition, v. 93(1), p. 73-80. doi: 10.3945/ajcn.110.004945, 2011.
MULLEN, W.; ARCHEVEQUE, M.A.; EDWARDS, C.A.; MATSUMOTO, H.; CROZIER, A. Bioavailability and metabolism of orange juice flavanones in humans: impact of a full-fat yogurt. Journal of Agricultural and Food Chemistry, p. 11157-64. doi: 10.1021/jf801974v, 2008.
NIELSEN, I.L.; CHEE, W.S.; POULSEN, L.; OFFORD-CAVIN, E.; RASMUSSEN, S.E.; FREDERIKSEN, H.; ENSLEN, M.; BARRON, D.; HORCAJADA, M.N.; WILLIAMSON, G. Bioavailability is improved by enzymatic modification of the citrus flavonoid hesperidin in humans: a randomized, double-blind, crossover trial. Journal of Nutrition, v. 136(2), p. 404-8, 2006.
PANDEY, K.B.; RIZVI, S.I. Plant polyphenols as dietary antioxidants in human health and disease. Oxidative Medicine and Cellular Longevity, v. 2, p. 270–278, 2009.
PEREZ-CACHO, P.R.; ROUSEFF R. Processing and storage effects on orange juice aroma: a review. Journal of Agricultural and Food Chemistry, v. 56, p. 9785–9796, 2008.
PEREZ-JIMENEZ, J.; FEZEU, L.; TOUVIER, M.; ARNAULT, N.; MANACH, C.; HERCBERG, S.; GALAN, P.; SCALBERT, A. Dietary intake of 337 polyphenols in French adults. American Journal of Clinical Nutrition, v. 93, p. 1220−1228, 2011.
PETERSON, J.J.; DWYER, J.T.; BEECHER, G.R.; BHAGWAT, S.A.; GEBHARDT, S.E.; HAYTOWITZ, D.B.; HOLDEN, J.M. Flavanones in oranges, tangerines (mandarins), tangors, and tangelos: a compilation and review of the data from the analytical literature. Journal of Food Composition and Analysis, v. 19, p. S66−S73, 2006.
PFEUFFER, M.; AUINGER, A.; BLEY, U.; KRAUS-STOJANOWIC, I.; LAUE, C.; WINKLER, P.; RÜFER, C.E.; FRANK, J.; BÖSCH-SAADATMANDI, C.; RIMBACH, G.; SCHREZENMEIR, J. Effect of quercetin on traits of the metabolic syndrome, endothelial function and inflammation in men with different APOE isoforms. Nutrition, Metabolism and CardiovascularDiseases, v. 23(5), p. 403-9. doi: 10.1016/j.numecd.2011.08.010, 2013.
PUSPARINI, M.D.; DHARMA, R.; SUYATNA, F.D.; MANSYUR, M.; HIDAJAT, A. Effect of soy isoflavone supplementation on vascular endothelial function and oxidative stress in postmenopausal women: a community randomized controlled trial. Asia Pacific Journal of Clinical Nutrition, v. 22(3), p. 357-64. doi: 10.6133/apjcn.2013.22.3.13, 2013.
RAMPRASATH, T.; SENTHAMIZHARASI, M.; VASUDEVAN, V.; SASIKUMAR, S.; YUVARAJ, S.; SELVAM, G.S. Naringenin confers protection against oxidative stress through upregulation of Nrf2 target genes in cardiomyoblast cells. Journal of Physiology and Biochemistry, v. 70(2), p. 407-15. 2014.
RIZZA, S.; MUNIYAPPA, R.; IANTORNO, M.; KIM, J.; CHEN, H.; PULLIKOTIL, P.; SENESE, N.; TESAURO, M.; LAURO, D.; CARDILLO, C.; QUON, M.J. Citrus Polyphenol Hesperidin Stimulates Production of Nitric Oxide in Endothelial Cells while Improving Endothelial Function and Reducing Inflammatory Markers in Patients with Metabolic Syndrome. Journal of Clinical Endocrinology & Metabolism, v. 96(5), p. E782–E792. doi: 10.1210/jc.2010-2879, 2011.
ROZA, J.M.; XIAN-LIU, Z.; GUTHRIE, N. Effect of citrus flavonoids and tocotrienols on serum cholesterol levels in Hypercholesterolemic subjects. Alternative Therapies, Health and Medicine, v. 13(6), p.44-8, 2007.
SÁNCHEZ-MORENO, C.; CANO, M.P.; ANCOS, B.; PLAZA, L.; OLMEDILLA, B.; GRANADO, F.; MARTÍN, A. Effect of orange juice intake on vitamin C concentrations and biomarkers of antioxidant status in humans. American Journal of Clinical Nutrition, v. 78, p. 454–60, 2003.
SANTOS, K.F.; OLIVEIRA, T.T.; NAGEM, T.J.; PINTO, A.S.; OLIVEIRA, M.G. Hypolipidaemic effects of naringenin, rutin, nicotinic acid and their associations. Pharmacological Research, v. 40, p. 493-6, 1999.
SCALBERT, A.; WILLIAMSON, G. Dietary intake and bioavailability of polyphenols. Journal of Nutrition, v.130, Suppl 8S, p. 2073S-2085S, 2000.
SCALBERT, A.; MANACH, C.; MORAND, C.; REMESY, C.; JIMENEZ, L. Dietary polyphenols and the prevention of diseases. Critical Reviews in Food Science and Nutrition, v. 45, p. 287-306, 2005.
SNYDER, S.M.; REBER, J.D.; FREEMAN, B.L.; ORGAD, K.; EGGETT, D.L.; PARKER, T.L. Controlling for sugar and ascorbic acid, a mixture of flavonoids matching navel oranges significantly increases human postprandial serum antioxidant capacity. Nutrition Research, v. 31(7), p. 519-26. doi: 10.1016/j.nutres.2011.06.006, 2011.
SPENCER, J.P.E.; CHOWRIMOOTOO, G.; CHOUDHURY, R.; DEBNAM, E.S.; SRAI, S.K.; RICE-EVANS, C. The small intestine can both absorb and glucuronidate luminal flavonoids. FEBS Letters, v. 458, p. 224-230, 1999.
TACO. Tabela Brasileira de Composição de Alimentos / NEPA-UNICAMP - 4ᵅ edição revista e ampliada -- Campinas: NEPA- UNICAMP, 2011. 161 p.
TANAKA, T.; MAKITA, H.; KAWABATA, K.; MORI, H.; KAKUMOTO, M.; SATOH, K.; HARA, A.; SUMIDA, T.; TANAKA, T.; OGAWA, H. Chemoprevention of azoxymethane-induced rat colon carcinogenesis by the naturally occurring flavonoids, diosmin and hesperidin. Carcinogenesis, v. 18, p. 957-65, 1997.
TOMÁS-NAVARRO, M.; VALLEJO, F.; SENTANDREU, E.; NAVARRO, J.L.; TOMÁS-BARBERÁN, F.A. Volunteer Stratification Is More Relevant than Technological Treatment in Orange Juice Flavanone Bioavailability. Journal of Agricultural and Food Chemistry, v. 62, p. 24-27, 2014.
VALLEJO, F.; LARROSA, M.; ESCUDERO, E.; ZAFRILLA, M.P.; CERD́, B.; BOZA, J.; GARCÍA-CONESA, M.T.; ESPÍN, J.C.; TOMÁ -BARBEŔN, F.A. The concentration and solubility of flavanones in orange beverages affect their bioavailability in humans. Journal of Agricultural and Food Chemistry, v. 58, p. 6516−6524, 2010.
VAN ACKER, F.A.A.; SCHOUTEN, O.; HAENEN, G.R.M.M.; VAN DER VIJGH, W.J.F.; BAST, A. Flavonoids can replace-tocopherol as an antioxidant. FEBS Letters, v. 473, p. 145-8, 2000.
VINSON, J.A.; JANG J. In vitro and in vivo lipoprotein antioxidant effect of a citrus extract and ascorbic acid on normal and hypercholesterolemic human subjects. Journal of Medicinal Food, v. 4(4), p. 187-92, 2001.
WILLIAMSON G. The use of flavonoid aglycones in in vitro systems to test biological activities: based on bioavailability data, is this a valid approach? Phytochemistry Reviews, v. 1, p. 215–22, 2002.
WU, B.J.; BASU, S.; MENG, S.N.; WANG, X.Q.; HU, M. Regioselective sulfation and glucuronidation of phenolics: insights into the structural basis. Current Drug Metabolism, v. 12, p. 900–16, 2011.
XIAO J.B., HÖGGER P. Metabolism of dietary flavonoids in liver microsomes. Current Drug Metabolism, v. 14, p. 381–91, 2013.
YANG, M.; TANAKA, T.; HIROSE, Y.; DEGUCHI, T.; MORI, H.; KAWADA, Y. Chemopreventive effects of diosmin and hesperidin on N-butyl-N-(4-hydroxybutyl) nitrosamine-induced urinary-bladder carcinogenesis in male ICR mice. International Journal of Cancer, v. 73, p. 719-24, 1997.
YOSHIDA H., WATANABE W., OOMAGARI H., TSURUTA E., SHIDA M., KUROKAWA M. Citrus flavonoid naringenin inhibits TLR2 expression in adipocytes. Journal of Nutritional Biochemistry, v. 24(7), p. 1276-84. doi: 10.1016/ j.jnutbio. 2012.10.003, 2013.