FACULDADE DE CIENCIAS FARMACtUTICAS
Cuno de Pós-Graduação em TecDologia Bioquimico-Farmacêutica Área de TecDologia de Fermeotaçõel
CONTRIBUIÇAO
AO ESTUDODOS PROCESSOS
DESCONT(NUO
E DESCONT(NUO
ALIMENTADO
DE FERMENT
AÇAOALCOOLlCA
JOÃO CARLOS MOY\TEIRO DE CARVALHO
Tese para obtenção do grau de
DOUTOR Orientador:
Prol. Titular EUGENIO AQUARONE
II
Contribuição
ao estudodos
processos
descontínuo e descontínuo alimentado
de
fermentaçãoalcoólica--Tesepara a obtençãodograude Doutor
ComissãoJulgadora
Prot. Tit. Eugênio Aquarone
Presidentee Orientador
Prot. Dr. José Glauco Grandi
,
o E:-:aminador
Prot. Tit. Flávio Alterthum20 E:-:aminador
Prot. Dr. Reynaldo Naeeo
30 Examinador
Prot. Assoe. Sunao Sato
40 Examinador
~~
~!
C~
~'~
1Wm,~
~ 11U1/fW C~~~/C~
~~~~/:
-
A~ ~~
J)-v.
~
Â~,
pJa~,
~
Q;~
rwk~.
- ÂM-~~ J)-v.~ bab-,J)-v.~ fJ~ ~ Q;J)-v.
rTIi1iMv
~
fB~,
~~,
~,
~
Q;
~~.
- Â~~~
iJ-v.rB~,
rwv~
~,
~
~
Q;~.
- AM-
~
iJa.mk
A. ~
, XfJwvA. ck A~
Q;rliiiMvck m.
fB~ pJa~
~
ru1;~ ~
Q; ru1;~
~
~.
AM-
~
~
m.:!. ck A~ Q,CMulik C.?'fbt
~
~
CMnt ~~.
-
À~~~
t~
~
V~Q;
~
Cfww,
~~,
~~ru1;~~.
- ÂM-
~
dJL~
cb YrB:!: ~uatWfV.
ck~,
~
cb~
~. ~. C~
Q;~
C~,
rwv wwm tJM-~ Q;~
Mn~~.
- ÂM- iJ~ Q;Y~ cb
~
ck:!~
fB~-J~,
~
~
(W;~
~~
(Jt~
~
~.
- A~b-v.~,pJa~~~Q;~~~
-
À ~
tJJwu(C~
-b~),~~cb~~1lM
RESlJMO i
ABS'fR.ACT ü
NO~NCLA 11JRA iü
1. IN1RODUÇÃO 1
2. OBJETIVOS 5
3. REVISÃO BffiUOORÁFICA 6
4. MA1'ERIAIS E ~TODOS " .18
4.1 - MA'fÉRIA PRillA '"'''''' , 18
4.1.1- Mosto .. ... ... ... .... .. ..."...18
4.2- mÓCULO... " .18
4.3 - EQUIP~NTO 19
4.4- DESCRIÇÃODEUMEXPE~NTO TÍPICO 19
4.4.1- Análisedasamostras 21
4.4.1.1 - Técnicas analíticas ...,"'" ..21
4.4.1.1.1 - Medida do valor do pH 21
4.4.1.1.2 - Medida de acidez total " " 22
4.4.1.1.3 - Detenninação da concentração celular 22
4.4.1.1.4 - DetemUnaçãoda concentraçãode ART " ..22
4.4.1.1. 5 - Detenninação da concentração de etanol 24
4.4.1.2 - Métodos de cálculo '"'''''''''' ...25
4.4.1.2.1 - Cálculo do volwne presente na doma (VD) 25
4.4.1.2.1.1 - Cálculo do volwne presente na doma para o processo descon1Ínuo
clássico 25
4.4.1.2.1.2 - Cálculo do volwne presente na doma para o processo descon1Ínuo
alimentado .25
4.4.1.2.2 - Cálculo do volwne celular na doma (VX) 26
4.4.1.2.3- Cálculodo volwnede Hquidona doma (VL) 26 4.4.1.2.4 - Cálculoda massacelularsecana doma ~ 26
4.4.1.2.5 - Cálculodas massasde ART 26
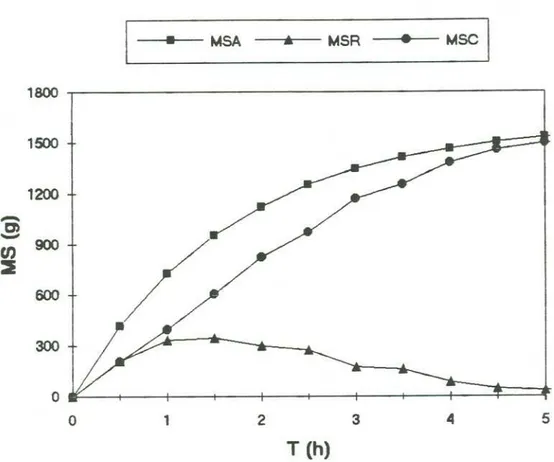
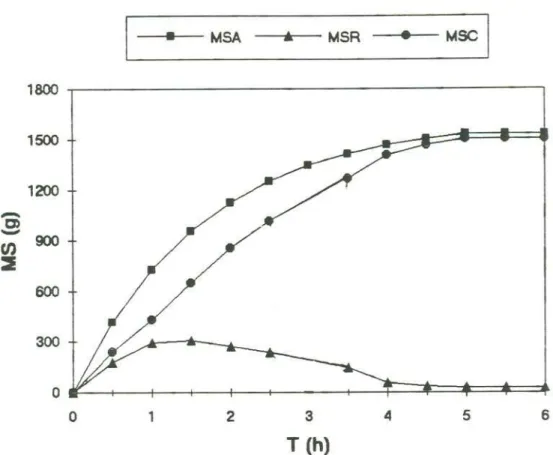
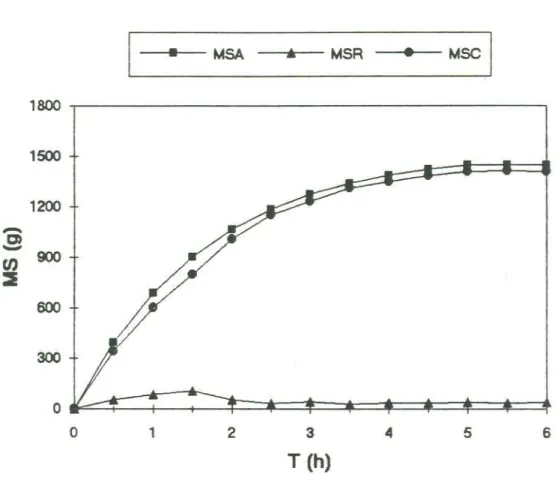
4.4.1.2.5.1 - Cálculo da massa de ART adicionada à doma (MSA) 26 4.4.1.2.5.1.1 - Cálculo da MSA para o processo descon1Ínuoclássico 26 4.4.1.2.5.1.2 - Cálculo da massa de ART adicionada à doma para o processo
descontínuo alimentado 27
fer-(MSC) ... ... ,... .27 4.4.1.2.6- Cálculoda massade etanolna faseliquidado meiode fennentação
~) ... ... ... ... ,...27
4.4.1.2.7- Cálculodo rendimentoem etanol " ..28 4.4.1.2.8 - Cálculoda produtividadeem etanol 28 4.4.1.2.9 - Cálculodo parâme1rorelacionadocomproduçãode células 28 4.4.1.2.10- Cálculoda produtividadeem células 28
4.5 - ANÁliSE ooS RESlILTADOS .29
5. RESlILTADOS... ... .30
5.1- RESlIL TAOOS 00 GRUPO I
PROCESSO DESCONTÍNUO ALIMENTADO
1'E=5h; K=O,6h-l ;~O'=l 000g ".. ." 33
5.1.1 - Experimento nútnero 1 " ...34
5.1.2- Experimentonútnero2. ... ... ... ... .36
5.1.3- Experimentonútnero3 .38
5.1.1- Apresentaçãodosresultadosobtidosno grupoI deexperimentos 40
5.1.2- Comentáriospreliminaressobreo grupoI ..40
5.11- RESlILTADOS DO GRUPO 11
PROCESSO DESCONTÍNUO ALIMENTADO
1'E=5h ;K=0,6h-1 ;~O'=1300g""'''''''''''' '"'''''''''''''''''''''' .41
5.2.4 - Experimento nútnero 4 ..42
5.2.5 - Experimento nÚInero5 ..44
5.2.6 - Experimento nútnero 6 ... ... .46
5.11.1- Apresentação dos resultados obtidos no grupo 11de experimentos 48 5.11.2 - Comentários prefuninares sobre o grupo 11 48 5.m - RESlILT ADOS DO GRUPO m
PROCESSO DESCONTÍNUO ALIMENTADO
1'E=5h ;K=O,8h-l ;~O'=1 000g 49
5.3.7 - Experimento nÚInero7 50
5.3.8 - Experimento nútnero 8 ~2
5.IV
-
RESULTADOS00 GRUPOIVPROCESSODESCONTÍNUOALIMENfADO
1'E=5h;K=O,8h-l;l\.1XO'=1300g ... ... ..57
5.4.10- Experimentonúmero 10.. 58
5.4.11- Experimentonúmero 11 60
5.4.12- Experimentonúmero12... 62
5.IV .1 - Apresentaçãodosresultadosobtidosno grupoIV de experimentos 64 5.IV.2- Comentáriospreliminaressobreo grupoIV ..64
5.V - RESULTADOS DO GRUPO V
PROCESSO DESCONTÍNUO ALIMENf ADO
1'E=4h ;K=O,6h-l ;l\.1XO'=I000g "'"'''''''''''''''''' ,.. ...65
5.5.13 - Experimento número 13 , 66
5.5.14 - Experimento nútnero 14 .68
5.5.15- Experimentonúmero 15 "... 70
5.V.l - Apresentaçãodos resultadosobtidosno grupoV de experimentos 72 5.V.2 - Comentáriospreliminaressobreo grupoV 72
5.VI - RESULTADOS DO GRUPO VI
PROCESSO DESCONTÍNUO ALIMENf ADO
1'E=4h ;K=O,6h-l ;l\.1XO'=1300g 73
5.6.16 - Experitnento nútnero 16 74
5.6.17- Experimentonúmero17 76
5.6.18- Experimentonútnero18 78
5.VI.1 - Apresentaçãodosresultadosobtidosno grupoVI de experimentos 80 5.VI.2 - Comentáriospreliminaressobreo grupoVI 80
5.vn - RESULTADOS DO GRUPO vn
PROCESSO DESCONTÍNUO ALIMENf ADO
1'E=3h ;K=O,6h-l ;l\.1XO'=I000g ,...""""" '''''''''''''''''' , 81
5.7.19 - Experimento número 19 " '''''' " 82
5.7.20 - Experitnento nútnero 20 ." 84
5.VIII - RESULTADOS DO GRUPO VIII PROCESSO DESCONTíNuo ALIMENTADO
TE=3h ;K=0,611-1;1vfXO'=1300g 89
5.8.22- ExperhnentonÚIllero22 " 90
5.8.23- ExperimentonÚIllero23 92
5.8.24 - Experhnento nÚIllero24. 94
5.VIII .1 - Apresentação dos resultados obtidos no grupo VIII de experimentos 96
5.VIII.2 - Comentáriospreliminaressobreo grupoVIII 96
5.IX - RESULTADOS DO GRUPO IX
PROCESSO DESCONTÍNUO ALIMENTADO
TE=3h ;K=0,611-1;1\1XO'=1600g ..".. ..,... """"""'"'''''''''''' ..97
5.9.25- ExperimentonÚIllero25 "'"'''''''''''''' 98
5.9.26- ExperimentonÚIllero26"'''''''''''''''' 100
5.9.27 - Experimento nÚIllero27 102
5.IX .1 - Apresentação dos resultados obtidos no grupo IX de experimentos l 04 5.IX.2- Comentáriospreliminaressobreo grupoIX"'''''''''''''''''''''''''''''''''''''' 104
5.X - RESULTADOS DO GRUPO X
PROCESSO DESCONTíNuo ALIMENTADO
TE=3h ;K=0,611-1;1\1XO'=2100g .., 105
5.10.28 - Experhnento nÚIllero28 ... ".. "'"'''''''' 106
5.10.29- ExperimentonÚJnero29 ""'"'''''''''''''' 108
5.10.30- Experimentonúmero30 11O
5.X..l - Apresentaçãodos resultadosobtidosno grupoX de experimentos 112 5.X.. 2 - Comentáriospreliminaressobreo grupoX ..112
5.XI - RESULTADOS DO GRUPO XI
PROCESSO DESCONTíNuo ALIME~" ADO
TE=3h ;K=0,Sh-l ;1vfXO'=I000g '''''''''''''' .." ..113 5.11.31 - Experimento nÚIllero 31 '"'' '"'' """""" 114
5.11.32 - Experimento número 32 ,"""'''''''''''''' ..116
5.xn - RESULTAOOS00 GRUPOxn
PROCESSODESCONTÍNUOALIMENTAOO
TE=3h ;K=0,8h-l ;f\.fXO'=1300g .121
5.12.34- ExperimentonÚlnero34 ..122
5.12.35- ExperiInentonÚlnero35 ..124
5.12.36- ExperimentonÚlnero36. .126
5.xn.l - Apresentaçãodosresultadosobtidosno grupoxn deexperimentos 128
5.xn.2 - Comentáriospreliminaressobreo grupoxn .128
5.xm - RESULTAOOSDO GRUPOxm PROCESSODESCONfÍNUO ALIMENTAOO
TE=3h ;K=0,8h-l ;1\.1XO'=I600g , ...129
5.13.37- ExperiInentonÚlnero37 .130
5.13.38- ExperimentonÚlnero38 132
5.13.39- ExperimentonÚlnero39 134
5.xm .1 - Apresentaçãodosresultadosobtidosno grupoxm deexperimentos 136
5.xm.2 - Comentáriospre1iIninaressobreo grupoxm ..136
5.XIV- RESULTAOOS00 GRUPOXIV PROCESSODESCONfÍNUO ALIMENTADO
TE=3h ;K=0,8h-l ;f\.fXO'=2100g .137
5.14.40- ExperimentonÚlnero40 .138
5.14.41- Experimentoniunero41 ... .140
5.14.42- ExperimentonÚlnero42 142
5.XIV .1 - Apresentaçãodosresultadosobtidosno grupoXIV de experimentos .144 5.XIV.2- Comentáriosprelinrinaressobreo grupoXIV .144
5.XV - RESULTAOOS 00 GRUPO XV PROCESSO DESCONTÍNUO ALIMENTADO
TE=3h ; K=1,2h-l ;f\.fXO'=I000g .145
5.15.43- Experimentoniunero43 .146
5.15.44- ExperimentonÚlnero44 .148
5.XVI - RESULTADOS DO GRUPO XVI
PROCESSODESCONTíNuo ALIMENTADO
TE=3h ;K=1,2h-l ;?\.1XO'=1300g ..153
5.16.46- Experimentoniunero46 ,.. 154
5.16.47- ExperjInentoniunero47 156
5.16.48- Experimentoniunero48 ..".. ""'"'''''''' " ...158 5.XVI.l - Apresentaçãodosresu1w1osobtidosno grupoXVI de experimentos 160 5.XVI.2 - Comentáriospre1inúnaressobreo grupoXVI .160
5.XVII - RESULTADOS DO GRUPO XVII
PROCESSODESCONTíNuo ALIMENTADO
TE=3h ;K =1,2h-l ;?\.1XO'=I600g """""'''''' '''''''''' ""'"'' '"'''' ..161
5.17.49- ExperjInentoniunero49 162
5.17.50- ExperimentonÚInero50 .. .., '''''''''''''''''''''''''' ..164
5.17.51- Experimentoniunero51 ..166
5.XVII.1 - Apresentaçãodosresultadosobtidosno grupoXVII de experimentos ..168 5.XVII.2- Comentáriospreliminaressobreo grupoXVII 168
5.XVIII - RESULTADOS DO GRUPO XVIII PROCESSO DESCONTíNuo ALIMENTADO
TE=3h ;K=1,2h-l ;?\.1XO'=2100g '"'''''''''' .."... .169
5.18.52 -Experimento nÚInero52 ". " " .170
5.18.53 - Experimento niunero 53. .172
5.18.54- Experimentoniunero54 174
5XVIII.l - Apresentaçãodos resultadosobtidosno grupoXVIIIde experimentos 176 5.XVIII.2 - Comentáriospreliminaressobreo grupoXVIII ..176
5.XIX - RESULTADOS DO GRUPO XIX PROCESSO DESCONTÍNUO ALIMENTADO
TE=3h ;K=1,6h-l ;?\.1XO'=I000g"'''''''''''''' ..177
5.19.55- ExperimentonÚIneroS5 """ """""" ". ...178
5.19.56 - Experimento nÚInero 56 ... ... .180
5.XX - RESULTADOS 00 GRUPO XX PROCESSO DESCONTÍNUO ALIMENTADO
TE=3h ; K=1,6h-l ;~O'=1300g .185
5.20.58- ExperimentonÚInero58 ..186
5.20.59- ExperiInentonÚInero59 .. 188
5.20.60- ExperimentonÚInero60 " , 190
5.XX .1 - Apresentaçãodos resultadosobtidosno grupoXX de experimentos ..192
5.XX.2- Comentáriospreliminaressobreo grupoXX... ..192
5.XXI- RESULTADOS00 GRUPOXXI PROCESSODESCONTÍNUOALIMENTADO
TE=3h ;K=1,6h-l ;~O'=I600g ..193
5.21.61- ExperimentonÚInero61 .194
5.21.62- ExperimentonÚInero62 , .1%
5.21.63- ExperimentonÚInero63 198
5.XXI.l - Apresentaçãodos resultadosobtidosno grupoXXI de experimentos 200 5.XXI.2- Comentáriospreliminaressobreo grupoXXI 200
5.XXII - RESULTADOS 00 GRUPO XXII PROCESSO DESCONTÍNUO ALIMENTADO
TE=3h ;K=1,6h-l ;~O'=21 OOg ..201
5.22.64 - Experimento nÚInero64 ., ..202
5.22.65 - Experimento nÚInero65.. ..204
5.22.66 - Experimento nÚInero66 ..206
5.XXII .1 - Apresentação dos resultados obtidos no gI11pOXXII de experiInentos 208 5.XXII. 2 - Comentários preliminares sobre o grupo XXII 208 5.xxm - RESULTADOS 00 GRUPO xxm
PROCESSO DESCONTÍNUO CLÁSSICO
~O'=I000g 209
5.23.67 - ExperiInento nÚInero67. ...210
5.23.68 - Experimento nÚInero68 .212
5.XXIV - RESULTADOS DO GRUPO XXIV PROCESSO DESCONTÍNUO CLÁSSICO
1\{X0'=1300g "0 ... ... .217
5.24.70- ExperimentonÚInero70 , ..218
5.24.71- ExperimentonÚInero71 .." .220
5.24.72- ExperimentonÚInero72 ..222
5XXIV.1 - Apresentaçãodosresultadosobtidosno grupoXXIVde experimentos 224 5.XXIV.2 - Comentáriospreliminaressobreo grupoXXIV 224
5.XXV - RESULTADOS DO GRUPO XXV PROCESSO DESCONTÍNUO CLÁSSICO
1\{X0'= 1600g o o"""""""""" o. o """""""""""""""""""" .225
5.25.73- ExperimentonÚInero73 ." ..226
5.25.74 - Experimento número 74 .228
5.25.75 - Experimento número 75 .230
5.XXV.l - Apresentação dos resultados obtidos no grupo XXV de experimentos 232 5.XXV.2 - Comentários preliminares sobre o grupo XXV 232 5.XXVI - RESULTADOS DO GRUPO XXVI
PROCESSO DESCONTÍNUO CLÁSSICO
1\{X0'=21 00g .233
5.26.76- Experimentonúmero76 ..234
5.26.77 - Experimento nÚInero77 " 236
5.26.78- ExperimentonÚInero78 .238
5.XXVI.1 - Apresentaçãodos resultadosobtidosno grupoXXVIde experimentos 240 5.XXVI.2 - Comentáriospreliminaressobreo grupoXXVI 240
6 - DISCUSSÃO DOS RESULTADOS 241
6.1- INTRODUÇÃO... ,.. ..241
6.2- PRODUÇÃODEETANOL 247
6.2.1 - Produção de etanol pelo processo descontínuo alimentado 247 6.2.1.1. - Produção de etanol pelo processo descontínuo alimentado, para cada
6.2.1.1.2 - Produtividade e rendimento em etanol em função da massa de inóculo,
para TE = 4 horas. .251
6.2.1.1.3 - Produtividade e rendimento em etanol em fimção da constante de
tem-po e da massa de inóculo, para TE = 3 horas. 255
6.2.1.2 - Produção de etanol pelo processo descontínuo alimentado: Análise con-joota das três variáveis estudadas: tempo de enchimento, constante de tempo e
massa de inóculo. ...262
6.2.2 - Produção de etanol pelo processo descontínuo clássico. 272 6.2.3 - Verificação de relação entre produtividade em etanol e rendimento em etanol. 281
6.3 - PRODUÇÃO DE CÉLlJl.AS 284
6.3.1 - Produção de células pelo processo descontínuo alimentado 284 6.3.1.1 - Produção de células pelo processo descontínuo aJimentado,para cada
tem-po de enchimento ('TE) .285
6.3.1.1.1 - Produtividade em células e fator de conversão de substrato em células
(Yxls) em fimção da constante de tempo e da massa de inóculo, para TE =5 horas 285 6.3.1.1.2 - Produtividade em células e fator de conversão de substrato em células
(Yxls) em fimção da massa de inóculo, para TE= 4 horas. 288 6.3.1.1.3 - Produtividade em células e fator de conversão de substrato em células
(Yxls) em fimção da constante de tempo e da massa de móculo, para TE = 3 horas 291 6.3.1.2 - Produção de células pelo processo descontínuo alimentado: Análise
conjoo-ta das três variáveis estudadas: tempo de enchimento, consconjoo-tante de tempo e massa
de móculo .297
6.3.2 - Produção celular pelo processo descontínuo clássico. 310 6.4 - VERIFICAÇÃO DE RELAÇÃO ENlRE PRODUTIVIDADES EM CÉLlJl.AS E EM
ETANOL. .315
7. CONCLUSÕES ... ...317
8. REFERtNCIASBffiUOORÁFICAS... ... .319
Foram estudados os processos descontínuo e descontínuo alimentado de
fermentação alcoólica, utilizando-se mosto de melaço de cana de açúcar e
Saccharomyces cerevisiae na forma de fermento prensado.
Foram analisados a influência da vazão de alimentação exponencialmente decrescente, do tempo de enchimento e do nível de inóculo no comportamento do sistema, considerando os seguintes parâmetros:
-
produtividades em etanol e em células- rendimento em etanol
- fator de conversão de substrato em células.
Para o processo descontínuo alimentado, o valor máximo atingido para a produtividade em etanol foi de 16,9 g/L.h.
ABSTRACT
The batch and fed-batch fermentations of sugar -cane blackstrap molasses by the action of Saccharomyces rerel4siae(pressed yeast) were studied.
The influence of exponentiallydecreasing feeding rates, fermentar filling-up time and levei of inocullum on the behavior was analysed considering the followingparameters:
- ethanol and cell productivities
- ethanol yield
- yield yeast.
At fed-batch fermentation, the maximum ethanol productivity obtained was 16.9 g/L.h.
NOMENCLATURA
ART: Açúcares redutores totais, calculados como glicose;
c: Constante de integração;
-DIF.: Diferença entre valor estimado e experimental (%); e: base do logaritmo neperiano
E: Concentração de etanol no meio isento de leveduras (g/L): F: vazão no instante T (Uh):
FO: vazão inicial (Uh):
K: Constante de tempo (h-1);
ME: Massa de etanol produzido até instante T, presente na fase líquida (g);
MEf:Massa de etanol presente na fase líquidano finalda fermentação(g); M5Af: Total de massa de ART adicionada na fermentação (g);
MSA: Massa de ART adicionado até instante T (g);
M5R: Massa de ART residual no instante T, presente na fase líquida(g);
M5C: Massa de ART consumido até instanteT(g);
MX: Massatotal de células secas no instante T(g);
MXf: Massa total de células secas no final da fermentação (g):
MXO: Massa total de células secas no inícioda fermentação (g):
MXOm: Massa seca médiade levedura no inóculo (g);
MXO':Massa úmidade fermento prensado utilizada o inóculo(g);
Nd: Normalidade do dicromato utilizado para receber o etanol destilado; Pe: Produtividade em etanol (g/L.h);
Pem: Produtividadeemetanol média (g/L.h);
Pe"":Produtividadeemetanol estimada (g/L.h);
Px: Produtividade em células (g/L.h);
Pxm: Produtividade em células média (g/L.h); Px"": Produtividade em células estimada (g/L.h); q.s.p.:quantidade suficiente para;
r: Coeficiente de correlação linear: r2: Coeficiente de determinação: Re: Rendimento em etanol (%):
Rem: Rendimento médio em etanol (%); Re"": Rendimento em etanol estimado (%);
s: Desviopadrão:
5: Concentração de ART na doma no instante T (g/L);
50: Concentração de ART no mosto de alimentação (g/L); T: Tempo (h);
TE: Tempode enchimento (h);
TF: Tempo de acompanhamento da fermentação (h);
VAD: Volume de mosto adicionado até instante T (L);
Vb: Volume de sulfato ferroso amoniacal gasto para titular (reduzir) o dicromato de normalidade N e volume V (mL);
VD: Volume de meio na doma (L); VF: Volume final de meio na doma (L); VL: Volume de líquido na doma (L);
VM: total de volume de mosto adicionado à doma até instante T (L) VX: Fração do volume de meio ocupado pelas células (%);
VO:Volume de inóculo (3,0 L);
X: Concentração celular em base seca (g/L).
Y
=
(103. Yxls) : Parâmetro relacionado com o fator de conversão desubstrato em células;
Ym: Valor médio do parâmetro Y; Y": Valor estimado do parâmetro Y;
Após o advento da aise do petróleo, no início da década de 70, a utilização do etanol como combustível carburante surgiu como alternativa para países carentes em reservas desse óleo e com grandes extensões territoriais (4). No Brasil, em 1975 foi criado o PROÁLCOOL (Programa Nacional do Àlcool) que teve como objetivo principal aumentar a produção de etanol no país, diminuindo sua dependência do petróleo.
No momento, quando a obtenção de etanol por via fermentativa não é muito atrativa, devemos ter uma preocupação ainda maior com a otimização deste processo. visto que no Brasil há ainda grande produção de etanol, sendo, na região centro-sul. autorizada para a safra de 1994/1995 uma produção de aproximadamente 8 bilhões de litros (12).
Por outro lado devemos considerar que a produção de etanol no Brasil tem benefícios que são de difícilmensuração econômica, dentre os quais: custo
social de substituição de importações elou inaemento de exportações,
regulação do mercado internacional do açúcar (90), contribuição com a atual matriz energética nacional (109), além de ser proveniente de matéria- prima renovável. BORZANI(17) mostra que o PROALCOOLaumentou a produção de
alimentos nas áreas onde ocorreu plantação de cana-de-açúcar e criou
empregos diretos e indiretos. Adicionalmente,do ponto de vista ambienta!, o etanol, na forma anidra, substitui com vantagens os aditivos do tipo "chumbo tetraetila" no tocante ao rendimento, sem os inconvenientes da poluição ambiental (7, 34, 90), e na forma hidratada é comprovadamente menos tóxico que a gasolina (1, 9). Sob este último aspecto já se iniciou recentemente a exportação do álcool etílico para paises que, embora sejam grandes produtores de petróleo, resolveram utilizá-Ioem lugar de aditivos poluentes.
Com todos os investimentos feitos na área de fermentação alcoólica, conseguiu-se um decréscimo no custo da produção de etanol, seja pelo aumento do rendimento e produtividade da fermentação, seja pelo melhor
aproveitamento da matéria-prima e separação do etanol. Atualmente, já é
cana e se estuda a obtenção de invertase a partir da levedura proveniente da
fermentação alcoólica (26. 124). Esses dados n06 dão uma boa idéia do
desenvolvimento atingido no setor.
No Brasil. as matérias-primas mais utilizadas para a produção de etanol são as açucaradas. como o melaço e a cana-de-açúcar (107). SERRA (108), porém. diz que há a possibilidade de utilização de matérias-primas comumente não utilizadas para a produção de etanol. como aJlturas complementares à cana-de-aç(jcar ou sua substituição em determinadas regiões. Neste sentido, foram feitos trabalhos com a intenção de estudar a utilização de matérias-primas alternativas tais como mandioca (13, 96, 98, 107. 118). batata doce (96). sorgo sacarino (11, 76. 96) e milho (81).
SERRA (108) apresenta uma tabela com as matérias-primas cana-de-aÇÚCBr,sorgosacarino,batata doce,mandioca e milho,mostrando a composição, produtividade e rendimento(de fermentação) em etanol de cada uma delas e conclui que, quando se observa o rendimento em etanol por hectare por mês. verifica-se que o sorgo sacarino apresenta um elevado índice e que a batata doce e a cana-de-açúcar se sobressaem. A mandioca apresenta um índice mais baixo em relação às outras culturas. Por outro lado.embora a mandioca não
apresente índices de rendimento tão elevados. deve-se lembrar que sua
potencialidade quanto à produtividade (toneladaslhectare) e utilização integral da planta são problemas ainda pouco estudados e difundidos no Brasil. Acrescenta que a utilização da mandioca se justifica pelo fato de ser uma cultura que poderá atuar no sentido de melhorar a alimentação e facilitar a fixação do homem em determinadas áreas do território nacional.
ARAÚJO et alii (11) comentam que o trabalho com sorgo apresenta como vantagem ponderável o aproveitamento do equipamento das usinas de açúcar e etanol no período de entre-safra de cana-de-açúcar, estendendo-se a produção de álcool aos doze meses do ano, com manutenção da equipe de operação.
O presente trabalho foi realizado com melaço de cana-de-açúcar.
Nos processos fermentativos de produção de etanol utiliza-se
principalmente o Saccharomyces cerevisiae (119). embora haja estudos
procurando utilizar fungos e bactérias. Tem eles a intenção de utilizar tanto
Zymomonas moblus(31, 65. 67.72,73.75.93, 103.). A leitura de alguns desses trabalhos nos permitem concluir que certos problemas poderiam aparecer com
a utilização de Zymomonas mobi/is para a produção de etanol a partir de cana-de-açúcar elou melaço de cana-de-aç(acar tais como a formação de levano (67) e baixa velocidade de consumo da frutose (12).
Quanto às leveduras. ainda hoje há pesquisas com a finalidade de selecionar elou testar suas atividades fermentativas com respeito à produção de
etanol(15. 101).
No presente trabalho. utilizamos levedura proveniente de fermento
prensado.por ter aplicação bastante difundida em usinas de álcool. devido
possuir boa atividade fermentativa. facilidade de separação e possibilitar
tratamento ácido para diminuiro número de contaminantes.
No Brasil. há algumas décadas o processo utilizado era o descontínuo clássico, mas. atualmente. grande parte do etanol é produzido pelo processo descontínuo alimentado de fermentação.
A partir do final da década de 60 .começou-se a utilizar mais
intensamente o processo de fermentação pelo método de "MELLE-BOINOT'que desde então passou a ser a principal técnica difundida e adotada em escala
industrial. Neste processo, uma vez terminada a fermentação do conteúdo do
tanque de fermentação. o vinho resultante é centrifugado ,obtendo-se uma
suspensão de células altamente concentrada (leite de lêvedo ). A suspensão é então enviada para tanques de tratamento onde é diluída com água e tratada com ácido sulfúrico até valor de pH próximo de 2.5 e após (2-3) horas sob agitação é utilizada como inóculo (5. 99. 119).
Numa análise da bibliografia em fermentação alcoólica, verificamos que muitos processos foram estudados. principalmente em escala laboratorial elou piloto: processo contínuo com células livres (6. 28. 59. 94. 105, 130). processo continuo com células imobilizadas (35. 116). processo utilizando leveduras floculantes (56, 70, 89. 101), processo sob pressão reduzida (32, 102), processo
Atualmente, há instalações industriais produzindo etanol por processo contínuo, entretanto o processo de batelada alimentada com recielo de células ainda é utilizado por grande parte das usinas nacionais. ZARPELON &. ANDRIETTA(130) comentam que dentre os processos contínuos desenvolvidos. os processos de fermentação em cascata são os mais satisfatórios e que no Brasil há pelo menos quatro desses processos operando com sucesso em escala industrial, alcançando produtividades em etanol da ordem de 9,4 glL.h.
As usinas que trabalham com o processo descontínuo alimentado
completam as domas sob condições controladas até o completo enchimento destas. Algumas das técnicas empregadas para o enchimento são:a) regular a vazão de alimentação de forma a manter, na doma,a concentração de açúcares
redutores totais próxima à metade da concentração do mosto de
alimentação(40) ou b) regular as vazões de "leite de lêvedo" e de mosto para manter uma concentração de açúcares da ordem de (5-6)OBrixno mosto de fermentação (52).
Vários trabalhos têm contribuído para o conhedmento do processo
descontínuo alimentado de produção de etanol . Pela análise destes
Este trabalho tem por objetivos contribuir para o estudo do
processo fermentativo descontinuo aUmentadode produção de etanol, utilizando
vazões exponencialmente decrescentes no enchimento de domas, bem como
executar eXPerimentos que permitam a "transição" da batelada alimentada para
batelada dássica. Ainda visa obter um conjunto de dados que, posteriormente,
possibilitem estudo cinético desse processo. Para tanto, trabalhou-se com as
seguintes variáveis: tempo de enchimento das domas, vazão de alimentação
Processo descontinuo dássico. ou simplesmente processo descontinuo. é
um processo fermentativo utilizado desde a antigüidade. Cada fermentador
recebe um inóculo e em seguida adiciona-se todo o mosto num intervalo de
tempo que pode ser considerado desprezível em relação ao tempo de
fermentação. Terminada a fermentação. a doma é descarregada. o material
fermentado pode ou não ser separado da fração celular, dependendo do produto fermentado e se for separado da fração celular. esta pode ou não ser reutilizada para inocular a doma para fermentação subseqüente. É um processo que pode levar a baixos rendimentos e/ou produtividades quando o substrato adicionado de uma vez só no início da fermentação exerce efeitos inibitórios ou desvia o
metabolismo celular a produtos que não interessam. Mas é um processo
bastante útil. principalmente quando se deseja rigor em esterilidade. Por outro
lado. é o processo mais utilizado na indústria de alimentos. Alguns dos
alimentos e bebidas produzidos por este processo fermentativo são iogurte.
chucrute. picles. cerveja, vinho, entre outros.
Já o processo descontínuo alimentado é definido como sendo aquele em que o fermentador é continuamente alimentado com substrato sem que haja saída de meio em fermentação, a não ser no final desta (39, 97, 126). Como conseqüência. este tipo de operação leva ao aumento contínuo do volume de meio em fermentação na doma. Terminada a fermentação. a descarga pode ser efetuada total ou parcialmente. sendo neste último caso denominado processo descontinuo alimentado cídico (97).
YOSHIDA et alii (126) analisaram o processo descontínuo alimentado
para o caso em que a velocidade de alimentação de substrato é constante. Por balanço material. chegaram a uma equação o"de mostram que a variação de massa de substrato no sistema é dada por uma parcela de suprimento e outra de demanda. representadas pela adição de substrato e consumo deste para o crescimento celular. respectivamente.
DUNN &. MOR (39) citam que os processos continuo e descontínuo
alimentado têm aplicações equivalentes em pesquisa na área de bioengenharia.
domas com o processo descontínuo alimentado tornam-no um processo de grande utilidade em escala industrial (53), pois o controle da velocidade de adição de substrato ao fermentador é meio de se evitar os mecanismos de
repressão por substrato ou produto excretado levando a importantes
aaéscimos em produtividades eJou rendimentos.
Há trabalhos na literatura visando a utilização do processo descontínuo alimentado, principaJmente para produção de miaorganismos (3, 33, 53. 95), aminoácidos (57, 92) e antibióticos(110, 115), mas já se tem a tentativa de produção de outros produtos tais como enzimas (117) e até mesmo células animais (125).
AIBA et alii (3) citam que no cultivo de Saa:::haromyces cereVls/ae
crescendo em aerobiose com glicose como substrato. quando a concentração desta atinge 70 mg/L, a glicose tende a ser parcialmente desviada para a produção de etanol e C02 . Isto diminuiriao fator de conversão de substrato em células. Por outro lado. com concentrações de substrato muito baixas. tem-se que a velocidade de crescimento do microorganismo diminui sensivelmente. Daí a importância da vazão de alimentação de substrato na produção de levedura de panificação.
KISHIMOTOet alii (57) estudando a produção de ácido glutâmico por processo descontínuo alimentado, com Brevibacterium divaricatum e etanol como substrato. trabalharam com vazão de alimentação de forma a manter a concentração de etanol constante na doma. Verificaram que a ação inibitóriado etanol era crescente com o aumento de sua concentração, mas que era em
concentrações mais elevadas que se conseguia maiores velocidades na
produção de áCido glutâmico. Sugeriram, então. que a produção de ácido glutâmico fosse realizada em dois passos: inicialmente (até aproximadamente 20 horas de cultivo) mantendo concentrações mais baixas de etanol (por volta de 5%) para rápida produção de células, e num segundo passo elevando a concentração de etanol (aproximadamente 35%) para aumentar a produção de ácido glutâmico.
SOLTERO et alii (110) , trabalhando com produção de penicilina por
Penici//ium chtySogenum Q-176 em meio sintético, verificaram que poder-se-ia
substituir a lactose por glicose ou sacarose continuamente adicionados ao meio
condições empregadas por eles, as velocidades ótimas de adição de glicose e sacarose para produção de penicilina foram 0,30 glL.h e 0,36 g/L.h. respectivamente.
UDOMVARAPHUNT &.YOSHIDA (111), em estudo visando a produção de penicilinacilase, verificaram que ocorreu uma diminuição do fempo para a produção máxima da referida enzima de 70 para 50 horas quando se utilizou o processo descontínuo alimentado ao invés de descontinuo.
XIE &. WANG (125), investigando a influência de diferentes meios de
cultivo e estratégias de alimentação, verificaram que a utilização do processo
descontinuo alimentado no cultivo de células de hibridoma levou a menores
velocidades específicas de formação de ladato e de amônia (diminuiram 26
vezes e 50 vezes, respectivamente), se comparadas com as obtidas com
processo descontinuo clássico. Mais importante que isso, o total de células
produzidas pelo processo desenvolvido por eles foi 5 vezes maior que a
quantidade obtida pelo processo descontínuo clássico.
Antes do advento do PROÁLCOOL, quando as usinas tinham domas
pequenas de trabalho, o processo descontinuo era o mais utilizado para
produção de etanol. Depois, com o aumento do volume das domas de
fermentação, esse processo passou a ser substituído pelo descontínuo
alimentado, por limitação de bombeamento de mosto e/ou formação de espuma.
Há muitos trabalhos na literatura que deram atenção a fenômenos de
inibição em fermentação alcoólica (principalmente efeito do etanol, do substrato
e das células), destacando-se estudos com processo descontínuo. Esses
trabalhos serão discutidos a seguir.
a) Efeito do etanol
Um dos fatores principais que causam baixa velocidade de produção de etanol por leveduras parece ser o efeito inibitório do etanol. Este tem sido examinado por diversos trabalhos de pesquisa. Nestes, incluem-se estudos a respeito do efeito do etanol no crescimento celular(2, 44, 91), no consumo de açúcares (30, 44, 47) e na viabilidade celular (83, 84).
decresceu de 0,156 g célulalg glicose a 0,026 g célulalg glicose com o aumento da concentração de etanol de Oa 107 glL. indicando uma definitivarelação entre rendimento em biomassa e inibição por etanol. Por outro lado. o etanol não teve efeito sobre o rendimento em etanol.
NAGODAWITHANA&. 5TEINKRAU5 (84) acompanharam o efeito
inibidor do etanol pela perda de atividade de álcooldesidrogenase. sugerindo que a inibição se situaria a nível dessa enzima. enquanto que NAVARRO (86) concluiu que a enzima mais significativamente inibida é a hexoquinase.
LUONG (71) conclui. com base em dados da literatura. que "como as relações dos inversos das velocidades específicas de crescimento (1/u) e dos
inversos das concentrações de substrato (115). na presença de diferentes
concentrações de etanol. são lineares com diferentes indinaçães. mas
convergindo sempre a um mesmo ponto de intersecção com o eixo da abscissa ( dados de 1/5 ) tem-se que a velocidade específica de crescimento do microrganismo parece ser inibida pelo etanol de maneira não competitiva (similar a uma reação enzimática)."
Há divergências a respeito da inibição pelo etanol depender ou não de sua origem. Alguns autores (84. 91) observaram que o etanol adicionado é menos inibidor que o etanol produzido. Esta observação era apoiada pelo fato da
concentração intracelular de etanol ser maior que a extracelular, devido à
resistência de difusão (85).Por outro lado. GUIJARRO &. LAGUNAS (48). na
tentativa de elucidar o mecanismo de transporte do etanol através da
membrana, realizaram um experimento para medir quantitativamente o acúmulo intracelular de etanol. Chegaram à conclusão que não ocorre acúmulo de etanol e que este permeia a membrana celular por simples difusão.
DOMBEK&.INGRAM(38) relatam que" tanto o etanol adicionado como o
acumulado no caldo de fermentação causam mudanças fisiológicas no
Saccharomyces cerevisíaeKD2 tais como danos pelo etanol. que levam a uma
diminuição em sua habilidade de produção desse álcool. Mesmo lavando as células. essas não recuperam sua atividade de produção de etanol. A extensão
dos danos causados pelo etanol parece estar relacionado com sua
Estudos cinéticos que abordaram o efeito inibitório do etanol no crescimento celular chegaram a diferentes condusães. Alguns relataram que a capacidade de inibição era uma função hiperbólica da concentração de etanol (1, 44). Outros conduíram que era linear (51, 66), exponencial (80, 82) ou funções mais complexas (14).
Esta heterogeneidade nas condu5Õe5 pode estar ligada a vários fatores: grau de inibição dos álcoois (68, 69), efeito da temperatura na velocidade de produção de etanol (84), composição lipídica da membrana dtoplasmática
(49,77)presença de oxigênio molecular (50, 63, 64, 83), espécies de
microorganismos (54), concentração inicial de células com que se trabalha (123), entre outros.
b) Efeito do Substrato
As vantagens de se trabalhar com concentrações elevadas de açúcares fermentesaveis no mosto de alimentação induem redução de água de diluição,
supressão de contaminantes osmossensíveis e redução dos custos de
destilação, enquanto a concentração de etanol não se tornar inibitória. Altas concentrações de substrato são, no entanto, inibitóriasà fermentação (54).
CIFTICI et alii (29) comentam que quando a concentração de glicose
decresce à exaustão , ocorrem a respiração e a produção de etanol. Por outro
lado, níveis de glicose maiores ou iguais a 5% causam um desvio para
fermentação somente, mesmo em presença de ar. Dizem ainda que, uma vez que a concentração de glicose dentro da célula é muito pequena, a inibição pela mesma deve ser exercida por um intermediário, ou ser efeito da inibição por produto. ou ser resultado de um efeito osmótico.
NAGODAWITHANAet alii (83) relatam que" mesmo em meio aerado ,a
300C, em meio com altas concentrações de açúcares, não ocorre síntese rápida
de enzimas respiratórias devido a repressão catabólica e então a célula
dependeria da via glicolítica com produção de etanol para seu requerimento
energético. Com células com alta velocidade de fermentação, um posterior controle por feed-back sobre a via glicolíticapode ser esperado devido a inibição por produto. Isto pode causar uma depleção no nível energético da célula,
podendo levar a um rompimento da atividade metabólica levando à morte
Muitos pesquisadores concordam. de um modo geral. que a inibição pelo substrato começa a ser significativa para valores superiores a 100 g/L em fermentações com Saccharomyces cerevisiaee glicose como substrato (29. 30.
47,78,79, 114).
CONVERTI et alii (30) trabalharam com Saccharomyces cemvisiae e sacarose como fonte de carbono. Medindo as velocidades iniciais de consumo
de substrato. verificaram que se obtinha um aumento dos valores das
velocidades máximas quando a concentração inicial de substrato se situava entre 50 a 100 glL. Também verificaram que quando a concentração inicial de substrato era superior a 100 glL, ocorria uma mistura de inibição competitiva e não competitiva, evidenciada pelo aumento da constante de Michaelis-Mentene decréscimo da velocidade máxima, respectivamente.
THATIPAMALAet alii (114). trabalhando com processo descontínuo. constataram que o fator de conversão de substrato em produto ( Ypls ) caiu de 0,45 9 etanollg glicose a 0,30 9 etanoll 9 glicose quando mudou a concentração inicialdo meio de fermentação de 150 g/L para 280 gIL. Disseram que os dados experimentais indicam que a inibição por substrato é mais tóxica do que inibição por produto e desativa algumas importantes enzimas que são vitais para a sobrevivência da levedura, resultando num decréscimo de viabilidade celular.
c) Efeito das Células
A vantagem de se trabalhar com concentrações celulares mais elevadas está na redução do tempo de fermentação. No entanto, há alguns trabalhos evidenciando que concentração celular elevada no inóculo inibe seu próprio crescimento.
GHOSE &. TYAGI (43), estudando o crescimento de SaccIJaromyces
cerevisiae NRRL-Y 132 em fermentação alcoólica de bagaço de cana hidrolisado, em processo descontinuo, verificaram que o crescimento celular diminui com o aumento da concentração inicial de células, sendo que para concentrações celulares iniciais iguais ou superiores a 21,0 glL (massa seca) não havia crescimento celular. Estes autores explicaram tal comportamento através do conceito de energia de manutenção (91), pois com o aumento da
massa celular inicial no fermentador crescem as necessidades relativas à
manutenção e os nutrientes disponíveis são consumidos para atender esta finalidade.
STREHAIANOet alii (113), trabalhando com fermentação alcoólica por processo descontínuo e com diferentes níveis de inóculo, encontraram que as velocidades máximas específicas de crescimento decresceram hiperbolicamente com o aumento da concentração do inóculo, enquanto que o rendimento em etanol não mudou para diferentes concentrações de inóculo. Sugerem que o álcool não é o único inibidor do crescimento microbiano, pois conduem que há inibidores presentes no inóculo.
DEL ROSARIO (37), estudando a cinética da fermentação alcoólica com altas concentrações de levedura floculante (inóculos de 58 g/L e de 83 glL em massa seca) em processo descontínuo alimentado, verificou que, após 5 horas de fermentação, para o menor inóculo houve uma perda de viabilidade de 16%, enquanto que para o inóculo de 83 glL a perda foi de 35%.
Por outro lado, há trabalhos com processo descontínuo que visaram o estudo do efeito de condições experimentais apenas em resultados globais finais tais como rendimentos e produtividades do processo.
MAGALHÃESet alii (74), checando a influência da adição de fonte de
nitrogênio ao mosto de melaço de cana-de-açúcar no teor de proteína de
levedura residual, no processo de batelada, verificaram que não há vantagem em suplementar o mosto com nitrogênio (na forma de sulfato de amônio ou de uréia) com concentrações superiores a 0,6 glL, levando-se em conta apenas a concentração final de proteína celular. Por outro lado, observando o perfil do gráfico que representou tempo de fermentação em função de uréia no mosto,
aUEIROZ et alii (100) estudaram influência do inóculo (Xi) e da
concentração inicial do mosto (Si) em processo descontínuo de fermentação
alcoólica, com condições experimentais onde as concentrações iniciais de
mosto (em ART) e de inóculo (em massa seca) variaram de 90,9 a 226,2g1L e
de 1,1 a 57,1 glL, respectivamente. Verificaram que para somente 3
experimentos não houve crescimento celular (Si = 216,7 glL, Xi = 25,0 g/L;
Si = 209,1 glL, Xi = 30,6 glL; Si = 206,9 glL, Xi = 55,1 glL)
.
Os rendimentos em etanol não tiveram um perfil com tendência definida em função de Si e elesconduíram que o fator de conversão de substrato em células bem como a
quantidade de substrato utilizado para manutenção não são constantes.
BORZANI et alii (21) chegaram a uma equação empírica para relacionar a produtividade em etanol (P) com concentração inicial de açúcar (Si) e
concentração inicial de células em massa seca (Xi) para o processo de batelada dássica. Os valores de Si variaram de 90 a 260 g/L e os de Xi de 14 a 31 glL. A equação por eles obtida pode ser escrita assim:
P = b . Si . Xi / ( a . Si +tm . Xi )
Onde: a = constante de proporcional idade entre o tempo de fermentação e a razão Si/Xi;
b = constante de proporcionalidade entre a concentração de etanol no vinho fermentado e Si ;
tm = "tempo morto" em um cido de funcionamento de uma doma.
ENDO et alii (41), trabalhando com processo descontínuo, verificaram que o rendimento em etanol tem valores mais elevados para concentrações iniciais de substrato entre 130 e 200 glL e concentração de células no inóculo
( Xi - em massa seca) da ordem de 2 glL. Com o aumento de Xi de 2 glL para
6 g/L, nota-se, graficamente, que houve diminuição do rendimento em etanol
que, devido à apresentação gráfica, não pode ser quantificada. Mesmo com Xi de 6,Og/L, trabalharam em condições distantes das utilizadas industrialmente.
CHEN (27) estudou o processo descontínuo. Trabalhou com meio
sintético com glicose como fonte de carbono ( concentrações que variaram de 120 a 300 Brix ) , -suplementado com extrato de levedura, e com uma levedura
termos de massa seca)
.
Chegou a produtividades em etanol da ordem de21g/L.h, com concentrações iniciais de 44 g/L (base seca) , 120 Brix e 2.8 % para células, substrato e extrato de levedura, respectivamente.
VAZ et alii (122) estudaram o efeito da temperatura e da suplementação do mosto em fermentação alcoólica pelo processo de batelada. Nos
experimentos, conduzidos com Saccharomyr::es uvarume com Saccharomyces
cerevisiae como inóculo, verificaram uma queda bastante acentuada na
produtividade em etanol ( da ordem de 60% ) quando trabalharam com temperatura de 380C ao invés de 300C. Para os rendimentos alcançados. constataram que foram pouco alterados em função da suplementação do meio. Nesta suplementação, foram utilizados, isoladamente ou em grupos, as seguintes substâncias: ácido linoleico. ergosterol, tween 80, albumina bovina, lecitina de soja, farinha de soja e óleo de soja comercial.
o primeiro trabalho realizado. tendo como objetivo estudar o processo descontínuo alimentado para produção de etanol, foi publicado por ENDO &
INOUE (40). Trabalharam com meio sintético e com glicose como substrato na
concentração de 10 g/L. condições essas bastante diferentes das adotadas
industrialmente. Posteriormente foram realizados trabalhos onde se procurou
essa aproximação.
Alguns trabalhos (45, 58. 60. 88) procuraram verificar a influência dos fatores: concentração celular no inóculo (9,5 glL
-
122,3glL em massa seca), concentração de açúcares redutores totais no mosto de alimentação (151,7 glL -330,9 glL), e vazão de alimentação constante (0,36 LIh - 2,04 Uh),produtividade em etanol mais baixas. O rendimento em etanol praticamente não foi afetado pelas condições experimentais.
Em trabalho posterior, BORZANI (16), relacionando velocidade de
produção de etanol em processo descontinuo alimentado para produção de
etanol com vazão constante, mostra que é possível avaliar o máximo valor de vazão de alimentação que deve ser usado de forma a obter um meio completamente fermentado no fim da fase de enchimento.
AQUARONE et alii (10) realizaram estudos do processo descontínuo alimentado para produção de etanol, utilizando diversos tipos de alimentação: vazão constante e vazão variável (linear decrescente e exponencial crescente). Observaram um aumento da produtividade em etanol quando utilizaram vazão de alimentação linearmente decrescente com o tempo. Esses resultados foram confirmados mais tarde (61).
De fato, KRAUTER et alii (62) concluíram que aumentou-se a
produtividade em etanol aproximadamente em 10% quando se utilizaram vazões de alimentação linearmente decrescentes ao invés de vazões de alimentação constantes em processo descontínuo alimentado para produção de etanol. Verificaram ainda uma correlação linear entre massa de etanol e tempo na fase de enchimento da doma.
VASCONCELOS&.VALDMAN(120). trabalhando com mosto de caldo de
cana-de-açúcar em escala piloto e utilizando vários perfis de vazão de
alimentação do mosto à doma, verificaram que nos perfis decrescentes obtinham-se maiores produtividades em etanol, tanto no final da fase de enchimento como nas produtividades finais do processo.
Trabalhando em escala industrial, VASCONCELOS &. VILELA FILHO
(121) ressaltaram a importância do perfil da vazão de alimentação na
produtividade e na eficiência do processo fermentativo.
CARVALHOet alii (23) estudaram o efeito de vazões exponencialmente
decrescentes (F=FO.e-K.T), onde K representa a constante de tempo, no
enchimento de domas- com tempos de enchimento de 5 e 7 horas - utilizando
o processo fosse batelada dássica) e mosto de 220 g/L em ART. Conseguiram um aumento da produtividade em etanol de 14% e 13% quando passaram de K=O (vazão constante de alimentação) a K=0,6 h-1 para tempos de enchimento de 5 e 7 horas, respectivamente, sem que houvesse queda no rendimento em etanol. Ajustaram uma equação do tipo Monod para relacionar vazão mássica
inicial ( FO
.
50 ) e produtividade em etanol ( Pe ). Nas condições por elesestudadas, chegaram a:
Pe = 9,6 . ( FO . 50 ) I ( 54 +FO.50 )
onde: FO= vazão de enchimento inicial (Uh)
50 = concentração do mosto em ART (g/L)
A equação anterior estima que a produtividade máxima possível de ser alcançada nas condições estudadas é 9,6 glL.h .
Em trabalho posterior. CARVALHO et alii (25), analisando os resultados
referentes a células. nas condições de fermentação acima descritas. chegaram a
equações do tipo hiperbólica para correlacionar tanto Px ( produtividade em
células) como Yxls (fator de conversão de substrato em células) com a vazão
mássica inicial (FO .50). Essas equações foram, respectivamente:
Px = 1,84 .( FO.50 ) I (156,1 +FO.50 )
103. Yxls = 73,0 . ( FO. 50) I (80,3
+
FO.
50 )onde: FO= vazão de enchimento inicial (Uh)
50 = concentração do mosto de alimentação, em ART (g/L)
5eus resultados permitem, ainda, conduir que a utilização de vazões
exponencialmente decrescentes com constante de adição ( K ) igual a 0,6 h-1
em vez de K=O (vazão constante de alimentação) levou a um aumento das
médias dos fatores de conversão de substrato em células e das produtividades
em células da ordem de 24% e 42%, respectivamente, para tempo de
valor zero para o valor 0,6 h-1. Esse incremento da produção de células não afetou os valores de rendimento em etanol.
VITOLO et alii (124), trabalhando com o mesmo processo descontínuo alimentado, com vazão exponencialmente deaescente de mosto. para produção de etanol, acompanharam a atividade invertásica das células. Constataram um aumento de 16% e 17% na velocidade específica de crescimento celular e na atividade invertásica específica em células na fase de enchimento da doma, respectivamente, quando se trabalhou com constante de tempo (K)de 0,6 h-1 ao invés de K=O.para tempo de enchimento de 7 horas.
CARVALHO & AQUARONE (24) publicaram uma nota prévia, onde
fizeram um estudo preliminar da otimização do processo descontínuo
alimentado de produção de etanol, utilizando vazões exponencialmente
decrescentes de enchimento de domas ( F=FO.e-K.T) e massas de inóculo
( fermento prensado) variáveis. Trabalharam com volume de inóculo de 3 L e adicionaram 7 L de mosto à doma .Conduíram que para tempo de enchimento de 5 horas e K=0,6 h-1 e K=0,8 h-1 , massas úmidas de inóculo da ordem de 1000 gramas já são suficientes para se conseguir o término da fermentação simultaneamente com o término do enchimento da doma, utilizando-se mosto com concentração de aproximadamente 220 g/L em ART. Esse estudo feito por eles, com alteração de massa de inóculo, foi realizado com os valores de constante de tempo (K)que levaram a melhores resultados em trabalho anterior
(23).
4.1 - MATÉRIA PRIMA
Utilizou-se melaço de cana-de-açúcar em todos os experimentos. Foi
recebido da Usina Éster (Cosmápolis) e armazenado em tambores de 200 L,
sendo o lote de melaço suficiente para a realização de todos os experimentos e tendo teor de ART em torno de 85% em massa.
4.1.1 - Mosto
A preparação do mosto consistiu em sua prévia darificação e posterior
diluição e suplementação adequadas.
A darificação foi realizada com diluição do melaço pela adição de água
destilada, em partes iguais, adição de 1,5 g de fosfato de sódio monobásico ,
como agente floculante, em cada litro da solução de melaço diluído e posterior
aquecimento a 1210e por 10 minutos. Após o aquecimento, foi mantido em
repouso. no mínimo por 48 horas, para sedimentação do material em
suspensão. O melaço darificado foi. então. sifonado e diluído com água
destilada de forma a se obter mosto com concentração de aproximadamente
220 glL em ART (23). Acertou-se o pH do mosto na faixa de 4,5
-
5,0 (54) pela adição de ácido sulfúrico concentrado ou de solução de hidróxido de sódio 4normal. Suplementou-se com uréia a 0,5 glL (14) e adicionou-se penicilina V
ácida ao mosto na concentração de 500 U/L (8).
4.2 - INÓeULO
Os experimentos foram realizados utilizanda-se como inóculo fermento
prensado comercial ,suspenso em água destilada. GOMEZ & BORZANI (46)
verificaram que a utilização de fermento prensado em fermentações alcoólicas
leva a variabilidades nos resultados da ordem de 5% e de 10% quando se
trabalha com meio sintético e com meio de melaço de cana-de-açúcar,
respectivamente. Por motivos operacionais , o volume de inóculo foi fixado em
impossibilidade de se obter informações a respeito da data de fabricação do fermento. nível de contaminantes e das condições de armazenamento, verificou-se apenas sua aparência (textura e cor) e odor.
4.3 - EQUIPAMENTO
Foi utilizado. em todos os experimentos. fermentador fabricado pela New Brunswick Scientific ec. Inc.. com domas de vidro de 14 L de capacidade nominal. com controles de temperatura e de freqüência do agitador. A figura 4.1 mostra, esquematicamente, o equipamento utilizado nos experimentos
4.4 - DESCRiÇÃO DE UM EXPERIMENTO TíPICO
Em todos os experimentos, foram fixados os seguintes parâmetros: a) temperatura de fermentação: (32 +/- 1)OC (129);
b) freqüência do agitador: 200 rpm (200 mino-1); a finalidade foi promover uma melhor homogeneização na doma;
c) concentração de ART no mosto de alimentação: aproximadamente
220g/L (23);
d) pH do mosto de alimentação: 4,5 a 5,0 (54);
e) concentração de uréia no mosto de alimentação: 0,5 g/L (74);
1)concentração de penicilina V ácida no mosto de alimentação:
500UIIL(8);
g) volume de inóculo adicionado: 3.0 L;
A
~
8
I
b
I
Legenda
A- Saída de amostra
8- Entrada de ar comprimido C- Chicana
D- Chicana
E- Turbina superior de 6 pás F- Turbina inferior de 6 pás G- Dispersar de ar
D
:yI
c d e
Cotas: a - 200 mm b - 75 mm c - 80 mm d - 230 mm e - 440 mm
Figura 4.1 - Esquema da doma de fermentação utilizada.
21
No dia anterior ao experimento ligou-se o equipamento para que logo no iníciodaquele, o banho já apresentasse a temperatura desejada.
No dia do experimento, preparou-se a suspensão de levedura e adicionou-se à doma. Acionou-adicionou-se a agitação para homogeneização e retirou-adicionou-se uma amostra de 10mL para determinação da concentração celular. Em seguida, iniciou-se a adição de mosto à doma, sendo 7,0 L o volume total de mosto adicionado, cuja vazão de alimentação foi previamente escolhida. Pelo fato de não dispormos de bomba de alimentação, esta foi feita periodicamente (22).
A fermentação foi acompanhada por amostragens de 30 em 30 minutos. Após o término do enchimento, as amostras deixaram de ser retiradas 1,5 horas após verificação de que não houve mais desprendimento de gás. O tempo de
fermentação a que correspondeu um valor mássico de etanol que não pôde
ser determinado diferente da média dos valores posteriores foi considerado
como tempo final de fermentação e foi denominado tempo de fermentação.
Considerou-se dois valores iguais quando a diferença entre a massa de etanol anterior e a média das posteriores foi menor ou igual a 2,2%. Este valor foi o
resultado da média dos coeficientes de variação de Pearson (desvio padrão
percentual), determinados experimentalmente a partir de 5 determinações de
cada uma das 3 amostras testadas (amostras com concentração de
aproximadamente 60 g IL, 70 g/L e 80 glL de etanol). Convém ressaltar aqui,
porém, que, para os experimentos realizados com processo descontínuo
alimentado, o menor tempo de fermentação possível é o equivalente ao tempo de enchimento da doma.
4.4.1 - Análise das amostras
Um volume de aproximadamente 25 mL de amostra foi retirado e usado para as técnicas analíticas desaitas a seguir.
4.4.1.1 - Técnicas analíticas
4.4.1.1.1 - Medida do valor do pH
4.4.1.1.2 - Medida de acidez total
Foi medida no mosto de alimentação e no meio final de fermentação.
Permite-nos a verificação da ocorrência de contaminação por bactérias
produtoras de ácidos. Quando se utiliza uréia como fonte de nitrogênio, o valor de acidez total final até duas vezes maior que a inicial Pode ser considerada como normal (94).
Como dispunha-se de penicilina V ácida no mosto e tratava-se de
fermentações rápidas não se determinou acidez total para todos os
experimentos
A acidez foi expressa em acidez sulfúrica total.
4.4.1.1.3 - Determinação da concentração celular
Uma amostra de 5,0 mL foi filtrada em membrana MilliporeR(diâmetro médio dos poros= 1,2 mícra) previamente pesada e depois foi lavada com 100 mL de água destilada. Após lavagem, foi submetida à secagem em estufa a (105 a 110)OCaté peso constante, o que era conseguido aproximadamente após 3 horas.
O resultado foi expresso em gramas de matéria seca por litrode amostra.
4.4.1.1.4 - Determinação da concentração de ART
A determinação da concentração de ART foi realizada pelo método de SOMOGYI (111), precedido da hidrólise da sacarose contida na fase líquida do meio de fermentação (amostra).
a)soluçães reagentes(preparados com reagentes p.a.)
SOLUÇÃO I:
NaHC03 1S,Og
NaKC4H40S 12,Og
Na2C03 .24,Og
Na2S04 144, Og
Água destilada q.s.p. " ..800,OmL
SOLUÇÃO 11:
Na2S04 .36,Og
CuS04.5H20 ..4,Og
Água destilada q.S.p. .200,OmL
SOLUÇÃO 111:
(NH4)6M07024.4. H20 ...25.0g
H2S04 (d=1.84 g/mL) 21,OmL
Na2HAs°4.7H20 ,.. .3,Og
Água destilada q.S.p. 500,OmL
As soluções devem ser guardadas em frascos escuros, à temperatura de 300C, por um período mínimo de 30 horas para então, serem calibradas a partir de soluções de glicose de concentrações conhecidas (20 a 200mg/L).
b) Doseamento
Em tubo de Follin-Wucontendo 1mL das soluções I e 11na proporção 4: 1, preparada no momento do uso, coloca-se 1.0mL de amostra convenientemente diluída. Leva-se ao banho em água fervente por 10 minutos e retira-se colocando em banho de água e gelo. Após o resfriamento, adidona-se 2,OmLda solução 111 e agita-se para a expulsão dos gases formados. Completa-se o volume de 25mL
com água destilada. Uma prova em branco é preparada simultaneamente
utilizando-se água destilada.
As leituras foram feitas em comprimento de onda igual a 540nm. em
espectofotômetro marca Prodon sc 90
4.4.1.1.5 - Determinação da concentração de etanol
A concentração de etanol foi determinada por uma adaptação do método do microdicromato (55).
Destilou-se em um microdestilador. com arraste a vapor. 1.0 mL de fase líquida do meio de fermentação (amostra). recolhendo aproximadamente 30mL de destilado em 15 mL de solução de dicromato de concentração rigorosamente conhecida e em excesso. A seguir tampou-se o Erlenmeyer e levou-se a banho de água a aproximadamente 650C por 15 minutos para que se completasse a oxidação do etanol. Decorridos os 20 minutos, retirou-se o Erlenmeyer do banho e deixou-se esfriar até temperatura ambiente, para ,então. ser titulado com solução de sulfato ferroso amoniacal. utilizando ortofenantrolina como indicador. Fez-se uma prova em branco, titulando o dicromato de potássio com o sulfato ferroso amoniacal.
A concentração de etanol na amostra é obtida pela expressão:
E(gll)
=
11,5 . Vd . Nd . (1 - ValVb)Seguem-se a composição das
utilizados(preparados com reagentes p.a.)
soluções e indicadores
SOLUÇÃO I : Solução de sulfato ferroso amoniacal
Fe(NH4)2(S04)2' 6H20 135,19
H2S04 (d= 1,84 glL) 30.0 mL
Água destilada q.s.p. 1000,OmL
SOLUÇÃO 11: Solução de dicromato de potássio
K2Cr207... ...33.7 g
H2S04(d= 1,84 glL) ..325,0 mL
Água destilada q.s.p. 1000,OmL
SOLUÇÃO 111: Solução de ortofenantrolina
C12H8N2' H20 1.485 9
FeS04.7H20 0,695 9
4.4.1.2 - Métodos de cálculo
Por trabalhar-se com um sistema onde a variação de concentração é
dada por duas variáveis( volume e massa - produzidaou consumida
).
além dese trabalhar com volumes celulares significativos. calculou-se os valores de massas totais para um melhor entendimento do processo fermentativo . Estes valores foram calculados de acordo com a técnica proposta por BORZANI &
BARALLE(19)
.
com substituição de concentração celular em massa úmida.sugerida por eles. por concentração celular em massa seca (18) . Cabe
ressaltar aqui que essa metodologia é de grande valia para estudos onde se
quer diminuir erros na determinação de volumes ocupados pela células.
especialmente quando se quer determinar o volume celular em fermentações
onde há desprendimento de gás.
Utilizamos em nossos cálculos a densidade de 1120 g/L para levedura
(20) e teor de massa seca de levedura igual a 0.292. determinado
experimentalmente (média de 5 determinações. onde se pesou 10 g de fermento
prensado previamente fragmentado e colocou-se para secar até massa
constante. A massa final de células. após secagem. dividida por 10 dá o valor
do teor de massa seca do fermento).
4.4.1.2.1 - Cálculo do volume presente na doma (VD)
4.4.1.2.1.1 - Cálculo do volume presente na doma para o processo
descontínuo clássico
Para este processo. VD foi constante e igual a 10.0 L, considerando o
volume retirado de amostras desprezível.
4.4.1.2.1.2 - Cálculo do volume presente na doma para o processo descontinuo alimentado
Num determinadoinstante T ,o VD foidado por :
VD
=
VO+ [7. ( 1 - e-K.T) I ( 1 - e-K.TE)] (L)Onde "e" é a base do logaritmo Neperiano, e considerando desprezível o
4.4.1.2.2 - Cálculodo volume celular na doma (VX)
Num determinado instante T , o VX , para ambos os processos fermentativos estudados,é dado por:
VX = (X /327,04) .100 (%)
Onde 327,04 é o produto da densidade da levedura pelo seu teor de
massa seca e o valor de X é correspondente ao instante T.
4.4.1.2.3-
Cálculo do volume de líquido na doma (VL)Num determinado instante T , o VL , para ambos os processos fermentativos estudados, é dado por :
VL = VD. ( 1 - X / 327,04 ) (L)
Onde 327,04 é o produto da densidade da levedura pelo seu teor de massa seca e os valores de VD e X são correspondentes ao instante T.
4.4.1.2.4 - Cálculo da massa celular seca na doma (MX)
Num determinado instante T , a MX , para ambos os processos fermentativos estudados.é dada por:
MX= X
.
VD (9)Onde os valores de X e VD são correspondentes ao instanteT.
4.4.1.2.5-Cálculo das massas de ART
4.4.1.2.5.1 - Cálculo da massa de ART adicionada à doma (MSA)
4.4.1.2.5.1.1 - Cálculo da MSA para o processo descontínuo dássico
Para qualquer instante, a MSA é :
4.4.1.2.5.1.2 - Cálculo da massa de ART adicionada à doma para o processo descontínuo alimentado
Num determinado instante T. o valor de M5Aé dado por:
M5A
=
50. [7. ( 1 - e-K.T ) I ( 1 - e- K.TE )] (g)Onde !te"é a base do logaritmo Neperiano.
4.4.1.2.5.2 - Cálculo da massa de ART residual na fase líquida do meio de fermentação (MSR)
Num determinado instante T
.
a M5R . para ambos os processos fermentativos estudados, é dada por:M5R
=
5 . VL (g)Onde os valores de 5 e VLsão correspondentes ao instante T.
4.4.1.2.5.3 - Cálculo da massa de ART consumida pelo microrganismo (M5C)
Num determinado instante T
.
a M5C.
para ambos os processosfermentativos estudados, é dada por:
M5C
=
M5A-
M5R (g)Onde os valores de M5Ae M5R são correspondentes ao instante T.
4.4.1.2.6 - Cálculo da massa fermentação (ME)
Num determinado instante T fermentativos estudados, é dada por :
de etanol na fase líquida do meio de
, a ME , para ambos os processos
ME
=
E . VL (g)4.4.1.2.7 - Cálculo do rendimento em etanol
Ao término da fermentação, para ambos os processos fermentativos estudados, o rendimento em etanol (Re) foi expresso por:
Re
=
(MEf 10,511 . M5Af) .100 (%)Onde M5Af
=
7 . 504.4.1.2.8 - Cálculo da produtividade em etanol
Ao término da fermentação. para ambos os processos fermentativos estudados, a produtividade em etanol (Pe) foi expressa por:
Pe
=
MEf I TF . 10 (g/L.h)4.4.1.2.9 - Cálculo do parâmetro relacionado com produção de células Ao término da fermentação, para ambos os processos fermentativos estudados, o valor do parâmetro relacionado com a produção de células (Y) foi expresso por:
Y
=
103 . [( MXf - MXO ) I MSAf ]Considerou-se "[( MXf- MXO) I M5Af ]" como sendo fator de conversão de substrato em células (Yxls).
4.4.1.2.10 - Cálculo da produtividade em células
Ao término da fermentação. para ambos os processos fermentativos estudados. a produtividade em células (Px) foi expressa por :
4.5 - ANÁLISEDOSRESULTADOS
Com a finalidade de auxiliar na verificação da influência dos fatores
estudados (tempo de enchimento, constante de tempo e massa de inóculo) nos
resultados obtidos nos grupos de experimentos, foram feitas análises de
variânda para um únicofator ou multivariada(87).
Emalguns casos, também se fez análise de regressão linear multivariada
(87), cujo modelo estatístico é dado pela seguinte equação geral:
Yi
=
bo + b1 . Xi1+ b2 . Xi2+ b3 . Xi3+ b4 . Xi4+ . . . bz-1 . Xi,z-1+ Eicom z-1 variáveis independentes, onde:
Yi
=
variável dependente ou variável respostab, bo, . . ., bz-1
=
coeficientesde regressãoXi1, Xi2, . . ., Xi,z-1
=
variáveis independentes i=
1, . . . nEi
=
erro do ajusteObservação: as variáveis independentes podem ser compostas somente
dos fatores em casos de não interação entre estes na resposta da variável
dependente; podem também ser compostos de adições de outras variáveis
independentes, representadas pelo produto de fatores, no caso de interação
destes na resposta da variável dependente.
Em todas as análises apresentaram-se as tabelas correspondentes,
sempre indicando os erros, chamados níveis descritivos (p).
Na análise de variânda, os valores de p indicam o menor erro em que se incorre ao afirmar que existe pelo menos uma média diferente entre as
comparadas, sendo essas médias resultados obtidos em função de diferentes
níveis dos parâmetros estudados, uma diferença entre as médias indica a influência destes parâmetros nos resultados obtidos.
Na análise de regressão, os valores de p indicam o menor erro em que se
incorre ao afirmar que um determinado coeficiente tem influência na
determinação do parâmetro estimado. Em outras palavras, testando o
coeficiente angular correspondente a uma variável independente é possível verificar se esta tem importância na determinação do parâmetro estimado.
Todas as análises estatísticas foram conduzidas utilizando o programa
estatístico Statgraphics (112), emprestado pelo Centro de Computação