i
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
RESISTOTIPAGEM E TRANSFERÊNCIA GENÉTICA DE
PLASMÍDIOS DE RESISTÊNCIA ENTRE COLIFORMES E
VIBRIOS POTENCIALMENTE PATOGÊNICOS PARA O HOMEM
ISOLADOS DE CAMARÃO (
Litopenaeus vannamei
)
COMERCIALIZADO EM NATAL-RIO GRANDE DO NORTE
LIGIA MARIA RODRIGUES DE MELO
NATAL/RN
ii
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
RESISTOTIPAGEM E TRANSFERÊNCIA GENÉTICA DE PLASMÍDIOS DE
RESISTÊNCIA ENTRE COLIFORMES E VIBRIOS POTENCIALMENTE
PATOGÊNICOS PARA O HOMEM ISOLADOS DE CAMARÃO (Litopenaeus
vannamei) COMERCIALIZADO EM NATAL-RIO GRANDE DO NORTE
TESE APRESENTADA AO
PROGRAMA DE PÓS-GRADUAÇÃO
EM CIÊNCIAS DA SAÚDE, COMO
PARTE DOS REQUISITOS PARA
OBTENÇÃO DO TÍTULO DE
DOUTOR.
Ligia Maria Rodrigues de Melo
Orientadora: Profa. Dra. Regine Helena Silva dos Fernandes Vieira Co-Orientadora: Profa. Dra Dulce Almeida
NATAL/RN
iii
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
RESISTOTIPAGEM E TRANSFERÊNCIA GENÉTICA DE PLASMÍDIOS DE
RESISTÊNCIA ENTRE COLIFORMES E VIBRIOS POTENCIALMENTE
PATOGÊNICOS PARA O HOMEM ISOLADOS DE CAMARÃO (Litopenaeus
vannamei) COMERCIALIZADO EM NATAL-RIO GRANDE DO NORTE
Coordenadora do Curso de Pós-Graduação
Profa. Dra. Ivonete Batista de Araújo
NATAL/RN
iv
RESISTOTIPAGEM E TRANSFERÊNCIA GENÉTICA DE PLASMÍDIOS DE RESISTÊNCIA ENTRE COLIFORMES E VIBRIOS POTENCIALMENTE PATOGÊNICOS PARA O HOMEM ISOLADOS DE CAMARÃO (Litopenaeus
vannamei) COMERCIALIZADO EM NATAL-RIO GRANDE DO NORTE
Presidente da Banca: Profa. Dra. Regine Helena Silva dos Fernandes Vieira
BANCA EXAMINADORA
____________________________________________ Profa. Dra. Regine Helena Silva dos Fernandes Vieira
(PPgCSA/CS/UFRN – Orientadora)
____________________________________________ Profa Dra Eveline Pipolo Milan
PPgCSA/CS/UFRN
____________________________________________ Profa. Dra. Ângela Maria Soares Cardonha
Departamento de Nutrição/UFRN-Examinadora Externa ao Programa
____________________________________________ Prof. Dr. Cícero Romão Gadê Neto
Escola da Saúde (UnP)-Examinador Externo à Instituição
____________________________________________ Prof. Dr. Ernesto Hofer
FioCruz – RJ – Examinador Externo à Instituição
v
DEDICATÓRIA
Aos meus pais, Manoel Rodrigues de Melo “in memoriam” e Laurita
Rodrigues de Melo “in memoriam” pelos exemplos de retidão, honestidade,
apoio, perseverança e incentivo, durante todas as etapas de minha vida. A eles a minha eterna gratidão e saudades.
vi
AGRADECIMENTOS
A Deus por me guiar e iluminar sempre, permitindo que as minhas dificuldades fossem todas superadas para que eu conseguisse atingir mais um objetivo em minha vida.
À minha orientadora, Profa. Dra. Regine Helena Silva dos Fernandes Vieira, pela paciência, apoio, competência e orientação desse trabalho.
À minha co-orientadora, Profa. Dra. Dulce Almeida, pela amizade, orientação e apoio, sempre disponível e me encorajando nas horas mais difíceis.
Ao Professor Dr. Ernesto Hofer pelo apoio, amizade e colaboração com sua vasta experiência me abrindo todas as portas, tornando possível a realização desse trabalho.
A Universidade Potiguar, pela valiosa colaboração permitindo a realização da parte experimental desse trabalho no Laboratório de Microbiologia dos Alimentos.
À Raissa Maria Chaves Dantas Barretto Godeiro, amiga de todas as horas, pela colaboração na parte prática desse trabalho.
vii
Ao Instituto Osvaldo Cruz pela inestimável colaboração na identificação fenotípica e molecular das cepas bacterianas isoladas.
Ao Laboratório de Ciências do Mar (Labomar), em especial a doutoranda Edirsana Maria Ribeiro de Carvalho e a Profa. Dra. Oscarina Viana de Souza, pelo treinamento da técnica de cura de plasmídios e colaboração na realização da conjugação bacteriana.
Ao Marcelo Barreto, sempre atencioso e prestativo, pela colaboração na formatação desse trabalho.
viii SUMÁRIO
Dedicatória ... v
Agradecimentos ... vi
Lista de siglas ... xi
Lista de abreviaturas ... xiii
Lista de Figuras e Tabelas... xiv
Resumo ... xv
1 INTRODUÇÃO ... 1
2 OBJETIVOS ... 4
2.1 GERAIS ... 4
2.2 ESPECÍFICOS ... 4
3 JUSTIFICATIVA ... 6
4 REVISÃO DE LITERATURA ... 9
4.1 Carcinicultura mundial ... 9
4.2 Carcinicultura brasileira ... 10
4.3 Carcinicultura no Rio Grande do Norte ... 11
4.4 O Viveiro, nicho de bactérias patogênicas ... 12
4.4.1 Os coliformes ... 12
4.4.2 O gênero Vibrio ... 13
4.4.3 O gênero Aeromonas ... 15
4.5 O Viveiro e a resistência bacteriana aos antimicrobianos ... 16
ix
5.1 Amostragem ... 19
5.2 Coleta das amostras ... 20
5.2.1 Camarões frescos ... 20
5.3 Processamento laboratorial ... 20
5.3.1 Isolamento e caracterização fenotípica dos coliformes ... 20
5.3.2 Isolamento e caracterização feno e genotípica dos vibrios ... 21
5.3.2.1 Teste de Kanagawa (Vibrio parahaemolyticus) ... 22
5.3.2.2 Detecção das Hemolisinas ... 22
5.3.3 Isolamento e caracterização fenotípica das aeromonas ... 24
5.3.4 Resistotipagem ... 25
5.3.4.1 Susceptibilidade Antimicrobiana ... 25
a) Cálculo do Índice de multiresistência a antimicrobianos (MAR) ... 25
5.3.5 Cura dos Plasmídios ... 26
5.3.6 Processo de recombinação genética ... 26
a) Experimentos de conjugação ... 26
6 ANEXAÇÃO DOS ARTIGOS ... 28
6.1 ARTIGO 1: Antibiotic resistance of Vibrio parahaemolyticus isolated from pond-reared shrimps Litopenaeus vannamei marketed in Natal, Brazil. ... 28
6.2 ARTIGO 2: Multiresistance in strains of Vibrio and Aeromonas isolated from marine shrimp (Litopenaeus vannamei) marketed in Natal, Northeastern Brazil. ... 38
7 COMENTÁRIOS, CRÍTICAS E SUGESTÕES ... 59
8 APÊNDICE ... 63
x
Tabela 1 - Incidência de coliformes isolados de camarão fresco e refrigerado (Litopenaeus vannamei) comercializado na cidade de Natal – Rio Grande do Norte
(RN). ... 63
8.2 APÊNDICE B ... 63
Tabela 2 - Perfil de resistência do grupo coliforme isolado de camarão fresco e refrigerado (Litopenaeus vannamei) comercializado na cidade de Natal – Rio
Grande do Norte (RN). ... 63 Tabela 3 - Perfil de multirresistência do grupo coliforme isolado de camarão fresco e refrigerado (Litopenaeus vannamei) comercializado na cidade de Natal – RN... 64 8.3 APÊNDICE C ... 66
Tabela 4 - Perfil de resistência a antimicrobianos da Escherichia coli
K12C600 após a conjugação bacteriana, adquirido de espécies de Vibrio
isolados de camarões frescos e refrigerados, comercializados em Natal/RN .. 66 8.4 APÊNDICE D - Lista de Publicações em Eventos ... 68
8.5 APÊNDICE E - Artigo e convites - A cólera no Estado do Rio Grande do Norte – Brasil – perfil sorológico e de sensibilidade do Vibrio
xi
LISTA DE SIGLAS
ABCC Associação Brasileira de Criadores de Camarão
AMK Amicacina
AMP Ampicilina
ANVISA Agência Nacional de Vigilância Sanitária
APA Água Peptonada Alcalina
ATCC American Type Culture Collection
CECON Centro de controle e produtos para diagnósticos LTDA
CHL Cloranfenicol
CIP Ciprofloxacina
dNTP Deoxynucleotide triphosphate dATP Deoxyadenosine triphosphate dCTP Deoxycytidine triphosphate dGTP Deoxyguanosine triphosphate dTTP Deoxythymidine triphosphate
EMB Eosine Methyl-Blue
FAO Food and Agriculture Organization of the United Nations
GEN Gentamicina
IMNV Vírus da Mionecrose Infecciosa
KIA Kligler Iron Agar
LABORCLIN Laboratório de Análises Clínicas
LB Luria Bertani
LIA Lysine Iron Agar
xii
NaCl Cloreto de sódio
NAL Ácido nalidíxico
NCCLS National Committee for Clinical Laboratory Standards
NIT Nitrofurantoína
OMS Organização Mundial de Saúde
PCR Reação em Cadeia Polimerase
pH Potencial Hidrogeniônico
RDC Reunião da Diretoria Colegiada
RN Rio Grande do Norte
SXT Sulfametoxazol-Trimetoprim
SIRVETA Sistema de Vigilância Epidemiológica de Enfermidades Transmitidas por Alimentos.
TCBS SacaroseTiossulfato Citrato Sais Biliares TCP Toxin -coregulated pilus
TDH Thermostable direct hemolysin
TL Thermolabile hemolysin
TRH Thermostable direct hemolysin-related
TSA Tripticase Soy Agar
TCY Tetraciclina
UnP Universidade Potiguar
USA Estados Unidos das Américas
US$ Dólar
xiii
LISTA DE ABREVIATURAS
A. Aeromonas
C Celsius
CT Toxina colérica Et al E Colaboradores
g Grama
h Hora
Há Hectare
Kg Kilograma
mg Miligrama
mL Mililitro
n Número
t Tonelada
V. Vibrio
µg Micrograma
µl Microlitro
xiv
LISTA DE FIGURAS E TABELAS
Figura 1 Perfil da Produção Mundial de Camarão Marinho: Cultivado e Capturado de 1978 a 2008 (ABCC, 2011).
Figura 2 Municípios do Rio Grande do Norte - procedência das amostras de camarão Litopenaeus vannamei
Tabela 1 Incidência de coliformes isolados de camarão fresco e refrigerado (Litopenaeus vannamei), comercializado na cidade de Natal – Rio
Grande do Norte (RN).
Tabela 2 Perfil de resistência do grupo coliforme isolado de camarão fresco e refrigerado (Litopenaeus vannamei) comercializado na cidade de
Natal – Rio Grande do Norte (RN).
Tabela 3 Perfil de multirresistência do grupo coliforme isolado de camarão fresco e refrigerado (Litopenaeus vannamei) comercializado na
cidade de Natal – Rio Grande do Norte (RN).
Tabela 4 Perfil de resistência a antimicrobianos da Escherichia coli K12C600
após a conjugação bacteriana, adquirido de Vibrio e Aeromonas
xv RESUMO
Cinquenta amostras de camarão fresco e refrigerado (Litopenaeus vannamei)
foram coletadas em diferentes pontos de comercialização na cidade de Natal – RN. As amostras foram maceradas em um gral estéril e 25 gramas semeadas em 225mL de APA contendo 1% de NaCl e 25g em 225mL de CL incubadas a 35ºC - 24 horas. O crescimento em APA foi semeado em placas de Ágar TCBS, incubadas a 35ºC-24h para isolamento de Vibrio e Aeromonas. O
crescimento do CL foi semeado em Agar EAM, para isolamento de coliformes. Dos 102 isolados, 91 (89,2%) pertenciam ao gênero Vibrio e 11 (10,8%) ao
gênero Aeromonas, com predominância de V. cholerae não O1/não O139, V. alginolyticus, V. carchariae e V. parahaemolyticus K- e A. veronii biogrupo sobria , A. jandaei, A. schubertii, A. veronii biogrupo veronii e A. hydrophila. A
menor eficiência entre os antimicrobianos foi da AMP (57,8% de resistência) seguida da AMK (29,4%) e TCY (21,6%). As 39 cepas de Vibrio e Aeromonas
multirresistentes se distribuíram em 10 perfis distintos, sendo que um revelou cinco marcos (AMP, CHL, NIT, SXT e TCY) em um isolado de V. carchariae de
camarão, adquirido em supermercados. O índice MAR, nas 39 cepas variou de 0,28 a 0,42, sugerindo que são de risco na transferência e difusão da resistência na cadeia alimentar. Após a cura plasmidial pelo tratamento com AO de 24 cepas multirresistentes e com resistência intermediária de víbrio e aeromonas escolhidas aleatoriamente, 13 perderam totalmente a resistência e 7 perderam parcialmente, sendo que o maior percentual de perda da resistência ocorreu nas cepas de V. cholerae não O1 e não O139 (6 cepas), se
xvi
curadas e a E. coli K12C600 demonstraram que 78,5% das culturas de Vibrio
testadas revelaram capacidade de transferência para o gene que confere resistência a AMP e 28,5% para a TCY. Dos coliformes, E. coli foi a mais
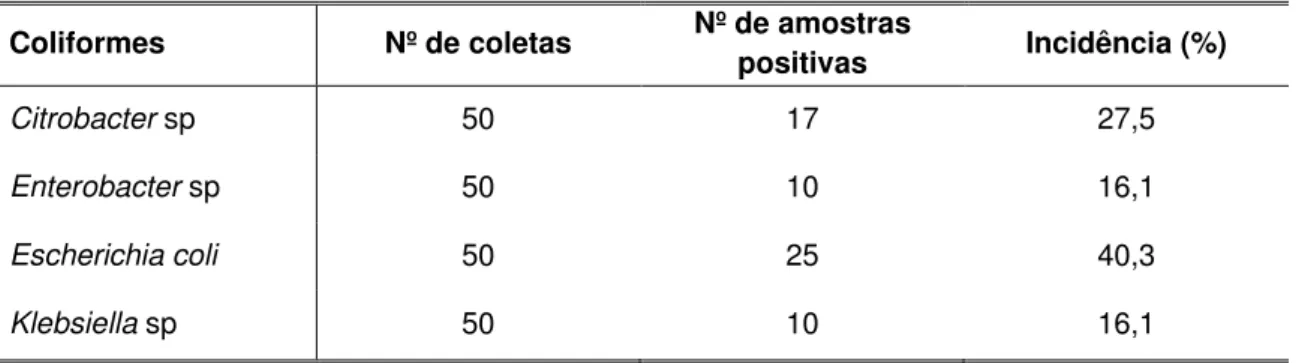
frequente, seguida de Citrobacter spp, isoladas em 40,3% e 27,5% das
amostras respectivamente. AMP foi o antimicrobiano menos eficaz, seguido de TCY. As 11 cepas multirresistentes se distribuíram em 9 perfis distintos, um deles constituído de cinco marcos (AMP, NIT, TCY, CHL, SXT), albergados em uma cepa de Klebsiella spp, oriunda de camarão adquirido em supermercado,
similar ao resultado obtido em V. carchariae. Conclui-se que, os camarões
marinhos frescos e refrigerados, comercializados em Natal-RN evidenciaram contaminação com coliformes, víbrios e aeromonas multirresistentes a antimicrobianos comumente utilizados na terapia médica e veterinária, e que, possivelmente, a transferência de genes de resistência entre bactérias se constitui um sério problema de saúde pública.
1 1 INTRODUÇÃO
O cultivo de camarão marinho em cativeiro, vem se desenvolvendo no mundo desde a década de 70, do século passado, com produções progressivas no agronegócio internacional, envolvendo mais de 50 países.
No Brasil a atividade ganhou destaque em meados dos anos 80, particularmente no Nordeste Brasileiro, que reúne as condições propícias para o cultivo, pela extensa área costeira banhada por águas com temperatura acima de 22ºC durante todo o ano (Barbieri Junior; Ostresnky Neto, 2002).
A carcinicultura em parte do litoral nordestino, se projetou através do desenvolvimento de pesquisas, da criação de fazendas para a reprodução e o cultivo experimental de camarão particularmente, no Estado do Rio Grande do Norte. Em 1995, uma nova etapa na carcinicultura brasileira teve início, motivada pela participação e consolidação do cultivo em caráter industrial do camarão branco (Litopenaeus vannamei), oriundo do Oceano Pacífico (Barbieri
Junior; Ostresnky Neto, 2002).
No entanto, o Brasil, tal como outros países produtores de camarão marinho em cativeiro, tem enfrentado, vários problemas com forte impacto econômico, resultante principalmente de enfermidades infecciosas, que contribuíram para a queda dos índices de desenvolvimento da carcinicultura (Alves; Mello, 2007).
2 obviamente, resultando como impacto sobre a microbiota a seleção de bactérias resistentes às drogas (Decamp; Moriarty, 2005).
Considerando todas as particularidades mencionadas e que o camarão consumido em Natal-RN é cultivado em viveiros, pareceu oportuno encetar uma investigação sobre vibrios e enterobactérias, potencialmente enteropatógenos para o homem, que são capazes de se colonizar nesse crustáceo e a tentativa de verificar se esses isolados são portadores de fatores de resistência antimicrobiana, tendo em vista a discreta literatura que abordou o problema, tanto nos âmbitos internacional como nacional.
Convém salientar que, o intuito de aprofundar os estudos sobre o nível de resistência antimicrobiana transmitida pelas bactérias, sua propagação através do meio ambiente até ao homem pelo consumo deste produto alimentar inadequadamente preparado, veio a se constituir em um tema investigativo. Desta forma foi apresentado ao Programa de Pós-Graduação em Ciências da Saúde – PPGCSA, da Universidade Federal do Rio Grande do Norte – UFRN, como ante-projeto para o curso de Doutorado, com o seguinte título – “Resistotipagem e transferência genética de plasmídios de resistência entre coliformes e vibrios potencialmente patogênicos para o
homem isolados de camarão (Litopenaeus vannamei) comercializado em
Natal-Rio Grande do Norte”. Ressalta-se que na dependência dos resultados que serão obtidos será possível ou não, avaliar a hipótese da permanência e/ou estabilidade de marcos de resistência nos isolados bacterianos, mesmo após a proibição do uso desses agentes em tais ecossistemas.
3 pertencentes às familias Vibrionaceae e Enterobacteriaceae a partir de camarões (Litopenaeus vannamei) comercializados na cidade de Natal – Rio
Grande do Norte (RN), assim como, detendo-se e aprofundando a pesquisa de plasmídios-R, fatores de resistência à antimicrobianos, nos isolados. Tal conjectura possibilitará avaliar a disseminação dos genes de resistência, que obviamente implicaria na diminuição da eficácia dos antimicrobianos no tratamento de infecções bacterianas, nas diversas fontes de infecção.
Os principais resultados obtidos estão apresentados nos documentos anexados nesta tese. “Antibiotic resistance of Vibrio parahaemolyticus isolated from pond-reared Litopenaeus vannamei marketed in Natal, Brazil” enviado para publicação em 2010 e aceito em 2011, na revista
4 2 OBJETIVOS
2.1 GERAIS
2.1.1 Determinar o perfil de resistência a antimicrobianos dos isolados bacterianos de amostras de camarão fresco e refrigerado (Litopenaeus vannamei) comercializado na cidade de Natal/RN;
2.1.2 Verificar a transferência de material genético entre bactérias da família Enterobacteriaceae e Vibrionaceae isoladas do camarão fresco e refrigerado (Litopenaeus vannamei), comercializado na cidade de Natal/RN.
2.2 ESPECÍFICOS
2.2.1 Isolar e identificar fenotipicamente os coliformes do camarão fresco e refrigerado (Litopenaeus vannamei), comercializado na cidade de Natal/RN;
2.2.2 Caracterizar feno e genotipicamente as espécies de Vibrio
potencialmente patogênicas para o homem, isoladas das coletas de camarão fresco e refrigerado (Litopenaeus vannamei), comercializado na cidade de
Natal/RN;
2.2.3 Caracterizar fenotipicamente as espécies de Aeromonas potencialmente
5 2.2.4 Determinar o perfil de resistência dos isolados de coliformes, vibrios e aeromonas, frente aos antimicrobianos utilizados na prevenção de vibrioses no camarão (Litopenaeus vannamei);
2.2.5 Verificar o nível da resistência plasmidial aos antimicrobianos após a cura ou eliminação de plasmídios pela Acridina Orange;
6 3 JUSTIFICATIVA
7 A Organização Mundial de Saúde (OMS) salienta para o problema, inclusive sugerindo a adoção de medidas de ordem tecnológica e ecológica para amenizar a questão da resistência às drogas. Como meta de natureza ecológica destaca-se as ações que devem ser instituídas para a redução do uso indiscriminado de antimicrobianos e o lançamento de tais produtos para o meio ambiente (Souza, 1998).
Diante da exposição e respaldo na afirmação de vários autores, que a maioria das espécies de Vibrio, presente neste ecossistema aquático e,
consequentemente no camarão, é dotada de fatores de virulência com ação patogênica para o homem, resultando em sérios problemas, com repercussão clínica para os consumidores do crustáceo. Nesse caso, exemplificam-se:
Vibrio cholerae O1 e não O1, Vibrio alginolyticus, V. vulnificus, V. parahaemolyticus, V. mimicus, V. metschnikovii, V. damsela (Photobacterium damsela) e V. fluvialis (Gopal et al., 2005; Costa et al., 2009).
Além disso, outros autores analisaram a susceptibilidade dos víbrios isolados do ambiente aquático a diferentes antibióticos, constatando a presença de cepas multirresistentes (Devi et al., 2009; Lagana et al., 2011).
8 Aprofundando os estudos sobre a suscetibilidade antimicrobiana, naquelas cepas de Vibrio, que por ventura, evidenciaram níveis de resistência,
as análises se concentraram na pesquisa de plasmídios portadores de fatores de resistência, a sua possível transmissibilidade para célula bacteriana receptora, assim como, a aplicação do processo de cura plasmidial.
9 4 REVISÃO DE LITERATURA
4.1 Carcinicultura mundial
O segmento mais bem sucedido da aquacultura, do ponto de vista econômico, é o cultivo de camarões marinhos, apresentando nos últimos 30 anos, um expressivo aumento, no tocante à produção de cultivo. Corroborando essa observação a FAO em 2010 reportou esse expressivo aumento no período de 1978 a 2008 (Quadro 1 – ABCC, 2011).
Figura 1 - Perfil da Produção Mundial de Camarão Marinho Cultivado e Capturado de 1978 a 2008 (ABCC, 2011)
10 destaca-se a China, com uma produção de camarões de 1.268.074t, a Tailândia, com 507.500t e Indonésia, com 408.346t e, no continente americano, encontramos o Equador, com 150.000t, o México, com 130.201t e Brasil, com 65.000t (ABCC, 2011).
4.2 Carcinicultura brasileira
No Brasil, a carcinicultura comercial deu seus primeiros passos na década de 1970, baseando-se inicialmente em modelos importados do Equador, do Panamá e dos Estados Unidos, cujas validações e intenso aprimoramento interno, resultaram na definição de uma tecnologia adequada a realidade nacional. Assim, o país se tornou líder mundial no quesito produtividade, no ano de 2003, quando a produção atingiu a marca de 90.190t, com exportações de 58.455t e 226 milhões de dólares (ABCC, 2011). .
Entretanto, de 2004 a 2009, a carcinicultura brasileira enfrentou desafios que afetaram o seu crescimento global, havendo uma queda significativa na produção (de 90.190t para 65.000t (-22,4%), na produtividade (de 6.083kg/há/ano para 3.514kg/há/ano e nas exportações que foram reduzidas de 58.455t para 5.728t (-90,2%). Isto, naturalmente, decorreu pela falta de apoio e de incentivos compensatórios para que a atividade pudesse superar seus problemas e competir em pé de igualdade com seus concorrentes internacionais (ABCC, 2011).
11 da produção nacional de camarão cultivado em 2010, cujo volume produzido foi de 80.000t do crustáceo (ABCC, 2011).
Hoje, o camarão de cultivo responde por cerca de dois terços da produção total de camarões no Brasil, com destaque para os estados do Rio Grande do Norte e Ceará (ABCC, 2011).
4.3 Carcinicultura no Rio Grande do Norte
O Rio Grande do Norte é o estado brasileiro com maior potencial para o desenvolvimento da carcinicultura, isto devido ao clima, posição geográfica e estuários de portes significativos. Aqui, a prática da carcinicultura teve início em 1970, quando foi criado o Projeto Camarão, visando comprovar a viabilidade técnica e econômica do cultivo de camarões marinhos no estado, objetivando minimizar o problema do desemprego nas salinas, incentivando assim, o pequeno e médio produtor (ABCC, 2011).
Até bem pouco tempo, o Rio Grande do Norte se revezava com a Bahia na liderança da produção nacional de camarões (Wainberg, 2001). Atualmente, o Rio Grande do Norte se mantém na liderança da exportação de pescado e é o segundo maior produtor de camarão do Brasil (Diário de Natal, 2010).
Ao longo da história da carcinicultura várias espécies de camarão têm sido testadas no intuito de encontrar uma espécie ideal, para o desenvolvimento desta atividade, a qual apresente uma boa taxa de crescimento, normalidade morfológica e resistência à doenças.
Entre as espécies mais cultivadas no mundo estão o Penaeus monodon
12 No Rio Grande do Norte, inicialmente, as pesquisas foram feitas com espécies nativas Penaeus brasiliensis e Penaeus schmitti, como também com
espécies exóticas, tais como, Penaeus monodon, Penaeus japonicus, Litopenaeus vannamei e Penaeus stylirostris, oriundas da Ásia, Oriente e
América Central. A espécie que apresentou as melhores performances de produção foi o Litopenaeus vannamei, tendo sido adotada pela maioria dos
produtores brasileiros(Molina; Lima, 2001).
4.4 O viveiro, nicho de bactérias patogênicas
4.4.1 Os coliformes
Os coliformes são bastonetes Gram-negativos pertencentes à família Enterobacteriaceae e têm uma característica em comum, a fermentação da lactose com produção de ácido e gás. Pertencem a esse grupo, os gêneros
Escherichia, Klebsiella, Enterobacter e Citrobacter. São utilizados como
indicadores biológicos da qualidade higiênico-sanitária dos alimentos, assim como, os diferentes componentes da carcinicultura, como a água e camarão (Bhaskar et al., 1998).
Alguns autores, verificaram que a qualidade da água utilizada na aquacultura é refletida na microbiota dos organismos cultivados (Sivakami et al., 1996). Parente et al. (2011), pesquisando a presença de bactérias entéricas
em amostras de água e camarão marinho Litopenaeus vannamei oriundos de
13 É interessante salientar que os coliformes, principalmente a E. coli
podem ser portadores de plasmídios de resistência aos antimicrobianos, transferíveis para outros membros da família Enterobacteriaceae, assim como, para espécies dos gêneros Vibrio e Aeromonas, que podem colonizar o
camarão de viveiro.
4.4.2 O gênero Vibrio
Nos últimos trinta anos, a carcinicultura no mundo tem sido acometida de diversas doenças infecciosas, principalmente as vibrioses, uma das maiores ameaças para essa atividade. Os víbrios são microrganismos oportunistas que fazem parte da microbiota normal dos peneídeos, provocando doenças quando condições da biocenose são desfavoráveis e assim, favorecem a propagação da bactéria nos sistemas de cultivo. Se veiculados através do produto destinado ao consumo, podem provocar gastroenterites e quadros de septicemia em humanos (Aguirre-Guzmán et al., 2004).
Dentre as várias espécies pertencentes ao gênero Vibrio, autóctones de
ambientes marinhos e estuarinos, V. vulnificus, V. parahaemolyticus e V.cholerae são os principais causadores de gastroenterite e em alguns casos,
septicemia (Panicker et al., 2004) .
A espécie mais importante é V. cholerae, sorogrupo O1, responsável
pela cólera, uma doença endêmica em extensas áreas do globo terrestre. V. cholerae O1 é capaz de produzir vários fatores de virulência que contribuem
14 Toxin (CT) e do pilus Toxin Coregulated Pilus (TCP) (Campos, 2008). Salienta-se que algumas estirpes de V. cholerae não O1/não O139 albergam vários
fatores de virulência, idênticos ao sorogrupo O1 (Cariri et al., 2010).
Outra espécie que deve ser destacada é V. parahaemolyticus, cujo papel
na etiologia das toxinfecções alimentares vem sendo reconhecido de maneira crescente, nos últimos anos. De acordo com Hayat et al. (2006), o consumo de alimentos de origem marinha pode representar risco para saúde pública, uma vez que cepas de V. parahemolyticus toxigênicas (O3:K6) têm sido isoladas
dessa fonte, inclusive no Brasil (Leal et al., 2008) e que apresentam características pandêmicas.
Por outro lado, investigações clínicas e epidemiológicas têm demonstrado que V. vulnificus quando atinge a corrente sanguínea pode
causar septicemia e morte, tendo como veículos de transmissão a ingestão de alimentos marinhos contaminados ou através da contaminação de cortes na superfície cutânea após contato direto com água e/ou pescados marinhos (Almeida Filho, 2004).
Outras espécies de víbrios, incluindo V. fluvialis, V. hollisae, V. alginolyticus, V. furnissii e V. metschnikovii, têm sido isolados de ambientes
estuarinos e associados a casos de gastroenterites. As espécies V. cincinnatiensis, V. damsela (Photobacterium damsela) e V. carchariae apesar
de não serem consideradas agentes etiológicos de gastroenterites, em casos raros representam risco à saúde humana (Elliot et al., 1998).
15 Costa et al.(2009) analisaram amostras de água de viveiros de cultivo do camarão marinho Litopenaeus vannamei no Estado do Ceará, Brasil e
identificaram a partir de 55 isolados de Vibrio, 7 espécies, com predominância
de V. cholerae nãoO1/nãoO139, V. harveyi, V. parahaemolyticus e V. anguillarum.
4.4.3 O gêneroAeromonas
Aeromonas spp. tem uma distribuição cosmopolita e são isoladas de
ambientes aquáticos dulcícolas ou salinos, em áreas de poluição ou não. Esse ambiente constitui o habitat do micro-organismo e representa um importante veículo de transmissão para o homem seja sob a forma direta (balneabilidade) ou indireta através da ingestão de alimentos e água contaminados.
As diversas espécies do gênero Aeromonas foram consideradas
oportunistas durante muito tempo, porém estudos realizados na área da Microbiologia de Alimentos permitiram descobrir a relação desses microrganismos com infecções humanas após consumo de alimentos de origem aquática, sob a forma in natura ou insuficientemente cozidos (Martins
et al., 2002; Vivekanandhan et al., 2002).
As espécies mais frequentemente citadas em associação a patologia humana são: A. hydrophila, A. caviae e A. veronii biotipo sobria. Algumas são
consideradas patógenos em circunstâncias raras, como: A. jandaei e A. schubertii. Outras, ocasionalmente, são isoladas de material clínico: A. sobria, A. media, A. trota e A. salmonicida. As duas últimas são adaptadas ao pescado
16 No Brasil, existem diversos relatos de isolamento de diferentes espécies de Aeromonas spp. de amostras clínicas de casos de diarréia infantil, infecção
hospitalar, ou gastrenterites causadas por ingestão de alimentos como ostras, mexilhões, pescado e vegetais (Martins et al., 2002; Vivekanandhan et al., 2002; Evangelista-Barreto et al., 2006; Pereira et al., 2008). Evangelista-Barreto et al. (2010) isolaram do estuário do rio Cocó, Ceará, Brasil, 38 cepas de Aeromonas, pertencentes a sete espécies: A. caviae, A. veronii biotipo sobria, A. veronii biotipo veronii, A. trota, A. media, A. sobria, A. hydrophila e Aeromonas spp.
De acordo com a literatura, uma das causas mais destacadas na propagação destes agentes etiológicos está relacionada com atividades antropogênicas, exemplificando-se o emprego de antibióticos, a introdução de espécies exóticas de camarão e o manejo inadequado do meio ambiente (Lightner; Redman, 1998).
4.5 O viveiro e a resistência bacteriana aos antimicrobianos
Para controlar as doenças infecciosas na aquacultura, algumas estratégias foram postas em prática, como por exemplo, o uso de drogas antimicrobianas. O uso de antimicrobianos provocou o surgimento de reservatórios de bactérias resistentes no ambiente aquático (Akinbowale, 2006).
17 extracromossômicos de resistência (plasmidios R) tem sido a arma mais eficaz dos micro-organismos (Molina-Aja et al., 2002).
Lagana et al. (2011), determinando a susceptibilidade antibiótica de cepas de víbrios isoladas da aquacultura italiana, verificaram um baixo valor para flumequina no teste da Concentração Inibitória Mínima (CIM – 0,97 μg mL -1), indicando assim seu forte efeito antimicrobiano. Um aspecto que merece ser considerado é que a resistência às quinolonas pode ser transmitida apenas por seleção de mutantes e não por outros mecanismos genéticos, razão pela qual deve haver um maior controle e acima de tudo, responsabilidade no uso de agentes antibacterianos na aquacultura.
Em geral, as bactérias aquáticas são capazes de transferir genes de resistência antimicrobiana para outras bactérias (Akinbowale et al., 2007). A aparente interrelação entre vários ambientes ecológicos, incluindo a aquacultura e o ambiente humano, significa que as bactérias e os genes da resistência às drogas que elas contêm podem ser trocados entre estes ambientes, implicando num risco de que genes de resistência podem ser transferidos para os seres humanos a partir do reservatório de bactérias aquáticas.
18 doenças humanas e animais (Decamp; Moriarty, 2005). Resistência bacteriana à eritromicina, estreptomicina, penicilina, ampicilina, amoxicilina, canamicina, tetraciclina, oxitetraciclina e cloranfenicol tem sido observada em espécies de
Vibrio isoladas do cultivo de camarão (Bhattacharya et al., 2000).
Vários autores analisaram a susceptibilidade dos víbrios do ambiente aquático a diferentes antibióticos, constatando a presença de cepas multirresistentes portadoras de fatores passíveis de se transferir aos coliformes e outras enterobactérias presentes no ambiente aquático (Srinivasan; Ramasamy, 2009; Rebouças et al., 2011).
19 5 MATERIAL E MÉTODOS
5.1 Amostragem
As amostras de camarão Litopenaeus vannamei, (n=50), foram obtidas
em vários pontos de comercialização: supermercados (n=21 amostras) e vendedores ambulantes (n=29 amostras), no período de agosto de 2005 a setembro de 2007, na cidade de Natal-Rio Grande do Norte - Brasil.
A procedência das amostras foi de fazendas de cultivo de camarão marinho, situadas no interior do Estado do Rio Grande do Norte, nos municípios de Macau, Canguaretama, Grossos, Nísia Floresta, São Gonçalo do Amarante e Arês.
Figura 2 - Municípios do Rio Grande do Norte - procedência das amostras de
20 5.2 Coleta das amostras
5.2.1 Camarões frescos
O camarão fresco e refrigerado (200g) para exame bacteriológico foi identificado e acondicionado em recipiente de isolamento térmico, e transportado a uma temperatura em torno de 10ºC ao Laboratório de Microbiologia dos Alimentos da Universidade Potiguar – UnP, onde as análises bacteriológicas foram realizadas, respeitando o prazo máximo de duas horas após a coleta.
5.3 Processamento laboratorial
5.3.1 Isolamento e caracterização fenotípica dos coliformes
Amostras de 200g de camarão fresco e refrigerado foram maceradas em um gral estéril e frações de 25g foram adicionadas em 225mL de caldo lactosado. A incubação foi feita a 35°C por 24 horas.
Após a incubação, foi semeada uma alçada de crescimento do caldo lactosado, para placas contendo Agar Eosina Azul de Metileno (Agar EMB- Difco) e incubadas a 35°C por 24 horas.
21 fenilalaninadesaminase, lisina descarboxilase, arginina dehidrolase, ornitina descarboxilase, motilidade, fermentação da lactose, sacarose, d-manitol, dulcitol, salicina, maltose, produção de gás a partir da fermentação da glicose e redução do nitrato a nitrito.
5.3.2 Isolamento e caracterização feno e genotípica dos vibrios
22 5.3.2.1 Teste de Kanagawa (Vibrio parahaemolyticus)
Os crescimentos de 24h a 35ºC em água peptonada alcalina das colônias puras de V. parahaemolyticus foram semeados de forma circular (±
1cm de diâmetro) no Ágar Wagatsuma contendo hemácias humanas na concentração de 2%. Após a incubação a 35ºC por 24h, verificou-se a presença ou ausência de um halo de hemólise total, indicativo da atuação de uma Hemolisina Termoestável Direta (HTD). Como controle positivo foi usada uma cepa de V. parahaemolyticus Kanagawa positiva (K+) isolada de um surto
de gastroenterite em Cascável, Ceará (Hofer, 1983).
5.3.2.2Detecção das Hemolisinas
A detecção dos genes tdh e trh, responsáveis pela ação hemolítica e
envolvidos na ação patogênica, e complementadas com a verificação do gene da hemolisina termolábil (tl), específico para V. parahaemolyticus foi realizada
através da técnica de PCR-Multiplex. Foram executadas as seguintes etapas: a) Extração do DNA;
b) Iniciadores;
c) Amplificação PCR-Multiplex. a) Extração do DNA
23 b) Iniciadores
As sequências nucleotídicas e o tamanho dos amplicons dos iniciadores específicos para os genes tl,tdh e trh estão dispostos na Tabela 1 (Anexação
de artigos, p. 44, Table 1).
c) Amplificação por PCR-Multiplex
A reação de amplificação para uso simultâneo dos três iniciadores foi preparada em microtubos de 200µl para um volume final da reação de 25µl, contendo:
2,5µl do tampão da reação (KCl – 50mM, MgCl2 – 1,5mM, Tris-HCl - 10mM, pH-9,0 – Amersham Pharmacia Biotech USA);
2,0µl da mistura de dNTPs (200µM de cada desoxinucleotídeo trifosfato – dATP, dCTP, dGTP, dTTP - Amersham Pharmacia Biotech USA);
0,5µl de cada iniciador (10 pmol);
0,25µl da enzima Taq DNA polimerase (1U – Amersham Pharmacia Biotech USA);
16,75µl de água deionizada esterilizada;
0,5µl do DNA genômico.
24 asseguraram a completa desnaturação do molde e a extensão final da nova fita, respectivamente.
Ao final das amplificações, o produto obtido foi submetido à eletroforese em gel de agarose a 1% em tampão TBE 0,5X, durante aproximadamente 1 hora. Um padrão de peso molecular (Amersham Pharmacia Biotech, USA) foi incluído em cada gel.
Após a migração, os produtos foram corados por imersão do gel em solução de brometo de etídio (10mg/mL) e analisados, sob luz ultravioleta, em equipamento analisador de imagens (Image Quant 300 – GE).
5.3.3 Isolamento e caracterização fenotípica das aeromonas
25 fermentação da glicose, sacarose, arabinose e manose e utilização de aminoácidos (lisina e ornitina descarboxilase e arginina dehidrolase) a fim de obter a identificação conclusiva das cepas isoladas (Hofer, 1975).
5.3.4 Resistotipagem
5.3.4.1 Susceptibilidade Antimicrobiana
Foi efetuada através da técnica dos discos impregnados de antimicrobianos e depositados na superfície de Ágar Mueller-Hinton (Bauer et al., 1966), adotando a orientação descrita pelo National Committee for Clinical
Laboratory Standards (NCCLS, 2003) . A incubação foi feita a 35ºC por 24h e após esse tempo os halos de inibição foram medidos com paquímetro.Como controle foi utilizada uma cepa de Escherichia coli ATCC 25922. Os discos de
antibióticos empregados (LABORCLIN) foram: ácido nalidíxico (NAL-30µg), amicacina (AMK-30µg), ampicilina (AMP-10µg), gentamicina (GEN-10µg), ciprofloxacina (CIP-5µg), cloranfenicol (CHO-30µg), nitrofurantoína (NIT-300µg), tetraciclina (TCY-30µg), sulfazotrim (SFT- 25µg).
a)Cálculo do Índice de multiresistência a antimicrobianos (MAR)
26 5.3.5Cura dos Plasmídios
As cepas de Vibrio e Aeromonas que apresentaram multirresistência
e/ou resistência intermediária foram semeadas em tubos de TSA inclinado, suplementado com 1,0% de NaCl e incubados a 35ºC por 24h. Após a incubação, inóculo de cada crescimento foi semeado em tubos de hemólise com 1mL de Caldo Luria Bertani (LB) acrescido de 1,0% de NaCl e 50mg/mL de Acridine Orange (Sigma, nº A-6014). A incubação foi feita a 35ºC por 24h (Molina-Aja et al., 2002).
Após o tratamento cada cepa foi semeada em TSA inclinado acrescido de 1,0% de NaCl e incubado a 35ºC por 24h, para, posteriormente, ser repetido o teste de susceptibilidade antimicrobiana, com o intuito de verificar aquelas que mantiveram ou perderam os marcos de resistência.
5.3.6 Processo de recombinação genética
a) Experimentos de conjugação (Dias; Hofer, 1985)
Foram utilizadas, como possíveis doadoras de marco de resistência nos experimentos de conjugação, cepas de Vibrio submetidas ao processo de cura
e que apresentaram monoresistência, multirresistência ou resistência intermediária, à ampicilina (AMP), amicacina (AMK), tetraciclina (TCY), ciprofloxacina (CIP) e nitrofurantoína (NIT), conforme resultados determinados através do método da difusão em disco.
Foi utilizada como receptora, a linhagem padrão de Escherichia coli
27 A partir de um crescimento exponencial, isto é, com uma concentração de 108 células, procedeu-se à mistura das culturas-testes com a receptora na proporção de 1:10, incubando-se em banho-maria a 35ºC durante 3 e 24h. Após as incubações, 0,1mL das misturas foi transferida para placas contendo uma modificação do meio de Mueller-Hinton com 2g% de lactose e 0,008g% de azul de bromotimol. Para contra-selecionar o crescimento da amostra doadora, acrescentou-se NAL, em concentração de 30µg/mL de acordo com a natureza da cultura padrão. Nesta etapa procurou-se analisar, além do perfil de resistência, a fermentação de lactose como outro marcador para detecção de transconjugantes.
28 6 ANEXAÇÃO DOS ARTIGOS
6.1 ARTIGO 1
Manuscrito aceito pela revista Brazilian Journal of Microbiology
(ISSN:1517-8382), sob o nº BJM 1640, de acordo com o documento em anexo.
Qualis CAPES B2 em Medicina II.
Fator de Impacto: .0,1644
29 ATT01016.pdf (202.4 Kb) attached
--- Original Message ---
From: "BJM" bjm@sbmicrobiologia.org.br
To: "'Regine HSF Vieira'" reginevieira@terra.com.br Cc: ernesto.hofer@yahoo.com.br
Sent: Ter 13/12/11 09:47
Subject: Fwd: ENC: ENC: sobre a publicação do trabalho código 1640
ATT01016.pdf (202.4 Kb) attached
Pedimos a gentileza de confirmar o recebimento.
Prezado (a) Dr (a). Regine HSF Vieira,
Segue abaixo o parecer da Dra. Bernadette.
Aproveito a oportunidade para solicitar o arquivo aprovado em WORD para que possamos agilizar o processo de publicação.
Section Editor 2011-12-04 06:14 PM
Subject: [BJM] Editor Decision Regine HSF Vieira:
We have reached a decision regarding your submission to Brazilian Journal of Microbiology, "Antibiotic resistance of Vibrio parahaemolyticus isolated from pond-reared Litopenaeus vannamei marketed in Natal, Brazil".
Our decision is to: accept the paper adn publish it the next issue of BJM.
Prof. Dr. Bernadette D.G.M. Franco Associate editor
Brazilian Journal of Microbiology Atenciosamente,
Tífani Luri
Secretária do BJM
BJM - Brazilian Journal of Microbiology
ICB III - SBM - Dep. de Microbiologia
Av. Prof. Lineu Prestes, 2415
30 05508-900 São Paulo, SP - Brasil
Tel: (+5511) 3813-9647/3037-7095
Ramal USP 7979
E-mail: bjm@sbmicrobiologia.org.br
Site: http://submission.scielo.br/index.php/index/login
38 6.2 Artigo 2
Manuscrito que será submetido à publicação em revista especializada no assunto.
39 Multiresistance in strains of Vibrio and Aeromonas isolated from marine shrimp (Litopenaeus vannamei) marketed in Natal, Northeastern Brazil
L. M. R. Melo1, D. Almeida2, E. Hofer3, O. V. Sousa4, R. M. C. D. B. Godeiro1, E. M. R. Carvalho4 and R. H. S. F. Vieira4
1 - Universidade Potiguar (UnP), Natal, RN, Brazil.
2 - Universidade Federal do Rio Grande do Norte (UFRN), Natal, RN, Brazil. 3 - Fundação Instituto Oswaldo Cruz (FIOCRUZ) , Rio de Janeiro, RJ, Brazil. 4 - Universidade Federal do Ceará – Instituto de Ciências do Mar, Fortaleza, CE, Brazil.
Corresponding author:
Ligia Maria Rodrigues de Melo, Av. Afonso Pena 632, Tirol, Natal, RN, Brazil. CEP 59020-100.
E-mail: melolg@digi.com.br
Abstract
Aims: To evaluate the microbial susceptibility of vibrios and aeromonas isolated from shrimp (Litopenaeus vannamei) marketed in Natal (Northeastern Brazil). Methods and results: The shrimp samples yielded 91 Vibrio strains and 11 Aeromonas strains. Susceptibility was tested for 9 drugs: 57.8% of the strains
40 Conclusion: Farmed marine shrimp marketed in Natal were contaminated with species of vibrios and aeromonas resistant to multiple antibiotics of common use in humans and livestock. Significance and impact of the study: The transference through the food chain of bacteria resistant to antibiotics employed in human therapy is a serious concern to public health. The study evidences the risk of transference of bacterial resistance markers to humans through the consumption of aquaculture products.
41 Introduction
The Brazilian shrimp farming industry has grown dramatically over the past 25 years, making Brazil one of the largest producers and exporters in the world, mainly due to the favorable ecological conditions found in the Northeastern part of the country (ABCC, 2004).
However, the rapid expansion of the sector has raised concerns about the introduction and propagation of exogenous viral, bacterial and/or fungal diseases (Alves and Mello 2007). Many farmers therefore regularly submit their livestock to chemoprophylaxis with antibacterial agents of different spectra of activity (Roque et al., 2001).
Nevertheless, in Brazil prophylaxis with antibiotics is prohibited in aquaculture (ABCC, 2004) due to the risk of development of resistant microorganisms in the environment. The propagation of pathogens to the environment favors the transference of resistance markers to bacteria potentially pathogenic to man and other animals (Decamp; Moriarty, 2005).
In this study, samples of Pacific white shrimp (Litopenaeus vannamei)
farmed and marketed in Rio Grande do Norte (Northeastern Brazil) were evaluated for the presence of Vibrio and Aeromonas strains. The isolated
strains were subsequently submitted to antibiogram testing.
Materials and methods
Samples
Between August 2005 and September 2007, 50 samples of L. vannamei
42 capital of the state of Rio Grande do Norte (Northeastern Brazil). The shrimp was produced on farms outside Natal and in the hinterland.
Sample collection
Fresh cooled shrimp samples (200g) were purchased and accommodated in labeled isothermal boxes at 10ºC, then transported to the Food Microbiology Laboratory at Universidade Potiguar for microbiological analysis within two hours of sampling.
Isolation and phenotypical characterization of vibrio strains
After grinding the samples (200g) in a sterilized mortar, 25g aliquots were added to 225 mL sterile alkaline peptone water containing 1.0% NaCl (pH 8.6) and incubated at 35ºC for 24 hours. After the initial enrichment, a loopful of inoculum was streaked on TCBS agar and incubated at 35°C for 24 hours (Kaysner; DePaola, 2004).
Three to five sucrose-positive and negative colonies were transferred to the differential media Kligler iron agar (KIA) and Lysine Iron Agar (LIA), then to inclined tubes with Trypticase Soy Agar (TSA) containing 1.0% NaCl, followed by incubation at 35°C for 24 hours. Finally, positive strains were selected with the cytochrome-oxidase test, followed by phenotyping (Kaysner; DePaola, 2004).
Antimicrobial susceptibility
43 Laboratory Standards Institute (CLSI, 2003). After 24 hours of incubation at 35ºC, the inhibition halos were measured with a caliper. A strain of Escherichia coli ATCC 25922 was used as control. The disks (Laborclin) were soaked with
nalidixic acid (NAL/30µg), amikacin (AMK/30µg), ampicillin (AMP/10µg), gentamicin (GEN/10µg), ciprofloxacin (CIP/5µg), chloramphenicol (CHL/30µg), nitrofurantoin (NIT/300µg), tetracycline (TCY/30µg) and sulfametoxazol-trimetoprim (SFT/25µg).
Multiple antibiotic resistance (MAR) index
The MAR index was calculated as the ratio between the number of antibiotics to which the strain was resistant and the number of antibiotics to which the strain was exposed. A MAR index above 0.2 indicates multiresistance (Krumperman, 1983).
Plasmid curing
Multiresistant strains were seeded in inclined tubes with TSA supplemented with 1.0% NaCl and incubated at 35ºC for 24 hours. Subsequently, a loopful of each inoculum was seeded in test tubes with 1 mL Luria-Bertani broth containing 1.0% NaCl and 50 mg/mL acridine orange dye (Sigma #A-6014) and incubated for 24 hours at 35ºC (Molina-Aja et al., 2002).
44 Results
The 50 shrimp samples analyzed yielded 102 strains, of which 91 (89.2%) were vibrios and 11 (10.8%) were aeromonas. Vibrio cholerae
(24.52%) was predominant among the former (although no strain of V. cholerae
O1 or O/139 was identified) followed by V. alginolyticus (18.63%), V. carcharie
(15.69%) and Kanagawa-negative V. parahaemolyticus (9.80%). The isolated Aeromonas strains belonged to five species: A. veronii biogroup sobria, A. jandaei, A. schubertii, A. veronii biogroup veronii and A. hydrophila (Table 1).
Table 1- Species of Vibrio and Aeromonas isolated from marine shrimp
(Litopenaeus vannamei) farmed and marketed in Rio Grande do Norte, Brazil.
Strains Strains (n) Percentage%
Vibrio cholerae não O1/não O139 25 24.52
Vibrio alginolyticus 19 18.63
Vibrio carcharie 16 15.69
Vibrio parahaemolyticus 10 9.80
Vibrio spp 10 9.80
Aeromonas spp 4 3.92
Vibrio mimicus 4 3.92
Aeromonas jandaei 2 1.96
Aeromonas veronii biogrupo sóbria 2 1.96
Vibrio fischeri 2 1.96
Vibrio harveyi 2 1.96
Aeromonas hydrophila 1 0.98
Aeromonas schubertii 1 0.98
Aeromonas veronii biogrupo veronii 1 0.98
Vibrio cincinnatiensis 1 0.98
Vibrio damsela (Photobacterium
damsela) 1 0.98
Vibrio vulnificus 1 0.98
45 Three of the ten Vibrio species identified are potentially pathogenic to
man and important to public health: V. cholerae non-O1/non-O139, V. parahaemolyticus and V. vulnificus. Likewise, three of the Aeromonas species
have been implicated in food-borne illnesses: A. veronii biogroup sobria, A. veronii biogroup veronii and A. hydrophila.
The antibiogram revealed that 11/102 strains (V. cholerae
non-O1/non-O139 n=9; Aeromonas jandaei n=2) were sensitive to all the antibiotics tested
46 Figure 1- Susceptibility to antibiotics (susceptible, intermediately resistant and resistant) of strains of Vibrio and Aeromonas isolated from marine shrimp
(Litopenaeus vannamei)farmed and marketed in Rio Grande do Norte, Brazil.
AMK – amikacin; AMP - ampicillin; CHL - chloramphenicol; CIP - ciprofloxacin; GEN - gentamicin; NIT - nitrofurantoin; SXT – sulfametoxazol-trimetoprim; TCY - tetracycline; NAL – nalidixic acid.
47 Table 2- Frequency of monoresistance in species of Vibrio and Aeromonas
isolated from shrimp (Litopenaeus vannamei) farmed and marketed in Rio
Grande do Norte, Brazil.
Antibiotic Species strains (n) Resistant
AMK
Vibrio cholerae não O1/não
O139(2)
6
Vibrio parahaemolyticus(1) Vibrio fisheri(2)
Aeromonas schubertii (1)
AMP
Vibrio cholerae não O1/não
O139(1)
24
Vibrio carcharie (9) Vibrio alginolyticus (8) Vibrio parahaemolyticus (4) Vibrio harveyi (1)
Vibrio spp (1)
SXT Vibrio choleraeO139(1) não O1/não 1
TCY Aeromonas spp(2) 2
* (33) Number isolates.
Multiresistance was observed for 39 strains distributed over 10 different profiles (Table 3). One strain of V. carcharie (isolated from shrimp purchased at
a supermarket) was resistant to five antibiotics (AMP, CHL, NIT, SFT and TCY). The resistance profiles “AMK/AMP”, “AMP/TCY” and “AMK/AMP/TCY” were
48 Table 3- Multiresistance profile of strains of Vibrio and Aeromonas isolated from
marine shrimp (Litopenaeus vannamei) farmed and marketed in Rio Grande do
Norte, Brazil.
Profile
Species
Number
of isolates Frequency of profile (%)
V . al gi no lyt icus V . ca rcha ri e V . cho lerae V . pa rah ae m ol yt icus V ibrio sp V . ha rveyi V .ci nci nn atie nsi s A . veroni i bi o.g rup o sób ri a A . veroni i bi og rup o veroni i A . hyd rop hi la A erom on as sp
AMK/AMP 4 4 5 1 14 36,4(4)
AMK/TCY 2 1 3 18,2(2)
AMP/CIP 2 2 9,1(1)
AMP/TCY 1 9 10 18,2(2)
AMK/AMP/CIP 2 2 9,1(1)
AMK/AMP/TCY 1 1 1 1 4 36,4(4)
AMK/NAL/TCY 1 1 9,1(1)
AMP/CIP/NIT 1 1 9,1(1)
AMP/CHL/NIT/SXT/TCY 1 1 9,1(1)
CHL/NIT/TCY 1 1 9,1(1)
Total 39
The MAR index of the 39 strains of multiresistant vibrios and aeromonas ranged from 0.28 to 0.42.
After plasmid curing of 24 randomly selected resistant or intermediately resistant strains using acridine orange dye, 13 (>50%) strains lost all resistance and 7 lost part of the resistance (Table 4). V. cholerae non-O1/non-O139
suffered the greatest percentage loss of resistance (6 strains), suggesting the predominance of sensitive strains among the 25 isolates of V. cholerae
49 frequently lost resistance marker was AMP (12 strains), followed by AMK (n=11), TCY (n=8) and CIP (n=3) (Table 4)
Table 4 – Effect of plasmid curing with acridine orange dye on randomly selected resistant and intermediately resistant strains of Vibrio and Aeromonas
isolated from marine shrimp (Litopenaeus vannamei) farmed and marketed in
Rio Grande do Norte, Brazil.
Species Resistance profile resistance Lost
markers (n)
before curing after curing
A. hydrophyla AMK, NAL, TCY 3
A. veronii biogrupo veronii AMK, TCY AMK i 1
V. alginolyticus AMP, AMK AMP, AMK 0
V. alginolyticus AMP/AMKi,CIPi AMP/AMKi,CIPi 0
V. alginolyticus AMP, AMK 2
V. alginolyticus AMK,AMP/CIPi,NITi,TCYi AMK, AMP 3i
V. carcharie AMP, CIP AMP 1
V. carcharie CIP, NIT, TCY 3
V. carcharie AMK, AMP 2
V. cholerae não O1/O129 AMPi, AMKi 2i
V. cholerae não O1/O129 AMP,AMK, TCY 3
V. cholerae não O1/O129 AMK, AMP AMK, AMP 0
V. cholerae não O1/O129 AMK, AMP 2
V. cholerae não O1/O129 AMPi, AMKi 2i
V. cholerae não O1/O129 AMPi, AMKi 2i
V. cholerae não O1/O129 AMPi, AMKi 2i
V. harveyi AMP, AMK/ CIPi, NITi AMP,AMK/CIPi, 1i
V. mimicus AMPi, AMKi 2i
V. parahaemolyticus AMP, AMK AMK i 1
V. parahaemolyticus AMK, AMP/ TCYi, CIPi AMK, AMP/CIPi 1i
Vibrio sp. AMP, TCY AMP 1
Vibrio sp. AMP,TCY 2
Vibrio sp. AMK, AMP 2
Vibrio sp. AMK, AMP AMK, AMP 0
50 Discussion
Shrimp is rich in proteins and polyunsaturated fatty acids, both of which are essential to human health but, like other seafoods, shrimp products are often subject to contamination by aquatic microorganisms, especially vibrios and aeromonas, as shown in the present study.
Vibrios are free-swimming bacteria found in marine and freshwater environments, especially at 17-20ºC. Some species are very tolerant to variations in salinity (Heidelberg et al. 2002), but at lower temperatures (<15ºC)
proliferation slows down (Huss, 1997).
V. cholerae non-O1/non-O139 and V. parahaemolyticus can induce
clinically mild to severe gastroenteritis in humans, depending on the infecting dose ingested (Rippey, 1994). Vibrio proliferation is related to food storage
temperature: thus, in a study by Bradshaw et al. (1984), the concentration of V. parahaemolyticus rose from 102 to 108 CFU/g in homogenized shrimp kept at
25ºC for 24 hours. At human body temperature (37ºC), the generation time of the species is only 8-9 minutes (Huss, 1977). Not surprisingly, in the northern hemisphere toxi-infectious outbreaks of V. parahaemolyticus are most common
during the summer. It follows that shrimp should be stored at temperatures low enough to prevent vibrio proliferation. This may not be the case when the product is sold by street peddlers or at the marketplace, especially in tropical regions such as Rio Grande do Norte.
Like V. parahaemolyticus, V. cholerae non-O1/non-O139 is found in
seafoods and has been implicated in gastroenteritis epidemics in Thailand (Bagchi et al. 1993), Northeastern Brazil (Leal et al., 2008) and elsewhere. In
cholera-51 like diarrhea following shrimp ingestion. In the present study, the most frequently isolated species was V. cholerae non-O1/non-O139 (Table 1), which
is capable of inducing cholera-like dysentery. The organism has previously been reported from Northeastern Brazil (Cariri et al., 2010).
V. vulnificus, the most pathogenic of all vibrio species, is a permanent
concern for public health authorities worldwide (Rippey,1994), but so far no outbreaks in humans have been reported in Brazil. Although the incidence of V. vulnificus was very low in this study (Table 1), matching results published by
Nascimento et al. (2001) for Xiphopenaeus kroyeri (Heller) sampled in
Fortaleza, this finding should not be dismissed as insignificant as V. vulnificus is
capable of penetrating discontinuities in the cutaneous tegument and infecting individuals, especially in association with low immunity or hepatic degeneration. Likewise significant is the occurrence of five different species, one of which unspecified, among the 11 Aeromonas strains (10.7%) isolated from our
samples (Table 1). The enteropathogenic activity of these bacteria is still a matter of controversy in the literature. However, in some reported cases, such as the outbreak of diarrhea registered in São Bento do Una (Pernambuco, Brazil), Aeromonas predominated over other enterobacteria (Hofer et al.,
2006). Enteropathogenic vibrios and aeromonas are often transferred to humans through contaminated seafood.
Resistance to AMP (57.8%), AMK (29.4%) and TCY (21.6%) was very high in this study (Table 2; Figure 1).
beta-52 lactamases which inactivate the drug by breaking the beta-lactam ring (Tavares, 2001).
Our findings match those of Molina-Aja et al. (2002) and Lagana et al. (2011) with regard to the high level of resistance to AMP in vibrios isolated from seafood. They also support the notion that resistance to beta-lactams is very common in vibrios from aquatic environments around the world.
Microorganisms seem to develop resistance to AMK mainly through a mutation modifying the way the antibiotic is transported into the cell. Plasmids are usually involved in the mechanism of resistance to aminoglycosides in both Gram-positive and Gram-negative bacteria (Trabulsi; Alterthum, 2008). This was confirmed by Manjusha and Sarita (2011) who demonstrated that resistance plasmids in vibrios encoded beta-lactamases and resistance to AMK, NAL, cephalosporin and rifampicin and could be transferred to Escherichia coli
by conjugation.
The use of TCY as a supplement in aquaculture fodder can lead to the development of resistant strains (Tavares, 2001). Studies from our region have reported TCY-resistant vibrio strains isolated from seafood (Dias et al., 1991;
Rebouças et al., 2011). In the present study, 21.6% of the strains were resistant
to TCY, while 66.7% were sensitive (Figure 1).
53 Likewise, 29% of the vibrio strains isolated from shrimp pond water and hepatopancreas (Litopenaeus vannamei) by Rebouças et al. (2011) displayed
multiresistance including the marker AMP. Interestingly, resistance to CIP―a more recently introduced antibiotic in human and animal therapy, especially against Gram-negative bacteria―has also been documented (Tavares, 2001).
The results presented in Table 3 are supported by Vaseeharan et al.
(2005) who found that >50% of strains of Vibrio spp. (n=90) and Aeromonas
spp. (n=7) isolated from shrimp (Penaeus monodon) farmed in India were
resistant to CIP.
The MAR index (0.28–0.42) calculated for the 39 multiresistant strains in the study indicates that these strains pose a risk of transference and diffusion of resistance factors along the food chain (Krumperman, 1983).
Plasmids and transposons often carry multiple resistance genes conferring resistance to a range of antibiotics, and selection for any one determinant may conserve the entire plasmid and its resistances (Livermore, 2003).
54 elements. Thus, following plasmid curing, several of our strains continued resistant to AMK and AMP (n=9) and to CIP (n=3) (Table 4).
A range of antibiotics have been used as preventive/therapeutic agents in aquaculture. Since antibacterial resistance can be transferred by genetic elements, it may be propagated to the intestinal microbiota of human consumers of marine aquaculture products (Dang et al., 2006).
Thus, the indiscriminate use of antibiotics in humans and livestock favors the emergence of resistant pathogens and their propagation to the environment. The effects of antibacterial resistance on the structure and functions of ecosystems remain unknown, but the perspective of generalized resistance raises serious concern in the public health setting (Crane et al., 2006).
According to Lima dos Santos, (2010), based on data from the SIRVETA information system, 6.930 outbreaks of food-borne illnesses were registered in the Americas between 1993 and 2002, of which only 17.8% were attributed to seafood. The author believes most cases of food-borne illnesses are not registered because symptoms are mild and recovery is fast and/or victims do not seek medical care.
However, it has been demonstrated that the intestinal microbiota of humans may contain strains resistant to antibiotics, of which the resistance markers have been conferred by conjugation in vivo of food-borne multiresistant
vibrios and aeromonas.
55 Acknowledgments