PROGRAMA DE PÓS-GRADUAÇÃO EM SISTEMÁTICA E EVOLUÇÃO
COLÊMBOLOS (ARTHROPODA: HEXAPODA: COLLEMBOLA)
NUMA ÁREA DE CAATINGA DO NORDESTE BRASILEIRO
________________________________________________
Dissertação de Mestrado
Natal/RN, agosto de 2013
COLÊMBOLOS (ARTHROPODA: HEXAPODA: COLLEMBOLA) NUMA ÁREA DE CAATINGA DO NORDESTE BRASILEIRO
Dissertação apresentada ao Programa de Pós-Graduação em Sistemática e Evolução da Universidade Federal do Rio Grande do Norte como requisito parcial para obtenção do título de Mestre em Sistemática e Evolução.
Orientador: Alexandre Vasconcellos Co-orientador: Bruno Cavalcante Bellini
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Rocha, Isabel Medeiros dos Santos.
Colêmbolos (Arthropoda: Hexapoda: Collembola) numa área de Caatinga do Nordeste brasileiro / Isabel Medeiros dos Santos Rocha. – Natal, RN, 2013.
56 f.: il.
Orientador: Prof. Dr. Alexandre Vasconcellos. Coorientador: Prof. Dr. Bruno Cavalcante Bellini.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Sistemática e Evolução.
1. Diversidade. – Dissertação. 2. Fauna de solo. – Dissertação. 3. Semiárido – Dissertação. I. Vasconcellos, Alexandre. II. Bellini, Bruno Cavalcante. III. Universidade Federal do Rio Grande do Norte. IV. Título.
COLÊMBOLOS (ARTHROPODA: HEXAPODA: COLLEMBOLA) NUMA ÁREA DE CAATINGA DO NORDESTE BRASILEIRO
Dissertação apresentada ao Programa de Pós-graduação em Sistemática e Evolução da Universidade Federal do Rio Grande do Norte como requisito parcial para obtenção do título de Mestre em Sistemática e Evolução.
Aprovada em: 30 de agosto de 2013.
Comissão Examinadora:
__________________________________________________________________ Dr.Eduardo Assis Abrantes - USP
__________________________________________________________________ Dr. Mauro Pichorim - UFRN
AGRADECIMENTOS
A Deus, em primeiro lugar, por ter criado todas as coisas e, entre elas, o objeto do meu estudo; por amar-me incondicionalmente e pacientemente; por capacitar-me, sustentar-me, consolar-me, escutar-me, alegrar-me, enfim, por tudo.
Aos meus pais, pela educação e pelo afeto que sempre me ofereceram, especialmente à minha mãe por ter aguentado solitária e em silêncio os efeitos colaterais da quimioterapia para
não me “atrapalhar” durante a fase final do mestrado.
À minha família, especialmente madrinha Ignez, pelo “apoio moral”.
Ao meu esposo, Carlos Gustavo, pelo incentivo constante; por participar, também, da minha vida acadêmica; por seu amor.
À minha filha, Giovana, que nasceu durante o mestrado, por todas as alegrias que me dá e por ter suportado a ausência da “minha mamãe” ainda tão pequena.
A Evaneide e Iracema, que cuidaram de Giovana nas minhas ausências. Aos meus amigos, por existirem.
Ao meu orientador, Alexandre Vasconcellos por ensinar-me ecologia.
Ao meu co-orientador, Bruno Cavalcante Bellini, pelo precioso auxílio na identificação dos espécimes, pela disponibilidade, pela paciência, por tudo que está me
ensinando e pela amizade. Sem ele, os colêmbolos do RN “não existiriam”.
Aos membros das bancas de qualificação e defesa (Prof. Bruno Bellini, Prof. Iuri Baseia, Prof. Herbet Andrade, Prof. Mauro Pichorim, Dr. Eduardo Abrantes) pelas críticas e sugestões que contribuíram para o aperfeiçoamento deste trabalho.
Ao Dr. Eduardo Abrantes pelo auxílio na identificação dos isotomídeos.
Ao Dr. José Palacios-Vargas pelo auxílio na identificação dos Symphypleona e Poduromorpha durante sua breve visita ao Brasil.
À UFRN, ao CB, à Coordenação do Programa de Pós-graduação em Sistemática e Evolução e ao LECOB, por fornecerem o suporte necessário à realização deste trabalho.
Aos colegas de turma, especialmente Aila e Nerivânia, pelos momentos compartilhados nesses últimos anos.
Aos colegas do LECOB e do CB (Aila, Nerivânia, Heitor, Reberth, Uirandé, Daniel, Nicholas, Pedro, Thiago, Rafael, Victor, Milena, George, Laura etc.) pelo auxílio em diversas fases do trabalho.
Ao Sr. Rogério Câmara, que gentilmente cedeu a área da Fazenda Cauaçu para a realização das coletas.
Ao Sr. Helder Emanuel e sua esposa Kelly pelo apoio logístico e acolhimento em sua Fazenda Itabira, utilizada como ponto de apoio para as coletas.
A todos que foram esquecidos nesta lista, mas que participaram de alguma forma da minha vida e da minha pesquisa.
A todos que tentam fazer a sua parte pela conservação do que ainda resta de bom no nosso planeta.
“Por vezes sentimos que aquilo que fazemos não é senão uma gota de água no mar.
Mas o mar seria menor se lhe faltasse uma gota.”
RESUMO
Os ecossistemas edáficos são base para toda produção de recursos biológicos terrestres e sua dinâmica afeta não apenas os ambientes naturais, mas também a sociedade e suas atividades econômicas. Na Caatinga, o clima semiárido associado ao uso inadequado do solo têm potencializado a degradação e a perda do potencial produtivo das terras. Considerando que a fauna edáfica, incluindo os colêmbolos, é um importante indicador da qualidade do solo, este trabalho objetivou avaliar a fauna de Collembola numa área de Caatinga do Rio Grande do Norte, verificando a influência de fatores bióticos e abióticos, tais como características do solo, da vegetação e do clima, sobre a estrutura da taxocenose. As variáveis ambientais utilizadas foram: granulometria (representada pela proporção de areia), quantidade de matéria orgânica e pH do solo; riqueza, densidade e biomassa aérea vegetal; e necromassa. Foram utilizadas armadilhas de queda (pitfall) para coletar espécimes da fauna epiedáfica de
Collembola em 30 pontos localizados na Fazenda Cauaçu, João Câmara, RN, nos meses de julho (período chuvoso) e novembro (período seco) de 2011. Foram coletados 5.513 indivíduos de 15 espécies, distribuídas em 13 gêneros e 9 famílias de Collembola. Cinco das espécies registradas são novas para a ciência, confirmando a expectativa de alto grau de endemismo para o bioma, e a maior abundância de indivíduos foi registrada na estação chuvosa, o que sugere sensibilidade dos colêmbolos à baixa umidade. Quatro espécies foram mais abundantes na estação seca, todas da Ordem Entomobryomorpha, e os resultados das análises estatísticas sugerem que a riqueza de plantas, a biomassa vegetal aérea, a proporção de areia no solo, o pH e a umidade devida às chuvas sejam os principais influenciadores da abundância de Collembola na região estudada.
ABSTRACT
Edaphic ecosystems are the basis for the production of terrestrial biological resources and their dynamics affect not only the natural environment but also society and their economic activities. In Caatinga biome, the semi-arid climate associated with an inadequate soil management has increased the degradation and loss of productive potential of the soil. In this context, the study of soil fauna, including springtails, becomes an important indicator of soil quality. This study aimed to evaluate the fauna of Collembola in an area of Caatinga of Rio Grande do Norte State and the influence of biotic and abiotic factors, such as soil, vegetation and climate characteristics, on the structure of the taxocenosis. The environmental variables which were used were the following ones: granulometry (represented by the proportion of sand), quantity of organic matter and soil pH, richness, density and aerial biomass of the vegetal structure, and necromass. We used pitfall traps intending to collect specimens of the epiedaphic fauna of Collembola in 30 points located on Cauaçu Farm, João Câmara, RN, in July (rainy season) and November (dry season) 2011. We collected 5513 individuals of 15 species distributed in 13 genera and 9 families of Collembola. Five of the recorded species are new to science, confirming the expected high degree of endemism for Caatinga biome, and the highest abundance was recorded in the rainy season, which suggests Collembola sensitivity to low humidity. Four species were more abundant in the dry season, all of them belonged to the Order Entomobryomorpha. Results of statistical analyzes suggest that plant species richness, aerial biomass of vegetal structure, proportion of sand in the soil, pH and humidity are the main influences to the abundance of Collembola in the region studied.
LISTA DE FIGURAS
Figura 1- Estrutura geral de um colêmbolo ... 11 Figura 2 - Apêndices abdominais de Collembola ... 12 Figura 3 - Cladograma das relações filogenéticas em Hexapoda segundo Henning (1981). ... 13 Figura 4 - Cladograma das relações filogenéticas em Hexapoda segundo Triplehorn; Johnson (2005). ... 13 Figura 5 - Cladograma das relações filogenéticas em Hexapoda segundo Gullan; Cranston (2007). ... 13 Figura 6 - Cladograma das relações filogenéticas em Arthropoda segundo Giribet e colaboradores (2004). ... 14 Figura 7 - Hábito de Collembola ... 15 Figura 8 - Distribuição da Caatinga, com destaque para as ecorregiões, unidades de conservação e terras indígenas. ... 17 Figura 9 - Mapa do Rio Grande do Norte, com o município de João Câmara em destaque. ... 22 Figura 10 - Vista da vegetação na Fazenda Cauaçu, João Câmara, RN, nos períodos seco (a) e chuvoso (b). ... 23 Figura 11 - Distribuição espacial das parcelas de coleta na Fazenda Cauaçu, João Câmara, RN. ... 24 Figura 12 - Armadilha utilizada nas coletas de colêmbolos ... 25 Figura 13 - Coletor suspenso instalado na Fazenda Cauaçu, João Câmara, RN. ... 26 Figura 14 - Riqueza de colêmbolos observada por parcela e por período no ano de 2011, em João Câmara, RN. ... 30 Figura 15 - Abundância de colêmbolos observada por parcela e por período no ano de 2011, em João Câmara, RN. ... 30 Figura 16 - Relação entre a densidade de plantas e a abundância da espécie Calvatomina sp.
numa área de Caatinga (João Câmara, RN) no ano de 2011. ... 32 Figura 17 - Relação entre a riqueza de plantas e a abundância de Temeritas sp. numa área de
Caatinga (João Câmara, RN) no ano de 2011. ... 32 Figura 18 - Relação entre o pH do solo e a abundância de Temeritas sp. numa área de
LISTA DE TABELAS
Tabela 1 - Táxons de Collembola registrados em João Câmara, RN, nos meses de julho/2011 (chuva) e novembro/2011 (seca) e suas respectivas abundâncias em cada período ...28 Tabela 2 - Descrição da regressão múltipla entre a abundância de colêmbolos e as variáveis ambientais registradas em João Câmara, RN, no ano de 2011. Em negrito, os valores do P e
SUMÁRIO
1 INTRODUÇÃO ... 11
2 OBJETIVOS ... 21
2.1 OBJETIVO GERAL ... 21
2.2 OBJETIVOS ESPECÍFICOS ... 21
3 METODOLOGIA ... 22
3.1 ÁREA DE ESTUDO ... 22
3.2 COLETAS ... 24
3.3 IDENTIFICAÇÃO ... 25
3.4 VARIÁVEIS INDEPENDENTES ... 26
3.5 ANÁLISES ESTATÍSTICAS ... 27
4 RESULTADOS ... 28
5 DISCUSSÃO ... 35
6 CONCLUSÃO ... 39
REFERÊNCIAS ... 40
ANEXOS ... 49
ANEXO A - Coordenadas dos pontos de coleta na Fazenda Cauaçu, João Câmara, RN. ... 50
ANEXO B - Riqueza de espécies e densidade de plantas, biomassa vegetal aérea e necromassa, por ponto de coleta, na Fazenda Cauaçu, João Câmara, RN. ... 51
ANEXO C - Resultado da análise feita pela EMPARN da camada A (0-10 cm) do solo coletado na Fazenda Cauaçu, João Câmara, RN. ... 52
ANEXO D - Precipitação pluviométrica e temperatura média do ar em João Câmara, RN, no ano de 2011 (Fonte: EMPARN). ... 53
ANEXO E - Distribuição dorsal das macroquetas corporais (lado direito) de Seira sp. n. 1. .. 54
ANEXO F - Distribuição dorsal das macroquetas corporais (lado direito) de Seira sp. n. 2. .. 55
1 INTRODUÇÃO
A Classe Collembola Lubbock, 1870 (Arthropoda: Hexapoda) é a de maior diversidade entre os hexápodes entognatos (LUAN et al., 2005) e está entre os mais abundantes e amplamente distribuídos grupos de artrópodes terrestres (HOPKIN, 1997).
Os colêmbolos são animais bastante comuns e abundantes na natureza, porém pouco conhecidos pela população em geral, provavelmente por causa do seu tamanho reduzido (0,12 a 17 mm) (BELLINGER; CHRISTIANSEN; JANSSENS, 1996-2013). Eles não possuem asas e o padrão de tagmose de seu corpo é semelhante ao dos insetos, com cabeça, tórax de três segmentos e abdome de seis segmentos (EISENBEIS; WICHARD, 1987; ZEPPELINI FILHO; BELLINI, 2004).
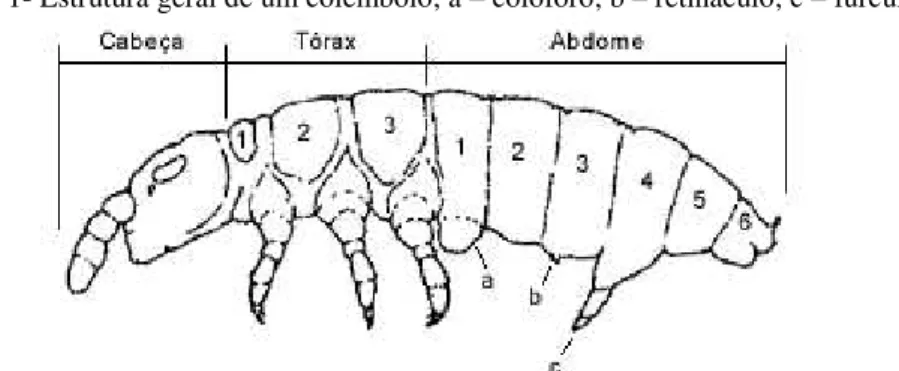
O táxon é considerado monofilético, sustentado por várias sinapomorfias: máximo de oito omatídeos na mancha ocular; antena com primariamente quatro artículos; abdome com seis segmentos, colóforo, retináculo e fúrcula (Figura 1) (ZEPPELINI FILHO; BELLINI, 2004).
Figura 1- Estrutura geral de um colêmbolo; a – colóforo; b – retináculo; c – fúrcula.
Fonte: Modificado de Bellinger; Christiansen; Janssens (1996-2013).
No terceiro segmento, está o retináculo (Figura 2b), formado por uma base (corpus) e um par
de peças distais (rami) que se acoplam aos dentes da fúrcula para mantê-la justaposta ao
abdome durante o repouso (EISENBEIS; WICHARD, 1987). No quarto segmento, encontra-se a fúrcula (Figura 2c), um órgão saltador em forma de furca composta por uma baencontra-se única (manúbrio) e dois ramos distais (dentes) que terminam, cada um, em uma espécie de garra (mucro). A fúrcula e o retináculo podem ser rudimentares ou estar ausentes em alguns grupos (ZEPPELINI FILHO; BELLINI, 2004) e são considerados adaptações das diferentes espécies de colêmbolos ao ambiente do solo (VANDERWALLE et al., 2010): uma fúrcula bem desenvolvida indica uma forma de vida epiedáfica, enquanto as formas euedáficas apresentam fúrcula rudimentar ou ausente (BADEJO; VAN STRAALEN, 1993; EISENBEIS; WICHARD, 1987).
Figura 2 - Apêndices abdominais de Collembola; a – Dicyrtomina cf. ornata (Nicolet, 1842) com vesículas do tubo ventral evertidas; b – Isotomurus sp., detalhe do retináculo, vista ventral; c – D. saundersi (Lubbock, 1862),
aspecto ventral com fúrcula estendida.
Fonte: a, c– Bellinger; Christiansen; Janssens (1996-2013); b – Magrisso (2012).
A posição filogenética de Collembola é alvo de discussões. Segundo Henning (1981), Hexapoda estaria dividido em dois grupos irmãos: Entognatha e Ectognatha (Figura 3). O primeiro (Collembola + Protura + Diplura) seria formado por animais cujas peças bucais são encerradas por pregas tegumentárias da cápsula cefálica, que se prolongam unindo-se ao lábio. O segundo (Insecta) corresponderia aos demais Hexapoda: animais com uma grande abertura na cabeça que expõe as peças bucais.
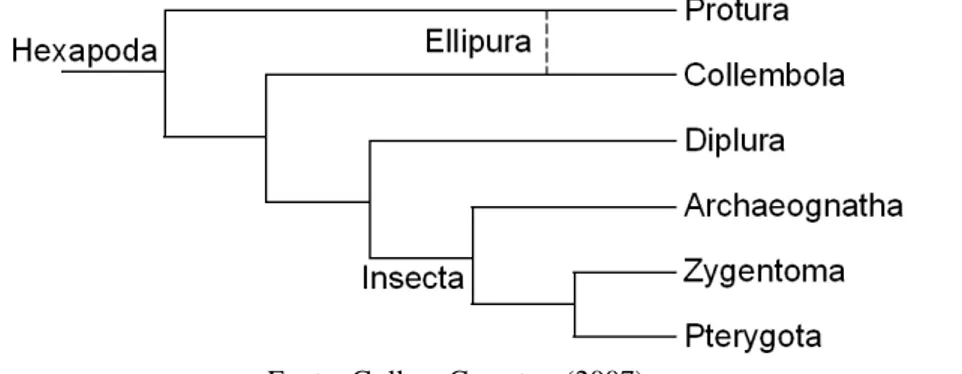
Por outro lado, na filogenia proposta por Kukalová-Peck (1987) e Triplehorn; Johnson (2005), Collembola estaria agrupado com Protura em um táxon chamado Ellipura, enquanto Diplura deveria constituir grupo irmão de Insecta (Figura 4).
Figura 3 - Cladograma das relações filogenéticas em Hexapoda segundo Henning (1981).
Fonte: Henning (1981).
Figura 4 - Cladograma das relações filogenéticas em Hexapoda segundo Triplehorn; Johnson (2005).
Fonte: Triplehorn; Johnson (2005).
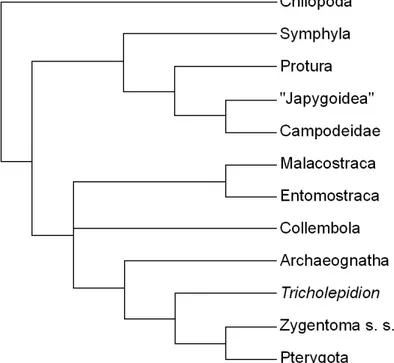
Figura 5 - Cladograma das relações filogenéticas em Hexapoda segundo Gullan; Cranston (2007).
Fonte: Gullan; Cranston (2007).
Num estudo sobre o grupo Ellipura, utilizando caracteres morfológicos e dados moleculares, Giribet e colaboradores (2004) mostraram que Protura e Diplura deveriam ser irmãos, enquanto Collembola estaria posicionado à parte, em posição incerta entre Crustacea e Ectognatha (Figura 6). Alguns dados que suportam uma relação próxima entre Collembola e Crustacea são: o fato do reduzido olho composto de Collembola ter se mostrado similar ao olho dos crustáceos (PAULUS, 1971 apud HOPKIN, 1997) e o fato de jovens embriões de
Anurida maritima (Guérin-Méneville, 1836) apresentarem um par de pequenos apêndices
Figura 6 - Cladograma das relações filogenéticas em Arthropoda segundo Giribet e colaboradores (2004).
Fonte: Giribet e colaboradores (2004).
Estudos com sequências completas de genomas mitocondriais sugeriram que Collembola teria derivado de Pancrustacea antes da invasão da terra firme pelos Hexapoda e todas as características que supostamente unem os dois grupos seriam resultado de convergência à vida nesse ambiente (NARDI et al., 2003). Posteriormente, novas pesquisas baseadas em dados moleculares sustentaram o monofiletismo de Hexapoda, com Collembola dentro do grupo (REGIER et al., 2010).
Dentro de Collembola, as relações são menos confusas e quatro Ordens sensu
Massoud, 1971 são reconhecidas: Entomobryomorpha e Poduromorpha, representadas por espécies de formas mais alongadas e claramente segmentadas (Figuras 7a e 7b, respectivamente), e Symphypleona e Neelipleona, com espécies de corpo globoso e com muitos segmentos fundidos entre si (Figuras 7c e 7d, respectivamente). Entomobryomorpha foi apontada como polifilética em alguns estudos de filogenia molecular que apresentaram a Superfamília Tomoceroidea fora do ramo em que se encaixaram os outros membros da Ordem
(D’HAESE, 2002; XIONG et al., 2008).
A Ordem com maior número de espécies descritas até o momento é Entomobryomorpha, com mais de 3.800 espécies, seguida por Poduromorpha, com aproximadamente 3.200. Em Symphypleona, há pouco mais de 1.200 espécies registradas e Neelipleona possui apenas 35 (BELLINGER; CHRISTIANSEN; JANSSENS, 1996-2013).
Figura 7 - Hábito de Collembola; a – Entomobryomorpha Seira mendoncea Bellini & Zeppelini, 2008; b –
Poduromorpha Anurida granaria (Nicolet, 1847); c – Symphypleona Allacma fusca Lineu, 1758; d –
Neelipleona Neelus murinus Folsom, 1896.
Fonte: a – Bellini; Zeppelini (2008); b, c, d – Bellinger; Christiansen; Janssens (1996-2013).
No Brasil, a fauna de Collembola é pouco conhecida, tendo sido registradas apenas 287 espécies, em 94 gêneros de 19 famílias (ABRANTES et al., 2010; ABRANTES et al., 2012; CULIK; ZEPPELINI FILHO, 2003; ZEPPELINI FILHO; BELLINI, 2004). Esse número é certamente incapaz de demonstrar a real composição faunística existente no Brasil (CULIK; ZEPPELINI FILHO, 2003) e reflete o baixo número de especialistas atuantes.
Para o Rio Grande do Norte, o número de registros ainda é baixo: apenas 17 espécies (BELLINI; GODEIRO, 2012; SANTOS-ROCHA; ANDREAZZE; BELLINI, 2011). O estado do Rio de Janeiro, por exemplo, possui uma área inferior e já conta com uma lista de, pelo menos, 140 espécies de colêmbolos (ABRANTES et al., 2012).
caídas ou na bainha de folhas vivas. Algumas espécies vivem na superfície de lagos ou ao longo de praias, sobre a neve, em cavernas ou em formigueiros e cupinzeiros. São raros, mas não ausentes, em regiões secas e muitos são transportados pelo vento (BUZZI, 2002; TRIPLEHORN; JOHNSON, 2005).
Eles atuam na ciclagem de nutrientes e decomposição de matéria orgânica de origem vegetal (CHAMBERLAIN et al., 2006; GANGE, 2000; SEASTED, 1984 apud LARSEN et al., 2008). Segundo Sautter; Santos (1991), os colêmbolos influenciam a fertilidade do solo através da estimulação da atividade microbiana, distribuição de esporos de espécies fúngicas e inibição de fungos e bactérias causadores de doenças em plantas.
Muitos colêmbolos se alimentam de microrganismos e fungos associados à matéria orgânica do solo e folhiço; outros grupos são coprófagos de outros invertebrados de solo e guano de morcegos (ZEPPELINI FILHO; BELLINI, 2004); podem ser consumidores de algas, líquens, substância animal ou vegetal em decomposição, ou até praticar canibalismo (BUZZI, 2002; GANGE, 2000).
Colêmbolos são utilizados em avaliações ambientais devido à sua ampla diversidade, abundância elevada em diversos tipos de habitats e por sua alta sensibilidade a alterações
ambientais (CASSAGNE et al., 2006; DEHARVENG, 1996; FERNANDES; NESSIMIAN; MENDONÇA, 2009; ZEPPELINI et al., 2009). A diversidade de colêmbolos e a densidade de suas populações são influenciadas por aspectos do solo como o pH, aeração, quantidade e qualidade da matéria orgânica, cobertura vegetal e presença (ou ausência) de compostos tóxicos em geral (CASSAGNE et al., 2006; FOUNTAIN; HOPKIN, 2004; SALAMON et al., 2004; ZEPPELINI et al., 2009). A Organização Internacional de Padronização (ISO) (1999 apud BROERSE; VAN GESTEL, 2010), por exemplo, publicou um protocolo para a utilização de Folsomia candida Willem, 1902 (Collembola: Isotomidae) em testes
ecotoxicológicos.
A avaliação de impacto ambiental e dos efeitos de fragmentação florestal, promovidas por atividades agrícolas ou outras, pode ser efetuada através da análise dos organismos do solo considerados como indicadores (SILVEIRA NETO et al., 1995; THOMANZINI; THOMANZINI, 2000); no entanto, estudos desse tipo com Collembola são relativamente pouco comuns, especialmente na Região Neotropical (e. g., BARETTA et al., 2008; GOMES et al., 2007; SAUTTER; SANTOS, 1991; ZEPPELINI et al., 2009; ZEPPELINI et al., 2013).
principalmente, a Região Nordeste do Brasil, além da porção norte do estado de Minas Gerais (Figura 8).
Figura 8 - Distribuição da Caatinga, com destaque para as ecorregiões, unidades de conservação e terras indígenas.
Fonte: Velloso; Sampaio; Pareyn (2002).
AMBIENTE E DOS RECURSOS NATURAIS RENOVÁVEIS, 2012), pela longa estação seca que dura de 7 a 9 meses por ano (NÓBREGA FILHO, 2009) e pela irregularidade pluviométrica, com precipitação anual média variando entre 250 e 900 mm (ALVES, 2007). Os solos, em geral, são pouco desenvolvidos, ricos em minerais, pedregosos, pouco espessos e com fraca capacidade de retenção de água (ALVES; ARAÚJO; NASCIMENTO, 2009).
A área original da Caatinga é povoada por cerca de 27 milhões de pessoas e esse alto nível de antropização trouxe inúmeros problemas para o bioma (BRASIL, 2013), entre os quais podem ser citados: comprometimento dos recursos hídricos; erosão, salinização e compactação dos solos; redução da diversidade biológica e da produção primária (ALVES, 2007).
O processo de degradação da Caatinga iniciou-se ainda no Brasil colonial, a partir da expansão da pecuária para o interior do país, e devido às várias décadas do uso impróprio e insustentável dos seus recursos, a Caatinga é considerada o bioma brasileiro menos estudado, menos conhecido cientificamente e menos conservado (ALVES; ARAÚJO; NASCIMENTO, 2009).
Apesar das condições severas em que se encontra, o bioma Caatinga apresenta grande variedade de ambientes organizados num mosaico de tipos de vegetação, que varia com o mosaico de solos e disponibilidade de água, e vai da vegetação xerófila e caducifólia até a caatinga arbustiva arbórea, mata seca e mata úmida, entre outras. Por isso, o bioma foi subdividido em oito ecorregiões (Figura 8), que são unidades naturais relativamente grandes delineadas pelos fatores bióticos e abióticos que regulam a estrutura e função das comunidades naturais que lá se encontram (VELLOSO; SAMPAIO; PAREYN, 2002).
Durante muito tempo, a Caatinga foi considerada homogênea e pouco diversa, mas estudos realizados nas últimas décadas já permitem uma mudança de paradigma e a exibem como um bioma heterogêneo que abriga uma alta diversidade de espécies e endemismos (LEAL; TABARELLI; SILVA, 2003).
Até o ano de 2011, a área protegida por Unidades de Conservação (UCs) no bioma atingiu cerca de 7,5% (Figura 8). Ainda assim, o bioma continua como um dos menos protegidos do país, já que pouco mais de 1% destas unidades são de Proteção Integral. Além disso, grande parte das UCs do bioma, especialmente as Áreas de Proteção Ambiental –
APAs, têm baixo nível de implementação (BRASIL, 2013).
LEWINSOHN; FREITAS; PRADO, 2005). São mais comuns os registros de ocorrência e as descrições de espécies (e. g., ABRANTES et al., 2010; ABRANTES et al., 2012; BELLINI; GODEIRO, 2012; BELLINI, ZEPPELINI, 2008; BELLINI; ZEPPELINI, 2011; BENTO et al., 2011; CULIK; ZEPPELINI FILHO, 2003; GODEIRO, 2013; SANTOS-ROCHA; ANDREAZZE; BELLINI, 2011; ZEPPELINI FILHO; BELLINI, 2004; ZEPPELINI; LIMA, 2012), mas alguns estudos ecológicos já foram realizados: Nunes; Araújo Filho; Menezes (2008) listaram os colêmbolos entre os membros da fauna edáfica em seu trabalho para avaliar a recolonização em áreas de Caatinga desmatadas e queimadas para o plantio de milho e feijão, mas não discutiram a presença de Collembola nos resultados; Nunes; Araújo Filho; Menezes (2009) avaliaram o impacto da queima tradicional e do enleiramento de resíduos orgânicos sobre abundância e diversidade da fauna edáfica, incluindo Collembola; Araujo e colaboradores (2009a) avaliaram o efeito das estações seca e chuvosa sobre a distribuição e abundância de organismos da macrofauna e mesofauna em áreas de Caatinga; Araujo e colaboradores (2009b) quantificaram a densidade e diversidade de grupos da comunidade de mesofauna do solo em área de Caatinga, no Semiárido da Paraíba, levando em consideração a influência da precipitação pluvial; Souza e colaboradores (2013) investigaram a influência de um rio temporário sobre a taxocenose de Collembola em uma área de Caatinga situada na ecorregião da Depressão Sertaneja Setentrional; Oliveira e colaboradores (2013b) compararam comunidades de colêmbolos em duas áreas com diferentes regimes de uso do solo na Caatinga; Oliveira e colaboradores (2013c) investigaram o padrão de diversidade de espécies de Collembola ao longo de um gradiente altitudinal na Caatinga e tentaram identificar variáveis ambientais que pudessem influenciar a diversidade do grupo no gradiente já citado; Oliveira e colaboradores (2013a) avaliaram o efeito da umidade, da disponibilidade de fungos (alimento) no solo e da densidade de predadores sobre a densidade de colêmbolos; Souto (2006) e Souto e colaboradores (2008) buscaram conhecer as flutuações das comunidades da mesofauna do solo em área de Caatinga; Zeppelini e colaboradores (2013) tentaram identificar padrões de diversidade em escala local em área de Caatinga (e outras) e compará-los à escala regional.
Apesar do interesse recente pela fauna colembológica da Caatinga, estes trabalhos isolados são incapazes de criar um panorama que explique a variação espacial da fauna de Collembola numa escala local, tentando identificar qual fator ou fatores ambientais mais afetam estes organismos.
questões ambientais, econômicas e sociais. Nesse contexto, a preservação e recuperação de solos é de extrema importância, visto que os ecossistemas edáficos são base para toda produção de recursos biológicos terrestres e sua dinâmica afeta não apenas os ambientes naturais, mas também a sociedade e suas atividades econômicas.
No caso da Caatinga, não somente o clima seco (às vezes acentuado por mudanças globais como, por exemplo, o El Niño), mas também a carência de informações, aliada ao uso
inadequado do solo (baseado na pecuária extensiva e em práticas agrícolas tradicionais), têm potencializado a degradação e a perda do potencial produtivo das terras. Para agravar este quadro, do ponto de vista da conservação, recursos naturais da Caatinga têm sido terminantemente perdidos por décadas sem mesmo terem sido catalogados.
Sabendo que a fauna edáfica é um importante indicador da qualidade do solo e que os colêmbolos são especialmente sensíveis a alterações ambientais, avaliar o efeito de fatores como a composição do solo e da vegetação sobre a diversidade desses organismos fornece informações preditivas do que ocorreria sob diferentes níveis de degradação, a partir das quais podem ser determinadas intervenções a fim de eliminar ou minimizar as perdas para o bioma. Além disso, o efeito do clima (seca x chuva) sobre a dinâmica populacional de Collembola simula o possível efeito do aquecimento global numa escala temporal reduzida e seu estudo auxilia a compreensão da relação entre o clima e a fauna numa região especialmente vulnerável a desastres ambientais.
2 OBJETIVOS
2.1 OBJETIVO GERAL
Estimar a diversidade da fauna de Collembola em uma área de Caatinga do Rio Grande do Norte, identificando fatores bióticos e abióticos que influenciam a taxocenose de colêmbolos numa escala local.
2.2 OBJETIVOS ESPECÍFICOS
- Inventariar a fauna de Collembola em uma área de Caatinga no Rio Grande do Norte; - Analisar as variações de riqueza e abundância da fauna de Collembola numa área de Caatinga, comparando os períodos seco e chuvoso;
3 METODOLOGIA
3.1 ÁREA DE ESTUDO
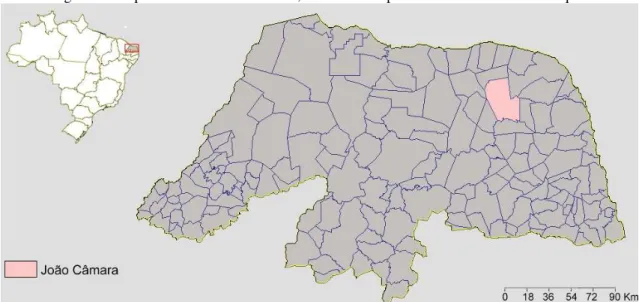
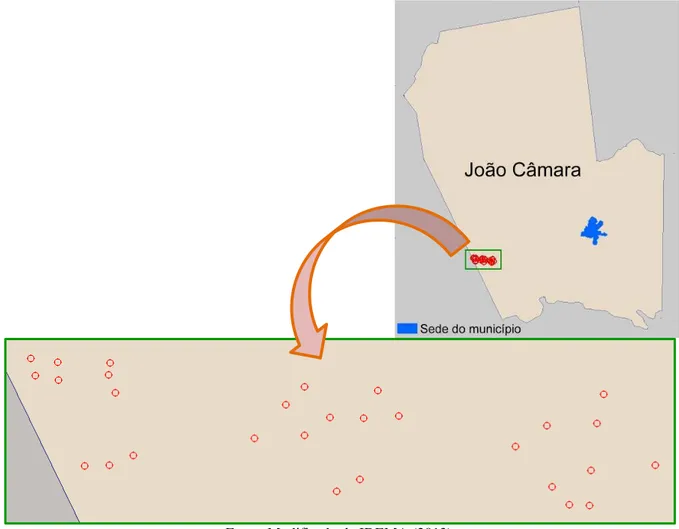
O município de João Câmara (Figura 9) está situado a 74 Km da capital do Rio Grande do Norte, na mesorregião Agreste Potiguar (MINISTÉRIO DE MINAS E ENERGIA, 2005), ocupa uma área de 714,96 Km2, possui 32.227 habitantes (INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA, 2013) e, assim como outros 95% do estado, localiza-se no bioma Caatinga (IBGE, 2012), na ecorregião da Depressão Sertaneja Setentrional (VELLOSO; SAMPAIO; PAREYN, 2002).
Figura 9 - Mapa do Rio Grande do Norte, com o município de João Câmara em destaque.
Fonte: Modificado de Instituto de Desenvolvimento Sustentável e Meio Ambiente do Rio Grande do Norte (2013).
A sede do município está 160 m acima do nível do mar (MME, 2005) e o clima é classificado como tropical com estação seca (classificação climática de Köppen-Geiger: As) (KOTTEK et al., 2006). A precipitação pluviométrica anual média é de 648,6 mm, com o período chuvoso ocorrendo tipicamente de março a junho, a temperatura média anual é de 24,7 °C e a umidade relativa média anual é de 70% (MME, 2005).
GRANDE DO NORTE, 2008). Geologicamente, o município de João Câmara encontra-se inserido na Província Borborema, sendo constituído pelos litotipos dos complexos Santa Cruz e João Câmara da Formação Seridó e das Suítes Calcialcalina de Médio e Alto potássio Itaporanga e Suíte Peraluminosa e os sedimentos das formações Açu e Jandaíra e do Grupo Barreiras (MME, 2005). Não há rios permanentes na ecorregião da Depressão Sertaneja Setentrional (VELLOSO; SAMPAIO; PAREYN, 2002).
As parcelas de coleta estão situadas em uma fazenda particular com 700 ha (Fazenda Cauaçu) e localizam-se na Formação Seridó (biotita xisto, metarritmito, clorita-sericita xisto) (MME, 2005). Na fazenda, a Caatinga arbórea-arbustiva tem densidade variável, possui em forte caráter decidual (Figura 10) e é entremeada por lajedos com vegetação própria (COSTA, 2012).
Figura 10 - Vista da vegetação na Fazenda Cauaçu, João Câmara, RN, nos períodos seco (a) e chuvoso (b).
Fonte: Costa (2012).
A área foi escolhida por apresentar um gradiente de fisionomias (vegetação mais homogênea e baixa até vegetação mais heterogênea e alta) com potencial de indicar diferentes níveis de degradação ambiental. Além disso, em entrevistas com moradores do entorno, foram apontadas subáreas com tempos diferentes de regeneração: a porção da área mais próxima à sede do município estaria sem uso para agricultura e pecuária há aproximadamente 15 anos e a mais distante há aproximadamente 100 anos, com uma porção intermediária que não está sendo alterada há 50 anos. Para a definição das parcelas de coleta, uma área de amostragem foi delimitada sob um grid de 2.000 m x 500 m, com células de 50 m x 50 m, no qual foram sorteadas aleatoriamente 30 células (Figura 11). O tamanho de 50 m x 50 m para as células do
grid foi definido com base numa estimativa do raio de deslocamento dos colêmbolos, de modo que cada parcela não tivesse influência sobre as outras (formação de pseudorréplicas). Em cada célula sorteada foi delimitado um quadrado de 20 m x 20 m com o auxílio de estacas de madeira dentro do qual as coletas foram realizadas. Foi utilizado um GPS para tomada das coordenadas dos pontos amostrados (Anexo A).
Figura 11 - Distribuição espacial das parcelas de coleta na Fazenda Cauaçu, João Câmara, RN.
Fonte: Modificado de IDEMA (2013).
3.2 COLETAS
Foram realizadas duas coletas, sendo uma no período chuvoso (julho/2011) e outra no período seco (novembro/2011), nas quais foram utilizadas armadilhas de queda (ALMEIDA; RIBEIRO-COSTA; MARINONI, 1998). A armadilha de queda, também conhecida como
pitfall, foi escolhida por ser apropriada à captura de artrópodes que se movem sobre a
foram adicionados 300 ml de etanol hidratado a 70%. Os pitfalls (Figura 12) foram dispostos
em cruz, com anteparos de 1 m de comprimento e 20 cm de altura, sendo um recipiente no centro e um em cada ponta da cruz, totalizando uma réplica com cinco frascos que ficaram abertos durante 48 h em cada parcela. Portanto, foram produzidas 30 réplicas em cada período, totalizando 60 réplicas ao final do trabalho.
Figura 12 - Armadilha utilizada nas coletas de colêmbolos; a – esquema de um dos elementos do pitfall em relação ao outro, ao anteparo e ao solo; b – arranjo dos pitffals em cada parcela de coleta.
Fonte: Autoria própria.
3.3 IDENTIFICAÇÃO
Os espécimes de colêmbolos coletados foram triados e contados sob estereomicroscópio Leica EZ4 e as morfoespécies foram identificadas, separadas (pela observação de padrões de coloração e morfometria) e fixadas em frascos do tipo eppendorf com álcool etílico hidratado a 70%.
Os colêmbolos foram tratados conforme a metodologia descrita por ARLÉ; MENDONÇA (1982), que consiste na imersão em uma solução despigmentadora, seguida de imersão em uma solução clarificadora e conservadora (líquido de Arlé). Depois, foram montados entre lâmina e lamínula com líquido de Hoyer para observação dos detalhes da morfologia externa em microscópio óptico e identificação das espécies. As preparações permanentes foram vedadas com esmalte incolor para unhas e etiquetadas de acordo com a área e a estação de coleta.
A identificação taxonômica foi procedida sob microscópio óptico (Leica DM500 e Olympus BX41) com o auxílio das chaves de identificação contidas em Bellini; Zeppelini (2009), Betsch (1980), Christiansen; Bellinger (1980), Bellinger; Christiansen; Janssens (1996-2013) e Richards (1968).
3.4 VARIÁVEIS INDEPENDENTES
A riqueza de espécies, densidade e biomassa aérea da vegetação (Anexo B) foram obtidas através de um estudo fitossociológico (em fase de elaboração)1 em que se utilizou o método de parcelas (MUELLER-DOMBOIS; ELLEMBERG, 1974), amostrando todos os indivíduos vivos com diâmetro do caule ao nível do solo (DNS) igual ou superior a 3 cm e altura total igual ou superior a 1 m (RODAL, 1992) numa área de 100 m² contida no quadrado de 20 m x 20 m onde foram coletados os colêmbolos. Para estimar a biomassa vegetal aérea de cada parcela foi usada a equação geral para plantas da Caatinga, exceto para a espécie
Cereus jamacaru DC. (mandacaru), cuja equação específica foi utilizada (SAMPAIO;
SILVA, 2005):
Equação geral: 0,0644*DNS2,3948 Equação para C. jamacaru: 0,0268*DNS2,3440
A produção de necromassa (em fase de elaboração)2 (Anexo B) foi estimada a partir da instalação de coletores suspensos de 1 m², confeccionados em ferro e náilon, com malha de 1 mm (Figura 13). Neles, o material da serrapilheira ficou retido sem permitir o acúmulo de água, evitando que se iniciasse o processo de decomposição (COSTA et al., 2007).
Figura 13 - Coletor suspenso instalado na Fazenda Cauaçu, João Câmara, RN.
Fonte: Barca (2012).
Para verificar o pH, a quantidade de matéria orgânica e a granulometria do solo (Anexo C), foram amostrados três monolitos por parcela contendo a camada superficial do solo (0-10 cm de profundidade). Um monolito consiste em uma amostra tridimensional e organizada de um corpo muito maior (o solo), que está sendo exposta com a maioria de suas propriedades preservadas (JACOMINE et al., 1996 apud MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO, 2011).
As amostras dos três monolitos de cada parcela foram homogeneizadas, guardadas em sacos plásticos impermeáveis e encaminhadas para a realização das análises no Laboratório de Análises de Solo, Água e Planta da EMPARN – Empresa de Pesquisa Agropecuária do Rio Grande do Norte. A análise granulométrica foi realizada através do método densitométrico (BOUYOUCOS, 1936), a quantidade de matéria orgânica do solo foi determinada pelo método colorimétrico calibrado com o método de Walkley;Black (1934) e o pH foi determinado por análise do solo em meio aquoso pelo método do potenciômetro combinado com eletrodo (EMPRESA BRASILEIRA DE PESQUISA AGROPECUÁRIA, 1997).
A temperatura média do ar e a precipitação pluviométrica (Anexo D) foram obtidas da EMPARN.
3.5 ANÁLISES ESTATÍSTICAS
Para avaliar quais parâmetros do habitat melhor explicam a composição da fauna de
Collembola no fragmento de Caatinga analisado, foi realizada uma regressão linear múltipla entre cada dado biótico da taxocenose (riqueza de espécies e abundância de indivíduos, respectivamente) e os parâmetros do habitat (riqueza de espécies, densidade e biomassa aérea
da vegetação; necromassa; pH, quantidade de matéria orgânica e a granulometria do solo). Depois disso, foi feita uma regressão linear entre os parâmetros do habitat e a
abundância de cada espécie de Collembola registrada.
Foram realizadas análises de variância monofatorial entre riqueza e abundância de
colêmbolos e a variável categórica “período” a fim de verificar se há influência da chuva/seca
sobre os animais.
Nas análises que envolveram as variáveis ambientais, as parcelas que apresentaram dados deficitários na amostragem ou foram consideradas outliers durante a avaliação
estatística dos dados foram excluídas.
4 RESULTADOS
No ano de 2011, devido ao fenômeno La Niña, o período chuvoso estendeu-se até
Julho (Anexo D), a precipitação pluviométrica anual foi de 930,3 mm e a temperatura média anual foi de 27,2 °C (EMPARN, 2011).
Foram coletados 5.513 colêmbolos, sendo 5.098 no período chuvoso e 415 no período seco, distribuídos em 15 espécies, de 13 gêneros e 9 famílias (Tabela 1).
Tabela 1 - Táxons de Collembola registrados em João Câmara, RN, nos meses de julho/2011 (chuva) e novembro/2011 (seca) e suas respectivas abundâncias em cada período.
Táxons Abundância
Chuva Seca
Ordem Poduromorpha
Família Brachystomellidae
Brachystomella aff. agrosa Wray, 1953 546 50
Família Neanuridae
Arlesia albipes (Folsom, 1927) 1.903 8
Ordem Entomobryomorpha Família Entomobryidae
Pseudosinella octopunctata Börner, 1901 4 57
Rhynchocyrtus cf. klausi Mendonça & Fernandes, 2007 1 2
Seira sp. n. 1 18 72
Seira sp. n. 2 120 216
Seira sp. n. 3 8 2
Família Isotomidae
Desoria trispinata (Mac Gillivray, 1896) 19 1
Hemisotoma thermophila (Axelson, 1900) 1 0
Família Paronellidae
Lepidonella sp. n. 1 6 0
Ordem Symphypleona
Família Bourletiellidae
Stenognathriopes sp. 20 2
Família Dicyrtomidae
Calvatomina sp. 210 0
Família Sminthuridae
Temeritas sp. 2.086 0
Família Sminthurididae
Sminthurides sp. n. 1 11 0
Sphaeridia sp. 145 5
Abundância total 5.098 415
As espécies Lepidonella sp. n. 1, Seira sp. n. 1 (Anexo E), Seira sp. n. 2 (Anexo F),
Seira sp. n. 3 (Anexo G) e Sminthurides sp. n. 1 são novas para a ciência e, além delas, as
espécies A. albipes, P. octopunctata, D. trispinata, H. thermophila, e os gêneros
Stenognathriopes e Calvatomina são registros não publicados para o estado do Rio Grande do
Norte (ABRANTES et al., 2012; BELLINI; GODEIRO, 2012; SANTOS-ROCHA; ANDREAZZE; BELLINI, 2011).
As espécies A. albipes e H. thermophila já haviam sido registradas em outros estados
brasileiros, com distribuição até a Paraíba, e os registros de P. octopunctata e D. trispinata no
Brasil eram restritos ao estado do Rio de Janeiro (Restinga e Mata Atlântica). As quatro espécies tiveram sua área de ocorrência estendida.
As espécies mais abundantes foram Temeritas sp., com 2.086 indivíduos amostrados e
A. albipes, com 1.903. A espécie menos abundante foi H. thermophila, com apenas um
espécime coletado.
Um terço das espécies registradas ocorreram apenas no período chuvoso (H.
thermophila, Lepidonella sp. n. 1, Sminthurides sp. n. 1, Calvatomina sp. e Temeritas sp.) e
todas as espécies que tiveram abundância maior no período seco pertencem à Família Entomobryidae (P. octopunctata, Rhynchocyrtus cf. klausi, Seira sp. n. 1 e Seira sp. n. 2).
A maior riqueza encontrada por coleta foi de oito espécies, nas parcelas 11 e 25, no período chuvoso, e a menor riqueza observada foi a ausência de colêmbolos nos pontos de coleta 4, 15, 18, 21, 23, 27 e 30, todos no período seco (Figura 14). A maior riqueza total foi de 10 espécies nos pontos 7 e 29 e a menor foi de três espécies nos pontos 18 e 30.
A maior abundância de colêmbolos verificada por coleta foi de 482 indivíduos, na parcela 25, no período chuvoso, e a menor abundância foi verificada nos mesmos pontos em que a riqueza foi nula, já citados anteriormente (Figura 15). A maior abundância total calculada foi de 483 espécimes no ponto 25 e a menor foi de 30 no ponto 9.
Todas as parcelas, com exceção da 29, apresentaram maior riqueza e abundância de colêmbolos no período chuvoso (Figuras 14 e 15).
Nas análises que envolveram variáveis ambientais, as parcelas 16, 20 e 24 foram excluídas a posteriori por apresentar dados deficitários e a parcela 25 foi excluída por ter sido
Figura 14 - Riqueza de colêmbolos observada por parcela e por período no ano de 2011, em João Câmara, RN.
Fonte: Autoria própria.
Figura 15 - Abundância de colêmbolos observada por parcela e por período no ano de 2011, em João Câmara, RN. 0 1 2 3 4 5 6 7 8 9
01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
R iqu eza de co lêmbo los Parcela Chuva Seca 0 100 200 300 400 500 600
01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
O modelo de regressão testado para a composição da fauna de Collembola explicou aproximadamente 57% da variação na abundância de indivíduos (R2=0,573; R2 ajustado=0,407). Das variáveis analisadas, a riqueza de plantas, a biomassa vegetal aérea, a proporção de areia no solo e o pH foram significativamente relacionadas com a abundância de colêmbolos, sendo a relação com a riqueza de plantas e o pH positiva e com a biomassa vegetal aérea e a proporção de areia no solo, negativa (Tabela 2).
Foi observada, também, uma tendência da densidade de plantas relacionar-se negativamente com a abundância dos colêmbolos (Tabela 2).
Tabela 2 - Descrição da regressão múltipla entre a abundância de colêmbolos e as variáveis ambientais registradas em João Câmara, RN, no ano de 2011. Em negrito, os valores do P e do coeficiente (β) obtidos para
as variáveis ambientais que foram significativamente relacionadas com a abundância de colêmbolos.
Fatores ambientais Coeficiente (β) Erro padrão P
Riqueza de plantas 23,596 6,474 0,002
Densidade de plantas -132,567 72,744 0,085
Biomassa vegetal aérea -0,087 0,030 0,009
Proporção de areia no solo -0,540 0,262 0,054
MOS -1,857 2,458 0,460
pH 79,597 30,856 0,019
Necromassa 0,977 1,029 0,355
Foi verificado, também por meio de regressão linear múltipla, que não existe tendência da riqueza de espécies de Collembola estar correlacionada com nenhuma das variáveis ambientais amostradas (R2=0,267; R2 ajustado=0).
Das regressões realizadas entre as variáveis ambientais e a abundância de cada espécie, somente duas indicaram influência significativa de alguma das variáveis sobre o número de indivíduos: a regressão realizada com a espécie Temeritas sp. (R2=0,489; R2
ajustado=0,29) e a realizada com Calvatomina sp. (R2=0,446; R2 ajustado=0,23). Esta última
indicou a densidade de plantas (p=0,016) como o fator que melhor explica a abundância de
Calvatomina sp. (Figura 16) e uma tendência da necromassa (p=0,077) influenciá-la,
enquanto aquela primeira apontou que a riqueza de plantas (p=0,001) (Figura 17) e o pH (p=0,039) (Figura 18) explicam a abundância de Temeritas sp. e a biomassa vegetal (p=0,072)
Figura 16 - Relação entre a densidade de plantas e a abundância da espécie Calvatomina sp. numa área de Caatinga (João Câmara, RN) no ano de 2011.
Fonte: Autoria própria.
Figura 17 - Relação entre a riqueza de plantas e a abundância de Temeritas sp. numa área de Caatinga (João Câmara, RN) no ano de 2011.
Fonte: Autoria própria.
Densidade de plantas (indiv./100 m²)
0 5 10 15 20 25 A b u n d ânc ia d e Cal va to mi n a sp.
Riqueza de plantas
Figura 18 - Relação entre o pH do solo e a abundância de Temeritas sp. numa área de Caatinga (João Câmara, RN) no ano de 2011.
Fonte: Autoria própria.
Com as análises de variância monofatorial, verificou-se que o período (chuvoso ou seco) influencia significativamente a taxocenose de Collembola (Figuras 19 e 20).
Figura 19 - Abundância média de colêmbolos entre os pontos amostrados em João Câmara, RN, nos períodos chuvoso (julho) e seco (novembro) de 2011 (F=52,77; p<0,05).
Fonte: Autoria própria.
3 4 5 6 7
pH do solo
0 50 100 150 200
A
b
u
n
d
ânc
ia
d
e
T
eme
r
it
as
Figura 20 - Riqueza média de colêmbolos entre os pontos amostrados em João Câmara, RN, nos períodos chuvoso (julho) e seco (novembro) de 2011 (F=19,63; p<0,05).
5 DISCUSSÃO
A ocorrência de cinco espécies novas (um terço do total) e mais seis espécies ainda não registradas para o Rio Grande do Norte amplia para 28 a riqueza de Collembola observada no estado (ABRANTES et al., 2012; BELLINI; GODEIRO, 2012; SANTOS-ROCHA; ANDREAZZE; BELLINI, 2011), número ainda muito pequeno se o compararmos com os de outros estados brasileiros em que há maiores esforços de coleta, como o Rio de Janeiro (142 espécies) e o Amazonas (59 espécies) (ABRANTES et al., 2012).
O gênero Temeritas, que foi o mais abundante, já havia sido coletado no RN numa
área de Mata Atlântica; no entanto, não há informações sobre sua abundância neste outro bioma (SANTOS-ROCHA; ANDREAZZE; BELLINI, 2011). A abundância elevada de indivíduos em poucos táxons, com os demais apresentando populações reduzidas, é um padrão característico de climas tropicais com estações bem definidas (BEGON; HARPER; TOWNSEND, 1996; COLINVAUX, 1986). Martins; Santos (1999) salientam que, numa comunidade, cada espécie tem abundância diferente, sendo algumas muito abundantes (dominantes), outras de abundância intermediária e outras de abundância muito pequena (raras). Observa-se nos resultados obtidos (Tabela 1) a grande probabilidade das espécies
Temeritas sp., A. albipes, B. aff. agrosa, Seira sp. n. 2 e Calvatomina sp. serem mais
resistentes e adaptadas às condições do ambiente em que o estudo foi desenvolvido (espécies dominantes) e Sphaeridia sp., Seira sp. n. 1 e P. octopunctata serem intermediárias. No
entanto, as demais espécies não são menos importantes, pois todas possuem um papel na regulação interna do fluxo de energia do ecossistema.
A maior abundância de colêmbolos observada na estação chuvosa já era esperada e corrobora o padrão encontrado em outros estudos realizados no bioma (ARAUJO et al., 2009a; NUNES, ARAÚJO FILHO; MENEZES, 2008; SOUTO, 2006; VASCONCELLOS et al., 2010). Souto (2006), por exemplo, explica que no período chuvoso há uma presença mais efetiva do estrato herbáceo na Caatinga, contribuindo para o conteúdo de matéria orgânica associado ao solo rizosférico.
para os próprios colêmbolos que, em sua maioria, só podem sobreviver, ou pelo menos estar ativos, em condições de umidade próximas ao ponto de saturação (CHRISTIANSEN, 1992). Vasconcellos e colaboradores (2010) estudaram os efeitos da sazonalidade sobre as ordens de insetos na Caatinga e constataram que os padrões de abundância foram relacionados principalmente com a precipitação pluviométrica.
O fato de a maior parte das espécies encontradas ter sido mais abundante na estação chuvosa e uma parte delas ter sido capturada apenas nesta época do ano sugere que os colêmbolos são sensíveis à baixa umidade (BUTCHER; SNIDER; SNIDER, 1971; GILLOT, 2005). No entanto, a escassez de indivíduos na estação seca não deve ser associada necessariamente à mortalidade. O decréscimo populacional normalmente é devido a mecanismos de sobrevivência, como a redução na taxa de reprodução ou a migração para locais mais úmidos (BUTCHER; SNIDER; SNIDER, 1971). Essa migração pode estar sendo dirigida por órgãos sensoriais, como o órgão pós-antenal, com função ainda não completamente elucidada, mas cuja estrutura leva a crer que seja um quimio, higro ou até termorreceptor (EISENBEIS; WICHARD, 1987). É válido ressaltar que esse órgão está ausente em algumas famílias, como Entomobryidae (HOPKIN, 1997), que no caso deste trabalho teve a maior abundância de espécies da estação seca. Pode-se supor, então, que a presença do órgão pós-antenal seja importante para que os animais migrem durante a seca, ficando no ambiente aqueles que não o possuem.
Outro mecanismo que pode estar atuando no período da seca é a sobrevivência de ovos e imaturos através de uma forma de latência ou diapausa (BELLINGER; CHRISTIANSEN; JANSSENS, 1996-2013; HOPKIN, 1997), ou de formas juvenis e adultas resistentes à dessecação (anidrobiose e ecomorfose), que possam ser rapidamente reativadas pela umidade (HOPKIN, 1997). Esse tipo de estratégia já foi observado em colêmbolos tanto de ambientes áridos como gélidos.
Além das estratégias já citadas, pode ocorrer também de o ciclo de vida da espécie ser rápido, com os estágios mais vulneráveis à dessecação (juvenil e adulto) durando pouco tempo e o estágio de ovo (resistente à seca) durando a maior parte do ano, ou de a espessura da cutícula ser maior, visando diminuir sua permeabilidade e, assim, reduzir a transpiração (HOPKIN, 1997). Greenslade (1981 apud HOPKIN, 1997) citou o exemplo de uma espécie do gênero Sphaeridia que vive nas regiões áridas de Koonamore (Austrália) e completa o
ciclo de vida de ovo a ovo em apenas uma semana (em laboratório).
e dessecação (BELLINI; FERNANDES; ZEPPELINI, 2010; BELLINI; ZEPPELINI, 2009). Os espécimes desse gênero têm o corpo coberto por abundantes cerdas e escamas que retêm uma camada de ar, reduzindo a perda de água e permitindo a sobrevivência em ambientes secos (CHRISTIANSEN; BELLINGER, 2000; ZEPPELINI FILHO; BELLINI, 2004).
Em outro trabalho realizado recentemente em João Câmara, RN, a espécie Seira sp. n.
2 também foi a mais abundante na estação seca. Nesse trabalho, foi sugerida uma relação entre a redução de alguns grupos de insetos predadores de Collembola, como Coleoptera, Diptera e Hymenoptera, e a maior abundância e frequência de Seira sp. n. 2 no período seco
(FERREIRA; BELLINI; VASCONCELLOS, no prelo).
Uma outra espécie que também teve maior abundância na estação seca foi P.
octopunctata, que apresenta distribuição cosmopolita e pode ser encontrada inclusive em
ambientes quentes e secos em outras partes do mundo (FJELLBERG, 2007).
As espécies da Ordem Symphypleona costumam apresentar longos colóforos que, sendo responsáveis pelo equilíbrio osmótico, também são uma grande superfície de perda de água para o ambiente (EISENBEIS; WICHARD, 1987; HOPKIN, 1997). Provavelmente, por este o motivo, os exemplares deste grupo coletados na estação seca foram pouco numerosos (apenas sete).
A parcela 29 foi a única que teve riqueza e abundância de colêmbolos maiores no período seco que no chuvoso, mas deve-se notar que não houve diferença significativa entre os valores dessas variáveis nos dois períodos de coleta como aconteceu na maioria dos outros pontos. A diferença entre as abundâncias nas duas coletas foi a menor entre todas as amostras e a diferença entre as riquezas foi de apenas uma espécie, apontando para a existência de algum fator não analisado neste trabalho que deve manter o ambiente mais estável ao longo do ano, como os elementos de micro-habitat (rochas úmidas, musgo, algas etc.).
A influência positiva da riqueza de plantas sobre a abundância de Collembola já foi constatada em outros estudos (NUNES, ARAÚJO FILHO; MENEZES, 2009; ROVEDDER et al., 2002; SALAMON et al., 2004; VEGTER; JOOSSE; ERNSTING, 1988; ZEPPELINI et al., 2009) e está relacionada tanto com a diversidade alimentar que ela proporciona quanto com a boa qualidade do habitat que ela indica, já que ambientes em estados mais adiantados
de sucessão ecológica (e preservados há mais tempo) tendem a apresentar maior riqueza de espécies vegetais.
(competição por luz), que estão mais diretamente associadas aos animais epiedáficos, como gramíneas e ciperáceas. Essa vegetação de menor porte não foi avaliada no presente trabalho, mas os dados apresentados aqui sugerem sua inclusão em futuras avaliações ecológicas na Caatinga.
A tendência observada de a densidade de plantas influenciar negativamente a abundância de colêmbolos pode estar relacionada também à competição com as plantas menores e até à disponibilidade de espaço no solo para os colêmbolos, já que na região há muitos afloramentos rochosos.
A relação positiva entre o pH e a abundância de Collembola reflete a adaptação dos animais da espécie Temeritas sp. a um pH subneutro, como se pode verificar no gráfico da
Figura 18, e já foi observado em outras espécies por Van Straalen; Verhoef (1997). Assim, é possível que Temeritas sp. seja um adequado bioindicador de pH do solo em ambiente de
Caatinga.
A relação entre a proporção de areia e a abundância de Collembola foi negativa e deve estar relacionada à baixa retenção de água que é característica de solos mais arenosos, já que uma proporção maior de areia subentende uma proporção menor de argila (elemento com maior capacidade de retenção de líquido). Souto (2006) afirma que o conteúdo de água no solo é particularmente importante para os colêmbolos. No caso da fauna coletada nesse trabalho (epiedáfica), a sensibilidade à dessecação superficial do solo é ainda maior.
6 CONCLUSÃO
Um terço das espécies registradas corresponde a espécies novas para a Ciência, confirmando a expectativa de um alto grau de endemismo para a Caatinga e reforçando a necessidade de conservação do bioma.
Foram identificados alguns fatores ambientais que estão influenciando a abundância de Collembola na área de Caatinga estudada (riqueza de plantas, biomassa vegetal aérea, pH, proporção de areia no solo e umidade devida à chuva), permitindo um melhor planejamento do manejo a fim de manter a saúde edáfica.
Verificou-se que a importância da água para a taxocenose de Collembola deve estar associada não só à umidade do solo, mas também ao efeito causado pela chuva sobre toda a vida na Caatinga.
A fim de elucidar que fatores ambientais estão relacionados à riqueza de Collembola na área em estudo, seria necessário realizar novas coletas, incluindo dados meteorológicos e dados bióticos relativos a predadores de colêmbolos e disponibilidade de microrganismos, por exemplo.
Considerando que houve maior diversidade de espécies no período chuvoso e que 2011 foi um ano atípico devido à ocorrência do fenômeno La Niña, surge a preocupação com
as mudanças climáticas que vêm ocorrendo em nosso planeta: se a maioria das espécies
consideradas “dominantes” estão adaptadas às condições severas da Caatinga, mas continuam
REFERÊNCIAS
ABRANTES, E. A. et al. Synthesis on Brazilian Collembola: an update to the species list. Zootaxa, [S.l.], v. 2388, p. 1-22, 2010.
______. Errata Corrigenda and update for the “Synthesis of Brazilian Collembola: an update to the species list.” ABRANTES et al. (2010), Zootaxa, 2388: 1-22. Zootaxa, [S.l.], v. 3168, p. 1-21, 2012.
ALMEIDA, L. M.; RIBEIRO-COSTA, C. S.; MARINONI, L. Manual de coleta, conservação, montagem e identificação de insetos. Ribeirão Preto: Holos, 1998.
ALVES, J. J. A. Geoecologia da Caatinga no semi-árido do Nordeste brasileiro. CLIMEP: Climatologia e Estudos da Paisagem, Rio Claro, v. 2, n. 1, p. 58-71, 2007.
ALVES, J. J. A.; ARAÚJO, M. A.; NASCIMENTO, S. S. Degradação da Caatinga : uma
investigação ecogeográfica. Caatinga, Mossoró, v. 22, n. 3, p. 126-135, 2009.
ARAUJO, K. D. et al. Grupos taxonômicos da macro e mesofauna edáfica em área de Caatinga. Revista Verde, Mossoró, v. 4, n. 4, p. 122-130, 2009a.
______. Influência da precipitação pluvial sobre a mesofauna invertebrada do solo em área de Caatinga no Semiárido da Paraíba. Geoambiente, Jataí, n. 12, p. 1-12, 2009b. Disponível em <http://revistas.jatai.ufg.br/index.php/geoambiente/article/view/604>. Acesso em: 06 jun. 2013.
ARLÉ, R.; MENDONÇA, C. Estudo preliminar das espécies de Dicranocentrus Schött, 1893,
ocorrentes no Parque Nacional da Tijuca, Rio de Janeiro (Collembola). Revista Brasileira de Biologia, [S.l.], v. 42, n. 1, p. 41-49, 1982.
BADEJO, M. A.; VAN STRAALEN, N. M. Seasonal Abundance of Springtails in Two Contrasting Environments. Biotropica, [S.l.], v. 25, n. 2, p. 222-228, 1993.
BARCA, R. R. B. Estrutura da população de Microcerotermes exiguus (Isoptera: Termitidae) e sua participação no consumo de madeira em uma área de Caatinga, Nordeste, Brasil. 2012. 43 f. Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte, Natal, 2012.
BARETTA, D. et al . Colêmbolos (Hexapoda: Collembola) como bioindicadores de qualidade do solo em áreas com Araucaria angustifolia. Revista Brasileira de Ciência do Solo,
Viçosa, v. 32, n. spe, p. 2693-2699, 2008.
BELLINGER, P. F.; CHRISTIANSEN, K. A.; JANSSENS, F. Checklist of the Collembola of the World, 1996-2013. Disponível em: <http://www.collembola.org>. Acesso em: 31 maio 2013.
BELLINI, B. C.; FERNANDES, L. H.; ZEPPELINI, D. Two new species of Seira
(Collembola , Entomobryidae) from Brazilian coast. Zootaxa, [S.l.], v. 2448, p. 53-60, 2010.
BELLINI, B. C.; GODEIRO, N. N. A new species of Tyrannoseira (Collembola:
Entomobryidae: Seirini) from the Brazilian coastal region. Zoologia, Curitiba, v. 29, n. 1, p. 81-84, 2012.
BELLINI, B. C.; ZEPPELINI, D. A new species of Seira (Collembola: Entomobryidae) from
northeastern Brazil. Revista Brasileira de Zoologia, [S.l.], v. 25, n. 4, p. 724-727, 2008.
______. A new species of Seira Lubbock (Collembola, Entomobryidae), with a key to the
species of Paraíba, Brazil. Revista Brasileira de Entomologia, [S.l.], v. 53, n. 2, p. 266-271, 2009.
______. New genus and species of Seirini (Collembola, Entomobryidae) from Caatinga Biome, Northeastern Brazil. Zoosystema, Paris, v. 33, n. 4, p. 545-555, 2011.
BENTO, D. D. M. et al. Mapeamento, caracterização ambiental e relevância do patrimônio espeleológico de Felipe Guerra/RN. In: CONGRESSO BRASILEIRO DE ESPELEOLOGIA, 31., 2011, Ponta Grossa. Anais... Ponta Grossa: Sociedade Brasileira de Espeleologia, p. 485-499, 2011.
BETSCH, J.-M. Éléments pour une monographie des collemboles symphyplèones (hexapodes, aptérygotes). Mémoires du Muséum National d'Histoire Naturelle, [S.l.], v. 65, 1980. (Nouvelle Série, Série A, Zoologie).
BOUYOUCOS, G. J. Directions for Making Mechanical Analysis of Soils by the Hydrometer Method. Soil Science, [S.l.], v. 42, n. 3, p. 225-230, 1936.
BRASIL. Ministério do Meio Ambiente. Caatinga. Disponível em: <http://www.mma.gov.br/biomas/caatinga>. Acesso em: 30 maio 2013.
BROERSE, M.; VAN GESTEL, C. A. M. Mixture effects of nickel and chlorpyrifos on
Folsomia candida (Collembola) explained from development of toxicity in time.
Chemosphere, [S.l.], v. 79, n. 9, p. 953-957, 2010.
BUTCHER, J. W.; SNIDER, R.; SNIDER, R. J. Bioecology of edapidc Collembola and Acarina. Annual Review of Entomology, [S.l.], v. 16, p. 249-288, 1971.
CASSAGNE, N. et al. Endemic Collembola, privileged bioindicators of forest management. Pedobiologia, [S.l.], v. 50, n. 2, p. 127-134, 2006.
CHAMBERLAIN, P. M. et al. Translocation of surface litter carbon into soil by Collembola. Soil Biology and Biochemistry, [S.l.], v. 38, p. 2655-2664, 2006.
CHRISTIANSEN, K. Springtails. Kansas School Naturalist, Emporia, v. 39, n. 1, 1992. Disponível em: <http://www.emporia.edu/ksn/v39n1-october1992/KSNVOL39-1.htm>. Acesso em: 2 mar. 2013.
CHRISTIANSEN, K.; BELLINGER, P. The Collembola of North America, North of Rio Grande. Grinnell: Grinnell College, 1980.
______. Redescriptions of Some of Salmon's Isotomid Types, Contr. biol. Lab. Kyoto Univ., [S.l.], v. 29, p. 103-115, 2000.
COLINVAUX, P. Ecology. New York: John Wiley and Sons, 1986.
COSTA, C. C. A. et al. Produção de serapilheira na Caatinga da Floresta Nacional do Açú-RN. Revista Brasileira de Biociências, Porto Alegre, v. 5, p. 246-248, 2007. Suplemento 1.
COSTA, U. O. Determinantes locais da decomposição foliar e de raízes finas em um ecossistema semiárido do Nordeste brasileiro. 2012. 48 f. Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte, Natal, 2012.
CULIK, M. P.; ZEPPELINI FILHO, D. Diversity and distribution of Collembola (Arthropoda: Hexapoda) of Brazil. Biodiversity and conservation, [S.l.], v. 12, p. 1119-1143, 2003.
D’HAESE, C. A. Were the first springtails semi-aquatic? A phylogenetic approach by means of 28S rDNA and optimization alignment. Proceedings of the Royal Society of London, [S.l.], v. 269, n. 1496, p. 1143-1151, 2002. (Series B, Biological sciences).
DEHARVENG, L. Soil Collembola Diversity, Endemism, and Reforestation: A Case Study in the Pyrenees (France). Conservation Biology, [S.l.], v. 10, n. 1, p. 74-84, 1996.
EATON, R. J. et al. Effects of organic matter removal, soil compaction, and vegetation control on Collembolan populations. Pedobiologia, [S.l.], v. 48, n. 2, p. 121-128, 2004.
EMPRESA BRASILEIRA DE PESQUISA AGROPECUÁRIA. Manual de Métodos de Análise de Solo. 2. ed. Rio de Janeiro: EMBRAPA, 1997. Disponível em <http://www.agencia.cnptia.embrapa.br/Repositorio/Manual+de+Metodos_000fzvhotqk02wx 5ok0q43a0ram31wtr.pdf>. Acesso em 4 jun. 2013.
FERNANDES, L. H.; NESSIMIAN, J. L.; MENDONÇA, M. C. DE. Structure of
Poduromorpha (Collembola) communities in “restinga” environments in Brazil. Pesquisa Agropecuária Brasileira, Brasília, v. 44, n. 8, p. 1033-1039, 2009.
FERREIRA, A. S. Variação temporal e descrição de novas espécies de Collembola (Arthropoda, Hexapoda) em uma área de caatinga do Nordeste do Brasil. 2013. 68 f. Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte, Natal, 2013.
FJELLBERG, A. The Collembola of Fennoscandia and Denmark. Part II: Entomobryomorpha and Symphypleona. Fauna Entomologica Scandinavica, Leiden, v. 42, 2007.
FOUNTAIN, M.; HOPKIN, S. P. A comparative study of the effects of metal contamination on Collembola in the field and in the Laboratory. Ecotoxicology, London, v. 13, n. 6, p. 573-587, 2004.
GANGE, A. Arbuscular mycorrhizal fungi, Collembola and plant growth. Trends in Ecology and Evolution, [S.l.], v. 15, n. 9, p. 369-372, 2000.
GILLOTT, C. Entomology. 3. ed. Dordrecht: Springer, 2005.
GIRIBET, G. et al. Is Ellipura monophyletic? A combined analysis of basal hexapod relationships with emphasis on the origin of insects. Organisms, Diversity and Evolution, [S.l.], v. 4, p. 319-340, 2004.
GODEIRO, N. N. Diversidade de Seirini (Collembola, Arthropleona, Entomobryidae) em áreas úmidas da Caatinga. 2013. 90 f. Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte, Natal, 2013.
GOMES, A. A. et al. Avaliação do impacto da fragmentação de florestas nativas sobre a mesofauna edáfica na região de Dourados-MS. Ciência e agrotecnologia, Lavras, v. 31, n. 3, p. 612-618, 2007.
GULLAN, P. J.; CRANSTON, P. S. Sistemática dos insetos: filogenia e classificação. In: _____. Os insetos: um resumo de entomologia. Tradução Sonia Maria Marques Hoenen. 3. ed. São Paulo: Roca, 2007. cap. 7, p. 155-174.
HENNING, W. Insect Phylogeny. New York: Wiley, 1981.
HOPKIN, S. P. Biology of the Springtails (Insecta: Collembola). New York: Oxford University Press, 1997.
INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. Mapa de biomas e de vegetação: IBGE lança o Mapa de Biomas do Brasil e o Mapa de Vegetação do Brasil, em comemoração ao Dia Mundial da Biodiversidade. Disponível em: <http://www.ibge.gov.br/home/presidencia/noticias/noticia_visualiza.php?id_noticia=169>. Acesso em: 15 nov. 2012.
______. João Câmara - RN. Disponível em: <http://www.ibge.gov.br/cidadesat/link.php? codmun=240580>. Acesso em: 23 maio 2013.
INSTITUTO BRASILEIRO DO MEIO AMBIENTE E DOS RECURSOS NATURAIS RENOVÁVEIS. Ecossistemas brasileiros: Caatinga. Disponível em: <http://www.ibama.gov.br/ecossistemas/caatinga.htm>. Acesso em: 15 nov. 2012.
INSTITUTO DE DESENVOLVIMENTO SUSTENTÁVEL E MEIO AMBIENTE DO RIO GRANDE DO NORTE. Perfil do seu Município: João Câmara. Disponível em: <http://200.149.240.140:8080/i3geo/aplicmap/geral.htm?dfcbf6f30402f5a5d568ab8edae8e35 8>. Acesso em: 25 maio. 2013.
KOTTEK, M. et al. World Map of the Köppen-Geiger climate classification updated. Meteorologische Zeitschrift, [S.l.], v. 15, n. 3, p. 259-263, 2006.
KUKALOVÁ-PECK, J. New Carboniferous Diplura, Monura, and Thysanura, the hexapod ground plan, and the role of thoracic side lobes in the origin of wings (Insecta). Canadian Journal of Zoology, [S.l.], v. 65, p. 2327-2345, 1987.
LARSEN, J. et al. Population performance of collembolans feeding on soil fungi from different ecological niches. Soil Biology and Biochemistry, [S.l.], v. 40, n. 2, p. 360-369, 2008.
LEAL, I. R.; TABARELLI, M.; SILVA, J. M. C. (Ed.) Ecologia e conservação da Caatinga. Recife: Universitária da UFPE, 2003.
LEWINSOHN, T. M.; FREITAS, A. V. L.; PRADO, P. I. Conservation of Terrestrial Invertebrates and Their Habitats in Brazil. Conservation Biology, [S.l.], v. 19, n. 3, p. 640-645, 2005.