UNIVERSIDADE ESTADUAL PAULISTA
FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS
CAMPUS DE JABOTICABAL
ASPECTOS DA INFECÇÃO TOXOPLÁSMICA NO
SISTEMA REPRODUTOR DE OVINOS (Ovis aries)
MACHOS EXPERIMENTALMENTE INFECTADOS
Welber Daniel Zanetti Lopes
Médico Veterinário
UNIVERSIDADE ESTADUAL PAULISTA
FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS
CAMPUS DE JABOTICABAL
ASPECTOS DA INFECÇÃO TOXOPLÁSMICA NO
SISTEMA REPRODUTOR DE OVINOS (Ovis aries)
MACHOS EXPERIMENTALMENTE INFECTADOS
Welber Daniel Zanetti Lopes
Prof. Dr. Alvimar José da Costa
Orientador
JABOTICABAL – SÃO PAULO - BRASIL
Janeiro de 2007
Dissertação apresentada à Facul-
dade de Ciências Agrárias e
Veterinárias - UNESP, Campus de
Jaboticabal,
como
parte
das
Trabalho
realizado
no
“Centro
de
Pesquisas
em
Sanidade
Animal-
CPPAR/FCAV/UNESP, no departamento
de Medicina Veterinária Preventiva da
FCAV-UNESP, no Instituto Adolfo Lutz e no
Laboratório de prozoologia molecular da
SUMÁRIO
Página
LISTA DE TABELAS... iv
LISTA DE FIGURAS... vii
RESUMO... 01
SUMMARY... 02
1. INTRODUÇÃO E REVISÃO BIBLIOGRÁFICA... 03
1.1. Aspectos Gerais... 03
1.2 Toxoplasmose em ovinos... 07
2. OBJETIVOS... 15
3. MATERIAL E MÉTODOS... 16
3.1. Cepas de Toxoplasma gondii... 16
3.2 Obtenção de cistos cerebrais contendo bradizoítos de T. gondii... 16
3.3. Obtenção de oocistos de Toxoplasma gondii... 17
3.4. Obtenção de taquizoítos de Toxoplasma gondii... 19
3.5 Confecção de lâminas com antígeno para IFI... 19
3.6. Seleção e adaptação dos ovinos reprodutores para o experimento... 20
3.7 Condicionamento dos reprodutores ovinos à colheita de sêmen... 21
3.8 Inoculação dos ovinos reprodutores machos... 21
3.9. Exames clínicos... 23
3.10. Determinação de parasitemia... 23
3.12. Exames no sistema reprodutor dos ovinos infectados experimentalmente ... 25
3.12.1. Colheita do sêmen... 25
3.12.2. Parâmetros espermáticos... 25
3.12.2.1 Motilidade e vigor... 25
3.12.2.2 Concentração e volume... 25
3.12.2.3 Morfologia espermática... 26
3.13. Bioensaio em camundongos... 26
3.14 Pesquisa de DNA de T. gondii pela PCR... 26
3.14.1. Extração do DNA das amostras do controle positivo e das amostras de sêmen... 27
3.14.2. Reação em cadeia da polimerase (PCR)... 28
3.14.3. Eletroforese em gel de agarose para análise dos produtos amplificados na PCR... 29
3.15. Pesquisa do Toxoplasma gondii no testículo, vesícula seminal, próstata e epidídimo dos ovinos reprodutores... 29
3.15.1. Exames anátomo-histopatológicos nos órgãos reprodutores dos ovinos... 29
3.15.2. Bioensaio em camundongos... 30
3.15.3. Imunoistoquímica em órgãos do sistema reprodutor dos ovinos.. 31
3.15.4 Pesquisa do DNA de T. gondii em tecidos pela PCR... 33
4. ANÁLISE ESTATÍSTICAS... 34
5. RESULTADOS... 35
5.1. Obtenção de taquizoítos de T. gondii... 35
5.3. Obtenção de oocistos de T.gondii... 35
5.4. Seleção dos ovinos reprodutores... 36
5.5. Exames clínicos... 37
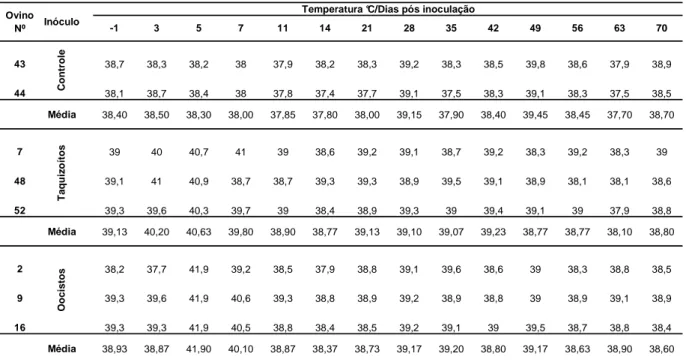
5.5.1 Temperatura corporal... 37
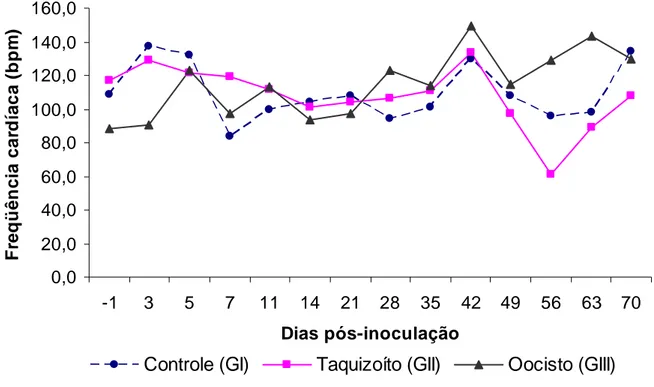
5.5.2 Freqüência cardíaca... 39
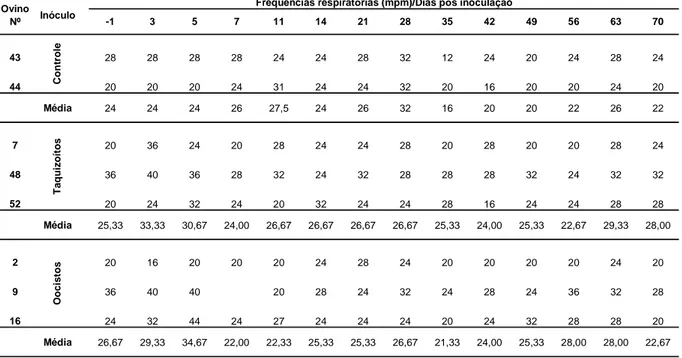
5.5.3 Freqüência respiratória... 41
5.5.4 Outros sinais clínicos... 43
5.6 Exames nos sistema reprodutor dos ovinos infectados experimentalmente... 45
5.6.1 Parâmetros espermáticos... 45
5.7. Determinação de Parasitemia... 53
5.8. Resposta Imune Humoral..(RIFI)... 55
5.9. Pesquisa do Toxoplasma gondii no sêmen dos ovinos (Bioprova)... 58
5.10. Pesquisa do Toxoplasma gondii no sêmen dos ovinos pela PCR... 61
5.11. Exames anátomo-histopatológicos (necropsias)... 62
5.12 Exames histopatológicos... 62
5.13. Pesquisa do Toxoplasma gondii em tecidos dos reprodutores ovinos... 62
5.13.1. Bioprova... 62
5.13.2. Imunoistoquímica... 62
5.13.3 Reação em Cadeia da Polimerase (PCR)... 65
6. DISCUSSÃO... 66
7. CONCLUSÕES... 73
LISTA DE TABELAS
Página
Tabela 1. Infecção toxoplásmica em ovinos pertencentes a diversas
regiões Mundiais... 09
Tabela 2. Delineamento experimental dos oito ovinos reprodutores
submetidos à infecção toxoplásmica experimental... 22
Tabela 3. Protocolo de Reação em Cadeia da Polimerase (PCR)... 29
Tabela 4. Resultados sorológicos para Toxoplasmose, Neosporose,
Brucelose e Leptospirose dos ovinos examinados para seleção dos
Tabela 5. Temperatura retal média mensurada dos ovinos
experimentais até 70 dias pós-inoculação com Toxoplasma
gondii... 38
Tabela 6. Freqüência cardíaca média mensurada nos ovinos
experimentais até 70 dias pós-inoculação com Toxoplasma
gondii... 40
Tabela 7. Freqüência respiratória média mensurada nos ovinos
experimentais até 70 dias pós-inoculação com Toxoplasma
gondii... 42
Tabela 8. Parâmetros seminais de ovinos inoculados com oocistos de
Toxoplasma gondii... 46
Tabela 9. Parâmetros seminais de ovinos inoculados com taquizoítos
de Toxoplasma gondii... 47
Tabela 10. Parâmetros seminais de ovinos pertencentes ao grupo
Controle... 48
Tabela 11. Comparações múltiplas e resultados da análise de
variância dos parâmetros seminais de ovinos nos não inoculados
(controle) e inoculados com 2,0 x 105 oocistos ou com 1,0 x 106
taquizoítos de Toxoplasma gondii... 49
Tabela 12. Surtos parasitêmicos detectados em ovinos não infectados
(controle) e inoculados com Toxoplasma
Tabela 13. Recíproca dos títulos obtidos pela Reação de
Inumofluorescência Indireta (IFI) em ovinos não inoculados (controle) e
inoculados com 2,5 x 105 ou com 1,0 x 106
taquizoítos... 56
Tabela 14. Comparações múltiplas e resultados da análise de
variância do título sorológico de ovinos nos não inoculados (controle) e
inoculados com 2,0 x 105 oocistos ou com 1,0 x 106 taquizoítos de
Toxoplasma gondii... 57
Tabela 15. Pesquisa de T. gondii em camundongos inoculados com
amostras seminais oriundas dos reprodutores ovinos não inoculados
(controle) e inoculados com oocistos ou
taquizoítos... 60
Tabela 16. Parasitismo tissular detectado pela técnica de
imunoistoquímica em testículos, epidídimos vesícula seminal e
próstata de ovinos inoculados com 2 x 10 5 oocistos ou 1 x 10 6
LISTA DE FIGURAS
Página
Figura 1. Temperaturas retais médias mensuradas nos ovinos não
inoculados (controle) e inoculados com 1 x 106 taquizoítos ou com 2,0 x
105 oocistos de Toxoplasma gondii... 39
Figura 2. Freqüências cardíacas médias mensuradas nos ovinos não
inoculados (controle) e inoculados com 1 x 106 taquizoítos ou com 2,0 x
105 oocistos de Toxoplasma gondii... 41
Figura 3. Freqüências respiratórias médias mensuradas nos ovinos não
inoculados (controle) e inoculados com 1 x 106 taquizoítos ou com 2,0 x
Figura 4. Apatia dos animais inoculados com oocistos de Toxoplasma
gondii no 5º DPI... 44
Figura 5. Apatia dos animais inoculados com oocistos de Toxoplasma
gondii no 7º DPI... 44
Figura 6. Volume espermático médio (mL) em ovinos não inoculados
(controle) e inoculados com 1 x 106 taquizoítos ou com 2 x 105
oocistos de Toxoplasma gondii... 50
Figura 7. Motilidade espermática média (%) em ovinos não inoculados
(controle) e inoculados com 1 x 106 taquizoítos ou com 2 x 105 oocistos
de Toxoplasma gondii... 50
Figura 8. Vigor espermático médio (0 a 5) em ovinos não inoculados
(controle) e inoculados com 1 x 106 taquizoítos ou com 2 x 105 oocistos
de Toxoplasma gondii... 51
Figura 9. Concentração espermáticas médias (x 108) em ovinos não
inoculados (controle) e inoculados com 1 x 106 taquizoítos ou com 2 x
105 oocistos de Toxoplasma gondii... 51
Figura 10. Patologias espermáticas médias de cabeça (%) em ovinos não
inoculados (controle) e inoculados com 1 x 106 taquizoítos ou com 2 x
105 oocistos de Toxoplasma gondii... 52
Figura 11. Patologias espermáticas médias de cauda (%) em ovinos não
inoculados (controle) e inoculados com 1 x 106 taquizoítos ou com 2 x
Figura 12. Taquizoítos fluorescentes de Toxoplasma gondii (IFI). Soro de
camundongo inoculado com amostra seminal de ovino infectado com
taquizoítos. Obj. 20x... 58
Figura 13. Cisto de Toxoplasma gondii em cérebro de camundongo
inoculado com sêmen de ovino infectado com oocistos. Obj. 40x... 59
Figura 14. Eletroforese em gel de agarose 2% de produto da reação em
cadeia da polimerase (PCR), a partir de amostras seminais dos ovinos
experimentalmente infectados... 61
Figura 15. Próstata demonstrando imunomarcação ao Toxoplasma gondii.
Ovino inoculado com oocistos de Toxoplasma gondii. Obj.
40x... 64
Figura 16. Vesícula seminal demonstrando agrupamento de taquizoítos
com imunomarcação ao Toxoplasma gondii. Ovino inoculado com
taquizoítos de Toxoplasma gondii. Obj. 40x... 64
Figura 17. Eletroforese em gel de agarose 2% de produto da reação em
cadeia da polimerase (PCR), a partir do “pool” das amostras de tecidos
(testículos, vesícula seminal, próstata e epidídimos) dos ovinos
ASPECTOS DA INFECÇÃO TOXOPLÁSMICA NO SISTEMA
REPRODUTOR DE OVINOS (Ovis aries) MACHOS
EXPERIMENTALMENTE INFECTADOS
RESUMO
Oito reprodutores ovinos, isentos de Toxoplasma gondii e quaisquer outras doenças
reprodutivas, foram distribuídos em três grupos para infecção com o respectivo
protozoário: GI - três ovinos (2,0 x 105 oocistos da cepa P), GII - três ovinos (1,0 x 106
taquizoítos da cepa RH) e GIII - dois ovinos (controle). Parâmetros clínicos foram
mensurados. Avaliações parasitêmicas e sorológicas (IFI) foram efetuadas. Qualidade
espermática foi avaliada e a presença do parasito no sêmen foi investigada por meio
das técnicas da bioprova e da PCR. Parasitismo tissular foi pesquisado pela bioprova,
PCR e imunohistoquímica. Foi possível registrar alterações hipertermia e apatia nos
ovinos infectados com oocistos de Toxoplasma gondii Parasitemia foi detectada em
cinco ovinos. Todos os ovinos inoculados responderam ao estímulo antigênico,
produzindo anticorpos contra T. gondii a partir do 5º dia pós-inoculação. Nos animais
dos grupos I e II, os títulos observados foram de 1:4096 e 1:8192, respectivamente. Nos
mesmos grupos, foram ainda, pela bioprova e PCR, constatada a presença do parasito
no sêmen. Pela PCR detectou-se o DNA de T. gondii no sêmen dos animais 02 e 09 (do
GI oocistos) e 07, 48 e 52 (do GII taquizoítos). Parasitismo tissular por T. gondii
(bioprova e PCR) foi diagnosticada nos ovinos 09, 16 (oocistos) e 07 (taquizoítos).
Vesícula seminal e próstata foram os tecidos de eleição da infecção por T. gondii
(imunohistoquímica) no sistema reprodutor dos ovinos experimentalmente infectados.
Em síntese, estes resultados sugerem a viabilidade da transmissão venérea deste
coccídio.
ASPECTS OF THE TOXOPLASMIC INFECTION ON
REPRODUCTIVE SYSTEM OF SHEEP (Ovis aries)
EXPERIMENTALLY INFECTED
SUMMARY
Eight sheep reproducers exempt of Toxoplasma gondii and any other reproductive
illnesses, were distributed in three groups for infection with the respective protozoan: GI
- three sheep (2.0 x 105 oocysts from P lineage), GII - three sheep (1.0 x 106 taquizoites
from RH lineage) and GIII - two sheep (control). Clinical parameters were measured.
Parasitemics and sorologicals evaluations (IFA) were effected. Spermetic quality was
evaluated and the presence of the parasite in the semen was searched through
techniques of bioassay and PCR. Tissue parasitism was researched through bioassay,
PCR and immuneistochemistry. It was possible to registered hyperthermia and apathy
alterations in sheep infected with oocysts from Toxoplasma gondii. Parasitemia was
detected in five sheep. All inoculated sheep responded to antigenic stimulation,
producing antibodies against T. gondii upon the 5th day post-inoculation. In animals from
groups I and II, the titles observed were 1:4096 and 1:8192, respectively. The animals of
group III (control), did not present antibodies against T. gondii during all experimental
period. In the same groups, it still has been evidenced, through bioassay and PCR, the
presence of the parasite in the semen. Through PCR, T. gondii DNA was detected in the
semen of animals 02, 09 of GI (oocysts) and 07, 48 and 52 of GII (taquizoites). Tissue
parasitism by T. gondii (biotest and PCR) was diagnosed in sheep 09, 16 (oocysts) and
07 (taquizoites). Seminal vesicle and prostate were the tissues elected for infection with
T. gondii (immuneistochemistry) in the experimentally infected sheep reproductive
system. In summery, these results suggests the viability of the venereal transmission for
this coccidium.
1. INTRODUÇÃO E REVISÃO BIBLIOGRÁFICA
1.1 Aspectos Gerais
Uma das tarefas básicas da pesquisa agropecuária consiste em divulgar, reunir e
conferir informações científicas que possibilitem prevenir problemas, visando resguardar
a integridade física e sanitária do rebanho.
Em relação à criação de ovinos, tendo em vista a importância econômica que
representa no contexto pecuário, a prioridade é de aumentar a segurança dos
investimentos realizados, principalmente em regiões de expressiva produtividade.
Portanto, conhecer doenças que possam vir a ser um problema em futuro próximo, é a
importância de se manter pesquisas na área animal.
O estudo do Filo Apicomplexa, o qual compreende parasitas intracelulares
obrigatórios, que são altamente adaptados e conseguem invadir e se desenvolver
dentro das células hospedeiras, torna-se de suma importância. Este grupo possui ciclos
de vida complexo, em que cada forma evolutiva interage com células específicas de um
único hospedeiro (QUEIROZ, 1998).
Um dos membros deste filo, a família Sarcocystidae, possui mais de 200
espécies reconhecidas de coccídios heteroxenos formadores de cistos tissulares nos
hospedeiros intermediários, sendo subdividida em duas sub-famílias: Sarcocystinae e
Toxoplasmatinae (RESENDES et al., 2002). Pertence ao reino protista, filo
Apicomplexa, classe Sporoazida, ordem Eucoccidiorida, família Sarcocystidae,
subfamília Toxoplasmatinae, gênero Toxoplasma, tipo-espécie Toxoplasma gondii.
A sub-família Toxoplasmatinae compreende quatro gêneros diferentes, dentro
dos quais pelo menos duas espécies, Toxoplasma gondii e Neospora caninum, são de
importância em saúde pública e veterinária, podendo causar abortamentos, natimortos
ou doença congênita nos hospedeiros.
T. gondii foi descrito pela primeira vez em coelhos por SPLENDORE (1908), em
roedor, o Ctenodactylus gondii, no entanto teve seus nomes genérico e específico
determinados por NICOLLE & MANCEAUX (1909).
No seu ciclo evolutivo, T. gondii se apresenta sob três formas principais: 1)
taquizoítos, de rápida multiplicação e que ocorrem na infecção aguda; 2) bradizoítos,
localizados em cistos teciduais e presentes na infecção crônica e 3) oocistos, produto
final da reprodução sexuada e que ocorre somente no trato digestivo dos felídeos, seus
hospedeiros definitivos (MILLER et al., 1972). Os oocistos são eliminados para o meio
juntamente com as fezes dos felídeos onde, após esporulação, tornam-se infectantes.
Após a ingestão, a parede do cisto ou do oocisto se rompe por ação enzimática,
liberando as formas infectantes (bradizoítos e esporozoítos, respectivamente) no trato
digestivo do hospedeiro. Penetram então nas células epiteliais do intestino parasitado
onde, após multiplicação, transformam-se em taquizoítos. A disseminação ocorre pelo
rompimento das células infectadas seguido da invasão das células vizinhas,
distribuindo-se praticamente por todo organismo via circulação sanguínea ou se
difundindo de uma célula a outra, podendo, ainda, ser disseminado por macrófagos,
linfócitos ou granulócitos, além de circular na corrente sanguínea na sua forma livre.
Os taquizoítos são encontrados somente em células nucleadas, com maior
afinidade pelos sistemas muscular e nervoso, onde se multiplicam com rapidez até
destruí-las.
Com o avanço da infecção, o hospedeiro começa a desenvolver uma resposta
imune que atua sobre a multiplicação dos taquizoítos, os quais passam a se dividir mais
lentamente, sendo então denominados bradizoítos e que se encontram confinados num
cisto no interior da célula parasitada, protegidos contra a ação do sistema imune e de
drogas. É a infecção latente ou crônica, que pode se perpetuar por vários anos
(HUTCHISON et al., 1968, 1970, 1971; WITE, PIEKARSKI, 1970; FRENKEL, 1970;
FRENKEL, 1973 e SWANGO et al., 1989).
Além deste ciclo, no hospedeiro definitivo, em especial o gato doméstico, ocorre
o ciclo entero-epitelial com esquizogonia e gametogonia, culminando com a fecundação
e produção do oocisto (FRENKEL, 1970 e WONG & REMINGTON, 1993). Os felídeos
ingestão de cistos com bradizoítos, por meio do carnivorismo, a via mais freqüente
(SWANGO et al., 1989; DUBEY et al., 1996 e DUBEY, 2002).
Normalmente T. gondii parasita seus hospedeiros sem a manifestação de sinais
clínicos, porém pode ser capaz de desencadear doença severa, ocorrendo graves
alterações comportamentais, como déficit de atenção e esquizofrenia (LAFFERTY,
2005) reduzindo a qualidade de vida dos indivíduos (McALLISTER, 2005). Deve-se
atentar para os fatores de risco de aquisição da infecção pré natal bem como considerar
sua patogenia e seqüelas (DUBEY, 1993; KRAVETZ, FEDERMAN, 2005;
BACHMEYER et al., 2006 e HUNG et al., 2007).
O risco de aquisição desta enfermidade na vida pós-natal, também foi
demonstrado por vários autores (DUBEY et al. 1998; GIRALDI et al. 2001 e SILVA et al.
2001).
Em humanos, a infecção é muito comum, porém a enfermidade clínica é pouco
freqüente. Estima-se que um terço, ou mais, da população possua anticorpos contra o
parasito. Somente nos EUA é provável que ocorram 1.437.500 novos casos de infecção
por T. gondii, com um custo aproximado de U$ 445 milhões por ano (TODD, 1989). No
mesmo país, segundo SAAD et al. (1996), aproximadamente 300 pessoas morrem
anualmente devido à toxoplasmose, tanto na sua forma congênita (neonatos) quanto
em indivíduos com severa imunossupressão iatrogênica (transplantados, tratamento de
neoplasias, pacientes submetidos à diálise renal) ou que sofram de enfermidades
imunossupressoras como doenças auto-imunes ou a síndrome de imunodeficiência
adquirida – AIDS (SMITH, 1993).
Em pacientes com síndrome de imunodeficiência adquirida, a toxoplasmose
manifesta-se com uma elevada freqüência, sendo considerada uma doença oportunista
(LUTF & REMINGTON, 1988; PASSOS et al., 2000) que provoca a reativação dos
cistos, principalmente os cerebrais, produzindo grave encefalite (HALONEN et al., 2001;
KHETSURIANI et al., 2002; MAMIDI et al., 2002; COLLAZOS, 2003; YADAV et al., 2004
e PRADHAN et al., 2007). POTASMAN et al. (1987) observaram uma freqüência de
encefalite por T. gondii entre seis e 10% de pacientes aidéticos nos EUA. No Brasil, em
mais prevalente, com 11.809 (3,72%) dos 314.582 casos notificados entre 1980 e 1996
(BRASIL, 1996).
Estudos da soroprevalência de Toxoplasma em indivíduos da cidade de
Fortaleza, Ceará, mostraram um rápido aumento na positividade, durante os primeiros
10 anos de vida, sugerindo que a maioria das infecções primárias seja adquirida
durante a infância. Fato este que pode ser associado ao contato domiciliar com gatos e
famílias numerosas, que provavelmente deixam a desejar na higiene e cuidado com as
crianças (REY & RAMALHO, 1999).
As principais vias de transmissão do T. gondii são: infecção transplacentária
(taquizoítos circulantes), sendo mais freqüente no terço final da gestação (FRENKEL,
1973; DUBEY e TOWLE 1986; MAMIDI et al., 2002); ingestão de água, como sugerem
os trabalhos de ARAMINI et al. (1998 e 1999), ou alimentos contaminados com oocistos
esporulados oriundos das fezes do gato e, ainda, ingestão de cistos teciduais em
carnes cruas e/ou mal cozidas (SILVA et al., 2000).
Menos freqüente, porém possível, a infecção pode se dar por meio de acidentes
laboratoriais (WONG & REMINGTON, 1993), transfusão sangüínea
(FIGUEROA-DAMIAN, 1998), transplante de órgãos (MUNIR et al., 2000), e ingestão de leite caprino
não pasteurizado contendo taquizoítos, já descrita em humanos por CHIARI & NEVES
(1984). Em mulheres, embora não se tenha comprovado a transmissão por meio da
amamentação, BONAMETTI et al. (1997a) descrevem um caso positivo de
toxoplasmose em uma criança, cuja dieta era constituída exclusivamente por leite
materno, e a mãe fazia parte de um grupo de 17 indivíduos que havia adquirido
toxoplasmose pela ingestão de carne ovina crua. Um inquérito sorológico na
propriedade de origem dos ovinos revelou 43% dos animais soropositivos para
protozoonose.
Outra via de transmissão recentemente reconhecida é o contato com cães,
devido ao comportamento de alguns deles de ingerir e rolar sobre fezes de gatos, talvez
atraídos pelo cheiro forte. Este comportamento foi denominado xesnomofilia e
possibilitaria a transmissão pelo contato com possíveis oocistos presentes na pelagem
1.2 Toxoplasmose em ovinos
A toxoplasmose ovina é uma doença parasitária de elevada importância
veterinária, zootécnica e de saúde pública, uma vez que acarreta prejuízos aos animais
de produção (WYSS et al., 2000; SMIELEWSKA, et al., 2001, O’ROUKE, 2002), além
de servirem de fonte direta ou indireta de infecção para o ser humano (LINDSAY et al.,
1997; GARCIA et al., 1999; WALSH et al., 1999). Na Europa, mais de 50% da carne de
ovinos e suínos, pesquisada por ACHA & SZYFRES (1986) apresentaram-se
parasitadas pelo T. gondii. A carne suína é considerada a principal fonte de transmissão
para humanos nos Estados Unidos e, provavelmente, em vários outros países
(GAMBLE, 1997). Em frangos de corte estima-se que a prevalência seja baixa, embora
KANETO et al. (1997) tenham isolado cistos viáveis de T. gondii de musculaturas
esquelética e cardíaca de animais infectados experimentalmente, e GARCIA et al.
(2000) encontraram uma soroprevalência de 10,3% em frangos de corte no estado do
Paraná.
Dentre os animais de produção, o ovino é um dos que mais comumente
apresenta-se infectado, juntamente com os suínos, caprinos e coelhos (DUBEY &
THULLIEZ, 1993).
A alta prevalência da toxoplasmose em ovinos pode estar ligada a menor
resistência desta espécie ao parasita e as próprias condições de exploração da
ovinocultura que expõe estes animais a maior probabilidade de contato com os oocistos
eliminados pelos gatos (DUBEY & HAMIR, 2002).
A toxoplasmose em ovinos foi descrita pela primeira vez por OLAFSON &
MONLUX (1942), nos Estados Unidos. Estes autores assinalaram esta enfermidade em
uma ovelha que clinicamente apresentava sintomatologia nervosa, aumento de
temperatura, rigidez muscular, entre outros. O diagnóstico para esta zoonose foi
estabelecido após necropsia e exame histopatológico do cérebro e medula espinhal do
animal.
Desordens reprodutivas, como abortos e neonatos mortos ou fracos, que
(PEREIRA-BUENO et al., 2004). Estudos conduzidos no Uruguai apontaram a
toxoplasmose como um problema importante nos rebanhos ovinos, promovendo
prejuízos anuais de US$ 1,4 a 4,7 milhões (FREYRE et al., 1999). MUNDAY & MASON
(1979) foram os primeiros a descreverem a toxoplasmose como importante causa de
prejuízos reprodutivos em caprino, e apesar de pouco relatada nesta espécie,
aparentemente, os danos são maiores, acometendo clinicamente tanto animais jovens,
como adultos (DUBEY, 1987). Para pequenos ruminantes, a principal via de infecção é
a ingestão de oocistos esporulados do parasito (DUBEY & BEVERLEY, 1988).
Em conseqüência disto, na Nova Zelândia e em alguns países europeus, tem
sido licenciado o uso de uma vacina (cepa atenuada “S48”) de taquizoítos, com o
objetivo de minimizar as perdas econômicas nestes sistemas de produção (MONTOYA
& LIESENFELD, 2004).
Um surto de Toxoplasmose humana foi relatado na cidade de Bandeirantes,
Estado do Paraná por BONAMETTI et al., (1997b). Os autores apresentaram 17 casos
(dentre estes, uma paciente que estava no 5º mês de gestação) com sintomatologia
aguda da doença, adquirida pela ingestão de carne crua de carneiro, servida em uma
festa. Todos apresentaram títulos séricos de anticorpos específicos (IgM) que
evidenciaram fase aguda da toxoplasmose, pela reação de Imunofluorescência Indireta
(IFI).
As taxas de infecção apontadas para rebanhos ovinos são variáveis (Tabela 1).
Esta flutuação na ocorrência deve-se principalmente ao tipo de teste sorológico
Tabela 1: Infecção toxoplásmica em ovinos pertencentes a diversas regiões Mundiais.
Autor(es) Ano País Reação
Sorológica
Nº de
ovinos
examinados
% de
positivos
FELDMAN & MILLER 1956 Estados Unidos SF 9 100
ANGELOFF et al., 1957 Bulgária SF 138 3
ROEVER-BONNET 1957 Holanda SF 128 63
RAWAL 1959 Inglaterra SF 200 36
EYLES et al., 1959 Estados Unidos SF 29 100
COOK 1959 Austrália SF 485 6
ANGELOV et al., 1960 Bulgária FC 526 24
GUILO & DESMONTS 1960 França SF 165 72
SATO 1960 Japão SF 52 44
BERVELEY &
WASTON 1961 Inglaterra SF 200 36
JACOBS 1961 Nova Zelândia SF 18 83
MOYLE & HARTLEY 1961 Nova Zelândia SF 696 45
BERVELEY & MACKAY 1962 Inglaterra SF 77 31
BERVELY & WASTON 1962 Inglaterra SF 246 25
JACOBS et al., 1963 Nova Zelândia SF 29 100
McCULLOCH et al., 1964 Estados Unidos SF 27 81
IFI 315 55
BOCH et al., 1965 Alemanha
ELISA 315 90
ZASTERA et al., 1965 Czechoslovakia SF 127 73
BERENGO et al., 1965 Itália SF 77 43
BERGER 1966 Alemanha SF 146 99
ELIAS 1966 Romênia SF 635 53
WORK 1967 Dinamarka SF 70 61
SINGH et al., 1967 Singapura HAI 24 25
continuação
JANITSCHKE et al., 1968 Alemanha SF 49 87
HARTLEY & MOYLE 1968 Austrália SF 230 88
CATAR et al., 1969 Czechoslovakia FC 429 27
ROEVER-BONNET 1969 Argentina SF 37 62
GILL & PRAKASCH 1970 Índia HAI 488 9
FRENCH et al., 1970 Kwait SF 70 70
WEILAND &
DALCHOW 1970 Turquia SF 250 38
MUNDAY &
CORBOULD 1971 Austrália IFI 1022 14
TATEYMA et al., 1971 Japão HAI 11 27
GARIN et al., 1971 Senegal IFI 83 46
WASTON &
BERVELEY 1971 Inglaterra SF 270 92
DONEV 1972 Bulgária FC 968 31
MARONPOT et al., 1972 Egito IFI 389 12
MUNDAY 1972 Austrália IFI 493 9
BERENGO et al., 1972 Itália SF 88 99
IANNUZZI & RENIERI 1973 Itália HAI 371 48
PLANT et al., 1974 Austrália SF 48 84
CAMPANA et al., 1974 França IFI 583 72
VANDERWAGEN et al., 1974 Estados Unidos HAI 68 28
FRANTI et al., 1975 Estados Unidos IFI 405 13
IFI 144 (M) 62
MUNDAY 1975 Tasmânia
IFI 160 (F) 17
KOZOJED et al., 1976 Afeganistão HAI 117 21
continuação
CHHABRA &
MAHAHAN 1976 Índia HAI 189 19
ARNAUDOV 1977 Estados Unidos HAI 1579 38
HASGAWA et al., 1977 Japão SF 17 18
MAITANI 1977 Japão SF 34 44
SHARMA & GAUTAM 1977 Índia HAI 122 7
WYNNE & MARTIN 1977 Argentina HAI 105 54
PECHERE et al., 1977 Canadá HAI 26 23
ARNAUDOV et al., 1977 Czechoslovakia IFI 493 33
RIFAAT et al., 1977 Egito SF 52 27
2164 (M) 24
RIEMANN et al., 1977 Estados Unidos HAI
699 (F) 4
MICHAEL 1977 Egito SF 100 51
AMARAL et al., 1978 Brasil HAI 100 23
HAGIQARA et al., 1978 Japão SF 26 65
APARICIO et al., 1978 Espanha IFI 84 50
PERRY 1978 Colômbia HAI 1655 58
TIZARD et al., 1978 Canadá SF 273 65
RIFAAT et al., 1978 Egito SF 54 18
CHABASSE et al., 1978 França IFI 60 15
AMARAL et al., 1978 Brasil (Bahia e
RS) SF 100 23
PERRY et al., 1979 Colômbia IFI 1655 58
RIFAAT et al., 1979 Egito SF 76 47
FAHMY et al., 1979 Egito SF 169 68
Larsson et al., 1980 Brasil
(Uruguaiana/RS) SF 100 39
continuação
Larsson et al., 1980 Brasil
(Uruguaiana/RS) SF 100 39
SHARMA 1980 Romênia IFI 502 37
PLANT et al., 1980 Austrália IFI 5724 42
PROSECK & HEIJECK 1980 Czechoslovakia SF 89 11
IFI 1092 (M) 29
RUTHERFORT 1980 Nova Zelândia
IFI 50 (F) 0
RAMISSE et al., 1981 França HAI 263 22
OKHO et al., 1981 Nigéria HAI 479 27
SILVA & COSTA 1981 Brasil
(Guaíba/RS) IFI 310 12
AGANGA et al., 1983 Nigéria IFI 200 9
GHORBANIi et al., 1983 Irã AL 203 32
UGGLA & HJORT 1984 Suécia IFI 155 62
SRIVASTAVA et al., 1984 Índia HAI 202 34
DUBEY & KIRKBRIDE 1984 Estados Unidos SF 15 100
RHYAN & DUBEY 1984 Estados Unidos SF 12 91
NISHIKAWA et al., 1984 Brasil (Rio
Grande do Sul) AL 655 8
DUBEY et al., 1985 Estados Unidos SF 78 41
DUBEY 1985 Estados Unidos SF 649 13
ALI ABBAS et al., 1986 Índia HAI 177 26
FESHASKI - HASHENI 1996 Iran IFI 3311 24,5
GONDIN et al., 1999 Brasil (Bahia) IFI 240 18,75
IFI 352 55
LANGONI et al., 1999 Brasil (Estado
de São Paulo)
HAI 352 30
continuação
MEIRELLES 2003 Brasil (São
Manuel/SP) ELISA 200 31
SILVA et al., 2003 Brasil
(Pernambuco) IFI 173 35,3
FIGIOULO et al., 2004 Brasil (Estado
de São Paulo) IFI 597 34
SAWADOGO et al., 2005 Moroccos ELISA 261 27,6
KLUN et al., 2006 Sérvia
Montenegro IFI 511 84,5
DUMETRE et al., 2006 França AD 257 44
LOPES et al., 2006 Brasil
(Jaboticabal/SP) IFI 134 56
SHARIF et al., 2006 Iran IFI 588 35
Convenções: SF: Reação de Sabin & Feldman; HAI: Reação de Hemoaglutinação Indireta; AL: Aglutinação em Látex; FC: Fixação de Complemento; IFI: Reação de Imunofluorêscencia Indireta; AD: aglutinação direta; ELISA: Ensaio Imunoenzimático.
SPOSITO-FILHA et al. (1992), isolaram 20 cepas de Toxoplasma a partir do
diafragma de 136 ovinos. DA SILVA & LANGONI (2001) identificaram o T. gondii do
cérebro e diafragma de 34 dos 40 ovinos sorologicamente reagentes à
imunofluorescência indireta. Estes trabalhos de isolamento de parasitos viáveis em
tecidos comestíveis, bem como no leite caprino (CHIARI & NEVES, 1984) revelam a
importância destas espécies como fonte de infecção para o homem. O isolamento do T.
gondii no sêmen de animais domésticos, foi comprovado em caprinos (DUBEY &
SHARMA, 1980), bovinos (SCARPELLI, 2001), suínos (MOURA, 2004) e caninos
(ARANTES, 2005).
Apenas três trabalhos na literatura (SPENCE et al., 1978; TEALE et al., 1982;
AGANGA et al., 1988) relatam o isolamento de T. gondii em sêmen de ovinos.
Diferentemente destes autores, no presente trabalho foram utilizadas duas
resultados relativos ao sistema reprodutor de ovinos (parâmetros espermáticos,
histopatologia, bioensaio, imunohistoquímica e PCR) são inéditos na literatura
2. OBJETIVOS
2.1 - Avaliar a infecção experimental, em ovinos machos, em idade reprodutiva,
inoculados com oocistos e taquizoítos de T. gondii;
2.2 - Compilar dados clínicos e laboratoriais para melhor conhecimento da infecção
toxoplásmica em reprodutores ovinos;
2.3 - Avaliar a resposta imune humoral dos animais infectados por meio da Reação de
Imunofluorescência Indireta (IFI);
2.4 - Pesquisar pelas técnicas da bioprova e da PCR, a eventual presença de T. gondii
em amostras de sêmen colhidas dos ovinos infectados experimentalmente.
2.5 - Investigar a presença de T. gondii em testículos, próstata, vesícula seminal e
epidídimo dos ovinos infectados experimentalmente por meio do bioensaio (inoculação
em camundongos), da Imunoistoquímica e da PCR.
2.6 - Dos resultados obtidos, devidamente analisados, extrair inferências sobre a
3. MATERIAL E MÉTODOS
3.1 – Cepas de Toxoplasma gondii
Foram utilizadas as cepas “P” (JAMARA & VIEIRA, 1991) e ”RH” (SABIN, 1941),
mantidas no “CPPAR - Centro de Pesquisas em Sanidade Animal” da Faculdade de
Ciências Agrárias e Veterinárias, UNESP - Campus de Jaboticabal. A cepa “P” produz
infecções letais nos camundongos experimentalmente infectados. Os sobreviventes à
infecção normalmente apresentam razoável quantidade de cistos teciduais em cérebro.
Os oocistos desta cepa apresentam-se infectantes para camundongos (VIDOTTO et al.,
1986b) mesmo depois de mantidos durante cinco anos em temperatura de refrigeração
(4oC a 8oC).
3.2 Obtenção de cistos cerebrais contendo bradizoítos de T. gondii
Camundongos albinos suíços, fêmeas, com idade média de 35 dias foram
inoculados intraperitonealmente com aproximadamente 10 cistos (cepa “P”) cada, e
observados diariamente até o 42o dia pós-inoculação, quando, então, eram
eutanasiádos. Os camundongos inoculados foram medicados com sulfadiazina (500
mg) misturada à ração (100g) na dose de 3,5g/animal/dia de ração do segundo ao 11o
dia pós-inoculação de T. gondii. A maioria dos camundongos sobreviventes à infecção
apresentavam cistos cerebrais.
Para pesquisa de cistos de T. gondii os camundongos foram eutanasiádos e
posicionados em decúbito esternal. Com o auxílio de pinça e tesoura, cada cérebro foi
removido e transferido para um graal estéril e macerado com cerca de 1,0 ml de
solução fisiológica estéril. Uma alíquota de 50 l foi examinada ao microscópio óptico,
com objetiva de 40X, para identificação e quantificação dos cistos de T. gondii
eventualmente presentes. Nos camundongos que morreram antes do 11o dia
assim obtidos, dependendo da concentração e viabilidade, foram também inoculados
em outros camundongos com o objetivo de se obter cistos cerebrais.
3.3 – Obtenção de oocistos de T. gondii
Foram utilizados dois gatos, SRD (sem raça definida), entre dois e três meses de
idade, todos sorologicamente negativos (IFI) para a presença de T. gondii (anticorpos e
oocistos). Cada um deles recebeu aproximadamente 3 mL de um inóculo, contendo
aproximadamente 1500 cistos de T. gondii provenientes de cérebros dos camundongos
cronicamente infectados (cepa “P”). Para a inoculação dos gatos, adotou-se a
metodologia proposta por COSTA et al. (1977), tomando-se o cuidado de realizar a
lavagem da seringa utilizada com solução fisiológica, a fim de remover os cistos que
porventura estivessem aderidos às paredes da mesma. Além do macerado cerebral, os
gatos receberam vísceras (pulmão, coração e fígado) e, ainda, a carcaça dos
camundongos positivos para cistos, com o objetivo de aumentar o inóculo administrado.
Os felinos foram mantidos, isoladamente, em gaiolas metálicas, devidamente
adaptadas para recebê-los. Os animais foram colocados em ambiente fechado, sendo a
água e a ração fornecidas “ad libitum”. A cada 24 horas, os animais foram transferidos
para gaiolas limpas e os comedouros e bebedouros trocados. Os papéis utilizados para
forrar as gaiolas foram acondicionados em sacos de papel e incinerados. As gaiolas e o
recinto (piso e paredes) ocupados pelos gatos infectados foram tratados com água
quente (80ºC).
Exames coproparasitológicos (Método de Sheather), utilizando-se do volume
total de fezes excretadas durante 24 horas pelos gatos, foram realizados, diariamente,
durante 15 dias consecutivos pós-inoculação. As fezes recentemente colhidas foram
misturadas com água até a formação de uma massa pastosa. Uma solução de
sacarose (500g de açúcar dissolvidas em 320mL de água destilada) foi adicionada na
proporção 1:1 para homogeneização do material. Em seguida, este material foi filtrado
para a remoção das partículas maiores e transferido para tubos cônicos de centrífuga
10 minutos), foram aspiradas alíquotas do sobrenadante, com auxílio de uma pipeta
Pasteur, para a pesquisa de oocistos de T. gondii em microscópio óptico (objetiva de
40X). Em cada uma das amostras de oocistos, assim obtidos, foi adicionada soluções
de ácido sulfúrico a 2% para auxiliar na esporulação. Assim, o material colhido
diariamente, foi mantido em temperatura ambiente em frasco, parcialmente fechado e
aerado mecanicamente duas vezes ao dia, durante 10 dias até a completa esporulação
dos oocistos (DUBEY et al., 1972).
Os oocistos esporulados foram lavados em solução fisiológica, por meio de
sucessivas centrifugações, para remoção do ácido sulfúrico 2% e estocados em
temperatura de refrigeração (4oC a 8oC), imersos em solução salina a 0,85%.
A identificação dos oocistos esporulados foi realizada utilizando-se critérios
morfológicos (ZAMAN, 1970), por meio da mensuração dos oocistos (10 a 12
micrômetros) em régua micrométrica ocular calibrada para a objetiva de aumento 40X
do microscópio óptico e por meio de inoculações intraperitoneais em camundongos
(DUBEY et al., 1972). Após a identificação, foi efetuada a quantificação total dos
oocistos em cada uma das datas de emissão das fezes, para cada um dos dois felinos,
por meio de cinco contagens em câmara de Neubauer, de acordo com a técnica
adotada por COSTA et al. (1977).
Para a inoculação nos ovinos, procedeu-se uma mistura de todas as amostras
fecais positivas, nos respectivos dias em que foram colhidas, para cada um dos felinos,
resultando assim em duas soluções (oriundas dos dois felinos). Posteriormente estas
soluções foram novamente examinadas, sendo o tamanho do inóculo definido mediante
3.4
–
Obtenção de taquizoítos de T. gondiiPara a obtenção dos taquizoítos e padronização dos inóculos que posteriormente
foram administrados aos ovinos procedeu-se da seguinte forma: camundongos albinos
suíços fêmeas, com idade de 35 dias, receberam por via subcutânea exsudato
(contendo T. gondii) colhidos de outros camundongos previamente inoculados com
taquizoítos de T. gondii (cepa RH). Freqüentemente, alguns destes camundongos eram
eutanasiádos e posicionados em decúbito dorsal. Após o acesso à cavidade abdominal,
era feito um lavado intraperitoneal com injeção de 1,0 mL de solução fisiológica estéril e
posterior aspiração deste conteúdo.
Com o auxílio de microscopia óptica (objetiva de 40X), a concentração,
viabilidade e morfologia dos taquizoítos foram avaliadas para obtenção dos inóculos. A
padronização desta metodologia permite a obtenção de taquizoítos, em concentrações
variadas, presentes no exsudato intraperitoneal dos camundongos previamente
infectados por T. gondii (COSTA, 1979).
3.5 - Confecção de lâminas com antígeno para IFI
Para a realização da IFI foi utilizado, como antígeno, taquizoítos da cepa RH de
T. gondii, mantidos em solução salina estéril acrescida de heparina (25µl de heparina em 50 mL de solução salina), obtidos de camundongos no segundo dia pós-infecção, e
inativados por formol a 0,5%, em estufa a 37oC por 30 minutos. Após centrifugação (um
minuto a 500 rpm), para sedimentar impurezas, o sobrenadante recolhido foi novamente
centrifugado (10 minutos a 1500 rpm), sendo descartado o novo sobrenadante. O
sedimento foi então ressuspenso em PBS e centrifugado mais uma vez. Após nova
ressuspensão do sedimento, o mesmo foi avaliado (microscopia óptica, objetiva de 40X)
quanto à quantidade de taquizoítos e então diluído em PBS até obter-se uma média de
20 a 30 taquizoítos por campo. Dez microlitros desta suspensão de taquizoítos foram
colocados em “poços” (impressos em lâminas de microscopia pela técnica de “Silk
(“overnight”), cobertas para evitar contaminação por poeira, para secarem. Em seguida,
as mesmas foram envoltas em papel alumínio e estocadas a –20oC até a utilização.
3.6 - Seleção e adaptação dos reprodutores ovinos para o experimento
Oito ovinos machos sorologicamente negativos para toxoplasmose, neosporose,
brucelose e leptospirose, clinicamente saudáveis, em idade reprodutiva, foram
selecionados de um total de 74 animais examinados, oriundos de propriedades rurais
dos municípios paulistas de Viradouro, Pitanguerias, Morro Agudo e Jaboticabal.
Amostras de sangue dos animais foram colhidas por venopunção jugular, em
tubos de vacutainer, sem anticoagulante. O material foi centrifugado a 2000 rpm, por 10
minutos, e os soros obtidos foram estocados a -20ºC, até o processamento. A técnica
sorológica empregada para detecção de anticorpos contra T. gondii foi a IFI - Reação
de Imunofluorescência Indireta (CAMARGO, 1964), utilizando-se de conjugado anti-IgG
específico para ovinos, marcado com isotiocianato de fluoresceína, sendo utilizadas as
diluições de 1:16 e 1:64. Foram consideradas como amostras positivas os soros que
apresentaram títulos iguais ou superiores a 1:16 (MAINARDI et al, 2003).
Empregou-se, também, a IFI para detectar a presença de anticorpos contra
Neospora caninum (CONRAD et al. 1993) sendo os soros dos animais usados nas
diluições de 1:50 e 1:100. Os ovinos com títulos sorológicos a partir de 1:50, foram
considerados positivos (FIGLIUOLO et al., 2004) e, conseqüentemente, descartados do
experimento.
Para pesquisa de anticorpos contra brucelose foi utilizada a Técnica do Antígeno
Acidificado Tamponado, também conhecida como Teste do Rosa Bengala ou “Card
Test” (ALTON et al., 1988). Para este teste, 0,03 mL do soro foi colocado em contato
com 0,03 mL do antígeno em placa de vidro própria. Em seguida, a mistura foi
homogeneizada e a placa mantida em movimentos rotatórios durante quatro minutos,
para observar a ocorrência, ou não, de grumos de aglutinação, indicativos da
impossibilidade de obtenção do antígeno referente a Brucela canis, não mais produzido
pelo MAPA (Ministério da Agricultura, Pecuária e Abastecimento).
Quanto à leptospirose, a técnica empregada foi a Prova de Soroaglutinação
Microscópica. Os soros foram testados contra os sorovares pomona,
icterohaemorrhagiae e canicula. O critério adotado para considerar um soro reagente foi
de 50% de aglutinação no título final de 1:100, ou seja, metade das leptospiras
aglutinadas no campo microscópico, observado no aumento de 100X. Para a realização
da técnica e interpretação do grau de aglutinação foram adotadas as recomendações
do CENTRO PANAMERICANO DE ZOONOSIS (1985).
Após a realização de todos os exames sorológicos, os animais selecionados
foram alocados em boxes individuais descontaminados, pertencentes ao “Setor de
Ovinos e Caprinos” do CPPAR - Centro de Pesquisas em Sanidade Animal da FCAV –
UNESP, Campus de Jaboticabal. Posteriormente, foram desverminados, examinados
clinicamente e submetidos a quarentena (quatro semanas) para detecção de eventuais
alterações clínicas e/ou laboratoriais que pudessem interferir nos resultados
experimentais. Durante o período de adaptação pré-experimental (40 dias) os ovinos
receberam água e ração “ad libitum”.
3.7 – Condicionamento dos reprodutores ovinos à colheita de sêmen
Durante esta fase pré-experimental, os animais foram submetidos à colheita de
sêmen pelo método artificial, com o uso de eletro-ejaculador, a cada sete dias, por um
período de quatro semanas, para obtenção de sêmen e, conseqüentemente, para que
estivessem aptos a doarem sêmen no decorrer do experimento.
3.8 – Inoculação dos ovinos reprodutores machos.
Após o período de adaptação, os animais foram identificados, sorteados e
Tabela 2. Delineamento experimental dos oito ovinos reprodutores submetidos à
infecção experimental por Toxoplasma gondii.
Número do
Ovino
Grupo
Oocistos de
Toxoplasma gondii
Taquizoítos de
Toxoplasma gondii
Via de
inoculação
02 2x 105 -- Oral
09 2x 105 -- Oral
16
I
2x 105 -- Oral
07 -- 1 x 106 Subcutânea
48 -- 1 x 106 Subcutânea
52
II
-- 1 x 106 Subcutânea
43 Placebo Oral
44 III Placebo Oral
Os oocistos foram administrados por meio de seringa acoplada a uma sonda de
metal, para deposição direta no esôfago dos animais. Em seguida a inoculação dos
oocistos, foram administrados mais 100 mL de solução fisiológica estéril em cada
animal, para lavagem das paredes da seringa e/ou sonda, onde eventualmente os
oocistos pudessem estar aderidos.
Os taquizoítos foram administrados via subcutânea (na região da paleta),
utilizando-se seringas e agulhas estéreis conforme descrito por BRESCIANI (2003).
Posteriormente, os últimos dois animais foram inoculados com 100 mL de solução
fisiológica estéril, por via oral, constituindo, assim, o grupo controle.
Todos os animais foram mantidos isolados, em baias individuais, no Setor de
Ovinos e Caprinos – CPPAR, durante todo o período experimental. Exames sorológicos
desordens reprodutivas, (brucelose, neosporose e leptospirose) também foram
realizados em todos os ovinos experimentais, pré e pós-inoculação.
3.9 – Exames clínicos
Os reprodutores foram submetidos a exames clínicos (Freqüência cardíaca,
respiratória e temperatura retal), desde o primeiro dia antes da infecção e a cada três
dias até o 14º dia pós-inoculação (DPI). A partir desta data, tais exames passaram a ser
realizados semanalmente até 70º DPI.
3.10 – Determinação da parasitemia
A avaliação parasitêmica em camundongos, segundo a técnica descrita por
OLIVEIRA (1997). Amostras de sangue (10 mL) dos animais inoculados e controles
foram colhidas em tubo estéril contendo EDTA, nas mesmas datas dos exames clínicos.
Após centrifugação (3000 rpm por 15 minutos), a camada leucocitária foi
cuidadosamente aspirada com auxílio de pipeta Pasteur e inoculada,
intraperitonealmente, em grupos de três camundongos. Esses camundongos foram
observados por 15 minutos após as inoculações para avaliar possíveis efeitos adversos
à inoculação. Em seguida, avaliações diárias foram efetuadas até 42 dias
pós-inoculação para verificação de manifestações da infecção toxoplásmica.
Nos animais que apresentaram aumento de volume abdominal ou que morreram
até o 10o DPI, foi pesquisada a presença de taquizoítos de T. gondii por meio da
microscopia do exsudato peritoneal e “imprint” de pulmão dos mesmos. Nos animais
que morreram a partir do 11o até o 42o DPI, realizou-se a pesquisa de anticorpos
3.11 – Resposta imune humoral
Nos soros de todos os ovinos reprodutores infectados experimentalmente e dos
controles, obtidos um dia anterior à inoculação e nos dias 3, 5, 7, 11, 14 após a infecção
e, semanalmente, até o fim do experimento foram pesquisados anticorpos contra
T.gondii por meio da Reação de Imunofluorescência Indireta (IFI), segundo CAMARGO
(1964).
A colheita de sangue foi feita por meio de punção da veia jugular com agulha 40
x 12 mm. Foram colhidos aproximadamente 10 mL de sangue sem anticoagulante de
cada animal. Este material foi processado para obtenção do soro, sendo centrifugado
por 10 minutos a 3000 rpm. O soro foi retirado com auxilio de pipeta de vidro e
acondicionado em microtubos previamente autoclavados, e mantidos sob congelamento
(-20oC).
Os soros dos ovinos foram diluídos em PBS (1:16 até 1:8192). A diluição de 16
microlitros de cada diluição de cada soro, foram depositados nos poços das lâminas
contendo o antígeno. As lâminas, assim preparadas, foram acondicionadas em câmara
úmida e incubadas a 37oC por 40 minutos. Em seguida, as lâminas foram lavadas três
vezes (em tampão PBS, 10 minutos cada vez) e colocadas para secarem (seis minutos
em estufa a 37oC). Posteriormente, adicionou-se o conjugado gamaglobulina anti-IgG
total de ovino marcado com isotiocianato de fluoresceína, e as lâminas foram
novamente incubadas em câmara úmida (37oC por 40 minutos) em estufa. Nova
lavagem por duas vezes foi procedida com tampão PBS e uma vez com água
bidestilada (10 minutos cada lavagem) para remoção do excesso de sais. Após a
secagem definitiva das lâminas, glicerina tamponada foi adicionada às mesmas,
recobertas com lamínulas e examinadas em microscópio de fluorescência (objetiva de
3.12 – Exames no sistema reprodutor dos ovinos infectados experimentalmente
3.12.1- Colheita do sêmen
A cada sete dias, por um período de quatro semanas, os oito ovinos foram
submetidos ao “condicionamento” para a colheita de sêmen, com o uso de
eletro-ejaculador. Dos oito ovinos experimentais foram obtidos ejaculados um dia antes da
inoculação, prosseguindo, no período de 3, 5, 7, 11, 14 e, semanalmente, até o 70º DPI.
Os ejaculados foram recolhidos em tubos graduados acoplados à funis plásticos
previamente esterilizados. Estes foram mantidos a 37ºC e, no momento da colheita,
acoplados a um recipiente aquecido para evitar o choque térmico, que poderia
ocasionar mortalidade dos espermatozóides e alterações morfológicas.
Imediatamente após o término da ejaculação, o tubo contendo o sêmen foi
colocado em banho-maria (37ºC) para garantir a integridade espermática.
3.12.2 Parâmetros espermáticos
3.12.2.1 Motilidade e Vigor
Para avaliação da motilidade (expressa em % de espermatozóides que se
movimentam em trajetória retilínea e para frente) e do vigor (intensidade com que esta
motilidade é exercida), imediatamente após a colheita, uma alíquota do sêmen
(aproximadamente 10µL) foi colocada sobre lâmina e recoberta por lamínula
(previamente aquecidas a 37ºC) e observada ao microscópio óptico (aumentos de 10 e
40X). Os dados foram expressos em porcentagem (motilidade), numa escala de 0 a 5
(vigor), e anotados em fichas próprias para posterior análise.
3.12.2.2 Concentração e volume
Para análise da concentração espermática foram obtidas alíquotas de 5µl,
contagem em câmara de Neubauer, conforme MAIA (1998). O volume seminal
mensurado por meio da observação direta dos tubos graduados.
3.12.2.3 Morfologia espermática
Para a análise da morfologia espermática foram obtidas alíquotas de 50µl,
diluídas em 1 mL de solução salina formol (0,9%). A morfologia seminal, para evidenciar
possíveis patologias espermáticas, foi realizada de acordo com critérios padronizados
por BLOM (1973), utilizando-se de microscopia de contraste de fase, conforme o
Manual de Exame Andrológico e Avaliação de Sêmen Animal do COLÉGIO
BRASILEIRO DE REPRODUÇÃO ANIMAL (1998).
3.13 – Bioensaio em Camundongos
Para o isolamento de T. gondii das amostras de sêmen (todas as frações)
colhidas, foi utilizada a metodologia proposta por TEALE et al. (1982), modificada.
Foram separadas duas amostras de sêmen (0,5mL cada amostra) de cada animal. Em
0,5 mL da amostra seminal, foi acrescido 0,5mL da solução tampão (PBS), com pH 7,2,
autoclavado e antibiótico (ampicilina, 1 mg/mL). Cinco camundongos foram inoculados,
via intraperitoneal, com 1mL da alíquota espermática diluída. Os camundongos foram
observados e examinados conforme metodologia adotada por OLIVEIRA (1997) e
BRESCIANI (1999).
3.14 – Pesquisa do DNA de T. gondii pela PCR
Alíquotas de 1mL de sêmen (não diluído) de cada animal infectado, foram
devidamente armazenadas para posterior processamento da técnica de PCR (BURG et
al. 1989 e FUENTS et al. 1996).
Escalas de diluição de taquizoítos de T. gondii (cepa RH) foram realizadas,
lavagem intraperitoneal dos camundongos, previamente inoculados, a concentração foi
aferida em câmara de Neubauer e o volume final ajustado para 1,0 x 107 taquizoítos/mL
(de PBS ou sêmen ou tecido). A partir desta diluição inicial, 500µL da mesma foram
diluídos em 9,5 mL de água de MiliQ estéril e assim sucessivamente, obtendo-se as
diluições de 107, 106 , 105,104 , 103 , 102 , 101 e 100 parasitos por mL. O material assim
obtido foi mantido congelado (-20oC) até a extração do DNA.
3.14.1 - Extração do DNA das amostras do controle positivo e das amostras de
sêmen e tecidos
Todas as amostras de sêmen (positivas para a presença de T. gondii em
camundongos inoculados) obtidas ao longo do experimento foram avaliadas quanto à
presença do T. gondii pela técnica de PCR.
O DNA de T. gondii das escalas de diluição (controle positivo) e das amostras de
sêmen para a detecção do DNA de T. gondii foi extraído segundo metodologia
preconizada por SAMBROOK & RUSSELL (2001).
Uma alíquota de 100µL (sêmen e tecido) previamente preparado para a extração
de DNA, foi transferida para um microtubo de 1500 µL. A esta, foram acrescidos 900 µL
de tampão PBS, pH 7,2, previamente autoclavado. Após homogeneização, o material
foi então centrifugado (8000 rpm por 6 min) para lavagem, sendo o sobrenadante
removido por inversão. Ao sedimento, foram acrescentados 100 µL de PBS e 400 µL da
solução de lise (2% β-mercaptoetanol, 10 mM Tris pH 8,0, 10 mM EDTA pH 8,0, 0,5%
SDS e 100 mM de NaCl). Após agitação em vortex, a amostra foi incubada em banho
Maria (37oC) por 30 minutos. Foram então adicionados 5µL de Proteinase K (200µg/mL)
e nova incubação em banho Maria (37oC por 12 a 16 horas). Na seqüência, foram
realizadas duas extrações de DNA com fenol:clorofórmio:álcool isoamílico (25:24:1). Em
seguida, foram acrescentados 10% do volume de uma solução de Acetato de Sódio
para precipitação do DNA. Na seqüência, foi adicionado etanol 100%, gelado (duas
a formação da “medusa” de DNA. Em seguida, o material foi centrifugado (12000-16000
rpm por 20 min), o sobrenadante descartado por inversão e 900µL de etanol 70% foram
acrescidos. O DNA precipitado foi submetido à agitação (vortex) para se desprender o
pellet. Nova centrifugação (12000-16000 rpm por 20 min) e o sobrenadante foi
desprezado por inversão e o tubo contendo o DNA foi deixado a secar de boca para
baixo em papel absorvente. O DNA foi ressuspendido em 50 µL de água miliQ
autoclavada e mantido em temperatura ambiente “overnight” para, em seguida, ser
estocado sob temperatura de congelamento (-20oC) até realização da PCR.
A quantificação do DNA foi realizada por meio de espectrofotometria em
absorbância de 260nm e corrida eletroforética, em gel de agarose 0,8% corado com
brometo de etídio, de 5µL do DNA previamente extraído. Foi utilizado o padrão de peso
molecular λ (50ng/10µL) e, por comparação visual, a quantidade de DNA foi estimada.
3.14.2 – Reação em cadeia da polimerase (PCR)
Para a detecção do DNA de T. gondii nas amostras de sêmen e tecidos
analisadas, foi amplificado um fragmento do gene B1 de T. gondii de 194 pares de
bases (bp) utilizando-se os “primers” 5’–GGAACTGCATCCGTTCATGAG-3’ (B11) e
5’TCTTTAAAGCGTTCGTGGTC –3’ (B12), descritos por BURG et al. (1989) e
FUENTES et al. (1996). A reação de polimerização em Cadeia (Polimerase Chain
Reaction) SAIKI et al. (1988) foi feita pela adição de 500ng de DNA molde em um meio
de reação contendo MgCl2 2mM, KCl 50mM, Tris-HCl 10mM pH 9, Triton X-100 0,01%,
Tabela 3. Protocolo de Reação em Cadeia da Polimerase (PCR):
PASSO
TEMPO TEMPERATURA (ºC)1 2 minutos 95
2 1 minuto 95
3 30 segundos 55
4 1 minuto 72
5 35 vezes (passo 2 a 4) -
6 7 minutos 72
7 - 4
As reações foram realizadas em termociclador modelo Mastercycler gradient®
(Eppendorf).
3.14.3 – Eletroforese em gel de agarose para análise dos produtos amplificados
na PCR
A análise dos produtos amplificados foi feita por eletroforese em gel de agarose
2% preparado em tampão de TAE 1X (Tris-Acetato 40 mM, EDTA 0,1 mM). As
eletroforeses foram realizadas neste mesmo tampão à temperatura ambiente. Géis de
agarose contendo fragmentos de restrição separados por eletroforese foram corados
em solução de Brometo de Etídeo 0,5 µg/mL em água por 20 minutos e observados em
trans-iluminados UV.
3.15 - Pesquisa do Toxoplasma gondii em testículos, epidídimos, vesícula seminal
e próstata dos ovinos reprodutores
3.15.1 – Exames anátomo-histopatológicos nos órgãos reprodutores dos ovinos
Os animais foram necropsiados para realização de exames
tecidos foram colhidas para exames histopatológicos e para isolamento de T. gondii por
meio da técnica da bioprova, Imunoistoquímica e PCR: testículos, epidídimos, vesícula
seminal e próstata. Para exames histopatológicos e imunoistoquímica, o material
colhido foi fixado em formol tamponado a 10%, por um período de 24 horas, sendo
então transferido para uma solução de álcool 70%. Em seguida o material foi
emblocado em parafina histológica e armazenado desta forma até a realização dos
exames.
3.15.2 - Bioensaio em camundongos
O bioensaio de amostras de testículos, epidídimos, vesícula seminal e próstata
colhidas, inclusive do grupo controle, foi realizado de acordo com o protocolo descrito
por DUBEY (1998). Os tecidos foram primeiramente cortados em pequenos pedaços,
sendo removidos o tecido conectivo e a gordura. A vesícula seminal e a próstata foram
utilizadas integralmente, enquanto que o testículo e epidídimo foram utilizados para
completar 100g de tecidos. O “pool” de tecidos foi homogeneizado com cinco volumes
de NaCl 0,15M (salina) sendo usado um homogenizador de uso doméstico.
Ao material homogeneizado adicionou-se o mesmo volume de uma solução de
pepsina ácida, pH 1,1 – 1,2 (pepsina, 2,6g; HCl, 7,0mL; água destilada suficiente para
500mL de solução), recém preparada e aquecida em banho-maria a 37ºC. A mistura foi
incubada em estufa a 37ºC por uma hora sobre agitador magnético.
Após a incubação, a suspensão foi coada por meio de duas camadas de gaze, o
coado transferido para cinco tubos cônicos de 50mL e centrifugado a 1.200 giros por 10
minutos. O sobrenadante foi desprezado e o sedimento de cada tubo foi então
neutralizado pela adição gradual de bicarbonato de sódio a 1,2%, pH 8,3,
recém-preparado (ao redor de 5,0mL por tubo). A neutralização foi percebida visualmente pela
mudança de cor do sedimento. Após homogeneização, o material foi transferido para
um vidro único tubo cônico, completando-se o volume para 50mL com salina, e
e o sedimento homogeneizado com salina (v/v) contendo 2000U de penicilina e 200ug
de estreptomicina por mililitro.
Imediatamente a amostra foi inoculada em grupo de 15 camundongos.
Esses camundongos inoculados (1mL/camundongo) foram observados
diariamente, por seis semanas (COSTA et al., 1977), para a avaliação da presença de
sinais clínicos da toxoplasmose. Naqueles que apresentaram pêlos eriçados e/ou
aumento de volume abdominal durante este período, foi pesquisada a presença de
taquizoítos de T. gondii no exsudato peritoneal e “imprint” de pulmão. Os sobreviventes
foram exsanguinados para pesquisa de anticorpos (IFI - CAMARGO, 1964) e cistos
cerebrais de T. gondii, em amostras de soros e cérebros dos camundongos
respectivamente.
3.15.3 – Imunoistoquímica em órgãos do sistema reprodutor dos ovinos
Fragmentos de testículos, epidídimos, vesícula seminal e próstata dos ovinos
reprodutores (controle e inoculados), colhidos e processados conforme item 3.15.1,
foram analisados pela Imunoistoquímica para pesquisa de possíveis antígenos de T.
gondii. Para tanto, foi utilizado o método imuno-enzimático de amplificação com o
complexo estrepto-avidina com peroxidase-biotina (Kit LSAB/HRP, Dako, USA)
conforme GUESDON et al. (1979).
Os tecidos incluídos em parafina foram submetidos à microtomia para obtenção
de secções histológicas de 3 m de espessura, estendidas em lâminas silanizadas e
incubadas em estufa a 55oC por seis horas para fixação dos cortes. Os cortes
histológicos foram submetidos a desparafinização em xilol, seguida de banhos em
álcoois gradualmente hidratados (álcool absoluto, álcool a 95%, álcool a 80%) e em
água destilada.
Foi empregado anticorpo policlonal contra T. gondii produzido por MINEO (2002
– comunicação pessoal), cuja diluição otimizada para o ensaio imunoistoquímico foi de