B I O L O G I A REPRODUTIVA DO C A M A R Ã OzyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA Macrobrachium brasiliense ( H E L L E R , 1862) ( C R U S T A C E A : D E C A P O D A : P A L A E M O N I D A E ) EM I G A R A P É S DE T E R R A F I R M E DA AMAZÔNIA PERUANA
Carmen Rosa GARCÍA-DÁVILA1
, Fernando ALCANTÁRA Β. 2
, Elvis VASQUEZ R.3
, Miquel CHUJANDAMA S.3
RESUMOzyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA — Foi estudada a biologia reprodutiva dezyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA Macrobrachium brasiliense (Decapoda: Palaemonidae) com base em 2604 indivíduos coletados entre outubro de 1994 e agosto de 1995,
em dois igarapés de terra firme da estrada Iquitos-Nauta, Loreto (Amazônia peruana). A proporção sexual fêmea: macho foi de 1,7:1 sendo que as fêmeas foram um pouco mais abundantes que os machos durante todo o período de coleta. M. brasiliense apresentou dimorfismo sexual no comprimento cefalotorácico, sendo as fêmeas ligeiramente menores que os machos. A reprodução foi contínua, com o pico reprodutivo entre abril e julho. A fecundidade variou de 15 a 168 ovos por fêmea, observando-se uma relação significativa entre a fecundidade e o comprimento cefalotorácico e o peso. O volume do ovo não apresentou relação significativa com o comprimento cefalotorácico e a fecundidade.
Palavras-chaves: Decapoda, água doce, reprodução, Amazônia, Peru.
Reprodutive Biology of the Shrimp Macrobrachium brasiliense (Heller, 1862) (Crustacea: Decapoda: Palaemonidae) in Small Forest Streams of Peruvian Amazon.
A B S T R A C T — T h e r e p r o d u c t i v e biology of Macrobrachium brasiliense ( D e c a p o d a :
Palaemonidae) was studied based on 2,604 specimens collected from October 1994 to August 1995, in two forest streams along the Iquitos-Nauta, highway in Loreto (Peruvian Amazon).The female: male sex ratio was 1.7:1. M. brasiliense showed sexual dimorphism in the cephalotorax
length, females being slighthly smaller than males. Reproduction was contínuos with a reproductive peak between April and June. Fecundity ranged from 15 to 168 eggs per female. A significant relationship was observed between fecundity and cephalotoraxic length and the weight. Egg volume presented no significant relationship with cephalotoraxic length or fecundity.
Key-worlds: Decapoda, freshwater, reproduction, Amazon, Peru.
1
Programa de Pós-graduação em Biologia de Água Doce e Pesca Interior (BADPI) - Instituto Nacional de Pesquisas da Amazônia (INPA), Caixa postal 478, 69011-970 Manaus, AM.
2
Instituto de Investigaciones de la Amazonia Peruana - ΠΑΡ, Αν. Abelardo Quiñones Km 2.5, Aptdo. 784, Iquitos, Loreto - Peru.
3
Universidad Nacional de la Amazonia Peruana - UNAP, calle Pevas 5,a
quadra, Iquitos, Loreto - Peru. INTRODUÇÃO
A maioria dos estudos sobre camarões amazônicos foram dirigidos a Macrobrachium amazonicum (Heller, 1862), uma vez que é a única espécie nativa pescada artesanalmente na Amazônia (Coelho et aí, 1982; O d i n e t z C o l l a r t , 1 9 8 8 ; 1992;
M o n t r e u i l et al., 1990). Pouco é conhecido sobre os camarões de água doce dos igarapés de terra firme, que a d a p t a r a m sua b i o e c o l o g i a a ambientes que apresentam um pulso de inundação mais dinâmico que o dos grandes rios (Walker & Ferreira,
1985). Μ brasiliense (Heller, 1862) é
geográfica, o c o r r e n d o n a s b a c i a s costeiras do norte de América do Sul, da Venezuela ao Brasil e bacias dos rios Orinoco, Amazonas, São Fran-cisco, Paraguai e Paraná (Coelho & Ramos-Porto, 1985; López & Pereira,
1996). Pode ser encontrado tanto na calha dos grandes rios quanto nos lagos, igapós e igarapés de terra firme.
Os e s t u d o s e x i s t e n t e s s o b r ezyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA M.
brasiliense abrangem principalmente
levantamentos faunísticos e taxonomia (Holthuis, 1952; Kensley & Walker,
1982; Coelho & Ramos-Porto, 1985; P e r e i r a , 1993; G a r c i a , 1998), c o n h e c e n d o - s e p o u c o s o b r e sua bioecologia. Neste trabalho, foram e s t u d a d o s a s p e c t o s da b i o l o g i a reprodutiva de camarão de água doce
M. brasiliense e sua relação com
fatores a m b i e n t a i s a q u á t i c o s em
pequenos igarapés. zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
MATERIAL Ε MÉTODOS
As coletas foram realizadas em dois igarapés de terra firme na estrada Iquitos-Nauta, situados no segmento compreendido entre os povoados de
Quistococha (3o
49,73'S e 73° 19,37' W)
e Allpahuayo ( 3o
51'S e 73° 19,37'W), nas proximidades de Iquitos (Amazônia peruana) (Fig. 1). As duas estações de coletas caracterizam-se por sofrer pouca influência dos grandes rios e pelo fato do nível das suas águas depender principalmente das precipitações pluviais locais. A profundidade média das estações de coleta foi de 0,50m, e largura média foi de 2,5m. O pH oscilou entre 5,5 e 6,0.
As coletas foram quinzenais e
realizadas de outubro de 1994 a agosto de 1995. Empregou-se uma rede de mão com a qual era levantada toda a serrapilheira submersa e a vegetação das margens até uma profundidade de 0,3m. As amostras foram tríadas e conservadas em álcool 70% no local de coleta.
No laboratório foi determinado o sexo de cada indivíduo com base na presença ou ausência do apêndice m a s c u l i n o no s e g u n d o par de pleópodos. A proporção de sexos foi calculada e testada (1:1) com o teste q u i - q u a d r a d o ( χ 2
) . A a n á l i s e morfológica para a identificação da e s p é c i e foi r e a l i z a d a em 523 indivíduos adultos, onde contou-se o número de dentes do rostro e mediu-se o c o m p r i m e n t o c e f a l o t o r á c i c o (distância dorsal entre a margem pos-terior da cavidade orbital e a margem p o s t e r i o r do c e f a l o t ó r a x ) , em milímetros. As diferenças entre ma-chos e fêmeas foram comparadas com um teste "Τ" . O dimorfismo sexual do s e g u n d o par de p e r e i ó p o d o s foi determinado em espécimes adultos m e d i n d o - s e o a p ê n d i c e de m a i o r t a m a n h o do par; os dados foram analisados mediante um teste "T". Também foi testada a relação entre o segundo pereiópodo e o comprimento cefalotorácico mediante análise de regressão simples.
número de ovos nas fêmeas ovadas. A relação entre o peso e o comprimento cefalotorácico foi testada com uma análise de regressão simples. O vol-ume do ovo foi determinado segundo
MedeiroszyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA et al. (1994), com a seguinte
relação:
V = (A)2
x 3 , 1 4 x L / 6
onde: V = Volume em mm3
, A = Diâmetro menor do elipsóide, L = D i â m e t r o m a i o r do e l i p s ó i d e . A relação entre o volume do ovo com o c o m p r i m e n t o c e f a l o t o r á c i c o e a f e c u n d i d a d e t a m b é m foi t e s t a d a
mediante análise de regressão simples. zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
RESULTADOS
Caracterização sistemática
M. brasiliense caracteriza-se
por possuir um rostro reto, com a e x t r e m i d a d e distai l i g e i r a m e n t e dirigida para acima, alcançando o fi-nal do escafocerito. O número de dentes na margem superior varia de 8 a 13, com 1 a 4 dentes pós-orbitais, e 2 a 5 na margem inferior. O segundo par de p e r e i ó p o d o s é bem d e s e n v o l v i d o , com os a p ê n d i c e s semelhantes na forma, mas diferentes em tamanho. O cefalotórax dos ma-chos apresentou-se um pouco maior que o das fêmeas (comprimento médio encontrado nos machos = 14,8mm, ± 3,4; nas fêmeas = 12,9 ± 2,0mm; Τ = 6,767; g.l. 421; p< 0,0001).
Dimorfísmo sexual do segundo par de pereiópodos
Os m a c h o s a p r e s e n t a r a m pereiópodos maiores e variáveis em t a m a n h o em r e l a ç ã o às fêmeas
( c o m p r i m e n t o m é d i o nos machos 34,77 ± 15,20mm; nas fêmeas, 28,05 ± 6 , 8 5 m m ; Τ = 5 , 5 7 2 ; g.l. 4 2 1 ; p< 0,0001). Nas fêmeas, o pereiópodo representa, em média, 2,26 vezes o comprimento do cefalotórax, enquanto q u e , nos m a c h o s , r e p r e s e n t a , em média, 2,51 vezes o comprimento do cefalotórax. Este valor mostrou uma grande variação no caso dos machos (C.V.= 2 2 % ) . N o s m a c h o s , o desenvolvimento do pereiópodo esteve mais fortemente relacionado com o desenvolvimento do cefalotórax que nas fêmeas (p=0,05) (Figs. 2 A e Β) .
Proporção de sexos
D u r a n t e t o d o o p e r í o d o de c o l e t a o b s e r v o u - s e u m a ligeira p r e d o m i n â n c i a de f ê m e a s na população. A porcentagem média, considerando os valores de todas as amostras m e n s a i s , foi de 6 2 % de fêmeas e 38% de machos, com uma proporção fêmea: macho de 1,7:1. O
teste de qui-quadrado (c2
) mostrou que essa relação, em todos os meses de coleta, com exceção de março e abril,
é significativa ( X2
= 169.32; n= 2604; p= 0,05).
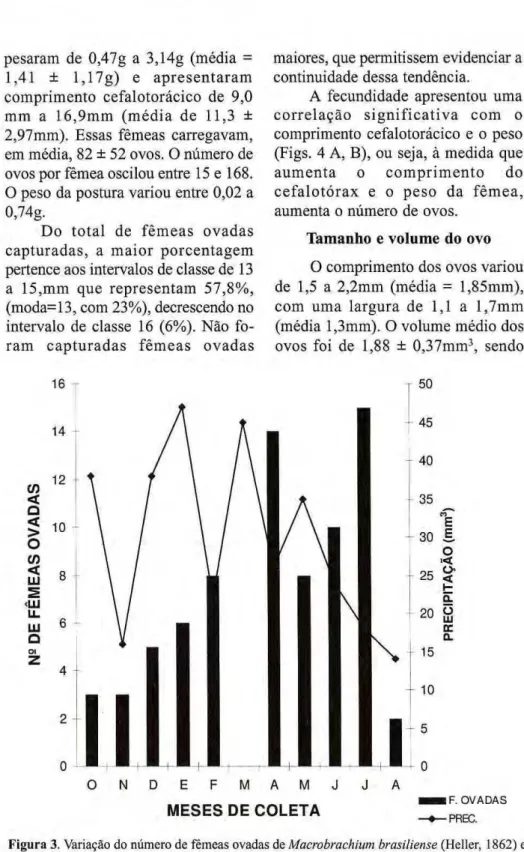
Período de desova
Nos dois igarapés estudados, M.
brasiliense apresentou fêmeas ovadas
durante todo o período de coleta (com exceção de m a r ç o ) , com um pico reprodutivo de abril a julho, período em que a precipitação se encontrava com valores médios (Fig. 3).
Fecundidade
100
90
80
70
60
50
40
30
20
10
0
zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBAΝ = 239 r = 0,76
Pereiópodo = 22,678 + 3,875 (LC) zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
• • zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
A
8 10 12 14 16 18 20 22 24 26
COMPRIMENTO CEFALOTÓRAX (mm)
50
45
40
§ 35
§ 3 0
| 2 5
zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBAo
20
I 15
I 10
o ü
5
0
Ν = 184
r = 0,42 zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA• . • •
Pereiópodo = 0,217 +2,191 (LC) zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
Β
8 10 12 14 16 18
COMPRIMENTO CEFALOTÓRAX (mm)
20 22
Figura 2.zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA Relação entre o comprimento do segundo pereiópodo e o comprimento do cefalotórax
pesaram de 0,47g a 3,14g (média = 1,41 ± 1,17g) e a p r e s e n t a r a m comprimento cefalotorácico de 9,0 mm a 16,9mm ( m é d i a de 11,3 ± 2,97mm). Essas fêmeas carregavam, em média, 82 ± 52 ovos. O número de ovos por fêmea oscilou entre 15 e 168. O peso da postura variou entre 0,02 a 0,74g.
Do total de f ê m e a s o v a d a s c a p t u r a d a s , a m a i o r porcentagem pertence aos intervalos de classe de 13 a 15,mm que representam 5 7 , 8 % , (moda=13, com 23%), decrescendo no intervalo de classe 16 (6%). Não fo-ram c a p t u r a d a s fêmeas o v a d a s
maiores, que permitissem evidenciar a continuidade dessa tendência.
A fecundidade apresentou uma c o r r e l a ç ã o s i g n i f i c a t i v a com o comprimento cefalotorácico e o peso (Figs. 4 A, B), ou seja, à medida que a u m e n t a o c o m p r i m e n t o do c e f a l o t ó r a x e o p e s o da f ê m e a ,
aumenta o número de ovos. zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
Tamanho e volume do ovo
O comprimento dos ovos variou de 1,5 a 2,2mm (média = l,85mm), com uma largura de 1,1 a l , 7 m m (média l,3mm). O volume médio dos
ovos foi de 1,88 ± 0,37mm3
, sendo
0zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA ^ " i zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
\
50
-- 4 5
40
35
\
Ε
30 £ zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
o zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
2zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA.0 <
20
a
zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBAa. zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
r 15
10
L
O N D E F M A M J J
MESES DE COLETA |F. OVADAS
• PREC.
Figura 3. Variação do número de fêmeas ovadas de Macrobrachium brasiliense (Heller, 1862) e
180
_
160
zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA8 140
g 120
zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBAο ι
δ
100
zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBAui
§ 80
zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBAI
60
I
40
20
0
zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBAN = 45 zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
_L r=0,88
Fecundidade = 8,408 + 0,051 (LC)
ρ = 0,0001 zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
• •
• •
• • • • •
• • zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
A
8 10 12 14 16
COMPRIMENTO DO CEFALOTÓRAX (mm)
18
180
_
160
1
1 4 0g 120
5
100
111
S
80
Q
1
60
I
40
zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBALL
20
0
Ν = 45 # r = 0,90 • *
Fecundidade = 13,728 + 47,650 (Pesq) ' # ρ = 0,0001
•
•
• zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
• * • • •
• ••
• • • •
Β
0
0.5
1.5
2
PESO TOTAL (g)
2.5
3.5
que o maior volume médio encontrado
por fêmea foi de 2,83mm3
, e o menor,
de l,27mm3
. O volume médio do ovo não apresentou nenhuma correlação com a comprimento cefalotorácico (r = 0,0008) ou com a fecundidade
(r = 0,0683) a um p= 0,05. zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
DISCUSSÃO
Dimodismo sexual no segundo par de pereiópodos
C r e s c i m e n t o h e t e r o g ê n e o a s s o c i a d o a fatores i n t r í n s e c o s , ambientais ou sociais, foi observado em outras espécies aquáticas (Wilbur
& C o l l i n s , 1 9 7 3 ; N e w k i n kzyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA et al,
1977). R a ' a n a n & C o h e n ( 1 9 8 4 ) comprovaram que no crescimento em cativeiro de juvenis de M. rosenbergii, os fatores sociais controlam mais efetivamente a variação no tamanho de juvenis que os fatores genéticos. Observaram crescimento heterogêneo com duas classes de t a m a n h o de c a m a r õ e s c u l t i v a d o s em g r u p o e crescimento homogêneo em camarões cultivados em isolamento.
Possivelmente tal fato também poderia ocorrer em ambientes naturais e que a diferença de tamanho no segundo par de pereiópodos entre os sexos de M. brasiliense responderia a pressões de grupo, nas quais os ma-chos p r e c i s a r i a m d e s e n v o l v e r pereiópodos maiores do que os das fêmeas para defender seu território e seu clã da invasão de outros machos. Isso t a m b é m e x p l i c a r i a a a m p l a variação apresentada entre os machos, j á q u e a e x i s t ê n c i a de m a c h o s
dominantes territorialistas envolveria uma hierarquização dentro de uma d e t e r m i n a d a á r e a , com m a c h o s d o m i n a d o s sob a i n f l u ê n c i a dos dominantes.
Período de desova
Os c a m a r õ e s de água d o c e podem apresentar reprodução contínua ou periódica. Nas regiões de latitudes maiores, a estação reprodutiva possa ocorrer por ação de um e s t í m u l o primário fotoperiódico, iniciando-se a partir do inverno e com época de eclosão das pós-larvas nos meses de v e r ã o (Bond & B u c k u p , 1982), enquanto nos trópicos a época de r e p r o d u ç ã o está, p r i n c i p a l m e n t e , relacionada ao regime hidrológico. Na Amazônia, reprodução contínua foi constatada em M. amazonicum, que habita as várzeas dos rios de águas brancas, ricas em nutrientes (Odinetz Collart, 1992) em Macrobrachium
inpa (Kensley & Walker, 1982) e
Pseudopalaemon amazOnensis
(Ramos-Porto, 1979), que habitam pequenos igarapés permanentes de terras mais altas (Kensley & Walker, 1982; Walker & Ferreira, 1985). Por outro lado, Palaemonetes carteri (Gor-don, 1935), que habita igarapés de áreas baixas próximas aos grandes rios de água preta e que sofrem inundação anual, apresenta reprodução somente no período de enchente das águas (Walker & Ferreira, 1985; Odinetz C o l l a r t & E n r i c o n i , 1993). No presente estudo, as populações de M.
brasiliense, que ocorrem nos igarapés
de terras altas da estrada Iquitos-Nauta
apresentaram desova durante o ano todo, mas com maior intensidade no período de abril a julho.
E s t e s d i f e r e n t e s p a d r õ e s r e p r o d u t i v o s a p r e s e n t a d o s por camarões que habitam hidrossistemas diferentes representaria uma resposta adaptativa às condições ambientais.
Assim,zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA M. amazonicum, que habita
á g u a s b r a n c a s e c l a r a s r i c a s em n u t r i e n t e s , c a p a z e s de s u p o r t a r milhares de larvas planctotróficas, se reproduz durante o ano todo (Odinetz Collart & Enriconi, 1993). Por sua v e z , M. brasiliense que habitam igarapés rasos de terra firme, onde o pulso de inundação é muito mais d i n â m i c o e de m e n o r d u r a ç ã o , reproduz-se o ano todo, assegurando a presença tanto temporal como espacial das larvas em condições ambientais tão instáveis. Ao contrário, P. carteri, que ocorre em igarapés do baixo rio N e g r o , desova somente durante o período de inundação do rio, o que garantiria a sobrevivência das larvas. A dispersão larval no meio aquático em e x p a n s ã o a u m e n t a r i a as possibilidades de sobrevivência da e s p é c i e , d e v i d o à d i m i n u i ç ã o da competição intra-específica com o aumento dos recursos alimentícios e espaciais. Esse tipo de estratégia reprodutiva é comum em espécies tropicais (Welcomme, 1985; Odinetz
Collart & Enriconi, 1993). zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
Fecundidade
A fecundidade (15 e 168 ovos) das f ê m e a s da p o p u l a ç ã o de M.
brasiliense estudada neste trabalho foi
superior à encontrada por Vega (1984),
que encontrou fêmeas portando de 63 a 108 o v o s . O n ú m e r o de o v o s p r o d u z i d o s por uma d e t e r m i n a d a espécie pode apresentar variações devido às diferenças na idade e no tamanho dos exemplares analisados, às c a r a c t e r í s t i c a s g e n é t i c a s das populações e à origem dos animais. S a b e - s e q u e , nos c r u s t á c e o s , a fecundidade pode se alterar de acordo com as condições fisiológicas das fêmeas, estações do ano, latitude e condições ambientais, bem como com a oferta alimentar ou a temperatura (Jensen, 1958; Coelho et al, 1982; Odinetz Collart & Magalhães, 1994).
Correlação significativa entre número de ovos e tamanho da fêmea já foi observado em outros camarões amazônicos que apresentam desenvolvimento larval completo e habitam águas brancas, como
Macrobrachium surimanicum
(Holthuis,1948) e M. amazonicum (Odinetz Collart, 1992; Odinetz Collart & Magalhães, 1994). Entretanto, em P.
carteri, que apresentou desenvolvimento
M a g a l h ã e s , 1994). Os r e s u l t a d o s o b t i d o s no p r e s e n t e e s t u d o c o n t r a p õ e m - s e a esta ú l t i m a afirmação, indicam que a fecundidade estaria influenciada tanto por fatores ecológicos do meio aquático, quanto por fatores genéticos, em espécies que habitam águas pobres em nutrientes.
Na tabela 1, observa-se que, en-tre os camarões que habitam corpos de
á g u a s da A m a z ô n i a c e n t r a l ,zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA M.
brasiliense apresenta uma fecundidade
muito inferior àquela apresentada por
M. amazonicum, cuja fecundidade
variou de 289 a 2259 ovos. Entretanto, apresenta uma fecundidade superior a outras espécies do mesmo gênero, como M. inpa, M. nattereri (Heller,
1862) e M. ferrerai ( K e n s l e y &
Walker, 1982). zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
Tamanho e volume do ovo
A relação de tamanho do ovo e a distribuição ecológica está bem documentada na literatura (Walker & Ferreira, 1985; Magalhães & Walker, 1988; Odinetz Collart & R a b e l o ,
1996). Os camarões que habitam a bacia amazônica e que realizam todo seu ciclo reprodutivo independente das águas estuarinas, podem apresentar duas e s t r a t é g i a s r e p r o d u t i v a s diferentes. Numa delas, a espécie apresenta alta f e c u n d i d a d e , ovos pequenos e desenvolvimento larval c o m p l e t o . Ε o caso de M.
amazonicum, que habita sistemas de
águas brancas, ricas em nutrientes, c a p a z e s de s u p o r t a r u m n ú m e r o elevado de larvas planctotrófícas. Na o u t r a , a e s p é c i e tem b a i x a fecundidade, ovos grandes e ricos em v i t e l o e d e s e n v o l v i m e n t o l a r v a l abreviado. Esta estratégia é aquela a p r e s e n t a d a p e l o s c a m a r õ e s q u e habitam os sistemas de águas pretas e claras, pobres em nutrientes e, por c o n s e g u i n t e , em f i t o p l â n c t o n (Magalhães & Walker, 1988; Odinetz C o l l a r t & M a g a l h ã e s , 1994). M.
brasiliense utiliza esta ú l t i m a
estratégia, tendo em vista sua baixa f e c u n d i d a d e e o t a m a n h o relativamente grande dos ovos pese ao
Tabela 1. Relação entre o habitat e a reprodução de cinco espécies de camarões Amazônicos de
gênerozyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA Macrobrachium. zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
Espécies Hablat Ns
de ovos Tamarrn do ovo (mm) N° de estádios larvais Fonte zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
M. amazonicum Sistema de águas brancas e
claras. 289225Θ 1,06 x0,77 10 11 Magahâes, 1985
M. ferreira Sistema de águas pretis e igarapés de terra Irme 2535 3,66x2,44 3 Magalhães» Walker, 1983
M. nattereri Sisemas de águas prebs e
darás, igarapés de terra Irme 34150 2,58x2.14 3
Rodriguez, 1982; Magahães & Walker, 1988
M. inpa Seemas de águas pretas e
claras, igarapés de terra lima &30 1,76x1,31 3 Wakar& Ferreira, 19%
M. trasilBnse SisBrras de águas pretas e
tamanho das fêmeas adultas. A espécie apresenta desenvolvimento abreviado, com as larvas eclodindo num estado b a s t a n t e a v a n ç a d o de desenvolvimento, muito parecido a um
camarão juvenil (Vega, 1984). zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA
AGRADECIMENTO
O s a u t o r e s a g r a d e c e m aos pesquisadores do INPA: Dr. Célio Magalhães e Dr. Carlos A. Lima pelas críticas e sugestões ao manuscrito. Ao Instituto de Investigaciones de la Amazônia Peruana — IIAP pelo apoio financeiro e pelas bolsas de pesquisas concedidas.
Bibliografia citada
Bond, G.; Buckup, L. 1982. O ciclo reprodutor
dezyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA Macrobrachium borrellii (Nobili, 1896) e Macrobrachium potiuna (Muller, 1880)
(Crustacea, Decapoda, Palaemonidae) e suas relações com a temperatura. Revista Brasileira de Biologia, 42(3): 473-483.
Coelho, P.A.; Ramos-Porto, M.; Soares, C. M. A. 1982. Biologia e cultivo de camarões de água doce. In: Série Aqücultura N'J
1. Universidade Federal de Pernambuco, Recife, Pernambuco, Brasil, p. 1 -53.
C o e l h o , P.A.; R a m o s - P o r t o , M. 1 9 8 5 . C a m a r õ e s de á g u a d o c e d o B r a s i l : distribuição geográfica. Revista brasileira de Zoologia, 2(4): 405-410.
Heller, C. 1862. Beitrage zur naheren kentniss der Macrouren. Sitzungs Berichte der Akademie Wissenschaften in Wiens, 45: 389-426.
Holthuis, L.B. 1952. A geral revision of the Palaemonidae (Crustacea: Decapoda : Natantia) of the Americas, II: the subfamily Palaemonidae. Allan Hancock Foundation Publications, Occasional Paper, 12: 1-79
García-Dávila, C. 1998. Revisão taxônomica dos camarões de água doce (Crustacea: Decapoda: Palaemonidae, Sergestidae)
da Amazônia peruana. Dissertação de Mestrado, Instituto Nacional de Pesquisas de Amazônia/Fundação Universidade do Amazonas. Manaus, Amazonas. 62p.
Jensen, J.P. 1958. The relation between body s i z e and n u m b e r o f e g g s in m a r i n e malacostrakes, Meddel. Danmarks Fish og Hauunder-Sogn. Ser. II, (19): 1-25.
Kensley, B.; Walker I. 1982. Palaemonid shrimps from the Amazon Basin, Brazil ( C r u s t a c e a : D e c a p o d a : N a t a n t i a ) . Smithsonian Contribuitions to Zoology, 362: 1-18.
López, B.; Pereira, G. 1996. Inventory of the d e c a p o d c r u s t a c e a n s of the high and middle Orinoco river delta, Venezuela. Acta Biológica Venezuelica, 16(3): 45-46.
Magalhães, C ; Walker, I. 1988: Larval devel-opment and ecological distribution of cen-tral a m a z o n i a n p a l a e m o n i d s h r i m p s (Decapoda: Caridea). Crustaceana, 55(3): 279-292.
Medeiros, Ν. ; Magalhães, C ; Odinetz Collart 0 . 1994. Caracterização morfológica e reprodutiva do camarão Macrobrachium inpa (Decapoda, Palaemonidae). In: a n a i s - 4 6a
R e u n i ã o A n u a l de S B P C , Universidade Federal do Espírito Santo, p. 826-836.
Montreuil, V.H.; Maco, J.; Tello, S.; Ismino, R.; Sanches, H. 1990. Cuadro ambiental dc la cocha Carocurahuaite y las posibilidades de e x p l o t a c i ó n del c a m a r ó n Macrobrachium amazonicum. Folia Amazônica, 2: 99-121.
Newkirk, G.F.; Haley, L.E.; Waugh, D.L. Doyle, R. 1977. Genetic of larvae and spat growt rates in the oyster Crassostrea virginica. Marine Biology, 4 1 : 49-52.
Odinetz Collart, O. 1988. Aspectos ecológicos do camarão Macrobrachium amazonicum (Heller, 1962) no baixo Tocantins (ΡΑ -Brasil). Memórias de la Sociedad de Ciências Naturales La Salle, XLVIII, suplemento: 341-353.
amazônicazyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA In: Ferreira, E.J.; Santos, G.M.; Leão, E.L.M.; Oliveira, L.A. (Eds). Bases
Cientificas para Estratégias de Preservação e Desenvolvimento da Amazônia, vol. 2. Instituto Nacional de Pesquisas da Amazônia (INPA). Manaus, Amazonas, p. 147-166.
O d i n e t z C o l l a r t , O.; E n r i c o n i , A. 1 9 9 3 . Estratégia reprodutiva e alguns aspectos demográficos do camarão Palaemonetes carteri Gordon, 1935 na Amazônia Cen-tral, rio Negro. Acta Amazônica, 23(2-3): 227-243.
Odinetz Collart, O.; Magalhães, C. 1994. Eco-logical constraints and life history strate-gies of palaemonid prawns in Amazonia. Verhandlungen der Internationale Vereinigung Limnologie, 25: 2460-2467.
Odinetz Collart, 0 . ; Rabelo, Η . 1996. Variation in the egg size the fresh-water prawn Macrobrachium amazonicum (Decapoda: Palaemonidae). Journal of Crustacean Bi-ology, 16(4): 684-688.
Pereira, S.G.A. 1993. A description of a new species of Macrobrachium from Peru, and distributional records for Macrobrachium brasiliense (Heller) (Crustacea: Decapoda: Palaemonidae). Proceedings of the Bio-logical Society of Washington, 106(2): 339-345.
Ra'anan, Z.; Cohen, D. 1984. The effect of group interaction on the develoment of size d i s t r i b u t i o n in Macrobrachium rosembergii (De Man) juvenile popula-tion. Biologique Bulletin de la France et de la Belgique, 166: 22-31.
Vega, P.L.A., 1984. Desenvolvimento larval de Macrobrachium heterochirus (Wiegman,
1836), Macrobrachium amazonicum (Heller, 1862) e Macrobrachium brasiliense (Heller, 1868) (Crustacea, Decapoda, Palaemonidae), em laboratório. Tese de doutorado, Universidade de São Paulo, São Paulo. 255p.
Walker, [.; Ferreira, M.J.N. 1985. On the popu-lation dynamics and ecology of the shrimp species (Crustacea, Decapoda, Natantia) in the central A m a z o n i a n river Taruma-Mirim. Oecologia, 66: 264-270.
Welcome, R.L. 1985. River Fisheries, FAO Fisheries Technical Paper 262. FAO Pub-lications, Roma, Italy. 330p.
Wilbur, H.M.; Collins, J.P. 1973. Ecological aspects of amphibian metamorphosis.
Sci-ence, 182:1305-1314. zyxwvutsrqponmlkjihgfedcbaZYXWVUTSRQPONMLKJIHGFEDCBA