AVALIAÇÃO DO TECIDO MAMÁRIO EM
MULHERES NA PÓS-MENOPAUSA USUÁRIAS
DE ISOFLAVONA DA SOJA
ORIENTADOR: PROF. DR. JORGE NAHÁS NETO
CO-ORIENTADORA: PROFA. DRA. ELIANA AGUIAR PETRI NAHÁS
DOUTORADO
FACULDADE DE MEDICINA DE BOTUCATU Universidade Estadual Paulista “Júlio de Mesquita Filho”
AVALIAÇÃO DO TECIDO MAMÁRIO EM
MULHERES NA PÓS-MENOPAUSA USUÁRIAS
DE ISOFLAVONA DA SOJA
Tese apresentada ao Programa de Pós Graduação em Ginecologia, Obstetrícia e Mastologia, Área de Ginecologia, da Faculdade de Medicina de Botucatu-UNESP, para obtenção do título de Doutor na área de Tocoginecologia.
ORIENTADOR: PROF. DR. JORGE NAHÁS NETO CO-ORIENTADORA: PROFA. DRA. ELIANA AGUIAR PETRI NAHÁS
DEDICATÓRIA
A Deus, por iluminar e se fazer presente em minha vida, dando saúde, proteção e permitindo, dessa forma, que as oportunidades sejam aproveitadas.
A minha esposa Lucia e aos meus filhos Laura e Armando Neto, pelo amor, pela família que construímos e pela alegria que sinto a cada dia que estou com vocês.
A meu pai e amigo Armando , pela presença, confiança, amizade e exemplo de vida.
AGRADECIMENTOS
Aos meus orientadores Dr Jorge e Dra Eliana pela atenção e pelo carinho na execução de mais uma tese. É admirável a capacidade de conciliar trabalho e
família, e isso vocês fazem com maestria. Nosso convívio constante tornou-se
familiar e, dessa forma, estreita cada vez mais nossos laços de amizade.
Ao Professor Paulo Traiman pela confiança, pela amizade, pelos ensinamentos e pelo trabalho conjunto nesses 10 anos. A admiração profissional me faz seu fiel
seguidor.
A colega Angela, pela amizade e pela agradável parceria nas atividades da oncogineco.
A todos os professores e colegas de trabalho na Disciplina de Ginecologia, em
especial aos amigos Heloísa, Gilberto, Daniel e Flávia.
As pacientes desse estudo que de maneira carinhosa nele se envolveram.
Aos funcionários Célia, Cesar e Cida, da secretaria do Departamento de Ginecologia e Obstetrícia, pela prestatividade sempre que necessária.
RESUMO
Objetivo: Avaliar o efeito da isoflavona da soja sobre o tecido mamário em mulheres na pós-menopausa.
Métodos: Trata-se de estudo clínico, prospectivo, randomizado, duplo-cego, placebo controlado, envolvendo 80 mulheres na pós-menopausa com sintomas
vasomotores, idade entre 45 a 70 anos, acompanhadas no Ambulatório de
Climatério e Menopausa da Faculdade de Medicina de Botucatu-Unesp, de janeiro
de 2005 a dezembro de 2006. Na randomização, 40 pacientes receberam 100 mg
isoflavona da soja/dia (duas cápsulas de 125 mg de extrato seco de glicine Max) e
40 pacientes placebo (duas cápsulas de lactose) durante 10 meses. A densidade
mamária (DM) foi avaliada pela mamografia e o parênquima mamário pela
ultrassonografia de mamas no início e após dez meses de seguimento. Para análise
estatística foram utilizados o teste t-Student, ANOVA, teste de Mann-Whitney e teste
do Qui-Quadrado.
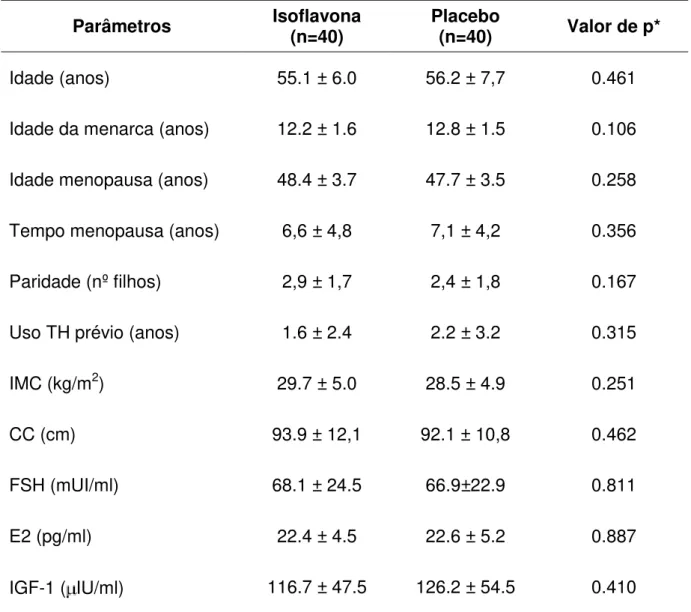
Resultados: Na comparação das características clínicas iniciais entre os grupos de usuárias de isoflavona e placebo, não houve diferenças significantes, com valores
médios de idade de 55,1±6,0 e 56,2±7,7 anos, tempo de menopausa de 6,6±4,8 e
7,1±4,2 anos e IMC de 29,7±5,0 e 28,5±4,9 kg/m2, respectivamente (p>0,05).
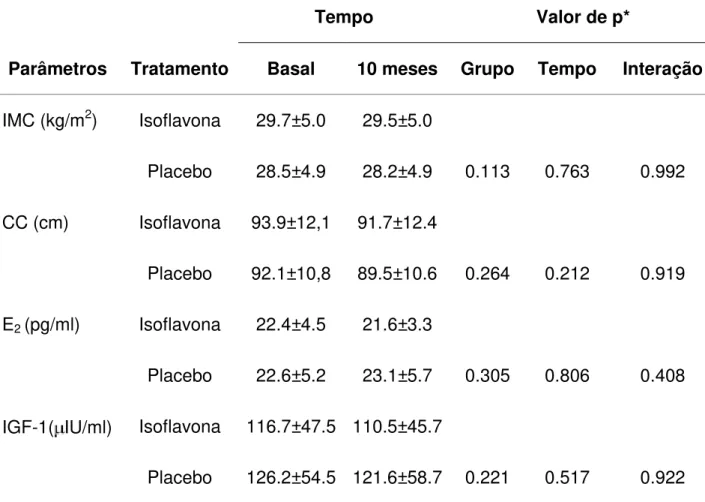
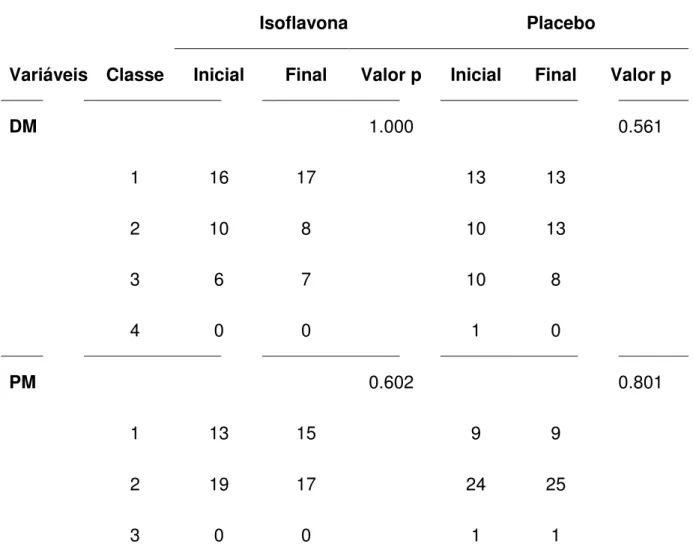
Concluíram o estudo 32 pacientes sob isoflavona e 34 sob placebo. Na comparação
da densidade mamográfica entre os momentos inicial e final, não houve diferença
estatisticamente significativa. Na avaliação do parênquima mamário pela
ultrassonografia, não houve diferença entre os grupos. Na comparação entre os
momentos dentro de cada grupo, não foram constatadas diferenças significativas
Conclusão: No período de 10 meses, o uso de isoflavona de soja não modificou o tecido mamário, avaliado pela mamografia e ultrassonografia, em mulheres na
ABSTRACT
Objective: To evaluate the effect of soy isoflavone on breast tissue in postmenopausal women.
Methods: This study is a prospective, randomized, double-blind, placebo-controlled trial involving 80 postmenopausal women with vasomotor symptoms, aged 45-70
years, followed in Climacteric and Menopause Clinic of the Botucatu Medical
School-UNESP, from January 2005 to December 2006. At randomization, 40 patients
received 100 mg of soy isoflavone/day (two capsules of 125 mg standardized soy
extract, Glicine max) and 40 patients, placebo (two capsules of lactose) for 10
months. The breast density was evaluated by mammography and breast
parenchyma by ultrasound, at baseline and after ten months of follow-up. The
Student t-test, ANOVA, Mann-Whitney and Chi-Square were used in the statistical
analysis.
Results: In comparison of baseline clinical characteristics between the isoflavone and placebo groups, there were no significant differences, with mean age of 55.1 ±
6.0 and 56.2 ± 7.7 years, duration of menopause 6.6 ± 4.8 and 7.1 ± 4.2 years and
BMI 29.7 ± 5.0 and 28.5 ± 4.9 kg/m2, respectively (p> 0.05). Concluded the study, 32
patients on isoflavone and 34 in the placebo group. In comparison in mammographic
density (MD) between moments, baseline and final, there was no difference
statistically significant. In the evaluation of breast parenchyma by ultrasound, there
was no difference between groups. In comparing the moments within each group,
there were no significant differences in the parameters of mammography and
LISTA DE ABREVIATURAS
ACS American Cancer Society
AMP Acetato de Medroxiprogesterona
BI-RADS Breast Imaging Reporting and Data System
CAR Colégio Americano de Radiologia
CC Circunferência da Cintura
DM Densidade Mamária
E2 Estradiol
EEC Estrogênios Eqüinos Conjugados
FSH Hormônio Folículo Estimulante
IBGE Instituto Brasileiro de Geografia e Estatística
IGF-1 Fator de Crescimento Insulino-like 1
IMC Índice de Massa Corpórea
INCA Instituto Nacional do Câncer
LH Hormonio Luteinizante
MWS Million Women Study
NAMS North American Menopause Society
NHIS National Healthy Interview Survey
TH Terapia Hormonal
GRANDE QUANTIDADE (>50%) DE TECIDO FIBROGLANDULAR
SUMÁRIO
1. INTRODUÇÃO ... 17
1.1. Menopausa e Tecido Mamário ... 17
1.2. Avaliação do Tecido Mamário ... 21
1.3. Isoflavona de Soja ... 26
1.4. Isoflavona de soja e o tecido mamário ... 29
2. OBJETIVOS ... 43
2.1. Objetivo Geral ... 43
2.2. Objetivos Específicos ... 43
3. PUBLICAÇÃO ... 45
3.1. Artigo ... 45
4. CONCLUSÕES ... 82
5. ANEXO ... 84
GRANDE QUANTIDADE (>50%) DE TECIDO FIBROGLANDULAR
1. INTRODUÇÃO
Com o aumento da expectativa de vida, o contingente de mulheres que
atinge a menopausa é cada vez maior. No Brasil, pelo Censo de 2010 do Instituto
Brasileiro de Geografia e Estatística (IBGE), a população de mulheres com 50 anos
ou mais foi de 21.113.769, representando 21,6 % da população feminina (IBGE,
2010). Considera-se menopausa um fenômeno essencialmente moderno em seus
aspectos fisiológico, clínico e terapêutico. É definida como interrupção das
menstruações resultante do término da atividade folicular ovariana, com diminuição
na produção dos esteróides sexuais (Adashi, 1994). Ocorre em média aos 49,4 anos
(± 5,5 anos) de idade nas mulheres latino-americanas (Blumel et al, 2006).
Diferentemente da menacme, os estrogênios da menopausa são de origem
periférica. A estrona, principal deles, é produzida principalmente pela aromatização
da androstenediona no tecido adiposo. A maior fonte de androstenediona na
menopausa é a glândula supra-renal (80%), embora ocorra pequena produção pelos
ovários (20%) (Adashi, 1994).
1.1. Menopausa e Tecido Mamário
O declínio na produção estrogênica interfere negativamente na qualidade
de vida repercutindo sobre o bem estar físico, emocional e social da mulher.
Observa-se que 76 a 80% das mulheres relatam algum sintoma decorrente do déficit
estrogênico, entre eles instabilidade vasomotora, atrofia vaginal e vulvar, alterações
de humor, disfunção vesical e uretral, atrofia endometrial e diminuição do volume
bilateral, localizada na parede anterior do tórax e recoberta por pele. Na superfície,
em sua porção central, apresenta o complexo aréolo-papilar, pelo qual se
exteriorizam secreções, exsudações e transudatos. O parênquima epitelial é
formado por vinte ou mais lobos. Cada um destes se esvazia em um ducto excretor
separado, que termina no mamilo. Os lobos dividem-se em vários lóbulos (corpos
glandulares) que são formados por dez, cem ou mais ácinos, agrupados ao redor de
um ducto coletor. Os ácinos (unidade funcional) são revestidos por uma ou duas
camadas de células: uma de epitélio cúbico, que está em contato com o lúmen, e
outra de células mioepiteliais, intercaladas entre as mesmas na camada basal. Os
ductos lactíferos, servindo de reservatório de leite na amamentação, são cobertos
por epitélio escamoso estratificado. O tecido conjuntivo intralobular é constituído de
estroma mixomatoso delicado e frouxo. Entre os lóbulos encontram-se estroma
fibroso, colagenoso e de maior densidade. Além disso, a mama é composta de
tecido gorduroso, artérias, veias, capilares, nervos e linfáticos (Haagensen, 1989).
Na menopausa ocorre involução mamária, devido ao declínio na produção
de esteróides ovarianos. Processa-se de forma lenta, progressiva e não uniforme.
Essas modificações não são absolutas e sincrônicas, dependendo de fatores como:
idade, tipo constitucional, paridade, produção estrogênica endógena e uso de
hormonioterapia exógena (Wolfe, 1976; Laya et al, 1996). O processo de involução é
dividido em duas fases. A primeira antecede a menopausa, sendo caracterizada pela
atrofia moderada do epitélio glandular e diminuição na quantidade de tecido lobular e
acinar. A segunda fase ocorre na menopausa, com redução progressiva de todo
tecido glandular, associado com aumento proporcional da quantidade de tecido
vasculares e diminuição do fluxo sanguíneo (Henson & Tarone, 1993; Laya et al,
1996).
A idade é o principal fator de risco para o câncer de mama. De fato, 77%
dos casos ocorrem em mulheres acima dos 50 anos (ACS, 2010). As taxas de
incidência aumentam rapidamente próximo aos 50 anos, e posteriormente, ocorrem
de forma mais lenta. Essa mudança no comportamento da taxa é atribuída ao início
da menopausa (Inca, 2010). Os fatores de risco relacionados à vida reprodutiva da
mulher (menarca precoce, menopausa tardia, nuliparidade, idade da primeira
gestação acima dos 30 anos), obesidade na pós-menopausa, antecedentes
familiares, uso de terapia hormonal estão estabelecidos em relação ao
desenvolvimento do câncer de mama. Estes fatores estariam relacionados à
prolongada exposição aos estrogênios (Veronesi et al, 2005). Isso se confirma pela
observação de redução de metástases em mulheres com câncer de mama
submetidas à ooforectomia(Clemons & Goss, 2001). Questiona-se a capacidade dos
hormônios sexuais de estimular o crescimento de tumores sub-clínicos ou de
provocar danos genéticos preexistentes, culminando na transformação maligna das
células ductais (Lécuru et al, 1995). O risco aumentado de câncer de mama em
mulheres submetidas à terapia hormonal (TH) se dá naquelas que fizeram uso por
período maior do que cinco anos e, ainda, uso de terapia combinada
estroprogestativa (Humphrey, 2002; Chlebowski & Anderson, 2011).
Em 2002, o estudo Women’s Health Iniciative (WHI), avaliou os riscos da
TH e, entre eles, o do câncer de mama em mulheres na pós-menopausa. Tratou-se
de estudo randomizado, duplo-cego, placebo controlado, com 8506 mulheres
tratadas com estrogênios equinos conjugados (EEC 0,625 mg) associados ao
placebo (grupo controle). O estudo foi delineado com a duração de 8,5 anos. No
entanto, a investigação foi interrompida com 5,2 anos pelo aumento na incidência de
câncer de mama, com risco relativo de 1,26. O risco absoluto, isto é, o excesso de
número de casos atribuídos a TH foi de oito casos adicionais em 10.000
mulheres/ano. Uma das informações de maior destaque é que o risco de câncer de
mama tornou-se aparente após cinco anos da randomização, quando a curva de
incidência aumentou rapidamente no grupo sob TH comparado com placebo.
Importante ressaltar que o risco só foi demonstrado nas mulheres que fizeram uso
de TH previamente ao estudo. Não faltaram críticas aos resultados desse estudo,
pois existiu abandono em ambos os grupos, sendo de 42% entre as usuárias de TH
e 38 % sob placebo. Além do mais, a pesquisa limitou-se a um único esquema
terapêutico (WHI, 2002). Em 2004, foi publicado novo resultado do estudo WHI, que
avaliou os efeitos dos EEC isolados em 10.739 mulheres histerectomizadas na
pós-menopausa. Com 6,8 anos de seguimento, encontrou-se risco relativo de 0,77 para
o câncer de mama, com menor taxa de diagnóstico no grupo de usuárias quando
comparado ao placebo (26 casos contra 33 por 10.000 mulheres/ano) (WHI, 2004).
Em recente publicação, com seguimento estendido de 11,8 anos de 7645 dessas
participantes que usaram EEC isolado por 5,9 anos em média, manteve-se
associado com menor incidência de câncer de mama invasivo (151 casos,
0,27%/ano) quando comparado ao grupo placebo (199 casos, 0,35%/ano) (Anderson
1.2. Avaliação do Tecido Mamário
O câncer de mama é o segundo tipo de câncer mais freqüente no mundo
e de maior prevalência entre as mulheres. No ano de 2008 foi diagnosticado
aproximadamente um milhão de casos novos de câncer de mama em todo o mundo
(ACS, 2010). No Brasil, para 2010 foram estimados 49.240 casos novos, com um
risco estimado de 49 casos a cada 100 mil mulheres (Inca, 2010). A prevenção
primária dessa neoplasia é difícil devido à variação dos fatores de risco e às
características genéticas que estão envolvidas na sua etiologia. Até o momento, a
mamografia, para mulheres com idade entre 40 e 69 anos, é reconhecidamente
como importante instrumento no diagnóstico de pequenos tumores ocultos e no
rastreamento do câncer de mama, reduzindo a taxa de mortalidade (Smith et al,
2003; Tabár et al, 2011). No Brasil, o rastreamento mamográfico para mulheres de
50 a 69 anos é a estratégia recomendada para controle do câncer de mama (Inca,
2010).
O rastreamento do câncer de mama, bem como seu intervalo, deve ser
personalizado com base na idade da paciente, história de biópsia prévia,
antecedente familiar de câncer de mama e a densidade mamária (Schousboe et al,
2011). Reconhecidamente, a densidade mamária é indicador de risco para o câncer
de mama (Martin & Boyd, 2008; Boyd et al, 2011). A densidade da mama, avaliada
pela mamografia, expressa a porcentagem da mamografia ocupada
radiologicamente por tecido denso (densidade mamográfica), refletindo variações na
composição do tecido mamário e estando fortemente associada com o risco de
câncer de mama (McCormack & Santos Silva, 2006). BI-RADS® (Breast Imaging
para a padronização dos relatórios mamográficos, inicialmente incluíram descritores
qualitativos da densidade mamográfica. A classificação do BI-RADS® de densidade
]mamográfica tem quatro categorias: (1) mamas quase inteiramente
lipossubstituídas; (2) mamas com densidade fibroglandular difusa; (3) mamas
heterogeneamente densas; e (4) mamas extremamente densas (ACR, 1993). Em
2003, foram acrescentadas definições quantitativas pelo CAR na quarta edição do
BI-RADS® que incluem porcentagens correspondentes de densidade no tecido
mamário: (1) menos de 25%; (2) de 25-50%; (3) de 51-75%; e (4) maior que 75% de
tecido denso (D’Orsi et al, 2003). A incorporação desses termos na padronização do
relatório da mamografia aumentou a capacidade do médico em compreender a
densidade mamária da paciente individualmente. Assim como, informações sobre a
densidade da mama aumentam a apreciação da sensibilidade (ou falta dela) do
exame mamográfico (Checka et al, 2012).
Mulheres que apresentam 50% ou mais da imagem da mamografia com
alta densidade têm três a cinco vezes mais risco de desenvolver câncer de mama do
que aquelas com menos de 25% de área densa (McCormack & Santos Silva, 2006;
Boyd et al, 2010). Aproximadamente 20 a 30% das mulheres na pós-menopausa
têm alta densidade mamária, frequência maior que a maioria dos fatores de riscos
conhecidos para o câncer de mama. Por exemplo, a história familiar de câncer de
mama ocorre em apenas 6 a 10% das mulheres (Boyd et al, 2011). Em seguimento
de três anos, um aumento na densidade mamária pela classificação de BI-RADS®
pode estar associado com aumento no risco de câncer de mama e diminuição da
densidade com menor risco quando comparado com mulheres que mantiveram a
mamária pelo BI-RADS® pode melhor predizer risco para câncer de mama do que
apenas uma avaliação (Kerlikowske et al, 2007).
Muitos dos fatores associados com a densidade mamográfica, estão
relacionados com alterações na exposição a hormônios que podem influenciar o
padrão proliferativo das células epiteliais e estromais na mama (Boyd et al, 2011).
Em recente pesquisa, Ghosh et al, por meio de core-biopsy guiada por
ultrassonografia mamária, demonstraram que a área mamograficamente densa
difere histologicamente da área não densa, refletindo maior proporção de células
epiteliais e estroma, com menor proporção de gordura (Ghosh et al, 2012). A
densidade mamográfica pode ser considerada um fator hereditário de risco para o
câncer de mama (Varghese et al, 2012). Estudos têm mostrado que a maioria das
variações na densidade mamográfica deve-se a fatores genéticos (uma combinação
de efeitos na proliferação – mitogênese, e dano genético na proliferação de células
por mutagênese), podendo aumentar o risco de câncer de mama associado com alta
densidade mamária (Hinz, 2007). No entanto, faz-se necessário melhorar o
conhecimento dos fatores específicos envolvidos nesse processo e da função dos
vários componentes do tecido mamário que contribuem para a densidade,
principalmente a identificação do gene responsável pela maioria das variações na
porcentagem da densidade (Martin & Boyd, 2008).
A densidade é influenciada por hormônios exógenos e fatores de
crescimento. Como exemplo, o fator de crescimento insulino-like 1 (IGF-1) que
promove proliferação e inibe apoptose em células mamárias normais e células
cancerosas da mama (Vertheus et al, 2010). Stephen et al demonstraram uma
relação recíproca entre a densidade celular e níveis de receptores de IGF-1 em
longo tempo, como a menopausa, poderia aumentar a quantidade de receptores de
IGF-1 promovendo o aumento da densidade celular da mama (Stephen et al, 2001).
Esse fator de crescimento parece estar associado com o risco de câncer de mama e
com a densidade mamária, contudo estudos clínicos apresentam resultados
conflitantes. Maskarinec et al não encontraram relação significativa entre a
densidade mamográfica e os valores séricos de IGF-1 em mulheres na pré e na
pós-menopausa (Maskarinec et al, 2007). Segundo Tamimi et al, uma variação genética
comum no IGF-1 poderia estar fortemente associada com a porcentagem de
densidade mamária (Tamimi et al, 2007). Este resultado não foi confirmado pelo
estudo de Taverne et al que observaram fraca associação entre essa variação
genética e a densidade mamográfica (Taverne et al, 2010).
O aumento da densidade mamográfica com uso da TH está diretamente
associado com maior risco de desenvolvimento de câncer de mama (Humphrey,
2002; Van Duijnhoven et al, 2007; Geirard et al, 2009; Chen et al, 2010). A
densidade mamográfica é influenciada pela reposição exógena de hormônios por
tempo prolongado (Kerlikowske et al, 2010). Banks et al, analisando a eficiência do
rastreamento mamográfico em uma amostra de 122.355 mulheres participantes do
Million Women Study (MWS), constataram redução da efetividade da mamografia em usuárias de TH (Banks et al, 2004). McTiernan et al, examinando os efeitos dos
EEC isolado sobre a densidade mamográfica em uma sub-amostra de participantes
do WHI, constataram aumento modesto, porém significativo, no período de dois
anos de avaliação (McTiernan et al, 2009). O uso de estrogênios associados com
progestagênios aumenta o risco de erro na classificação (falso positivo) pela
mamografia de rastreamento, por influenciar a densidade mamográfica (Njor et al,
É bem sabido que a sensibilidade da mamografia diminui em mamas
densas sendo frequentemente necessária a complementação diagnóstica pela
ultrassonografia (Buist et al, 2004; Yaffe et al, 2008). Esta tem a vantagem de
imagens tridimensionais e de não expor a mama a radiação ionizante. O papel da
ultrassonografia na avaliação das lesões mamárias tem sido alvo de constantes
mudanças. Entre as décadas de 1970 e 1980, esse método era usado basicamente
para diferenciar lesões císticas de sólidas, porém, a partir de 1990, com a melhor
resolução das imagens ultrassonográficas, foi possível o estudo das características
dos nódulos e dos tecidos vizinhos (Madjar, 2010). Assim, esse exame tem sido
utilizado para diferenciar lesões benignas das malignas, especialmente em
pacientes com mamas densas (Havert & Huffaker, 2010). Estudos recentes têm
mostrado que a detecção de pequenos tumores com ultrassom de alta resolução
aumenta 3-4 cânceres por 1.000 mulheres sem clínica ou anormalidades
mamográficas (Madjar, 2010). Kolb et al compararam a sensibilidade da mamografia
e do ultrassom de acordo com a densidade segundo BI-RADS®. A sensibilidade da
mamografia diminuiu e do ultrassom aumentou com o aumento da densidade
mamográfica. Para BI-RADS® 4, a sensibilidade da mamografia foi de 47,8% e de
76,1% a do ultrassom (Kolb et al, 2002). Mulheres com BI-RADS® categoria 2 a 4
para densidade deveriam realizar ultrassom complementar a mamografia (Havert &
Huffaker, 2010).
Há indicação que as medições com ultrassom podem fornecer
equivalente informação da densidade a partir da mamografia (Glide et al, 2007). Em
estudo recente, Moon et al, comparando medidas da densidade mamária pelo
ultrassom e ressonância magnética, encontraram boa correlação entre as técnicas
altamente dependente do avaliador, e isso provavelmente irá levar a variabilidade na
medição da densidade (Yaffe et al, 2008). Para melhorar a padronização dos laudos
do ultrassom e a comparação entre os exames, o Colégio Americano de Radiologia
(CAR) criou o léxico BI-RADS ultrassom (US), empregando dessa forma, o número
máximo de características que pudessem ser comparadas com o BI-RADS
mamográfico (ACR, 2003). Em ordem crescente de importância das características
avaliadas pelo léxico BI-RADS® US estão: sombra acústica posterior, presença de
microcalcificações no interior do nódulo, orientação não paralela da lesão em
relação à pele, alteração do tecido ao redor e dos limites da lesão representados
pela presença ou não do halo ecogênico, tendo esse último o maior impacto na
diferenciação das lesões (Pessoa et al, 2007). Certas características, como
orientação da lesão e ecogenicidade são próprias da ultrassonografia e não têm
correspondência com a mamografia. Além disto, a ultrassonografia é altamente
dependente da qualidade do aparelho e da experiência do examinador (Baker &
Soo, 2002).
1.3. Isoflavona de Soja
Atualmente, muito se tem estudado sobre as alternativas à TH
convencional em mulheres na pós-menopausa (Nedrow et al, 2006). E, entre estas,
estão as isoflavonas da soja. Durante os últimos 20 anos uma grande quantidade de
pesquisas sobre os efeitos benéficos do consumo de soja e seus derivados tem sido
realizada. A isoflavona passou a ser estudada desde 1940, quando um problema na
fertilidade foi detectado em ovelhas que pastavam em vegetação rica em trevos que
em roedores, as isoflavonas foram estudadas como possíveis promotoras de
crescimento quando usadas na ração animal, embora mais tarde observou-se
também que poderia ter ação anti-estrogênica. No entanto, antes da década de
1990, a isoflavona não foi útil. A partir de então, devido pesquisas do Instituto
Nacional do Câncer dos Estados Unidos, sugerindo ação preventiva em relação a
algumas doenças, a isoflavona recebeu grande atenção no meio científico.
Posteriormente, ocorreu a descoberta da ação positiva sobre os sintomas de ondas
de calor em mulheres na pós-menopausa. Em 1995, a proteína da soja mostrou-se
eficaz na redução do colesterol e, nessa mesma época, a isoflavona foi utilizada
cada vez mais como alternativa à TH convencional para alívio dos sintomas
vasomotores (Messina, 2010). As isoflavonas da soja são modestamente eficazes
no controle das ondas de calor, como demonstrado em vários estudos em mulheres
na pós-menopausa com pelo menos quatro fogachos ao dia (Nahas et al, 2004;
Nahas et al, 2007; NAMS, 2011). Estudo com pelo menos 12 semanas é,
geralmente, suficiente para avaliar a resposta à terapia. Suplementos com
proporções superiores de genisteína têm mostrado melhor benefício (NAMS, 2011).
As isoflavonas, também chamadas fitoestrogênios, são compostos
derivados de plantas com atividade biológica semelhante ao estrogênio e uma
estrutura química similar à do estradiol. Entre as principais isoflavonas destacam-se
a genisteína, a daidzeína e a gliciteína, presentes na soja (Murkies et al, 1998). São
compostos não esteróides, que se ligam fracamente aos receptores estrogênicos
(menos que 1% da afinidade de ligação do estradiol). A genisteína e daidzeína
ligam-se preferencialmente aos receptores estrogênicos do tipo , presentes no
sistema nervoso central, ossos, parede vascular e trato urogenital. Apresentam
do estradiol (Suthar et al, 2001). Dependendo das concentrações de estradiol e
saturação dos receptores, apresentam ação seletiva, isto é, exibem atividade
estrogênica em alguns tecidos, e antiestrogênicas em outros (Baker et al, 2000;
Wolters & Han, 2004; Branca & Lorenzetti, 2005).
As isoflavonas da soja encontram-se na forma glicosilada na natureza,
biologicamente inativas. Após ingestão ocorre complexo mecanismo enzimático de
conversão no trato gastrointestinal, resultando na formação de fenois heterocíclicos
estruturalmente similares ao 17- -estradiol (Mackey & Eden, 1998). A taxa de
absorção é de 20% a 55% (Wolters & Han, 2004). Decorrente deste fator, as
concentrações dos diferentes metabólitos dos fitoestrogênios e seus efeitos clínicos
têm variação individual mesmo quando controlada a quantidade de isoflavona
administrada, sendo difícil estabelecer a dose ideal. Recomenda-se de 30 a
100mg/dia (Elkind-Hirsch, 2001; Brouns, 2002; Messina & Messina, 2003).
Nos Estados Unidos, o consumo de soja aumentou ao longo dos últimos
15 anos, com um terço dos americanos consumindo suplementos de soja pelo
menos uma vez por mês. Apesar deste aumento, o consumo de soja nos Estados
Unidos mantém-se muito abaixo do asiático. Em 2002, em pesquisa populacional,
The National Health Interview Survey (NHIS) indicou que 9,4% dos adultos norte-americanos relataram uso de suplementos de soja nos últimos 12 meses (Barnes et
al, 2004). Em recente consenso de North American Menopause Society (NAMS)
sobre o papel das isoflavonas da soja na saúde na menopausa, os autores
concluem que mais pesquisas são necessárias para compreender as razões na
saúde para a utilização de soja especificamente em mulheres na pós-menopausa.
suplementos, assim como as potenciais interações com a prescrição médica e as
medicações de balcão (NAMS, 2011).
1.4. Isoflavona de soja e o tecido mamário
O câncer de mama tem menor incidência nos países asiáticos quando
comparado aos ocidentais (Mishra et al, 2003). Elevado consumo de isoflavonas da
soja está associado com redução do risco de câncer de mama em estudos
epidemilógicos (Wu et al, 2008; Goodman et al, 2009; Lee et al, 2009). Propostas
dos mecanismos relacionados com a dieta rica em soja e a possível prevenção dos
tumores malignos incluem a inibição do sistema tirosinaquinase, à supressão da
angiogênese e os efeitos antioxidantes (Kass-Annese, 2000). As propriedades
antioxidantes das isoflavonas parecem ser independentes da ligação com receptores
estrogênicos (Macdonald et al, 2005). As isoflavonas parecem influenciar a
proliferação celular (Wolters & Han, 2004). Em culturas de células de câncer de
mama, a isoflavona da soja demonstra efeito antiproliferativo, dose dependente
(Davis, 2001). Estudos in vitro indicam que atuariam como substância
anti-proliferativa, inibindo a enzima tirosinaquinase (Peterson & Barnes, 1991);
modulando a atividade enzimática dos esteróides (Scott et al, 2008); induzindo a
apoptose (Kiguchi et al, 1994); e inibindo a angiogênese (Fotsis et al, 1995).
Algumas pesquisas mostram que a suplementação da soja no alívio dos sintomas
vasomotores pode ser segura em relação à mama (Nahas et al, 2004; Palacios et al,
2010; Manuella et al, 2011). Ainda, outros estudos associam a alta ingestão de soja
com diminuição no risco de câncer de mama (Cho et al, 2010; Zhang et al, 2010;
significativa de redução do risco de câncer de mama com o aumento do consumo
de alimentos de soja entre as mulheres asiáticas. Comparando com baixa ingestão
de alimentos de soja (<5 mg de isoflavonas/d), o risco foi intermediário com a
ingestão moderada (10 mg de isoflavonas / d) e menor com a ingestão elevada (>20
mg / d). Ingestão de soja em baixo consumo não foi relacionada ao câncer de mama
em populações ocidentais, cujos valores mais altos e mais baixos de ingestão de
isoflavonas foram cerca de 0,8 a 15 mg por dia (Wu et al, 2008a). Entre mulheres
asiáticas, a ingestão de soja está associada a um menor risco de câncer de mama,
sendo que várias linhas de pesquisa sugerem que a proteção máxima é atingida
com uso da isoflavona desde a infância (Messina, & Wu, 2009; NAMS, 2011).
Pesquisas sugerem taxas de câncer de mama três vezes menores em
populações asiáticas, onde o consumo de soja é elevado (Messina et al, 2006; Trock
et al, 2006). Meta-análise de dados de coorte e caso-controle sobre o consumo de
soja e o câncer de mama mostrou pequena redução no risco (Trock et al., 2006).
Enquanto que outro estudo encontrou tendência significativa de redução de risco de
câncer de mama com o consumo crescente de alimentos de soja (Wu et al., 2008a).
Análise de pacientes tratadas de câncer de mama participantes do Shanghai Breast
Cancer Survival Study mostrou que o consumo de alimentos de soja (com média de ingestão de 47mg/dia de isoflavonas) foi inversamente associado com risco de morte
(RR=0,71) e recorrência do câncer de mama (RR=0,68) (Shu et al, 2009). Apesar
desses dados epidemiológicos, os resultados dos estudos de intervenção
disponíveis têm sido conflitantes. Até o momento não foram descritos grandes
ensaios clínicos randomizados de longo prazo, com o poder de avaliar risco do
diferentes fontes alimentares diminuem o risco de câncer de mama (Hopper et al,
2010).
Densidade mamária pode ser considerada um biomarcador do efeito de
um tratamento sobre o tecido mamário (Atkinson & Bingham, 2002). Não há
consenso em relação aos efeitos da isoflavona sobre a densidade mamária, devido
à escassez de estudos na literatura, além de resultados conflitantes (Messina &
Wood, 2008). Em estudo transversal, Nagel et al, avaliando 310 mulheres,
demonstraram relação inversa entre alta ingestão de produtos de soja e a densidade
mamográfica (Nagel et al,2005). Frankenfeld et al, avaliaram a relação entre o
padrão de densidade mamográfica e a capacidade de produção de metabólitos da
daidzeína (equol) em 55 mulheres na pós-menopausa. A densidade foi 39% menor
entre as mulheres produtoras dos metabólitos quando comparadas a não produtoras
(Frankenfeld et al, 2004). Esses resultados foram confirmados por Fuhrman et al,
com 232 mulheres, com idade entre 48 a 82 anos, em que as produtoras de equol
apresentavam menor porcentagem de densidade mamográfica quando comparadas
as não produtoras (Fuhrman et al, 2008). Por outro lado, Ursin et al, em estudo
transversal, avaliando a associação entre a ingestão de soja da dieta e a densidade
mamográfica em 380 mulheres chinesas (50-69 anos de idade), constataram
diferença de 4-5% na densidade entre mulheres do maior quartil e menor quartil de
ingestão (Ursin et al, 2006). Enquanto que outras pesquisas não comprovam
modificações de densidade mamária com uso de dieta rica em soja e seus derivados
(Maskarinec et al, 2003; Verheus et al, 2008; Atkinson et al, 2009; Maskarinec et al,
2009; Lee et al, 2010).
Em 2010, em revisão sistemática e meta-análise do efeito da isoflavona
apresentaram critérios para serem incluídos na análise (Hooper et al, 2010). Entre
os estudos avaliados, dois estudos empregavam a isoflavona da Red clover
(Atkinson et al, 2004; Powles et al, 2008), três estudos avaliaram mulheres na pré
menopausa (Maskarinec et al, 2002 e 2004; Tice et al, 2005), e apenas 3 estudos
analisaram a isoflavona de soja sobre a densidade mamográfica em mulheres na
pós menopausa (Marini et al, 2008; Verheus et al, 2009; Maskarinec et al, 2009).
Marini et al, em estudo duplo-cego, placebo controlado, avaliaram o efeito da
genisteína (54mg/dia) sobre o metabolismo ósseo de 138 mulheres osteogênicas.
Durante intervenção de 3 anos, estudando a segurança sobre o tecido mamário, os
autores não encontraram mudanças significativas na densidade mamográfica (Marini
et al, 2008). Verheus et al, em estudo duplo-cego, placebo controlado, avaliaram os
efeitos do consumo da soja sobre a densidade mineral óssea, função cognitiva e
bem estar de mulheres na pós-menopausa. Essas foram randomizadas para receber
proteína da soja (100mg/isoflavona/dia, n=70) ou proteína do leite (controle, n=56)
durante um ano. Na análise das mamografias, observou-se diminuição da densidade
mamária em ambos os grupos, sem diferença significativa (Verheus et al, 2008).
Maskarinec et al realizaram estudo clinico, multicêntrico, duplo-cego, placebo
controlado, com 303 mulheres na pós-menopausa, randomizadas para receber
80mg ou 120mg de isoflavona da soja ou placebo, tendo como objetivo principal o
estudo da densidade mineral óssea. Em análise das mamografias pré e pós dois
anos de intervenção, as diferentes doses de suplementação de isoflavona de soja
não modificaram a densidade mamográfica (Maskarinec et al, 2009).
Evidências de ensaios clínicos randomizados indicam que consumo de
alimentos de soja não aumenta a densidade mamária como relatado com a TH, além
proteção contra o câncer de mama. Assim, novasabordagens de imagem de mama,
como o ultrassom, podem ser úteis para compreender as influências nutricionais na
densidade da mama em mulheres (Maskarenic et al, 2010). Contudo, até o momento
não há estudos na literatura que avaliem o efeito da isoflavona de soja sobre o
parênquima mamário por meio da ultrassonografia.
Dessa forma, a realização deste estudo se justifica com o intuito de
avaliar a possível influência da isoflavona sobre o tecido mamário, pela mamografia
e pela ultrassonografia.
Referências
ACS- American Cancer Society. Breast Cancer Facts & Figures 2009-2010. http://www.cancer.org
ACR- American College of Radiology: Breast Imaging Reporting and Data System (BIRADS). Reston, VA: American College of Radiology;1993.
Adashi EY. The climateric ovary as a functional gonadotrofin-driven androgen-producing gland. Fertil Steril. 1994; 62:20-7.
Anderson GL, Chlebowoski RT, Aragaki AK, Kuller LH, Manson JE, Gass M, et al. Conjugated equine estrogen and breast cancer incidence and mortality in postmenopausal women with hysterectomy: extended follow-up of the Women’s Health Initiative randomized placebo-controlled trial. Lancet Oncol. Forthcoming 2012.
Andres S, Abraham K, Appel KE, Lampen A. Risks and benefits of dietary isoflavones for câncer. Crit Rev Toxicol. 2011; 41(6):463-506.
Atkinson C, Bingham SA. Mammographic breast density as a biomarker of effects of isoflavones on the female breast. Breast Cancer Res 2002;4:1-4
Atkinson C, Warren RM, Sala E, Dowsett M, Dunning AM, Healey CS, et al. Red-clover-derived isoflavones and mammographic breast density: a double-blind, randomized, placebo-controlled trial. Breast Cancer Res 2004;6:R170–R179.
Baker JA, Soo MS. Breast US: assessment of technical quality and image interpretation. Radiology. 2002;223(1):229-38.
Baker VL, Leitman D, Jaffe RB. Selective estrogen receptor modulators in reproductive medicine and biology. Obstet Gynecol Surv 2000;55(suppl 2):S21-S47. Banks E, Reeves G, Beral V, Bull D, Crossley B, Simmonds M, et al. Influence of personal characteristics of individual women on sensitivity and specificity of mammography in the Million Women Study: cohort study. Br Med J. 2004;329:477-85.
Barnes PM, Powell-Griner E, McFann K, Nahin RL. Complementary and alternative medicine use among adults: United States, 2002. Adv Data 2004;343:1-19.
Boyd NF, Martin LJ, Bronskill M, Yaffe MJ, Duric N, Minkin S. Breast tissue composition and susceptibility to breast cancer. J Natl Cancer Inst 2010;102:1224– 1237.
Boyd NF, Martin LJ, Yaff MJ, Minkin S. Mammographic density and breast cancer risk: current understanding and future prospects. Breast Cancer Research 2011;13:223-35.
Branca F, Lorezentti S. Health effects of phytoestrogens. Forum Nutr 2005;57:100-11.
Brouns F. Soya isoflavones: a new and promising ingredient for the health foods sector. Food Res Int 2002;35:187-93.
Buist DS, Porter PL, Lehman C, Taplin SH, White E: Factors contributing to mammography failure in women aged 40-49 years. J Natl Cancer Inst 2004, 96:1432-1440.
Castelo-Branco C, Blümel JE, Chedraui P, Calle A, Bocanera R, Depiano E, et al. Age at menopause in Latin America. Menopause. 2006; 13:706-12.
Checka CM, Chun JE, Schnabel FR, Lee J, Toth H. The relationship of mammographic density and age: Implications for breast cancer screening. AJR 2012;198:W292–W295.
Chen FP, Cheung YC, Soong YK. Factors that influence changes in mammographic density with postmenopausal hormone therapy. Taiwan J Obstet Gynecol. 2010; 49(4):413-8.
Chlebowski RT, Anderson GL. The Influence of Time From Menopause and Mammography on Hormone Therapy–Related Breast Cancer Risk Assessment. J Natl Cancer Inst 2011; 103(4):284-5.
Clemons M, Goss P. Estrogen an the risk of breast cancer. N Engl J Med 2001; 344:276-85.
D’Orsi CJ, Bassett LW, Berg WA, Feig SA, Jacksonn VP, Kopans DB, et al. BI-RADS: mammography. 4th ed. In: D’Orsi CJ, Mendelson EB, Ikeda DM et al. Breast Imaging Reporting and Data System: ACR BI-RADS- breast imaging atlas. Reston, VA: American College of Radiology; 2003.
Davis SR. Phytoestrogen therapy for menopausal symptoms?: there’s no good evidence that it’s any better than placebo. Br Med J. 2001;323:354-5.
Dong JY, Qin LQ. Soy isoflavones consumption and risk of breast câncer incidence or recurrence: a meta-analysis of prospective studies. Breast Cancer Res Treat. 2011; 125(2):315-23.
Elkind-Hirsch K. Effect of dietary phytoestrogens on hot flushes: can soy-based proteins substitute for traditional estrogens replacement therapy? Menopause 2001; 8:154-6.
Fotsis T, Pepper M, Adlercreutz H, Hase T, Montesano R, Schweigerer L. Genistein, a dietary ingested isoflavonoid, inhibits cell proliferation and in vitro angiogenesis. J Nutr. 1995; 125:790S-7.
Frankenfeld CL, McTiernan A, Aiello EJ, Thomas WK, LaCroix K, Schramm J, et al. Mammographic density in relation to daidzein-metabolizing phenotypes in overweight, postmenopausal women. Cancer Epidemiol Biomarkers Prev. 2004; 13(7):1156-62.
Fuhrman BJ, Teter BT, Barba M, Byrne C, Cavalleri A, Grant BJ, et al. Equol status modifies the association of soy intake and mammographic sensity in a sample of postmenopausal women. Cancer Epidemiol Biomarkers Prev. 2008;17(1):33-42.
Geirard B, Guldenfels C, Haehnel P, Mathelin C. Breast density: a major parameter to follow during hormone replacement therapy. Gynecol Obstet Fertil. 2009; 37(7-8):657-60.
Ghosh K, Brandt KR, Reynolds C, Scott CG, Pankratz VS, Riehle DL, et al. Tissue composition of mammographically dense and non-dense tissue. Breast Cancer Res Treat. 2012;131(1):267-75.
Glide C, Duric N, Littrup P: Novel approach to evaluating breast density utilizing ultrasound tomography. Med Phys 2007, 34:744-753.
Goodman MT, Shvetsov VB, Wilkens LR, Franke AA, Le Marchand L, Kakazu KK, et al. Urinary phytoestrogen excretion and postmenopausal breast cancer risk: the multiethnic cohort study. Cancer Prev Res. 2009;2:887-92.
Haagensen CD. Anatomia da glândula mamária. In: Doenças da mama. São Paulo: Roca; 1989. cap.1, p.1-47.
Hinz B. Formation and function of the myofibroblast during tissue repair. J Invest Dermatol 2007, 127:526-537.
Hooper L, Madhavan G, Tice JA, Leinster SJ, Cassidy A. Effects of isoflavones on breast density in pré- and post-menopausal women: a systematic review and meta-analysis of randomized controlled trials. Hum Reprod Update. 2010; 16(6):745-60.
Humphrey LL. Hormone replacement therapy and breast cancer [Internet]. [access 2011/11/23]. Rockville: Agency for Healthcare Research and Quality; 2002. Available from: http://www.ncbi.nlm.nih.gov/books/ NBK42725/
Instituto Brasileiro de Geografia e Estatística [Internet]. Painel do censo 2010 [acesso 2011/12/13]. Disponível em: www.censo2010.ibge.gov.br
Inca- Instituto Nacional de Câncer do Ministério da Saúde. http://www2.inca.gov.br/wps/wcm/connect/tiposdecancer/site/home/mama.
Jaffe RB. The menopause and perimenopausal period. In: Yen S, Jaffe RB. Reproductive endocrinology. Philadelphia: WB Saunders Company; 1991. cap.14, p.406-23.
Kass-Annese B. Alternative therapies for menopause. Clin Obstet Gynecol 2000; 43:162-83.
Kerlikowske K, Ichikawa L, Miglioretti DL, Buist DS, Vacek PM, Smith-Bindman R, et al. Longitudinal measurement of clinical mammographic breast density to improve estimation of breast cancer risk. J Natl Cancer Inst. 2007; 99(5):386-95.
Kerlikowske K, Cook AJ, Buist DS, Vachon C, Vacek P, et al. Breast cancer risk by breast density, menopause, and postmenopausal hormone therapy use. J Clin Oncol. 2010;28(24):3830-7.
Kiguchi K, Glesne D, Chubb CH, Fujiki H, Huberman E. Differential induction of apoptosis in human breast tumor cells by okadaic acid and related inhibitors of protein phosphatases 1 and 2ª. Cell Growth Differ. 1994; 5:995-1004.
Kolb TM, Lichy JL, Newhouse JH. Comparison of the performance of screening mammography, physical examination, and breast ultrasound and evaluation of factors that influence them: An analysis of 27,825 patient evaluations. Radiology 2002;225(1):165–175.
Laya MB, Larson EB, Taplin SH, White E. Effect of estrogen replacement therapy on the specificity and sensitivity of screening mammography. J Natl Cancer Inst 1996; 88:643-9.
Hooper L, Madhavan G, Tice JA, Leinster SJ, Cassidy A. Effects of isoflavones on breast density in pré- and post-menopausal women: a systematic review and meta-analysis of randomized controlled trials. Hum Reprod Update. 2010; 16(6):745-60.
Lécuru F, Laforest H, Darles C, Taurelle R. Does hormone replacement therapy increase the risk of breast cancer? Eur J Obstet Gynecol Reprod Biol 1995; 62:159-66.
Lee SA, Shu XO, Li H, Yang G, Cai H, Wen W, et al. Adolescent and adult soy food intake and breast cancer risk: results from the Shanghai Women’s Health Study. Am J Clin Nutr. 2009;89:1920-6.
MacDonald RS, Guo J, Copeland J, Browning JD Jr, Sleper D, Rottinghaus GE, et al. Enviromental influences on isoflavones and saponins in soybeans and their role in colon cancer. J Nutr. 2005;135:1239-42.
Mackey R, Eden J. Phytoestrogens and the menopause. Climateric 1998; 1:302-8. Madjar H. Role of Breast ultrasound for the detection and differentiation of breast lesions. Breast Care 2010;5:109–114.
Mannella P, Tosi V, Russo E, Zulino S, Pancetti F, Gompal S, et al. Effects of red clover extracts on breast câncer cell migration and invasion. Gynecol Endocrinol. 2011. doi: 10.3109/0951 3590. 2011. 579660.
Marini H, Bitto A, Altavilla D, Burnett BP, Polito F, Di Stephano V, et al. Breast safety and efficacy of genistein aglycone for postmenopausal bone loss: a follow-up study. J Clin Endocrinol Metab 2008;93:4787–4796.
Martin LJ, Boyd NF. Potential mechanisms of breast cancer risk associated with mammographic density: hypotheses based on epidemiological evidence. Breast Cancer Res. 2008; 10:201.
Maskarinec G, Williams AE, Inouye JS, Stanczyk FZ, Franke AA. A randomized isoflavone intervention among premenopausal women. Cancer Epidemiol Biomarkers Prev 2002;11:195–201.
Maskarinec G, Williams AE, Carlin L. Mammographic densities in a one-year isoflavone intervention. Eur J Cancer Prev. 2003; 12(2):165-9.
Maskarinec G, Takata Y, Franke AA, Williams AE, Murphy SP. A 2-year soy intervention in premenopausal women does not change mammographic densities. J Nutr 2004;134: 3089–94.
Maskarinec G, Takata Y, Chen Z, Gram IT, Nagata C, Pagano I, et al. IGF-1 and mammographic density in four geographic locations: a pooled analysis. Int J Cancer. 2007; 121(8):1786-92
Maskarinec G, Verheus M, Tice JA. Epidemiologic studies of isoflavones and mammographic density. Nutrients 2010;2:35-48.
McCormack VA, dos Santos Silva I. Breast density and parenchymal patterns as markers of breast cancer risk: a metaanalysis. Cancer Epidemiol Biomarkers Prev 2006;6:1159–69.
McTiernan A, Chlebowski RT, Martin C, Peck JD, Aragaki A, Pisano ED, et al. Conjugated equine estrogen influence on mammographic density in postmenopausal women in a substudy of the women's health initiative randomized trial. J Clin Oncol. 2010;28(24):3830-7.
Messina M, Messina V. Provisional recommended soy protein and isoflavone intakes for health adults: rationale. Nutr Today 2003;38:100-9.
Messina M, McCaskill-Stevens W, Lampe JW. Addressing the soy and breast cancer relationship: review, commentary, and workshop proceedings. J Natl Cancer Inst 2006;98:1275–1284.
Messina MJ, Wood CE. Soy isoflavones, estrogen therapy, and breast câncer risk: analysis and commentary. Nutr J. 2008; 7:17.
Messina M, Wu AH. Perspectives on the soy-breast câncer relation. Am J Clin Nutr. 2009; 89(5):1673S-9.
Messina M. A brief historical overview of the past two decades of soy and isoflavone research. J Nutr. 2010; 140(7):1350S-4.
Mishra SI, Dickerson V, Najm W. Phytoestrogens and breast cancer prevention: What is the evidence? Am J Obstet Gynecol 2003;188(suppl 5):S66-S70.
Moon WK, Shen YW, Huang CS, Luo SC, Kuzucan A, Chen JH, et al. Comparative study of density analysis using automated whole breast ultrasound and MRI. Med Phys. 2011;38(1):382-9.
Murkies AL, Wilcox G, Davis SR. Phytoestrogens. J Clin Endocrinol Metab 1998; 83:297-303.
Nahas EAP, Nahas-Neto J, De Luca L, Traiman P, Pontes A, Dalben I. Benefits of soy germ isoflavone in postmenopausal women with contraindications for conventional of hormone replacement therapy. Maturitas 2004;48:372-80.
Nahas EA, Nahas-Neto J, Orsatti FL, Carvalho EP, Oliveira ML, Dias R. Efficacy and safety of a soy isoflavone extract in postmenopausal women: a randomized, double-blind, and placebo-controlled study. Maturitas 2007;58(3):249-58
NAMS - The role of soy isoflavones in menopausal health: report of The North American Menopause Society/ Wulf H. Utian Translational Science Symposium in Chicago, IL (October, 2010). Menopause 2011;18(7):732-53.
Nedrow A, Miller J, Walker M, Nygren P, Huffman LH, Nelson HD. Complementary and alternative therapies for the management of menopause-related symptoms: a systematic evidence review. Arch Intern Med 2006;166(14):1453-65.
Nelson HD. Menopause. Lancet 2008;371:760–70
Njor SH, Hallas J, Schwarts W, Lynge E, Pedersen AT. Type of hormone therapy and risk of misclassification at mammography screening. Menopause. 2011; 18(2):171-7.
Palacios S, Pornel B, Vázquez F, Aubert L, Chantre P, Marès P. Long-term endometrial and breast safety of a specific, standardized soy extract. Climateric. 2010; 13(4):368-75.
Peterson G, Barnes S. Genistein inhibition of the growth of human breast cancer cells: independence from estrogen receptors and the multi-drug resistence gene. Biochem Biophys Res Commun. 1991; 179:661-77.
Pessoa EC, Rodrigues JRP, Kamiya CP, Morceli J, Nabuco JJG, Vespoli HML, et al. Quais as características propostas pelo Birads-US que melhor diferenciam nódulos malignos dos benignos? Rev Bras Ginecol Obstet 2007; 29(12):605-66.
Powles TJ, Howell A, Evans DG, McCloskey EV, Ashley S, Greenhalgh R et al. Red clover isoflavones are safe and well tolerated in women with a family history of breast cancer. Menopause Int 2008;14:6–12
Ravert PK, Huffaker C. Breast cancer screening in women: An integrative literature review. J Am Acad Nurse Pract 2010;22:668–673.
Schousboe JT, Kerlikowske K, Loh A, Cummings SR. Personalizing mammography by breast density and other risk factors for breast cancer: analysis of health benefits and cost-effectiveness. Ann Intern Med 2011; 155(1):10-20.
Scott LM, Xu X, Veenstra TD, Tooze JA, Wood CE, Register TC, et al. Past oral contraceptive use and current dietary soy isoflavones influence estrogen metabolism in post-menopausal monkeys (Macaca fascicularis). Cancer Epidemiol Biomarkes Prev 2008; 17:2594-2602.
Shu XO, Zheng Y, Cai H, Gu K, Chen Z, Zheng W, et al. Soy Food Intake and Breast Cancer Survival. J Am Med Assoc 2009;302:2437–2443.
Smith RA, Saslow D, Sawyer KA, Burke W, Costanza ME, Evans WP 3rd, et al.
American Cancer Society guidelines for breast cancer screening: update 2003. CA Cancer J Clin. 2003;53(3):141-69.
Stephen RL, Shaw LE, Larsen C, Corcoran D, Darbre PD. Insulin-like growth factor receptor levels are regulated by cell density and by long term estrogen deprivation in MCF 7 human breast câncer cells. J Biol Chem. 2001; 276:40080-6.
Sung J, Song YM, Stone J, Lee K, Kim SY. Association of body size measurements and mammographic density in Korean women: the Healthy Twin study. Cancer Epidemiol Biomarkers Prev. 2010 Jun;19(6):1523-31.
Tabár L, Vitak B, Chen TH, Yen AM, Cohen A, Tot T, et al. Swedish two control-trial: impact of mammographic screening on breast cancer mortality during 3 decades. Radiology. 2011;260(3): 658-63.
Tamimi RM, Cox DG, Kraft P, Pollak MN, Haiman CA, Cheng I, et al. Common genetic variation in IGF-1, IGFBP-1, and IGFBP-3 inrelation to mammographic density: a cross-sectional study. Breast Cancer Res. 2007; 9(1):R18.
Taverne CW, Verheus M, McKay JD, Kaaks R, Canzian F, Grobbee DE, et al. Common genetic variation of insulin-like growth factor-binding protein 1 (IGFBP-1), IGFBP-3, and acid labile subunit in relation to serum IGF-1 levels and mammographic density. Breast Cancer Res Treat. 2010; 123(3):843-55.
Tice JA, Guthrie N, Shepherd J, Kerlikowske K, Esserman L. Soy for the Prevention of Breast Cancer—a randomized trial. Era of Hope meeting Baltimore, MD 8–11 June 2005.
Trock BJ, Hilakivi-Clarke L, Clarke R. Meta-analysis of soy intake and breast cancer risk. J Natl Cancer Inst 2006;98:459–471.
Ursin G, Sun CL, Koh WP, Khoo KS, Gao F, Wu AH, et al. Associations between soy, diet, reproductive factors, and mammographic density in Singapore Chinese women. Nutr Cancer. 2006; 56(2):128-35.
Valko M, Izakovic M, Mazur M, Rhodes CJ, Talser J: Role of oxygen radicals in DNA damage and cancer incidence. Mol Cell Biochem 2004, 266:37-56.
Van Duijnhoven FJ, Peeters PH, Warren RM, Bingham SA, van Noord PA, Monninkhof EM, et al. Postmenopausal hormone therapy and changes in mammographic density. J Clin Oncol. 2007; 25(11):1323-8.
Varghese JS, Thompson DJ, Michilidou K, Lindström S, Turnbull C, Brown J, et al. Mammographic breast density and breast cancer: evidence of a shared genetic basis. Cancer Res. 2012;72(6):1478-84.
Veronesi U, Boyle P, Goldhirsch A, Orecchia R, Viale G: Breast cancer. Lancet 2005;365:1727-1741.
Verheus M, Van Gils CH, Kreijkamp-Kaspers S, Kok L, Peeters PHM, Grobbee DE, et al. Soy protein containing isoflavones and mammographic density in a randomized controlled trial in postmenopausal women. Cancer Epidemiol Biomarkers Prev. 2008; 17(10):2632-8.
Yaffe MJ. Measurement of mammographic density. Breast Cancer Research 2008;10:209-19.
WHI –Writing group for the Women’s Health Initiative (WHI) Investigators. Risks and Benefits of Estrogen plus Progestin in Healthy Post Menopausal Women. JAMA 2002;288:321-33.
WHI - The Women’s Health Initiative (WHI) Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. JAMA 2004;291:1701-12.
Wolfe JN. Breast patterns as na index of risk for developing breast cancer. Am J Roentgenol 1976; 126:1130-9.
Wolters M, Hahn A. Soy isoflavones: a therapy for menopausal symptoms? Wien Med Wochenschr 2004;154:334-41.
Woolcott CG, Cook LS, Courneya KS, Boyd NF, Yaffe MJ, Terry T, et al. Associations of overall and abdominal adiposity with area and volumetric mammographic measures among postmenopausal women. Int J Cancer. 2011 Jul 15:129(2):440-8.
Wu AH, Koh WP, Wang R, Lee HP, Yu MC. Soy intake and breast cancer risk in Singapore Chinese Health study. Br J Cancer 2008;99:196-200.
Wu AH, Yu MC, Tseng CC, Pike MC. Epidemiology of soy exposures and breast cancer risk. Br J Cancer 2008a;98:9-14.
PEQUENA QUANTIDADE (< 25%) DE TECIDO FIBROGLANDULAR
2. OBJETIVOS
2.1. Objetivo Geral
Avaliar o tecido mamário em mulheres na pós-menopausa usuárias de
isoflavona de soja.
2.2. Objetivos Específicos
2.2.1. Avaliar o efeito da isoflavona da soja sobre a densidade mamária pela
mamografia.
2.2.2. Avaliar o efeito da isoflavona da soja sobre o parênquima mamário pela
PEQUENA QUANTIDADE (< 25%) DE TECIDO FIBROGLANDULAR
3. PUBLICAÇÃO
Avaliação do Tecido Mamário em Mulheres na Pós-Menopausa Usuárias de Isoflavona da Soja: Estudo Randomizado, Duplo-cego e Placebo Controlado
Evaluation of Breast Tissue in Postmenopausal Women Users of Soy Isoflavone:
Randomized, Double-blind, and placebo-controlled clinical trial
Armando Delmanto1, Jorge Nahas Neto2, Gilberto Uemura³, Eduardo Carvalho
Pessoa³, Paulo Traiman¹, Eliana Aguiar Petri Nahas2
1 Programa de Pós-graduação em Ginecologia, Obstetrícia e Mastologia da Faculdade de
Medicina de Botucatu – UNESP.
2 Setor de Climatério & Menopausa da Faculdade de Medicina de Botucatu
– UNESP.
3 Centro de Avaliação em Mastologia (CAM) da Faculdade de Medicina de Botucatu -
Resumo
Objetivo: Avaliar o efeito da isoflavona da soja sobre o tecido mamário em mulheres na pós-menopausa.
Métodos: Trata-se de estudo clínico, prospectivo, randomizado, duplo-cego, placebo controlado, envolvendo 80 mulheres na pós-menopausa com sintomas
vasomotores, idade entre 45 a 70 anos, acompanhadas no Ambulatório de
Climatério e Menopausa da Faculdade de Medicina de Botucatu-Unesp, de janeiro
de 2005 a dezembro de 2006. Na randomização, 40 pacientes receberam 100 mg
isoflavona da soja/dia (duas cápsulas de 125 mg de extrato seco de glicine Max) e
40 pacientes placebo (duas cápsulas de lactose) durante 10 meses. A densidade
mamária (DM) foi avaliada pela mamografia e o parênquima mamário pela
ultrassonografia de mamas no início e após dez meses de seguimento. Para análise
estatística foram utilizados o teste t-Student, ANOVA, teste de Mann-Whitney e teste
do Qui-Quadrado.
Resultados: Na comparação das características clínicas iniciais entre os grupos de usuárias de isoflavona e placebo, não houve diferenças significantes, com valores
médios de idade de 55,1±6,0 e 56,2±7,7 anos, tempo de menopausa de 6,6±4,8 e
7,1±4,2 anos e IMC de 29,7±5,0 e 28,5±4,9 kg/m2, respectivamente (p>0,05).
Concluíram o estudo, 32 pacientes sob isoflavona e 34 no grupo placebo. Na
comparação da densidade mamográfica entre os momentos inicial e final, não houve
diferença estatisticamente significativa. Na avaliação do parênquima mamário pela
ultrassonografia, não houve diferença entre os grupos. Na comparação entre os
momentos dentro de cada grupo, não foram constatadas diferenças significativas
Conclusão: No período de 10 meses, o uso de isoflavona de soja não modificou o tecido mamário, avaliado pela mamografia e ultrassonografia, em mulheres na
Abstract
Objective: To evaluate the effect of soy isoflavone on breast tissue in postmenopausal women.
Methods: This study is a prospective, randomized, double-blind, placebo-controlled trial involving 80 postmenopausal women with vasomotor symptoms, aged 45-70
years, followed in Climacteric and Menopause Clinic of the Botucatu Medical
School-UNESP, from January 2005 to December 2006. At randomization, 40 patients
received 100 mg of soy isoflavone/day (two capsules of 125 mg standardized soy
extract, Glicine max) and 40 patients, placebo (two capsules of lactose) for 10
months. The breast density was evaluated by mammography and breast
parenchyma by ultrasound, at baseline and after ten months of follow-up. The
Student t-test, ANOVA, Mann-Whitney and Chi-Square were used in the statistical
analysis.
Results: In comparison of baseline clinical characteristics between the isoflavone and placebo groups, there were no significant differences, with mean age of 55.1 ±
6.0 and 56.2 ± 7.7 years, duration of menopause 6.6 ± 4.8 and 7.1 ± 4.2 years and
BMI 29.7 ± 5.0 and 28.5 ± 4.9 kg/m2, respectively (p> 0.05). Concluded the study, 32
patients on isoflavone and 34 in the placebo group. In comparison in mammographic
density (MD) between moments, baseline and final, there was no difference
statistically significant. In the evaluation of breast parenchyma by ultrasound, there
was no difference between groups. In comparing the moments within each group,
there were no significant differences in the parameters of mammography and
Introdução
Atualmente, muito se tem estudado sobre as alternativas à terapia
hormonal (TH) convencional em mulheres na pós-menopausa (Nedrow et al, 2006).
Dentre estas, estão as isoflavonas da soja (NAMS, 2011). Durante os últimos 20
anos uma grande quantidade de pesquisas sobre os efeitos benéficos do consumo
de soja e seus derivados tem sido realizada (Messina, 2010). As isoflavonas da soja
são modestamente eficazes no controle das ondas de calor, como demonstrado em
vários estudos em mulheres na pós-menopausa (Nahas et al, 2004; Nahas et al,
2007; NAMS, 2011). Pesquisas mostram que a suplementação da soja no alívio dos
sintomas vasomotores parece ser segura em relação à mama (Nahas et al, 2004;
Palacios et al, 2010; Manella et al, 2011). Além disso, o elevado consumo de
isoflavona da soja está associado com redução do risco de câncer de mama em
vários estudos epidemilógicos (Wu et al, 2008; Goodman et al, 2009; Lee et al, 2009;
Cho et al, 2010; Zhang et al, 2010; Andres et al, 2011; Dong & Qin, 2011). Isto é
observado principalmente em populações asiáticas onde as taxas de câncer de
mama são três vezes menores devido ao alto consumo de soja (Messina et al, 2006;
Trock et al, 2006). Apesar dos dados epidemiológicos, os resultados dos estudos de
intervenção disponíveis são escassos (Messina & Wood, 2008). Até o momento não
foram descritos grandes ensaios clínicos randomizados de longo prazo, com o poder
de avaliar o risco do câncer de mama e uso de isofalvona da soja. Não está claro se
as isoflavonas de diferentes fontes alimentares diminui o risco de câncer de mama
(Hopper et al, 2010).
A densidade mamária pode ser considerada um biomarcador do efeito de
influenciada pela reposição exógena de hormônios por tempo prolongado
(Kerlikowske et al, 2010). O uso de estrogênios associados com progestagênios
aumenta o risco de erro na classificação (falso positivo) pela mamografia de
rastreamento, por influenciar negativamente aumentando a densidade mamária (Njor
et al, 2011). Em 2010, por meio de uma meta-análise, avaliou-se o efeito da
isoflavona sobre a densidade mamária (Hooper et al, 2010). Entre os estudos
incluídos, dois empregavam a isoflavona da red clover (Atkinson et al, 2004; Powles
et al, 2008), três avaliaram mulheres na pré-menopausa (Maskarinec et al, 2002 e
2004; Tice et al, 2005), e apenas três analisaram a isoflavona de soja sobre a
densidade mamária em mulheres na pós-menopausa (Marini et al, 2008; Verheus et
al, 2009; Maskarinec et al, 2009). Apesar da escassa literatura, evidências indicam
que o consumo de isoflavona de soja parece não aumentar a densidade
mamográfica em mulheres na pós-menopausa, como relatado com a TH (Hooper et
al, 2010, Kerlikowske et al, 2010; Njor et al, 2011). Ainda, é possível que a
exposição por longo prazo possa oferecer alguma proteção contra o câncer de
mama.
Baseado neste contexto, o objetivo do presente estudo foi avaliar o efeito
da isoflavona da soja sobre a densidade mamária pela mamografia e sobre o
Métodos
1. Desenho do Estudo e Seleção da Amostra
No presente estudo, empregou-se dados a partir de um estudo clinico
prospectivo, randomizado, duplo-cego e placebo-controlado, para avaliar a eficácia
da isoflavona da soja em mulheres na pós-menopausa (Nahas et al, 2007). O grupo
populacional foi constituído de 80 mulheres na pós-menopausa, acompanhadas no
Ambulatório de Climatério e Menopausa do Hospital das Clínicas da Faculdade de
Medicina de Botucatu – UNESP de janeiro de 2005 a dezembro de 2006. O cálculo
do tamanho amostral foi embasado no estudo de Nahas et al (2004) que
encontraram melhora dos sintomas vasomotores em 40% dos casos tratados com
isoflavona de soja. Considerando a razão de um caso para um controle, intervalo de
confiança de 95% e um erro tipo II de 10% (poder do teste de 90%), foi estimado a
necessidade de avaliar 40 pacientes por grupo. Foram incluídas no estudo mulheres
com: (1) idade ≥ 45 anos; (2) data da última menstruação há pelo menos 12 meses;
(3) valores de FSH superior a 40 mIU/ml; e (4) presença de sintomas vasomotores
(mínimo de 5 ondas de calor por dia). E não incluídas aquelas com: (1) dieta
vegetariana, macrobiótica ou rica em soja; (2) história de doenças crônicas do trato
gastrointestinal; (3) uso de terapêutica hormonal ou de fitoestrogênios até seis
meses antes do estudo; (4) antecedente pessoal de doença cardiovascular ou
tromboembolismo; (5) antecedente pessoal de câncer de mama, mamoplastia
redutora ou prótese mamária; (6) antecedente pessoal de câncer de endométrio; (7)
história de hepatopatias agudas; (8) etilistas. Foram esclarecidos, para as pacientes
as assinaturas do Termo de Consentimento Livre e Esclarecido (TCLE), exigência
da resolução nº 196/outubro/1996 do Conselho Nacional de Saúde, após aprovação
pelo Comitê de Ética e Pesquisa da Faculdade de Botucatu – UNESP (Anexo 1).
Preliminarmente, todas as pacientes foram submetidas à anamnese,
exame físico geral, especial e ginecológico. Na anamnese geral foram obtidos os
seguintes dados: idade, menarca, idade e tempo de menopausa, paridade, pressão
arterial, tabagismo, peso, altura, circunferência da cintura. Todos os sujeitos da
pesquisa realizaram colpocitologia oncótica, exames bioquímicos, função tireoidiana,
mamografia e ultrassonografia transvaginal e mamária. Após esse período de
seleção, as pacientes recrutadas foram randomizadas em seqüência de numeração
pré-estabelecida, em dois grupos:
- Grupo ISO: 40 usuárias de isoflavona (Glycine max).
- Grupo PL: 40 usuárias de placebo
Um processo de randomização computadorizado foi realizado
empregando um software estatístico específico. O pesquisador e as pacientes não
tiveram conhecimento prévio dos referidos grupos e das diferentes numerações,
apenas o farmacêutico responsável. Assim, 40 pacientes receberam 100 mg de
isoflavona da soja, referentes a duas cápsulas ao dia de 125 mg de extrato seco de
Glycine max L. (Menop , Ativus Farmacêutica, Brasil), por via oral, divididas em
duas tomadas, durante dez meses. O extrato padronizado contém aproximadamente
50% de genisteína e 35% de daidzeína. As outras 40 pacientes receberam duas
cápsulas ao dia, por via oral, de lactose. As cápsulas eram idênticas e apresentavam
as embalagens numeradas em código pelo farmacêutico para impedir a identificação
do grupo em teste pelos participantes do estudo. Todas participantes foram
ao tratamento. O tempo de seguimento foi de dez meses; 32 pacientes no grupo
isoflavona e 34 no grupo placebo finalizaram o presente estudo (Figura 1).
Figura 1- Fluxograma do estudo
2. Metodologia
2.1. Avaliação antropométrica
Foram obtidos os seguintes dados para avaliação antropométrica: peso,
altura, índice de massa corpórea (IMC=peso/ altura2) e circunferência da cintura
(CC). Para mensuração do peso, utilizou-se balança antropométrica eletrônica, tipo
plataforma da marca Filizola®, graduada a cada 100g, capacidade até 150 kg, com
precisão de 0,1 kg, com a paciente descalça e com o mínimo de roupa. A estatura
foi determinada em estadiômetro vertical afixado a balança, com precisão de 0,1cm,