M
ARIA
L
UIZA
G
AZZANA
Avaliação Ecocardiográfica do Ventrículo Direito
e da Pressão Arterial Pulmonar em Portadores de
Hipertireoidismo
Tese apresentada ao Programa de
Pós-graduação “Fisiopatologia em Clínica
Médica” da Faculdade de Medicina de
Botucatu, Universidade Estadual Paulista Júlio de Mesquita Filho – UNESP, para
obtenção do título de Doutor.
Orientador: Prof. Adjunto Katashi Okoshi
BOTUCATU
A meu marido, Jean, companheiro em todos os momentos
da minha vida nos últimos vinte anos, e fonte de minha
inspiração, admiração e respeito.
A meu filho, Luiz Henrique, que modifica e amplifica
minha visão de mundo e das pessoas a cada dia.
A meu orientador, Professor Katashi Okoshi, minha imensa gratidão por ter aceito a
orientação desse trabalho, e apesar de todas as dificuldades impostas pela grande
distância, permitiu o andamento da tese. Não tenho dúvidas que isso só foi possivel por
sua dedicação incansável ao trabalho, sua seriedade e generosidade.
Ao Dr. Jean Jorge Souza, por ter me encaminhado todos os pacientes desse trabalho,
sempre visando oferecer o melhor para os pacientes.
A Professora Dra. Marina Politi Okoshi, por seu acolhimento e simpatia que sempre
me recebeu nas várias oportunidades que nos encontramos.
Ao Prof. Dr. João Carlos Hueb e à Profª. Dra. Silméia Garcia Zanati Bazan pelas
inestimáveis contribuições no exame de qualificação.
Ao Professor Luiz Matsubara e demais membros da Comissão de Pós-Graduação
pelo apoio durante o processo de seleção.
Ao Dr. José Wilson Cavalcante, professor da minha residência de clínica médica e
meu atual chefe, por permitir minhas liberações para cursar as disciplinas e terminar
o trabalho.
A meus sogros, Jorge e Ivanilde, por ter ajudado a cuidar do meu filho, durante
minhas ausências.
Aos funcionários do Departamento de Clínica Médica e da Seção de Pós-Graduação
da Faculdade de Medicina de Botucatu pela disponibilidade.
Aos funcionários do Setor de Ecocardiografia do Hospital Universitário Francisca
Mendes pelo atendimento aos pacientes.
Ao Hospital Universitário Francisca Mendes, por disponibilizar o aparelho de
ecocardiografia e demais exames.
A todos os pacientes que aceitaram participar deste estudo.
Existem, sim, obstáculos.
Existem e sempre existirão os desafios, a distância e as
frustrações.
LISTA DE ABREVIATURAS E SIGLAS LISTA DE GRÁFICOS
LISTA DE TABELAS RESUMO
ABSTRACT
1.INTRODUÇÃO ... 25
1.1.MANIFESTAÇÕES CARDIOVASCULARES DO HIPERTIREOIDISMO... 27
1.2.HIPERTIREOIDISMO E HIPERTENSÃO PULMONAR ... 31
2. OBJETIVOS ... 37
3. CASUÍSTICA E MÉTODOS ... 39
3.1 CASUÍSTICA... 40
3.2 AVALIAÇÃO CLÍNICA ... 42
3.3 AVALIAÇÃO ECOCARDIOGRÁFICA ... 43
3.4ANÁLISE ESTATÍSTICA ... 48
4.RESULTADOS... 50
4.1 ANÁLISE DE ACORDO COM A PRESENÇA OU NÃO DE HIPERTENSÃO PULMONAR ... 57
4.2 ANÁLISE ANTES E APÓS NORMALIZAÇÃO DO T4 LIVRE ... 66
5.DISCUSSÃO ... 70
6. CONCLUSÕES ... 80
7. REFERÊNCIAS BIBLIOGRÁFICAS ... 82
AD Átrio direito
ADVD Área diastólica do ventrículo direito
AE Átrio esquerdo
ANA Anticorpo antinuclear
ASVD Área sistólica do ventrículo direito
At Velocidade diastólica tardia ao Doppler tecidual
DC Débito cardíaco
DDVE Diâmetro diastólico do ventrículo esquerdo
DSVE Diâmetro sistólico do ventrículo esquerdo
E Velocidade diastólica precoce
Et Velocidade diastólica precoce ao Doppler tissular
ESAT Excursão sistólica do anel tricúspide
EUA Estados Unidos da América
FC Frequência cardíaca
FEVE Fração de ejeção do ventrículo esquerdo
HAP Hipertensão arterial pulmonar
IC Índice cardíaco
IDMVD Índice de desempenho miocárdico do ventrículo direito
NYHA New York Heart Association
PCP Pressão capilar pulmonar
PEL Paraesternal longitudinal
PMAP Pressão média na artéria pulmonar
PSAP Pressão sistólica na artéria pulmonar
SERCA Cálcio ATPase dos retículos sarcoplasmático e
endoplasmático
St Velocidade sistólica do anel tricuspídeo ao Doppler tissular
T4 Tiroxina
T4L Tiroxina livre
TCIV Tempo de contração isovolumétrica
TR Receptor de hormônio tireoidiano
TSH Hormônio estimulante da tireóide
VCI Veia cava inferior
VD Ventrículo direito
VE Ventrículo esquerdo
VRT Velocidade sistólica da regurgitação tricúspide
VSVD Via de saída do ventrículo direito
VSVE Via de saída do ventrículo esquerdo
VTI Integral velocidade-tempo
Gráfico 1 - Débito cardíaco (L/min) de acordo com presença ou não de dispneia... 54
Gráfico 2- Índice cardíaco (L/min/m2) de acordo com presença ou não de dispneia... 54
Gráfico 3- Índice de desempenho miocárdico do ventrículo direito de acordo com presença ou não de dispneia... 55
Gráfico 4- Velocidade de deslocamento sistólico (St, cm/s) tricuspídeo de acordo com presença ou não de dispneia... 55
Gráfico 5- Pressão sistólica na artéria pulmonar (PSAP, mmHg) de acordo com presença ou não de dispneia... 56
Gráfico 6- Níveis séricos de T4 livre (ng/dL) de acordo com presença ou não de hipertensão arterial pulmonar ... 58
Gráfico 7- Correlação entre nível de T4 livre e pressão sistólica da artéria pulmonar.... 58
Gráfico 8- Número de pacientes com e sem dispneia de acordo com presença ou não de hipertensão arterial pulmonar... 59
Gráfico 9- Débito cardíaco (L/min) de acordo com presença ou não de hipertensão arterial pulmonar... 62
Gráfico 10- Correlação entre débito cardíaco e pressão sistólica da artéria pulmonar... 62
Gráfico 11- Correlação entre nível de T4 livre e débito cardíaco... 63
Gráfico 12- Fração de ejeção do ventrículo esquerdo (FEVE) de acordo com presença ou não de hipertensão arterial pulmonar... 64
Gráfico 13- Correlação entre nível de T4 livre e índice de desempenho miocárdico do ventrículo direito (IDMVD)... 64
Gráfico 14- Correlação entre resistência vascular pulmonar (RVP) e pressão sistólica da artéria pulmonar (PSAP)... 65
Gráfico 15- Índice de desempenho miocárdico do ventrículo direito (IDMVD) de acordo com presença ou não de hipertensão arterial pulmonar... 65
Tabela 1. Características clínicas e laboratoriais iniciais dos 32 portadores de
hipertireoidismo... 51
Tabela 2. Características ecocardiográficas iniciais dos 32 portadores de
hipertireoidismo... 53
Tabela 3. Características clínicas e laboratoriais dos pacientes com hipertireoidismo
de acordo com presença ou não de hipertensão arterial pulmonar (HAP)... 57
Tabela 4. Características ecocardiográficas dos pacientes com hipertireoidismo de
acordo com presença ou não de hipertensão arterial pulmonar (HAP)... 60
Tabela 5. Características clínicas e laboratoriais dos pacientes com hipertireoidismo
antes e após normalização do T4 livre... 66
Tabela 6. Características ecocardiográficas dos 26 pacientes com hipertireoidismo
Introdução: A disfunção ventricular direita é um determinante importante no prognóstico dos pacientes portadores de hipertensão arterial pulmonar (HAP)
em várias doenças. No entanto, a presença de HAP e disfunção do ventrículo
direito (VD) com suas manifestações clínicas, em pacientes com
hipertireoidismo sem alterações associadas no coração esquerdo, ainda não
está suficientemente esclarecido na literatura. O objetivo desse estudo foi
avaliar ecocardiograficamente, as variáveis estruturais e funcionais cardíacas
com enfoque no coração direito, correlacionando-as com alterações clínicas e
laboratoriais, antes e após o tratamento medicamentoso. Métodos: Nesse estudo prospectivo foram incluídos 32 portadores de hipertireoidismo primário,
de ambos os sexos, com mais de 18 e menos de 80 anos de idade, cujas
causas eram o bócio difuso tóxico (doença de Graves), bócio nodular tóxico
(doença de Plummer) ou bócio multinodular tóxico. Os pacientes foram
submetidos a avaliação clínica, laboratorial e ecocardiográfica. O estudo
ecocardiográfico teve como enfoque principal o coração direito e utilizaram-se
técnicas habituais como os modos mono e bidimensional e Doppler pulsado e
tissular. Em 26 deles foram também realizados exames após o
restabelecimento do eutireoidismo. Resultados: A idade média dos pacientes foi de 42,5±11,9 anos, sendo 90,6% do sexo feminino, e a doença de Graves
foi a etiologia mais frequente (75%). De acordo com a classificação funcional
da NYHA, 46,9% dos pacientes estavam em classe I e 53,1% em II. A
prevalência de HAP (PSAP ≥36 mmHg) em pacientes antes do tratamento foi
43,8%. O IDMVD estava alterado (>0,55) em 37,5% dos pacientes; o T4 livre
significante com a PSAP (R=0,42, p<0,05); a resistência vascular pulmonar
apresentou tendência em se correlacionar positivamente com a PSAP
(p=0,073); também houve tendência à maior frequência de dispneia nos
portadores de HAP (p=0,067), e esse sintoma correlacionou-se com valores
maiores de débito cardíaco (DC), índice cardíaco (IC), IDMVD e St tricuspídeo
(p<0,05). As dimensões do ventrículo e átrio direito foram maiores no grupo
com HAP, assim como as dimensões do ventrículo e átrio esquerdo, DC e IC.
As funções sistólica e diastólica do ventrículo esquerdo e a função diastólica do
VD encontravam-se normais nos grupos com e sem HAP. As alterações
ecocardiográficas observadas nos pacientes com hipertireoidismo
normalizaram-se após o tratamento. Conclusão: Em portadores de hipertireoidismo, poucos apresentam dilatação das câmaras cardíacas direitas
ou esquerdas. No entanto, a presença de HAP, na maioria sintomática e
transitória, cursa frequentemente com comprometimento do IDMVD, maiores
DC, IC e St tricúspide. Há correlação positiva e significante entre a PSAP e os
níveis de T4 livre e com o DC. Além disso, há reversão das alterações
ecocardiográficas após normalização da função tireoidiana.
Palavras-chave: hipertireoidismo, hipertensão pulmonar, ventrículo direito,
Background: Right ventricular (RV) dysfunction is an important determinant of prognosis in patients with pulmonary arterial hypertension (PAH) in many
diseases. Nevertheless, the occurrence of PAH and RV dysfunction with their
clinical manifestations in thyrotoxicosis patients without left ventricular
dysfunction is not yet well understood. The aim of the present study was to
evaluate by echocardiography, the cardiac structural and functional parameters,
particularly the right side of the heart, and to evaluate their correlation with
clinical and laboratorial findings, before and after medical therapy for
thyrotoxicosis. Methods: In this prospective study, 32 patients, both genders, and 18 to 80 years old with primary hyperthyroidism caused by diffuse goiter
(Graves’ disease), nodular goiter (Plummer’s disease), or multinodular goiter
were evaluated. Patients were submitted to clinical, laboratorial, and
echocardiographic assessments. Echocardiographic examination focused the
right heart using standard techniques, such as mono (uni-) and two-dimensional
assessments and pulsed and tissular Doppler. In 26 patients the exam was
repeated after normalization of hyperthyroidism. Results: Patients were
42.5±11.9 years old, most females (90.6%), and Graves’ disease was the most
frequent etiology (75%). Fifteen (46.9%) were classified as class I and 17
(53.1%) as class II of New York Heart Association functional classification. The
prevalence of PAH, defined as pulmonary artery systolic pressure (PASP) ≥36
mmHg, in untreated hyperthyroidism patients was 43.8%. PAH patients showed
a trend to higher frequency of dyspnea than patients with normal PASP (71.4%
vs. 38.9%, p=0.067). Free T4 (FT4) was greater in PAH patients than in patients
was a trend to correlation between pulmonary vascular resistance and PASP
(r=0.32, p=0.073). Twelve patients (37.5%) had impaired RV myocardial
performance index (MPI) (>0.55). Dyspnea was associated to higher values of
cardiac output (CO), cardiac index (CI), RV MPI and tricuspid St (p<0.05). RV
and right atrial dimensions were greater in PAH patients, as well as left ventricle
(LV), left atrium, CO and CI. LV diastolic and systolic and RV diastolic functions
were normal and did not alter after treatment in both PAH and normal PASP
patients. All echocardiographic changes normalized after restoration of
euthyroidism. Conclusions: In patients with hyperthyroidism, few present right or left chambers dilation. However, while PAH was symptomatic and transitory
in its nature, impairment of RV MPI and higher values of CO, CI, and tricuspid
St is frequent. There is positive correlation between PASP and FT4, and PASP
and CO. Furthermore, there is reversion of echocardiographic alterations after
normalization of thyroid function.
Key words: hyperthyroidism; pulmonary hypertension; right ventricle; cardiac
Em 1835, Graves descreveu três casos de mulheres com palpitações,
hipertrofia da tireóide, “sensação de sufocação”, nervosismo, taquisfigmia,
fraqueza muscular, emagrecimento e exoftalmia. Cunningham (1898) observou
que pessoas que ingeriam grande quantidade de extrato de tireóide
desenvolviam estes sinais e sintomas e chamou esta síndrome de
“tireoidismo”.
O hipertireoidismo ocorre quando há excesso de hormônio produzido
pela glândula tireóide (Maia et al., 2013). Sua principal causa é o bócio difuso
tóxico, mais conhecido como doença de Graves ou doença de
Basedow-Graves, síndrome caracterizada por hipertireoidismo associado a oftalmopatia
específica e mixedema pré-tibial (Abraham-Nordling et al., 2011; DeGroot,
2012; Pierce et al., 2012; Maia et al., 2013). Outras causas de hipertireoidismo
são o bócio multinodular tóxico e o adenoma tóxico (doença de Plummer)
(Quadro 1) (Maia et al., 2013).
Na Grã-Bretanha, o hipertireoidismo acomete cerca de 1,7% da
população, sendo mais frequente em mulheres (2,7%) do que em homens
(0,6%) (Pierce et al., 2012). Na Suécia, observa-se essa mesma proporção
entre mulheres e homens (4,1:1), com prevalência estimada em 27,6/100.000
habitantes (Abraham-Nordling et al., 2011). Já na Dinamarca a prevalência é
bem maior, com 81,6 casos por 100.000 habitantes, com prevalência
semelhante de doença de Graves e de bócio multinodular tóxico (Carlé et al.,
Quadro 1. Causas de tireotoxicose de acordo com a captação de radioiodo (I131 ou I123)
Captação normal ou elevada Captação baixa ou ausente
Doença de Graves Tireoidite indolor (silenciosa)
Bócio multinodular tóxico Tireoidite induzida por amiodarona
Adenoma tóxico Tireoidite subaguda (granulomatosa,
de Quervain)
Doença trofoblástica Tireotoxicose iatrogênica
Adenoma hipofisário secretor de TSH Tireotoxicose factícia pela ingestão de hormônios tireoidianos
Resistência aos hormônios
tireoidianos Struma ovarii
Tireoidite aguda
Metástases extensas de carcinoma folicular da tireóide
Fonte: Maia et al. The Brazilian consensus for the diagnosis and treatment of hyperthyroidism: recommendations by the Thyroid Department of the Brazilian Society of Endocrinology and Metabolism. Arq Bras Endocrinol Metabol. 2013;57:205-32.
A doença de Graves é uma doença auto-imune, na qual o sistema
imunológico passa a produzir anticorpos que estimulam o receptor do hormônio
estimulante da tireóide (TSH) nas células foliculares tireoidianas, induzindo
hiperplasia e hiperfunção da tireóide (De Groot, 2012).
Laboratorialmente, a tireotoxicose se caracteriza pela elevação dos
hormônios tireoidianos tiroxina (T4) e triiodotironina (T3) e pela diminuição,
geralmente supressão, do hormônio hipofisário regulador da tireóide, o TSH
(Bahn et al., 2011; Maia et al., 2013), sendo que o nível de T4 livre fornece
estimativa da gravidade da doença (Bahn et al., 2011; De Groot, 2012).
O tratamento do hipertireoidismo pode ser feito inicialmente com
tionamidas disponíveis são metimazol (tiamazol) e propiltiouracil. Elas inibem a
síntese de hormônios tireoidianos através da inibição de enzimas encontradas
nas células tireoidianas e que são necessárias à síntese de hormônios
tireoidianos (Cooper, 2005; De Groot, 2012). Com doses de metimazol em
torno de 30 mg/dia, cerca de 96% dos pacientes normalizam os níveis de T4
livre (Nakamura et al., 2007).
1.1. MANIFESTAÇÕES CARDIOVASCULARES DO HIPERTIREOIDISMO
O hipertireoidismo está associado a diversas alterações
cardiovasculares que podem levar a alto grau de morbidade e mortalidade
cardiovascular.
Na descrição inicial do hipertireoidismo feita por Graves (1835) foram
destacadas as manifestações cardiovasculares, com a descrição de
palpitações e bulhas cardíacas que podiam ser ouvidas a mais de um metro de
distância. A “sensação de sufocação” percebida pelas pacientes assistidas por
Graves também poderia ter origem no sistema cardiovascular, além daquela
atribuída à compressão da traqueia pelo bócio difuso.
Entre as manifestações cardiovasculares da tireotoxicose estão:
taquicardia sinusal, arritmias atriais, aumento do débito cardíaco, alargamento
da pressão de pulso e, ocasionalmente, insuficiência cardíaca (Amidi et al.,
1968; Polikar et al.,1993; Siu et al., 2007). A insuficiência cardíaca de alto
esquelética, principalmente a respiratória - fazem com que indivíduos
portadores de hipertireoidismo não sejam capazes de atender à demanda
adicional do débito cardíaco em situações de esforço físico (Kahaly et al.,
1999).
O coração está entre os órgãos mais responsivos à ação dos hormônios
tireoidianos (Klein, 1990). As células cardíacas sofrem ação direta e indireta do
excesso desses hormônios, influenciando todo o sistema cardiovascular e
provocando manifestações clínicas características dessa doença
(Woeber,1992).
O miócito cardíaco, ao contrário de outras células dos tecidos do
organismo, não tem atividade deiodinase suficiente para converter T4 em T3;
dessa forma, o próprio T3 é transportado para o interior da célula, mais
especificamente para o núcleo (Dillmann et al., 1990; Lazar, 1990). Esse
hormônio liga-se a receptores nucleares específicos (TRs), que se ligam a
elementos de resposta ao T3 em genes alvo. Esse complexo T3-receptor-gene
ativado determina uma transcrição genética otimizada (Tsai et al., 1994). Esses
genes-alvo, cuja transcrição é ativada e sofrem regulação positiva (cadeia
pesada de miosina alfa, SERCA, receptores adrenérgicos E1,
sódio/potássio-ATPase, hormônio natriurético atrial e canais de potássio), estão implicados em
alguns dos efeitos cardiovasculares, tais como aumento do inotropismo e
cronotropismo cardíaco (Dillmann et al., 1990; Klein, 2007; Klein & Ojaama,
2001).
Outro efeito direto do T3 no miócito, porém não genômico (ação não
canais iônicos da membrana celular, como os canais de sódio, potássio e
cálcio, resultando em aumento da contratilidade e frequência cardíaca. Ainda, o
hormônio diminui o tônus vasomotor da célula muscular lisa (Davis et al.,
2002).
Segal et al. (1989) relataram aumento da entrada rápida de cálcio em
cortes de coração de ratos, após adicionar doses fisiológicas de T3. Esse efeito
foi diretamente proporcional à concentração do hormônio e independente das
concentrações de cálcio extracelular.
As repercussões hemodinâmicas ocasionadas pelos hormônios da
tireóide incluem diminuição da resistência vascular periférica e da pós-carga e
aumento da frequência e contratilidade cardíaca (Klein, 1990; Dillmann et
al.,1990) e, consequentemente, aumento do débito cardíaco.
Kahaly et al. (1999) avaliaram, por meio de ecocardiograma sob
estresse, 42 pacientes com hipertireoidismo não tratado e observaram que
esses pacientes, em comparação ao grupo controle (eutiroidianos),
apresentavam em repouso maior índice de volume sistólico do ventrículo
esquerdo (VE), maior fração de ejeção e menor resistência vascular periférica.
Durante o exercício, apresentaram redução na reserva contrátil do VE e no
cronotropismo cardíaco. Houve reversão dessas alterações após o tratamento
(Kahaly et al., 1999).
Devido ao aumento do consumo de oxigênio pelos tecidos e do estado
periférica compensatória para atender a maior demanda de oxigênio dos
tecidos em geral, com consequente aumento do débito cardíaco.
Napoli et al. (2001) relataram também excesso de produção de óxido
nítrico endotelial e exagerada reatividade vascular das arteríolas, secundária a
sensibilidade aumentada do componente endotelial, levando a redução da
resistência vascular periférica. Após tratamento medicamentoso (metimazol) e
alcançado o estado de eutireoidismo, houve restabelecimento da
responsividade vascular.
Klemperer et al. (1995) também demonstraram, clinicamente, que alta
dose de T3 reduziu a resistência vascular sistêmica e aumentou o débito
cardíaco em algumas horas após a cirurgia de revascularização. Ojamaa et al.
(1993) também observaram efeito direto do T3 nas células de músculo liso dos
vasos levando ao aumento do débito cardíaco.
A consequente queda da resistência vascular periférica reduz o volume
efetivo do enchimento arterial e a perfusão renal, levando a ativação da renina
e do eixo angiotensina-aldosterona, causando maior absorção renal de sódio e
aumentando o volume circulante, alterações que levam ao aumento da
pré-carga e do débito cardíaco (Resnick et al,1982).
A relação do hormônio tireoidiano com o sistema neuro-adrenégico
determina parte das manifestações clínicas (taquicardia, sudorese, etc.).
Observa-se redução desses sintomas com o uso de bloqueadores dos
Há evidências de que o hormônio potencializa a resposta adrenérgica
(Amidi et al., 1968), porém outras evidências apontam para redução do efeito
estimulante adrenérgico em pacientes com hipertireoidismo (Buccino et al.,
1967). Em 1968, Amidi et al. observaram que, após injeção de reserpina (um
depletor de catecolaminas) em pacientes portadores de hipertireoidismo, a
contratilidade miocárdica permanecia aumentada, e não dependia das reservas
de catecolaminas.
Anderson et al. (1993) indicaram haver maior afinidade e número de
beta-receptores potencializando a atividade do sistema adrenérgico no
hipertireoidismo.
1.2. HIPERTIREOIDISMO E HIPERTENSÃO ARTERIAL PULMONAR
Uma das alterações cardíacas que ocorre em portadores de
hipertireoidismo é a hipertensão arterial pulmonar (HAP) (Okura & Takatsu,
1994; Nakchbandi et al., 1999; Virani et al., 2003; Soroush-Yari et al., 2005;
Armigliato et al., 2006; Paran et al., 2006; Siu et al., 2007; Di Giovambattista,
2008), que é uma condição caracterizada no cateterismo cardíaco por pressão
sistólica na artéria pulmonar (PSAP) >30 mmHg, ou pressão média na artéria
pulmonar (PMAP) >25 mmHg em repouso. Os sintomas típicos da HAP
incluem: dispneia aos esforços, fadiga, dor torácica retroesternal e síncope
Vários estudos têm sugerido associação entre hipertireoidismo e
hipertensão pulmonar (Okura & Takatsu, 1994; Nakchbandi et al., 1999; Virani
et al., 2003; Soroush-Yari et al., 2005; Armigliato et al., 2006; Paran et al.,
2006; Siu et al., 2007; Di Giovambattista, 2008; Marvisi et al., 2002; Mercé et
al., 2005; Armigliato et al., 2006; Pires et al., 2006; Siu et al., 2007; lozano et
al., 2004; Thurnheer, 1997).
A etiologia da hipertensão pulmonar pode ser idiopática, com
prevalência de 5,9 casos/milhão na Europa (Galiè et al., 2009), ou secundária a
doenças pulmonares e/ou hipoxemia, doenças no coração esquerdo,
tromboembolismo pulmonar crônico hipertensivo ou causada por mecanismos
multifatoriais não esclarecidos (Simonneau et al., 2009). Entre as causas
cardíacas estão: disfunção ventricular esquerda, doenças valvares ou
miocárdicas, doenças cardíacas congênitas, mixoma do átrio esquerdo. (Galiè
et al., 2009).
No último consenso de hipertensão arterial pulmonar, realizado em Dana
Point, nos EUA, o hipertireoidismo foi classificado no grupo de hipertensão
pulmonar com mecanismos multifatoriais não esclarecidos (Simonneau et al.,
2009). No consenso europeu, a definição da HAP foi baseada em alterações
hemodinâmicas: PMAP >25 mmHg em repouso e pressão capilar pulmonar ou
de átrio esquerdo <15 mmHg, com resistência vascular pulmonar >3 unidades
Wood (avaliado por cateterismo) (Galiè et al., 2009). A PMAP em condições
fisiológicas e ao nível do mar é d20 mmHg e a PSAP é d30 mmHg (estimado
A prevalência de HAP em pacientes portadores de hipertireoidismo
encontra-se entre 35% e 65% (Marvisi et al., 2002; Marvisi et al., 2006; Mercé
et al., 2005; Siu et al., 2007).
Em contraste com o padrão de hipertensão pulmonar primária ou
secundária devido a doenças vasculares autoimunes, a HAP relacionada ao
hipertireoidismo tem bom prognóstico, e as pressões normalizam-se após o
tratamento (Siu et al., 2007).
Siu et al. (2007) avaliaram 75 pacientes com hipertireoidismo antes e
após o tratamento, sendo 40% com doença de Graves e 60% com doença
multinodular. A prevalência de HAP nesses pacientes foi de 47% (considerando
PSAP >35 mmHg). Os autores observaram maiores valores de débito cardiaco,
PSAP, relação E/e’ e menor resistência vascular sistêmica em relação aos
pacientes do grupo sem HAP e do grupo controle. Em relação ao mecanismo
da HAP, tanto nos pacientes com a forma autoimune como na doença
multinodular, não foi observada diferença significativa na prevalência de
anticorpos positivos nos grupos com e sem HAP. Desta forma, esses achados
sugerem que não há envolvimento da autoimunidade na patogênese da HAP
relacionada ao hipertireoidismo, e as evidências apontaram para
anormalidades cardiovasculares como mecanismos causadores de HAP.
Mercé et al. (2005) estudaram 39 pacientes com hipertireoidismo
durante 24 meses e observaram a prevalência de 41% de HAP. Observaram
também maior número de regurgitações valvares mitral e tricúspide de grau
moderado na fase inicial do estudo. Esse achado foi relacionado com maior
atrial; alterações que reverteram com o tratamento do hipertireoidismo. Não
houve diferença do diâmetro diastólico e da fração de ejeção do VE em relação
ao tratamento.
Marvisi et al. (2002) estudaram 34 pacientes (20 com doença de Graves
e 14 com doença multinodular) e encontraram prevalência de HAP de 35%,
não havendo diferença entre os grupos quanto a presença de anticorpos
antimicrossomal e antitireoglobulina e também quanto a presença de anticorpo
antinuclear (ANA). Houve correlação positiva entre os pacientes que cursavam
com níveis mais elevados de T4 livre e valores de pressão sistólica em artéria
pulmonar.
Esse mesmo grupo (2006) estudou 114 pacientes, sendo 47 com
doença de Graves e 67 com doença nodular. A prevalência encontrada de HAP
foi de 43%, todas de grau leve, e que reverteu com o restabelecimento do
eutireoidismo. Não houve alteração do débito cardíaco em relação aos grupos
pré-tratamento e após uso de metimazol. Esses autores sugeriram
mecanismos patogênicos ligados aos efeitos diretos dos hormônios no
endotélio vascular pulmonar (aumento na sensibilidade às catecolaminas
causando vasoconstrição pulmonar, aumento do metabolismo das substâncias
vasodilatadoras, etc.) levando a HAP.
Armigliato et al. (2006) encontraram alta prevalência (65%) de HAP na
admissão de 23 pacientes com diagnóstico de hipertireoidismo em um período
de nove meses. Em 52% desses pacientes os anticorpos antitireoidianos não
estavam presentes. Os autores não encontraram relação que comprovasse
A associação entre hipertireoidismo e HAP também foi reportada em
uma série de relatos de caso na literatura (Thurnheer et al., 1997; Nakchhandi
et al., 1999; Lozano et al., 2004; Paran et al., 2006; Tam et al., 2008; Momesso
et al., 2010). Em todos os pacientes foram descartadas causas primárias e
secundárias de HAP, sendo o hipertireoidismo a única alteração encontrada.
Após tratamento medicamentoso e com alcance do eutireoidismo, houve
regressão total das pressões em artéria pulmonar.
Suk et al. (2011) avaliaram 64 pacientes portadores de doença de
Graves. Em 28 desses pacientes (44%) foi observada HAP. Foram analisadas
variáveis ecocardiográficas tais como PSAP, débito cardíaco, resistência
vascular pulmonar e índice de performace miocárdica. O índice de performance
miocárdico do ventrículo direito (VD) estava comprometido, mas não houve
diferença nos valores de resistência pulmonar, velocidade de deslocamento do
anel tricuspídeo e espessamento da parede livre do VD. Não houve relação
entre HAP e presença de anticorpos antitireoidianos.
O mecanismo da HAP no hipertireoidismo parece ser complexo (Silva et
al., 2009). Entre as causas aventadas estão o aumento do débito cardíaco e do
retorno venoso e a lesão endotelial pulmonar induzida pelo aumento do débito
cardíaco. Mecanismos inflamatórios também têm sido implicados, entre os
quais a autoimunidade. Anticorpos antitireoidianos podem ser marcadores de
um processo de ativação imunológica generalizada, e podem ter relação com a
etiologia da HAP, através de lesão e/ou disfunção endotelial. Yanai-Landau et
al. (1995) observaram que 30% dos portadores de HAP primária tinham
na etiopatogenia da HAP do hipertireoidismo é a ocorrência de HAP em
recém-nascidos com hipertireoidismo em filhos de portadoras de doença de Graves
(O'Donovan et al., 1997; Markham & Stevens, 2003; Oden & Cheifetz, 2005).
Também poderia contribuir para a HAP no hipertireoidismo o aumento do
metabolismo de substâncias vasodilatadoras pulmonares.
A HAP do hipertireoidismo não poderia ser explicada simplesmente
pelas alterações das câmaras cardíacas esquerdas, uma vez que vários
autores têm relatado que a função do ventrículo esquerdo está normal nesses
pacientes (Okura & Takatsu, 1994; Virani et al., 2003; Paran et al., 2006; Siu et
al., 2007; Di Giovambattista, 2008).
Apesar da HAP associada ao hipertireoidismo ter bom prognóstico
(Soroush-Yari et al., 2005), a sua presença parece ser um marcador de
gravidade do acometimento cardiocirculatório no hipertireoidismo. Sua
presença geralmente está associada a prognóstico ruim em muitos casos
(Paran et al., 2006; Di Giovambattista, 2008), como também tem sido
observado em hospitais da região amazônica, onde os pacientes chegam
2.1. Geral
Avaliar as características clínicas, laboratoriais e ecocardiográficas
em pacientes com hipertireoidismo, antes e após o tratamento.
2.2. Específicos
x Analisar ecocardiograficamente as variáveis estruturais e
funcionais cardíacas em portadores de hipertireoidismo, antes e
após o tratamento, com enfoque principal no coração direito;
x Comparar variáveis ecocardiográficas de portadores de
hipertireoidismo com e sem dispneia;
x Comparar variáveis ecocardiográficas de portadores de
3.1. CASUÍSTICA
Neste estudo prospectivo, observacional, foram estudados 32 pacientes
com hipertireoidismo primário atendidos no Serviço de Endocrinologia da
Universidade Federal do Amazonas, no período de fevereiro de 2010 a
fevereiro de 2014.
Foram incluídos pacientes de ambos os sexos, com mais de 18 e menos
de 80 anos de idade, com diagnóstico de hipertireoidismo primário clínico [TSH
suprimido (<0,5 mUI/L) e com T4 livre aumentado (>1,7 ng/dL)] ou subclínico
[TSH suprimido (<0,5 mUI/L) e com T4 livre normal (0,8-1,7 ng/dL)], causado
por bócio difuso tóxico (doença de Graves), bócio nodular tóxico (doença de
Plummer) ou bócio multinodular tóxico.
Este projeto de pesquisa foi aprovado pela Comissão de Ética da
Universidade Federal do Amazonas (Anexo A) e, de acordo com a
regulamentação em vigor, os pacientes ou seus representantes legais
assinaram o Termo de Consentimento Livre e Esclarecido (Anexo B).
3.1.1. Critérios de Exclusão
Foram excluídos:
x Pacientes que não apresentavam refluxo através da valva tricúspide
x Pacientes com hormônios tireoidianos (T3 e T4 livres) abaixo do
valor da normalidade, pois na vigência de TSH baixo, tais valores de
x Pacientes com diagnóstico de doenças pré-existentes (antes do
diagnóstico de hipertireoidismo) tais como:
o Doença valvular significante
o Doença coronariana
o Hipertensão arterial sistêmica
o Diabetes mellitus
o Miocardiopatia da doença de Chagas
o Cardiomiopatia dilatada ou hipertrófica
o Insuficiência cardíaca congestiva
x Pacientes com outras doenças potencialmente causadoras de
hipertensão arterial pulmonar:
o Tromboembolismo pulmonar
o Doença pulmonar significativa
o Doenças do tecido conjuntivo
o Uso de medicamentos anorexígenos
x Uso de fármacos que interferem com a função tireoidiana, tais como
betabloqueador, amiodarona, lítio, glicocorticóides em altas doses e
imunossupressores
x Gestantes
x Pacientes com hipertireoidismo secundário (etiologia hipofisária)
x Imagem ecocardiográfica inadequada e arritmias que pudessem
prejudicar a avaliação das variáveis ecocardiográficas (fibrilação
atrial, flutter atrial, extrassistolia frequente, etc.)
x Participantes em outros projetos de pesquisa nos últimos 3 meses.
3.2. AVALIAÇÃO CLÍNICA
As seguintes avaliações clínica e laboratorial foram realizadas:
x Anamnese e exame físico
x Avaliação da capacidade funcional cardíaca utilizando os critérios da
New York Heart Association (NYHA) (McLaughlin et al., 2009)
x Radiografia de tórax
x Eletrocardiograma
x Dosagem de TSH e T4 livre
O diagnóstico etiológico do hipertireoidismo foi realizado pelo quadro
clínico e exames complementares, como ultrassonografia de tireóide ou
cintilografia de tireóide, quando necessário.
Foram considerados portadores de doença de Basedow-Graves os
pacientes com um dos seguintes critérios:
x Exoftalmia associada a bócio difuso ao exame físico ou à
x Bócio difuso hipercaptante à cintilografia
Foram considerados portadores de bócio nodular tóxico (doença de
Plummer) os pacientes com nódulo hipercaptante (“quente”) à cintilografia.
Pacientes com dois ou mais nódulos hipercaptantes à cintilografia foram
diagnosticados como bócio multinodular tóxico.
3.3 AVALIAÇÃO ECOCARDIOGRÁFICA
Foram realizados estudos ecocardiográficos de acordo com as
recomendações da American Society of Echocardiography (Lang et al., 2005;
Horton et al., 2009). Os exames foram realizados no Setor de Ecocardiografia
do Hospital Universitário Francisca Mendes, da Universidade Federal do
Amazonas. O aparelho utilizado foi GE VIVID 3 (GE Medical System, EUA)
com transdutor adulto de 2,5-3,0 MHz.
Como a presença de regurgitação tricúspide é necessária para estimar a
PSAP, inicialmente foi avaliado se havia regurgitação tricúspide através da
janela apical quatro câmaras. A medida da velocidade máxima (V) da
regurgitação tricúspide obtida pelo Doppler contínuo permite, através da
equação de Bernoulli, estimar o gradiente de pressão entre o ventrículo direito
(VD) e o átrio direito (AD) (Gradiente= 4xV2) (Currie et al., 1985). A PSAP foi estimada adicionando-se a esse gradiente o valor da pressão no AD, que por
sua vez foi estimada pelo diâmetro da veia cava inferior (VCI) e sua variação
normal (>50%); 10 mmHg se VCI normal ou dilatada e variação inspiratória
<50%; 15 mmHg se VCI dilatada e variação respiratória ausente] (Rudski et al.,
2010). O diagnóstico de HAP foi realizado quando a PSAP foi igual ou superior
a 36 mmHg (Rudski et al., 2010). Todos os valores obtidos representam a
média aritmética de três ciclos cardíacos consecutivos. A ecocardiografia foi
realizada no momento do diagnóstico de hipertireoidismo e após a
normalização do T4 livre.
Foram avaliadas também as seguintes variáveis ecocardiográficas e
hemodinâmicas do ventrículo direito conforme as “Diretrizes para avaliação
ecocardiográfica do coração direito em adultos” da American Society of
Echocardiography (Rudski et al., 2010):
x Dimensão do ventrículo direito
1. Diâmetro basal na imagem bidimensional ao final da diástole no corte
apical 4-câmaras;
2. Diâmetro proximal do VD na imagem bidimensional no corte
paraesternal longitudinal.
x Áreas diastólica e sistólica do VD (ADVD e ASVD)
Medidas realizadas no corte apical 4-câmaras por meio de planimetria
do ventrículo em sístole e diástole, desde o plano do anel tricúspide
estendendo-se por toda cavidade ventricular.
x Dimensão do átrio direito
1. Volume do átrio direito: medida realizada no corte apical 4-câmaras
por meio do método de Simpson modificado;
2. Área do átrio direito: medida realizada no corte apical 4-câmaras por
meio de planimetria.
x Débito cardíaco (DC)
Método ecocardiográfico padrão obtido por meio do Doppler
pulsado. Foram realizadas medidas da via de saída do VE (VSVE), no corte
paraesternal longitudinal, e da integral tempo-velocidade (VTI) da VSVE, no
corte apical 5-câmaras (Evangelista et al., 1995). O débito cardíaco foi
calculado pela fórmula: (área da VSVE) x (VTI da VSVE) x FC.
x Índice de desempenho miocárdico do VD (IDMVD)
Esse índice foi obtido por meio do Doppler tissular na região lateral do
anel tricuspídeo. Foram medidos o tempo de contração isovolumétrica (TCIV),
tempo de relaxamento isovolumétrico (TRIV) e o tempo de ejeção (TE) do VD.
O IDMVD foi calculado dividindo-se o valor da soma de TCIV e TRIV pelo TE
x Porcentagem de variação da área do VD (%'AVD)
Avalia a função sistólica global do VD e foi calculada segundo a fórmula
(ADVD – ASVD) / ADVD.
x Excursão sistólica do anel tricuspídeo ao modo-M (ESAT)
Avalia a função regional do VD, principalmente a movimentação sistólica
das paredes no eixo longitudinal. Essa medida é realizada no corte apical
4-câmaras com o cursor do modo-M angulando a parede lateral do anel
tricuspídeo em direção ao ápice. O paciente é orientado a realizar apneia para
reduzir a interferência da respiração (Kaul et al., 1984; Miller et al., 2004).
x Velocidade sistólica do anel valvar tricuspídeo (St)
Esse índice, obtido por meio do Doppler tissular, avalia a função regional
do VD no corte apical 4-câmaras.
x Resistência vascular pulmonar (RVP) obtida através das equações
(Abbas et al., 2003): VRT/VTI da VSVD e RVP= 10x(VRT/VTI da
VSVD)+0,16, na qual VRT e VTI da VSVD representam,
respectivamente, velocidade do fluxo de regurgitação tricúspide e
integral de velocidade-tempo da via de saída do VD. Esse índice pode
pulmonar e aquela por aumento da resistência vascular pulmonar
(Abbas et al., 2003).
x Função diastólica do ventrículo direito
1. Ondas E e A do fluxo diastólico transtricuspídeo
2. Razão E/A do fluxo diastólico transtricuspídeo
3. Velocidades de deslocamento inicial (Et) e tardio (At) obtidas por
Doppler tissular na porção lateral do anel tricuspídeo
x Avaliação das funções diastólica e sistólica do ventrículo esquerdo
A. Função diastólica:
- Velocidades das ondas E e A do fluxo mitral
- Razão entre as ondas E/A do fluxo mitral
- Velocidade de deslocamento inicial (Et) do anel mitral lateral
- Velocidade de deslocamento tardio (At) do anel mitral lateral
- Razões entre as ondas E/Et e Et/At
- Pressão capilar pulmonar (PCP), calculada pela equação (Nagueh et
al.,1997): PCP= 1,9+(1,24xE/Et)
B. Função sistólica:
- Fração de ejeção (FE) pelo método de Teichholz et al. (1976):
FE= (VDF-VSF)/VDF, onde VDF e VSF representam, respectivamente, os
volumes diastólico e sistólico final do ventrículo esquerdo, calculados segundo
a equação abaixo (DDVE: diâmetro diastólico do VE; DSVE: diâmetro sistólico
do VE).
VDF= (DDVE3x7)/(2,4+DDVE) VSF= (DSVE3x7)/(2,4+DSVE)
- Velocidade do deslocamento sistólico do anel mitral lateral ao
Doppler tissular (St)
Não foi necessária a realização de ecocardiograma transesofágico para
descartar HAP secundária a comunicações sistêmico-pulmonares, nos casos
duvidosos ao ecocardiograma transtorácico, em nenhum paciente.
3.4 ANÁLISE ESTATÍSTICA
As características gerais dos pacientes são apresentadas por meio da
estatística descritiva envolvendo medidas de posição e variabilidade.
A normalidade da distribuição das variáveis foi avaliada através do teste
Os dados numéricos são expostos como média e desvio padrão para as
variáveis com distribuição normal, ou como mediana e percentis 25% e 75%
para as variáveis com distribuição não normal.
Para as comparações entre os grupos com HAP e sem HAP foram
utilizados os testes t de Student para amostras independentes para as
variáveis com distribuição normal, ou o teste não-paramétrico de Mann-Whitney
para as variáveis com distribuição não normal.
A análise dos pacientes antes e após o tratamento foi realizada através
do teste t de Student pareado, para as variáveis com distribuição normal, ou do
teste de Wilcoxon, no caso de variáveis com distribuição não normal.
O estudo de correlação entre as variáveis ecocardiográficas e clínicas foi
realizado por meio do coeficiente linear de Pearson para as amostras com
distribuição normal, ou pelo coeficiente de correlação de Spearman para
amostras com distribuição não normal. Na análise das variáveis categóricas foi
utilizado o teste exato de Fisher. Todas as conclusões estatísticas são
discutidas no nível de significância de 5% (p<0,05). Para realização da análise
No período de fevereiro de 2010 a fevereiro de 2014 foram estudados 32
pacientes com diagnóstico de hipertireoidismo primário. Desses 32 pacientes, 5
perderam o seguimento. Dos 27 pacientes que retornaram com resultados de
exames de função tireoidiana, 26 apresentavam normalização do T4 livre com
o tratamento (Anexo C). As características clínicas e laboratoriais destes
pacientes estão mostradas na Tabela 1.
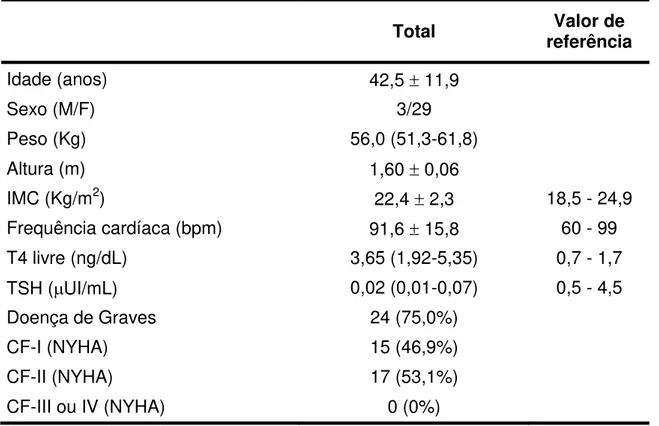
Tabela 1. Características clínicas e laboratoriais iniciais dos 32 portadores de hipertireoidismo.
Total referência Valor de
Idade (anos) 42,5 r 11,9
Sexo (M/F) 3/29
Peso (Kg) 56,0 (51,3-61,8)
Altura (m) 1,60 r 0,06
IMC (Kg/m2) 22,4 r 2,3 18,5 - 24,9
Frequência cardíaca (bpm) 91,6 r 15,8 60 - 99
T4 livre (ng/dL) 3,65 (1,92-5,35) 0,7 - 1,7
TSH (PUI/mL) 0,02 (0,01-0,07) 0,5 - 4,5
Doença de Graves 24 (75,0%)
CF-I (NYHA) 15 (46,9%)
CF-II (NYHA) 17 (53,1%)
CF-III ou IV (NYHA) 0 (0%)
Houve acentuada predominância do sexo feminino nessa amostra,
sendo apenas 3 do sexo masculino. A frequência cardíaca era t90 bpm em 17
(53,1%) pacientes e t100 bpm em 11 (34,4%). Em 75,0% dos casos, a
etiologia do hipertireoidismo foi a doença de Graves. Todos os pacientes
estavam em classe funcional I (46,9%) ou II (53,1%) da NYHA.
As características ecocardiográficas dos 32 pacientes iniciais estão
expostas na Tabela 2.
Em relação às dimensões do VE e átrio esquerdo, duas pacientes
apresentavam discreta dilatação dessas cavidades e uma paciente
apresentava discreta dilatação do átrio esquerdo. Além disso, os índices de
função sistólica e diastólica do VE estavam normais.
O diâmetro diastólico do ventrículo direito e a área do átrio direito
estavam discretamente aumentados, respectivamente, em 2 e 3 pacientes.
Entre as variáveis de função do ventrículo direito, observamos uma paciente
com discreta diminuição da %'AVD. O IDMVD estava alterado (>0,55) em 12
(37,5%) pacientes. A pressão sistólica da artéria pulmonar estava elevada (t36
mmHg) em 14 (43,8%) pacientes, e a resistência vascular pulmonar estava
elevada em 3 pacientes.
Comparando-se os grupos de portadores de hipertireoidismo com e sem
dispneia, observou-se que as únicas variáveis que mostraram diferença
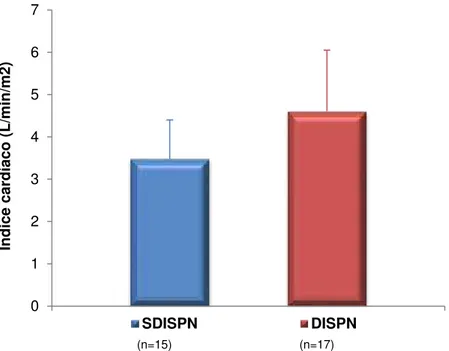
significante foram: débito cardíaco (Gráfico 1), índice cardíaco (Gráfico 2),
índice de desempenho miocárdico do ventrículo direito (Gráfico 3) e o St
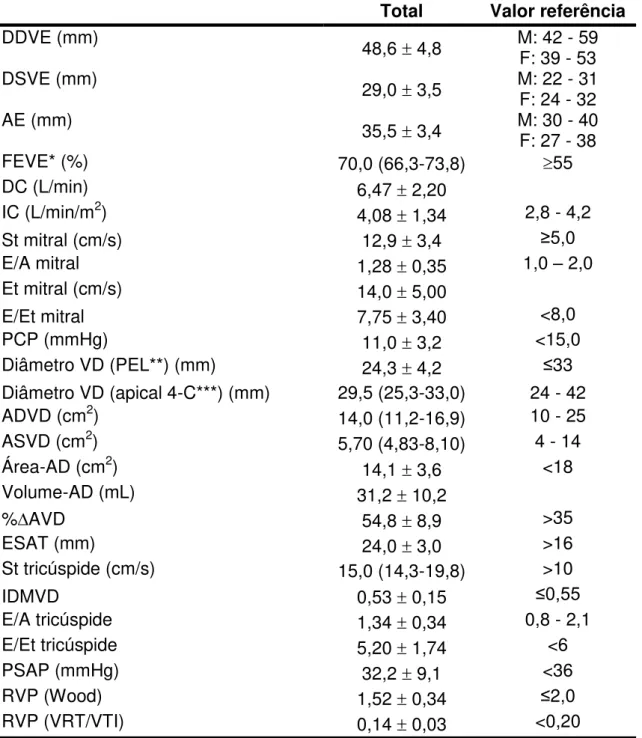
Tabela 2. Características ecocardiográficas iniciais dos 32 portadores de hipertireoidismo.
Total Valor referência
DDVE (mm) 48,6
r 4,8 M: 42 - 59 F: 39 - 53
DSVE (mm) 29,0
r 3,5 M: 22 - 31 F: 24 - 32
AE (mm)
35,5 r 3,4 M: 30 - 40 F: 27 - 38
FEVE* (%) 70,0 (66,3-73,8) t55
DC (L/min) 6,47 r 2,20
IC (L/min/m2) 4,08 r 1,34 2,8 - 4,2
St mitral (cm/s) 12,9 r 3,4 ≥5,0
E/A mitral 1,28 r 0,35 1,0 – 2,0
Et mitral (cm/s) 14,0 r 5,00
E/Et mitral 7,75 r 3,40 <8,0
PCP (mmHg) 11,0 r 3,2 <15,0
Diâmetro VD (PEL**) (mm) 24,3 r 4,2 ≤33
Diâmetro VD (apical 4-C***) (mm) 29,5 (25,3-33,0) 24 - 42
ADVD (cm2) 14,0 (11,2-16,9) 10 - 25
ASVD (cm2)
5,70 (4,83-8,10) 4 - 14
Área-AD (cm2) 14,1 r 3,6 <18
Volume-AD (mL) 31,2 r 10,2
%'AVD 54,8 r 8,9 >35
ESAT (mm) 24,0 r 3,0 >16
St tricúspide (cm/s) 15,0 (14,3-19,8) >10
IDMVD 0,53 r 0,15 ≤0,55
E/A tricúspide 1,34 r 0,34 0,8 - 2,1
E/Et tricúspide 5,20 r 1,74 <6
PSAP (mmHg) 32,2 r 9,1 <36
RVP (Wood) 1,52 r 0,34 ≤2,0
RVP (VRT/VTI) 0,14 r 0,03 <0,20
(n=15) (n=17)
Gráfico 1. Débito cardíaco (L/min) de acordo com presença ou não de dispneia (p<0,05). DISPN: grupo com dispneia; SDISPN: grupo sem dispneia.
(n=15) (n=17)
(n=15) (n=17)
Gráfico 3. Índice de desempenho miocárdico do ventrículo direito de acordo com presença ou não de dispneia (p<0,05). DISPN: grupo com dispneia; SDISPN: grupo sem dispneia.
(n=15) (n=17)
Gráfico 4. Velocidade de deslocamento sistólico (St, cm/s) tricuspídeo de acordo com presença ou não de dispneia (p<0,05). DISPN: grupo com dispneia; SDISPN: grupo sem dispneia.
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
Índice de desempenho
(n=15) (n=17)
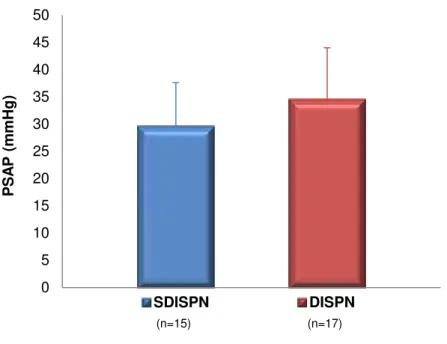
Gráfico 5. Pressão sistólica na artéria pulmonar (PSAP, mmHg) de acordo com presença ou não de dispneia (p=0,126). DISPN: grupo com dispneia; SDISPN: grupo sem dispneia.
O grupo de pacientes sem dispneia apresentou valores menores de
débito cardíaco, índice cardíaco, IDMVD e St tricuspídeo. A PSAP não diferiu
entre os grupos com e sem dispneia (p=0,126, Gráfico 5), assim como o nível
sérico de T4 livre (p=0,526). 0
5 10 15 20 25 30 35 40 45 50
PSA
P (
m
m
H
g
)
4.1 ANÁLISE DE ACORDO COM PRESENÇA OU NÃO DE HAP
Dos 32 portadores de hipertireoidismo submetidos a avaliação
ecocardiográfica, 14 (43,8%) apresentavam HAP. As variáveis clínicas e
laboratoriais dos pacientes de acordo com presença ou não de HAP estão
apresentadas na Tabela 3.
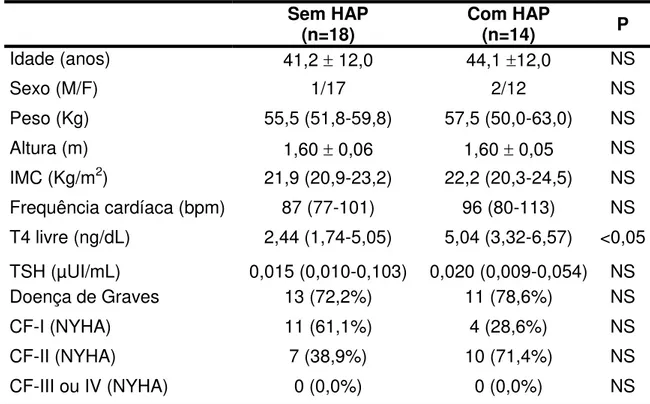
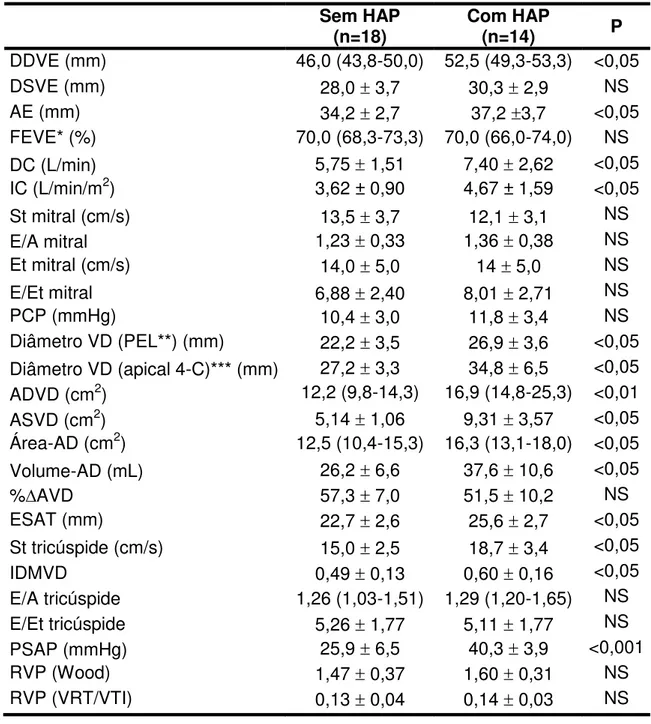
Tabela 3. Características clínicas e laboratoriais dos pacientes com hipertireoidismo de acordo com presença ou não de hipertensão arterial pulmonar (HAP)
Sem HAP
(n=18) Com HAP (n=14) P
Idade (anos) 41,2 r 12,0 44,1 r12,0 NS
Sexo (M/F) 1/17 2/12 NS
Peso (Kg) 55,5 (51,8-59,8) 57,5 (50,0-63,0) NS
Altura (m) 1,60 r 0,06 1,60 r 0,05 NS
IMC (Kg/m2) 21,9 (20,9-23,2) 22,2 (20,3-24,5) NS
Frequência cardíaca (bpm) 87 (77-101) 96 (80-113) NS
T4 livre (ng/dL) 2,44 (1,74-5,05) 5,04 (3,32-6,57) <0,05
TSH (µUI/mL) 0,015 (0,010-0,103) 0,020 (0,009-0,054) NS
Doença de Graves 13 (72,2%) 11 (78,6%) NS
CF-I (NYHA) 11 (61,1%) 4 (28,6%) NS
CF-II (NYHA) 7 (38,9%) 10 (71,4%) NS
CF-III ou IV (NYHA) 0 (0,0%) 0 (0,0%) NS
Valores expressos em média r desvio-padrão ou em mediana e percentis 25% e 75%. M: sexo masculino; F: sexo feminino; IMC: índice de massa corporal; T4: tiroxina; TSH: hormônio estimulante da tireóide; CF: classe funcional; NYHA: New York Heart Association. NS: não significante.
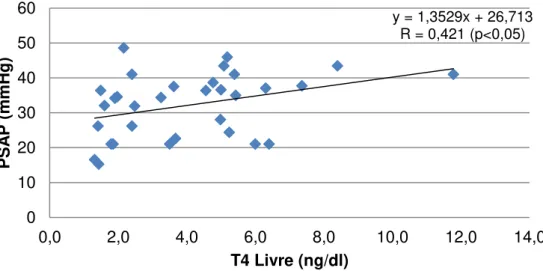
O T4 livre sérico dos pacientes do grupo com HAP foi significantemente
maior em relação ao grupo sem HAP (Tabela 3 e Gráfico 6). Foi observada
também correlação positiva e significativa, embora fraca, entre T4 livre sérico
Gráfico 6. Níveis séricos de T4 livre (em ng/dL) de acordo com presença ou não de hipertensão arterial pulmonar (p<0,05). HP: grupo com hipertensão arterial pulmonar; NHP: grupo sem hipertensão arterial pumonar.
Gráfico 7. Correlação entre nível de T4 livre e pressão sistólica da artéria pulmonar (p=0,045).
y = 1,3529x + 26,713 R = 0,421 (p<0,05)
0 10 20 30 40 50 60
0,0 2,0 4,0 6,0 8,0 10,0 12,0 14,0
PSA
P (
m
m
H
g)
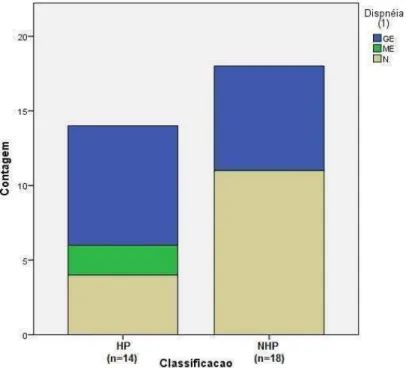
A maioria dos portadores de HAP apresentava dispneia, enquanto que a
maioria sem HAP não apresentava esse sintoma, tendo sido observada
tendência de maior prevalência de dispneia naquele grupo (p=0,067)
(Gráfico 8).
Gráfico 8. Número de pacientes com e sem dispneia de acordo com presença ou não de hipertensão arterial pulmonar (p=0,067). GE: dispneia aos grandes esforços; ME: dispneia aos pequenos esforços; N: sem dispneia; HP: grupo com hipertensão arterial pulmonar; NHP: grupo sem hipertensão arterial pumonar.
Os valores das variáveis ecocardiográficas dos pacientes com
hipertireoidismo, separados em grupos sem e com HAP, são mostrados na
Tabela 4. Em relação aos diâmetros diastólico do VE e do átrio esquerdo,
ambos apresentavam valores maiores no grupo de portadores de
hipertireoidismo com HAP. Além disso, o débito e o índice cardíaco também
Tabela 4. Características ecocardiográficas dos pacientes com hipertireoidismo de acordo com presença ou não de hipertensão arterial pulmonar (HAP).
Sem HAP
(n=18) Com HAP (n=14) P
DDVE (mm) 46,0 (43,8-50,0) 52,5 (49,3-53,3) <0,05
DSVE (mm) 28,0 r 3,7 30,3 r 2,9 NS
AE (mm) 34,2 r 2,7 37,2 r3,7 <0,05
FEVE* (%) 70,0 (68,3-73,3) 70,0 (66,0-74,0) NS
DC (L/min) 5,75 r 1,51 7,40 r 2,62 <0,05
IC (L/min/m2) 3,62 ± 0,90 4,67 ± 1,59 <0,05
St mitral (cm/s) 13,5 r 3,7 12,1 r 3,1 NS
E/A mitral 1,23 r 0,33 1,36 r 0,38 NS
Et mitral (cm/s) 14,0 r 5,0 14 r 5,0 NS
E/Et mitral 6,88 r 2,40 8,01 r 2,71 NS
PCP (mmHg) 10,4 r 3,0 11,8 r 3,4 NS
Diâmetro VD (PEL**) (mm) 22,2 r 3,5 26,9 r 3,6 <0,05
Diâmetro VD (apical 4-C)*** (mm) 27,2 r 3,3 34,8 r 6,5 <0,05
ADVD (cm2) 12,2 (9,8-14,3) 16,9 (14,8-25,3) <0,01
ASVD (cm2) 5,14 r 1,06 9,31 r 3,57 <0,05
Área-AD (cm2) 12,5 (10,4-15,3) 16,3 (13,1-18,0) <0,05
Volume-AD (mL) 26,2 r 6,6 37,6 r 10,6 <0,05
%'AVD 57,3 r 7,0 51,5 r 10,2 NS
ESAT (mm) 22,7 r 2,6 25,6 r 2,7 <0,05
St tricúspide (cm/s) 15,0 r 2,5 18,7 r 3,4 <0,05
IDMVD 0,49 r 0,13 0,60 r 0,16 <0,05
E/A tricúspide 1,26 (1,03-1,51) 1,29 (1,20-1,65) NS
E/Et tricúspide 5,26 r 1,77 5,11 r 1,77 NS
PSAP (mmHg) 25,9 r 6,5 40,3 r 3,9 <0,001
RVP (Wood) 1,47 r 0,37 1,60 r 0,31 NS
RVP (VRT/VTI) 0,13 r 0,04 0,14 r 0,03 NS
representada pela FEVE não apresentou diferença entre os grupos, assim
como a função sistólica regional, representada pela St mitral.
As variáveis relacionadas às dimensões das câmaras cardíacas direitas,
como área e volume do átrio direito, área diastólica (ADVD) e sistólica (ASVD)
do ventrículo direito e diâmetro do VD (nos cortes paraesternal longitudinal e
apical 4-câmaras) foram significativamente maiores no grupo com HAP.
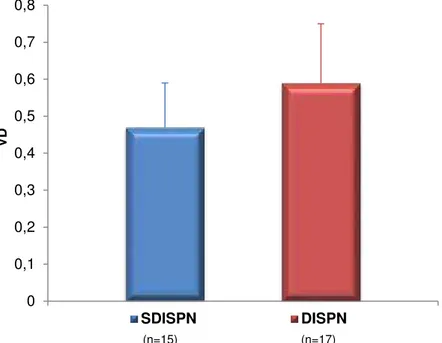
Quanto às variáveis de função ventricular direita, o IDMVD foi maior nos
portadores de hipertireoidismo com HAP, indicando função sistólica global do
VD menor nesses pacientes. Porém, outro parâmetro de estimativa da função
global ventricular direita, a % de variação de área do VD (%∆AVD) não diferiu
entre os dois grupos. A função sistólica regional do VD, representadas pela St
tricuspídeo e excursão sistólica do anel tricúspide (ESAT), estava aumentada
nos pacientes com HAP em relação aos sem HAP.
As variáveis de função diastólica do VE (razão E/A mitral, Et mitral, E/Et
mitral e pressão capilar pulmonar) e do VD (razão E/A tricúspide, E/Et
tricúspide) não apresentaram diferenças entre os dois grupos.
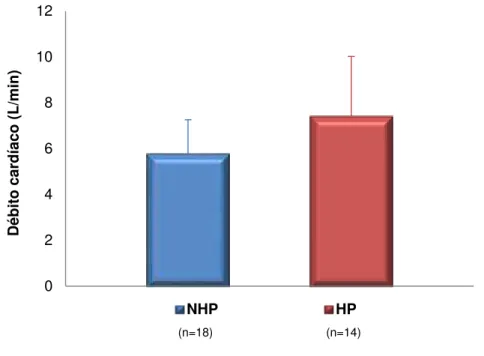
Conforme descrição acima, o débito cardíaco (DC) foi significativamente
maior no grupo com HAP (Gráfico 9) e esta variável se correlacionou
significativamente com a PSAP (Gráfico 10). No entanto, não foi observada
(n=18) (n=14)
Gráfico 9. Débito cardíaco (L/min) de acordo com presença ou não de hipertensão arterial pulmonar (p<0,05). HP: grupo com hipertensão arterial pulmonar; NHP: grupo sem hipertensão arterial pumonar.
Gráfico 10. Correlação entre débito cardíaco (L/min) e pressão sistólica da artéria pulmonar (PSAP, em mmHg) (p=0,0014).
0 2 4 6 8 10 12 Débito cardíaco (L/min) NHP HP
y = 2,2183x + 17,86 R = 0,538 (p<0,01)
0 10 20 30 40 50 60
0,0 2,0 4,0 6,0 8,0 10,0 12,0
PSA
P (mm
Hg)
Gráfico 11. Correlação entre nível de T4 livre e débito cardíaco (p=0,218).
Não foi observada diferença na FEVE entre os grupos com e sem HAP
(Gráfico 12), sendo que esta variável estava normal em todos os 32 pacientes
avaliados.
Quanto à função do ventrículo direito, não foram observadas
associações entre nível sérico de T4 livre e IDMVD (Gráfico 13) e também com
%∆AVD (r=-0,292, p=0,105), ESAT (r=0,229, p=0,208) e St tricúspide (r=0,308,
p=0,087).
A RVP, avaliada pelo método de Wood e pela relação VRT/VTI, não foi
diferente entre os pacientes com e sem HAP, e houve tendência em se
correlacionar com a PSAP (p=0,073, Gráfico 14). O IDMVD foi maior no grupo
com HAP do que no sem HAP (p<0,05, Gráfico 15).
y = 0,204x + 5,6413 R = 0,151 (p=NS)
0,0 2,0 4,0 6,0 8,0 10,0 12,0
0,0 2,0 4,0 6,0 8,0 10,0 12,0 14,0
Débito cardíaco
(L/min)
Gráfico 12. Fração de ejeção do ventrículo esquerdo (FEVE) de acordo com presença ou não de hipertensão arterial pulmonar (p>0,05). HP: grupo com hipertensão arterial pulmonar (n=14); NHP: grupo sem hipertensão arterial pumonar (n=18).
Gráfico 13. Correlação entre nível de T4 livre e índice de desempenho miocárdico do ventrículo direito (IDMVD) (p=0,663).
y = -0,0048x + 0,5537 R = -0,237 (p=NS)
0,0 0,2 0,4 0,6 0,8 1,0
0,0 2,0 4,0 6,0 8,0 10,0 12,0 14,0
Índice de
desempenho
mi
ocárdico do
VD
Gráfico 14. Correlação entre resistência vascular pulmonar (RVP) e pressão sistólica da artéria pulmonar (PSAP) (p=0,073).
(n=18) (n=14)
Gráfico 15. Índice de desempenho miocárdico do ventrículo direito (IDMVD) de acordo com presença ou não de hipertensão arterial pulmonar (p<0,05). HP: grupo com hipertensão arterial pulmonar; NHP: grupo sem hipertensão arterial pumonar.
y = 84,412x + 20,694 R = 0,321 (p=0,073, NS)
0 10 20 30 40 50 60
0,00 0,05 0,10 0,15 0,20 0,25
PSA P ( m m Hg) RVP (VRT/VTI) 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
Índice de desempenho
miocárdico
do VD
4.2 ANÁLISE ANTES E APÓS NORMALIZAÇÃO DO T4 LIVRE
Nesta análise foram comparadas as variáveis clínico-laboratoriais e
ecocardiográficas de 26 pacientes antes e após normalização do T4 livre
(Tabelas 5 e 6). A mediana e os percentis 25% e 75% do intervalo de tempo
entre os ecocardiogramas iniciais e finais foram de 5,00 (2,00-10,5) meses,
respectivamente.
Como esperado, após normalização do T4 livre, houve elevação do peso
corporal, IMC e TSH, e diminuição da frequência cardíaca e todos os pacientes
em classe funcional II da NYHA passaram para classe I (Tabela 5).
Tabela 5. Características clínicas e laboratoriais dos pacientes com hipertireoidismo antes e após normalização do T4 livre.
Antes do tratamento
Após normalização
do T4 livre P
Peso (kg) 56,5 (51,8-62,8) 57,0 (54,0-66,0) <0,05
IMC (Kg/m2) 22,6
r 2,5 23,3 r 2,5 <0,001
Frequência cardíaca (bpm) 90,4 r 14,8 71,9 r 9,2 <0,001
T4 livre (ng/dL) 3,56 (1,89-5,40) 1,08 (0,89-1,44) <0,001
TSH (PUI/mL) 0,02 (0,01-0,07) 1,32 (0,33-3,13) <0,001
CF-I (NYHA) 11 (42,3%) 26 (100,0%) <0,001
CF-II (NYHA) 15 (57,7%) 0 (0,0%) < 0,001
CF-III ou IV (NYHA) 0 (0,0%) 0 (0,0%) NS
As variáveis ecocardiográficas obtidas antes e após normalização do T4
livre estão apresentadas na Tabela 6.
Houve redução significativa do diâmetro diastólico do VE e do átrio
esquerdo. Houve redução também do DC e do índice cardíaco (IC) e da FEVE,
porém não houve alteração da St mitral.
As variáveis relacionadas às características estruturais do coração
direito, como área-AD, volume-AD, áreas diastólica e sistólica do VD e
diâmetro do VD (corte paraesternal longitudinal e apical 4-câmaras)
apresentaram redução significativa de seus valores.
Quanto às variáveis de função ventricular direita, o IDMVD e a %∆AVD
apresentaram melhora significante. A função sistólica regional do VD,
representada pela St tricúspide e ESAT, exibiu redução significativa de seus
valores.
As variáveis de função diastólica do VE (razão E/A mitral, Et mitral, E/Et
mitral e PCP) e do VD (razão E/A tricúspide e E/Et tricúspide) não
apresentaram alterações após normalização do T4 livre.
O tratamento do hipertireoidismo foi acompanhado de redução
Tabela 6. Características ecocardiográficas dos 26 pacientes com hipertireoidismo antes e após normalização do T4 livre.
Antes do tratamento
Após normalização
do T4 livre p
DDVE (mm) 49,3 r 4,2 48,5 r 3,6 <0,05
DSVE (mm) 30,0 (27,8-32,0) 30,0 (29,0-32,3) NS
AE (mm) 35,7 r 3,6 34,5 r 2,9 <0,05
FEVE* 70,0 (66,0-73,3) 66,0 (63,5-71,0) <0,05
DC (L/min) 6,48 r 2,26 4,09 r 0,85 <0,001
IC (L/min/m2) 4,09 r 1,40 2,54 r 0,56 <0,001
St mitral (cm/s) 12,4 r 3,30 11,9 r 3,00 NS
E/A mitral 1,29 r 0,35 1,25 r 0,33 NS
Et mitral (cm/s) 13,0 (11,0-17,0) 13,0 (9,00-17,0) NS
E/Et mitral 7,20 (5,61-9,71) 6,82 (5,08-9,91) NS
PCP (mmHg) 10,8 (8,90-13,9) 10,4 (7,30-14,2) NS
Diâmetro VD (PEL**) (mm) 24,5 r 4,40 23,0 r 4,00 <0,05
Diâmetro VD (apical 4-C***) (mm) 31,0 (27,8-35,0) 29,0 (24,8-33,3) <0,001
ADVD (cm2) 15,0 (11,7-17,6) 13,4 (10,4-17,0) <0,05
ASVD (cm2) 6,20 (5,10-10,1) 4,70 (3,50-7,00) <0,01
Área-AD (cm2) 13,5 (11,2-17,0) 12,0 (10,0-14,0) <0,01
Volume-AD (mL) 32,7 r 10,5 29,1 r 8,10 <0,01
%' AVD 53,8 r 9,60 62,4 r 8,70 <0,001
ESAT (mm) 24,4 r 2,90 22,3 r 2,40 <0,01
St tricúspide (cm/s) 15,0 (13,0-20,0) 14,0 (13,0-15,3) <0,05
IDMVD 0,52 (0,45-0,65) 0,43 (0,40-0,50) <0,01
E/A tricúspide 1,26 (1,11-1,46) 1,51 (1,07-1,71) NS
E/Et tricúspide 5,14 (3,77-6,20) 4,65 (3,73-5,83) NS
PSAP (mmHg) 34,0 r 8,60 21,7 r 4,50 <0,001
RVP (Wood) 1,58 r 0,33 1,42 r 0,33 <0,05
RVP (VRT/VTI) 0,14 r 0,03 0,13 r 0,03 <0,05
Gráfico 16. Evolução da pressão sistólica da artéria pulmonar (mmHg) de 26 pacientes com hipertireoidismo antes do tratamento (PSAP-1) e após normalização do T4 livre (PSAP-2) (p<0,001).
0 10 20 30 40 50 60
PSAP (1) PSAP (2)
O diagnóstico de HAP é realizado principalmente pelas características
hemodinâmicas do cateterismo cardíaco direito, mas o ecocardiograma já foi
extensamente validado para sugerir a presença de alterações morfofuncionais
do VD e a exclusão de causas de HAP relacionadas ao coração esquerdo
(Lang et al., 2005; Rudski et al., 2010), e além disso há ampla disponibilidade
desse método não invasivo.
No presente estudo, a causa mais frequente de hipertireoidismo foi a
doença de Graves. A prevalência de HAP encontrada foi de 43,8% e todos os
pacientes apresentavam grau leve dessa alteração, que regrediu após o
tratamento. Vários autores (Marvisi et al., 2002; Marvisi et al., 2007; Siu et al.,
2001; Nakchbandi et al., 1999) encontraram prevalência de HAP entre 35% a
47% em portadores de hipertireoidismo, sendo essa alteração relatada como
sendo leve e transitória, como observado no presente estudo.
Observou-se que todos os pacientes tinham FEVE normal e ausência de
doença estrutural no coração. Detectou-se aumento significativo do DC e IC
nos pacientes que apresentavam HAP em relação aos sem HAP, sugerindo
estado hiperdinâmico mais acentuado naquele grupo; porém não houve
diferença na FEVE. Os valores das variáveis estruturais do coração esquerdo
como diâmetros diastólico do VE e do átrio esquerdo, e as do coração direito,
como a área-AD, volume-AD e diâmetro do VD também eram maiores no grupo
com HAP. Pode-se sugerir que os pacientes com maior DC apresentaram
maior repercussão nas câmaras cardíacas como um todo e cursaram com
maiores pressões em artéria pulmonar. O DC correlacionou-se positivamente
pulmonar. Essa correlação foi relatada também por Suk et al. (2009), que
observaram ainda diferença significante no diâmetro do átrio esquerdo e no DC
em portadores de hipertireoidismo com HAP, mas não encontraram no
diâmetro diastólico do VE. Entretanto, no presente estudo, verificou-se níveis
mais elevados de DC, o que pode ter ocasionado maior repercussão
hemodinâmica.
Observou-se correlação positiva e significante entre o T4 livre e PSAP,
que foi, no entanto, menor que a observada por Marvisi et al. (2002). Porém,
não houve associação entre T4 livre e DC, o que sugere que o mecanismo
através do qual o hipertireoidismo leva à HAP envolve outros fatores além do
hiperfluxo pulmonar.
Apesar de ter sido observada RVP discretamente mais elevada no grupo
com HAP, não houve diferença entre os grupos. Além disso, a PSAP
aumentada não se correlacionou com a RVP, sugerindo existência de outros
mecanismos determinantes da HAP, sem alterações significativas na
vasculatura pulmonar. Segundo Abbas et al. (2002), que determinaram de
forma não invasiva a RVP, os pacientes podem apresentar PSAP aumentada
secundária ao fluxo transpulmonar aumentado, mesmo cursando com RVP
normal. O presente estudo sugere que o estado hiperdinâmico do
hipertireoidismo estaria causando hiperfluxo pulmonar e, ao contrário do que
ocorre com a resistência vascular sistêmica, a RVP não diminuiu em nossos
pacientes antes do tratamento, e essa associação poderia contribuir para os