Suzana Alcantara
Evolução da Morfologia Floral e Estrutura de Comunidades em um
Clado de Lianas Tropicais (Bignonieae, Bignoniaceae)
Tese apresentada ao Instituto de
Biociências da Universidade de São
Paulo, para a obtenção de Título de
Doutor em Ciências, na Área de
Botânica.
Orientador(a): Lúcia G. Lohmann
São Paulo
Alcantara, Suzana
Evolução da Morfologia Floral e Estrutura
de Comunidades em um Clado de Lianas Tropicais
(Bignonieae, Bignoniaceae)
343 páginas
Tese (Doutorado) - Instituto de
Biociências da Universidade de São Paulo.
Departamento de Botânica.
1. Diversificação fenotípica 2.
Polinização 3. Neotrópico I. Universidade
de São Paulo. Instituto de Biociências.
Departamento de Botânica.
Comissão Julgadora
:
_________________________
_________________________
Prof(a). Dr(a). Prof(a). Dr(a).
_________________________
__________________________
Prof(a). Dr(a). Prof(a). Dr(a).
______________________________
“Nothing in Biology makes sense, except in the light of Evolution.”
Theodore Dobzhansky (The American Teacher, 1973)
“...very little in Evolution makes sense, except in the light of Ecology.”
D
edicatória
A
gradecimentos
À Lúcia G. Lohmann, pela extrema generosidade e por compartilhar comigo muito mais do que seu imenso conhecimento sobre as Bignonieae; por incentivar, apoiar e me ajudar de todas as formas possíveis desde o início deste projeto. Este trabalho jamais teria sido tão produtivo sem o seu otimismo e a sua confiança.
Ao Fernando R. Martins, que influenciou minha formação “ecológica” e científica desde os anos de graduação e cuja colaboração no último capítulo desta tese foi essencial. Meu muito obrigada pelo exemplo de seriedade e profissionalismo, e também pelo carinho.
Ao Richard (Rick) Ree, pela excelente recepção em Chicago, pelas caronas, jantares e principalmente pelas discussões científicas. Pelo confiança, por se empolgar até mais do que eu com as minhas viagens acadêmicas e pela paciência diante da minha “destreza” computacional. Por proporcionar um ótimo ambiente de trabalho, acolhedor e ao mesmo tempo desafiador; por ter se tornado um amigo muito querido e um colaborador indispensável, thanks forever.
Ao Louis Bernard, que embora não tenha participado diretamente deste projeto, foi o primeiro a saber das idéias iniciais (lá em meados de 2004...) e essencial para direcionar meu projeto científico “de vida”. Obrigada pelo bom senso em me mostrar o que seria impossível de ser feito durante um doutorado, pelo espírito visionário e os bons conselhos. Embora eu tenha optado pelas flores, mesmo sabendo que haveria mais complicações do que a arquitetura foliar das samambaias, meu eterno obrigada por ter sido um dos meus mais influentes mentores, e por ter feito Evolução ser tão apaixonante aos olhos de uma aluna de graduação.
Aos amigos Felipe Oliveira e Deren Eaton, que me ajudaram com as análises das matrizes fenotípicas e de convex hull, respectivamente. Suas habilidades e paciência na programação das análises e em explicar os detalhes das rotinas me pouparam horas (talvez meses) preciosos. Sem contar que a troca de experiências e discussões em temas de interesses em comum foram um estímulo necessário e compensador em muitos dos momentos de desânimo durante o doutorado.
Aos curadores dos herbários HBR (Ademir Reis), MBM (Gert Hatschbach), MO (Jim Solomon), R (Rafaella Forzza), SP (Inês Cordeiro), SPF (José Rubens Pirani) e UEC (Washington Oliveira), por permitirem o acesso às exsicatas. Em especial ao Sr. Gert Hatschbach, pela excelente acolhida durante minha visita ao MBM, e ao Dr. José Rubens Pirani, ambos exemplos de dedicação à curadoria e de conhecimentos botânicos. Agradeço também aos Drs. Charlotte Taylor e Bob Magill (MO), pelo acesso a base de dados digitalizada da coleção de Bignoniaceae do TROPICOS, o que otimizou muitíssimo o trabalho de amostragem dos dados.
Aos doutores José Rubens Pirani, Renato de Mello-Silva, Luzia Modolo, Peter Stevens,
Peter Jorgensen, Corrie Moreau, Boris Igic, Andrew Hipp e Joseph (Joe) Williams, pelo estímulo, discussões e comentários preciosos em diversos momentos.
À Diana Carneiro, artista extremamente talentosa e paciente, cuja contribuição conseguiu retratar uma pequena parte de toda beleza atual e histórica das flores das Bignonieae.
À Miriam Kaehler, pela amizade e companheirismo, e sua família, Paulinho e Natália, por dividirem-na comigo durante um ano e por me receberem em sua casa. Aos amigos e
roommates que me abrigaram por diversas ocasiões durante os anos de viagens do doutorado e suas
famílias: Márcio (Má) Lorencini e Raquel (Quel) Berg, Luciana (Lu) Cordeiro e Maurício (Mau) Pozzobon, Maurício Watanabe, Érica Moreira, Erika Kague, Priscila Cortez, Juliana José (Ju!!!) e Tia Marisa, Norma Machado da Silva, Andrea Borges e Claudemir R. Dias, Taís (Tá) N. Mazzola, Marcos Túlio (Tuio) de Oliveira e Emily Mckinney, Sarah O’Brien e Dave Clarke, Dee Runnas, Melanie Treuhaft e Nicole Pattino.
Aos meus queridíssimos amigos botânicos que dividiram comigo muitas das angústias, alegrias, decepções e esperanças ao longo deste trabalho: Maurício Watanabe, Carol Agostini,
Benoît Loeuille e Sara Branco. Em especial, agradeço à Mariane (Mari) de Sousa-Baena,
Marcelo (Má) Pace e Juliana (Ju) Lovo, pela paciência incomensurável; pelo apoio logístico, editorial, espiritual e sentimental e pelos comentários em várias partes desta tese. Sem vocês esse processo teria sido muito mais penoso e o resultado final certamente estaria aquém do obtido.
À toda minha família e aos amigos “das antigas”, pelo carinho, as boas lembranças e o apoio de décadas: Marta Brandão, Maria Ivete Costa, Elaine Alves, Adriana Alcântara,
Portugal, Raphael Theodoro de Castro (Leitão), Rogéria Lopes e Ricardo Soares (Preto).
Aos amigos (Campinas:) Vera Solferini, Juliana José, Taís Nitsch Mazzola, Valéria Forni Martins, Márcio Lorencini, Raquel Berg, Norma Machado, Gustavo Dias, Mirella Crevellaro, Carol Virillo, Gabriel Hornink, Guilherme Aguirre, Flaviana Souza, Luiz Gustavo Fernandes (Garça), Flaviane Fernandes, Luzia Modolo, Priscila Cortez, Flávio Cavalcanti, Andréa Borges, Claudemir Dias, Cristina Sazima, Marcela Pereira, (Saint Louis:)
Felipe Zappata, Paulo Câmara, Alba Arbelaez, Kathy Hulbert, Carmem Ulloa, Juan Carlos Penagos, Tatiana Erika Espinoza, Sabine, Seema Sheth, Carolina (Carito) Romero, Vidal Mansano, Diana Chavez, Mauricio Diazgranados, (Chicago:) Tyana Wachter, Robin Foster,
Juliana Philipp, Corrie Moreau, Deren Eaton, Nate Upham, Brian Wray, Lucinda Lawson,
Nate Smith, George Mugambi, Eimy Rivas-Plata, Brandow Kilbourne, Sara Branco, Maria Vibranovsky, Hedibert Lopes, Marcelo Nóbrega, Margarida Moreira, Carla Araújo, Sheila Dias, Felipe Marin. Muito obrigada pelas ótimas recordações que levarei desta época!
Aos amigos e colegas do laboratório de Sistemática Vegetal da USP, que contribuíram para que esses anos fossem mais divertidos: Alexandre (He-man) Zuntini, Alice Calvente e Leonardo Versieux, Dayane Tarabay, Flávio Gomes, Herbert Freitas, Ju Ottra, Ju Rando, Ju Souza,
Leandro Assis, Leonardo (Caqui) Borges, Lívia Andrade, Luiz Henrique Fonseca, Marcelo Trovó, Mariana Wagner, Matheus (Bozo) Santos, Maura Albergaria, Wesley Pires, Abel Cangussu e Fabiana Begale. Aos amigos do GD de Biogeografia, pelos cafés e panetones na cozinha da Zoologia: Humberto (Teté) Yamaguti, Renata Moretti, Marcio (MBS) Silva,
Ricardo Pinto, Felipe (Fino) Oliveira, Harley Sebastião, George Mattox, Ana Paula (Paulinha) Aprígio, Paula Valdujo. Ao time da disciplina de Processos Evolutivos: Gabriel Marroig, Diogo Meyer, Leila Shirai e Tatiana Almeida. A todos aqueles que me acompanharam nas idas ao campo, que embora escassas foram cruciais para manter minha sanidade durante o doutorado.
Aos integrantes de diversos grupos de discussões que muito contribuíram para meu crescimento acadêmico: Biogeografia (USP), GEEBIC (coordenado por Lúcia G. Lohmann, USP),
Journal Club of Missouri Botanical Garden (MO, St. Louis), Analysis Unity (CCSD, St Louis),
Por último, porém de importância fundamental para realização desta tese, agradeço as instituições que financiaram e apoiaram este projeto e aos seus funcionários que facilitaram em todos os aspectos possíveis sua realização: Laboratório de Sistemática Vegetal e Instituto de Biociências da Universidade de São Paulo (especialmente aos secretários Norberto e Helder),
Resumo
Abstract
Índice
Introdução Geral
Histórico dos estudos sobre evolução floral ...02
Interações Polinizador-Planta e Estrutura de Comunidades ...07
Diversidade, Evolução e Ecologia da Tribo Bignonieae ...10
Organização geral desta tese ...14
Referências ...16
Capítulo 1: Evolução da morfologia floral e sistemas de polinização em Bignonieae (Bignoniaceae) 1.1. Resumo ...23
1.2. Introdução ...24
1.3. Manuscrito resultante do Capítulo 1...26
1.4. Resultados e considerações complementares ...90
1.5. Referências...106
Capítulo 2: Taxas de evolução e sinais filogenéticos contrastantes em caracteres florais de um clado de lianas Neotropicais 2.1. Resumo...113
2.2. Introdução...114
2.3. Manuscrito resultante do Capítulo 2...117
2.4. Considerações complementares ...150
2.5. Referências...152
Capítulo 3:Integração fenotípica em flores de lianas Neotropicais (Bignonieae, Bignoniaceae) 3.1. Resumo ...158
3.2. Introdução ...159
3.3. Manuscrito resultante do Capítulo 3 ...161
3.4. Considerações complementares...216
3.5. Referências ...218
Capítulo 4: Efeito da filogenia, ambiente e morfologia floral na estrutura de comunidades de lianas tropicais (Bignonieae, Bignoniaceae) 4.1. Resumo...223
4.2. Introdução ...224
4.3. Manuscrito resultante do Capítulo 4 ...227
4.4. Considerações complementares...263
4.5. Referências...265
Considerações finais ...272
Referências ...276
Epílogo ...277
Anexos Anexo 1: Lista de material examinado para amostragem dos caracteres quantitativos ...279
Anexo 2: Matriz de ocorrência de espécies de Bignonieae por localidade ...294
Anexo 3: Lista de trabalhos apresentados em congresso e palestras resultantes desta tese ...313
Anexo 4: Manuscrito publicado no American Journal of Botany em maio de 2010 ...314
I
ntrodução
G
er
al
“Without the gift of flowers and the infinite diversity of their fruits, man and bird,
if they had continued to exist at all, would be today unrecognizable.
The weight of a petal has changed the face of the world and made it ours.”
H
istórico dos Estudos sobre Evolução Floral
As angiospermas representam o maior grupo de plantas existente atualmente, compreendendo aproximadamente 1/6 de todas as espécies vivas descritas (Waser, 2006). A diversidade de formas e estratégias associadas aos órgãos reprodutivos das angiospermas tem suscitado o interesse científico pelas flores há pelo menos três séculos. Observações de campo evidenciaram associações entre formas florais e a visitação por determinados animais, as quais começaram a ser investigadas experimentalmente por Joseph Gottlieb Kölreuter (1733-1806), que fundou as bases da biologia da polinização e foi o primeiro pesquisador a reconhecer animais como polinizadores. Além da descrição de polinização por vento, insetos e auto-polinização, suas observações também incluíram questões sobre as características sexuais das flores e a hibridação em várias espécies (Mayr, 1986).
Após os trabalhos de Kölreuter (publicados em 1761, 1763, 1764 e 1766), o livro de Christian Konrad Sprengel publicado em 1793 representa o segundo grande marco nos estudos de biologia floral. Esse estudo foi o primeiro a apresentar uma abordagem comparativa entre muitas de espécies, a partir do acúmulo de informações sobre a relação entre espécies de plantas e seus polinizadores (Vogel, 1996). Nesse aspecto, o trabalho de Sprengel foi complementar ao de Kölreuter, que empregava uma abordagem experimental, focada em uma determinada espécie (Mayr, 1986). Além disso, Sprengel também foi o primeiro a buscar uma “ordem” na diversidade de fenótipos florais, correlacionando-os às relações observadas entre plantas e polinizadores, em um sistema de classificação que foi a base das idéias que culminaram nos conceitos associados às síndromes de polinização, um conceito que ainda hoje é crucial para a biologia da polinização (Waser, 2006).
estudos sobre a sexualidade das plantas (Vogel, 1996). Entretanto, ao contrário de Sprengel, que via um “desenho intencional” na morfologia das flores para a adequação à polinização por determinados vetores, Darwin (1859, 1862) defendia que tais morfologias são um exemplo de adaptação resultante do processo de seleção natural. Além disso, o trabalho de Kölreuter sobre hibridação também influenciou Darwin (ver 1876, 1877), que aprimorou a idéia inicial de Kölreuter de que plantas e polinizadores diferem nos interesses que determinam a dinâmica das interações mutualísticas entre ambos (respectivamente, reprodução sexual vs. obtenção de recursos) (Waser, 2006). Em seu famoso livro sobre a polinização de orquídeas, Darwin (1862) contextualiza o estudo dos processos de polinização dentro da teoria evolutiva e contribui com informações detalhadas sobre a polinização de várias espécies, com o objetivo de evidenciar que a seleção natural favorece a fecundação cruzada e que a morfologia floral é adaptada à reprodução sexuada e, conseqüentemente, à atração de polinizadores. Seguindo essa mesma linha, os alemães Hermann Müller, em 1873, e Paul Knuth, entre 1898 e 1905, publicaram compêndios importantes relatando em detalhes a polinização de muitas espécies (Waser, 2006). O Handbook of flower pollination de Knuth é conhecido como o “Velho Testamento” da biologia da polinização (Baker, 1983) e encerra uma época de extensivo acúmulo de dados sobre as relações entre flores e polinizadores.
amplamente difundidas pelo trabalho de Faegri & van der Pijl (1966) que, ao contrário de Vogel, defendiam que a especialização a determinados polinizadores seria a norma na natureza e que flores generalistas seriam “mal-adaptadas” ou primitivas, o que se tornou um paradigma na segunda metade do século XX.
Embora amplamente difundidas e aceitas pela maior parte dos botânicos, as síndromes de polinização e a pressuposta prevalência da especialização nas relações planta-polinizador provocaram grande polêmica entre ecólogos, que evidenciaram uma ampla gama de visitantes florais mesmo em flores classificadas dentro de uma determinada síndrome (Herrera, 1988; 1996; Olerton, 1996; Waser et al., 1996). O conceito de polinizador mais efetivo (Stebbins, 1970) e a re-avaliação do papel funcional das estratégias generalistas (Waser et al., 1996) representam algumas das tentativas de conciliar o aparente paradoxo entre as síndromes florais e as observações empíricas. Esse assunto ainda é motivo de debate (ver Waser & Ollerton, 2006), embora a utilização do conceito de síndrome de polinização sob uma perspectiva evolutiva venha ganhando espaço (ver Capítulo 1 desta tese).
& Bierzychudek, 2007), embora botânicos e ecólogos tenham demorado algumas décadas para empregar abordagens explicitamente evolutivas em estudos sobre a variação floral.
Após os anos 50, uma das contribuições conceituais mais importantes aos estudos sobre evolução morfológica a partir de modelos de seleção fenotípica foi feita por Raquel Berg (1959, 1960), que apresentou o conceito de “plêiades” utilizando como exemplo empírico as correlações entre caracteres florais. Segundo a autora, flores polinizadas por animais estariam sujeitas à uma maior pressão seletiva favorecendo a constância nas correlações entre caracteres, as quais seriam fortemente mantidas por adaptação e posteriormente resultariam numa canalização durante o desenvolvimento dessas flores quando comparadas à flores auto-polinizadas ou polinizadas pelo vento. As idéias de correlação e canalização entre caracteres funcionalmente associados foram desenvolvidas sob os conceitos de integração fenotípica, que se refere ao padrão de correlação entre caracteres que compõem um organismo (Cheverud, 1982) e modularidade, que se refere a articulação diferencial entre partes de um organismo mais ou menos correlacionadas (Wagner & Altenberg, 1996). Entender os padrões de correlação entre caracteres é primordial para a compreensão da evolução de órgãos e organismos complexos, formados por módulos diferencialmente integrados. Apesar da contribuição inicial de Berg para o estudo da evolução de caracteres complexos, o estudo de flores ou outros órgãos vegetais como caracteres complexos somente começou a ser realizado recentemente (Waitt & Levin, 1997; Armbruster et al., 1999; 2004; Pérez et al., 2007; Ordano et al., 2008). Entretanto, esses estudos ainda se concentram em poucas amostragens experimentais, com foco em uma ou poucas espécies, e carecemos de amostragens comparativas que permitam identificar os padrões macroevolutivos associados à evolução dos padrões de correlação entre caracteres (ver Capítulo 3 desta tese).
alo-cruzamento, na evolução dos sistemas sexuais, nas estratégias de gênero e na alocação de recursos passou a ser considerada um fator crucial para o entendimento da diversificação das flores e dos sistemas de cruzamento (Lloyd, 1992, ver também Barrett, 1998). Por outro lado, trabalhos experimentais caracterizando a seleção desempenhada por polinizadores em condições naturais também vêm se intensificando nas últimas três décadas (revistos em Harder & Johnson, 2009). Alguns deste trabalhos têm sido particularmente informativos para o entendimento de processos de diversificação adaptativa (Bradshaw & Schemske, 2003; Kay et al., 2005; 2006), indicando que agentes seletivos indiretos e até antagônicos aos polinizadores podem influenciar a evolução floral (Strauss & Whittall, 2006; Harder & Johnson, 2009). Contrapondo as idéias iniciais de que as flores representam adaptações a um determinado agente polinizador, ecólogos e evolucionistas vêm ressaltando a importância de outros fatores seletivos e não-seletivos para a evolução floral (ver exemplos em Herrera, 1996; Galen, 1999; Waser et al., 1996; Armbruster, 2002; Herrera et al., 2002; Strauss & Whittall, 2006). Particularmente, os trabalhos de Waser et al. (1996), Armbruster (2002) e Herrera et al. (2002) evidenciam como relações entre plantas e polinizadores são dinâmicas no tempo e no espaço e como a história das linhagens pode influenciar a morfologia floral, afetando conseqüentemente as interações polinizador-planta.
em um contexto explicitamente filogenético, utilizando como modelo de estudo uma linhagem de lianas tropicais (a tribo Bignonieae, família Bignoniaceae). Além disso, abordei alguns aspectos sobre a estrutura de comunidades taxonomicamente delimitadas (taxocenoses) de modo a incluir somente espécies desse clado devido à influência recíproca do contexto ecológico para a evolução da morfologia floral e da variação floral para a estrutura de comunidades vegetais (ver próxima seção).
I
nterações Polinizador-Planta e Estrutura de Comunidades Vegetais
Aproximadamente 90% das fanerógamas são polinizadas por animais (Linder, 1998), o que evidencia que os polinizadores são um recurso primordial para as angiospermas (Ollerton et al., 2006). Evolutivamente, a diversificação dos sistemas de polinização está associada à diversificação explosiva das angiospermas na metade do Cretáceo (Grimaldi, 1999), e há evidências de que a diversificação de alguns grupos de insetos coincidem com a diversificação das angiospermas (Farrel & Mitter, 1998; Moreau et al., 2006). Por outro lado, do ponto de vista ecológico, as interações polinizador-planta influenciam a dinâmica e a estrutura das comunidades vegetais por afetar as relações intra e inter-específicas entre plantas que compartilham polinizadores (Heithaus, 1974; Gentry, 1974b; Armbruster, 1986; Pleasants, 1990). Em geral, é esperado que espécies com fenótipo floral semelhante atraiam os mesmos grupos de polinizadores, o que pode levar à competição entre espécies de plantas pelos polinizadores ou à facilitação, o que diminui o efeito da competição e ao mesmo tempo aumenta a permanência de polinizadores em uma determinada área (Ghazoul, 2006).
1972). Entretanto, a utilização diferencial de polinizadores impede a ocorrência de exclusão competitiva por interferência reprodutiva entre espécies que dependem dos mesmos vetores de pólen, permitindo um aumento na riqueza de espécies em uma comunidade (Ollerton et al., 2003). O uso diferencial de polinizadores pode ocorrer por: (i) aumento do tamanho de nicho pela utilização de vetores de pólen que não são normalmente utilizados, (ii) diminuição do tamanho de nicho por especialização a uma gama menor de polinizadores e (iii) aumento da sobreposição de nicho a partir do compartilhamento de polinizadores entre taxa, possivelmente facilitado pelo deslocamento de caracteres (Armbruster 1986, 1995, 2006; Armbruster et al., 1994; Ollerton et al. 2003; Sargent & Ackerly, 2008).
Os mecanismos que possibilitam a co-ocorrência de espécies que compartilham polinizadores são importantes sobretudo nos trópicos, devido ao maior número de espécies de plantas que co-ocorrem em uma mesma comunidade. Apesar das dificuldades logísticas em obter evidências experimentais desses mecanismos, alguns padrões apóiam a idéia de que a especialização a polinizadores nos trópicos é maior do que em regiões de clima temperado. Ollerton e colaboradores (2006) demonstram que a maior complexidade estrutural e a maior riqueza de espécies de plantas nos trópicos estão positivamente correlacionadas a uma maior especialização ecológica a diferentes grupos de insetos, quando comparado a comunidades temperadas e subtropicais. Do ponto de vista taxonômico, também há evidências de que a especialização evolutiva/funcional a diferentes grupos de polinizadores seja favorecida em linhagens tropicais quando comparada a linhagens temperadas (Fenster et al., 2004; Armbruster, 2006).
espécies que ocorrem em uma determinada área, as quais demonstram menor variação fenotípica quando comparadas às espécies que ocorrem em áreas onde não há limitação do recurso (Cornwell et al., 2006; Pausas & Verdú, 2008). No contexto das interações polinizador-planta, por exemplo, regiões temperadas podem ser consideradas um filtro ao estabelecimento de espécies polinizadas exclusivamente por beija-flores, já que esse grupo de polinizadores não ocorre em tais regiões (Sargent & Ackerly, 2008). Por essa razão, não é esperada a ocorrência de flores com o fenótipo corola tubular, vermelha, estreita e longa, com anteras exsertas e néctar diluído.
Devido a esses aspectos, entender os padrões de evolução de características fenotípicas (como a presença de direcionalidade, taxas de evolução e sinal filogenético) e de co-ocorrência entre espécies em diferentes escalas, considerando os fatores ambientais relacionados à ocorrência das espécies, a história evolutiva das espécies (refletida na estrutura filogenética de comunidades) e a similaridade morfológica das espécies co-ocorrentes, é extremamente relevante para determinarmos quais recursos são importantes para a estruturação das comunidades e quais processos determinam a distribuição dessas espécies, principalmente em ambientes estruturalmente diversos, como os trópicos (MacArthur, 1972). Além disso, determinar o contexto ecológico de co-ocorrência entre espécies nos permite associar os padrões de evolução morfológica de um determinado clado a processos causais, ainda que indiretamente. Assim, estudar a estrutura filogenética de comunidades de Bignonieae nos permite um entendimento mais amplo sobre os fatores que afetaram a evolução floral na tribo, resultando na diversidade de morfologias e estratégias de polinização encontradas entre as espécies atuais.
D
iversidade, Evolução e Ecologia da Tribo Bignonieae
Prancha 1. Características da tribo Bignonieae. A. Anemopaegma acutifolium DC., hábito arbustivo. B.
A presença de lianas é uma característica marcante de formações tropicais, ao contrário de florestas temperadas (Schnitzer & Bongers, 2002). Assim, a tribo Bignonieae desempenha papel fundamental na estrutura de florestas tropicais por constituir o maior clado de lianas do Neotrópico (Lohmann, 2006). Por essa razão, entender os processos envolvidos na diversificação de Bignonieae pode representar avanços consideráveis ao entendimento da evolução de grupos lianescentes em geral. Nas últimas décadas, um grande número de estudos ecológicos vêm determinando a influência das lianas na dinâmica de comunidades florestais e o efeito de diferentes aspectos ambientais na sobrevivência das mesmas (Phillips et al., 2002; Schnitzer & Bongers, 2002; Gilbert et al., 2006). Estudos evolutivos, entretanto, ainda são escassos (Lohmann, 2003; 2006; Pace et al., 2009). Schnitzer & Bongers (2002) ressaltam a ausência de estudos de biologia reprodutiva em lianas, tanto ecológicos quanto evolutivos. Apesar a ausência de estudos comparativos, a tribo Bignonieae tem sido particulamente bem estudada quanto à morfologia floral, bastante variável, que durante muito tempo foi utilizada para classificação taxonômica da tribo (Lohmann, in press). Alwyn H. Gentry (1974a, 1990) realizou descrições detalhadas das morfologias florais e definiu “tipos” florais análogos às síndromes de polinização para o grupo, embora informações sobre as relações entre as Bignonieae e seus polinizadores fosse bastante escasso há 20 anos atrás. Estudos focando a polinização das espécies, entretanto, vêm aumentando nas últimas décadas, mas abordagens evolutivas sobre morfologia e estratégias reprodutivas ainda são ausentes para o grupo e para clados lianescentes em geral (ver Capítulo 1).
polinizadores seria fundamental para estruturação das comunidades de Bignoniaceae por saturação com relação aos nichos representados pelos polinizadores (Gentry, 1974a). Esse cenário, assim como vários outros, pode ser empiricamente avaliado a partir de uma abordagem integrativa, que incorpore aspectos filogenéticos, ecológicos e da biologia das espécies estudadas e testes de predições específicas quanto aos padrões filogenéticos encontrados.
Com base no extenso volume de informações levantadas por A. H. Gentry e L. G. Lohmann sobre a distribuição e a morfologia das espécies de Bignonieae, nas recentes filogenias reconstruídas para a tribo (Lohmann, 2003; 2006) e na disponibilidade de uma análise de datação filogenética calibrada por registro fóssil (Lohmann et al., in prep.), utilizei análises filogenéticas comparativas para testar hipóteses formuladas sob o arcabouço conceitual apresentado ao longo desta Introdução. Os objetivos gerais desta tese foram organizados em quatro tópicos:
1. Re-avaliar as associações entre morfologia floral e polinizadores (“síndromes de polinização”) propostas para Bignonieae com base na revisão de estudos de polinização para o grupo e determinar o padrão de evolução das diferentes morfologias florais na tribo;
2. Testar se a variação em caracteres quantitativos representativos dos quatro verticilos florais (cálice, corola, androceu e gineceu) está correlacionada ao parentesco filogenético entre as espécies e se há sinais de conservantismo ou divergência morfológica entre espécies próximas;
3. Caracterizar as correlações fenotípicas entre caracteres quantitativos e avaliar a influência da filogenia e das diferentes morfologias florais no padrão e na magnitude das correlações, visando determinar os padrões evolutivos e funcionais de integração fenotípica;
As hipóteses específicas testadas são apresentadas ao longo dos capítulos da tese. É crucial salientar que este projeto de tese só pode ser idealizado e concretizado devido ao esforço amostral acumulado durante décadas quanto à caracterização taxônomica, morfológica e ecológica das Bignonieae (Gentry, 1972; Lohmann, 2003) e principalmente devido à disponibilidade das filogenias utilizadas (Lohmann, 2006; Lohmann et al., in prep.). Como em todo estudo comparativo, o levantamento e a compilação de um grande volume de dados e a qualidade desses dados foram fatores essenciais, que dependeram não só do trabalho de amostragem que realizei durante o doutorado mas também do trabalho de outros pesquisadores que se dedicaram ao estudo dessas plantas, aos quais sou muito grata por possibilitarem a realização de um estudo desta abrangência. Além dos dados previamente acumulados, também contei com a colaboração indispensável de diversos pesquisadores ao longo da elaboração de cada um dos capítulos, os quais são co-autores dos manuscritos resultantes desta tese e, assim como minha orientadora, foram indispensáveis por complementar o conhecimento necessário para que cada um dos capítulos fosse concluído.
O
rganização geral desta tese
Os quatro tópicos que compõem esta tese estão apresentados na forma de capítulos. Cada um dos quatro capítulos está organizado da seguinte maneira:
1. Resumo ( português);
2. Introdução (português): contextualiza cada capítulo;
3. Manuscrito resultante (inglês): apresenta os principais resultados de cada capítulo em forma de artigo científico tal como aceito ou preparado para publicação;
inclusos nos manuscritos preparados para publicação.
5. Referências: apresentadas por capítulo, em ordem alfabética. As referências citadas nos manuscritos estão marcadas com *, as demais são citadas apenas nas sessões Introdução ou Resultados e considerações complementares de cada capítulo.
Embora essa forma de organização seja diferente da organização comumente adotada em teses e dissertações, isso permite tanto a apresentação do resultado final, representado pelos manuscritos apresentados à comunidade científica, quanto a apresentação de passos intermediários a esse processo. Esses passos intermediários não são normalmente incluídos nos artigos científicos, mas foram indispensáveis para a realização desta tese.
R
eferências
Armbruster, W. S. 1986. Reproductive interactions between sympatric Dalechampia species: are natural assemblages “random” or organized? Ecology 67: 522-533.
Armbruster, W. S. 1995. The origins and detection of plant community structure: Reproductive versus vegetative processes. Folia Geobotanica Phytotaxonomica 30: 483-497.
Armbruster, W. S. 2002. Can indirect selection and genetic context contribute to trait diversification? A transition-probability study of blossom-colour evolution in two genera.
Journal of Evolutionary Biology 15: 468-486.
Armbruster, W. S. 2006. Evolutionary and ecological aspects of specialized pollination: Views from the Artic to the Tropics. In N. M. Waser & J. Ollerton [eds]. Plant-pollinator interactions: From specialization to generalization, 260-282. University of Chicago Press, Chicago, EUA. Armbruster, W. S., M. E. Edwards & E. M. Debevec. 1994. Character displacement generates
assemblage structure of Western Australian triggerplants (Stylidium). Ecology 75: 315-329. Armbruster, W. S., V. S. DiStilio, J. D. Tuxill, T. C. Flores & J. L. V. Runk. 1999. Covariance and
decoupling of floral and vegetative traits in nine Neotropical plants: a re-evaluation of Berg's correlation-pleiades concept. American Journal of Botany 86: 39-55.
Baker, H. G. 1983. An outline of the history of anthecology, or pollination biology. In: L. Real [ed]. Pollination biology, 7-28. Academic Press, Orlando, EUA.
Barrett, S. C. H. 1998. The evolution of mating strategies in flowering plants. Trends in Plant Science 3: 335-341.
Bawa, K. S. 1990. Plant-pollinator interactions in tropical rain forests. Annual Review of Ecology and Systematics 31: 399-422.
Bradshaw, H. D & D. H. Schemske. 2003. Allele substitution at a flower colour locus produces a pollinator shift in monkeyflowers. Nature 426: 176-178.
Berg, R. L. 1959. A general evolutionary principle underlying the origin of developmental homeostasis. American Naturalist 93: 103-105.
Berg, R. L. 1960. The ecological significance of correlation pleiades. Evolution 14: 171-180. Case, A. L., S. W. Graham, T. D. Macfarlane & S. C. H. Barrett. 2008. A phylogenetic study of
evolutionary transitions in sexual systems in Australasian Wurmbea (Colchicaceae).
International Journal of Plant Sciences 169: 141-156.
Cavender-Bares, J., D. D. Ackerly, D. A. Baum & F. A. Bazzaz. 2004. Phylogenetic overdispersion in Floridian oak communities. American Naturalist 163: 823-843.
cranium. Evolution 36: 499-516.
Cornwell, W. K., D. W. Schwilk & D. D. Ackerly. 2006. A trait-based test for habitat filtering: convex hull volume. Ecology 87: 1465-1471.
Darwin, C. R. 1859. On the origin of species by means of natural selection, or the preservation of favoured races in the struggle for life. John Murray, London, RU.
Darwin, C. R. 1862. On the various contrivances by which orchids are fertilized by insects. John Murray, London, RU.
Darwin, C. R. 1876. The effects of cross and self fertilisation in the vegetable kingdom. John Murray, London, RU.
Darwin, C. R. 1877. The different forms of flowers on plants of the same species. John Murray, London, RU.
East, E. M. 1916. Studies on size inheritance in Nicotiana. Genetics 1: 164-176.
Elton, C. 1946. Competition and the structure of ecological communities. Journal of Animal Ecology 15: 54-68.
Fægri, K. & L. van der Pijl. 1966. The principles of pollination ecology. Pergamon, Oxford, RU. Farrel, B. D. & C. Mitter. 1998. The timing of insect/plant diversification: might Tetraopes
(Coleoptera: Cerambycidae) and Asclepias (Asclepiadaceae) have co-evolved? Biological Journal of the Linnean Society 63: 553-577.
Fenster, C. B., W. S. Armbruster, P. Wilson, M. R. Dudash & J. D. Thomson. 2004. Pollination syndromes and floral specialization. Annuals Review of Ecology, Evolution and Systematics
35: 375-403.
Fischer, E., I. Theisen & L. G. Lohmann. 2004. Bignoniacae. In: K. Kubitzki & J. W. Kadereit [eds]. The families and genera of vascular plants. VII. Flowering plants. Dicotyledons. Lamiales (except Acanthaceae including Avicenniaceae). Springer-Verlag, Berlim, Alemanha.
Fisher, R. A. 1918. The correlation between relatives on the suppostion of Mendelian inheritance.
Transactions of the Royal Society of Edinburgh 52: 399-433. Galen, C. 1999. Why do flowers vary? Bioscience 49: 631-640.
Gentry, A. H. 1974a. Coevolutionary patterns in Central American Bignoniaceae. Annals of the Missouri Botanical Garden 61: 728-759.
Gentry, A. H. 1974b. Flowering phenology and diversity in tropical Bignoniaceae. Biotropica 6: 64-68.
Gentry, A. H. 1990. Evolutionary patterns in Neotropical Bignoniaceae. Memoirs of the New York Botanical Garden 55: 118-129.
Gentry, A. H. 1992. An eco-evolutionary study of the Bignoniaceae of Southern Central America. Ph.D. dissertation, Washington University - Saint Louis, Saint Louis, EUA.
Ghazoul, J. 2006. Floral diversity and the facilitation of pollination. Journal of Ecology 94: 295-304.
Gilbert, B., S. J. Wright, H. C. Muller-Landau, K. Kitakima & A. Hernandéz. 2006. Life history trade-offs in tropical trees and lianas. Ecology 87: 1281-1288.
Grimaldi, D. 1999. The co-radiations of pollinating insects and angiosperms in the Cretaceous.
Annals of the Missouri Botanical Garden 86: 373-406.
Harder, L. D. & S. C. H. Barret. 2006. The ecology and evolution of flowers. Oxford University Press, Oxford, RU.
Harder, L. D. & S. D. Johnson. 2009. Darwin’s beautiful contrivances: evolutionary and functional evidence for floral adaptation. New Phytologist 183: 530-545.
Heithaus, E. R. 1974. The role of plant-pollinator interactions in determining community structure.
Annals of the Missouri Botanical Garden 61: 675-691.
Herrera, C. M. 1988. Variation in mutualisms: The spatiotemporal mosaic of a pollinator assemblage. Biological Journal of the Linnean Society 35: 95-125.
Herrera, C. M. 1996. Floral traits and plant adaptation to insect pollinators: A devil’s advocate approach. In D. G. Lloyd & S. C. H. Barrett [eds]. Floral Biology: Studies on floral evolution in animal-pollinated plants, 65-87. Chapman & Hall, New York, EUA.
Herrera, C. M., X. Cerdá, M. B. García, J. Guitián, M. Medrano, P. J. Rey & M. Sánchez-Lafuente. 2002. Floral integration, phenotypic covariance structure and pollinator variation in bumblebee-pollinated Helleborus foetidus. Journal of Evolutionary Biology 15: 108-121. Kay, K. M., P. A. Reeves, R. G. Olmstead & D. W. Schemske. 2005. Rapid speciation and the
evolution of hummingbird pollination in neotropical Costus subgenus Costus (Costaceae): evidence from nrDNA, ITS and ETS sequences. American Journal of Botany 92: 1899-1910. Kay, K. M., C. Voelckel, J. Y. Yang, K. M. Hufford, D. D. Kaska & S. A. Hodges. 2006. Floral
characters ad species diversification. In L. D. Harder & S. C. H. Barrett [eds]. The ecology and evolution of flowers, 311-325. Oxford University Press, Oxford, RU.
Kraft, N. J. B., W. K. Cornwell, C. O. Webb & D. D. Ackerly. 2007. Trait evolution, community assembly, and the phylogenetic structure of ecological communities. American Naturalist
170: 271-283.
[eds]. Reproductive biology in systematics, conservation, and economic botany, 123-135. Royal Botanic Gardens, Kew, RU.
Lloyd, D. G. 1992. Evolutionary stable strategies of reproduction in plants: Who benefits and how?
In: R. Wyatt [ed]. Ecology and evolution of plant reproduction, 137-168. Chapman and Hall, New York, EUA.
Lohmann, L. G. 2003. Phylogeny, classification, morphological diversification and biogeography of Bignonieae (Bignoniaceae, Lamiales). Ph.D. dissertation, University of Missouri - Saint Louis, Saint Louis, EUA.
Lohmann, L. G. 2006. Untangling the phylogeny of neotropical lianas (Bignonieae, Bignoniaceae).
American Journal of Botany 93: 304-318.
Lohmann, L. G. in press. A new generic classification of Bignonieae (Bignoniaceae) based on molecular phylogenetic data and morphological synapomorphies. Annals of the Missouri Botanical Garden.
Lohmann, L. G. & C. Ulloa. 2006. Bignoniaceae. In: iPlants prototype checklist. www.iplants.org. Lohmann, L. G., R. C. Winkworth & C. Bell. in prep. Pattern and timing of biogeographic history
in the Neotropical Tribe Bignonieae (Bignoniaceae).
Losos, J. B. 2008. Phylogenetic niche conservatism, phylogenetic signal and the relationship between phylogenetic relatedness and ecological similarity among species. Ecology Letters
11: 995-1007.
MacArthur, R. H. 1972. Geographical Ecology. Harper & Row, New York, EUA.
Mayr, E. 1986. Joseph Gottlieb Kölreuter’s contributions to biology. Osiris (Series 2) 2: 135-176. Moreau, C. S., C. D. Bell, R. Vila, S. B. Archibald & N. E. Price. 2006. Phylogeny of the ants:
Diversification in the age of angiosperms. Science 312: 101-104.
Olerton, J. 1996. Reconciling ecological processes with phylogenetic patterns: The apparent paradox of plant-pollinator systems. Journal of Ecology 84: 767-769.
Ollerton, J., S. D. Johnson, L. Cramer & S. Kellie. 2003. The pollination ecology of an assemblage of grassland asclepiads in South Africa. Annals of Botany 92: 807-834.
Ollerton, J., S. D. Johnson & A. B. Hingston. 2006. Geographical variation in diversity and specificity of pollination systems. In N. M. Waser & J. Ollerton [eds]. Plant-pollinator interactions: From specialization to generalization, 238-308. University of Chicago Press, Chicago, EUA.
Ordano, M., J. Fornoni, K. Boege & C. A. Domínguez. 2008. The adaptive value of phenotypic floral integration. New Phytologist 179: 1183-1192.
in Bignonieae (Bignoniacae). Evolution & Development 11: 465-479.
Pausas, J. G. & M. Verdú. 2008. Fire reduces morphospace occupation in plant communities.
Ecology 89: 2181-2186.
Pérez, F., M. T. K. Arroyo & R. Medel. 2007. Phylogenetic analysis of floral integration in
Schizanthus (Solanaceae): Does pollination truly integrate corolla traits? Journal of Evolutionary Biology 20: 1730-1738.
Phillips O. L., R. V. Martínez, L. Arroyo, T. R. Baker, T. Killeen, S. L. Lewis, Y. Malhi, A. M. Mendoza, D. Neillq, P. N. Vargas, M. Alexiades, C. Cerón, A. Di Fiore, T. Erwin, A. Jardim, W. Palacios, M. Saldias & B. Vinceti. 2002. Increasing dominance of large lianas in Amazonian forests. Nature 418: 770-774.
Pleasants, J. M. 1990. Null-model tests for competitive displacement: the fallacy of not focusing on the whole community. Ecology 71: 1078-1084.
Sargent, R. D. & D. D. Ackerly. 2008. Plant-pollinator interactions and the assembly of plant communities. Trends in Ecology and Evolution 23: 123-130.
Schemske, D. W. & P. Bierzychudek. 2007. Spatial differentiation for flower color in the desert annual Linanthus parryae: Was Wright right? Evolution 61: 2528-2543.
Schnitzer, S. A. & F. Bongers. 2002. The ecology of lianas and their role in forests. Trends in Ecology and Evolution 17: 223-230.
Stebbins, G. L. 1950. Variation and Evolution in Plants. Columbia University Press, New York, EUA.
Stebbins, G. L. 1970. Adaptive radiation of reproductive characteristics in angiosperms. I: pollination mechanisms. Annual Review of Ecology and Systematics 1: 307-326.
Strauss, S. Y. & J. B. Whittall. 2006. Nonpollinator agents of selection on floral traits. In L. D. Harder & S. C. H. Barrett [eds]. The ecology and evolution of flowers, 120-138. Oxford University Press, Oxford, RU.
Tripp, E. A. & P. S. Manos. 2008. Is floral specialization an evolutionary dead-end? Pollination system transition in Ruellia (Acanthaceae). Evolution 62: 1712-1737.
Vamosi, J. C., T. M. Knight, J. A. Steets, S. J. Mazer, M. Burdl & T. Ashman. 2006. Pollination decays in biodiversity hotspots. Proceedings of National Academy of Science of USA 103: 956-961.
van der Pijl, L. 1961. Ecological aspects of flower evolution. II. Zoophilous flower classes.
Evolution 15: 44-59.
Vogel, S. 1996. Christian Konrad Sprengel’s theory of the flower: The cradle of floral ecology. In
animal-pollinated plants, 44-62. Chapman and Hall, New York, EUA.
Wagner, G. P. & L. Altenberg. 1996. Complex adaptations and the evolution of evolvability.
Evolution 50: 967-976.
Waitt, D. E. & D. A. Levin. 1997. Genetic and phenotypic correlation in plants: a botanical test of Cheverud’s conjecture. Heredity 80: 310-319.
Waser, N. M. 2006. Specialization and generalization in plant-pollinator interactions: a historical perspective. In N. M. Waser & J. Ollerton [eds]. Plant-pollinator interactions: From specialization to generalization, 3-17. University of Chicago Press, Chicago, EUA.
Waser, N. M., L. Chittka, M. V. Price, N. Williams & J. Ollerton. 1996. Generalization in pollination systems, and why it matters. Ecology 77: 279-296.
Waser, N. M. & J. Ollerton. 2006. Plant-pollinator interactions: From specialization to generalization. University of Chicago Press, Chicago, EUA.
Webb, C. O. 2000. Exploring the phylogenetic structure of ecological communities: an example for rain forest trees. American Naturalist 156: 145-155.
Webb, C. O., D. D. Ackerly, M. A. McPeek & M. J. Donoghue. 2002. Phylogenies and community ecology. Annual Review of Ecology and Systematics 33: 475-505.
Weiher, E., G. D. P. Clarke & P. A. Keddy. 1998. Coomunity assembly rules, morphological dispersion, and the coexistence of plant species. Oikos 81: 309-322.
Wright, S. 1943a. Isolation by distance. Genetics 28: 114-138.
Wright, S. 1943b. An analysis of local variability of flower color in Linanthus parryae. Genetics
Capítulo 1:
Evolução da morfologia floral
e sistemas de polinização em Bignonieae (Bignoniaceae)
“If a man could pass through Paradise in a dream
and have a flower presented to him as a pledge that his soul had really been there,
and if he found that flower in his hand when he awake – Aye, what then?”
E
volução da morfologia floral e
sistemas de polinização em Bignonieae (Bignoniaceae)
Resumo: A radiação das angiospermas é freqüentemente associada a mudanças no modo de polinização, as quais em teoria são responsáveis pela diversificação das formas florais. Entretanto, a seqüência exata de eventos evolutivos que resultaram na grande diversidade de caracteres florais é desconhecida para a maior parte dos grupos vegetais. Neste capítulo, caracterizei o padrão de evolução de caracteres florais discretos e da morfologia floral na tribo Bignonieae (Bignoniaceae). Dentre os 32 caracteres inicialmente analisados, foram selecionados 12 caracteres associados aos sete tipos florais previamente descritos para o grupo. Uma árvore de verossimilhança penalizada da tribo foi utilizada para reconstruir os estados ancestrais desses caracteres em todos os nós da filogenia de Bignonieae, com algoritmo de máxima verossimilhança (MV) e máxima parcimônia (MP, com otimizações DELTRAN e ACCTRAN). Os resultados provenientes das diferentes reconstruções foram geralmente congruentes. Além disso, a ocorrência de correlações evolutivas entre caracteres foi testada a partir de MV para avaliar se a evolução de caracteres florais individuais segue os padrões de evolução correlacionada esperados sob o conceito de “síndromes de polinização”. A flor ancestral de Bignonieae foi reconstruída como uma flor do tipo Anemopaegma, a partir da qual as outras morfologias florais presentes no grupo evoluíram paralelamente várias vezes. Essas transições ocorreram tanto a partir da evolução de flores com estágios morfológicos intermediários entre os tipos florais como a partir da evolução de um tipo floral diretamente para outro. Correlações positivas e negativas entre caracteres seguem o esperado pelas síndromes de polinização, sugerindo que interações entre flores e polinizadores foram importantes para a diversificação de Bignonieae.
I
ntrodução
A classificação de determinadas combinações de caracteres florais em síndromes associadas a determinados agentes de polinização tem sido prevalente nos estudos de biologia floral. Na família Bignoniaceae, essa classificação foi realizada com a definição de 10 “tipos” florais, sete dos quais estão representados na tribo Bignonieae (Gentry, 1974a). Essa classificação, embora concordante com as síndromes definidas por Faegri & van der Pijl (1966) e amplamente aceitas pela comunidade científica da época, baseou-se em grande parte em observações ocasionais realizadas por Alwyn H. Gentry e em poucos estudos experimentais quanto à polinização das Bignoniaceae. Dessa maneira, uma re-avaliação das síndromes de polinização propostas para o grupo, com base nos estudos experimentais e observacionais acumulados durante os últimos 25 anos é crucial para que a classificação estabelecida por Gentry (1974a) e os conceitos implicitamente associado às síndromes continuem a ser utilizados como base para estudos sobre a biologia floral em Bignoniaceae.
Assim, um dos objetivos deste capítulo foi re-avaliar a equivalência entre os “tipos” florais definidos para o grupo e os sistemas de polinização observados em campo. Entretanto, ao invés de abranger toda a família Bignoniaceae, este trabalho foi focado na tribo Bignonieae devido à disponinilidade de uma filogenia datada e bem sustentada, que também foi utilizada nos demais capítulos desta tese. A avaliação de aspectos relacionados à evolução de diferentes morfologias florais é fundamental para o teste de cenários evolutivos, devido a correlação entre forma floral e funcionalidade quanto à atração de agentes polinizadores. Além de uma intensa revisão bibliográfica para a compilação de estudos de polinização em Bignonieae, este trabalho também permitiu uma avaliação preliminar dos padrões de evolução da morfologia floral a partir de caracteres qualitativos. Nos dois capítulos seguintes, essa avaliação preliminar foi refinada a partir da amostragem de caracteres quantitativos.
M
anuscrito resultante do Capítulo 1:
Evolution of Floral Morphology and Pollination System
in Bignonieae (Bignoniaceae)
Suzana Alcantara & Lúcia G. Lohmann
Universidade de São Paulo, IB, Departamento de Botânica, Cidade Universitária, Rua do Matão 277, São Paulo, SP, CEP 05508-090, Brazil.
Abstract— The radiation of angiosperms is associated with shifts among pollination modes that are thought to have driven the diversification of floral forms. However, the exact sequence of evolutionary events that led to such great diversity in floral traits is unknown for most plant groups. Here, we characterize the patterns of evolution of individual floral traits and overall floral morphologies in the tribe Bignonieae (Bignoniaceae). We identified 12 discrete traits that are associated with seven floral types previously described for the group and used a penalized likelihood tree of the tribe to reconstruct the ancestral states of those traits at all nodes of the phylogeny of Bignonieae. In addition, evolutionary correlations among traits were conducted using a maximum likelihood approach to test whether the evolution of individual floral traits followed the correlated patterns of evolution expected under the “pollination syndrome” concept. The ancestral Bignonieae flower presented an Anemopaegma-type morphology, which was followed by several parallel shifts in floral morphologies. Those shifts occurred through intermediate stages resulting in mixed floral morphologies as well as directly from the Anemopaegma-type morphology to other floral types. Positive and negative evolutionary correlations among traits fit patterns expected under the pollination syndrome perspective, suggesting that interactions between Bignonieae flowers and pollinators likely played important roles in the diversification of the group as a whole.
Introduction
Understanding how reproductive traits evolved in the past leads to important insights into how organisms adapted. In sexually reproducing organisms, traits associated with outcrossing are thought to be under strong selection because of their direct effect on reproductive success; the radiation of floral morphologies in angiosperms represents a great example of this (e.g., Darwin, 1871; Lloyd & Webb, 1992). Specifically in the case of animal-pollinated plant species, pollinator preference represents a strong selective pressure to flower traits (Darwin, 1862; Fægri & van der Pijl, 1966; Stebbins, 1970; Schemske & Bradshaw, 1999). Attraction of pollinators and successful pollen transfer represent the primary targets of selection during flower evolution, leading to repeated evolutionary shifts between pollinators and, consequently, to the diversification of floral forms (Darwin, 1862; Fægri & van der Pijl, 1966; Stebbins, 1970; 1974; Harder & Barrett, 2006).
2000; Fenster et al., 2004 and references therein).
Shifts among floral morphologies resulting from the selection exerted by specific pollinator groups can occur in three different ways (Armbruster, 1993): (i) gradual quantitative shifts that correspond to those shifts proposed by Darwin’s coevolutionary race model (1862); (ii) gradual qualitative shifts with intermediate stages among flowers pollinated by different pollinators; and (iii) qualitative shifts without intermediate morphologies (Stebbins, 1970; 1974; Armbruster, 1993). Despite the transient nature of the intermediate phases among floral morphologies, these morphologies may persist in plant populations when the frequencies of the effective pollinators fluctuate (Stebbins, 1970; 1974). This condition is thought to represent the rule, rather than the exception, for shifts between pollination modes (Stebbins, 1970). On the other hand, drastic variation in the frequencies of pollinators might lead to rapid changes in traits that determine pollinator specificity, leading to shifts without intermediate morphologies.
pollinate the small Tynanthus-type flowered species (Gentry, 1974a), which are considered to be generalists given that the small bee syndrome includes pollination by a broad spectrum of small insects.
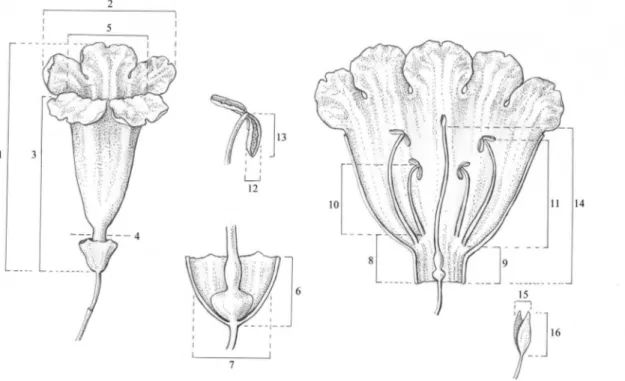
Fig. 1. Morphological types of Bignonieae as classified by Gentry (1974a). A-B. Anemopaegma-type: A.
Anemopaegma chamberlaynii (Sims) Bureau & K. Schum. B.Fridericia candicans (Rich.) L.G. Lohmann. C-F.Martinella-type: C.Dolichandra cynanchoides Cham. D.Lundia cordata (Vell.) DC. E. Adenocalymma dichilum A.H. Gentry. F. Pyrostegia venusta (Ker Gawl.) Miers. G. Amphilophium-type: Amphilophium paniculatum (L.) Kunth. H.Pithecoctenium-type: Amphilophium crucigerum (L.) L.G. Lohmann. I.Cydista -type: Bignonia corymbosa (Vent.) L.G. Lohmann. J.Tynanthus-type: Tynanthus cognatus (Cham.) Miers. K.
Most floral types of Bignonieae are thought to represent modifications from the basic Anemopaegma-type, except the Amphilophium-type, which is thought to have evolved from Pithecoctenium-type flowers (Gentry, 1974a). In a previous study, the flower types defined by Gentry (1974a) were used to infer pollination syndromes that were mapped onto the phylogeny of Bignonieae as a single multistate trait, indicating several homoplastic origins for pollination systems in the group (Lohmann, 2003). Because the various traits that determine the individual flower types can show different levels of evolutionary correlation, a more detailed evaluation of the patterns of evolution of individual floral traits can contribute important information on the evolution of flower morphologies and pollination systems as a whole. In particular, an understanding of the evolutionary patterns of individual floral traits of Bignonieae allows for a test of the hypothesis that the ancestral flower of Bignonieae was a “specialized” flower, pollinated by a narrow group of pollinators (i.e., an Anemopaegma-type flower, as suggested by Gentry, 1974a), from which successive shifts in pollinators subsequently occurred.
analyses of evolutionary correlation allows us to evaluate whether transitions in particular traits are associated with transitions in other traits, as expected under the pollination syndrome hypothesis.
Material and Methods
Taxon and trait sampling — Taxon sampling was identical to that used in the combined molecular phylogeny of Lohmann (2006). Specifically, we included 104 Bignonieae species, representing 20 of the 21 genera recognized by Lohmann (in press); only the monotypic Callichlamys was not included in the analysis. Species were selected as to include all the morphological diversity of the group. In particular, this sampling strategy included representatives of all major morphological shifts in the group (see Appendix S1 in the Supplemental Material).
Specific floral traits used are described in detail in Lohmann (2003) and Lohmann et al. (in press). Of the 95 discrete characters originally coded by Lohmann (2003), 12 floral characters were selected for the present study, seven of which were coded as binary and five as multistate (Appendix 1). These 12 discrete floral traits were chosen because of their association with Gentry’s floral types (Table 1; see Evolution of overall floral morphology for further details).
associated with the age of representative nodes were obtained through bootstrapping (Sanderson, 2002). Additionally, the five polytomies encountered in the PL tree were randomly resolved using the treefarm Package implemented in the program Mesquite 1.12 (Maddison & Maddison, 2006).
Table 1. Gentry’s floral types described for Bignonieae followed by individual traits associated with each floral type and their putative pollination syndrome; traits associated with each morphology were compiled from Gentry (1974a) and from published pollination studies (see Appendix 2).
Floral traits
Amphilophium Anemopaegma Cydista Martinella Pithecoctenium Tanaecium Tynanthus
Calyx shape Cupular Cupular, Tubular Cupular Spath., Tubular, Urceolate Cupular Cupular, Tubular Cupular Double calyx
Present Absent Absent Absent Absent Absent Absent
Corolla color Magenta Magenta, Yellow, White Magenta 1.Red, Magenta 2. White Yellow, White White Magenta, White Nectar guides
Absent Absent Present Absent Absent Absent Present
Corolla shape
Tubular Infund. Infund. Tubular,
Infund., Urceolate
Infund. Tubular Infund.
Corolla curvature
Straight Straight Straight Straight Curved Straight Straight
Corolla texture Coriac. Memb., rarely Coriac. Memb. Coriac., rarely Memb.
Coriac. Coriac. Memb.
Corolla tubes
Rounded Rounded Flattened
abaxially
Rounded Rounded Rounded Rounded
Corolla lobes Bilabiate Not- bilabiate Not- bilabiate Not- bilabiate Not- bilabiate Not- bilabiate Bilabiate Corolla mouth*
Closed Opened Opened Opened Opened Opened Opened
Anther position
Included Included Included Exserted Included Exserted Exserted,
rarely Inserted Nectar disk Present Present, Absent in Lundia
Absent Present Present Present Absent,
Reduced
Pollination syndrome
1. Large to medium sized bees
2. Bats
1. Large to medium sized bees 2. Small bees
and insects Large to medium sized bees 1.Hummingbird (long tube) 2. Bats (short tube, see text)
Large to medium sized bees Hawkmoths Small bees and insects, butterflies
To evaluate how alternative tree resolutions affected ancestral-state reconstructions, we created an additional set of 500 trees with polytomies randomly resolved. The shortest possible branch lengths were also assigned to the six branch lengths created to resolve the five polytomies. These time-calibrated, fully resolved trees were used in all analyses. In order to assess the potential impact of branch lengths to the analyses, we modified branch lengths of the time-calibrated tree (L. G. Lohmann et al., unpublished data) in Mesquite 1.12 so that nodes reached the maximum or minimum confidence intervals associated with each node. That is, branch lengths were modified so that the minimum age estimated for each node would represent the youngest or oldest age indicated by the confidence intervals. For convenience, hereafter we refer to these trees as those presenting minimum possible branch lengths and maximum possible branch lengths, respectively. Overall, three sets of 500 trees were produced from the PL Bignonieae tree, as follows: (i) trees including the original branch lengths assigned by the PL analyses, (ii) trees with minimum possible branch lengths, and (iii) trees with maximum possible branch lengths.
Evolution of individual floral traits — Ancestral character state reconstructions were carried out in Mesquite 1.12 (Maddison & Maddison, 2006) using a maximum likelihood approach (ML). This methodology finds the ancestral states for each node that maximize the probability of the observed states in the terminal taxa under a stochastic model of evolution (Pagel, 1999). The assignment of individual ancestral states is made from the likelihood estimated for each character state according to a decision threshold value, with the states that present the lowest likelihood values being rejected (Pagel, 1999). This method allows the incorporation of additional parameters (i.e., phylogenetic branch lengths, varying rates of evolution and evolutionary models), which leads to increased accuracy on the ancestral state reconstructions (Pagel, 1997). The assignment of probabilities to all possible states at each node is particularly interesting for traits with a high number of transitions.
parameter and the Mk with 2 parameters, representing forward and backward rates of changes between character states. Models were chosen using the likelihood ratio test (LRT) following the recommendation of Posada & Buckley (2004). For multistate traits, reconstructions using the Mk model with 1 parameter were conducted. We used a decision threshold value 2.0 when ancestral states were assigned to a given node (Maddison & Maddison, 2006). These ancestral character state reconstructions were used to assess the rates of transition of floral traits and the shifts among floral morphologies in Bignonieae.
To further assess the effect of alternative topologies and branch lengths to the reconstructed ancestral states, we used the three sets of trees obtained (i.e., dated trees, trees with minimum branch lengths possible, and trees with maximum branch lengths possible) as a basis for carrying out the ancestral-state reconstructions for the 12 characters studied. One tree was randomly chosen from all trees analyzed (Fig. 2). Results from this tree were compared to the results obtained from all other trees and the following information were recorded: (i) the percentage of trees that presented a particular node and (ii) the percentage of trees in which the ancestral states were reconstructed unambiguously for a given node (see Case et al., 2008). These results were reported for the five nodes that were randomly resolved (one of these corresponding to a supra-generic node), for the 35 suprageneric nodes, and for the 20 infrageneric nodes associated with shifts in floral morphology, leading to a total of 59 nodes analyzed overall.
the ancestral states of the individual traits reconstructed at each node and used the same procedure described above to classify each ancestral flower into one of Gentry’s flower types (1974a) or into a mixed morphology. For binary traits, the assignment of floral types was solely based on the unambiguous reconstructions. For multistate traits, several characters were reconstructed ambiguously. However, in those cases, the probabilities assigned to each character allowed us to rule out particular character states that were improbable for a particular node; this information was used to establish the morphological types associated with particular nodes.
A literature review indicated that the pollination system of 46 species of Bignonieae had been studied in the field (Appendix 2). For these 46 species, we were able to establish a direct association between Gentry’s floral types (1974a) and their respective pollinator groups. This information was then used to predict the most likely pollination mode for the remaining species for which the pollination system had not been studied in the field. Furthermore, these studies, provided sufficient information for us to categorize the individual floral morphologies into specialized or generalized flowers (sensu Fenster et al., 2004). Whenever a floral morphology was associated with a single functional guild of pollinator, that particular species was classified as a specialist. On the other hand, whenever a floral morphology was pollinated by two or more functional groups, the species was considered to be a generalist. Based on the association between floral types and the pollination systems described for the tribe (see Table 1), we were able to classify all 104 species of Bignonieae into specialists and generalists. Similarly, comparisons with current pollination systems were extrapolated to infer the most likely pollination mode for the ancestral flowers.