AVALIAÇÃO DA ESTIMULAÇÃO DA MEDULA ESPINHAL
COMO MODELO DE TRATAMENTO DA DOENÇA DE
PARKINSON NO PRIMATA Callithrix jacchus.
Tese de Doutorado apresentada à Universidade Federal do Rio Grande do Norte, como requisito parcial para a obtenção do título de Doutor em Psicobiologia.
MAXWELL BARBOSA DE SANTANA
AVALIAÇÃO DA ESTIMULAÇÃO DA MEDULA ESPINHAL
COMO MODELO DE TRATAMENTO DA DOENÇA DE
PARKINSON NO PRIMATA Callithrix jacchus.
Tese de Doutorado apresentada à Universidade Federal do Rio Grande do Norte, como requisito parcial para a obtenção do título de Doutor em Psicobiologia.
Orientador: Prof. Dr. Antônio Pereira Junior Co-Orientador: Prof. Dr. Rómulo Antonio Fuentes
UFRN / Biblioteca Central Zila Mamede Catalogação da Publicação na Fonte
Santana, Maxwell Barbosa de.
Avaliação da estimulação da medula espinhal como modelo de tratamento da doença de Parkinson no primata Callithrix jacchus. / Maxwell Barbosa de Santana – Natal, RN, 2014.
132 f.: il.
Orientador: Prof. Dr. Antônio Pereira Júnior. Co-orientador: Prof. Dr. Rómulo Antonio Fuentes.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Psicobiologia.
1. Sagui comum – Tese. 2. Sagui comum – Doença de Parkinson - Tese. 3. Estimulação medular - Tese. I. Pereira Júnior, Antônio. II. Fuentes, Rómulo Antonio. III. Universidade Federal do Rio Grande do Norte. IV. Título.
AVALIAÇÃO DA ESTIMULAÇÃO DA MEDULA ESPINHAL
COMO MODELO DE TRATAMENTO DA DOENÇA DE
PARKINSON NO PRIMATA CALLITHRIX JACCHUS.
Autor: MAXWELL BARBOSA DE SANTANA
Data: Natal, 31 de Janeiro de 2014
Orientador: Prof. Dr. Prof. Dr. Antônio Pereira Junior
Co-Orientador: Prof. Dr. Rómulo Antonio Fuentes
Banca Examinadora: Prof. Dr. Antônio Pereira Júnior
Instituto do Cérebro – UFRN (Orientador). _________ _______________________
Prof. Dr. Hougelle Simplício Gomes Pereira Departamento de Ciências Biomédicas -
UERN.
__________ _______________________
Prof. Dr. Renan Cipriano Moioli
Instituto Internacional de Neurociências de Natal (IINN-ELS).
_____________________________________ Prof. Dr. Clécio de Oliveira Godeiro Júnior Professor Adjunto do Departamento de
Medicina Integrada - UFRN.
__________ _______________________ Prof. Dr. Jeferson de Souza Cavalcante Professor Adjunto do Departamento de Fisiologia - UFRN.
Aos pacientes portadores da doença de Parkinson, solidarizo-me nas suas lutas diárias. Gostaria que este trabalho pudesse contribuir para abrir uma nova porta na terapêutica desta patologia.
“Lembre-se que nada acontece por acaso, tudo é decorrência de nossa ação ou omissão.”
(David Pereira Neves)
“Se acredita que consegue ou não consegue é o que acontece.”
AGRADECIMENTOS
Ao professor Rómulo Fuentes, pela oportunidade oferecida para desenvolver este trabalho. Pela confiança, orientação e dedicação na condução da minha carreira científica durante o doutorado. Por seu exemplo e parceria durante os anos deste projeto desafiador. Por seu incentivo, pela sua grande amizade que adquiri e por seus importantes conselhos ao longo desta jornada no Instituto Internacional de Neurociências de Natal (IINN-ELS).
Ao professor Antônio Pereira, pela confiança e orientação durante o doutorado. Por ter me apresentado este projeto quando iniciei esta jornada a 5 anos atrás. Por abrir as portas do Instituto Internacional de Neurociências de Natal (IINN-ELS). Pela sua amizade.
Ao professor Hougelle Simplício, pela orientação e confiança durante o desenvolvimento deste projeto. Pelos seus preciosos e pacientes ensinamentos que me possibilitou aprender diversas habilidades para a realização de cirurgias com o Callithrix jacchus. Pelos valiosos conselhos e pela grande amizade.
Ao professor Miguel Nicolelis, pelo apoio e confiança na realização deste trabalho. Pelos incentivos e conselhos durante a execução deste projeto. Pelo admirável trabalho na condução das atividades do Instituto Internacional de Neurociências de Natal (IINN-ELS), e o seu trabalho sócio educacional, os quais me contagiaram e me incentivaram a vir para Natal. Tenho profunda admiração por sua capacidade desbravadora e inovadora.
Ao professor Per Petersson pela orientação e pelas discussões durante a realização deste trabalho. Pela sua amizade. Aos meus colegas Pär Halje e Ulrike Richter que auxiliaram na análise eletrofisiológica dos dados. Ao Tobias Pálmer, por ter desenvolvido o software de tracking e por sua amizade.
Ao professor Edgard Morya, pelo apoio na realização deste trabalho. Por sua ajuda inestimável na estruturação do sistema de eletrofisiologia do CPM. Por seus ensinamentos nas construções de partes dos componentes eletrofisiológicos usados neste trabalho. Por sua amizade e conselhos.
À Jim Meloy e Gary Lehew pelo apoio na elaboração do projeto de construção das matrizes de eletrodos de registros em multi áreas no Callitrhix jacchus. Pelos conselhos e por suas amizades.
À Valéria Arboés por sua ajuda nas discussões durante a montagem dos aparatos comportamentais. Por sua ajuda durante as cirurgias, ensinamentos no manejo dos animais e pelas opiniões que contribuíram para realização deste trabalho. Pela sua amizade.
À Professora Hannah Buchanan-Smith pelos seus ensinamentos iniciais com o manejo dos saguis. E cujos conselhos me incentivaram a adquirir um novo olhar sobre o Callithrix jacchus.
Gostaria de agradecer aos funcionários do Instituto Internacional de Neurociências de Natal (IINN-ELS), que foram sempre solidários e deram suporte para a realização deste trabalho. Nominalmente, gostaria de agradecer ao bioterista Alexandre Nascimento pela ajuda no manejo dos animais e pela ajuda durante a condução dos experimentos.
Aos meus colegas do Instituto Internacional de Neurociências de Natal (IINN-ELS), pela amizade e discussão durante a realização deste trabalho, em especial, gostaria de agradecer à Ivani Brys, Carolina Kunicki, Joanilson Guimarães, Nelson Lemos e Mariana Araujo.
Aos alunos de iniciação científica que se disponibilizaram a me auxiliar na realização deste trabalho, Alynne Soares, Pollyanna Schneider, Pedro Cavalcanti, Thayane Kerbele, Thaís Vinholo e Carlos Eduardo Idalino.
À minha mãe, pelo carinho, apoio e paciência durante este período de ausência. Ao meu pai, à D. Zilda e os meus irmãos pelo carinho e pelo apoio durante estes anos de doutorado. Por permite alterar as suas rotinas para me auxiliar nesta jornada. A minha estadia em Natal não teria sido fácil sem o apoio de vocês.
Aos meus amigos que me incentivaram nesta jornada. Em especial, gostaria de agradecer ao professor Pergentino da Cunha Sousa, por seus conselhos e sua amizade nos momentos difíceis desta caminhada.
À Pós-graduação de Psicobiologia da Universidade Federal do Rio Grande do Norte pela oportunidade de desenvolvimento da minha carreira científica e pelo apoio dado no desenvolvimento deste trabalho.
Às agências de fomento que contribuíram para a realização deste trabalho.
RESUMO
ABSTRACT
SUMÁRIO
Página
LISTA DE ILUSTRAÇÕES xi
LISTA DE ABREVIATURAS xii
1 – INTRODUÇÃO 1
1.1 – DOENÇA DE PARKINSON. CONSIDERAÇÕES
HISTÓRICAS E EPIDEMIOLÓGICAS 1
1.2 – ASPECTOS CLÍNICOS 4
1.3 – RESUMO DAS ESTRUTURAS RESPONSÁVEIS PELO MOVIMENTO 9
1.3.1. Resumo da Organização dos Circuitos dos Núcleos da base 10
1.4 - SUBSTRATO NEUROANATÔMICO DA DP 15
1.5 – TRATAMENTOS DA DP 18
1.5.1 – Tratamentos Farmacológicos 18
1.5.1 – Tratamentos Não-Farmacológicos 25
1.5.2.1 - Técnicas lesionais 26
1.5.2.2 -Estimulação Cerebral Profunda (ECP) 27
1.6 – MODELOS ANIMAIS DA DOENÇA DE PARKINSON 30
1.6.1 – O modelo da 6-OHDA no sagui comum 35
1.7 - ESTIMULAÇÃO DAS VIAS DA COLUNA DORSAL:
DESSINCRONIZAÇÃO DE CIRCUITOS NEURONAIS ENVOLVIDOS NA DP 37
1.7.1 – Sincronização Anômala do Circuito Córtex
Motor-Tálamo-Núcleos da Base na DP 37
1.7.2 – Estimulação Elétrica das Colunas Dorsais 38
2 – OBJETIVOS 44
2.1 – OBJETIVO GERAL 44
2.2 – OBJETIVOS ESPECÍFICOS 44
3 – PRIMEIRO ARTIGO:Objetivos específicos 1 e 2 45
Characterization of long-term motor deficits in the 6-OHDA model of
Parkinson’s disease in the common marmoset 47
4 –SEGUNDO ARTIGO: Objetivos específicos 3 e 4 79
Spinal Cord Stimulation alleviates motor symptoms in a primate model of
Parkinson’s disease 79
5–CONCLUSÃO GERAL 97
6 – REFERÊNCIAS BIBLIOGRÁFICAS 101
LISTA DE ILUSTRAÇÕES
Página
Figura 1: Cronograma de Evolução da DP segundo os estágios de Braak. 8
Figura 2: Desenho esquemático resumido das vias direta e indireta através dos
Núcleos da Base. 16
Figura 3: Locais de ação de algumas drogas utilizadas no tratamento da DP na
sinapse dopaminérgica. 18
Figura 4: Metabolismo de síntese e degradação da dopamina. 20
Tabela 1: Complicações motoras e não-motoras associadas à farmacoterapia
com levodopa. 21
Tabela 2: Principais características das intervenções cirúrgicas utilizadas no
tratamento da DP 28
LISTA DE ABREVIATURAS
6 – OHDA 6 – Hidroxidopamina
AMPT α-Metil-p-tirosina
AV Núcleo ventral anterior do tálamo
COMT Catecol-O-metil-transferase
DA Dopamina
DAT Transportador de dopamina
DAT-KO Animal geneticamente modificado que não expressa o transportador de dopamina
DDC Enzima dopa-descarboxilase
DBS Sigla em Inglês para “Deep Brain Stimulation” (Estimulação cerebral profunda)
DP Doença de Parkinson
DOPAC Ácido dihidroxifenilacético
ECP Estimulação cerebral profunda
ECD Estimulação elétrica das vias das colunas dorsais da medula espinhal
GABA Ácido gama-aminobutírico
GPi Porção Interna do globo pálido
HVA Ácido homovalínico
L-DOPA L-dihidroxifenilalanina
LFP Potencial de campo local
M1 Córtex motor primário
MPTP 1-Metil-4-fenil-1,2,3,6-tetrahidropiridina
MPP+ 1-Metil-4-fenilpiridina
MAO-B Monoamima oxidase (Tipo B)
NB Núcleos da base (Gânglios da Base)
Put Núcleo putamen
Si3a Córtex sensorial primário
SNC Sistema nervoso central
SNpc Região pars compacta da substância negra
SNpr Região pars reticulada da substância negra
STN Núcleo subtalâmico
TH Tirosina hidroxilase
VL Núcleo ventral lateral do tálamo
VLPN Núcleo posterior do tálamo
1 – INTRODUÇÃO
1.1– DOENÇA DE PARKINSON. CONSIDERAÇÕES HISTÓRICAS E EPIDEMIOLÓGICAS
A doença de Parkinson (DP) é uma patologia que foi primeiramente descrita em 1817 pelo médico inglês James Parkinson, em uma monografia que se tornou célebre dentro na História das Neurociências, intitulada: Um Ensaio Sobre a Paralisia Agitante (“An Essay on the Shaking Palsy”)(Parkinson 2002; Fahn 2008).
James Parkinson descreveu as características desta patologia neurodegenerativa como sendo um tremor de repouso, acompanhado de postura fletida e marcha acelerada e para frente, com um curso progressivo; culminando após um período de anos em invalidez, caquexia e por último, morte por inanição (Parkinson 2002). Ainda no século XIX, Jean Marie Charcot, através da obra “Leçons sur les maladies du système nerveux”, também contribuiu de forma importante para o estudo desta patologia ao detalhar mais características clínicas da doença, entre elas a alteração postural, a rigidez muscular, a micrografia e a bradicinesia. Além disso, Charcot sugeriu a mudança de nome da enfermidade, de “Paralisia Agitante” para “Doença de Parkinson”, em homenagem à descrição da patologia realizada por James Parkinson (Teive et al. 2001).
Posteriormente, Marsden contribuiu de maneira significativa para o entendimento das bases bioquímicas da DP, particularmente ao elucidar a participação dos defeitos do complexo I mitocondrial e os estudos sobre o estresse oxidativo na etiopatogenia da doença. Além disso, Marsden destacou-se pelas contribuições no entendimento da fisiologia dos núcleos da base, uma área do cérebro atualmente envolvida em vários distúrbios do movimento, incluindo a DP (Teive et al. 2001)
Por volta de meados do século XX, outro resultado importante apresentado por Carlsson proporcionou um melhor entendimento das mudanças bioquímicas ocorridas no cérebro, e particularmente, com a participação do neurotransmissor dopamina na DP. Atualmente, este neurotransmissor é reconhecido por ter um papel chave na modulação sináptica dos núcleos da base; e o entendimento da sua funcionalidade propiciou o surgimento do principal tratamento farmacológico da DP até o momento, que é a farmacoterapia por levodopa (Fahn 2008).
Mais recentemente, a melhor caracterização dos corpos de Lewy, especificamente a descoberta de que estes têm como principal componente a proteína alfa-sinucleína, abriu uma fronteira promissora no estudo da DP. Além do mais, a utilização da técnica de estimulação cerebral profunda, como tratamento não-farmacológico da DP, destacou - se como terapia de vanguarda e ferramenta experimental para o melhor entendimento desta patologia neurodegenerativa.
A DP apresenta uma prevalência crescente com o avançar da idade. Existem estimativas que apontam que em indivíduos na faixa de 65 à 69 anos a prevalência da doença seja entre 0,5 e 1 % dos indivíduos. Este percentual aumentaria em idosos acima de 80 anos, atingindo uma prevalência de 1 a 3% dos indivíduos (Toulouse & Sullivan 2008).
Em um trabalho recente, Wright Willis e colaboradores (2010) fizeram um levantamento epidemiológico detalhado da população idosa acima de 65 anos atendida pelo serviço de saúde dos EUA. Estes autores encontraram uma prevalência média de 553/100.000 pessoas na faixa de 65-69 anos, e entre pessoas de 75-79 anos este valor foi de 1.881/100.000 indivíduos. Na população acima de 80 anos os valores médios de prevalência observados foram de 2.757/100.000. Ainda neste estudo, os autores encontraram um aumento da prevalência e da incidência da DP maior na população branca em relação à população negra, asiática e hispânica dentro dos Estados Unidos. Ademais, embora tenham encontrado uma associação inconsistente entre a vida no campo e a DP, os autores ressalvam a ocorrência em certas populações rurais de valores elevados de incidência e prevalência da doença, assim como uma maior prevalência e incidência da DP em áreas historicamente mais industrializadas do país. Estas associações podem estar correlacionadas à fatores ambientais, tais como a presença de contaminantes químicos como pesticidas e herbicidas (Wright Willis et al. 2010).
1.2 – ASPECTOS CLÍNICOS
Clinicamente, a DP apresenta um conjunto de sintomas, entre eles alguns são considerados como características cardinais desta patologia neurodegenerativa: o tremor de repouso, a rigidez muscular, a bradicinesia e distúrbios do equilíbrio (instabilidade postural). Esses sintomas normalmente surgem afetando inicialmente um lado do corpo. A redução da expressão facial, diminuição da freqüência de piscar dos olhos e a hipofonia também podem ser manifestações precoces. O espalhamento das características motoras para o membro contralateral ocorre tipicamente 3 a 5 anos após o diagnóstico, implicando em extensão do processo neurodegenerativo (Pahwa & Lyons 2007; Obeso et al. 2010).
O Tremor de repouso. O tremor na DP é tipicamente de repouso e desaparece quando um movimento voluntário é realizado. Registros eletromiográficos mostram descargas rítmicas à uma freqüência de 4-6Hz com disparos alternados em grupos de músculos agonistas e antagonistas. As articulações distais dos membros são preferencialmente afetadas. O tremor pode ser intermitente e ser aumentado pelo estresse ou por atividades que envolvam concentração, tal como a contagem de palavras (Pahwa & Lyons 2007).
A característica mais típica da rigidez na DP é o aumento da resistência ao deslocamento passivo da articulação normalmente associado com o fenômeno de “ roda-denteada” (semelhante a pequenos solavancos que o examinador percebe durante a movimentação de um membro). Comumente, este fenômeno é observado nos membros superiores. Movimentos voluntários simultâneos de outros segmentos do corpo podem aumentar a rigidez (Pahwa & Lyons 2007).
A Bradicinesia. A Bradicinesia é caracterizada como uma lentidão na inicialização e na execução dos movimentos. Pode ser observada durante a execução de movimentos apendiculares repetitivos. A bradicinesia pode ser vista, intercambiavelmente, como parte de um quadro geral mais amplo que inclui a Hipocinesia. Aqui será adotado a linha de visão de pesquisadores que segregam o termo bradicinesia da hipocinesia, sendo que esta é definida como pobreza de movimentos espontâneos e automáticos (menor frequência de movimentos). Adicionalmente, será utilizado neste trabalho o termo Acinesia, que é entendido como dificuldade em iniciar movimentos, ou mesmo ausência de movimentos(Pahwa & Lyons 2007).
Na DP, o paciente apresenta uma redução na taxa e amplitude de movimentos. Movimentos automáticos tais como piscar, movimentos dos braços quando caminha, ou comprometimento do passo quando caminha, bem como tarefas voluntárias mais complexas, como escrever (micrografia) e beber e escovar os dentes podem ser afetados. Outros aspectos da bradicinesia incluem salivação excessiva devido à disfagia de saliva e perda da expressão facial (hipomímia) (Pahwa & Lyons 2007).
parkinsoniana é caracterizada pela flexão do tronco e movimento reduzido do braço ao caminhar, sendo mais pronunciado no lado do corpo mais afetado. O portador da DP não consegue mais caminhar com passos largos, os joelhos tornam-se flexionados e a marcha torna-se arrastada. Com o progresso da doença, a paralisia começa a aparecer. Ao tentar iniciar uma marcha o paciente pode paralisar, como se estivesse em um estado congelado (Pahwa & Lyons 2007).
O diagnóstico da DP pode considerar a presença de ao menos três destes sinais: tremor de repouso, a rigidez muscular, a bradicinesia e distúrbios do equilíbrio, sendo que um deles deve ser a bradicinecia, um sinal chave, que é observado em combinação a dois outros sinais em quase todos os pacientes que apresentam o diagnóstico da DP (Pahwa & Lyons 2007).
Recentemente, outros elementos passaram a ser citados como possíveis sinais não motores e anteriores ao aparecimento dos sinais cardinais. Em um artigo publicado em 2003, Braak e colaboradores propõem uma periodização (sistema de estágio) para o surgimento dos sintomas, baseado em estudos de imageamento, neuropatologia e avaliações clínicas e epidemiológicas. Estes autores concebem estes estágios em uma fase prodrômica de aproximadamente 20 anos ao início clínico dos sintomas motores característicos da DP, seguido por um progresso da doença que poderia equivaler a aproximadamente 20 anos após este diagnóstico (Braak et al. 2003).
Estes estágios de Braak incluiem os estágios de Hoehn & Yahr de 1967, cujas observações eram focadas apenas nos estágios posteriores ao diagnóstico da DP e são considerados modelos adotados no estudo desta patologia (Hawkes et al. 2010). (ver Figura 01).
1.3 – RESUMO DAS ESTRUTURAS RESPONSÁVEIS PELO MOVIMENTO
O conjunto de estruturas neuronais responsáveis pelo controle do movimento pode ser dividido em quatro subsistemas distintos, altamente interconectados. O primeiro desses subsistemas é representado pelos circuitos da substância cinzenta na medula espinhal. Os tipos celulares existentes nesse subsistema correspondem aos motoneurônios alfa, que enviam axônios para inervar a maior parte dos músculos estriados do corpo (a chamada via final comum de Charles Sherrington). Os motoneurônios são inervados por neurônios sensoriais primários da periferia e também recebem projeções descendentes de áreas motoras no tronco cerebral e no córtex. Além disso, são contactados por interneurônios inibitórios que modulam a sua excitabilidade (Purves 2007).
O segundo subsistema motor consiste de neurônios cujo corpo celular está localizado no córtex e tronco cerebral. Os axônios desses neurônios de alta ordem descendem para a medula espinhal, onde farão sinapses diretamente com motoneurônios alfa, formando um circuito monosináptico efetor juntamente com um interneurônio, ambos na substância cinzenta da medula espinhal. O terceiro e o quarto subsistemas são estruturas ou grupo de estruturas que não tem acesso direto a motor neurônios ou interneurônios da medula espinhal, mas, que exercem controle sobre o movimento pela regulação da atividade dos neurônios motores superiores que dão origem as vias descendentes. Um desses subsistemas, o terceiro, é o cerebelo, que tem como função corrigir erros de movimentos, comparando os movimentos comandados pelo córtex e tronco cerebral com a retroalimentação sensorial sobre o movimento que tem realmente ocorrido (Purves 2007).
planejamento e programação do controle do movimento (Purves 2007). A discussão dos seus aspectos estruturais e funcionais será realizada de maneira separada a seguir. O melhor entendimento da contribuição dos NB para o controle motor é proveniente dos estudos das desordens ocorridas nestas áreas, tais como a DP e a doença de Huntington(Purves 2007).
1.3.1. Resumo da Organização dos Circuitos dos Núcleos da base
Os NB se referem a uma coleção de núcleos subcorticais constituídos pelo núcleo caudado, o putâmen, o globo pálido externo (GPe) e Globo pálido interno (GPi) e o núcleo subtalâmico (STN). Os seguintes núcleos talâmicos estão associados aos núcleos basais: núcleo ventral anterior e núcleo ventral lateral. Além destes, há outros núcleos como a substância negra (subdividida em pars compacta e pars reticulata) - uma estrutura mesencefálica conectada de maneira recíproca com os núcleos da base (Purves 2007).
Em um modelo funcional considerado clássico, os núcleos da base têm dois pontos de entrada primários: o estriado (núcleo caudado e o putâmen) e o núcleo subtalâmico. Estes núcleos recebem aferências do córtex, de estruturas límbicas e do tálamo, além de aferências modulatórias da porção da substância negra pars compacta (SNpc) do mesencéfalo e do núcleo da Raphe. (Alexander et al. 1986; Albin et al. 1989; Haber 2003).
Citologicamente, o caudado e o putâmen são idênticos. Seus neurônios se dividem em duas categorias dependendo se seus dendritos sejam espinhosos ou lisos. Os neurônios espinhosos são os mais numerosos do estriado e funcionam como neurônios de circuito local e de projeção, contendo a maioria deles mais de um neurotransmissor. Desta forma é possível demonstrar uma divisão histoquímica do estriado para distintos neuropeptídos e enzimas relacionadas com neurotransmissores (Graybiel 1990; Gerfen & Surmeier 2011).
Além disso, as conexões provenientes da substância negra (região pars compacta) para o estriado (por meio do trato nigroestriatal) são as conexões estriatais mais intensamente estudadas. Estas projeções utilizam a dopamina como neurotransmissor e tem como alvo as espinhas dendríticas dos neurônios espinhosos médios do estriado e são terminações imunorreativas para a enzima tirosina hidroxilase (TH), a qual sintetiza a dopamina (Gerfen & Surmeier 2011).
A população de neurônios espinhosos estriatais recebe aferências corticais e talâmicas e envia projeções eferentes pelas vias direta e indireta (Albin et al. 1989). Os neurônios espinhais estriatais que fazem parte da chamada via direta expressam os receptores dopaminérgicos do subtipo D1 (receptores D1 e D5). Esta subpopulação de neurônios espinhosos envia projeções diretamente para o Globo pálido interno e para a substância negra (região pars reticulada). Por outro lado, a subpopulação de neurônios espinhais estriatais da via indireta expressam os receptores dopaminérgicos do subtipo D2 (receptores D2, D3 e D4) e projetam axônios para o Globo Pálido externo. Funcionalmente, a via direta é tida como facilitadora do movimento e a via indireta é tida como inibidora do movimento (Kravitz et al. 2010).
que enviam projeções de volta para o córtex motor. Em situações normais, o efeito da transmissão dopaminérgica em ambas as vias direta e indireta diminui o fluxo inibitório dos gânglios da base e aumenta a excitabilidade dos neurônios do córtex motor. (Gerfen & Surmeier 2011). (ver painel A da Figura 2).
A partir do córtex motor, a informação é enviada para os motoneurônios através das vias motoras descedentes laterais (especialmente os tratos corticoespinhal e rubro-espinhal) e vias ventromediais (especialmente os vestíbulo-espinhais; os tratos tecto-espinhal e os tratos retículo-espinhais pontino e bulbar) (Purves 2007).
Atualmente, consideram-se os NB também sob outros aspectos funcionais. Um primeiro modelo alternativo destaca a participação do tronco cerebral, por meio do núcleo pedúnculo pontino (NPP), e da formação reticular locomotora mesencefálica (RLM) e a formação reticular pontomedular (FRPM) como alvos das projeções de saída dos núcleos da base (via GPi e SNr),e, usando o mesmo conceito de ativação das vias direta e indireta, este modelo propõe um papel motor chave dos NB como o início e término seletivo de sequências motoras estereotipadas ou rítmicas. Estas sequências motoras normalmente são controladas pelo tronco cerebral e circuitos da medula espinhal, muitas vezes referidas como programas motores. Revisão detalhada deste conceito alternativo por (Haber 2003; Grillner et al. 2005; Draganski et al. 2008; Obeso et al. 2008; Redgrave et al. 2010).
Sob um outro modelo, os NB são subdivididos anatomofuncionalmente em áreas motoras, límbicas, associativas e sensórias. Esta divisão é mais abrangente e complexa do que
o modelo clássico de “via direta e indireta”. Especificamente sob o ponto de vista motor, os
possibilidades de interconexões entre as regiões dos NB, destacadamente entre o Globo Pálido externo e o Núcleo Subtalâmico e o Globo Pálido externo e o estriado. Em relação às vias extrínsecas, considera-se que os NB interconectam-se com estruturas externas como loops
paralelos segregados. Esta segregação a partir do córtex fornece “um aferente organizado
segregado para os principais núcleos de entrada dos NB”. Revisão detalha deste conceito
Figura 2: Desenho esquemático resumido das vias direta e indireta através dos Núcleos da Base. Em A, na via indireta (sombra amarela), as projeções inibitórias transitórias do núcleo caudado e putamen (estriado) projetam para os neurônios inibitórios tonicamente ativos na porção externa do globo pálido, que projetam para o núcleo subtalâmico o qual também recebe projeções excitatórias do córtex (seta não mostrada). O Núcleo subtalâmico envia projeções excitatórias para a porção interna do globo pálido. Este último envia projeções inibitórias para os núcleos Ventral Anterior (AV) e Ventral Lateral (VL) do Tálamo. Na via direta, as projeções inibitórias do caudado e putamen são ligadas diretamente à porção interna do globo pálido. Na via direta, as projeções inibitórias do caudado e putamen projetam para os neurônios inibitórios tonicamente ativos da porção interna do globo pálido, a qual projeta para os núcleos Ventral Anterior (AV) e Ventral Lateral (VL). Note que a região pars compacta da substância nigra (SNpc) tem ação inibitória na via indireta e excitatória na via direta. Em B, na condição parkinsoniana, o balanço dos sinais inibitórios na via direta está alterado. As projeções da SNpc diminuem, o que dificulta a inibição dos núcleos caudado e putamen. O resultado disto na via direta é uma inibição tônica sustentada do globo pálido interno, fazendo com que haja uma menor inibição dos neurônios corticais pelo tálamo. Adaptado de Purves et al. (2007).
Córtex Frontal Córtex Cerebral
Tálamo (Núcleos VL e VA) Globo Pálido (Porção Interna) Globo Pálido (Porção Externa) Núcleo Subtalâmico
SNpc Caudado / Putamen
tônico
tônico transitório
Transitório transitório transitório
transitório transitório transitório
Transitório
Córtex Cerebral Córtex Frontal
Tálamo (Núcleos VL e VA) Globo Pálido (Porção Interna) Globo Pálido (Porção Externa) Núcleo Subtalâmico
SNpc Caudado / Putamen
Degeneração Maior Inibição tônica Diminuiu Aumento Excitação diminuiu
B
(Doença de Parkinson)1.4 - SUBSTRATO NEUROANATÔMICO DA DP
A principal mudança patológica observada nos indivíduos portadores da DP é a perda de neurônios que produzem dopamina na parte compacta da substância negra. Outra característica patológica chave é a presença de inclusões citoplasmáticas chamadas corpúsculos de Lewy nos neurônios dopaminérgicos da substância negra. Estas inclusões citoplasmáticas também são encontradas em outras áreas do cérebro, tais como o locus coeruleus; os núcleos basais de Meynert; os núcleos motores basais do vago; o gânglio simpático e o córtex cerebral (Obeso et al. 2010)
De acordo com Dauer & Przedborski (2003), estima-se que ocorra uma perda de 70-80% da dopamina estriatal e uma perda de 50-85% dos neurônios da substância negra no início dos sinais clínicos da doença de Parkinson. Nos estágios iniciais de evolução da doença, os processos neurodegenerativos são principalmente confinados às fibras dopaminérgicas inervando o aspecto dorso-lateral do putâmen e, portanto, as manifestações clínicas são principalmente motoras. Com o progresso da doença, a perda de dopamina se estende para todo o estriado e outras regiões no córtex cerebral, tronco cerebral e medula espinhal também podem ser afetadas (Dauer & Przedborski 2003; Obeso et al. 2010).
Esta perda de morte celular seletiva dos neurônios da SNpc permanece não totalmente esclarecida, mas alguns estudos indicam que a homeostosia desta região é vulnerável à diferentes fatores genéticos, celulares e ambientais que de maneira independente ou simultânea podem influenciar nas taxas de morte celular ao longo do tempo (Obeso et al. 2010). Além disso, existe uma outra região adjacente à SNpc, a Área Tegmental Ventral (VTA), que também possui neurônios dopaminérgicos, mas, que apresenta uma suscetibilidade relativamente menor à degeneração (Salvatore & Pruett, 2012).
Esta discrepância de degeneração não isenta a VTA de também ser afetada por um processo de degeneração celular. A VTA apresenta um processo de degeneração mais lento. A causa desta diferença de suscetibilidade não está clara. Por exemplo, em um trabalho recente com amostras de cérebros humanos de pacientes parkinsonianos, Reyes e colaboradores (2013) indicam que existem diferenças na composição do transportador de dopamina e de autorreceptores dopaminérgicos de superfície de membrana das células do VTA e da SNpc. Esta diferença entre as células dopaminérgicas poderia contribuir para este padrão de morte heterogêneo observado (Reyes et al. 2013).
Durante a progressão da DP, os alvos dos neurônios dopaminérgicosnos NB são afetados de maneira diferente (Brooks & Piccini 2006). Na fase inicial, os terminais dopaminérgicos da região dorsal do putâmen são afetados primeiramente. Em seguida, os terminais localizados na porção anterior do putâmen e a cabeça do caudado também são afetados. Por consequência, o globo pálido interno apresenta um aumento da regulação dopaminérgica. Esta localização inicial da degeneração dos terminais dopaminérgicos tem sido correlacionada com sintomas da DP como a rigidez e a bradicinesia (Brooks et al. 2003).
mostraram uma extensão dos danos para outras áreas que compõem os NB. Inclui-se também nesta progressão a redução significativa dos neurônios dopaminérgicos da SNpc (Braak et al. 2003; Brooks & Piccini 2006).
1.5 – TRATAMENTOS DA DP
1.5.1 – Tratamentos Farmacológicos
Até os anos 1960, o tratamento da DP era fundamentado no uso de medicamentos com ação anticolinérgica e no tratamento cirúrgico com ablação de alvos localizados nos NB. O aparecimento da levodopa, contudo, permitiu uma revolução no tratamento desta doença. Este fármaco, que é um precursor da dopamina, foi introduzido como agente terapêutico a partir de estudos em modelos animais de parkinsonismo por Arvid Carlsson (Iversen & Iversen 2007).
A ação desta droga reduzia significativamente a intensidade dos sintomas de impedimento motor nos modelos animais da doença e posteriormente mostrou-se eficaz em humanos (Cotzias,1967 citado por (Ponce & Lozano 2011). Desse modo, este fármaco promoveu um surpreendente impacto em pacientes que estavam afetados com DP fazendo com que voltassem a ter uma vida próxima do normal (Ferraz, 2004).
A levodopa (também conhecida como L-dopa ou L-3,4-dihidroxifenilalanina) até hoje é considerada a pedra angular do tratamento da DP, tida como o padrão ouro na terapêutica desta patologia. A levodopa quando administrada por via oral é absorvida no duodeno e transportada pela corrente sanguínea, e pode então atravessar a barreira hematoencefálica através de transportadores de aminoácidos neutros. Ao chegar até o cérebro é convertida em dopamina pela ação da enzima dopa-descarboxilase (DDC). Esta conversão pode ocorrer nos neurônios dopaminérgicos remanescentes na substância nigra ou por neurônios não dopaminérgicos ou ainda por células da glia na região do estriado (Figura 03) (Fahn 2008).
pode levar a ocorrência de náuseas, vômitos e hipotensão ortostática. A COMT converte a levodopa em 3-O-metil-dopa. A meia vida plasmática da levodopa é considerada muito curta, não passando de 90 minutos. Nas apresentações comerciais de levodopa sempre há a combinação com drogas inibidoras da ação periférica da DDC, como a benzerasida ou a carbidopa. Há também drogas com ação inibitória sobre a COMT (tolcapone e entacapone) que podem estar presentes nestas apresentações comerciais (Singh et al. 2007).
Figura 4: Metabolismo de síntese e degradação da dopamina. Em A, a via de síntese da dopamina a partir da tirosina. Notar que a dopamina, a noradrenalina e a adrenalina fazem parte de uma mesma via de síntese, e são quimicamente semelhantes com a presença do anel catecol. Em B, a dopamina é degradada pelas enzimas MAO e COMT, gerando dois principais metabólitos: Ácido 3,4-Dihidroxifenilacético (DOPAC) e Ácido Homovanílico (HVA). Adaptado de (Fahn 2008) e (Eisenhofer et al. 2003).
A farmacoterapia com levodopa oferece o melhor controle sintomático da DP. Entretanto, o tratamento prolongado com a levodopa pode levar a complicações motoras graves, incluindo diferentes tipos de discinesias (Tabela 1). Em muitos pacientes, os períodos de dificuldade motora estão também associados com dor, ataques de pânico, depressão severa, confusão e sensações de morte (Stocchi 2009).
Tabela 1:Complicações motoras e não-motoras associadas à farmacoterapia com levodopa.
Flutuações motoras Principais complicações não-motoras
“Fenômeno de encurtamento do tempo de efeito”
(Wearing-off phenomenon) Ansiedade, agitação, irritabilidade
“Retardo do início do efeito” (Delayed ON)
“Ausência do efeito” (no ON) Dor, formigamento, sudorese, calor, fadiga, mudanças de humor, sonolência, urgência urinária
“Fenômeno liga-desliga” (“ON-OFF” phenomenon) Discinesias
Distonias de pico de dose
Bifásica
Distonias de período “OFF”
Fonte: Adaptado de (Stocchi 2009).
de 3–6 Hz e a dopamina estriatal é mantida em níveis relativamente constantes, como mostrado por trabalhos que empregaram técnicas de microdiálise e amperometria (Stocchi 2009). Assim, a resposta promovida pela levodopa seria no sentido de alterar os níveis de dopamina na fenda sináptica de uma forma variável, e com o passar do tempo dependente da concentração de levodopa sanguínea. Esta modulação a longo prazo acarreta no surgimento dos efeitos adversos deste fármaco e, entre estes, os sintomas motores da discinesia são destacamente os mais relatados (Olanow et al. 2006).
Uma outra classe de agentes farmacológicos também usada na tratamento da DP são antagonistas colinérgicos (anti-Ach). O uso destes agentes como anti-parkinsonianos foram primeiramente propostos por Charcot. O alvo da ação desta classe de fármacos são os NB, onde há normalmente um balanço entre a neurotransmissão dopaminérgica e colinérgica. Na DP, há um excesso relativo da transmissão colinérgica devido à deficiência de dopamina. Ao se bloquear os receptores colinérgicos recupera-se o equilíbrio perdido (Singh et al. 2007).
A amantadina é outro fármaco também utilizado no tratamento da DP. Ela é um fármaco antiviral cujo mecanismo de ação ainda é não totalmente esclarecido, mas parece exercer uma ação peculiar de antagonista de receptores NMDA, além de estimular a secreção de dopamina, a inibição da recaptação de dopamina pelos neurônios da SNpc e além de uma possível ação estimulatória sobre os receptores dopaminérgicos (Olanow et al. 2006; Singh et al. 2007). Sua ação antiparkinsoniana foi descoberta acidentalmente ao se perceber a melhoria do estado motor de um indivíduo bradicinético ao qual se prescreveu o fármaco devido um quadro gripal (Singh et al. 2007).
farmacológica semelhante: substituem a dopamina, poupam o metabolismo glial, e estimulam diretamente os receptores pós-sinápticos do estriado. Fazem parte desse grupo a pergolida, lisuride, bromocriptina, apomorfina, cabergolina, pramipexole e ropinirole. As vantagens desta classe de fármacos sobre a levodopa são (i) agem diretamente no estriado; (ii) ultrapassam a barreira hemato-encefálica com facilidade e não sofrem concorrência pelo transporte com aminoácidos aromáticos como a levodopa sofre; (iii) possuem ação mais duradoura, e (iv) não sofrem metabolismo oxidativo (Stocchi 2009). A estas vantagens, pode-se adicionar a menor incidência de complicações motoras, um reflexo provável de sua longa meia-vida plasmática, variando entre 6 a 96 horas quando administrados por via oral (Stocchi 2009).
O papel dos agonistas dopaminérgicos no manejo de pacientes na fase inicial da DP foi mais bem compreendido com os chamados estudos de monoterapia. Nestes estudos, observou-se que a administração de pramipexole, carbegolina, pergolida e ropinirole reduziu o risco de aparecimento das complicações motoras que surgem na terapia prolongada com levodopa (Parkinson Study 2000) (Oertel et al. 2006). Embora a monoterapia com agonistas dopaminérgicos possa ser efetiva na fase inicial da doença, com o passar do tempo (cerca de três anos) ela se torna ineficaz, propendo os pacientes ao uso da levodopa como complementação terapêutica (Jenner 2000; Olanow et al. 2006).
avançada da DP, atenuando as complicações relacionadas ao uso da levodopa, sobretudo as flutuações (Olanow et al. 2006).
Os inibidores seletivos da COMT (catecol-O-metil-transferase), tolcapone e entacapone foram introduzidos recentemente na terapia antiparkinsoniana. Propunham-se a diminuir a dose de levodopa administrada aos pacientes com DP, ao bloquear a enzima responsável por sua degradação. Porém, a hepatotoxicidade combinada com sua eficácia discutível levou a uma utilização mais restrita (Olanow et al. 2006).
1.5.2 – Tratamentos Não-Farmacológicos
A abordagem cirúrgica da doença de Parkinson é uma alternativa que tem quase um século de uso. Portanto, muito antes da introdução de medicação dopaminérgica, cirurgias já eram executadas para tratar o tremor parkinsoniano. Estas, porém, falhavam em reduzir a discinesia. Dezenas de técnicas de lesões e ablações foram propostas, e a maioria abandonada em pouco tempo (Singh et al. 2007).
Segundo estes mesmos autores, “estes procedimentos geralmente não são recomendados para os seguintes pacientes: (1) pacientes que não respondem à levodopa; (2) pacientes muito idosos; (3) pacientes cujo principal sintoma é o tremor; (4) pacientes cujos sintomas predominantes são o congelamento (“freezing”) e quedas; (5) pacientes que tem sérios problemas psiquiátricos ou de saúde; e, (6) pacientes que possuem parkinsonismo
(oposto ao da DP idiopática).” (Singh et al. 2007, p.11).
1.5.2.1 - Técnicas lesionais
1. A talamotomia é uma técnica indicada para o tratamento do tremor no paciente com a DP. Pode proporcionar uma redução significativa na intensidade do tremor (Pahwa & Lyons 2007). Esta é uma vantagem do ponto de vista clínico, por reduzir ou abolir a necessidade de uso de drogas anticolinérgicas. O quadro de acinesia pode permanecer inalterado. Portanto, a melhora substancial da qualidade de vida do paciente não é absoluta, uma vez que a acinesia figura entre os sintomas mais disabilitantes. As complicações incluem apraxia do membro superior, disartria, disfagia, abulia e distúrbios da fala e da linguagem, principalmente nas intervenções bilaterais (Pahwa & Lyons 2007).
benefício na redução do tremor é bem mais discreto. Esta técnica cirúrgica apresenta morbidade menor que a talamotomia e mortalidade nula. No entanto, há relatos de complicações como disfunção cognitiva, disfagia, disartria, hemianopsia lateral homônima, hemiparesia transitória, abscesso intracraniano e hemorragia subcortical e palidal. Os locais acidentalmente lesionados são a cápsula interna e a radiação óptica (Pahwa & Lyons 2007).
1.5.2.2 - Estimulação Cerebral Profunda (ECP)
Há uma grande semelhança nos efeitos clínicos obtidos com lesão cirúrgica e a estimulação cerebral profunda. Tal fato sugere que a estimulação elétrica crônica atue de forma a romper ou inibir a atividade neuronal. A estimulação cerebral profunda possui a vantagem de poder ser regulada ou mesmo suspensa, ao contrário das técnicas lesionais. Da mesma forma, não impede que o paciente possa futuramente obter proveito de novas abordagens (Pahwa & Lyons 2007).
A técnica de ECP do núcleo subtalâmico é um procedimento comumente utilizado para casos mais avançados da DP. Nesta técnica, é feito um estudo pré-operatório de imagens (principalmente ressonância magnética) para determinar a localização dos alvos de estimulação. Durante a cirurgia são colocados primeiramente eletrodos de registro eletrofisiológicos até a região alvo. Em seguida, estes eletrodos são substituídos por outros que permitem iniciar as sessões de estimulação intra-operatória para avaliar a melhora do paciente, sobretudo para a rigidez. Após confirmação da melhora, são implantados os eletrodos de estimulação definitiva. Uma bateria subcutânea ligada ao eletrodo de estimulação é inserida na região da clavícula, ao final da cirurgia, ou vários dias depois (ver Benabid et al. 2009).
O mecanismo de ação da ECP ainda não está totalmente esclarecido, mas, sugere-se que a estimulação de alta frequência empregada poderia promover os seguintes mecanismos: (1) pode haver uma interferência na funcionalidade das redes neurais da região estimulada levando a uma dessincronização das oscilações anormais; (2) extinção ou inibição do disparo neuronal; (3) Indução de disparos de alta freqüência na região alvo e (4) inibição da produção ou liberação de algum neurotransmissor nas regiões afetadas (ver Benabid et al. 2009).
Tabela 2:Principaiscaracterísticas das intervenções cirúrgicas utilizadas no tratamento da DP.
Intervenção cirúrgica Características do procedimento
Palidotomia Procedimento de escolha no tratamento de
discinesias induzidas por levodopa e na bradicinesia refratária à medicação. Os locais acidentalmente lesionados são a cápsula interna e a radiação óptica.
Talamotomia Indicada no tratamento do tremor. Pode
proporcionar uma redução de até 80% da intensidade do tremor. É raramente realizado.
Estimulação Cerebral Profunda do Núcleo
Subtalâmico e Globo Pálido interno O eletrodo, sustentado por uma bateria subcutânea que dura de 3 a 5 anos, pode ser implantado no núcleo subtalâmico ou no globo pálido interno. Representa um custo elevado para o paciente.
Estimulação Talâmica No tálamo é inserido um eletrodo que está conectado à um pulso gerador localizado na pele sobre o tórax. Possui as vantagens da
talamotomia.
Transplante Uma alternativa recente é o alotransplante de
células mesencefálicas de fetos. Apresenta três problemas importantes: os de aspectos técnicos, éticos e imunológicos. Ainda não há consenso geral sobre a melhor localização onde devem ser repostas as células dopaminérgicas e necessita-se de pelo três menecessita-sencéfalos fetais para o implante unilateral.
Fonte: Adaptado de Singh (2007).
1.6 – MODELOS ANIMAIS DA DOENÇA DE PARKINSON
O aumento do conhecimento sobre a fisiopatologia da DP depende da existência de modelos animais adequados, que permitam a avaliação de novos agentes farmacológicos e estratégias terapêuticas antes que estes sejam aplicados em humanos. As características da DP podem ser mimetizadas, em maior ou menor escala, em animais de laboratório (como roedores e primatas) através da administração de diferentes compostos farmacológicos: reserpina, 6-hidroxidopamina (6-OHDA), 1-metil-4-fenil-1,2,3,6-tetrahidropiridina (MPTP), paraquate, manebe e rotenona (Dawson 2000); (Beal 2001) e (Shimohama et al. 2003).
Embora não exista um modelo animal ideal da DP, que satisfaça todos os critérios e apresente todas as características associadas à condição clínica em humanos, como: (I) fácil detecção das alterações motoras associadas ao parkinsonismo; (II) perda seletiva e gradual dos neurônios dopaminérgicos com o avanço da idade e (III) produção de inclusões citoplasmáticas (corpos de Lewy); alguns modelos têm sido de grande valia na elucidação dos mecanismos moleculares relacionados à neurodegeneração na DP e na avaliação de novos agentes terapêuticos (Shimohama et al. 2003).
(Fahn 2008). Entretanto, a principal desvantagem de tais modelos é que os déficits motores são temporários.
Em contraste, a 6-OHDA é uma das neurotoxinas mais comuns utilizadas experimentalmente em modelos de degeneração da SNpc, tanto in vitro como in vivo (Blum et al. 2001). A 6-OHDA é uma toxina efetiva em camundongos, ratos, gatos e primatas, mas, é incapaz de atravessar a barreira hematoencefálica, sendo necessária a administração diretamente na estrutura cerebral que se deseja lesar. (Schwarting & Huston 1996). Os sítios de injeção de 6-OHDA comumente são a SNpc; o feixe prosencefálico medial (objetivando lesionar o feixe nigroestriatal) e o estriado (Deumens et al. 2002) (Eslamboli 2005) (Simola et al. 2007).
O modelo de DP em roedores induzido por lesão unilateral dos núcleos da base por 6-OHDA tem sido empregado satisfatoriamente como um meio de detecção de potenciais agentes antiparkinsonianos através da indução de comportamento rotacional após a destruição da via nigroestriatal. Porém, a principal limitação do uso deste modelo é que este comportamento rotacional não se assemelha com as anormalidades motoras ocorridas na DP (Gerlach & Riederer 1996) (Deumens et al. 2002).
A injeção bilateral de 6-OHDA na SNpc ou em outras regiões cerebrais provoca uma mortalidade neuronal elevada (Glinka et al. 1997). Esta droga apresenta similaridade estrutural com as catecolaminas e tem alta afinidade pelo sistema de transporte das mesmas, mostrando assim a sua seletividade por neurônios catecolaminérgicos. A 6-OHDA produz lesões na SNpc pela indução da produção de H2O2 e radicais livres, como radicais •OH, e é
Após a injeção de 6-OHDA dentro da SNpc ou o feixe prosencefálico medial, os neurônios dopaminérgicos começam a degenerar dentro de 12 h e os níveis de dopamina reduzem para níveis acentuadamente baixos de 2 a 3 dias depois. De maneira interessante, a injeção intraestriatal de 6-OHDA causa uma morte neuronal induzida retrogradamente mais progressiva que a sua administração dentro da porção mesencefálica substância nigra / área tegmental ventral. A magnitude da lesão depende da quantidade de 6-OHDA injetada, o sítio de injeção, e as espécies animais usadas (Schober 2004).
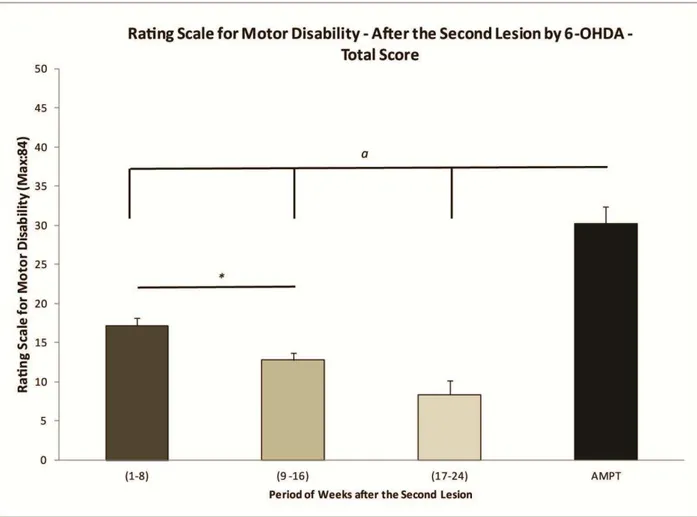
Animais lesionados bilateralmente com 6-OHDA demonstram sintomas motores parkinsonianos acentuados que prejudicam sua alimentação e por isso causa alta mortalidade, podendo prejudicar experimentos comportamentais de caráter crônicos (Ferro et al. 2005). A 6-OHDA é usualmente injetada unilateralmente, desta maneira, o hemisfério intacto funciona como um controle interno, constituindo um modelo de hemiparkinsonismo caracterizado por comportamento motor assimétrico (Betarbet et al. 2002).
Outro modelo animal da doença de Parkinson é o camundongo geneticamente alterado (knock-out, KO) para não expressar do transportador de dopamina (DAT-KO) (Giros et al. 1996). O transportador de dopamina (DAT) é responsável pela recaptação da dopamina liberada para o terminal pré-sináptico, controlando a duração e a intensidade da transmissão dopaminérgica. Nos animais DAT-KO, existe uma dependência estrita da dopamina recém sintetizada (síntese de novo) para a função sináptica normal e os níveis de dopamina extracelulares estão aumentados, levando à hiperatividade locomotora (Sotnikova et al. 2006).
A inibição aguda da enzima tirosina hidroxilase pela administração do fármaco AMPT (α -metil-p-tirosina) resulta em uma depleção rápida (<15min), profunda (>99,8 %) e de longo prazo (até 16 h) da dopamina estriatal. Os camundongos DAT-KO tratados com AMPT apresentam grave acinesia, rigidez, tremor e ptose (Gainetdinov 2008).
Um avanço importante no desenvolvimento dos modelos animais da DP, bem como do conhecimento acerca dos mecanismos relacionados ao processo neurodegenerativo desta doença, deu-se com a descoberta do MPTP (Dauer & Przedborski 2003). O uso desta substância foi um dos raros casos em que os efeitos da neurotoxina foram descobertos primeiro em humanos, sendo posteriormente desenvolvido o modelo animal (Shimohama et al. 2003).
Em primatas (homens, macacos e babuínos), o MPTP induz sinais que são praticamente indistinguíveis da DP, como degeneração de neurônios dopaminérgicos da via nigroestriatal, aparecimento de agregados da proteína α-sinucleína (embora não existam corpos de Lewy característicos), além de distúrbios motores clássicos da DP, como rigidez muscular, bradicinesia e instabilidade postural. Embora no modelo de parkinsonismo no sagui comum induzido com MPTP não seja mostrado a ocorrência de tremor de repouso, estes animais mostram um tremor corporal postural (Jenner 2003; Jackson & Jenner 2012). De maneira similar ao observado na DP, a neurotoxicidade e os sintomas induzidos pelo MPTP aumentam com o avanço da idade em primatas (Ovadia et al. 1995), podendo estes serem revertidos quando tratados com levodopa e agonistas dopaminérgicos (Langston & Irwin 1986; Jackson & Jenner 2012).
No entanto, o MPTP é considerado uma droga que requer um risco de segurança alto
para quem manuseia os animais de experimentação. E, por essa razão, procedimentos
rigorosos de conduta experimental e equipamentos de segurança laboratorial adequado são
uma exigência absoluta para se trabalhar com este modelo de parkinsonismo (Przedborski et
al. 2001). Consequentemente, surgiram uma série de estudos que visaram o desenvolvimento
de modelos de parkinsonismo em um primata não-humano de fácil manejo com base em
lesões intracerebrais de 6-OHDA que minimizassem o risco de exposição tóxica inadvertida
para pesquisadores e a equipe de manutenção dos biotérios (Ungerstedt 1976); (Annett et al.
1.6.1 – O modelo da 6-OHDA no sagui comum
O sagui comum (Callithrix jacchus) passou a ser utilizado mais recentemente como
uma boa referência de estudo de modelo de envelhecimento e de doenças neurodegenerativas
como a DP (Tardif et al. 2011). Este pequeno primata do novo mundo possui uma expectativa
de vida máxima de 16 anos. Além disso, eles exibem mudanças relacionadas à idade em
patologias que se espelham àquelas observadas em humanos como amiloidoses, assim como
propensão à redução da atividade do complexo ubiquitina-proteassoma, semelhante à DP
(Zeng et al. 2005).
Nesta espécie animal, os principais modelos de indução de sintomas motores de
parkinsonismo induzido por 6-OHDA são: (a) injeção unilateral no feixe prosencefálico
medial (feixe nigroestriatal) ou (b) injeção unilateral no estriado. Estes modelos são bastantes
descritos na literatura, e como mencionado anteriormente, requerem uma intervenção
cirúrgica estereotáxica. Estes dois modelos possibilitam a avaliação da coordenação motora
fina; negligência sensório-motora contralateral ao sítio de lesão; viés de cabeça ipsilateral ao
sítio de injeção, rigidez contralateral, bradicinesia e rotação corporal quando o animal tenta
movimentar-se. Os primeiros sintomas surgem após 7 dias da administração de 6-OHDA. As
características neuropatológicas reportam para uma perda acentuada tanto nos neurônios
dopaminérgicos quanto nos níveis de dopamina observado na região estriatal ipsilateral à
injeção. Em ambos os modelos de parkinsonismo induzido por 6-OHDA não há a descrição
de presença de corpos de Lewy. Para mais detalhes ver os trabalhos de (Annett et al. 1992)
(Eslamboli et al. 2003), (Eslamboli 2005) e (Jackson & Jenner 2012).
No modelo de parkinsonismo induzido por injeção de 6-OHDA no feixe de projeção
nigroestriatal dopaminérgica (feixe prosencefálico medial) os sintomas citados acima são
3-5 Hz típico de lesão do mesencéfalo, como visto no ser humano (Brooks & Piccini 2006).
Este modelo de parkinsonismo será adotado neste trabalho, adotando o modelo descrito por
Annett (1992).
O modelo de injeção bilateral simultânea de 6-OHDA tanto no estriado quanto no feixe nigroestriatal no sagui comum não são modelos frequentemente usados porque acabam levando a impedimento motor acentuado, o qual requer durante muitos dias um cuidado intensivo nos pós-operatório, além de elevada taxa de morbidade (Cenci et al. 2002).
Mais recentemente, modelos bilaterais de injeção de 6-OHDA no feixe nigroestriatal
foram conduzidos através de outra estratégia. Foi introduzida uma separação temporal das
cirurgias de lesão hemisféricas entre um lado. Ou seja, a injeção de 6-OHDA feita primeiro
em um hemisfério e depois de 8 semanas realizada no outro hemisfério, mostrou-se eficiente
em aumentar a sobrevida do animal. Neste modelo, também se faz necessário um cuidado
intensivo no pós-operatório, no entanto, este tempo despendido neste cuidado é reduzido
comparado ao modelo de injeção bilateral simultânea. Além disso, este modelo parece ter a
vantagem de otimizar o uso de um mesmo animal para uma avaliação comportamental em um
condição unilateral e posteriormente bilateral (Mitchell et al. 1995) (Klintenberg et al. 2003).
1.7 - ESTIMULAÇÃO DAS VIAS DA COLUNA DORSAL: DESSINCRONIZAÇÃO DE CIRCUITOS NEURONAIS ENVOLVIDOS NA DP
1.7.1 – Sincronização Anômala do Circuito Córtex Motor-Tálamo-Núcleos da Base na DP
Um importante fenômeno eletrofisiológico observado da reunião de neurônios de uma mesma região ou regiões distintas, é o fenômeno de sincronia das atividades neuronais. A dinâmica de sincronização de disparos de neurônios tem sido proposta como um mecanismo fundamental para representações de objetos perceptuais, esquemas cognitivos e funções motoras (Singer 1999; 2001; Fries 2009; Uhlhaas et al. 2009). Neste sentido, por exemplo, observa-se a atividade sincrônica da atividade correlacionada de diferentes neurônios entre o córtex e os NB, que seguem “loops” de reentradas entre estas duas regiões, cuja atividade cíclica se supõe sejam importantes para codificar diferentes tipos de movimentos (Hammond et al. 2007).
revertendo-se, por exemplo, com agonistas dopaminérgicos diretos ou mesmo a levodopa (Jaidar et al. 2010).
A sincronização da atividade neuronal das estruturas dos núcleos da base é também evidente nos potenciais de campos locais (LFPs) registrados na região subtalâmica de pacientes com a DP. Estas oscilações ocorrem principalmente na faixa de banda Beta (β) (~14
– 30 Hz) e após o tratamento com levodopa mudam para sincronização em frequências mais altas na faixa de gama (Kuhn et al. 2004; Kuhn et al. 2006). Esta mudança no padrão de bandas é compatível com a execução de movimento. Além disso, Estes registros sugerem que as descargas de alguns neurônios do núcleo subtalâmico estão bloqueadas (presas) em
oscilações β (Uhlhaas & Singer 2006). Do mesmo modo, foi observado este padrão de alteração anômala e a reversão para um padrão de oscilação gama em vários outros modelos animais, como em primatas não-humanos (Hammond et al.,2007).
O núcleo subtalâmico é o principal sítio alvo de ação da técnica de estimulação cerebral profunda em humanos. Sua efetividade terapêutica deve-se à aplicação de estímulos elétricos de alta frequência (>100 Hz) sobre esta região dos núcleos da base. Acredita-se que este padrão de estimulação possa promover uma ação de inibição da atividade deste núcleo, o que leva a uma ação dessincronizadora e uma liberação do estado anômalo em que ficavam os circuitos córtico-tálamo-núcleos da base na condição parkinsoniana (Benabid 2003).
1.7.2 – Estimulação Elétrica das Colunas Dorsais
epidural da medula espinhal restaurou a capacidade locomotora em dois modelos animais que reproduzem os principais sintomas da DP. Os modelos foram: (1) um modelo de depleção aguda de dopamina empregando camundongos DAT-KO tratados com AMPT e (2) um modelo crônico que envolveu a perda de conexões dopaminérgicas nigrais através da técnica de lesão bilateral estriatal com 6-OHDA em ratos (Fuentes et al. 2009).
Neste trabalho, os autores observaram que a técnica de ECD alterou o padrão de atividade no córtex motor e na região dorsolateral do estriado para um estado que se aproximou daquele encontrado durante a iniciação espontânea da locomoção, tanto nos animais normais quanto nos animais que reproduziram a DP. Ou seja, a ECD além de estimular as vias somestésicas (Holsheimer 2002) (Ramasubbu et al. 2013), poderia também recrutar áreas relacionadas à motricidade levando a uma dessincronização cortical e estriatal, requerida para a iniciação dos movimentos voluntários (Fuentes et al. 2009; Fuentes et al. 2010).
As chamadas colunas dorsais da medula espinhal são tratos de substância branca localizados na porção dorsal da medula espinhal. São formados por fibras de neurônios de segunda ordem, cujos axônios são do tipo grandes e mielinizado Aβ, que conduzem informações sensoriais ascendentes corporais de tato fino, pressão e propriocepção ao cérebro. As colunas dorsais da medula integram com o lemnisco medial do tronco cerebral o chamado sistema coluna dorsal-leminisco medial, e são subdivididas em fascículo grácil e fascículo cuneiforme. A figura 05 mostra a localização das colunas dorsais na medula. Para maiores detalhes sobre a organização e fisiologia das vias sensoriais ver Purves (2007).
medicamentos e alimentos dos Estados Unidos (“Food and Drug Administration – FDA”) para os seguintes tratamentos: dores crônicas, dores refratárias a medicamentos, dor bilateral ou unilateral associada com a síndrome pós-lamectomia, dores lombares e dores nas pernas. Além disso, a sua aplicação é autorizado para o tratamento de Neuropatias periféricas, causalgias, radiculopatias, distrofia simpático-reflexa entre outras fontes de dor crônica (Kries 2009). Quanto ao tratamento de outras patologias, é descrito o seu uso experimental em humanos, mas ainda sem estudos suficientes que permitam a aprovação pelas agências de saúde. Entre estas últimas condições de aplicação de tratamento destacam-se: a transsecção total da medula espinhal; paraplegia e quadriplegia (Fishman 2009; Harkema et al. 2011; Ramasubbu et al. 2013).
B
C
T2 - Sagui
D
T1 - Rato
E
T2 - Camundongo
Figura 5: Desenhos esquemáticos de seguimentosda medula espinhal. Em A, uma visão coronal de uma seção da medula espinhal, onde se observa a localização da passagem das vias sensoriais ascendentes representadas pela cor azul. Notar a localização do Sistema Coluna Dorsal-Leminisco Medial, subdividido em duas regiões: Fascículo Grácil e Fascículo Cuneiforme (estas duas regiões compõem as chamadas colunas dorsais da medula espinhal). Em vermelho, estão marcadas as regiões de passagem das vias motoras descendentes. B, C, D e E são desenhos esquemáticos da medula a nível torácico alto no Homem (B); Sagui (C); Rato (D) e Camundongo (E). Nestas estruturas note a semelhança das regiões da coluna dorsal. O fascículo grácil está indicado pela sigla “gr" ; enquanto o fascículo cuneiforme está sinalizado pela sigla “cu”. As regiões estão sinalizadas por um círculo vermelho. Adaptado de: (A) (Wikipedia 2013) e (B), (C), (D) e (E) adaptado de (Sengul 2013).
Dorsal
Ventral
1.8 – JUSTIFICATIVA
De acordo com as informações mostradas até o momento, o tratamento dos sintomas motores da DP corrente envolve apenas o controle dos sintomas. No entanto, a Estimulação Cerebral Profunda, a principal terapia não farmacológica utilizada atualmente no tratamento sintomático da DP, atinge apenas uma fração de todos os pacientes que poderiam se beneficiar desta terapia. O baixo número de pacientes elegíveis para este tratamento se deve, em parte, ao procedimento cirúrgico altamente invasivo (Singh et al. 2007).
Era, portanto, um fato potencialmente importante que um método muito menos invasivo pudesse ser desenvolvido e testado para se obter uma alternativa eficiente para aliviar os sintomas motores em modelos de roedores da DP.
Com base neste sentido, a técnica de ECD como complemento do tratamento da DP foi primeiramente desenvolvida em modelos de roedores no laboratório do professor Miguel Nicolelis (Duke University – Estados Unidos) e se mostrou ser um complemento importante na terapia da DP em modelos de roedores (Fuentes et al., 2009).
Após a implementação desta terapia nestes modelos animais, vários relatos de casos clínicos foram reportados na literatura. Quase todos estes relatos indicaram que esta técnica poderia se tornar uma alternativa para o tratamento dos sintomas motores da DP.
pode ser empregada como um complemento para o tratamento dos sintomas motores da DP, em primatas não-humanos .
2 – OBJETIVOS
2.1 – OBJETIVO GERAL
O objetivo geral do presente trabalho consisti em estudar os efeitos da estimulação elétrica das vias das colunas dorsais da medula espinhal em um modelo de parkinsonismo em um primata não-humano, c omo uma avaliação pré-clínica desta terapêutica, utilizando metodologias comportamentais; eletrofisiológicas e histológicas.
2.2 – OBJETIVOS ESPECÍFICOS
1 - Adaptar um modelo de parkinsonismo agudo bilateral, através do uso de 6-OHDA em primatas não-humanos da espécie Callithrix jacchus no Centro de Pesquisas de Macaíba (RN) do Instituto Internacional de Neurociências de Natal Edmond & Lily Safra (CPM/IINN-ELS), em parceria com a UFRN;
2 - Investigar as alterações comportamentais motoras nestes animais parkinsonianos; 3 - Utilizar a terapêutica experimental nos animais parkinsonianos com a técnica de Estimulação das Colunas Dorsais (ECD);