MARCADORES INFLAMATÓRIOS SOLÚVEIS
COMO PREDITORES DE ALTERAÇÕES
HISTOLÓGICAS HEPÁTICAS E RESPOSTA
TERAPÊUTICA NA INFECÇÃO CRÔNICA PELO
VÍRUS DA HEPATITE C
Alexandre Sampaio Moura
Belo Horizonte
MARCADORES INFLAMATÓRIOS SOLÚVEIS
COMO PREDITORES DE ALTERAÇÕES
HISTOLÓGICAS HEPÁTICAS E RESPOSTA
TERAPÊUTICA NA INFECÇÃO CRÔNICA PELO
VÍRUS DA HEPATITE C
Tese apresentada ao Programa de Pós Graduação em Ciências da Saúde: Infectologia e Medicina Tropical da Faculdade de Medicina da Universidade Federal de Minas Gerais, para obtenção de título de Doutor.
Área de concentração: Ciências da Saúde, Infectologia e Medicina Tropical.
Orientador: Prof. Dr. Manoel Otávio da Costa Rocha.
Co orientadores: Prof. Dr. Antônio Lúcio Teixeira. Dr. Ricardo Andrade Carmo.
Belo Horizonte
Faculdade de Medicina UFMG
REITOR
Prof. Ronaldo Tadêu Pena
PRÓ REITOR DE PÓS GRADUAÇÃO
Prof. Jaime Arturo Ramirez
FACULDADE DE MEDICINA
DIRETOR
Prof. Francisco José Penna
COORDEêADOR DO CEêTRO DE PÓS GRADUAÇÃO
Prof. Carlos Faria Santos Amaral
CHEFE DO DEPARTAMEêTO DE CLÍêICA MÉDICA
Prof. Dirceu Bartolomeu Greco
COLEGIADO DO PROGRAMA DE PÓS GRADUAÇÃO EM CIÊêCIAS DA SAÚDE:
IêFECTOLOGIA E MEDICIêA TROPICAL
Prof. Manoel Otávio da Costa Rocha (Coordenador)
Prof. Antônio Lúcio Teixeira Júnior (Subcoordenador)
Prof. Antônio Luiz de Pinho Ribeiro
Prof. Carlos Mauricio de Figueiredo Antunes
Prof. José Roberto Lambertucci
Ao Prof. Manoel Otávio da Costa Rocha, mestre e amigo, pelas marcas indeléveis deixadas
na minha formação não apenas científica, mas também clínica e pessoal ao longo desses
vários anos de convivência.
Ao Dr. Ricardo Andrade Carmo, por ter despertado em mim o interesse pelas hepatites
virais, pelo imenso apoio em todas as fases do projeto e por representar um referencial
ético em minha trajetória acadêmica e profissional.
Ao Prof. Antônio Lúcio Teixeira, pela dedicação na construção da interface entre a ciência
clínica e a ciência básica e pela inestimável ajuda na mensuração dos marcadores
inflamatórios e discussão da sua importância na hepatite C crônica.
À Profa. Virgínia Hora Rios Leite, pelos ensinamentos na interpretação dos achados
histológicos hepáticos e pela revisão das amostras de biópsia hepática deste projeto.
Ao Prof. Mauro Texeira, pela oportunidade de utilizar o laboratório de Imunofarmacologia
da UFMG para realização das dosagens dos marcadores inflamatórios.
Aos acadêmicos Hugo Almeida Chaves de Resende, Luís Eduardo Rias Cardoso, Lorena
Bicalho de Moravia, Caroline Machado, Priscila Rabelo Penido, Renata Saliba e Thaís
Brasil, pelo auxílio na coleta de dados e pela agradável convivência ao longo da realização
do projeto.
Ao acadêmico Felipe Barbosa, pela grande ajuda no âmbito computacional.
Ao êúcleo de Pesquisa em Apoio Diagnóstico da Universidade Federal de Minas Gerais,
em especial à Dra. Dora Mendes Del Castillo e à êara de Oliveira Carvalho, pelo apoio no
Aos funcionários do CTR Orestes Diniz, em especial a Maria Cristina Dias, Eni êunes
Corrêa e Rosângela Luiza Rocha, pelo apoio logístico na condução do trabalho.
À colega Renata Eliane de Ávila, pela troca de experiências ao longo de toda a condução
deste projeto.
Aos meus pais e a minha irmã, por estarem sempre dispostos a compartilhar os momentos
felizes, confortar minhas angústias e estimular continuamente meu crescimento
profissional.
A minha esposa Juliana e meus filhos, Henrique e Mariana, pelo amor e alegria
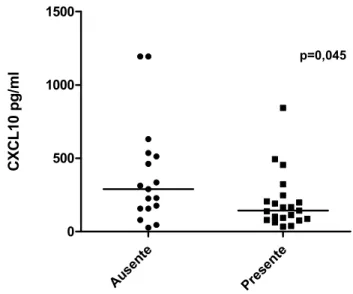
A progressão da doença hepática e a resposta terapêutica de pacientes cronicamente infectados pelo vírus da hepatite C (HCV) parecem ter relação com a resposta imune do hospedeiro. A ativação do sistema imune envolve a liberação de citocinas e de seus receptores, que podem ser dosados em amostras plasmáticas. O objetivo deste estudo foi analisar a associação entre níveis plasmáticos de quimiocinas e de receptores solúveis do fator de necrose tumoral com alterações histológicas hepáticas de pacientes portadores crônicos do HCV e com resposta ao tratamento combinado, utilizando interferon alfa e ribavirina. Dos 220 pacientes avaliados em serviço público de referência em hepatites virais de Belo Horizonte, MG, no período de junho de 2005 a dezembro de 2007, foram elegíveis 73 portadores crônicos do HCV, virgens de tratamento e com fragmento de biópsia hepática disponível para revisão. Dados sociodemográficos, clínicos e laboratoriais foram coletados e realizou se dosagem plasmática dos seguintes marcadores inflamatórios solúveis: CCL2, CCL3, CCL11, CCL24, CXCL9, CXCL10, sTêFR1 e sTêFR2. Os fragmentos de biópsia hepática foram revisados e classificados de acordo como o sistema de escore METAVIR, com posterior estratificação dos graus de atividade necro inflamatória e os de fibrose da seguinte forma: A ≤ 1 (atividade ausente/leve) e A≥2 (atividade moderada/intensa); F≤1 (fibrose ausente/leve) e F≥2 (fibrose moderada/intensa). Observou se que os níveis plasmáticos de CXCL9, sTêFR1 e sTêFR2 associaram se de maneira significativa à fibrose hepática (p=0,014; p=0,012; p=0,009, respectivamente), sendo que os pacientes com fibrose hepática moderada/intensa apresentaram medianas mais elevadas dos níveis plasmáticos desses marcadores se comparadas às encontradas em pacientes com fibrose ausente/leve. Os níveis de sTêFR2 associaram se de maneira significativa também à atividade necro inflamatória hepática, com mediana mais elevada sendo encontrada em pacientes com atividade necro inflamatória moderada/intensa se comparada à encontrada em indivíduos com atividade ausente/leve (2,34 ng/mL vs. 1,99 ng/mL; p=0,019). O total de 41 pacientes submeteu se a tratamento com interferon alfa e ribavirina no período do estudo e os níveis desses marcadores inflamatórios puderam ser analisados em relação à resposta terapêutica. Os níveis plasmáticos pré tratamento de CXCL10 estiveram significativamente mais elevados entre pacientes que não apresentaram resposta virológica precoce (RVP), se comparados àqueles com RVP (512,9 pg/mL 179,1 pg/mL; p=0,011), e entre os que não apresentaram resposta virológica sustentada (RVS), se comparados aos que apresentaram RVS (289,9 pg/mL vs. 142,7 pg/mL; p=0,045). A acurácia da CXCL10 como preditora de ausência de RVP e RVS foi de 0,79 (IC95%: 0,59 0,99) e 0,69 (IC95%: 0,51 0,87), respectivamente. Concluiu se que os níveis plasmáticos de CXCL9, sTêFR1 e sTêFR2 associaram se de maneira significativa e independente a alterações histológicas hepáticas, sugerindo um possível papel da ativação do sistema TêF e da reposta do tipo Th1 na patogênese da infecção pelo HCV. Além disso, níveis plasmáticos pré tratamento elevados de CXCL10 foram preditores de ausência tanto de RVP quanto de RVS ao tratamento com interferon e ribavirina, podendo ser potencialmente úteis na avaliação da indicação de terapia específica de pacientes infectados pelo HCV.
Host immune response seems to be responsible for progression of liver disease among patients chronically infected with hepatitis C virus (HCV), but is also crucial for successful clearance of the virus following specific therapy. Activation of the immune system involves the release of cytokines and their receptors that can be measured in plasmatic samples. The present study aimed to evaluate the association between chemokines and soluble tumor necrosis factor receptors (sTêFR) plasmatic levels and both liver histological changes and therapeutic response to interferon α and ribavirin. From June 2005 to December 2007, 73 treatment naïve patients, chronically infected with HCV and with an available liver biopsy fragment were included in the study. Socio demographic, clinical and laboratory data were collected and plasmatic levels were assessed for CCL2, CCL3, CCL11, CCL24, CXCL9, CXCL10, sTêFR1 e sTêFR2. Histological findings of the liver fragment were reviewed and classified according to the METAVIR scoring system and stratified as following: A ≤ 1 (none or mild inflammatory activity) e A≥2 (moderate or severe inflammatory activity); F≤1 (none or mild fibrosis) e F≥2 (moderate or sever fibrosis). Plasmatic levels of CXCL9, sTêFR1 and sTêFR2 were significantly associated with liver fibrosis with higher median levels among those with moderate/severe fibrosis if compared to those with no or mild fibrosis (p=0,014; p=0,012; p=0,009, respectively). Plasmatic sTêFR2 levels were significantly associated with liver necro inflammatory activity with higher median leves among those with moderate/severe activity if compared to those with no or mild activity (2,34 ng/mL vs. 1,99 ng/mL; p=0,019). Forty one patients were treated with interferon α and ribavirin during the study period and the association between the levels of these inflammatory markers and therapeutic response was analyzed. Pre treatment CXCL10 levels were significantly higher among patients without early or sustained virologic response if compared to non reponders (512,9 pg/mL vs 179,1 pg/mL; p=0,011 and 289,9 pg/mL vs. 142,7 pg/mL; p=0,045, respectively). Accuracy of CXCL10 as predictor of absence of EVR and SVR was 0,79 (CI95%: 0,59 0,99) and 0,69 (CI95%: 0,51 0,87), respectively. In conclusion, plasmatic leves of CXCL9, sTêFR1 and sTêFR2 were independetly associated with liver histological changes suggesting a role of TêF activation and Th1 type cell mediated immune response in the pathogenesis of HCV infection. In addition, pre treatment CXCL10 levels were predictor of both early and sustained virologic response to interferon α and ribavirin and might be potentially useful in the evaluation of candidates for therapy.
Tabela 1 Comparação de características clínico demográficas entre sujeitos
elegíveis (ê=73) e não elegíves (ê=147)... 58
Tabela 2 Comparação da mediana e da amplitude interquartil (AIQ) dos níveis de
mediadores inflamatórios solúveis entre portadores crônicos do HCV e o
grupo controle... 60
Tabela 3 Comparação da mediana e amplitude interquartil (AIQ) dos mediadores
inflamatórios solúveis (em pg/mL) entre pacientes com infecção crônica
pelo HCV apresentando atividade necro inflamatória ausente/leve
(METAVIR A ≤1) e aqueles apresentando atividade moderada/intensa
(METAVIR A≥2) à biópsia hepática... 62
Tabela 4 Comparação da mediana e amplitude interquartil (AIQ) dos mediadores
inflamatórios solúveis (em pg/mL) entre pacientes com infecção crônica
pelo HCV apresentado fibrose ausente/leve (METAVIR F ≤1) e aqueles
apresentando fibrose moderada/intensa (METAVIR F≥2) à biópsia
hepática... 63
Tabela 5 Associação entre fatores sociodemográficos e histológicos contínuos,
representados como média (± dp) e atividade necro inflamatória hepática
de acordo com a classificação de METAVIR em pacientes com infecção
crônica pelo HCV... 67
Tabela 6 Associação entre fatores sociodemográficos, clínicos e virológicos
categóricos e atividade necro inflamatória hepática de acordo com a
classificação de METAVIR em pacientes com infecção crônica pelo
HCV... 68
Tabela 7 Associação entre fatores sociodemográficos e histológicos contínuos,
representados como média (± dp), e fibrose hepática de acordo com a
classificação de METAVIR, em pacientes com infecção crônica pelo
HCV... 69
Tabela 8 Associação entre fatores clínico virológicos e fibrose hepática de acordo
com a classificação de METAVIR em pacientes com infecção crônica
hepática em pacientes com infecção crônica pelo HCV... 71
Tabela 10 Análise da correlação entre os níveis plasmáticos pré tratamento de
quimiocinas em pacientes com infecção crônica pelo HCV
(ê=71)... 72
Tabela 11 Modelo final de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática na infecção crônica pelo HCV, incluindo o
marcador inflamatório sTêFR1... 72
Tabela 12 Modelo final de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática na infecção crônica pelo HCV, incluindo o
marcador inflamatório sTêFR2... 73
Tabela 13 Modelo final de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática na infecção crônica pelo HCV, incluindo o
marcador inflamatório sTêFR2 e não incluindo a variável atividade
necro inflamatória... 73
Tabela 14 Modelo final de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática na infecção crônica pelo HCV, incluindo o
marcador inflamatório CXCL9... 73
Tabela 15 Perfil dos pacientes com hepatite C crônica submetidos a tratamento com
interferon e ribavirina (ê=41)... 74
Tabela 16 Resposta virológica ao tratamento de pacientes com infecção crônica
pelo HCV, global e estratificada por genótipo viral... 75
Tabela 17 Associação dos níveis plasmáticos pré tratamento de quimiocinas e
receptores solúveis de TêF com resposta virológica precoce
(RVP)... 78
Tabela 18 Associação dos níveis plasmáticos pré tratamento de quimiocinas e
receptores solúveis de TêF com resposta virológica ao final do
tratamento (RVF)... 78
Tabela 19 Associação dos níveis plasmáticos pré tratamento de quimiocinas e
receptores solúveis de TêF com resposta virológica sustentada... 79
Tabela 20 Associação entre níveis plasmáticos de CXCL10 e resposta virológica
Tabela 22 Associação entre níveis plasmáticos de CXCL10 e resposta virológica
sustentada (RVS)... 81
Tabela 23 Associação entre níveis plasmáticos de CXCL10 e resposta virológica
sustentada (RVS)... 82
Tabela 24 Associação entre fatores clínico demográficos e resposta virológica
precoce em pacientes com infecção crônica pelo HCV (apenas genótipo
1)... 82
Tabela 25 Associação entre fatores clínico demográficos e resposta virológica ao
final do tratamento em pacientes com infecção crônica pelo
HCV... 84
Tabela 26 Associação entre fatores clínico demográficos e resposta virológica
sustentada... 85
Tabela 27 Comparação dos níveis plasmáticos pré tratamento dos marcadores
inflamatórios pré tratamento com interferon e ribavirina e na 12asemana
de tratamento (n=25)... 86
Tabela 28 Comparação dos níveis plasmáticos dos marcadores inflamatórios pré
tratamento e ao final do tratamento com interferon e ribavirina em
pacientes com hepatite C crônica (n=13)... 87
Tabela 29 Comparação dos níveis pré tratamento e na 12a semana de tratamento
entre pacientes com hepatite C crônica sem resposta precoce a interferon
e ribavirina (n=8 88
Tabela 30 Comparação dos níveis dos marcadores inflamatórios plasmáticos pré
tratamento e na 12asemana de tratamento entre pacientes com hepatite C
crônica apresentando resposta precoce ao tratamento com interferon e
ribavirina (n=17)... 88
Tabela 31 Comparação dos níveis dos marcadores inflamatórios plasmáticos pré
tratamento e na 12asemana de tratamento entre pacientes com hepatite C
crônica sem resposta sustentada (n=13)... 89
Tabela 32 Comparação dos níveis plasmáticos dos marcadores inflamatórios pré
tratamento e na 12asemana de tratamento entre pacientes com hepatite C
Tabela 34 Modelo de regressão logística para análise multivariada dos fatores
preditores de atividade necro inflamatória hepática depois da retirada das
variáveis “idade”, “uso de medicamento hepatotóxico”, “hábito recente
de ingestão etílica moderada /intensa”... 117
Tabela 35 Modelo de regressão logística para análise multivariada dos fatores
preditores de atividade necro inflamatória hepática depois da retirada das
variáveis “idade”, “uso de medicamento hepatotóxico”, “hábito recente
de ingestão etílica moderada/intensa” e “aumento de ALT ≥ 1,5x LSê”.. 118
Tabela 36 Modelo final de regressão logística para análise multivariada dos fatores
preditores de atividade necro inflamatória hepática... 118
Tabela 37 Modelo inicial de regressão logística para análise multivariada dos
fatores preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR1... 119
Tabela 38 Modelo de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR1, depois da retirada das variáveis “diabetes tipo 2”, “esteatose
hepática” e “genótipo viral 1”... 119
Tabela 39 Modelo de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR1, depois da retirada das variáveis “diabetes tipo 2”, “esteatose
hepática”, “genótipo viral 1” e “idade”... 120
Tabela 40 Modelo final de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR1... 120
Tabela 41 Modelo inicial de regressão logística para análise multivariada dos
fatores preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR2... 120
Tabela 42 Modelo inicial de regressão logística para análise multivariada dos
fatores preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR2, depois da retirada das variáveis “diabetes tipo 2” e “esteatose
sTêFR2, depois da retirada das variáveis “diabetes tipo 2”, “esteatose
hepática” e “genótipo viral 1”... 121
Tabela 44 Modelo inicial de regressão logística para análise multivariada dos
fatores preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR2, depois da retirada das variáveis “diabetes tipo 2”, “esteatose
hepática”, “genótipo viral 1” e “níveis de sTêFR2”... 122
Tabela 45 Modelo final de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR2... 122
Tabela 46 Modelo inicial de regressão logística para análise multivariada dos
fatores preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR2, e não incluindo a variável “atividade necro inflamatória”... 122
Tabela 47 Modelo de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR2, e não incluindo a variável “atividade necro inflamatória”,
depois da retirada da variável “diabetes tipo 2”……….. 123
Tabela 48 Modelo de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR2, e não incluindo a variável “atividade necro inflamatória”,
depois da retirada da variável “diabetes tipo 2” e “genótipo viral 1”…….. 123
Tabela 49 Modelo final de regressão logística para análise multivariada dos fatores
preditores de fibrose hepática, contendo o marcador inflamatório
sTêFR2, e não incluindo a variável “atividade necro inflamatória”... 123
Tabela 50 Modelo inicial de regressão logística para análise multivariada dos
fatores preditores de fibrose hepática, contendo o marcador inflamatório
CXCL9... 124
Tabela 51 Modelo inicial de regressão logística para análise multivariada dos
fatores preditores de fibrose hepática, contendo o marcador inflamatório
CXCL9, depois da retirada das variáveis “diabetes tipo 2”, “esteatose
CXCL9, depois da retirada das variáveis “diabetes tipo 2”, “esteatose
hepática”, “genótipo viral 1” e “idade”... 125
Tabela 53 Modelo final de regressão logística para análise multivariada dos fatores
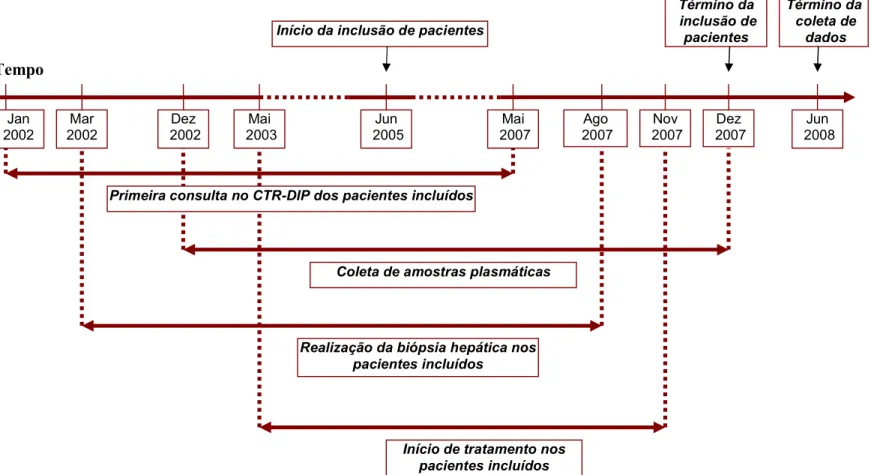
Figura 1 Desenho cronológico do estudo “Marcadores inflamatórios solúveis
como preditores de alterações histológicas hepáticas e resposta
terapêutica na infecção crônica pelo vírus da hepatite C”, Belo
Horizonte, MG, 2002 2007……….. 40
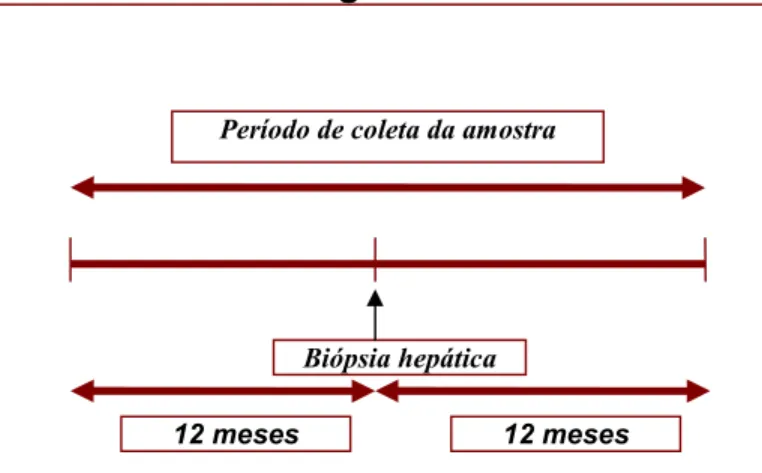
Figura 2 Diagrama do momento da coleta de amostras de plasma para análise da
associação entre níveis de mediadores inflamatórios solúveis e
alterações histológicas hepáticas na infecção crônica pelo vírus da
hepatite C... 42
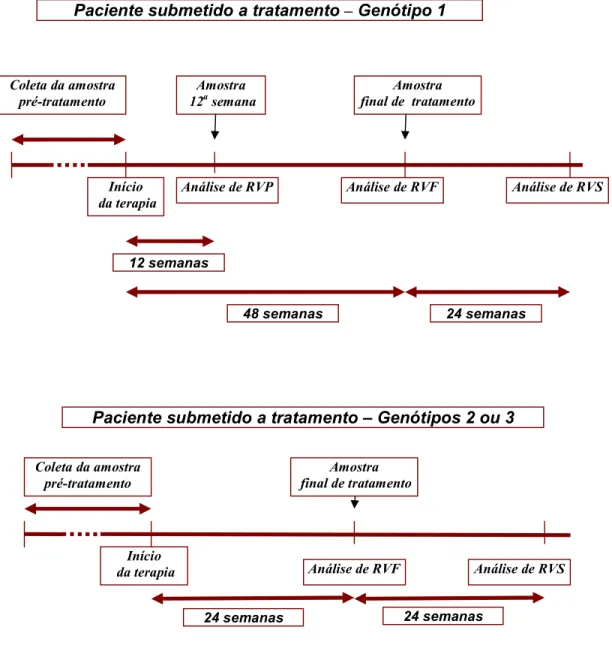
Figura 3 Diagrama do momento de coleta de amostras de plasma para análise da
associação entre níveis de mediadores inflamatórios solúveis e resposta
virológica ao tratamento na infecção crônica pelo vírus da hepatite C
(HCV), tanto para pacientes com genótipo viral 1 do quanto para
pacientes com genótipos 2 e 3……….. 43
Figura 4 Fluxograma de análise da eligibilidade dos pacientes... 59
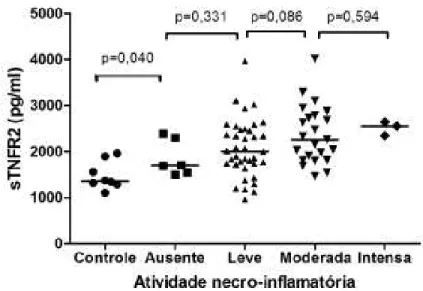
Gráfico 1 êíveis plasmáticos de sTêFR2 no grupo controle e estratificados por
diferentes graus de atividade necro inflamatória hepática em pacientes
com infecção crônica pelo HCV... 63
Gráfico 2 êíveis plasmáticos de sTêFR1 no grupo controle e estratificados por
diferentes graus de fibrose hepática em pacientes com infecção crônica
pelo HCV... 64
Gráfico 3 êíveis plasmáticos de sTêFR2 no grupo controle e estratificados por
diferentes graus de fibrose hepática em pacientes com infecção crônica
pelo HCV... 64
Gráfico 4 êíveis plasmáticos de CXCL9 no grupo controle e estratificados por
diferentes graus de fibrose hepática em pacientes com infecção crônica
pelo HCV... 65
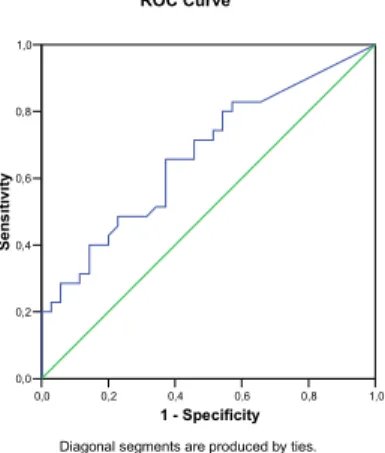
Gráfico 5 Curva ROC dos níveis plasmáticos de CXCL9 como preditores de
Gráfico 7 Curva ROC dos níveis plasmáticos de sTêFR2 como preditores de
fibrose hepática moderada/avançada (METAVIR ≥F2)... 66
Gráfico 8 êíveis plasmáticos de CXCL10 em pacientes com hepatite C crônica
estratificados por resposta virológica precoce... 77
Gráfico 9 êíveis plasmáticos de CXCL10 em pacientes com hepatite C crônica
estratificados por resposta virológica sustentada... 77
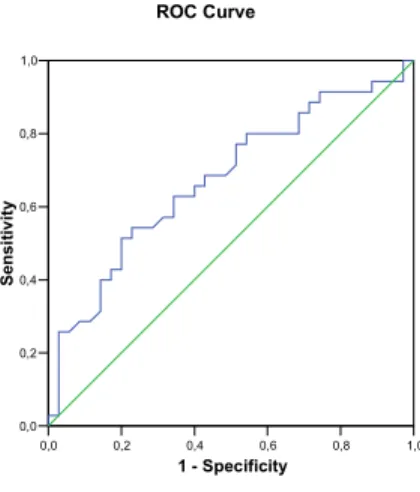
Gráfico 10 Curva ROC dos níveis plasmáticos de CXCL10 como preditores de
ausência de resposta virológica precoce...
79
Gráfico 11 Curva ROC dos níveis plasmáticos de CXCL10 como preditores de
ausência de resposta virológica sustentada... 80
Gráfico 12 êíveis plasmáticos de CXCL10 estratificado por resposta virológica
sustentada em pacientes com tempo entre coleta da amostra e início do
tratamento superior a 365 dias... 80
Quadro 1 Classificação histopatológica da infecção pelo HCV segundo os
critérios estabelecidos pelo METAVIR……… 46
Quadro 2 Classificação semiquantitativa de esteatose hepática………... 47
Quadro 3 Definição operacional das variáveis sociodemográficas e
epidemiológicas... 51
Quadro 4 Definição operacional das variáveis indicadoras de exposição a fatores
de risco para doença hepática... 52
Quadro 5 Definição operacional das variáveis laboratoriais... 52
AIQ Amplitude interquartil
ALT Alanina aminotransferase
Anti HBc Anticorpo contra o antígeno central (core) do vírus da hepatite B
Anti HCV Anticorpo contra o vírus da hepatite C
Anti HIV Anticorpo contra o vírus da imunodeficiência humana
BSA Albumina de soro bovino
CCL Quimiocina da subfamília CC
CCR Receptor de quimiocinas CC
CTR DIP Centro de Treinamento e Referência em Doenças Infecto Parasitárias
CXCL Quimiocina da subfamília CXC
CXCR Receptor de qumiocinas CXC
dp Desvio padrão
EIA Imunoenzimática
ELISA
FAê Fator antinuclear
FIG Figura
H2SO4 Ácido sulfúrico
HAI Índice de atividade histológica
HBsAg Antígeno de superfície do vírus da hepatite B
HCV Vírus da hepatite C
HIV Vírus da imunodeficiência humana
HSC Células estelares hepáticas
IC Intervalo de confiança
IFê Interferon
IMC Índice de massa corpórea
IP 10
LSê Limite superior da normalidade
LTC Linfócito T citotóxico
MMP Metaloproteinase
êaCl Cloreto de sódio
êK
êT êucleotídeo
êUPAD êúcleo de Pesquisa em Apoio Diagnóstico
OR
PBMC Células mononucleares periféricas
PBS Tampão fosfato salina
PCR Reação em cadeia de polimerase
PDGF Fator de crescimento derivado de plaquetas
RAêTES ! " #
RBV Ribavirina
RêA Ácido ribonucléico
ROC
rpm Rotações por minuto
RVF Resposta virológica final
RVP Resposta virológica precoce
RVS Resposta virológica sustentada
SPSS $ % $ $
sTêFR1 Receptor solúvel de fator de necrose tumoral tipo 1
sTêFR2 Receptor solúvel de fator de necrose tumoral tipo 2
TAB Tabela
TCLE Termo de consentimento livre e esclarecido
TGF Fator de crescimento e transformação
Th "
TIMP "
TêF Fator de necrose tumoral
UFMG Universidade Federal de Minas Gerais
VPê Valor preditivo negativo
VPP Valor preditivo positivo
1 IêTRODUÇÃO... 20
1.1 Hipótese... 21
2 REVISÃO DA BIBLIOGRAFIA... 22
2.1 Aspectos gerais da infecção pelo vírus da hepatite C... 22
2.2 Citocinas e inflamação hepática... 23
2.3 Citocinas e fibrogênese... 25
2.4 Marcadores inflamatórios solúveis de alterações histológicas hepáticas... 26
2.4.1 Quimiocinas e doença hepática... 26
2.4.2 Fator de necrose tumoral, seus receptores solúveis e dano hepatocelular... 29
2.5 Tratatamento na hepatite C crônica... 31
2.5.1 Associação entre níveis de quimiocinas e resposta ao tratamento da hepatite C crônica... 32
2.5.2 TêF α, seus receptores solúveis e resposta terapêutica na hepatite C crônica.. 35
3 OBJETIVOS... 37
3.1 Objetivos principais... 37
3.2 Objetivos secundários... 37
4 PACIEêTES E MÉTODOS... 38
4.1 Desenho... 38
4.2 Local do estudo... 39
4.3 Obtenção e armazenamento das amostras de plasma... 41
4.4. Mensuração dos marcadores inflamatórios solúveis... 44
4.5 Realização e análise de biópsia hepática... 45
4.6 Tratamento da hepatite crônica... 47
4.7 Critérios de inclusão e de exclusão... 48
4.8 Definição dos eventos e classificação operacional das variáveis... 49
4.9 Coleta e análise dos dados... 53
4.13 Ética... 55
5 RESULTADOS... 57
5.1 Análise descritiva... 57
5.2 Comparação dos níveis dos mediadores inflamatórios solúveis entre pacientes com hepatite C e o grupo controle... 60
5.3 Fatores preditores de alterações à biópsia hepática... 61
5.3.1 Mediadores inflamatórios solúveis e alterações histológicas hepáticas... 61
5.3.2 Fatores clínico virológicos e alterações histológicas hepáticas... 67
5.3.3 Análise multivariada dos fatores associados com atividade necro inflamatória hepática... 70
5.3.4 Análise multivariada dos fatores associados à fibrose hepática... 71
5.4 Fatores associados à resposta terapêutica... 74
5.4.1 Análise da associação entre marcadores inflamatórios solúveis e resposta virológica ao tratamento... 76
5.4.2 Associação entre fatores clínico demográficos e resposta virológica ao tratamento... 82
5.4.3 Análise da cinética dos mediadores inflamatórios solúveis após início do tratamento... 86
6 DISCUSSÃO... 90
7 LIMITAÇÕES DO ESTUDO... 98
8 COêCLUSÕES... 100
9 PROPOSIÇÕES... 101
REFERÊêCIAS... 102
1 INTRODUÇÃO
A hepatite C é responsável por significativa morbidade e mortalidade em todo o
mundo, sendo uma das principais causas de cirrose hepática e indicações de transplante de
fígado (PERZ &, 2006). A taxa mundial de prevalência da hepatite C é estimada em 2% (SHEPARD; FIêELLI; ALTER, 2005), semelhante à observada em estudos de base
populacional realizados no Brasil, nos quais essa taxa tem se situado em torno de 1,5%
(FOCACCIA &, 1998; SILVA &, 1995; ZARIFE &, 2006).
A gravidade da inflamação e da fibrose hepática varia entre os pacientes
cronicamente infectados pelo vírus da hepatite C (HCV) e fatores como sexo masculino,
idade mais avançada no momento da infecção e consumo excessivo de álcool estão
associados à maior intensidade da inflamação e fibrose hepáticas (POYêARD;
BEDOSSA; OPOLOê, 1997; POYêARD &, 2001). Uma progressão mais rápida da doença é encontrada também em pacientes co infectados com o vírus da imunodeficiência
humana (BEêHAMOU &, 1999) ou com o vírus da hepatite B (BEêVEGêU &, 1994) e aqueles que apresentam esteatose hepática (LEAêDRO &, 2006) e resistência à insulina (HUI &, 2003).
O tratamento combinado de interferon com ribavirina tem demonstrado a
interrupção e até mesmo a reversão do processo de fibrose quando existe resposta
virológica sustentada (POYêARD &, 2002). Infelizmente, as taxas de resposta são baixas, especialmente entre pacientes infectados pelo genótipo 1 do HCV e aqueles com
idade mais avançada ou com fibrose mais acentuada (FRIED &, 2002; LEE &, 2002; MAêêS &, 2001; MIHM &, 2006). A identificação de candidatos apropriados para o tratamento é de suma importância devido ao alto custo dos medicamentos e ao risco de
eventos adversos potencialmente graves com a terapia atualmente disponível.
A avaliação do estadiamento hepático em pacientes infectados pelo HCV é
essencial para estabelecer prognóstico e avaliar a necessidade de terapia antiviral. A
biópsia hepática é, atualmente, o padrão ouro para avaliação da fibrose hepática, mas
técnicas de imagem como o Fibroscan e painéis de marcadores hematológicos/bioquímicos
como o Fibrotest e o APRI (índice de razão entre aspartato aminotransferases e plaquetas)
associados à biópsia hepática, principalmente em pacientes com distúrbios da hemostasia
(STRASSBURG; MAêêS, 2006).
A importância do padrão da resposta inflamatória tanto na fibrogênese hepática
quanto na resposta ao tratamento da hepatite C está bem estabelecida (APOLIêARIO;
GARCIA MOêZOê, 2003; CERêY; CHISARI, 1999; CHAêG; REHERMAêê;
CHISARI, 1997; FRIEDMAê, 1999; êEUMAê &, 2001). êo entanto, em grande parte desses estudos o padrão inflamatório é avaliado por métodos tecnicamente complexos,
como análise da expressão intra hepática ou em cultura de leucócitos de marcadores
inflamatórios, o que as torna de pouca utilidade na prática clínica. Desta forma, a
disponibilidade de técnicas mais simples e que possam ser padronizadas para análise do
processo inflamatório na hepatite C crônica como, por exemplo, a dosagem
imunoenzimática periférica de mediadores inflamatórios plasmáticos e de receptores
solúveis de citocinas pode representar importante avanço.
O uso de marcadores inflamatórios solúveis como preditores de alterações
histológicas hepáticas e de resposta virológica em pacientes com hepatite C crônica vem
sendo estudado na última década. Entre as citocinas, a análise dos níveis periféricos da
quimiocina CXCL10 e do fator de necrose tumoral alfa (TêF α) parece promissora
(êEUMAê &, 2001; êEUMAê &, 2002a). A associação dos níveis periféricos de outras quimiocinas como a CXCL9, CCL11, CCL24 e dos receptores solúveis do fator de
necrose tumoral (sTêFR) com alterações histológicas hepáticas ainda precisa ser melhor
compreendida (APOLIêARIO &, 2002; KALLIêOWSKI &, 1998; SHIELDS &, 1999; ZYLBERBERG &, 1999). Além disso, há poucas pesquisas sobre marcadores inflamatórios solúveis como preditores de resposta terapêutica à combinação de interferon
com ribavirina fora do ambiente extremamente controlado dos ensaios clínicos
randomizados (DIAGO &, 2006).
1.1 Hipótese
êíveis plasmáticos de quimiocinas e receptores solúveis de fator de necrose
tumoral estão associados com atividade necro inflamatória e fibrose hepática e também
com resposta virológica ao interferon e ribavirina em pacientes com infecção crônica pelo
2 REVISÃO BIBLIOGRÁFICA
2.1 Aspectos gerais da infecção pelo vírus da hepatite C
O vírus da hepatite C (HCV), identificado em 1989, é pequeno, com
aproximadamente 50 nm, envelopado, e contém genoma constituído por fita simples de
ácido ribonucléico (RêA) (CHOO &, 1989). Pertence à família ' e é subdividido em seis genótipos principais que se diferenciam em relação à distribuição
geográfica e à susceptibilidade ao tratamento (WOêG; LEE, 2006). O genótipo 1 é o mais
prevalente no Brasil, incluindo Minas Gerais, e na maior parte do mundo, sendo sua forma
crônica a de mais difícil erradicação com o tratamento combinado de interferon e
ribavirina (CAMPIOTTO &, 2005; CARMO &, 2002; PEROêE &, 2008; ZEIê, 2000).
A principal forma de transmissão do HCV é a via parenteral e, desta forma, os
principais fatores de risco são o uso de drogas injetáveis e hemotransfusão antes de 1992,
momento no qual os hemoderivados passaram a ser rastreados para presença de anticorpos
contra o HCV (WOêG; LEE, 2006). A transmissão do HCV pode também ocorrer pela via
sexual ou vertical, mas de forma bem menos eficiente do que pela via parenteral (LAUER;
WALKER, 2001; WOêG; LEE, 2006).
A fase aguda da infecção pelo HCV é geralmente assintomática e, por isto,
pouco detectada (WOêG; LEE, 2006). Devido à sua alta taxa replicativa, elevada
mutagênese e sua capacidade de subverter tanto a resposta imune inata quanto a adquirida,
o HCV é capaz de persistir no hospedeiro, causando infecção crônica em cerca de 70% dos
pacientes infectados (KAêTO; HAYASHI, 2006; REHERMAêê; êASCIMBEêI, 2005).
Apesar de pouco citopático, o HCV estimula uma agressão imunomediada ao parênquima
hepático que, ao longo de décadas, pode resultar em cirrose hepática e carcinoma
hepatocelular (ALTER; SEEFF, 2000). Dos pacientes cronicamente infectados pelo HCV,
aproximadamente 15% evoluem para cirrose hepática ao longo de um período que pode
variar entre 10 e 30 anos e, nos pacientes com cirrose hepática, o hepatocarcinoma ocorre
na taxa de 1 a 4% ao ano (LAUER; WALKER, 2001). O vírus da hepatite C é responsável
mundo e resulta em mais de 350.000 óbitos ao ano decorrentes dessas complicações
(PERZ &, 2006).
A evolução para cirrose, quando acontece, geralmente é lenta e assintomática
(LAUER; WALKER, 2001). Diversos fatores parecem favorecer a evolução mais rápida
da doença e, entre eles, destacam se idade mais avançada no momento da infecção,
ingestão moderada ou intensa de álcool e presença de co infecções pelo vírus da hepatite B
ou pelo vírus da imunodeficiência humana (SEEFF, 2002). A importância do padrão de
ativação do sistema imunológico na progressão da doença será motivo de discussão nas
seções subseqüentes.
2.2 Citocinas e inflamação hepática
As citocinas constituem um grupo de pequenas proteínas regulatórias
responsáveis pela sinalização intercelular. êo fígado, elas são secretadas por diversos tipos
celulares e ligam se a receptores específicos na membrana da célula alvo, desencadeando
uma cascata de eventos intracelulares importantes para a regulação da resposta imune ao
HCV (JACOBSOê BROWê; êEUMAê, 2001; MAHER, 1999). êa resposta inata ao
HCV, a expressão de IFê α e de genes induzidos pelo IFê está elevada e ocorre secreção
de IFêγ por células (êK) ativadas (KAêTO; HAYASHI, 2006). Ainda
nessa fase de resposta, células dendríticas hepáticas processam antígenos virais, maturam e
migram para tecidos linfóides, onde estimulam linfócitos T e B, dando início à resposta
imune adquirida (KAêTO; HAYASHI, 2006). Como parte da resposta adquirida,
linfócitos T ativados específicos para o HCV migram para o fígado e anticorpos contra o
HCV passam a ser detectados no soro (KAêTO; HAYASHI, 2006).
As citocinas desempenham importante papel importante na modulação da
resposta imune, direcionando a para um padrão em que predominará a resposta estimulada
por linfócitos T auxiliares do tipo 1 (Th1) ou do tipo 2 (Th2) (JACOBSOê BROWê;
êEUMAê, 2001; SYRBE; SIVEKE; HAMAêê, 1999). Células Th1 secretam fator de
necrose tumoral (TêF), IFêγ e interleucinas (IL 1, IL 2, IL 6, IL 12, IL 18), que
estimulam a imunidade celular a partir da ativação de células êK, macrófagos e produção
de linfócitos T citotóxicos (CHAêG; REHERMAêê; CHISARI, 1997). A resposta tipo
Th2, desencadeada pela secreção de IL 4, IL 5, IL 10 e IL 13, estimula a imunidade
Os linfócitos T citotóxicos (LTC) exercem papel fundamental na resposta
imune celular ao HCV, reconhecendo os antígenos virais em associação com moléculas
HLA classe I na superfície dos hepatócitos e eliminando o vírus do fígado (GUIDOTTI;
CHISARI, 2001). Essa eliminação ocorre por meio de dois mecanismos principais: um
citolítico, no qual o LTC induz apoptose do hepatócito infectado, e um não citolítico,
mediado por citocinas como IFê γe TêF α, no qual a supressão da replicação viral se dá
pela inibição da síntese protéica no hepatócito (GUIDOTTI; CHISARI, 2001). A
imunidade humoral, apesar de ter potencial para atuar no controle inicial da infecção pelo
HCV, tem pouca efetividade na erradicação do vírus, provavelmente pela emergência de
cepas virais resistentes à neutralização pelos anticorpos (SHIMIZU &, 1994).
A qualidade da resposta do tipo Th1 parece ser o principal determinante da
evolução da infecção aguda pelo HCV. Pacientes com infecção resolvida têm ampla
resposta Th1, multiespecífica, vigorosa e sustentada, enquanto a ativação da resposta Th2
parece favorecer a cronificação da infecção (CRAMP &, 2000; DAY &, 2002; THIMME &, 2001; TSAI &, 1997). Embora importante para a resolução da infecção durante a fase aguda e para o controle da infecção em sua fase crônica, a presença de
citocinas Th1 (IL 2, IFê γ, TêF α) e a ação dos linfócitos T citotóxicos parecem estar
relacionadas à inflamação, necrose e fibrose cicatricial hepática (BAêêER &, 1997; FAê &, 1998; HIROISHI &, 1997; LEROY &, 2003; êAPOLI &, 1996).
Técnicas de imuno histoquímica mostram que 1 a 10% dos hepatócitos estão
infectados em algum momento (HIRAMATSU &, 1992; êOURI ARIA &, 1995), mas a ação dos linfócitos T citotóxicos, por meio de FasL, TêF α e perforina, pode levar à
morte também células hepáticas não infectadas, ampliando o potencial de dano
hepatocelular (AêDO &, 1997). As citocinas Th2 inibem os efeitos deletérios da resposta citotóxica e podem ter papel de proteção ao hospedeiro contra as conseqüências
deletérias das células Th1 (JACOBSOê BROWê; êEUMAê, 2001). Desta forma, a
resposta Th2 atuaria de maneira a proteger o fígado, reduzindo o dano hepatocelular,
embora diminuiria também a chance de eliminação do vírus, resultando em cronificação na
2.3 Citocinas e fibrogênese
A fibrogênese hepática é desencadeada principalmente a partir da ativação das
células hepáticas estreladas que se convertem de células peri sinusoidais quiescentes, ricas
em vitamina A para células proliferativas, contráteis e fibrogênicas (IREDALE, 2003). As
células estreladas ativadas secretam maiores quantidades de substâncias que compõem a
matriz extracelular, como colágeno (I, III, IV, VI, XIV, XVIII), proteoglicanos, proteínas
acídicas secretadas ricas em cisteína (SPARC) e glicoproteínas (fibronectina, laminina)
(FRIEDMAê, 1999). Essas substâncias se acumulam no interstício e, com o passar do
tempo, podem subverter a arquitetura lobular e prejudicar a função hepática. Além do
aumento da quantidade, há alteração também na qualidade do colágeno secretado pelas
células estreladas, que passam de colágeno IV e VI (não formadores de fibrila) para I e III
(formadores de fibrila), que contribuem para uma ativação ainda maior das células
estreladas (FRIEDMAê, 1999).
O fator de crescimento e transformação beta (TGF β) parece ser a mais potente
citocina fibrogênica (BLOBE; SCHIEMAêê, 2000; GUTIERREZ RUIZ; GOMEZ
QUIROZ, 2007). Ele é secretado principalmente pela própria célula estrelada (efeito
autócrino), mas é também produzido por macrófagos hepáticos (células de Kupffer)
ativados (FRIEDMAê, 1999). As células de Kupffer têm participação fundamental no
desencadeamento da fibrogênese e seu acúmulo no fígado precede a ativação das células
estreladas (FRIEDMAê, 1999). As células endoteliais, plaquetas e os próprios hepatócitos
também reagem à agressão hepática, secretando, além do TGF β, substâncias como
fibronectina, fator de crescimento derivado de plaquetas (PDGF) e peróxidos lipídicos que
também estimulam a ativação das células estreladas (FRIEDMAê, 1999).
A degradação da matriz extracelular é regulada por metaloproteinases (MMP),
por enzimas que ativam MMP latentes (plasmina, estromelisina e MMP tipo membrana) e
por inibidores específicos tissulares das MMP (TIMP) (FRIEDMAê, 1999;
GUTIERREZ RUIZ; GOMEZ QUIROZ, 2007). As células estreladas e as células de
Kupffer, principais envolvidas no processo de fibrogênese, contribuem para a degradação
2.4 Marcadores inflamatórios solúveis de alterações histológicas hepáticas
O dano hepatocelular na hepatite C crônica resulta principalmente da resposta
imunocelular Th1 (êAPOLI &, 1996; SOBUE &, 2001), que é também o principal fator de progressão da fibrose hepática (GHAêY &, 2003). A resposta Th1 está muito ativada em pacientes com infecção crônica pelo HCV e os LTC, na tentativa de clarear a
infecção, acabam desempenhando importante papel na destruição hepatocitária (CHAêG;
REHERMAêê; CHISARI, 1997; WEJSTAL, 1995). A avaliação da intensidade da
ativação imune a partir da dosagem periférica de marcadores inflamatórios solúveis pode,
portanto, auxiliar na predição de dano hepático.
2.4.1 Quimiocinas e doença hepática
As quimiocinas constituem um subgrupo de pequenas citocinas envolvidas na
quimiotaxia leucocitária e importantes na regulação do equilíbrio das respostas Th1/Th2
(BAGGIOLIêI; DEWALD; MOSER, 1997; CHARO; RAêSOHOFF, 2006; GERARD;
ROLLIêS, 2001; KUêKEL, 1999; LUSTER, 1998; MACKAY, 1997; OêO &, 2003). A partir de um processo denominado haptotaxia, os leucócitos se movem em direção a
concentrações mais altas de quimiocinas e migram para locais de infecção ou são
direcionados aos linfonodos. Além da quimioatração, as quimiocinas também estão
envolvidas na ativação leucocitária, diferenciação linfocitária, angiogênese e fibrogênese
(BAGGIOLIêI; DEWALD; MOSER, 1997; CHARO; RAêSOHOFF, 2006; GERARD;
ROLLIêS, 2001; KUêKEL, 1999; LUSTER, 1998; MACKAY, 1997; OêO &, 2003). Mais de 50 quimiocinas já foram identificadas e agrupadas em quatro
subfamílias de acordo a posição dos pares de resíduos de cisteína em sua estrutura (ROT;
VOê AêDRIAê, 2004). As duas subfamílias mais importantes são a CC, a maior delas,
na qual os primeiros dois resíduos de cisteína (C) são adjacentes; e a CXC, que possuiu
esses resíduos de cisteína separados por um aminoácido (X). As quimiocinas são
denominadas de acordo com a subfamília, seguidas da letra L (ligante) e de um número
corresponde ao gene que a codifica (ex: CCL5 ou CXCL10). A nomenclatura dos
receptores de quimiocinas segue a mesma regra, com a substituição da letra L pela letra R
específicos para quimiocinas de determinadas subfamílias, cada receptor geralmente se liga
a mais de uma quimiocina.
Em processos inflamatórios crônicos, as quimiocinas CC são importantes para a
atração de monócitos para os locais de inflamação, enquanto as da subfamília CXC
parecem ser mais importantes na atração de linfócitos T ativados (CHARO;
RAêSOHOFF, 2006; LUSTER, 1998; ROLLIêS, 1997). Como a resposta Th1 está
particularmente envolvida no dano hepatocelular de pacientes com hepatite C crônica,
existe especial interesse nas quimiocinas que se ligam aos receptores CCR5 e CXCR3,
expressos em células inflamatórias relacionadas a esse tipo de resposta (BOêECCHI &, 1998; QIê &, 1998). Entre essas quimiocinas, destacam se a CCL2 (
1, MCP 1), CCL3 ( 1 alpha, MIP 1
alpha), CCL4 ( 1 beta, MIP 1beta), CCL5 (
! " # , RAêTES), CXCL9 (
, MIG) e CXCL10 ( , IP 10).
êo fígado, as quimiocinas são produzidas principalmente por monócitos
ativados, células de Kupffer, células endoteliais e hepatócitos (APOLIêARIO; GARCIA
MOêZOê, 2003; KOZIEL, 1999). Em consonância com a predominância de uma resposta
imune Th1, as células endoteliais dos tratos portais de pacientes infectados pelo HCV
secretam CCL3, CCL4 e CCL5, enquanto os linfócitos que os infiltram expressam
intensamente o receptor CCR5 (SHIELDS &, 1999). As quimiocinas CXCL9 e CXCL10 são expressas principalmente pelos hepatócitos e associam se com a infiltração
intra hepática de linfócitos que apresentam receptor CXCR3 (ZEREMSKI ., 2008).
A expressão desses receptores de quimiocinas em linfócitos T intra hepáticos
parece associar se à lesão hepatocelular. Larrubia . (2007) mostraram que a maioria
dos LTC infiltrando o fígado apresentava fenótipo com elevada expressão de CCR5 e
CXCR3 e que esta expressão associou se à atividade inflamatória hepática periportal e
lobular. Reforçando a importância do CCR5 na patogênese da doença, pacientes com
hepatite C crônica evidenciando mutações que resultam em um CCR5 menos funcional
têm menos inflamação hepática (GOULDIêG &, 2005; HELLIER &, 2003).
Embora relevante para a compreensão dos mecanismos de inflamação hepática
na hepatite C crônica, a avaliação da expressão intra hepática de quimiocinas e/ou de
receptores linfocitários é tecnicamente difícil e não pode ser amplamente utilizada. Por
outro lado, os níveis de quimiocinas podem ser medidos com mais facilidade no soro ou
Os níveis de quimiocinas periféricas geralmente refletem um excedente da
produção nos locais de inflamação e são interpretados como marcadores indiretos da
atividade inflamatória local (BUTERA &, 2005). O papel das quimiocinas na circulação periférica ainda não está estabelecido. Embora possam representar apenas
subprodutos não funcionais, alguns autores têm especulado que essas quimiocinas séricas
ou plasmáticas poderiam antagonizar a migração leucocitária, regulando negativamente os
receptores na membrana dos leucócitos (LARRUBIA &, 2007) e/ou interferindo no gradiente de sinalização responsável pela quimiotaxia dos leucócitos periféricos (CLARK
LEWIS &, 2003; HECHTMAê &, 1991).
Apesar do papel incerto das quimiocinas circulantes e embora elas possam
refletir também produção extra hepática (BUTERA &, 2005), a utilização dos níveis periféricos desse subgrupo de citocinas como marcadores de dano hepatocelular em
pacientes com hepatite C crônica vem sendo amplamente estudada.
A associação entre níveis de CXCL10 circulante e infecção pelo HCV foi
inicialmente demonstrada em 1997 (êARUMI &, 1997) em um estudo que ressaltou aumento dos níveis séricos dessa quimiocina em portadores crônicos do HCV comparados
aos encontrados em voluntários sadios. Estudos adicionais revelaram que, além de estarem
elevados (BUTERA &, 2005), os níveis de CXCL10 periféricos (tanto séricos quanto plasmáticos) estiveram associados de forma dose resposta a inflamação e fibrose hepáticas
(APOLIêARIO &, 2004; HARVEY &, 2003). êo fígado infectado pelo HCV, a CXCL10 é produzida por células linfóides, hepatócitos e células endoteliais sinusoidais em
reposta ao interferon γ, TêF α e às proteínas do HCV como a êS5A e proteína core
(APOLIêARIO &, 2005; êARUMI &, 1997; êARUMI &, 2000; ZEREMSKI
&, 2008). Além de atrair monócitos e células T, a CXCL 10 influencia também na fibrogênese. As células estelares hepáticas (HSC), protagonistas do processo de
fibrogênese hepática (IREDALE, 2003), expressam CXCR3 e migram seguindo um
gradiente de CXCL10 (BOêACCHI &, 2001).
A expressão intra hepática de CXCL9, uma quimiocina que se liga ao mesmo
receptor da CXCL10 e que tem funções semelhantes, está também aumentada em pacientes
com hepatite C e correlaciona se com inflamação e fibrose hepática (APOLIêARIO &, 2002; SHIELDS &, 1999; ZEREMSKI &, 2008). êíveis periféricos de CXCL9 também estiveram significativamente elevados entre pacientes com hepatite C crônica se
êíveis periféricos de outras quimiocinas da subfamília CXC, como CXCL8
(interleukin 8, IL 8) e CXCL11 (interferon gamma inducible protein 9, IP 9), também
estão aumentados em pacientes com hepatite C (APOLIêARIO &, 2002; BUTERA
&, 2005). A expressão de CXCL8 é estimulada pela presença intracelular de proteínas virais não estruturais (e.g. êS5A) (WERTHEIMER &, 2007) e, além de atuar como quimiocina pró inflamatória, exerce efeito pró viral a partir da inibição da atividade
antiviral do interferon (KHABAR &, 1997; POLYAK &, 2001a; 2001b). Alguns autores demonstraram que os níveis séricos de CXCL8 aumentam significativamente em
pacientes com atividade histológica mais intensa e estão ainda mais elevados naqueles
apresentando cirrose hepática (KAPLAêSKI &, 1997; êEUMAê &, 2007). Mais recentemente, Tachibana & (2007) também salientaram a correlação entre níveis desta quimiocina e progressão da doença hepática, enfocando o aparecimento de carcinoma
hepatocelular. Esses autores foram capazes de demonstrar significativo aumento dos níveis
séricos de CXCL8 entre pacientes com carcinoma hepatocelular, especialmente entre
aqueles com metástases à distância, sugerindo que a expressão dessa quimiocina estaria
aumentada a partir da transformação maligna dos hepatócitos (TACHIBAêA &, 2007). Em relação a quimiocinas da subfamília CC, a expressão intra hepática de
CCL5 está aumentada, especialmente nas áreas periportais, e associa se significativamente
ao grau de inflamação hepática e aos níveis de aminotransferases (APOLIêARIO &, 2002; KUSAêO &, 2000; êISCHALKE &, 2004; SHIELDS &, 1999). êíveis séricos de CCL5 foram também associados ao índice de atividade histológica (HAI) em
pacientes com hepatite C crônica (êEUMAê &, 2007). A importância dos níveis intra hepáticos de CCL21 (BOêACCHI &, 2003) e séricos de CCL20 (YAMAUCHI &, 2002) na inflamação hepática e na modulação de fibrose em pacientes com hepatite C
crônica já foi também demonstrada.
2.4.2 Fator de necrose tumoral, seus receptores solúveis e dano hepatocelular
O fator de necrose tumoral alfa (TêF α) é uma citocina pró inflamatória com
importante papel nas respostas aguda e crônica às infecções virais, bacterianas, fúngicas e
parasitárias (BRADLEY, 2008). O TêF α é produzido principalmente por macrófagos
mas o estímulo exato para sua produção aumentada na infecção pelo HCV ainda não foi
claramente definido (RADKOWSKI &, 2004).
A bioatividade do TêF α é desencadeada por sua ligação a receptores celulares
específicos (TêF R), TêF R1 (p55) e TêF R2 (p75) (BRADLEY, 2008), que diferem
em peso molecular, localização e função (GEHR &, 1992; WARE &, 1991). Enquanto o TêFR1 se distribui amplamente nas células do corpo, o TêFR2 restringe se a
células de origem hematopoiética. O TêFR1 faz a mediação da maioria das repostas
celulares induzidas pelo TêF α, incluindo ativação da transcrição de fatores como o êF
κB e apoptose (KALLIêOWSKI &, 1998; LIU; HAê, 2001).
Esses receptores de membrana podem sofrer clivagem proteolítica e se tornar
receptores solúveis que se ligam ao TêF α circulante e inibem sua atividade
(EêGELMAêê; êOVICK; WALLACH, 1990; êOPHAR &, 1990; OLSSOê &, 1989; SECKIêGER; ISAAZ; DAYER, 1989; WAêG &, 2003). Essa inibição é o resultado da competição entre receptores de membrana e receptores solúveis pela ligação
ao TêF α e tem importante papel regulador da bioatividade do TêF α (ADERKA, 1996).
Receptores solúveis de TêF (sTêFR1 e sTêFR2) são liberados por neutrófilos e células T
ativadas, células mononucleares e fibroblastos (PORTEU; êATHAê, 1990; PORTEU
&, 1991; PORTEU; HIEBLOT, 1994;) em resposta a diferentes substâncias como produtos virais ou bacterianos e diversas citocinas (IL 1β, IL 2, IL 6), incluindo o próprio TêF α (JOYCE &, 1994; LAêTZ &, 1990; LIEê &, 1995; PORTEU; êATHAê, 1990).
O TêF α está envolvido na patogênese de diversas condições hepáticas,
incluindo as hepatites virais (KALLIêOWSKI &, 1998; YOSHIOKA &, 1989). Em pacientes com hepatite C, o TêF α é um indutor de apoptose em hepatócitos infectados
(KOUêTOURAS; ZAVOS; CHATZOPOULOS, 2003) e pode também ser responsável
pelo dano causado pelos LTCs aos hepatócitos circunvizinhos não infectados
(KAPLAêSKI &, 1997).
Os níveis séricos de TêF α correlacionam se bem com seu padrão imuno
histoquímico hepático, sugerindo que os níveis periféricos dessa citocina possam ser
usados como marcadores indiretos da sua expressão local, em pacientes com hepatite C
crônica (êEUMAê &, 2007). êíveis séricos de TêF α estão significativamente mais elevados entre pacientes com hepatite C crônica, se comparados a voluntários sadios
(TILG; VOGEL; DIêARELLO, 1995). Mesmo pacientes com inflamação hepática leve
apresentam níveis elevados de TêF séricos, sugerindo que essa citocina pode ser utilizada
como marcador sensível de inflamação hepática (êEUMAê &, 2002c). êíveis séricos elevados de TêF α também estiveram associados à esteatose hepática, possivelmente
devido à sua correlação inversa com níveis de adiponectina, um importante regulador do
conteúdo lipídico hepático (DURAêTE MAêGOêI &, 2006).
êíveis circulantes de sTêFR parecem refletir ativação do sistema TêF (DIEZ
RUIZ &, 1995), embora não esteja claro se esses receptores solúveis provêm do fígado e/ou de células mononucleares periféricas (KALLIêOWSKI &, 1998). Como o sTêFR tem mais estabilidade e maior meia vida que o TêF circulante, tem sido considerado
melhor marcador de atividade inflamatória (VAê ZEE &, 1992).
Assim como em relação ao TêF, os níveis séricos dos receptores solúveis dessa
citocina (sTêFR1 e sTêFR2) também se associaram de maneira significativa aos níveis de
aminotransferases e ao grau de inflamação e fibrose hepática em diversos estudos
envolvendo pacientes com hepatite C crônica (ITOH &, 1999; KAKUMU &, 1997; KALLIêOWSKI &, 1998; ZYLBERBERG &, 1999).
2.5 Tratamento na hepatite C crônica
O tratamento atual dos pacientes com hepatite C crônica é baseado na
combinação de interferon α (IFê α), em sua forma convencional ou peguilada, e ribavirina
(RBV), por 24 a 48 semanas, dependendo do genótipo viral (BRASIL, 2007; DE ARAUJO
&, 2007; STRADER &, 2004).
O IFê α exógeno age de maneira similar ao endógeno por meio da indução de
genes estimulados pelo interferon (ISGs), que estabelecem um estado antiviral no interior
das células (FELD; HOOFêAGLE, 2005; TILG, 1997). Além dessa atividade antiviral, o
IFê α fortalece tanto a resposta imune inata quanto a adquirida de interações com
linfócitos T, células êK e células dendríticas (TILG, 1997).
A ribavirina é um análogo de guanosina que parece atuar como um agente
antiviral principalmente por meio da indução de mutagênese do HCV, resultando em baixa
aptidão replicativa (FELD; HOOFêAGLE, 2005). A ribavirina parece atuar também como
imunomoduladora, alterando o balanço Th1/Th2 em favor de uma resposta Th1 (TAM
Resposta virológica sustentada (RVS), ou seja, HCV RêA sérico indetectável
24 semanas após o término do tratamento, é observada em quase a metade dos pacientes
tratados. Fatores como idade, genótipo, carga viral e índice de massa corpórea interferem
na taxa de resposta (FRIED &, 2002; MAêêS &, 2001). O desfecho do tratamento da hepatite C parece ser influenciado também pela capacidade da resposta imunocelular de
controlar a replicação viral. Uma resposta Th1 precoce parece ser importante para o
clareamento viral durante a hepatite C aguda (GUIDOTTI; CHISARI, 2001; KAMAL
&, 2004; REHERMAêê; êASCIMBEêI, 2005) e um resposta de células T HCV específicas também está associada à resposta terapêutica entre pacientes cronicamente
infectados (CRAMP &, 2000; KAMAL &, 2002; 2004; êELSOê &, 1998).
2.5.1 Associação entre níveis de quimiocinas e resposta ao tratamento da hepatite C crônica
A atividade intra hepática dos linfócitos T citotóxicos é fundamental na
resposta terapêutica de pacientes com hepatite C crônica (êELSOê &, 1998) e, desta forma, as quimiocinas envolvidas na atração dessas células para o fígado podem
desempenhar importante papel na erradicação do HCV.
Como já mencionado, as quimiocinas CCL3, CCL4 e CCL5, mediante sua
interação com o receptor CCR5 presente nos leucócitos, são importantes na resposta imune
ao HCV. Uma expressão reduzida de CCR5 reduz a resposta de citocinas Th1 em pacientes
com hepatite C crônica (LECHêER &, 2000; WOITAS &, 1997) e pode, portanto, prejudicar a resposta terapêutica. A expressão de CCR5 é positivamente regulada pelo
interferon (YAêG &, 2001) e inibida pela proteína viral de envelope E2 (êATTERMAêê &, 2004).
Para compreender melhor o papel do CCR5 no tratamento de pacientes com
hepatite C crônica, alguns estudos foram conduzidos com indivíduos apresentando
mutações que impedem a expressão funcional desse receptor. Esses estudos referenciaram
que a mutação CCR5 Delta 32 esteve associada à menor resposta à monoterapia com IFê
(AHLEêSTIEL &, 2003), embora essa diferença não tenha sido observada quando o interferon foi utilizado em combinação com a ribavirina (GLAS &, 2003).
As células Th1 efetoras também expressam o receptor CXCR3 (VOê
está associado a melhores taxas de resposta virológica sustentada (LARRUBIA &, 2007). Esta última pesquisa também demonstrou que todos os pacientes que falharam em
aumentar os níveis de LTC com elevada expressão de CXCR3 depois de 24 semanas de
tratamento também falharam em obter resposta virológica sustentada (LARRUBIA &, 2007).
A quimiocina CXCL10, um ligante do CXCR3, está associada à resposta
terapêutica de pacientes com hepatite C crônica. êíveis periféricos pré tratamento de
CXCL10 estiveram inversamente associados à resposta à terapia tanto com interferon em
monoterapia (BUTERA &, 2005) como em combinação com a ribavirina (APOLIêARIO &, 2004; DIAGO &, 2006). A associação entre os níveis periféricos de CXCL10 e desfecho terapêutico foi demonstrada tanto para interferon convencional
(êARUMI &, 1997) quanto para o peguilado (APOLIêARIO &, 2004; BUTERA
&, 2005; LAGGIêG &, 2006; ROMERO &, 2006), com níveis mais elevados encontrando se significativamente associados a piores respostas terapêuticas. Essa
associação foi constatada tanto para resposta virológica rápida quanto para resposta
virológica sustentada (LAGGIêG &, 2006; ROMERO &, 2006). Dois estudos diferentes mostraram que níveis periféricos de CXCL10 superiores a 600 pg/mL
apresentaram valor preditivo negativo para RVS de aproximadamente 80% e que alcançou
100% em pacientes difíceis de serem tratados (e.g. alto índice de massa corpórea e alta
carga viral) (LAGGIêG &, 2006; ROMERO &, 2006).
êíveis séricos de CXCL10 durante o tratamento também foram preditores de
resposta terapêutica. êarumi & (1997) relataram que uma redução dos níveis de CXCL10 precedeu a resposta terapêutica e que aqueles com resposta virológica sustentada
normalizaram completamente seus níveis. Pacientes que não eliminaram o HCV após o
tratamento mantiveram níveis elevados de CXCL10, em comparação aos encontrados em
respondedores virológicos, mesmo que tenham normalizado as aminotransferases, isto é,
que tenham apresentado resposta bioquímica (ITOH &, 2001).
Diferentes teorias têm sido apresentadas para explicar a relação entre níveis
elevados de CXCL10 e baixas taxas de resposta. êíveis elevados de CXCL10 periférico
poderiam prejudicar o gradiente de sinalização tanto de CXCL10 quanto de CCL5
(BUTERA &, 2005) ou poderiam regular negativamente receptores CCR5 em LTC circulantes (LARRUBIA &, 2007). Uma explicação diferente foi proposta por Diago
. (2006), que sugeriram que os níveis elevados de CXCL10 poderiam resultar em
seletiva do HCV, promovendo o aparecimento de maior número de mutantes do HCV
passíveis de escape da resposta imune, que seriam de mais difícil erradicação com a terapia
específica (DIAGO &, 2006).
Outros dois ligantes do CXCR3 CXCL9 e CXCL11 também foram avaliados
como preditores de resposta ao tratamento em pacientes com hepatite C crônica. êíveis
plasmáticos de CXCL9 apresentaram redução significativa em pacientes com RVS, mas os
níveis pré tratamento não se associaram às taxas de resposta (BUTERA &, 2005). Os mesmos autores não referiram associação entre níveis plasmáticos pré tratamento de
CXCL11 e resposta terapêutica nem alterações dos níveis durante o tratamento (BUTERA
&, 2005).
CXCL8, uma quimiocina que se liga aos receptores CXCR1 e CXCR2, está
envolvida na inibição da ação do interferon. Possivelmente devido a essa ação inibitória,
níveis séricos de CXCL8 mais elevados associaram se à falha na resposta à terapia
antiviral em pacientes com hepatite C crônica (MIHM &, 2004; êEUMAê &, 1999; POLYAK &, 2001b).
A cinética das quimiocinas CC durante tratamento de pacientes com hepatite C
crônica também foi investigada. Yamauchi . (2002) descreveram níveis séricos de
CCL20 aumentados duas semanas após o início de monoterapia com interferon entre
respondedores, enquanto os não respondedores não manifestaram mudança significativa
nos níveis séricos dessa quimiocina. Entretanto, os níveis de CCL20 pré tratamento foram
similares comparando respondedores e não respondedores, não sendo úteis como
preditores de resposta terapêutica (YAMAUCHI &, 2002).
O papel do CCL2 e de seu receptor, CCR2, como preditores de resposta
terapêutica entre pacientes com hepatite C ainda não foi bem esclarecido. Um estudo
demonstrou associação entre a cinética dos níveis séricos de CCL2 e taxas de resposta
virológica (PAêASIUK; PROKOPOWICZ; PAêASIUK, 2004), mas outra pesquisa
falhou em verificar qualquer associação da resposta virológica com polimorfismos do gene
CCL2 e CCR2 (MOêTES CAêO &, 2007).
2.5.2 TNFEα, seus receptores solúveis e resposta terapêutica na hepatite C crônica
O TêF α parece não estar diretamente envolvido na eliminação do HCV, pois
sabe se que a síntese de TêF α é suprimida pelo IFê α durante o tratamento (ABU
KHABAR; ARMSTROêG; HO, 1992) e essa supressão parece ser um dos mecanismos
pelo qual a normalização das aminotransferases pode ocorrer durante o tratamento, mesmo
com a persistência da infecção (FABRIS &, 1999).
Em pacientes com hepatite C crônica recebendo terapia combinada com IFê α
e ribavirina, os níveis séricos de TêF α reduziram se significativamente ao final do
tratamento e esse declínio acompanhou aquele observado nos níveis de aminotransferases
(êEUMAê &, 2001). Entre os respondedores, os níveis de TêF α sustentaram se em valores mais baixos durante o acompanhamento pós tratamento, enquanto entre os
recidivantes retornaram àqueles encontrados antes do tratamento. A queda de TêF α foi
mais acentuada ao final do tratamento entre os que receberam terapia combinada se
comparados àqueles que receberam IFê α em monoterapia (êEUMAê &, 2002b). A avaliação dos níveis pré tratamento do TêF α parece ser também útil na
predição de resposta terapêutica. Pacientes com níveis séricos de TêF α pré tratamento
mais baixos (êEUMAê &, 1999) ou menores níveis pré tratamento de expressão do TêF α em células mononucleares periféricas (PBMC) (LARREA &, 1996) apresentaram melhores taxas de resposta ao tratamento com IFê α. Um estudo conduzido
por Zein &(2005) usando etanercept, um antagonista TêF α, nas primeiras 24 semanas de tratamento com IFê α e ribavirina, resultou em taxas de respostas mais altas durante o
tratamento.
Ressalta se que o papel dos níveis de TêF α como preditores ainda precisa ser
mais bem compreendido, já que um outro trabalho não mostrou diferença entre os níveis
pré tratamento de TêF α entre respondedores e não respondedores à monoterapia com
IFê α (KALLIêOWSKI &, 1998).
Em relação aos receptores solúveis de TêF (sTêFR), sua influência na
homeostasia do sistema TêF pode contribuir para a ação antiinflamatória do IFê α. êa
infecção pelo vírus da hepatite B, níveis séricos elevados de sTêFR antes da terapia com
interferon associaram se a sucesso terapêutico (MARIêOS &, 1995). êa hepatite C, o papel do sTêFR não está ainda bem esclarecido. Um aumento dos níveis de sTêFR,
especialmente no sTêFR1, ocorre poucas horas após administração de IFê α (TILG;
VOGEL; DIêARELLO, 1995), mas este aumento parece ser temporário, não sendo
encontrada alterações nos níveis séricos tanto de sTêFR1 quanto de sTêFR2 três meses
indivíduos com resposta sustentada, enquanto os níveis entre os não respondedores
permaneceram inalterados (ITOH &, 1999). Entretanto, os níveis séricos pré tratamento de sTêFR1 ou sTêFR2 não foram capazes de predizer resposta virológica em pacientes
tratados em monoterapia com IFê α (KALLIêOWSKI &, 1998).
Considerando as características do sTêFR, que incluem maior estabilidade na
circulação periférica, pesquisas adicionais são necessárias para melhor compreender o
3 OBJETIVOS
3.1 Objetivos principais
• Analisar a associação dos níveis plasmáticos de quimiocinas e receptores solúveis de fator de necrose tumoral com atividade necro inflamatória e fibrose hepática em
pacientes com infecção crônica pelo vírus da hepatite C.
• Analisar a associação dos níveis plasmáticos pré tratamento de quimiocinas e receptores solúveis de fator de necrose tumoral com resposta virológica ao
tratamento com interferon e ribavirina em pacientes com infecção crônica pelo
vírus da hepatite C.
3.2 Objetivos secundários
• Identificar fatores clínicos, epidemiológicos, bioquímicos e virológicos associados à atividade necro inflamatória e fibrose hepática nos pacientes com infecção
crônica pelo vírus da hepatite C.
• Identificar fatores clínicos, epidemiológicos, bioquímicos e virológicos associados à resposta de pacientes com infecção crônica pelo vírus da hepatite C ao tratamento
com interferon e ribavirina.
• Analisar a cinética dos níveis plasmáticos de quimiocinas e receptores solúveis de fator de necrose tumoral após início do tratamento com interferon e ribavirina e sua
associação com resposta virológica em pacientes com infecção crônica pelo vírus
4 PACIENTES E MÉTODOS
41 Desenho
Trata se de estudo observacional, coorte prospectivo, com coleta de dados
realizada entre junho de 2005 e junho de 2008. A inclusão de pacientes ocorreu de junho
de 2005 a dezembro de 2007, período no qual pacientes consecutivos com infecção crônica
pelo vírus da hepatite C (HCV), atendidos em consultas de acompanhamento no
Ambulatório de Hepatites do Centro de Treinamento e Referência em Doenças Infecciosas
(CTR DIP) Orestes Diniz, foram triados pelos pesquisadores do estudo (FIG. 1). Os
pacientes que preencheram critérios de eligibilidade nessa avaliação de triagem foram
convidados a participar da pesquisa e os que aceitaram, após lerem e assinarem termo de
consentimento livre e esclarecido (APÊêDICE A), tiveram amostras plasmáticas
analisadas em relação à concentração dos seguintes marcadores inflamatório solúveis:
CCL2, CCL3, CCL11, CCL24, CXCL9 e CXCL10, sTêFR1 e sTêFR2. Dados
sociodemográficos e clínicos foram obtidos pela revisão de prontuário e complementados
por entrevista aplicada logo após a consulta clínica.
Realizou se análise transversal da associação entre os níveis plasmáticos dos
marcadores inflamatórios solúveis e o grau de atividade necro inflamatória e de fibrose
presentes em fragmento de biópsia hepática. Procedeu se à análise longitudinal da
associação entre resposta terapêutica e os mesmos marcadores inflamatórios anteriormente
descritos, dosados em amostras plasmáticas coletadas antes do início do tratamento, na 12a
semana de tratamento e ao seu final.
Para constituírem o grupo controle, acompanhantes de pacientes vinculados ao
serviço e estudantes de Medicina que atendiam aos critérios de eligibilidade foram
convidados a participar. Aqueles que aceitaram, após lerem e assinarem termo de
consentimento livre e esclarecido, foram submetidos à coleta de sangue para dosagem
plasmática dos mesmos marcadores inflamatórios analisados nos pacientes com hepatite C