Phanuel Saroni Arwa
Estudo químico e busca de sub stâncias
b ioa tivas de Garcinia brasiliensis
Tese apresentada ao Instituto de Química, Universidade Estadual Paulista, como parte dos requisitos para obtenção do título de Doutor em Química.
Orientadora
Profª. Dra. Dulce Helena Siqueira Silva
AGRADECIMENTOS
Agradecemos sinceramente ao TWAS/CNPq pelo apoio financeiro.
Aos docentes, alunos e funcionários do Departamento de Química Orgânica e do NuBBE.
Aos Profs Drs Maria José S. M. Giannini, Ana Marisa F. Almeida, M Regina B. Cicarelli, M. Claudia M. Young, Luce M. Brandao Torres, pela colaboração na realização dos bioensaios antifúngico, antitripanosoma e anticolinesterásico.
Ao Laboratoire de Biologie Cellulaire du Vieillissement, UR4-UPMC, IFR 83, Université Pierre et Marie Curie-Paris 6, 4 Place Jussieu, 75005 Paris, France, pela realização de bioensaios de inibição de protease de HIV.
À FAPESP e CAPES pelo apoio financeiro aos projetos desenvolvidos no NuBBE e ao PPG-Química/UNESP.
RESUMO
A investigação fitoquímica de espécies vegetais contribui para a conservação e uso sustentável da diversidade vegetal no Estado de São Paulo através de estudos sobre diversidade química e busca de drogas potenciais, que incluem as atividades de bioprospecção e fiazem parte da estratégia de exploração racional de nossa biodiversidade. A planta selecionada para este estudo, Garcinia brasiliensis (família
Clusiaceae), apresentou perfil químico com expressiva ocorrência de benzofenonas, conhecidas por seu potencial antimalárico, antioxidante, antibacteriano e antinflamatório. Os objetivos deste trabalho incluíram o estudo químico/biológico dos caules e folhas de Garcinia brasiliensis, com o isolamento e determinação estrutural de
metabólitos secundários e avaliação de sua bioatividade. Apesar das plantas medicinais serem raramente utilizadas como antioxidantes na medicina popular, suas propriedades terapêuticas podem ser devidas a sua capacidade de sequestrar radicais livres de oxigênio, envolvidos em diversas patologias decorrentes do estresse oxidativo em sistemas biológicos. A ação antioxidante tem sido também apontada como forte indicativo de ação quimiopreventiva, associada à indução de enzimas destoxificantes do organismo como a quinona redutase, que pode evitar eventos iniciais da geração de tumores.
O estudo fitoquímico dos extratos de folhas e galhos de G. brasiliensis resultou no isolamento
ou identificação de diversas substâncias polifenólicas a partir de frações polares: os biflavonoides amentoflavona, podocarpusflavona, fukugetina, além de procianidina e seus trímeros e da benzofenona garcinol através do uso de técnicas cromatográficas e espetrométricas como CLAE-DAD, CLAE-EM, UV, IV e RMN. Os extratos de baixa polaridade foram analisados por CG-EM e mostraram a presença de triterpenos e esteroides, entre os quais estigmasterol,
-amirinona, -amirina, taraxerol e lupeol como constituintes majoritários. O fracionamento
cromatográfico desses extratos foi monitorado por ensaios em cromatografia planar revelada com -caroteno e anisaldeído para detecção de constituintes antioxidantes, além de ensaios para
atividade tripanocida, antifúngica para patógenos humanos e vegetais, antimalárica, cicatrizante, anticolinesterásica e inibitória de protease de HIV. Os extratos apresentaram conteúdos maiores de metabólitos antimicrobianos contra fungos patogênicos humanos e T. cruzi, atribuídos à mistura de compostos polares e não-polares agindo em sinergismo ou
Title: Chemical and biological study of Garcinia brasiliensis
ABSTRACT
The phytochemical investigation of plant species contributes to conservation and sustainable use of São Paulo biodiversity. This project has addressed the phytochemical investigation of stems and leaves of Garcinia brasiliensis, with isolation,
structural determination of secondary metabolites as well as evaluation of bioactivity.
G. brasiliensis is a member of the Clusiaceae family with interesting secondary
metabolites such as benzophenones which have potent antimalarial, antioxidant, antitumoral, antibacterial, antiinflamatory and chemoprevention capacity.
Whereas medicinal plants are not used as antioxidants in popular medicine their therapeutic properties are derived from capacity to scavenge free radicals involved in oxidative stress. The antioxidant activity is indicative of chemoprevention associated with toxic enzymes such as quinone reductase that is associated with inhibition of tumor development. The phytochemical study of extracts from leaves and stems of G. brasiliensis led to the isolation or identification of several polyphenols from polar
fractions: biflavonoids amenthoflavone, podocarpusflavone, fukugetin, in addition to procyanidin and its trimers and the benzophenone garcinol through chromatographic and spectrometric techniques as HPLC-DAD, HPLC MS, UV, IR and NMR. Low polarity extracts were analyzed by GC-FID and evidenced the presence of triterpenes and steroids, including stigmasterol, -amirinone, -amirin, taraxerol and lupeol, as
major compounds. Metabolite target analysis was carried out using thin layer chromatographic tests with -carotene and anisaldehyde as revealing agents aiming
the detection of antioxidant compounds, in addition to inhibitory activity against T. cruzi, human and plant pathogenic fungi, malaria, acetylcholinesterase, and HIV
protease. Best results were obtained for polar and medium polarity fractions and compounds against human pathogenic fungi and T. cruzi, which might be associated
Sumário
Resumo Abstract Sumário
Lista de Figuras Lista de Tabelas
Lista de Abreviaturas e Símbolos Lista de Anexos
1 Introdução p. 21
1.1 Descrição da planta . . . p. 24
1.2 Objetivos gerais . . . . . p. 25
1.3 Objetivos específicos . . . p. 25
2 Materiais e métodos p. 26
2.1 Materiais, equipamento e técnicas . . . p. 26
2.1.1 Materiais . . . p. 26
2.1.2 Equipamento . . . p. 26
2.2 Coleta e identificação do material . . . p. 27
2.3 Procedimento experimental . . . p. 27
2.3.1 Extração líquido-líquido dos galhos . . . . p. 27
2.3.2 Separação por grupo dos compostos bioativos (RE) usando ex-
tração solvente/solvente: partição líquido-líquido do RE . . . . p. 29
2.3.3 Extração por solvente das folhas . . . . p. 30
2.3.4 Separação por grupo dos compostos bioativos (FE) usando ex-
2.3.5 Gradiente exploratório da fração de acetato de etila da Garcinia
brasiliensis . . . . p. 31
2.3.6 Grau de polimerização . . . . p. 32
2.3.7 Cromatografia por exclusão de massa e cromatografia de afini-
dade em gel . . . . p. 33
2.3.8 Análise CLAE-DAD de A0–A57 . . . . p. 33
2.3.9 Espectrometria de massas . . . . p. 34
2.3.10 Análise ESI-MS2 . . . . p. 35
2.3.11 Ensaios com tricloreto férrico . . . . p. 35
2.3.12 Teste de cloreto de alumínio . . . . p. 36
2.3.13 Quantificação da capacidade de absorbância de UV . . . . p. 36
2.3.14 Quantificação do deslocamento hipercrômico . . . p. 36
2.3.15 Ensaio de sequestro do radical DPPH . . . . . . . p. 37
2.3.16 Estequiometria das reações . . . . . . p. 38 8
2.3.17 Quantificação da capacidade antioxidante do DPPH (TOSC) . . p. 38
2.3.18 Quantificação da capacidade antioxidante do DPPH (CTOSC) . p. 39
2.3.19 Cromatografia de camada delgada (CCD) . . . p. 39
2.3.20 O método de Folin-Ciocalteu . . . p. 40
2.3.21 Ensaios de magnésio/ácido clorídrico . . . p. 42
2.3.22 Conteúdo total de flavonoides . . . p. 42
2.3.23 Espectroscopia UV/Visível . . . p. 44
2.3.24 Espectroscopia vibracional no infravermelho . . . p. 44
2.3.25 Determinação da atividade ótica . . . p. 44
2.3.26 Triagem virtual . . . p. 44
2.3.27 Ressonância Magnética Nuclear (RMN) . . . p. 44
2.3.28 Ensaios de cicatrização de feridas . . . p. 45
2.3.30 Inibidores da acetilcolinesterase . . . . . . p. 46
2.3.31 Micopatogênese humana . . . . . . p. 47
2.3.32 Determinação dos componentes antimicrobianos . . . p. 48
2.3.33 Determinação das forças intermoleculares . . . . . p. 48
2.3.34 Atividade tripanocida . . . . . . p. 49
2.3.35 Capacidade antimalárica das amostras . . . . . . . p. 50
2.3.36 Análise de inibição fitopatogênica . . . . . . p. 50
2.3.37 Estudo químico de A17 . . . . . . p. 51
2.3.38 Análise em CG-DIC dos extratos da Garcinia brasiliensis . . . p. 52
2.3.39 Desreplicação . . . . . . . p. 55
2.3.40 Espectroscopia vibracional no infravermelho . . . . . . . p. 55
2.3.41 Identificação da fukugetina, da podocarpusflavona e da amento-
flavona . . . p. 55
2.3.42 Testes de fluorescência com tricloreto de alumínio . . . p. 56
3 Resultados e discussão p. 57
3.1 Consideracoes iniciais . . . p. 57
3.2 Extração dos galhos e folhas de Garcinia brasiliensis. . . p. 58
3.3 Fracionamento cromatográfico dos extratos de galhos e folhas de G.
brasiliensis. . . p. 62
3.4 Teste de cloreto de alumínio . . . p. 63
3.5 Análises cromatográficas por CCD e espectrométricas por UV-Vis. . . . p. 67
3.6 Análise por CLAE-DAD de RE e FEE . . . p. 70
3.8 Análise CLAE-DAD (A0–A57) . . . p. 73
3.9 Análise por ESI-MS de FEE e suas subfrações . . . p. 83
3.10 Análise ESI-MS2 . . . p. 87
3.11 Análise de Ressonância Magnética Nuclear (RMN) . . . p. 89
3.12 Ensaio de clareamento do -caroteno . . . . . . p. 98
3.13 Varredura total de onda das frações REB e FEB . . . p. 100
3.14 Espectroscopia vibracional no infravermelho . . . . . p. 100
3.15 Determinação do conteúdo fenólico total . . . . . . p. 102
3.16 Determinação do conteúdo total de flavonoides . . . p. 103
3.17 Teste de cloreto férrico . . . . . . p. 103
3.18 Ensaios de magnésio/ácido hidroclorídrico . . . . . p. 106
3.19 Teste de fluorescência de tricloreto de alumínio . . . p. 108 3.20 Atividade de eliminação de radicais livres sobre o DPPH . . . p. 109
3.21 Quantificação da capacidade antioxidante . . . . . . p. 116
3.22 Valores CTSAc das amostras relativos ao sequestramento do DPPH . . p. 117
3.23 Estequiometria das reações . . . . . . p. 117
3.24 CE50 total em diferentes frações após o fracionamento . . . p. 120
3.25 Análise de aglomerados hierárquicos . . . . . . p. 122
3.26 Atividade antioxidante baseado no clareamento do DPPH . . . p. 122
3.27 Determinação da rotação ótica . . . . . . p. 123
3.28 Estereoisômeros dos dímeros da procianidin . . . p. 124 3.29 Triagem virtual . . . . . . p. 126
3.30 Derreplicação . . . . . . p. 128
3.32 Identificação das procianidinas na fração FEB . . . p. 130 3.33 Identificação de procianidinas em FEB usando ESI-MS . . . . . . . p. 134
3.34 Identificação da amentoflavona e da podocarpusflavona em REE . . . . p. 135
3.35 Atividade de disrupção dimérica e inibição da protease . . . . . . . p. 136
3.36 Atividade antitripanossoma das frações, subfrações e compostos puros
da G. brasiliensis . . . p. 141
3.37 Ensaios de cicatrização de feridas . . . p. 144
3.38 Determinação da atividade antimalárica usando a -hematina . . . p. 145
3.39 Testes anti-acetilcolinesterase . . . p. 147
3.40 Testes para fungos fitopatogênicos. . . p. 150
3.41 Testes frente a fungos patogênicos humanos . . . p. 152
3.42 Conteúdo antimicrobiano total . . . p. 153
3.43 Análise hierárquica de clusters . . . p. 158
3.44 Análise de componentes principais (PCA) . . . p. 162
3.45 Resistência relativa das cepas fungais testadas contra todas as amostras
testadas . . . p. 168
4 Conclusões . . . .. . . p. 175
5. Anexos . . . p. 179
Lista de Figuras
1.1 Frutos e ramos com folhas de Garcinia brasiliensis. . . . . . p. 24
2.1 Maceração dos galhos de G. brasiliensis após moagem . . . . . . p. 28
2.2 Extração líquido-líquido dos galhos de G. brasiliensis após moagem . . p. 29
2.3 Maceração das folhas de G. brasiliensis após moagem . . . . . . p. 30
2.4 Extração líquido-líquido das folhas de G. brasiliensis após moagem . . p. 31
2.5 Ácido gálico serialmente diluído para determinação de fenólicos totais . p. 40
2.6 Absorbância do ácido gálico a diferentes concentrações . . . . . p. 41
2.7 Quercetina serialmente diluída para determinação total de . p. 42
2.8 Absorbância da quercetina a diferentes concentrações . . . p. 43
2.9 Fracionamento de A17 . . . p. 51
2.10 Cromatograma obtido por CG-DIC SPB 5 da FH, mostrando a se- paração dos triterpenos: colesterol 18,46 min, estigmasterol 21,84 min,
-amirinona 23,71 min e -amirina . . . p. 53
2.11 Cromatograma obtido por CG-DIC SPB 5 da RH, mostrando a se- paração dos triterpenos: colesterol 18,52 min, taraxerol 24 min, -ami- rina 25,59 min e lupeol 25,80 min. Os resultados foram comparados com o banco de dados no laboratório NuBBE, que
fornece os valores relativos ao colesterol como um padrão interno. . p. 54
3.1 Análise da G. brasiliensis . . . p. 57
3.2 Produtos da extração dos galhos . . . p. 58
3.3 Complexo da amentoflavona com alumínio . . . p. 65 3.4 Placas de CCDC C18 mostrando pontos vermelhos-amarelos dos flavo-
3.5 Placa CCDC C18 em fase reversa mostrando a correlação entre ligações interflavonoídicas R f . Na análise co-cromatográfica, A49 e A57 apresentaram pontos marrons/amarelos, sugerindo valores de R f intimamente relacionados.
. . . p. 68
3.6 Placa C18 em fase reversa mostrando a podocarpusflavona (X) e o trí-
mero (Y). . . . p. 69
3.7 Cromatograma da fração etanólica (RE) mostrando conteúdos ativos na
região do UV . . . p. 71
3.8 Cromatograma de FEE mostrando os conteúdos ativos na região do UV p. 72
3.9 Espectro UV/Vis dos principais picos típicos dos polifenóis . . . p. 72
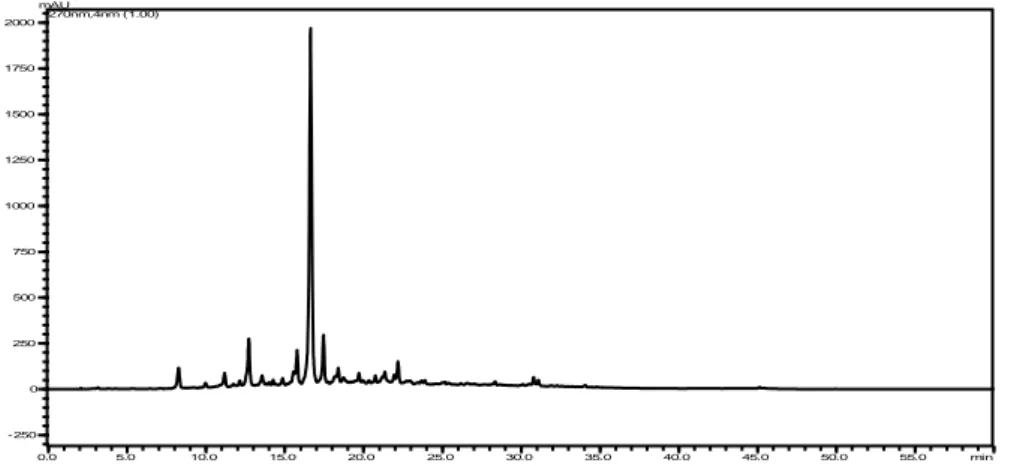
3.10 Cromatograma de A0, 5 mg ml−1, cromatógrafo CLAE-DAD Shimadzu LabSolutions com injeção automática de MeOH/H2O 5:95, eluição gradiente com vazão de 1 ml min−1 durante 60 min, coluna Phenomenex 250 mm × 4,6 mm
× 0,5 μm . . . p. 74
3.11 Cromatograma de A9, 5 mg ml−1, cromatógrafo CLAE-DAD Shimadzu LabSolutions com injeção automática de MeOH/H2O 5:95, eluição gradiente com vazão de 1 ml min−1 durante 60 min, coluna Phenomenex 250 mm × 4,6 mm × 0,5 μm . . . . . . p. 75
3.12 Análise de A17, 5 mg ml−1, cromatógrafo CLAE-DAD Shimadzu LabSo- lutions com injeção automática de MeOH/H2O 5:95, eluição gradiente com vazão de 1 ml min−1 durante 60 min, coluna Phenomenex 250 mm × 4,6 mm × 0,5 μm . . . p. 75
3.13 E s p e c t r o d e U V d a s u b s t a n c i a a s s o c i a d a a o p i c o e m T r
1 7 . 0 m i n d a f r a ç ã o A 1 7 . . . . . . p. 75
3.15 Análise de A33, 5 mg ml−1, cromatógrafo CLAE-DAD Shimadzu LabSo- lutions com injeção automática de MeOH/H2O 5:95, eluição gradiente com vazão de 1 ml min−1 durante 60 min, coluna Phenomenex 250 mm × 4,6 mm × 0,5 μm . . . p. 76
3.16 Análise de A41, 5 mg ml−1, cromatógrafo CLAE-DAD Shimadzu LabSo- lutions com injeção automática de MeOH/H2O 5:95, eluição gradiente com vazão de 1 ml min−1 durante 60 min, coluna Phenomenex 250 mm × 4,6 mm × 0,5 μm . . . p. 77
3.17 Análise de A49, 5 mg ml−1, cromatógrafo CLAE-DAD Shimadzu LabSo- lutions com injeção automática de MeOH/H2O 5:95, eluição gradiente com vazão de 1 ml min−1 durante 60 min, coluna Phenomenex 250 mm × 4,6 mm × 0,5 μm . . . p. 77
3.18 Trímeros da procianidina tipo A e a podocarpusflavona . . . p. 79
3.19 Análise de A57, 5 mg ml−1, cromatógrafo CLAE-DAD Shimadzu LabSo- lutions com injeção automática de MeOH/H2O 5:95, eluição gradiente com vazão de 1 ml min−1 durante 60 min, coluna Phenomenex 250 mm × 4,6 mm × 0,5 μm . . . p. 79
3.20 Espectro UV/Vis do pico majoritário em de A57. . . . .. . . . p 79
3.21 Cromatograma de A17C em CLAE/DAD, em coluna C18. . . p. 81
3.22 Espectros UV/Vis dos picos majoritários de A17 obtidos
por CLAE/DAD . . . . . . . p. 81 3.23 Cromatograma CLAE-UV das amostras A17, A17A, A17B e A17C, com
coluna Phenomenex Gemini 250 mm × 4,6 mm × 0,5 μm e sistema iso-
crático MeOH/H2O (1:1 v/v) . . . p. 82 3.24 Interconversão não-enzimática proposta para os dímeros da procianidina p. 82
3.25 Espectro ESI-MS da FEE mostrando os valores para m/z dos po-
lifenois . . . p. 83
3.26 Espectro ESI-MS da A0 . . . p. 83
3.27 Espectro ESI-MS da A9 . . . p. 84
3.29 Espectro ESI-MS da A33 mostrando o garcinol, a fukugisida e os
trímeros tipo B . . . p. 85
3.30 Espectro ESI-MS da A41 mostrando a fukugetina e os trímeros
tipo B . . . p. 85
3.31 Espectro ESI-MS da A49 mostrando a podocarpusflavona e tríme-
ros tipo A . . . p. 85
3.32 Espectro ESI-MS da A57 mostrando a amentoflavona . . . p. 86
3.33 Cromatograma ESI-MS/MS2 da A17 mostrando picos correspondentes a frag- mentos nos dímeros tipo A . . . p. 87
3.34 Padrão de fragmentação ESI-MS2 proposto para as procianidinas . . . p. 88
3.35 Correlações HMBC nos dímeros do tipo A 4-8 e nos dímeros A 4-6 . . . p. 90
3.36 Espectros RMN 13C de A17 . . . p. 91
3.37 Garcinol (1), procianidinas (2), fukugetina (3), amentoflavona (4) e po-
docarpusflavona (5) . . . p. 95
3.38 Fukugetina (6), amentoflavona (7), podocarpusflavona (8) e garcinol (9) p. 95
3.39 Procianidinas do tipo A (10–17) e B (18–25) . . . p. 96
3.40 -amirina (26), -amirinona (27), estigmasterol (28), -amirina (29), tara-
xerol (30) e lupeol (31) . . . p. 97
3.41 Mecanismo de peroxidação e descoloração do beta caroteno . . . p. 98
3.42 Placa de CCDC mostrando as atividades antioxidantes da FEE, FEB e FEW. O ponto de cor laranja-amarelado, R f = 0, 93, típico de carote-
noides, é indicativo do potencial protetivo de uma amostra no -caroteno p. 99 3.43 Espectro infravermelho das frações FEB, REB, REE e REW. . . p. 101
3.44 Formação dos complexos de ferro com fenóis . . . . . . . p. 104
3.45 Redução do FeCl3 nas amostras . . . . . . . p. 105
3.46 Hidrolise das amostras após 5 min (a) e após 168 horas . . . . .... . . p. 107
3.47 Fluorescência em luz natural e sob luz UV a 254 e 366 nm . . . p. 108
3.49 Capacidade de sequestro de radicais dos padrões rutina e vit. E
e extratos de G brasiliensis. . . p. 112
3.50 Capacidade de eliminação de radicais das subfrações de FEE . . . p. 113
3.51 Valores da integral da área sob a curva . . . p. 116
3.52 Integral de cTOSC das amostras relativas a vitamina E e rutina . . . p. 117
3.53 Histograma mostrando o conteúdo total de compostos antioxidantes nos
extratos e metabólitos isolados da Garcinia brasiliensis . . . p. 120
3.54 Dendrograma obtido por AGH para o conjunto de treinamento. A AGH classifica os compostos nos amplos grupos ativo (Grupo 1) e inativo
(Grupo 2). . . . p. 123
3.55 Placa CCDC C18 UV/Vis mostrando isômeros dos dímeros da procianidinap. 128
3.56 Perfil químico da fração de acetato de etila mostrando (1) a prociani- dina B, (2) a procianidina A, (3) a fukugetina, (4) a amentoflavona e
(5) a podocarpusflavona . . . p. 129
3.57 Cromatograma ESI-MS de REE mostrando m/z = 602 de garcinol . . . p. 130 3.58 Cromatograma CLAE-DAD de FEB mostrando TR 22 min como o prin-
cipal pico . . . p. 131
3.59 Perfil cromatográfico de FEB e REB 5 mg ml−1 gradiente de
MeOH/H2O 5:95, Tempo de execução: 67 min.coluna, em 355 nm. . . . p. 132
3.60 Cromatogramas sobrepostos de FEB e REB. . . p. 133
3.61 Espectros de IV sobrepostos de FEB e REB. . . p. 133
3.62 Espectro ESI-MS2 de FEB mostrando m/z = 577, característico
de procianidinas . . . p. 134
3.63 Cromatogramas obtidos por análise de cromatografia líquida de alta efi-
3.64 Sítios ativos dos dímeros da protease . . . p. 137
3.65 Capacidade de inibição da PR do HIV-1 da podocarpusflavona . . . p. 138
3.66 Capacidade de inibição da PR do HIV-1 da amentoflavona . . . p. 139
3.67 Gráfico de Lineweaver-Burk para a capacidade de inibição da dimeriza-
ção da PR do HIV-1 da podocarpusflavona . . . p. 139
3.68 Gráfico de Lineweaver-Burk para a capacidade de inibição da dimeriza-
ção da PR do HIV-1 da amentoflavona . . . p. 140
3.69 Redução do MTT amarelo ao MTT azul . . . p. 141
3.70 Conteúdo relativo dos compostos em relação à atividade contra o T. cruzi p. 142
3.71 Células no ensaio de cicatrização: (A) 0h, (B) 22h, após a migração celularp. 144
3.72 Comparação da evodimina, podocarpusflavona e amentoflavona . . . . p. 145
3.73 Atividades antimaláricas das subfrações obtidas do etanol (FE). Cada valor é resultado de três medições. A cloroquina e a quinina foram utili-
zadas como controles positivos. . . p. 147
3.74 Mecanismo de inibição do acetilcolinesterase . . . p. 148
3.75 Resultado da atividade anticetilcolinesterásica. Legenda: (1) FEH, (2) FEW, (3) FEB, (4) FEE, (P) fisostigmina 0,05 μg/2,5 μL. . . p. 149
3.76 Ensaios bioautográficos de Cladospora cladosporioides e C.
sphaerosper-mum . . . p. 151
3.77 Dendrograma para Atividade antifúngica . . . . . . p. 159
3.78 Dendrograma para Atividade antioxidante . . . . . p. 160
3.79 Dendrograma para Resistência dos fungos . . . . . . . p. 161
3.80 Dendrograma para Atividade antioxidante e sequestro do DPPH . . .. .. . p. 162
3.81 Contribuição de cada componente . . . p. 163
3.82 PCA das frações . . . p. 164
3.84 Contribuição dos componentes principais . . . p. 165
3.85 Componentes principais responsáveis pelas atividades . . . p. 166
3.86 FE relacionado com outras amostras . . . p. 167
3.87 Sequestro do DPPH relacionado com a resistência do C. albicans . . . . p. 167
3.88 Sequestro do DPPH relacionado com a atividade antifúngica . . . p. 168
3.89 Atividade antifúngica total das frações e compostos puros . . . p. 169
3.90 Resistência do C. albicans com outras . . . p. 170
Lista de Tabelas
2.1 Método de eluição para análise por gradiente CLAE-DAD . . . p. 28
2.2 Método de eluição para análise por gradiente CLAE-DAD . . . p. 32
2.3 Absorbância do ácido gálico em diferentes concentrações . . . p. 41
2.4 Absorbância das amostras a 415 nm para determinação total de flavonoides p. 43
2.5 Conteúdo de FH e RH baseado nos resultados do CG-DIC . . . p. 54
3.1 Pesos dos extratos obtidos pela maceração/sonicação das hastes . . . . p. 59
3.2 Extração líquido-líquido dos extratos etanólicos dos ga-
lhos (RE) de G. brasiliensis . . . p. 59
3.3 Massas dos extratos obtidos pela maceração/sonificação das folhas
moídas de G. brasiliensis . . . . . . . p. 60
3.4 Extração líquido-líquido do extrato etanólico (FE) de folhas
de G. brasiliensis . . . . . . . . p. 61
3.5 Fracionamento cromatográfico de FEE em CC de Sephadex LH20/25–100μ. p. 62
3.6 Ensaios espectrométricos das subfrações de FEE da Sephadex . . . p. 64
3.7 Efeito hipercrômico o b se r v a d o pa r a a s f ra ç õe s d e F E E
a p ó s a d iç ã o d e A l Cl 3 . . . . . . . p. 64
3.8 Efeito do tempo na absorbância de UV e o comprimento de onda . . . p. 65
3.9 Absorbância máxima, tempos de retenção (TR), comprimento de onda
e área dos principais picos . . . p. 67
3.10 Perfil químico da RE com base nas análises de CLAE e UV . . . p. 71
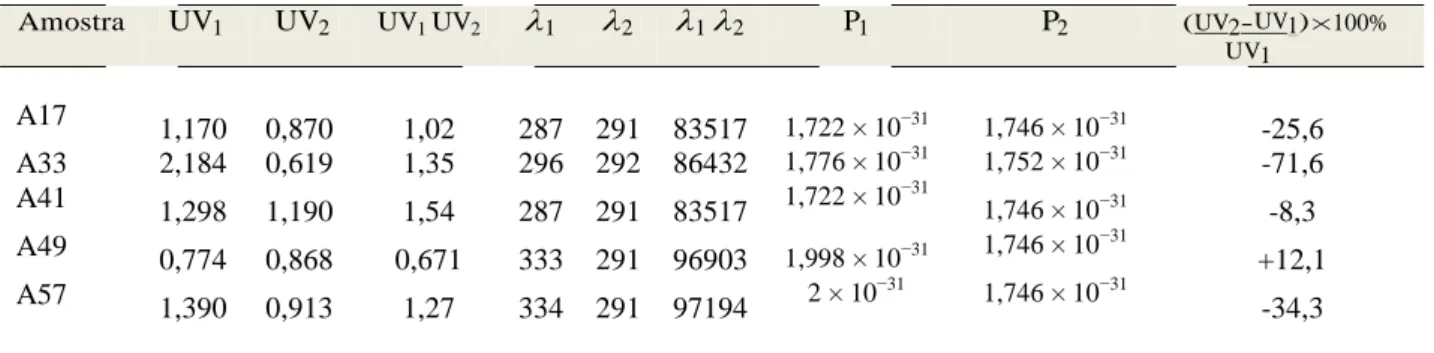
3.12 Comprimentos de onda e máxima absorbância de UV . . . p. 80
3.13 Grau de polimerização das frações de FEE (m/z = 288n + 23 + a) . . . p. 86 3.14 RMN 1H e 13C da procianidina A isolada da Garcinia brasiliensis . . . p. 92
3.15 Sumário dos metabólitos detectados . . . . . . . p. 94 3.16 Grau relativo de inibição: Inibição leve: (+), Inibição alta: (++++) . . p. 99 3.17 Dados de UV para FEB e REB. . . p. 100 3.18 Conteúdo fenólico total a 765 nm . . . p. 102
3.19 Flavonóides totais analisados nos extratos. . . p. 103
3.20 Capacidade de cloreto férrico das frações . . . p. 106
3.21 Valores de absorbância para as subfrações de RE . . . p. 111
3.22 Valores de IC50 das amostras testadas . . . p. 111
3.23 Valores Equivalente Total de Vitamina E (TVE) e CE50 em μg/ml . . . p. 119
3.24 Valores de Equivalente Total de Rutina (TRE) e CE50 das amostras . . p. 119
3.25 CE50 em diferentes frações após o fracionamento . . . p. 121
3.26 Rotação óptica dos polifenois de G. brasiliensis . . . p. 124
3.27 Estereoisomeros de dímeros de procianidinas . . . . .... .p. 125
3.28 Hidrofobicidade das moléculas . . . p. 127
3.29 Cinética da ação de A49 e A57 . . . p. 138
3.30 Capacidade de inibição de dímeros da podocarpusflavona (1) e da amen-
toflavona (2) . . . p. 140
3.31 Valores CE50 das amostras contra o T. cruzi . . . p. 142
3.32 Testes antimaláricos in vitro utilizando a -hematina . . . p. 146
3.33 Atividades antifúngicas (em μg/ml) dos extratos, frações e compostos isolados das folhas e galhos da Garcinia brasiliensis. Cada valor é resul-
tado de três medidas. . . p. 152
3.34 Quantidade relativa de componentes antimicrobianos em diferentes fra-
3.35 Quantidade relativa de componentes antimicrobianos em diferentes fra-
ções contra Candida krussei . . . p. 154
3.36 Quantidade relativa de componentes antimicrobianos em diferentes fra-
ções contra Candida parapsilosis . . . p. 155
3.37 Quantidade relativa de componentes antimicrobianos em diferentes fra-
ções contra Cryptococcus neoformans . . . p. 156
Lista de abreviaturas e símbolos
AAlCl3 – absorbância da solução de cloreto de alumínio
AMeOH- Absorbância em metanol
ARP- potencia redutora de antioxidante CCD- cromatografia em camada delgada
CG- - cromatografia gasosa (Gas Chromatography )
COSY – espectroscopia de correlação (correlation spectroscopy) DAD- Detector de arranjo de diodos
DEPT – distortionless enhancement by polarization transfer DIC- Detector de ionização de chama
ESI-MS- espectrometria de massas com ionização por eletronspray (Electron Spray Ionization mass Spectroscopy)
HAT- transferencia de átomo de hidrogênio (hydrogen atom transfer ) Hcr- deslocamento hipercrômico
HMBC – heteronuclear multiple Bond correlation HMQC – heteronuclear multiple quantum coherence
HPLC, CLAE- -Cromatografia Líquida de Alta Eficiência (High performance liquid Chromatography )
Mid-IR- infra vermelho mediano
PCA – análise do componente principal (Pricipal component analysis) RMN – ressonância magnética nuclear
RR- tempo de retenção relativo
SPE- Extração em fase sólida (solid phase extraction) TR- tempo de retenção
TRE- equivalente de rutina total (Total Rutin equivalent)
Lista de Anexos
Anexo 1a. Espectro de RMN de 1H de FEE ...
Anexo 1b. Espectro de RMN de 13C de FEE ...
Anexo 1c. Espectro de RMN de H do garcinol ...
Anexo 1d. Espectro de RMN de 13C do garcinol ...
Anexo 1d. Espectro de RMN DEPT do garcinol ...
Anexo 1e. Espectro de RMN de 13C da Procianidina-A2 mostrando o sinal
para C2 das ligacoes (C2-O-C7, C2-O-C5 ) em 104.5 ppm ...
Anexo 2. Esquema de fragmentacao proposto para procianidinas ...
Anexo 3. Espectros de UV-VIS de flavonoides e xantonas de FEE ...
Anexo 4. Espectros de UV-VIS de flavonoides e xantonas de FEB ...
Anexo 5. Espectros de UV-VIS de flavonoides e xantonas de RE ...
Anexo 6: Espectros de UV-VIS de flavonoides de FEH ...
Anexo 7. Cromatograma obtido pelo programa Aurora para o extrato RE
mostrando pico de xantonas (200-300nm). ...
Anexo 8 Espectros de IV das fracoes butanólica (REB) e aquosa (REW) dos
ramos de G. brasiliensis ...
Anexo 9. Redução do anion superóxido por procianidina tipo A (S17),
fukugetina (A41), podocarpusflavona (A49) e amentoflavona (A57). Controle positivo (DMSO + células estimuladas). ...
Anexo 10. Inibição da produção de anio superoxido por: fukugetina (41),
podocarpusflavona (49) e amentoflavona (57)...
Anexo 11. Sequestro de anion superoxido por: fukugetina (41),
podocarpusflavona (49) e amentoflavona (57).). ...
Anexo 12. Inibicao da produção das species reativas de oxigenio totais (ROS)
por: fukugetina (41), podocarpusflavona (49) e amentoflavona (57)...
Anexo 13. Efeito da fukugetina (41), podocarpusflavona (49) e amentoflavona
(57) a 10 μmol L-1) sobre a produção de HOCl por neutrofilos. ...
Anexo 14. Efeito da fukugetina (41), podocarpusflavona (49) e amentoflavona
(57) a 50 μmol L-1 sobre eritrócitos humanos ...
Anexo 15. Efeito da fukugetina (41), podocarpusflavona (49) e amentoflavona
(57) sobre a produção de MDA. ...
Anexo 16: mecanismos de tautomerismo ceto-enolico e propriedades opticas do garcinol e seus isomeros ...
Anexo 16 Atividade antioxidante total para serie 1 (TVE) e serie 2 (TRE) ...
Anexo 17: Atividade antioxidante total das amostras: series 1 (TVE) series 2 (TRE)
Anexo 18 Atividade antioxidante total das amostras: series 1 (TVE), series 2 (TRE).
Anexo 19: Atividade antioxidante total das amostras : series 1 (TVE) series 2 (TRE)
Anexo 20 Atividade antioxidante total das amostras series 1 (TVE) series 2 (TRE)
Anexo 21: Atividade antioxidante total das amostras series 1 (TVE) series 2 (TRE)
Anexo 22 Atividade antifúngica total das amostras 1 (massa) series 2 (CA).
series 3(CK) series 4 (CP) series 5 (CN) series 6 (∑) series 7 (media)...
Anexo 23 Atividade antifungica total das amostras series 1 (CA) series
2(CK) series 3 CP series 4 (CN). ...
Anexo 24 Atividade antifungica total das amostras series 1 (CA) series
2(CK) series 3 CP series 4 (CN). ...
Anexo 25 Atividade antifungica total das amostras series 1 (CA) series
2(CK) series 3(CP) series 4 (CN)...
Anexo 26: Atividade antifungica total das amostras series 1 (CA) series
2(CK) series 3(CP) series 4 (CN)...
Anexo 25 Atividade total frente a T. cruzi ...
Anexo 27: Atividade total frente a T. cruzi ...
Anexo 28: Quercetina (1) Taxifolina (2) Podocarpusflavona (3)
Amentoflavona (4): azul β5, vermelho β1 verde β2 ...
Anexo 29: Quercetina (1) Taxifolina (2) Podocarpusflavona (3)
Amentoflavona (4): Blue β5, red β1 green β2 ...
Anexo 30: Quercetin (1) Taxifolina (2) Podocarpusflavona (3)
Amentoflavona (4): Blue β5, red β1 green β2 ...
Anexo 31: Procianidina A (1) Garcinol (2) Fukugetina (3)
Podocarpusflavona (4) Amentoflavona (5): ...
Anexo 32: Procianidina A (1) Garcinol (2) Fukugetina (3)
Podocarpusflavona (4) Amentoflavona (5): ...
Anexo 33 atividade antioxidante dos polifenois ...
Anexo 34 atividade antioxidante dos polifenois ...
Anexo 35 Series 1 T. cruzi Series 2 TER ...
21
1
Introdução
Produtos naturais são substâncias obtidas de organismos como plantas, fungos e algas, dentre outros. Essas substâncias são produzidas como parte do programa normal de crescimento ou como resposta ao estresse e ataque patogênico (ELGORASHI et al., 2003; NEWMAN; CRAGG, 2007). Esses produtos podem ser obtidos semissinteticamente ou sinteticamente e podem ser explorados pela indústria, medicina e por outras áreas. Na indústria, produtos naturais são usados como adesivos, como tintas, além da floculação da argila durante a purificação de água. Na medicina, produtos naturais são usados biologicamente como recursos antioxidantes, antimicrobianos, antivirais, antifúngicos, antiparasitários etc. e biorreguladores. Segundo a Organização Mundial da Saúde, 80% das medicinas tradicionais em países de terceiro mundo é derivada de plantas. As plantas fornecem à humanidade uma fonte regular de agentes medicinais, servindo como fonte de diversos agentes terapêuticos. O contínuo uso etnofarmacológico de plantas acelerou o estudo de atividades antimicrobianas, dos mecanismos de ação e derivativos em potencial. Recentemente, houve um aumento na pesquisa de métodos para isolamento e quantificação de compostos bioativos (LIU; CAO; ZHAO, 2010; ZARENA; SANKAR, 2009) que podem estar associados com atividades antimaláricas, analgésicas, leishmania, antivirais, antibacterianas, antifúngicas e anti-inflamatórias (SANTA-CECÍLIA et al., 2011; ELFITA et al., 2009; PEREIRA et al., 2010), observadas em partes de plantas.
Neste trabalho, as folhas e galhos de G. brasiliensis foram submetidas a
22
coletadas e analisadas para possível exploração como recursos agrícolas, farmacêuticos ou industriais (MCGAW et al., 2008).
A família Clusiaceæ (Guttiferæ) é uma família de arbustos e árvores. Geograficamente, o táxon está distribuído nas regiões tropicais e é constituído de 40 gêneros e 1200 espécies, sendo a Garcinia (Rhedia) a mais abundante, com mais de 400 espécies disseminadas na Ásia tropical, África, Nova Caledônia, Polinésia e América Latina. Garcinia é um táxon pan-tropical parafilético com a característica distintiva de estames fasciculares que são fundidos às pétalas por mais de metade de seu comprimento. O táxon possui diversos traços morfológicos que vão da filotaxia floral aos dutos e glândulas agindo como células secretoras de resina e canais dispersos por toda a planta. O gênero é único na produção de pólen, néctar e resinas que são recompensas aos polinizadores. O gênero tem diversas aplicações medicinais.
Na Indonésia, a G. griffithii é conhecida como kandis gajah e usada em
casos de diarreia e desordens menstruais. Na Tailândia, a G. cowa é popularmente
conhecida como cha muang e usada para melhorar a circulação sanguínea.
Na Tailândia e no Camboja, a G. dulcis é popularmente conhecida como
gourka/maphut/kokum e usada contra a linfadenite e parotidite. Na China,
a G. multiflora, a G. morel la e a G. spicata são fontes de corante vermelho
tradicionalmente usado como anti-ulceroso, emplastro e anti-inflamatório. A espécie é conhecida popularmente como fukujisima (KONOSHIMA; IKESHIRO;
MIYAHARA, 1970) no Japão. Na Índia, a G. indica e a G. cambogia são
conhecidas por vários nomes, como kokum, bindin, biran, bhinda,
katambi, ratamba e usadas como anti-inflamatório. A G. huil lkensis também
é referida como kokum na medicina ayurvédicae suas folhas são usadas na
imunomodulação. Em Gana, as cascas e folhas da G. kola são usadas como
bebida. No Brasil, a G. brasiliensis, conhecida popularmente como bacupari, é
usada como alimento, anti-inflamatório, antianêmico e na cicatrização de feridas (AGRA et al., 2008).
Análises fitoquímicas anteriores revelam que as folhas, hastes, frutas e raízes contém derivados oxigenados e prenilados do fenol, incluindo xantonas e gutiferonas (PANDYE et al., 2009), que são responsáveis por atividades anti-HIV, anti-ulcerosas, anti-inflamatórias, antibacterianas, ansiolíticas, ateroscleróticas, anti-tumor e imunomodulatórias (KOEBERLE; NORTHOFF; WERZ, 2009).
Outros estudos in vivo demonstraram que a planta contém fukugetina e
anti-23
inflamatórias em ratos (SANTA-CECÍLIA et al., 2011). Estudos detalhados sobre a atividade antimicrobiana das gutiferonas e das epiclusianonas isoladas das sementes mostram que esses compostos apresentam atividades citotóxicas, inibição da sintase do óxido nítrico, quimioprevenção do câncer, atividades antifúngicas, catepsinase, atividades antitumorais e inibição de Staphylococcus aureus (NALDONI et al., 2009). A análise dos extratos hexânicos das folhas da Garcinia brasiliensis revelou a presença de xantonas tetra-oxigenadas que
possuem atividade antifúngica, da garciniafenona e da gutiferona (PEREIRA et al., 2010) com atividade anti-aflatoxina. A análise do pericarpo da fruta levou ao isolamento da epiclusianona e da gutiferona, que são antibacterianos (ALMEIDA et al., 2008) e antifúngicos, além da bioatividade contra a Leishmaniose (PEREIRA et al., 2010), a inibição do vírus HIV (MARTINS et al., 2009) e a inibição da protease da Leishmania. A moreloflavona, detectada nos extratos etanólicos das folhas, possui atividade hipocolesterolêmica. Outros relatos indicam que as folhas desta planta contém lupeol e outros triterpenos que têm sido associados com atividades antioxidantes e anti-inflamatórias (MARTINS et al., 2008).
Apesar do crescente uso etnofarmacológico, da análise fitoquímica e atividades biológicas da G. brasiliensis, os dados não são exaustivos. Assim,
selecionou-se a espécie G. brasiliensis análise química e biológica,
considerando a larga ocorrência de metabólitos bioativos em espécies do gênero Garcinia, especialmente polifenóis, bem como o fato de ser uma espécie
comestível e usada na medicina tradicional no Brasil e a importante contribuição da bioprospeccao para o uso sustentável da biodiversidade. Estudos recentes em nosso grupo de pesquisa mostraram a ocorrência de saponinas e flavonoides antifúngicos em Lippia salviaefolia (MARQUI et al.,
2008; FUNARI et al., 2012), flavonóides inibidores de mieloperoxidase em
Pterogyne nitens (FERNANDES et al., 2008; REGASINI et al., 2008), e
flavonoides inibidores de lipoperoxidacao e das enzimas inflamatórias COX-1 e COX-2 em Iryanthera juruensis (SILVA et al., 2007); além de ácido gálico em Alchornea glandulosa e Chrysophyllum inornatum, a partir do qual foram
24
1.1 Descrição da planta
Reino: Plantæ
Divisão: Magnoliophyta
Classe: Magnoliopsida
Ordem: Theales
Família: Clusiaceaæ
Gênero: Garcinia
Espécie: G. brasiliensis
Figura 1.1. Frutos e ramos com folhas de Garcinia brasiliensis. (reproduzido de
www.montosogardens.com/garcinia_brasiliensis;
www.picasaweb.google.com/lh/photo/12WxFW6b6QQChJ1JzOSLig ; e
www.flickr.com/photos/anadec/5831327634/. );
Garcinia brasiliensis Mart. é uma árvore de tamanho médio (9–14 m) que é
pirami dal e tem forma de circular a semicircular. Suas folhas são de tamanho grande a médio. A fruta é de grande a média em tamanho, com um formato de redondo a elipsoide. As flores aparecem isoladas ou em grupo, e têm pedúnculo curto. O estigma é redondo a elipsoide. G. brasiliensis é nativa do
Brasil, Argentina e Paraguai e floresce de agosto a setembro (FONSECA-KRUEL; PEIXOTO, 2004). A planta é originária da floresta Amazônica e mata Atlântica, mas atualmente cresce em três grandes biomas brasileiros: na mata Atlântica, no Cerrado e no Amazonas. A árvore, com suas folhas verdes lustrosas e formato simétrico, é bonita como ornamento. Garcinia brasiliensis é
25
guacomo em espanhol. O bacupari tem frutas amarelas com uma polpa mucilaginosa que é branca e comestível. As frutas são consumidas principalmente frescas e também usadas para fazer sucos e geleias. Na medicina popular, as folhas da G. brasiliensis são usadas para tratar tumores,
inflamação do trato urinário, artrite e para aliviar a dor. O suco da fruta é usado contra a anemia (FIGUEIREDO; LEITÃO-FILHO; BEGOSSI, 1997) e como alimento (FONSECA-KRUEL; PEIXOTO, 2004). A planta é apogâmica, com sementes agamospérmicas que são usadas como emplasto em ferimentos em comunidades tradicionais no Rio de Janeiro, na Amazônia e São Paulo. Seu caule e a casca são infundidos ou macerados e usados como laxante ou contra dermatite. A resina é usada contra doenças de pele e feridas (AGRA et al., 2008). A árvore é semiapomítica, propaga-se por meio de sementes e possui uma baixa taxa de germinação e crescimento.
1.2 Objetivos gerais
Estudar as propriedades biológicas e químicas da Garcinia brasiliensis,
incluindo:
1. Realizar análises fitoquímicas de extratos, frações e compostos puros da
Garcinia brasiliensis usando abordagens de análise de metabólitos alvo,
por meio de técnicas cromatográficas e espectrométricas.
2. Realizar análises bioquímicas, biofísicas e biológicas de extratos, frações e compostos puros para atividades antifúngica, inibição de protease de HIV, antimalárica, antioxidante, anti acetilcolina esterase e atividade contra o T. cruzi.
1.3 Objetivos especí
fi
cos
1. Isolar e caracterizar os metabólicos na Garcinia brasiliensis.
2. Determinar as atividades antimicrobiana, de inibição de protease do HIV, antitripanosoma, antimalárica e antioxidante.
3. Determinar as propriedades sinergísticas dos metabólitos isolados.
2
Materiais e métodos
2.1 Materiais, equipamentos e técnicas
2.1.1 Materiais
A água foi tratada em um sistema de purificação de água Milli-Q (TGI Pure Water Systems, Estados Unidos). Os solventes utilizados foram o metanol de grau CLAE, o ácido acético, o n-hexano, o acetato de etila, o n-butanol (Tedia Brazil Produtos para Laboratórios), e o DMSO (Cambridge Isotope Laboratories, Inglaterra). Para filtração e limpeza das amostras, Cartuchos Chromabond C18 equipados com membrana Chromafil Xtra RC-20/25 0,20 μm ou PVDF 0,22 μm, papel Whatman, Sephadex LH-20/
25–100 μm, XAD-4 e Sílica-gel 0,06–0,200 μm (Sigma Aldrich) foram utilizados. As placas de CCDC utilizadas foram ALLUGRAM C18 150 μm UV254 (Sorbent Technologies, Estados Unidos) e ALLUGRAM SIL G 200μm UV254 (Macherey-Nagel, Alemanha). Os materiais para testes biológicos incluíram as linhagens dos fungos patogênicos humanos
Candida krusei, C. parapsilosis, C. albicans, Cryptococcus neoformans, Cladosporium cladosporioides e C. sphærospermum. Os testes antimaláricos foram realizados
utilizando -hematina, ao passo que testes antioxidantes foram feitos baseados na
absorbância de UV/Vis, sequestro de radical livre DPPH, tricloreto férrico, -caroteno,
tricloreto de alumínio, ensaio de magnésio e HCl e ensaio de Folin-Ciocalteau.
2.1.2 Equipamentos
O evaporador rotativo usado foi BUCHI Rotavapor R114, B140. O SpeedVac utilizado foi o RVT 4104. Também foram utilizados o banho ultrasônico USC 28000 SR 2311919, o equipamentos de CLAE-DAD Varian ProStar, o CLAE-UV (Varian, ternário) e CLAE-DAD (SHIMADZU Lab Solutions). Lâmpada UV SOLAB 254nm– 365nm foi usada. O equipamento GC-DIC utilizado foi Varian CP 3800 (Galaxie Software), o equipamento CG-EM utilizado foi Varian CP 3800 MS Saturn 2000 NIST, e os equipamentos de RMN Varian 300MHz e 500MHz foram usados para determinações espectroscópicas. O espectrofotômetro UV–visível 2100 e leitores de microplaca (Biotek®) foram utilizados na determinação de propriedades espectrofotométricas. O programa CAMAG Reprostar 3 WINCATS foi utilizado para registrar as placas CCDC de 96 poços. Substâncias isoladas foram analisadas utilizando técnicas de RMN 1D e 2D como a Espectroscopia de Correlação (COSY), a Correlação Heteronuclear de Múltiplas Ligações (HMBC), a Espectroscopia de Efeito Nuclear de Overhauser (NOESY), a Espectroscopia Rotativa de Efeito Overhauser (ROESY) e a Espectroscopia de Correlação Total (TOCSY).
2.2 Coleta e identi
fi
cação do material
Folhas e galhos da G. brasiliensis (Mart. Planch. et Triana) (syn Rheedia brasiliensis) foram coletados durante o verão (fevereiro de 2008) no município de Assis
(22°390 4200 Sul e 50°240 4400 Leste), São Paulo, Brasil, por Edivaldo Furlan. Os espécimes foram identificados pela Professora Giselda Durigan da Floresta Estadual de Assis, SP, Brasil. Uma exsicata FEA, nº3548, está depositada no Herbário da Coleção Botânica da Floresta Estadual de Assis, SP, Brasil.
2.3 Procedimento experimental
As folhas da planta foram secas e moídas até fornecerem um pó fino. O material bem moído e seco foi armazenado em envelopes de papel fechados até o uso.
2.3.1 Extração líquido-líquido dos galhos
A amostra de n-hexano foi concentrada e seca usando um evaporador rotativo BUCHI R114 a 200rpm conectado a um sistema de banho-maria BUCHI B480 a 40°C. Subsequentemente, etanol foi adicionado aos resíduos, colocado no banho ultrassônico e extraído três vezes, sempre filtrando com papel de filtro (Whatman Ederol Hatzfeld Eder Germany). O extrato etanólico foi então seco utilizando um evaporador rotativo.
Figura 2.1: Maceração dos galhos de G. brasiliensis após moagem
Perfil químico de RE
O perfil químico do RE foi investigado por análise de gradiente exploratório preliminar CLAE-DAD usando um Varian Prostar equipado com coluna Phenomenex C18 Luna
× 250mm × 4.6mm × 5μm e fluxo a 1mL min−1. A faixa do detector PDA Prostar estava configurada de 200 a 800nm e foram usados um amostrador automático Prostar 410 e injetor automático de 20μL. Os solventes A/B foram de grau analítico, sendo o Solvente
A, água ultra pura Mill-Q Plus 50 acidificada com 0,1% de ácido acético e o Solvente B, metanol de grau CLAE acidificado com 0,1% de ácido acético. O fluxo foi 1mL min−1. O amostrador automático foi configurado para injetar 20μL com 3 lavagens por vez. O sistema de referência foi calibrado usando benzeno e tolueno. A variação da percentagem de metanol solvente (B) variou como segue: 0–35min 5–100%, 35–42min 100%, 42–45min
100–5% e 45–60min.
Tempo (min) MeOH (% v/v) Água (% v/v) Comentário 0–35
35–42 42–45 45–60
5–100 100 100–5
5
95–0 0 0–95
95
Gradiente Isocrático Gradiente Equilíbrio isocrático
2.3.2 Separação por grupo dos compostos bioativos (RE) usando
extração solvente/solvente: partição líquido-líquido do RE
A extração líquido-líquido (ELL) explora as diferentes solubilidades dos conteúdos de uma amostra em fase aquosa e a fase orgânica imiscível para extrair um grupo de compostos em um solvente, deixando o restante da matriz no outro solvente. Portanto, solventes como o hexano ou o ciclohexano são usados para remover contaminantes não polares. O RE (2000 mg) contendo metabólitos polares e apolares (MARTINI; ELOFF, 1998) foi dissolvido em 27 mL de metanol preparado: água (9/1 v/v) à temperatura ambiente de 25°C.
Figura 2.2: Extração líquido-líquido dos galhos de G. brasiliensis após moagem
Após isso, 10 mL de n-hexano foi adicionado e vertido em um funil de separação de 250 mL. A solução foi agitada suavemente, sempre abrindo a tampa para liberar o gás desprendido. A unidade inteira foi, então, fixada a um suporte por 30 minutos para permitir a separação da fração do n-hexano e metanol/água, que foram coletados em frascos separados. A partição com n-hexano foi realizada três vezes, seguida de acetato de etila, durante o qual a razão de metanol/água (v/v) foi alterada para 4:6 e extraído três vezes.
2.3.3 Extração por solvente das folhas de G. brasiliensis
O pó finamente moído das folhas, pesando 277,6 g, foi colocado num béquer com 1000 mL e 600 mL de n-hexano foi adicionado. A amostra foi extraída por maceração e banho ultrassônico USC 2800 SR 2311919 por 15 minutos. Os materiais foram filtrados num frasco cônico usando papel Whatman e o processo foi repetido três vezes, sempre usando banho ultrassônico e filtração para coletar as soluções de n-hexano que foram secas usando um evaporador rotativo BUCHI Rotavapor R114, B140 a 40 °C. Posteriormente, etanol foi adicionado aos resíduos no banho ultrassônico por 15 minutos cada e extraídos três vezes. O extrato de etanol foi filtrado usando papel Whatman em um frasco cônico, concentrado e seco usando evaporador rotativo e preservado no refrigerador a 7 °C.
Figura 2.3: Maceração das folhas de G. brasiliensis após moagem
2.3.4 Separação por grupo dos compostos bioativos (FE) usando
extração solvente-solvente
Figura 2.4: Extração líquido-líquido das folhas de G. brasiliensis após moagem
A solução foi suavemente agitada, sempre abrindo a tampa para liberar o gás desprendido. A unidade inteira foi, então, fixada a um suporte por 30 minutos, para permitir a separação da fração do n-hexano e metanol/água coletados em frascos separados. A partição com n-hexano foi realizada três vezes, seguida de acetato de etila, durante a qual a razão de metanol/água foi alterada para 4:6 (v/v) e extraída três vezes. Durante a partição líquido-líquido entre MeOH/H2O e n-butanol, a proporção de metanol/água foi alterada para 2:8 (v/v) e a partição foi realizada três vezes. As quatro frações resultantes foram secas usando evaporador rotativo a 250rpm, conectado a um banho-maria a 40 °C.
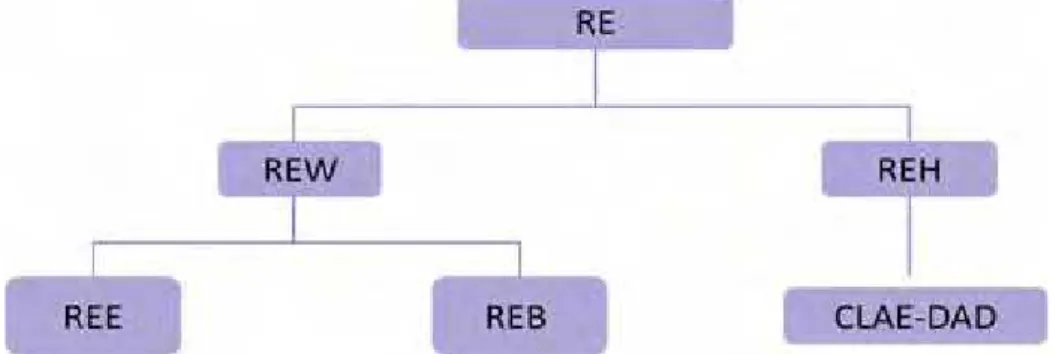
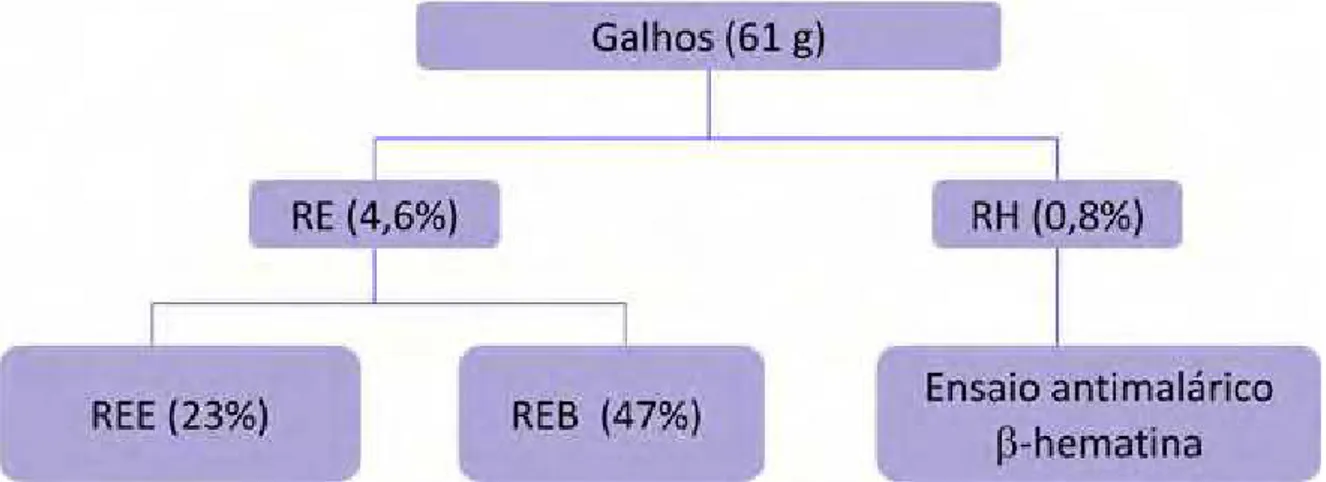
As amostras foram completamente secas usando SpeedVac RVT4104, produzindo as seguinte quatro frações: REH, REE, REB e REW, que foram preservadas em refrigerador a 7 °C (ELOFF, 2004).
2.3.5 Gradiente exploratório da fração de acetato de etila da
Garcinia brasiliensis
Extração em fase sólida (SPE)
O perfil químico do FEE foi investigado por análise CLAE-DAD com gradiente exploratório preliminar, usando um Varian Prostar equipado com Phenomenex C18 Luna
250 mm × 250 mm × 5 μm e fluxo 1 mL min−1. A faixa do detector PDA Prostar estava configurada de 200 a 800nm e foram usados um amostrador automático Prostar 410 e injetor automático de 20 μL. Os solventes A/B foram de grau analítico, sendo o Solvente
A, água ultra pura Mill-Q Plus 50 acidificada com 0,1% de ácido acético e o Solvente B, metanol de grau CLAE acidificado com 0,1% de ácido acético. O fluxo foi de 1mL min−1. O amostrador automático foi configurado para injetar 20μL com três lavagens por vez. O sistema de referência foi calibrado usando benzeno e tolueno. A variação da percentagem de metanol (solvente B) variou como segue: 0–35min 5–100%, 35–42min 100%, 42–45min
100–5% e 45–60min. Os dados foram adquiridos usando o sistema de dados Prostar. Os picos foram identificados de acordo com o tempo de retenção e os perfis de absorção de UV.
Tempo (min) MeOH (% v/v) Água (% v/v) Comentário 0–35
35–42 42–45 45–60
5–100 100 100–5
5
95–0 0 0–95
95
Gradiente Isocrático Gradiente Equilíbrio isocrático Tabela 2.2: Método de eluição para análise por gradiente CLAE-DAD
2.3.6 Grau
de
polimerização
O grau de polimerização, também conhecido como status de oligomerização, foi determinado como segue: os picos foram identificados no cromatograma ESI-MS; a partir de cada pico de interesse, o número de monômeros foi estimado a partir da equação (BEHRENS et al., 2003a)
m
= 288n + 23 + a z
2.3.7 Cromatogra
fi
a por exclusão de massa e cromatogra
fi
a de
a
fi
nidade em gel
A cromatografia de exclusão por tamanho foi utilizada para analisar o status oligomérico do FEE sugerido no ESI-MS. A cromatografia em coluna Sephadex LH-20 é largamente empregada na fração de extratos naturais de plantas. Este suporte é lipofílico, portanto retém compostos apolares. A separação de fenólicos na coluna em gel do Sephadex é rápida e eficiente. Compostos fenólicos são separados por filtração (efeito de peneira molecular do gel) e adsorção (ligações de hidrogênio e outras interações intermoleculares). O fracionamento foi realizado de acordo com o método descrito por Martini e Eloff (1998). Uma porção de 2 g de FEE foi dissolvida em 4 mL de metanol de grau CLAE e cromatografado em coluna cromatográfica com Sephadex LH-20/25– 100μ (Sigma Al drich) 210 cm × 3,5cm eluída com metanol (grau técnico) 100% em modo isocrático por 24 horas, produzindo sessenta e sete frações de 50 mL cada.
Varredura total das frações por UV
Frações metanólicas (2 mL cada) de A0–A67 foram coletadas em tubos de ensaio e sua absorbância foi medida em 200 a 600nm usando um espectrômetro UV–visível 2100 Asham BioSciences.
2.3.8 Análise por CLAE-DAD de A0
–
A57
A cromatografia em fase reversa CLAE com detecção de UV é usada para separar e detectar compostos fenólicos em plantas. Baseado nos dados de absorbância, os eluídos foram agrupados em frações maiores e os solventes evaporados e redissolvidos em 1 mL de metanol de grau CLAE.
As amostras foram filtradas em filtro de 0,45μm antes da injeção (20 μL). As amostras A0–A57 foram analisadas usando uma coluna de fase reversa C18 por CLAE-DAD. O equipamento utilizado foi um cromatógrafo SHIMADZU L201145 06350 CLAE-DAD equipado com desgaseificador DGU 20 A, amostrador automático SIL A20 e detector SPD M20A. Os solventes A e B usados foram de grau analítico A e B. O
A coluna de fase reversa foi Phenomenex Gemini C18 250 mm × 4,6mm × 5 μm e a vazão, de 1mL min−1. A faixa do detector estava configurada para 200–800nm e a percentagem do solvente B variou como segue: 0–35min 5–100%, 35–42min 100%, 42– 45min 100–5% e 45–60min 5%.
2.3.9 Espectrometria de massas
As amostras foram analisadas por espectrometria de massas com fonte de íons ESI empregando técnica de injeção direta de amostra por seringa. As massas foram escaneadas numa faixa de m/z = 501050 em experimento de injeção direta de amostra num equipamento LCQ FLEET Themo Scientific. Os solventes foram MeOH:H2O (1/1 v/v) em fluxo contínuo de 10 μL min
−1. O gás de arraste foi N
2 com uma vazão de 10 uni dades; a temperatura capilar foi 270 °C e a tensão no tubo da lente foi 120 V. A análise foi otimizada no modo íon negativo −40 V para melhor detecção de procianidinas (FU et al., 2007). Toda a análise de MS foi realizada no modo de íon negativo uma vez que prótons fenólicos em polifenóis possuem elevada acidez (FU et al., 2007). As condições do experimento foram:
Tensão da fonte −40 V; Tubo da lente 120 V;
Temperatura capilar 270 °C; Vazão do N2 10 unidades arbitrárias;
Varreduras completas das massas com variação de m/z = 50 −−1050 foram registradas durante o teste cromatográfico usando acetonitrila/água (1/1 v/v) permitindo a identifica ção de íons pseudomoleculares.
A espectrometria de massas foi usada para caracterização inequívoca de compostos fenólicos, para eliminar artefatos decorrentes da co-eluição de substâncias com espectros UV similares. O ESI é um método de ionização suave que gera principalmente moléculas desprotonadas (M − H) de compostos analisados no modo ne gativo para rápida
2.3.10 Análise por ESI-MS
2Essas análises foram realizadas através do cromatograma ESI-MS, seguidos de injeção e análise ESI-MS, os picos foram estudados e sujeitos a determinações ESI-MS2. Picos de interesse foram analisados e o padrão de fragmentação observado e registrado.
Ensaio de branqueamento do caroteno em cromatografia planar
Usando placas de CCDC com base de alumínio ALLUGRAM SIL G UV254 (Sor bent Technologies), FEB, REH, REE, REB and REW foram dissolvidos separadamente em HCl 0,1% em metanol e eluídos com acetato de etila/ácido fórmico/água (60/10/10 v/v/v) usando técnicas de co-cromatografia. As placas de CCDC foram desenvolvidas com sistemas eluentes otimizados no laboratório para separar componentes polares de extra tos de plantas, por exemplo, clorofórmio: metanol: água 58/36/6 (v/v/v) em recipiente fechado no qual a atmosfera foi saturada com o vapor eluente, efeito alcançado ao reves tir o tanque com papel molhado no eluente. As placas desenvolvidas foram pulverizadas com uma solução de -caroteno e expostas a luz natural por 30 minutos para promover a degradação do -caroteno por oxidação e consequente perda de cor.
2.3.11 Ensaios com tricloreto férrico
1 mg de cristais de cloreto férrico (III) foi dissolvido em metanol e a vibração induzida por vórtex foi utilizada para dissolução, resultando em uma solução laranja (SOLOWAY; WILEN, 1952). Então, as amostras A9, A17, A25, A33, A49 e A57 foram dissolvidas em metanol, passaram pelo processo de vibração induzida por vórtex e complementadas para atingirem 1 mg mL−1. Foram, então, misturadas com a solução de FeCl
3
2.3.12 Teste de cloreto de alumínio
1 mg mL−1 de cada amostra foi preparado em metanol de grau CLAE. 3 mL de cada uma foi escaneada utilizando o espectrofotômetro a média velocidade (200–600 nm). En tão, 1,5 mL de AlCl3 2% foram misturados com 1,5mL de cada amostra dissolvida utili zando vórtex e escaneada a velocidade média (200–600 nm). O experimento foi realizado à temperatura ambiente de 25 °C.
2.3.13 Quanti
fi
cação da capacidade de absorbância de UV
A perda em absorbância de UV foi determinada por:
∆UV =
UV2 −UV1 UV1
× 100%
onde UV1 é a absorbância depois de 24 horas e UV2 é a absorbância Depois de 168 horas de armazenamento.
2.3.14 Quanti
fi
cação do deslocamento hipercrômico
O aumento em intensidade relativo ao metanol, também conhecido como deslocamento hipercrômico, foi determinado como segue:
Hcr =
AAlCl 3 −A MeOH
100% AMeOH
×
onde Hcr é o deslocamento hipercrômico, AAlCl e AMeOH é a absorbância na solução de metanol.
2.3.15 Ensaio de sequestro do radical DPPH
O DPPH é um radical livre utilizado para determinar a capacidade de amostras de sequestrar radicais livres. O DPPH puro em solução tem uma capacidade de absorbância de 9960 a 517 nm e apresenta cor violeta. Quando uma substância com capacidade de sequestro de radicais livres, esse valor cai para 1640 e a cor muda para amarelo.
Para determinar as capacidades antioxidantes das amostras, o seguinte experimento foi realizado: 1 mg de cada amostra foi dissolvido em 1 mg de metanol e, então, diluído serialmente em 1,67 μg mL−1, 2,67 μg mL−1, 3,33 μg mL−1, 6,67 μg mL−1, 10 μg mL−1, 33,33 μg mL−1 e 66,7 μg mL−1. Mais tarde, 200 μL das várias diluições foram misturadas com 3 mL de soluções de DPPH em etanol 5 × 10−4. As amostras foram incubadas no escuro por 15 minutos e analisadas visualmente e espectrofotometricamente. A absorbância foi medida usando um espectrofotometrômetro UV–visível 2100 e leitores de microplacas Biotek (517 nm) e gravada usando o CAMAG Reprostar 3. A diminuição da absorbância em 517 nm foi medida usando um espectrofotometrômetro com rutina e Vitamina E como padrões de referência. A atividade de sequestro de radicais (RSA) foi calculada como uma porcentagem da descoloração do DPPH usando a seguinte equação:
%RS A =
( ADPP H −AS ) ADPP H
onde AS é a absorbância da solução quando o extrato da amostra foi adicionada a um nível particular e ADPP H é a absorbância da solução DPPH. Amostras com baixos valores de AS foram consideradas como antioxidantes fortes. Os ensaios foram realizados em triplicata e os resultados expressos como a média dos valores ± desvios
padrões. A concentração provendo 50% de inibição (EC50) foi calculada do gráfico da porcentagem de RSA contra a concentração do extrato. A análise baseada em CCD do sequestro do DPPH foi determinada como segue: a capacidade de sequestro do DPPH foi determinada usando placas de CCDC onde amostras de 1 mg mL−1 foram dissolvidas em HCl 0,1% em metanol e colocadas em placas de CCDC (ALLUGRAM SIL G UV254) usando tubos capilares. As placas foram eluídas com acetato de etila/ácido fórmico/água (60/10/10 v/v/v).
Após seu desenvolvimento, as placas foram borrifadas com 1,1-difenil-2-picril-hidrazil 0.2% (Sigma) (DPPH) em metanol como revelador e deixadas em repouso por 6 minutos para permitir reações químicas à temperatura ambiente de 25 °C, que indicam a redução do radical DPPH a DPPH H e sua perda de coloração violeta.
2.3.16 Estequiometria das reações
A estequiometria foi obtida ao multiplicar os valores concentração eficiente média (CE50) de sequestro do DPPH de cada uma das amostras por dois, o que dá a
concentração eficiente teórica (CE) de cada antioxidante necessário para reduzir 100% do radical DPPH ou a quantidade de amostras teoricamente necessária para 100% de inibição.
O poder antioxidante total (AOP) foi determinado por 1/ (2 x EC50)
2.3.17
Quanti
fi
cação da capacidade antioxidante do DPPH
(TOSC)
2.3.18
Quanti
fi
cação da capacidade antioxidante do DPPH
(CTOSC)
O total comparativo da capacidade de sequestro do DPPH (CTSAc) foi determinado usando a seguinte equação:
CTS Ac = CTS
Aramostra CTS Arcontrole
onde CTS Aramostra é a área sob a curva cinética para cada amostra e CTS Arcontrole é a área sob a curva cinética para o controle usado. A rutina e a Vitamina E foram usadas como controle positivo. O metanol foi usado como controle negativo.
2.3.19 Cromatogra
fi
a de camada delgada (CCD)
2.3.20 O
método de Folin-Ciocalteu
O conteúdo total de compostos fenólicos foi determinado usando reagente de Folin- Ciocalteu. Cada amostra foi dissolvida a uma concentração de 0,25 mg/ml. 0,5 ml foi misturado com 1 mL do reagente de Folin-Ciocalteu 10% (diluído até 1:10 em água deionizada) e 1,6mL de uma solução de carbonato de sódio (7,5% p/v). A mistura foi mantida no escuro à temperatura ambiente por 30 minutos com agitações intermitentes. A absorbância da mistura foi determinada como 765 nm e 760 nm usando um espectrofotômetro UV/visível. O conteúdo total de compostos fenólicos foi calculado como a média ± desvio padrão (n = 3) e expresso como gramas de ácido gálico equivalentes (GAE)/100g do extrato, como lido na curva de calibração preparada. A análise foi realizada usando o Microcal Origin Versão 5.0.
Preparação da curva de calibração para a determinação dos fenólicos totais
1 mg de ácido gálico medido precisamente foi dissolvido em metanol de grau CLAE e diluído serialmente em concentrações de 0,5, 0,25, 0,125, 0,0625 e 0,03125 μg/mL. 0,4mL das várias concentrações foram misturadas com 0,8 mL do reagente de Folin-Ciocalteu e
1,6 mL de uma solução de Na2CO3. As amostras foram deixadas no escuro por 30 minutos e a absorbância a 765 nm usando um UltraSpec Pro 2100 UV/Vis. Metanol puro foi usado para a correção dos sinais de fundo.
Os resultados foram plotados em um gráfico (figura 2.6) e a regressão linear determinada como R = 0, 99342.
A curva de calibração para a determinação dos fenóis foi calculada usando
y = mx + A,
Amostra Concentração Au aU aU aU aU aU
GA1 0,3125 0,029 0,029 0,028 0,015 0,015 0,015 GA2 0,0625 0,042 0,042 0,043 0,034 0,034 0,034 GA3 0,125 0,048 0,048 0,049 0,042 0,042 0,042 GA4 0,25 0,075 0,075 0,076 0,075 0,075 0,076 GA5 0,5 0,111 0,111 0,111 0,101 0,102 0,101 RE 0,25 0,031 0,032 0,032 0,031 0,032, 0,032 FE 0,25 0,040 0,040 0,040 0,040 0,040 0,040 Branco 0,00 0,00 0,00 0,00 0,00 0,00 0,00
Tabela 2.3: Absorbância do ácido gálico em diferentes concentrações
Figura 2.6: Absorbância do ácido gálico em diferentes concentrações
2.3.21 Ensaios de magnésio/ácido clorídrico
Os ensaios de magnésio/ácido clorídrico foram realizados utilizando o método relatado por Fu et al. (2007), com modificações. Em um tubo de Eppendorf, foram preparadas soluções de amostras (100 μl, 1mg/mL em metanol) e utilizando-se pinças, fragmentos de magnésio metálico foram adicionados às soluções preparadas de metanol (1mg/mL) de cada amostra. Utilizando-se uma pipeta, gotas de HCl 37% concentrado foram adicionadas às misturas e observado seu comportamento. A solução resultante foi deixada à temperatura ambiente 25 °C por 24 horas.
2.3.22 Conteúdo total de
fl
avonoides
O conteúdo total de flavonoides foi analisado empregando o método colorimétrico com cloreto de alumínio. Primeiramente, a curva de calibração foi preparada como segue.
1 mg de quercetina precisamente pesado foi dissolvido em metanol de grau CLAE e seriamente diluído em concentrações de 0,125, 0,0833, 0,0625, 0,416 e 0,03125 μg/mL. Então, 1 mg de cada concentração de quercetina foi misturada com 1 mL de uma solução saturada de AlCl3. A mistura foi deixada no escuro por 10 minutos a 25 °C. A absorbância foi
lida a 415 nm utilizando o UltraSpec Pro 2100 UV/Vis.