UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS EXATAS E DA TERRA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS
DISSERTAÇÃO DE MESTRADO
PROPRIEDADE FOTOLUMINESCENTE DA ZrO2: Tb+3, Eu+3, Tm+3 OBTIDA
PELO MÉTODO DE POLIMERIZAÇÃO DE COMPLEXOS
LAURA XIMENA LOVISA
Orientadora: Profª. Dra. Fabiana Villela da Motta
Co-orientador: Prof. Dr. Maurício Roberto Bomio Delmonte
Dissertação: nº 141/PPGCEM
LAURA XIMENA LOVISA
PROPRIEDADES FOTOLUMINESCENTE DA ZrO2: Tb+3, Eu+3, Tm+3 OBTIDA
PELO MÉTODO DE POLIMERIZAÇÃO DE COMPLEXOS
Dissertação de Mestrado apresentada ao Programa de Pós - Graduação em Ciência e Engenharia de Materiais da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para a obtenção do título de Mestre em Ciência e Engenharia de Materiais.
Orientadora: Profª. Dra. Fabiana Villela da Motta
Co-orientador: Prof. Dr. Maurício Roberto Bomio Delmonte
Natal/RN
UFRN / Biblioteca Central Zila Mamede.
“Porque nele foram criadas todas as coisas que há nos céus e na terra, visíveis e invisíveis, sejam tronos, sejam dominações, sejam principados, sejam potestades. Tudo foi criado por ele e para ele. E ele é antes de todas as coisas, e todas as coisas subsistem por ele.”
DEDICATÓRIA
AGRADECIMENTOS
Agradeço a Deus, Supremo Arquiteto de todo o universo, sem a ajuda do qual não seria possível a conclusão deste trabalho.
Aos meus orientadores Profa. Dra. Fabiana Villela da Motta e Prof. Dr. Maurício Roberto Bomio Delmonte pela oportunidade, atenção, pelo acompanhamento exercido durante a execução do trabalho, por cada contribuição de grande valia para realização desta pesquisa.
Ao Prof. Dr. Carlos Alberto Paskocimas, pelos conhecimentos passados que foram de grande importância para o trabalho.
Ao Prof. Dr. Máximo Siu Li pela colaboração nas medidas de fotoluminescência realizadas no Instituto de Física de São Carlos da USP.
Ao Laboratório de Síntese Química dos Materiais da UFRN (LSQM), pela infra-estrutura concedida e pelo material para o desenvolvimento do trabalho.
Ao Laboratório Interdisciplinar de Eletroquímica e Cerâmica (LIEC) da UFSCar pelas medidas realizadas de absorção no UV-Visível.
Aos amigos do grupo de pesquisa de síntese química pelo companheirismo no decorrer do mestrado e pelos bons momentos compartilhados.
Ao Ppgcem (Programa de Pós-graduação em Ciência e Engenharia de Materiais) pela assessoria oferecida durante o curso.
RESUMO
Estudos recentes investigam uma nova classe de materiais inorgânicos que surgem como uma opção promissora em aplicações de alto desempenho no campo da fotoluminescência. Destaque para fósforos dopados com íons de terras raras (TR+3), que possuem uma alta eficiência luminosa, um longo tempo de decaimento e por serem capazes de emitir radiações na faixa do visível, específicas de cada elemento. Neste trabalho, foram sintetizadas nanopartículas de ZrO2:Tb+3, Eu+3,
Tm+3 pelo método de polimerização dos complexos (MPC). Foram investigadas as
influências causadas pela temperatura de tratamento térmico e pelo teor dos dopantes no comportamento fotoluminescente da zircônia. As partículas foram calcinadas nas temperaturas de 400, 500 e 600ºC durante duas horas e a concentração dos dopantes variou em 1, 2, 4 e 8% mol TR+3. As amostras foram caracterizadas por análises térmicas (TG/ DSC), difração de raios X (DRX), medidas de fotoluminescência (FL) e espectroscopia na região do UV-Visível (UV-vis). Os resultados de difração de raios X confirmaram a formação das fases tetragonal e cúbica de acordo com o teor de dopantes. Os espectros de fotoluminescência apresentam emissões simultâneas correspondentes na região do azul (450 nm), do verde (550 nm) e do vermelho (615 nm). De acordo com os resultados obtidos, as partículas de ZrO2 codopadas com íons de terras raras apresentam-se como um
material promissor para emissão no branco com um potencial de aplicação no campo da fotoluminescência.
ABSTRACT
Recent studies are investigating a new class of inorganic materials which arise as a promising option for high performance applications in the field of photoluminescence. Highlight for rare earth (TR+3) doped, which have a high luminous efficiency, long
decay time and being able to emit radiation in the visible range, specific to each element. In this study, we synthesized ZrO2: Tb+3, Eu+3, Tm+3 nanoparticles complex
polymerization method (CPM). We investigated the influences caused by the heat treatment temperature and the content of dopants in zirconia photoluminescent behavior. The particles were calcined at temperature of 400, 500 and 600 ° C for two hours and ranged in concentration of dopants 1, 2, 4 and 8 mol% TR +3. The samples
were characterized by thermal analysis, X-ray diffraction, photoluminescence of measurements and uv-visible of spectroscopies. The results of X-ray diffraction confirmed the formation of the tetragonal and cubic phases in accordance with the content of dopants. The photoluminescence spectra show emission in the region corresponding simultaneous to blue (450 nm), green (550 nm) and red (615 nm). According to the results, ZrO2 particles co-doped with rare earth ions is a promising
material white emission with a potential application in the field of photoluminescence.
LISTA DE FIGURAS
Figura 1 Representação esquemática das estruturas cristalinas da
zircônia: a) monoclínica b) tetragonal e c) cúbica 20
Figura 2 Representação da estrutura de bandas eletrônicas 23
Figura 3 Representação esquemática do Método Pechini 28
Figura 4 Espectro eletromagnético: a faixa que vai de 400 nm a 700 nm
compreende a região do visível 30
Figura 5 Mecanismos de transferência de energia em complexos com
íons TR+3 32
Figura 6 Esquema representativo para a FL (a) sistema ordenado (b)
sistema desordenado 35
Figura 7 Funções XC, YC e ZC utilizadas para obtenção das coordenadas
de cromaticidade
37
Figura 8 Funções XC, YC e ZC utilizadas para obtenção das coordenadas
de cromaticidade 37
Figura 9 Fluxograma do procedimento experimental 42
Figura 10 Análises Térmicas (TG/DSC) do material pré-calcinado da ZrO2
pura
47
Figura 11 Difratogramas da Zr(1-x)TbxO2-δ, (a) x=0.01, (b) x=0.02, (c) x=0.04
e (d) x=0.08 49
Figura 12 Difratogramas da Zr(x)EuxO2-δ, (a) x=0.01, (b) x=0.02, (c) x=0.04
e (d) x=0.08
50
Figura 13 Difratogramas de Zr(1-x)TmxO2-δ, (a) x=0.01, (b) x=0.02, (c)
x=0.04 e (d) x=0.08
51
Figura 14 Difratogramas de Zr(1-x)(Tb Eu Tm)x-δ O2, (a) x=0.01, (b) x=0.02,
(c) x=0.04 e (d) x=0.08
53
Figura 15 (a) Relação tamanho do cristalito X temperatura, (b) Relação
Figura 16 (a) Relação tamanho do cristalito X temperatura, (b) Relação
Volume da célula unitária X Eu+3 mol% 56
Figura 17 (a) Relação tamanho do cristalito X temperatura, (b) Relação Volume da célula unitária X Tm+3 mol%
57
Figura 18 (a) Relação tamanho do cristalito X temperatura, (b) Relação Volume da célula unitária X (Tb+3 Eu+3 Tm+3) mol %
57
Figura 19 Difratograma observado e calculado por refinamento de Rietveld da Zr0,92Tb 0,08O2
58
Figura 20 Difratograma observado e calculado por refinamento de Rietveld da Zr0,92Eu0,08O2
59
Figura 21 Difratograma observado e calculado por refinamento de Rietveld da Zr0,92Tm0,08O2
59
Figura 22 Difratograma observado e calculado por refinamento de Rietveld da Zr0,92(Tb Eu Tm)0,08O2
60
Figura 23 Espectros de emissão da ZrO2 calcinadas a 400°C, 500°C e 600°C
62
Figura 24 Espectros de emissão Zr(1-x)TbxO2, 0.01 ≤ x ≤0.08 nas
temperaturas: (a) 400°C, ( b) 500°C e (c) 600°C
63
Figura 25 Relação entre a intensidade relativa versus a concentração (%) dos íons Tb+3 na posição 550 nm
64
Figura 26 Intensidade da luminescência do Tb+3 para diferentes temperaturas de tratamento térmico para amostra Zr calcinação
65
Figura 27 Espectros de emissão Zr(1-x)EuxO2, 0.01 ≤ x ≤ 0.08 nas
temperaturas: (a) 400°C, ( b) 500°C e (c) 600°C
66
Figura 29 Relação entre a Intensidade relativa versus a concentração (%) dos íons Eu+3 na temperatura 600ºC
68
Figura 30 Relação entre a Intensidade relativa do Eu+3 e a temperatura de
calcinação
69
Figura 31 Espectros de emissão Zr(1-x)TmxO2, 0.01 ≤ x ≤ 0.08 nas
temperaturas: (a) 400°C, ( b) 500°C e (c) 600°C
71
Figura 32 Espectros de emissão Zr(1-x)(Tb Eu Tm)xO2, 0.01 ≤ x ≤ 0.08 nas
temperaturas: (a) 400°C, ( b) 500°C e (c) 600°C
73
Figura 33 Espectros de emissão do Zr0,92(Tb Eu Tm)0,08O2 nas
temperaturas de 600ºC, 800ºC e 1000ºC.
74
Figura 34 Diagrama de Cromaticidade da Zr0,92(Tb Eu Tm)0,08, A: 600°C, B:
800°C, C: 1000ºC
75
Figura 35 Espectros de Absorção Uv-Visível da Zr0,92Tb0,08O2 para (a)
400°C, (b) 500°C e (c) 600°C
77
Figura 36 Espectros de Absorção Uv-Visível da Zr0,92Eu0,08O2 para (a)
500°C e (b) 600°C
78
Figura 37 Espectros de Absorção Uv-Visível da Zr0,92Tm0,08O2 para (a)
500°C e (b) 600°C
80
Figura 38 Espectros de Absorção Uv-Visível da Zr0,92(Tb Eu Tm)0,08O2 para
(a) 400°C, (b) 500°C e (c) 600°C
LISTA DE TABELAS
Tabela 1 Dados dos parâmetros de rede das fases ZrO2 21
Tabela 2 Reagentes utilizados nas sínteses de ZrO2: TR+3 40
Tabela 3 Dados cristalográficos das amostras Zr(1-x)TbxO2 53
Tabela 4 Dados cristalográficos das amostras Zr(1-x)EuxO2 54
Tabela 5 Dados cristalográficos das amostras Zr(1-x)TmxO2 55
Tabela 6 Dados cristalográficos das amostras Zr(1-x)(Tb Eu Tm)xO2 53
Tabela 7 Coordenadas (x,y,z) da Zr0,92(Tb Eu Tm)0,08, A: 600°C, B: 800°C
e C: 1000ºC 76
Tabela 8 ―Gap‖ óptico do Zr(1-x)TbxO2 para 0,01 ≤ x ≤ 0,08 78
Tabela 9 ―Gap‖ óptico do Zr(1-x)EuxO2para 0,01 ≤ x ≤ 0,08 79
Tabela 10 ―Gap‖ óptico do Zr(1-x)TmxO2 para 0,01 ≤ x ≤ 0,08 80
LISTA DE ABREVIATURAS
FL Fotoluminescência
TR Terras Raras
MPC Método de Polimerização de Complexos
UV-Vis Ultravioleta visivel
AC Ácido Cítrico
EG Etileno glicol
u.a Unidades arbitrárias
IC Conversão Interna
ISC Cruzamento intersistema
T1 Estado Tripleto
BV Banda de Valência
BC Banda de Condução
DRX Difração de raios X
TG Termogravimetria
DSC Calorimetria Exploratória Diferencial
LISTA DE EQUAÇÕES
Equação 1 Integral do componente X para formação da cor P( ) 38
Equação 2 Integral do componente Y para formação da cor P( ) 38
Equação 3 Integral do componente Z para formação da cor P( ) 38
Equação 4 Coordenada x’ de cromaticidade 38
Equação 5 Coordenada y’ de cromaticidade 38
Equação 6 Coordenada z’ de cromaticidade 38
Equação 7 Equação de Scherrer 43
Equação 8 Calculo do parâmetro 2 43
Equação 9 Relação da energia do ―gap‖ com a absorbância 45
Equação 10 Cálculo da absorbância 45
SUMÁRIO
1 INTRODUÇÃO 16
2 REVISÃO BIBLIOGRÁFICA 18
2.1 CERÂMICAS FOTOLUMINESCENTES 19
2.2 DIÓXIDO DE ZIRCÔNIO (ZrO2) 19
2.2.1 Estrutura Cristalina da ZrO2 20
2.3 OS LANTANÍDEOS 21
2.4 ZIRCÔNIA DOPADA COM ÍONS DE TERRAS RARAS (ZrO2:TR+3) 23
2.5 MÉTODOS DE SÍNTESE PARA OBTENÇÃO DA ZrO2 26
2.5.1 Método de Polimerização de Complexos 27
2.6 LUMINESCÊNCIA 29
2.6.1 Mecanismo de Transferência de Energia em Complexos com íons TR+3
31
2.6.2 Fotoluminescência (FL) 33
2.6.3 Diagrama de cromaticidade 36
3 MATERIAIS E MÉTODO 39
3.1 MATERIAIS 40
3.2 METODO DE SÍNTESE 40
3.3 TÉCNICAS DE CARACTERIZAÇÃO DAS PARTÍCULAS 42
3.3.1 Análises Térmicas (TG e DSC) 42
3.3.2 Difração de raios X (DRX) 43
3.3.2.1 Determinação do tamanho de cristalito 43
3.3.3 Método de Rietveld 44
3.3.4 Fotoluminescência (FL) 44
3.3.5 Espectroscopia na região do UV-Visível (UV-Vis) 45
4 RESULTADOS E DISCUSSÃO 46
4.1 Análises Térmicas 47
4.2 Difração de Raios X (DRX) 48
4.3 Método de Rietveld (DRX) 58
4.4.1 Luminescência da ZrO2 61
4.4.2 Luminescência da Zr(1-x)TbxO2 62
4.4.3 Luminescência da Zr(1-x) EuxO2 65
4.4.4 Luminescência da Zr(1-x)TmxO2 69
4.4.5 Luminescência da Zr(1-x)(Tb Eu Tm)xO2 72
4.4.6 Diagrama de Cromaticidade (CIE) 75
4.5 Espectroscopia na Região do Ultravioleta Visível (UV-Vís) 76
5 CONCLUSÕES 83
Capítulo 1
1 INTRODUÇÃO
Atualmente crescentes investimentos têm sido aplicados na produção, caracterização e aplicação de materiais nanoestruturados. Esta nova classe de materiais vem despertando bastante interesse na pesquisa por apresentarem possibilidades de melhorias em diversas propriedades quando comparadas as dos materiais tradicionais.
Dentro deste novo grupo de materiais, os materiais inorgânicos dopados com íons de terras raras (TR) vêm sendo reconhecidos por seu enorme potencial no campo da fotoluminescência graças ao desenvolvimento de fósforos mais eficientes. A produção de óxidos com propriedade fotoluminescente tem sido obtida através de uma variedade de rotas como: sol – gel (ZHANG, H. et al, 2005), precipitação (GUNAWIDJAJA,R.; MYINT. T. e EILERS, H. 2011), síntese hidrotérmica (YU, L. et al, 2010) e método dos precursores poliméricos (HUANG, et al., 2011).
Os fósforos nanoestruturados são classificados como materiais semicondutores que apresentam propriedades luminescentes e uma grande faixa de aplicações: diodo emissor de luz (LED), tubo de raios catódicos (CRT) entre outras (XIAOSHAN, et al., 2007; LIU, et al., 2007; CHEN, et al., 2004). As principais características dos fósforos são tempo de vida longo da luminescência (ordem de alguns microssegundos), eficiência luminosa (80-105 lm/W), atuam sob baixas tensões e são quimicamente estáveis.
A ZrO2 apresenta um bom desempenho quanto ao papel de rede hospedeira
para os íons terras raras tendo em vista sua estabilidade química e fotoquímica, o seu alto índice de refração e baixa energia de fônon. O comportamento fotoluminescente da ZrO2 dopada com os lantanídeos tem sido bastante investigado
(GÓMEZ, et al., 2010; LANGE, er al., 2008; CABELLO, et al, 2008). A emissão dos íons TR incorporados ocorre por meio de uma transferência de energia do material hospedeiro sob fotoexcitação. As emissões de fótons são baseadas nas transições 4f-4f ou 5d-4f, caracterizadas por bandas estreitas e bem definidas.
Este trabalho teve como objetivo principal a obtenção da ZrO2 codopada com
Capítulo 2
2. REVISÃO BIBLIOGRÁFICA
2.1 CERÂMICAS FOTOLUMINESCENTES
O avanço dos materiais semicondutores com propriedades ópticas, tais como fotoluminescência (FL), proporciona o desenvolvimento de novos dispositivos com melhores desempenhos. A propriedade fotoluminescente de um material pode ser potencializada pela presença de determinados dopantes ou pela existência de defeitos estruturais, como vacâncias e impurezas. Atualmente estudos reportam o uso de vários materiais cerâmicos para esta aplicação tais como: SrTiO3:Sm (Longo
et al., 2010), Y2O3:Tb, Eu (Mukherjee et al., 2008), YVO4:Ln, P (Wang et al., 2008) e
SiO2-PbF2:Eu (Zhao et al., 2007). Dentre eles destaca-se a ZrO2 (Mukherjee et al.,
2012; Marin, R. et al., 2013) devido a sua estabilidade química e fotoquímica, por possuir um alto índice de refração e apresentar uma menor energia de fônons.
2.2 DIÓXIDO DE ZIRCÔNIO (ZrO2)
A zircônia pode ser encontrada na natureza na forma de dois tipos de minérios: o zircão (ZrSiO4) e a badeleíta (ZrO2). Entre os minerais comerciais, o
zircão é o mais comum e amplamente distribuído. A badeleíta possui de 80-90% de ZrO2 e é comumente encontrada em associação com outros óxidos, como: SiO2,
Fe2O3 e TiO2 como principais impurezas, além do HfO2 que possui estrutura e
propriedades semelhantes ao ZrO2 (SOMIYA,1989).
O uso da zircônia em diversas áreas industriais é atribuído ao seu conjunto de propriedades: químicas, físicas, óticas, elétricas e mecânicas. Devido as suas características, a ZrO2 tem encontrado espaço em várias áreas como: na confecção
combustível para produção de energia devido as suas características estruturais que favorecem a alta condutividade iônica (FLORIO et al., 2004).
2.2.1 ESTRUTURA CRISTALINA DA ZrO2
A zircônia pura é polimórfica. Ela apresenta três estruturas cristalinas: monoclínica (estável até 1173ºC), tetragonal (até 2370ºC) e cúbica com sua estabilidade garantida até a temperatura de fusão de 2680 ºC. A zircônia cúbica apresenta estrutura similar a da fluorita, onde os átomos de zircônio ocupam a posição na rede cúbica de face centrada (CFC) (0,0,0) e o oxigênio a posição (1/4,1/4,1/4). As estruturas tetragonal e monoclínica são consideradas distorções da estrutura anterior (STEVENS,1991).
1173ºC 2370ºC
Monoclínica (m) Tetragonal (t) Cúbica (c)
: Zr+4 e : O-2
Figura 1 - Representação esquemática das estruturas cristalinas da zircônia: a) monoclínica b) tetragonal e c) cúbica
Os dados cristalográficos das fases da ZrO2 estão descritos na Tabela 1.
TABELA 1 - Dados dos parâmetros de rede das fases ZrO2
Estrutura Cristalina Cúbica Tetragonal Monoclínica
Parâmetros de Rede (a= b = c) (a= b ≠ c) (a ≠ b ≠ c)
Ângulo α = θ = = 90º α = θ = = 90º α = θ = 90º ≠
Número de Coordenação 8 8 7
O uso da ZrO2 como cerâmica avançada está relacionado a uma série de
fatores que inclui processamento do material e controle microestrutural que garanta um desempenho esperado. A estabilização de fase da zircônia é determinante para a sua aplicação. A utilização de dopantes como Ca2+, Mg2+ e terras raras (Eu+3, Tb+3, Y+3) favorece a estabilização das fases cúbica e tetragonal da zircônia em temperaturas ambientes (LEILEI, 2013 e YOSHIMURA, 2007).
Os primeiros a pesquisar sobre a cinética do tamanho das partículas e as transformações de fases da ZrO2 foram GARVIE (1970) e SUBBARAO (1981). Os
autores atribuem à mudança do número de oxigênio ligado na rede a substituição do íon zircônio, Zr4+, por um dopante de menor valência, TR+3. O surgimento destas
vacâncias de O2- é uma forma de contrabalancear as cargas, garantindo a
neutralidade do material. Esta desordem ocasionada pela adição dos dopantes promove a estabilização das fases cristalinas de alta temperatura da zircônia em baixas temperaturas, conforme reportado na literatura (RIZZUTI, 2010; PIOTR, 2012; ROMERO, 2010).
2.3 OS LANTANÍDEOS
recebe a denominação de terras raras (TR). Com exceção dos elementos Y, Sc e La, todos os outros elementos apresentam uma configuração eletrônica igual a [Xe] 4fn (n = 0, 1,..., 14), tanto no estado sólido como em solução (ALVES, 2012).
A expressão terras raras foi atribuída aos lantanídeos (La-Lu), assim como para o escândio (Sc) e o ítrio (Y) por terem sido encontrados na forma de seus óxidos, e possuindo uma aparência semelhante aos materiais que conhecesse como terras, a exemplo o calcário e semelhantes (LIMA, 2003).
Uma infinidade de aplicações das terras raras é justificada pelas suas propriedades ímpares, principalmente as espectroscópicas e magnéticas. Os lantanídeos possuem propriedades químicas e físicas muito semelhantes; isto é uma conseqüência da sua configuração eletrônica. Outra característica deste grupo de elementos é quanto ao estado de oxidação, o estado trivalente (Ln+3) é o mais comum e que diferencia grande parte dos compostos TR, sendo ainda o mais estável termodinamicamente. Este estado de oxidação (+3) não depende apenas da configuração eletrônica, mas também de um balanço entre as energias de ionização, reticular, de ligação. (ISOLANI e MARTINS, 2005).
Os elétrons do nível 4f de um íon lantanídeo sofrem o efeito de blindagem pela vizinhança química dos orbitais 5s e 5p, que estão preenchidos. Devido a este efeito, os níveis eletrônicos 4f são pouco afetados pelo campo ligante.
A luminescência nos TR+3 apresenta transições do tipo f→f. Como os elétrons do 4f são internos existem apenas efeitos muito fracos do campo dos ligantes. Em razão disto, as propriedades eletrônicas são pouco afetadas pelo ambiente químico. As transições ópticas são caracterizadas por serem muito finas e bem definidas. As transições intraconfiguracionais (f→f) ocorrem pela relaxação da lei de Laporte através da teoria de Judd e Ofeld (JUDD e OFELD,1962 apud PAL, P. et al.,2013, p. 66) que admite transições entre estados de mesma paridade (d→d, f→f), oriundas de uma mistura de estados da configuração 4 f e 5d.
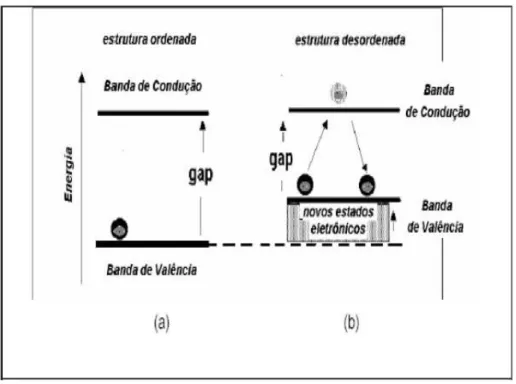
descritas através de modelos de bandas de valência, bandas de condução e bandas proibidas.
Figura 2 - Representação da estrutura de bandas eletrônicas
Fonte: Adaptado http://webexhibits.org/causesofcolor/11A0.html
Através dos dados espectrais dos compostos contendo íons de TR+3 é possível quantificar as energias fundamentais e excitadas destes íons. O comportamento fotoluminescente destes materiais pode ser avaliado levando em consideração a diferença entre a energia dos níveis excitados dos íons TR+3 e dos estados dos ligantes (SOUZA, 2009).
2.4 ZIRCÔNIA DOPADA COM ÍONS DE TERRAS RARAS (ZrO2:TR+3)
PATRA, 2004; De la ROSA-CRUZ et al, 2003; GUTZOV e LERCH, 2003), devido suas propriedades, em especial, por possuir uma baixa energia vibracional em sua rede cristalina. Esta baixa energia de fônon da zircônia está relacionada a probabilidade de ocorrência das transições não radiativas. Materiais que apresentam uma alta energia de fônon significam ter uma menor eficiência na emissão radiativa.
Romero et al (2010) avaliaram a fotoluminescência das partículas de ZrO2:TR+3 (TR = Tb, Eu, Tm). Estes autores concluíram que a eficiência da
propriedade estudada está associada a alguns parâmetros adotados nos processamentos do materiais, tais como: concentração dos íons dopantes, a rota de síntese utilizada e a temperatura de tratamento térmico. Estes fatores influenciam diretamente a estrutura cristalina do material formado.
Embora, os íons Eu+3 Tb+3 e Tm+3 apresentem uma configuração eletrônica semelhante por pertencer a um mesmo grupo de elementos químicos (terras raras), contudo, Romero et al (2010) registra um comportamento diferente entre os cátions quanto a estabilização da fase tetragonal da ZrO2 (t-ZrO2). De acordo com o autor,
estas desigualdades podem ser compreendidas através das propriedades atômicas de cada dopante: raio atômico e eletronegatividade dos íons.
Cada íon TR+3 possui uma concentração ideal, quando inserido numa determinada matriz, que corresponde uma máxima intensidade de emissão. Para valores a cima desta concentração crítica é possível observar um decréscimo na intensidade e no tempo de vida da emissão. Este evento é conhecido como ―quenching‖ e pode ocorrer devido uma relaxação cruzada, em que dois íons vizinhos trocam energia por meio de transições não radiativas (EHRHART, 2007).
A luminescência nos íons TR+3 é bastante sensível à simetria dos íons O-2 em
torno dos íons TR+3. Desta forma, qualquer mudança de fase ocorrida na rede
hospedeira é captada pelos TR+3, os quais funcionam como uma espécie de sonda
na estrutura do cristal. O interesse em particular pelos íons de terras raras está na habilidade que eles possuem de monitorar as alterações estruturais.
Através dos espectros de excitação das partículas de ZrO2:TR+3 é possível
apresenta uma fácil interpretação quando comparado a outras terras raras devido ao seu estado não-degenerado do estado emissão (5D
0). O Fator de assimetria ao redor
do Eu+3 está relacionado a razão entre as transições de dipolo elétrico (5D
0 →7F2) e
de dipolo magnético (5D
0 →7F1). A transição 5D0 →7F2 é hipersensível ao ambiente
químico no qual o íon se encontra. Já a transição 5D
0→7F1 não sofre influencia por
qualquer alteração do meio, e é considerada uma espécie de padrão interno (NASSAR, 2007).
As transições 5D
0 → 7Fj (j = 1,2,3,4,...) são responsáveis pelo processo de
emissão do fóton no Eu+3, descritas e discutidas por diversos autores (Hirano, M. e Dozono, H., 2013) O número máximo de bandas resultantes de uma transição 5D0→ 7F
j é dado pela regra de (2J + 1) componentes. O número de bandas associado a
cada transição depende da simetria pontual ao redor do íon TR+3 e pode ser facilmente determinada usando a teoria de grupos (ONO, 1995).
A luminescência da ZrO2:Eu+3 também foi estudada por Gutzov e Lerch
(2003) que observaram um comportamento diferente nos espectros de emissão para diferentes estruturas cristalinas formadas. Entretanto, não apresentou maiores detalhes devido à baixa intensidade da luminescência.
Quan et al. (2005) obteveram partículas de ZrO2:Eu+3 pelo método de pirólise
e concluiu a partir de seus resultados que não houve alteração de fase da zircônia em até 10% da adição de Eu+3. Contrario a este resultado, outros trabalhos
(ROMERO, 2010; SALAS, 2008; MONDAL e RAM, 2008) relatam a estabilização da fase tetragonal da ZrO2 em menores concentrações do dopante.
2.5 MÉTODOS DE SÍNTESE PARA OBTENÇÃO DO ZrO2.
O aperfeiçoamento nos métodos de síntese para obtenção de pós cerâmicos tem por objetivo a produção de pós com características específicas, minimizando a quantidade e o tamanho dos defeitos no material final além de condicionar determinadas propriedades. As características ideais de um pó cerâmico incluem tamanho nanométrico de partícula, distribuição controlada de tamanho de partícula, morfologia das partículas, reduzido grau de aglomeração, elevado grau de pureza, homogeneidade química e de fases controladas, baixa volatilidade e química superficial controlada (RIMAN, 1994).
Atualmente o desenvolvimento de métodos adequados para a produção de pós cerâmicos tem sido de grande importância, uma vez que as propriedades principais de uma cerâmica dependem, em grande parte, das características originais dos pós utilizados. Essas características são afetadas pelos métodos empregados na obtenção desses pós (COSTA et al., 2006).
Vários métodos têm sido utilizados na preparação de pós de ZrO2 dopada com
íons de terra raras (TR+3). A produção desses materiais é realizada por métodos químicos tais como sol-gel (ZHANG, H. et al, 2005; ), precipitação (VLASOVA, K. Y. et al., 2011;GUNAWIDJAJA,R.; MYINT. T.; e EILERS, H. 2011), hidrotermal (SMITS, K. et al., 2010; YU, L. et al, 2010) e outros que apresentam como resultados materiais com alto grau de pureza. No entanto, a síntese baseada no método Pechini vem sendo desenvolvida com êxito em muitos trabalhos (REZAEI, M., 2009; SOUZA, W. et al., 2007; ZHANG, Y. et al., 2003; LONGO, 2001)
2.5.1 MÉTODO DE POLIMERIZAÇÃO DE COMPLEXOS
Entre as diversas rotas químicas para obtenção de pós cerâmicos, o método de polimerização de complexo (MPC) tem apresentado um conjunto de vantagens, dentre as quais ressalta o controle direto e preciso na estequiometria dos reagentes e a baixa temperatura de síntese.
O método dos precursores poliméricos foi patenteado por Magio Pechini. Em seu trabalho, Pechini (1967) demonstra a preparação de titanatos e niobatos por meio de uma resina polimérica obtida através de um ácido policarboxílico e de um poliálcool. A técnica fundamenta-se na síntese de um poliéster partindo de uma reação de condensação de polihidroxi-álcool, comumente usado o Etilenoglicol (EG) com um ácido carboxílico, a exemplo o ácido cítrico (AC). É possível formar uma solução contendo o AC e o EG e uma quantidade estequiométrica do metal ou metais desejados.
Na solução, as misturas dos sais metálicos (cloreto, carbonatos, nitratos) reagem com o ácido carboxílico formando os citratos metálicos, este processo é conhecido com reação de quelação. Fornecendo um grau de agitação e aquecimento moderado na faixa de 70ºC a 110ºC é possível ocorrer reações de condensação e poliesterificação em decorrência da adição de EG, observando as proporções molares corretas.
Figura 3 - Representação esquemática do Método Pechini
Fonte: MOTTA, 2008.
A Figura 3 ilustra uma representação esquemática do método de polimerização dos complexos. A utilização do MPC dentro da pesquisa em materiais é bastante difundida, pois apresenta boas vantagens como uma distribuição homogênea dos diferentes íons metálicos ao longo do polímero formado, facilitando o controle estequiométrico. É de grande importância a homogeneidade na síntese de óxidos, pois a homogeneidade da composição do óxido final está diretamente relacionada à homogeneidade química da distribuição de cátions em um sistema gel. Outros fatores positivos do método são a baixa temperatura de síntese, a obtenção de partículas nanométricas e a reprodutibilidade.
Algumas variáveis da técnica como a razão entre AC/EG, a temperatura de calcinação interferem na fase formada e na morfologia das partículas (REZAEI, M. 2009). Garvie em seu trabalho de estabilização da ZrO2 na fase tetragonal (GARVIE,
1978) explica que o tamanho do cristalito influencia o tipo de fase formada. A ZrO2
apresenta valores ainda menores que a t- ZrO2, visto que apresenta uma estrutura
mais simétrica.
Segundo Longo et al (2001) a quantidade de Etilenogicol (EG) adicionada à reação interfere diretamente no tamanho de cristalito. O aumento de teor do EG promove um aumento no comprimento das cadeias poliméricas, distanciando os cátions quelados entre si. Sugere-se que devido a este distanciamento, a cristalização das primeiras partículas, durante a calcinação, ocorre de forma mais independente (isolada). As interações entre as partículas são consideradas fracas e apresentam partículas com tamanhos menores.
Tai e Lessing (1992) em um estudo bastante minucioso investigaram o comportamento do material obtido pelo método de polimerização de complexos após a pirólise. Concluíram que uma resina altamente porosa é formada pela desidratação de uma mistura AC/EG em razão apropriada. Identificaram a necessidade de um controle entre AC e EG para se chegar a resina macia, essencial para obtenção de partículas livres e fracamente aglomeradas. Existe uma razão ótima entre AC/EG, variando entre 40/60 e 60/40, dependendo das espécies químicas presentes na resina (CHO, JOHSON e CONDRATE JR, 1990).
2.6 LUMINESCÊNCIA
Figura 4 - Espectro eletromagnético: a faixa que vai de 400 nm a 700 nm compreende a região do visível
Fonte: ASSUNÇÃO, 2009.
A luminescência é definida como a emissão de radiação eletromagnética por um átomo quando seus elétrons se encontram em estados excitados e retornam para o estado fundamental por transições radiativas. O comprimento de onda, , desta radiação está compreendido numa faixa do espectro eletromagnético, que vai da região do ultravioleta e se estende até ao infravermelho (PIERRE, 2008).
A luminescência é um termo geral utilizado para o fenômeno, porém existem vários tipos de excitações que se refletem em expressões como: fotoluminescência - emissão de onda eletromagnética na forma de fótons; quimiluminescência – a produção de luz ocorre de energia proveniente de reações químicas; eletroluminescência - a radiação de luz é transmitida quando há descargas nos gases; termoluminescência - a energia liberada pelos átomos sob a forma de luz que é compensada pela energia do movimento térmico dos átomos (ou moléculas) do corpo que irradia (BUNZLI, 1995).
origens em luz visível. Estes materiais podem ser classificados quanto ao tempo de decaimento. Para um tempo de decaimento (τ) inferior a 10ms são chamados de fluorescentes, acima de 0,1s são denominados fosforescentes (FELDMANN et al., 2003).
Entre milhares de materiais luminescentes que são sintetizados, poucos, no entanto, exibem propriedades interessantes para aplicações tecnológicas. Fatores como a eficiência luminosa, a cor de emissão, o tempo de decaimento, estabilidade química e física, a reprodutibilidade na preparação dos materiais e em suas propriedades, a disponibilidade de matérias-primas, os aspectos ambientais, assim como o preço de custo devem ser considerados. Como forma de potencializar a aplicação destes materiais pesquisas têm direcionado o foco no estudo dos efeitos secundários, que inclui a investigação e a otimização da estrutura cristalina dos fósforos, morfologia das partículas, geração e propagação da luz, assim como outros tópicos (SUN, 2014; HE, 2014 e SOHN, 2014).
2.6.1 MECANISMOS DE TRANSFERÊNCIA DE ENERGIA EM COMPLEXOS COM ÍONS TR+3.
transfere energia para os estados |3〉 ou |2〉 de energias mais baixas do íon TR+3,
que então decaem radiativamente para o estado fundamental.
Figura 5 - Mecanismos de transferência de energia em complexos com íons TR+3
FONTE: Adaptado SOUZA e SIGOLE, 2012.
A radiação eletromagnética emitida por um material luminescente ocorre usualmente na região do visível, mas o mesmo pode ocorrer em outras regiões do espectro, tais como, no ultravioleta ou no infravermelho. A luminescência é observada em todos os estados da matéria, tanto para compostos inorgânicos como orgânicos (GURGEL, et al., 2007).
Quando um fóton com energia suficiente para excitar um elétron do estado fundamental (S0) para um nível energético superior S1 é absorvido, ocorre uma
transição óptica entre esses estados. Em cada nível eletrônico existem vários níveis vibracionais, nos quais as transições ópticas podem acontecer. A energia mínima que um fóton pode possuir para elevar um elétron do estado fundamental (S0) para o
primeiro estado excitado (S1), corresponde a diferença das energias relacionadas
Os elétrons que assumem níveis mais energéticos estão instáveis, logo têm um tempo de vida muito curto e rapidamente relaxam para o nível vibracional S1, que
tem um tempo de vida mais longo. Esse processo de decaimento não radiativo entre níveis de mesma multiplicidade é conhecido como conversão interna (IC). A relaxação de um nível excitado mais energético para o primeiro nível vibracional de S1 também pode ocorrer por cruzamento intersistema (ISC) que dá origem a elétrons
excitados no estado tripleto (T1). ISC é o termo utilizado para designar transições
não-radiativas entre estados de diferentes multiplicidades (SOUZA, 2009).
A radiação eletromagnética, que é resultante de um decaimento radiativo de um nível eletrônico superior para um nível fundamental, pela emissão de um fóton, só ocorre quando o intervalo para o nível adjacente mais baixo está acima de um valor crítico (LUCENA et al., 2004).
2.6.2 FOTOLUMINESCÊNCIA (FL)
A fotoluminescência é um dos tipos da luminescência e constitui em um fenômeno óptico quando um material é excitado por luz e exibe uma emissão de onda eletromagnética na forma de fóton. A onda eletromagnética irradiada por fotoluminescência tem como regra geral, um comprimento de onda maior do que a onda eletromagnética que causou esta luminescência (LUCENA, 2004).
Inicialmente a fotoluminescência foi estudada em materiais cristalinos nos quais a emissão do fóton ocorria em temperaturas criogênicas, razão que dificultou a aplicação destes materiais (BLASSE, 1979).
A fotoluminescência é um fenômeno intimamente associado às transições eletrônicas entre bandas de valência e de condução e ocorrem a partir de elétrons que, quando excitados, são transferidos da banda de valência para a banda de condução, deixando buracos na banda de valência antes completamente preenchida. A emissão ocorre pela recombinação buraco – elétron.
Na maioria dos sólidos inorgânicos, a fotoluminescência envolve impurezas, denominadas dopantes, ou defeitos estruturais, como as vacâncias. Estas imperfeições são do tipo atômica e/ou molecular, sendo que suas características dependem da natureza e estrutura da imperfeição e dos estados eletrônicos do sólido (BLASSE, 1979). A atividade FL pode ser potencializada através da presença de dopantes na rede cristalina de determinados materiais (PINHEIRO et al.,2003) de maneira a emitir energia na forma de fótons, ou seja, decaimento radiativo. Em outros casos, os dopantes podem ser desfavoráveis a emissão de fótons, diminuindo sua ocorrência. Criando estados eletrônicos responsáveis pelo decaimento não-radiativo, fenômeno conhecido por envenenamento (BLASSE e GRABMAIER, 1994).
As interações entre a estrutura hospedeira, dopante e vários defeitos são responsáveis pelo surgimento das propriedades dos materiais luminescentes (KANG, CHANF e YOON, 2000). Todos estes fatores estão fortemente ligados a composição química do material. Um dos principais defeitos encontrados em partículas cerâmicas é a presença de íons de oxigênio não ligados no material, o que pode modificar a estrutura eletrônica do sistema. A presença destes ―oxigênios não-ligados‖ na rede contribui para a propriedade fotoluminescente devido à recombinação radiativa entre os elétrons e buracos causados pelos átomos de oxigênio não ligados.
Figura 6 - Esquema representativo para a FL (a) sistema ordenado (b) sistema desordenado
Fonte: GURGEL, 2005.
Os valores encontrados na literatura para a zircônia pura estão dentro da faixa de 4,84 eV (Petkova et al., 2011) a 5,65 eV (Balakrishnan et al., 2011) de acordo a fase da ZrO2 estabilizada. Os altos valores de gap associados à zircônia,
lhes classificam como um material isolante, próprio de uma cerâmica. com a literatura a zircônia apresenta altos valores de ―band gap‖, sendo classificado como cerâmica
Os níveis de energia são criados entre a banda de valência e a de condução surgem a partir do desdobramento de orbitais do átomo mantido em campo ligante (TANABE e SUGANO, 1954). Com base nesta teoria, foram desenvolvidos diagramas de energia dos desdobramentos do estado fundamental de metais de transição, considerando as interações entre os orbitais e o campo ligante octaédrico e tetraédrico a que são submetidos. Estes diagramas são conhecidos como diagramas configuracionais de Tanabe e Sugano.
são freqüentemente usados como ativadores para emitir luz dos materiais (KYOMEN et al., 2005).
Trabalhos na literatura mencionam a uso dos íons terras raras na fotoluminescência (ZHANG, PITA, KAM, 2013; JIA et al., 2003; MOINE e BIZARRI, 2003; KODAIRA, BRITO e FELINTO, 2003) devido sua persistência luminosa. As aplicações dos materiais luminescentes são inúmeras. Uma dessas aplicações é em tubos de televisores coloridos, onde são usados para produzir as três cores primárias: vermelha, azul e verde. As transições responsáveis por essas cores são
5D
0→ 7FJ (J=2) do íon Eu+3, emissão em 611 nm (vermelha); 5D0→ 7FJ (J=2) do íon
Tb+3, emissão em 550 nm (verde) e a transição 5d → 4f do íon Eu+2, emissão em
450 nm (azul). Os materiais luminescentes estão presentes em nosso dia-a-dia. Algumas aplicações destes materiais são representadas em fibras ópticas, lâmpadas fluorescentes, LEDs, tintas, vernizes, marcadores ópticos luminescentes, telas de computadores, detecção de radiação (raios- e elétrons), etc.
As características mais importantes dos fósforos são eficiência luminosa, reatividade, estabilidade e morfologia do pó, ou seja, quanto mais homogêneo melhor será o seu desempenho.
2.6.3 DIAGRAMA DE CROMATICIDADE
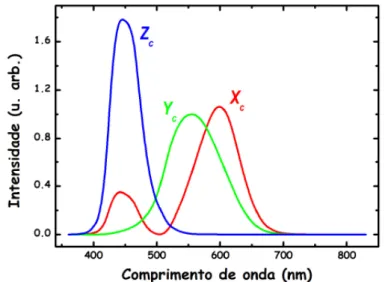
Figura 7: Diagrama de cromaticidade CIE, 1931
Fonte: http://www-cvrl.ucsd.edu/database/data/cmfs/cie
O diagrama consiste em uma representação de um espaço 2D em cujo interior estão representadas todas as cores perceptíveis ao olho humano, dentro do intervalo de comprimento de onda ( ) de 420 nm a 680 nm.
As funções de combinação de cor CIE1931 são funções matemáticas que representam a combinação de cores em termos de Xc( ), Yc( ) e Zc( ), essas
funções são mostradas na figura 8.
Figura 8: Funções XC, YC e ZC utilizadas para obtenção das coordenadas de cromaticidade
Para uma dada densidade de potência espectral P( ), o grau de excitação necessário para combinar uma cor de P( ) será dado pelas equações 1, 2 e 3
Nesse caso, X, Y e Z são os valores triestímulos que fornecem a potencia de cada uma das três cores primárias – vermelho, verde e azul – necessárias para combinar uma cor de P( ). Com esses valores triestímulos, podem ser encontradas as coordenadas de tricromaticidade em x e y a partir das equações 4 e 5:
x’ = X/ (X + Y + Z) (4) e y’ = Y/ (X+ Y+ Z) (5)
E o valor da tricromaticidade em z pode ser obtido de x e y, a partir da equação 6:
z' = X/ (X + Y + Z) (6)
Capítulo 3
3 MATERIAIS E MÉTODOS
No presente capítulo, serão apresentados os materiais de partida utilizados na rota de síntese para obtenção das nanopartículas de ZrO2 dopada com terras raras
(TR+3 = Eu+3, Tb+3 e Tm+3). Posteriormente, será feita a descrição do procedimento experimental empregado para caracterização das nanopartículas.
3.1 MATERIAIS
Os reagentes utilizados na rota de síntese são apresentados na tabela 2.
TABELA 2 – Reagentes utilizados nas sínteses de ZrO2: TR+3
REAGENTES FÓRMULA QUÍMICA MARCA PUREZA
Etileno glicol (EG) (HOCH2CH2OH) Synth 99%
Ácido cítrico (AC) (H3C6H5O7) Vetec 99,5%
Nitrato de Zircônia Hidratado [ZrO(NO3)2xH2O] Vetec 99%
Oxído de Túlio Tm2O3 Aldrich 99,9%
Nitrato de Térbio Pentahidratado [Tb(NO3).5H2O] Aldrich 99,9%
Oxído de Európio Eu2O3 Aldrich 99,9%
Hidróxido de amônio (NH4OH) CRQ
Ácido Nítrico HNO3 Synth 65%
3.2 MÉTODO DE SÍNTESE
respectivos precursores: nitrato de európio, nitrato de térbio e nitrato de túlio. Para os dopantes Eu+3 e Tm+3, foi necessário dissolver os óxidos Tm
2O3 e Eu2O3 em
aproximadamente 10 mL de HNO3 sob condição de agitação e a uma temperatura
de 70°C para formação dos respectivos nitratos. Desta forma foi possível solubilizar todos os dopantes no meio reacional. Estes reagentes foram estequiometricamente pesados e adicionados na solução de citrato de zircônio. Logo após, o pH da solução foi ajustado em 8, utilizando o hidróxido de amônio com a finalidade de estabilizar os cátions na solução. Depois que a solução estava completamente homogeneizada, foi adicionado o etileno glicol na proporção de ácido cítrico/etileno glicol (AC/EG) de 60/40 (em massa). A solução permaneceu sob agitação e com temperatura controlada por cerca de 4 horas, ocorrendo a reação de poliesterificação e evaporação do excesso de água.
Numa outra etapa a resina polimérica foi aquecida a uma temperatura de 350ºC por 4 horas. Nestas condições de aquecimento, iniciou-se a quebra das ligações do polímero com conseqüente expansão da resina pelo aprisionamento dos gases H2O, CO2 e CO Depois da decomposição, foi obtido um material
semicarbonizado. O material da pirólise foi desaglomerado em um almofariz e em seguida calcinado em temperaturas diferentes: 400ºC, 500ºC e 600ºC por 2 horas a uma taxa de aquecimento de 5ºC/min. Ao final da calcinação, foram obtidos óxidos particulados combinados quimicamente. As amostras foram caracterizadas pelas técnicas de TG e DSC, DRX, Espectroscopia na região do UV-Visível, e Fotoluminescência (FL).
Foram realizadas sínteses com dopantes diferentes (Eu+3, Tb+3, Tm+3) e, posteriormente, a co-dopagem entre estes cátions variando sua concentração em 1%, 2%, 4% e 8% mol TR+3. Cada amostra foi tratada termicamente nas
temperaturas de 400ºC, 500ºC e 600ºC. Para o sistema codopado, a amostra ZrO2: 8% TR+3 também foi calcinada a 800ºC e 1000ºC a fim de analisa a mudança no
Figura 9 - Fluxograma do procedimento experimental
3.3 TÉCNICAS DE CARACTERIZAÇÃO DAS PARTÍCULAS
As partículas de ZrO2 foram caracterizadas utilizando a técnica de análise de
difração de raios-X (DRX). A partir dos dados do DRX foram realizados os cálculos do tamanho de cristalito e parâmetros de rede. Foi estudado o comportamento térmico do material por meio de TG e DSC. Assim como caracterizado pelas técnicas de Espectroscopia na região do UV-visível e medidas de fotoluminescência (FL).
3.3.1 Análises Térmicas (TG e DSC)
substância e o material de referência são submetidos a uma programação controlada de temperatura (IONASHIRO e GIOLITO, 1980).
As duas análises foram realizadas de forma simultânea em um equipamento NETZSCH STA 449F3 empregando o fluxo de ar sintético de 70 mL/ min em cadinho de alumina. Foi aplicada a taxa de aquecimento de 5°C/ min, iniciando a análise a uma temperatura de 25°C com temperatura final de 700°C.
3.3.2 Difração de raios X (DRX)
As analises de difratometria de raios X foram realizadas nos pós de ZrO2:TR+3
em difratômetro Shimadzu /XRD-7000. Através desta técnica foi possível identificar a estrutura cristalina formada nas amostras. As condições de uso do equipamento no momento das analises foram: faixa de varredura de 5º a 80º, passo angular de 0,020º, velocidade de varredura 5º graus por minutos com radiação CuKα ( = 1,54 Å), de 40 kV e 30 mA.
3.3.2.1 Determinação do tamanho de cristalito
Com base nos resultados emitidos pelo DRX, pode se avaliar os parâmetros de rede da estrutura obtidos, como também determinar o tamanho médio dos cristalitos, partindo da equação de Scherrer:
D =
0,9λ
βcosθ
(7)com: 2= ( exp)2–( padrão)2 (8)
Onde representa o comprimento de onda utilizado, θ o ângulo de difração e B a largura à meia altura do pico de difração. Bexp é a largura meia altura do
padrão que tenha um tamanho de partícula muito grande (∼ 6 m). O silício foi utilizado como amostra padrão.
O parâmetro de rede foi calculado a partir do programa UnitCell – 97 (UNITCELL; 1997), através do refinamento a partir dos dados da difração de raios X do pó.
3.3.3 Método de Rietveld
As análises quantitativas dos raios X das amostras foram realizadas utilizando o método de Rietveld pelo software Maud versão 2.33. Através do método é possível realizar refinamento de cela unitária e da estrutura cristalina, simultaneamente, assim como realizar a análise quantitativa de fases, ou seja, é um método de refinamento que utiliza os dados de difração de raios X , por pó. A estrutura é refinada, de forma com que o difratograma calculado com base na estrutura cristalina, se aproxime do difratograma observado.
3.3.4 Fotoluminescência (FL)
As medidas de emissão fotoluminescentes das amostras ZrO2:TR+3 foram
3.3.5. Espectroscopia na região do UV-Visível (UV-Vis)
As análises de UV-Vis foram realizadas nas partículas de ZrO2:TR+3
calcinadas em diferentes temperaturas e em concentrações diferentes de TR+3. O
equipamento usado para esta análise foi o espectrofotômetro UV-Vis NIR Cary, modelo 5G. Os espectros foram obtidos na região entre 200 e 800 nm. Todas as medidas foram realizadas em temperatura ambiente.
A energia do gap óptico foi obtido pela extrapolação da curva de (Eα)2
tendendo a zero de acordo com o método de Tauc (1974). Na região de alta energia da curva de absorção, a energia do ―gap‖ é associada à absorbância conforme a Equação 6.
hαυ ∝(hυ – Eg)1/2 (9)
onde: h é a constante de Planck, υ (Hz) é a freqüência, α (cm-1) é o coeficiente de
absorção e o Eg (eV) é a energia do ―gap‖.
A absorbância pode ser calculada utilizando a expressão abaixo:
Capítulo 4
4. RESULTADOS E DISCUSSÃO
Neste capÍtulo serão apresentados os resultados das análises realizadas nas amostras, conforme descritas no capitulo anterior, em conjunto com suas caracterizações.
4.1- Análises Térmicas
As análises térmicas TG/DSC representadas na Figura 10 foram realizadas no material pré-calcinado da ZrO2 não dopada. A análise foi utilizada como um
estudo preliminar a fim de avaliar a melhor faixa de temperatura de calcinação para o desenvolvimento do trabalho. Através dos resultados, foram obtidas informações em relação à decomposição e perda de massa em diferentes etapas.
0 100 200 300 400 500 600 700
0 20 40 60 80
100 Exo
Temperatura (C)
T
G
(
%
)
-4 -2 0 2 4 6
D
S
C
/(
u
V
/m
g
)
De acordo com a curva de variação de massa (TG), é possível identificar três regiões diferentes. A primeira região, compreendida entre 25°C e 132°C, refere-se a uma perda de massa de 8 % associada à eliminação de H2O. A presença da água é
justificada como sendo um subproduto da reação de esterificação. Na segunda região, entre 132°C e 550°C, ocorre a maior perda de massa. A redução de 73% em massa está relacionada à eliminação de CO2 resultante da pirólise do polímero. Na
última região, situada entre 550°C e 700°C, não foi observada nenhuma alteração na massa. Nesta etapa acontece o inicio da cristalização com a formação das partículas de ZrO2. O Comportamento da zircônia com o aumento da temperatura ilustrado na
Figura 9 está de acordo com trabalhos encontrados na literatura (KULPINSKI et al, 2012 e REZAEI et al., 2009).
Na curva de DSC, é possível verificar a formação de um pico endotérmico próximo a 100°C, pertencente à perda de água do material, como indicado na curva da TG. A presença de um pico exotérmico a 520°é atribuída à liberação de energia do sistema decorrente da degradação (ΔH<0). Esta transição de segunda ordem é responsável pelo inicio da cristalização do material.
4.2 - Difração de Raios X (DRX)
As Figuras 11, 12 e 13 ilustram os difratogramas das amostras da ZrO2
dopadas com térbio, európio, túlio respectivamente. A figura 14 representa os difratogramas da ZrO2 codopada com íons de Tb+3, Eu+3 e Tm+3. Foi avaliada a
evolução microestrutural das fases formadas conforme apresentadas nas figuras abaixo. A ZrO2 foi dopada em diferentes concentrações de 1, 2, 4 e 8 mol% TR+3.
Para analisar o efeito do tratamento térmico na microestrutura do material, as amostras foram submetidas a temperaturas de calcinação de 400°C, 500°C e 600°C, com taxa de aquecimento de 5ºC/ minuto durante duas horas.
Observa-se inicialmente nos difratogramas a presença de uma única fase da ZrO2. Todos os picos de difração são referentes à fase tetragonal da zircônia e foram
30.02°, 50,21°, 59,91°, 62.53° e 74,42°, como reportado na literatura (YIZHU XIE et al., 2010). É possível observar o aumento da intensidade do pico principal (011) acompanhado de uma diminuição da largura meia altura (FWHM) para as amostras calcinadas a 600ºC, esse comportamento indica que estas amostras apresentam um maior grau de cristalinidade, conforme verificado na análise de tratamento térmico (Figura 9). Devido ao alargamento dos picos de difração, em razão do pequeno tamanho dos cristalitos, pode existir sobreposição dos picos na fase tetragonal e cúbica. A presença de fase cúbica é esperada para o sistema com maior teor de dopante segundo os autores DAS, S. et al., 2013.
Figura 11 -Difratogramas da Zr(1-x)TbxO2-δ, (a) x=0.01, (b) x=0.02, (c) x=0.04 e (d) x=0.08
30 40 50 60 70 80
I n te n si d a d e (u .a .)
2(graus)
400C 500C 600C
(0 1 1 ) (1 1 0 ) (1 1 2 ) (1 2 1 ) (0 0 4 )
(a)
(2 0 2 ) (2 2 0 )
30 40 50 60 70 80
I n te n si d a d e (u .a .)
2(graus)
400C 500C 600C
(2 0 2 ) (0 1 1 ) (1 1 0 ) (1 1 2 ) (1 2 1 ) (0 0 4 )
(b)
(2
2
0
)
30 40 50 60 70 80
In te n si d a d e (u .a .)
2(graus)
400C 500C 600C (c)
(2 2 0 ) (2 0 2 ) (0 1 1 ) (1 1 0 ) (1 1 2 ) (1 2 1 ) (0 0 4 )
30 40 50 60 70 80
In te n si d a d e (u .a .)
2(graus)
400C 500C 600C
(0 1 1 ) (1 1 0 ) (1 1 2 ) (1 2 1 ) (0 0 4 )
(d)
Figura 12 - Difratogramas da Zr(x)EuxO2-δ, (a) x=0.01, (b) x=0.02, (c) x=0.04 e (d) x=0.08
30 40 50 60 70 80
(2 2 0 ) (0 0 4 ) (2 0 2 ) (1 2 1 ) (1 1 2 ) (1 1 0 ) (0 1 1 ) In te n si d a d e (u .a .)
2(graus)
400C 500C 600C (a)
30 40 50 60 70 80
In te n si d a d e (u .a .)
2(graus)
400C 500C 600C
(0 1 1 ) (1 1 0 ) (1 1 2 ) (1 2 1 ) (0 0 4 ) (2 2 0 ) (c)
30 40 50 60 70 80
(2 2 0 ) (0 0 4 ) (1 2 1 ) (1 1 2 ) (1 1 0 ) (0 1 1 ) I n te n si d a d e (u .a .)
2(graus)
600C 500C 400C (d)
30 40 50 60 70 80
(2 2 0 ) (0 0 4 ) (2 0 2 ) (1 2 1 ) (1 1 2 ) (1 1 0 ) (0 1 1 ) I n te n si d a d e (u .a .)
2(graus)
Figura 13 - Difratogramas de Zr(1-x)TmxO2-δ, (a) x=0.01, (b) x=0.02, (c) x=0.04 e (d) x=0.08
30 40 50 60 70 80
I n te n si d a d e (u .a .)
2(graus)
400C 500C 600C
(c)
(0 1 1 ) (1 1 0 ) (1 1 2 ) (1 2 1 )30 40 50 60 70 80
I n te n si d a d e (u .a .)
2 (graus)
400C 500C 600C
(0 1 1 ) (1 1 0 ) (1 1 2 ) (1 2 1 ) (0 0 4 ) (2 2 0 ) (a)
30 40 50 60 70 80
I n te n si d a d e (u .a .)
2(graus)
400C 500C 600C
(0 1 1 ) (1 1 0 ) (1 1 2 ) (1 2 1 ) (d)
30 40 50 60 70 80
In te n si d a d e (u .a .)
2(graus)
400C 500C 600C
Figura 14 - Difratogramas de Zr(1-x)(Tb Eu Tm)x-δ O2, (a) x=0.01, (b) x=0.02, (c) x=0.04 e (d) x=0.08
A atribuição da estrutura cúbica e tetragonal, com base apenas na análise de difração de raios x pode se tornar difícil devido a semelhança do valor do parâmetro de rede (a) nas duas estruturas (a = 0,5124 nm para a fase cúbica e a= 0,094 nm e c = 0,5177 nm par fase tetragonal) ( SRINIVASAN et al., 1991). A estrutura tetragonal pode ser obtida a partir da estrutura cúbica, onde um dos eixos da estrutura fluorita é alongado devido ao deslocamento dos íons de oxigênio da sua posição ideal ao
30 40 50 60 70 80
I n te n si d a d e (u .a .)
2(graus)
400C 500C 600C (b) (1 2 1 ) (1 1 2 ) (1 1 0 ) (0 1 1 )
30 40 50 60 70 80
In te n si d a d e (u .a .)
2(graus)
400C 500C 600C (c) (1 2 1 ) (1 1 2 ) (1 1 0 ) (0 1 1 )
30 40 50 60 70 80
I n te n si d a d e (u .a .)
2(graus)
400C 500C 600C (d) (1 2 1 ) (1 1 2 ) (1 1 0 ) (0 1 1 )
30 40 50 60 70 80
I n te n si d a d e (u .a .)
2(graus)
longo do eixo c. A distinção das fases é observada através da divisão de alguns picos do DRX. No entanto, no caso de nano-pós devido ao alargamento dos picos, a divisão não é muito evidente. A espectroscopia Raman é a técnica mais adequada para distinguir as modificações da estrutura cristalina (SRIVASTAVA et al., 1974 e DAPIAGGI et al., 2010) devido a maior sensibilidade do espalhamento do Raman da determinação da simetria de um sistema cristalino (HESHMATPOU et al., 2012).
As Tabelas 3, 4, 5 e 6 apresentam os valores estimados do volume da célula unitária calculados pelo programa UnitCell – 97 (UNITCELL, 1997) e valores do tamanho do cristalito baseado na equação de Scherrer para Zr(1-x)TbxO2, Zr(1-x)EuxO2,
Zr(1-x)TmxO2 e Zr(1-x)(Tb Eu Tm)xO2 respectivamente. O pico dominante em todas as
amostras foi representado pelo índice de Miller (011) característico de estrutura tetragonal.
TABELA 3 - Dados cristalográficos das amostras Zr(1-x)TbxO2
Amostras Temperatura
(°C) cristalito (nm) Tamanho do
Volume Célula Unitária (Å)
Zr0,99Tb0,01O2
400 8,7 67,0145
500 9,50 67,0390
600 13,28 67,3072
Zr0,98Tb0,02O2
400 13,1 67,9259
500 13,27 67,3091
600 15,24 68,0536
Zr0,96Tb0,04O2
400 6,1 67,3729
500 6,57 67,7527
600 8,7 68,3170
Zr0,92Tb0,08O2
400 5,8 69,5127
500 6,6 69,1273
TABELA 4 - Dados cristalográficos das amostras Zr(1-x)EuxO2
Amostras Temperatura
(°C) cristalito (nm) Tamanho do
Volume Célula Unitária (Å)
Zr0,99Eu0,01O2
400 8,7 66,2045
500 8,75 66,6436
600 15,23 67,4651
Zr0,98Eu0,02O2
400 8,78 66,4864
500 8,80 67.2934
600 15,07 67,6782
Zr0,96Eu0,04O2
400 6,51 68,0835
500 8,77 68,2998
600 13,13 68,3250
Zr0,92Eu0,08O2
400 6,51 69,6543
500 8,77 69,5239
600 8,85 69,5127
TABELA 5 - Dados cristalográficos das amostras Zr(1-x)TmxO2
Amostras Temperatura
(°C) cristalito (nm) Tamanho do
Volume Célula Unitária (Å)
Zr0,99Tm0,01O2
400 10,5 66,2341
500 13,27 66,6436
600 15,7 67,6570
Zr0,98Tm0,02O2
400 13,1 67,3091
500 13,27 67,4259
600 17,12 68,1134
Zr0,96Tm0,04O2
400 5,83 67,3215
500 7,52 67,9259
600 15,23 68,8578
Zr0,92Tm0,08O2
400 10,8 68,5767
500 13,15 68,2201
TABELA 6 - Dados cristalográficos das amostras Zr(1-x)(Tb Eu Tm)xO2
Amostras Temperatura
(°C) cristalito (nm) Tamanho do
Volume Célula Unitária (Å)
Zr0,99(Tb.Eu.Tm)0,01O2
400 8 65,884
500 8.8 66,7036
600 9 67,5733
Zr0,98(Tb.Eu.Tm)0,02O2
400 7.3 66,5319
500 7.5 66,8557
600 8.75 67,3166
Zr0,96(Tb.Eu.Tm)0,04O2
400 5.51 66,8261
500 7.5 67,5613
600 7.7 68,0919
Zr0,92(Tb.Eu.Tm)0,08O2
400 5 68,6575
500 6.55 68,7185
600 7 69,0029
As Figuras 15, 16, 17 e 18 apresentam a evolução do tamanho do cristalito com o efeito do tratamento térmico no material assim como as mudanças ocorridas na célula unitária da zircônia em razão da concentração dos dopantes introduzidos na matriz.
É possível verificar pelas Figuras 15 -18 (a) que o tamanho do cristalito da zircônia em todos os sistemas apresenta um crescimento com o aumento da temperatura de calcinação. A cristalinidade é obtida via tratamento térmico. O crescimento de cristalito é acompanhado pelo aumento do grau de cristalinidade, fato que interfere na determinação do tamanho do cristalito a partir da equação de Scherrer (Equação 2). Um comportamento diferente foi apresentado pelas amostras Zr0,92Tb0,08O2 e Zr0,92Eu0,08O2 que obtiveram tamanhos de cristalitos bem inferiores
As Figuras 15 – 18(b) ilustram as mudanças ocorridas no volume da célula unitária da ZrO2 em razão do teor do dopante incorporado na matriz. Devido o raio
iônico do TR+3 (Tb+3, Eu+3, Tm+3) possuir maior valor que o raio iônico do Zr4+,
quando os íons Zr4+ são substituídos, ocorre um aumento no parâmetro de rede da
estrutura, em consequência disto há uma expansão no volume da célula unitária. Os íons Tb+3, Eu+3, Tm+3 apresentam os respectivos raios iônicos: 0,923 Å, 0,947 Å e 0,83 Å , o íon Zr4+ possui um raio iônico de 0,72 Å.
Figura 15 - (a) Relação tamanho do cristalito X temperatura, (b) Relação Volume da célula unitária X Tb+3 mol%
Figura 16 - (a) Relação tamanho do cristalito X temperatura, (b) Relação Volume da célula unitária X Eu+3 mol%
400 450 500 550 600 6 8 10 12 14 16 18 D (0 1 1 ) (n m )
Temperatura(C)
Zr0,99Tb0,01O2 Zr0,98Tb0,02O2 Zr0,96Tb0,04O2 Zr0,92Tb0,08O2 (a)
0 1 2 3 4 5 6 7 8
67,0 67,5 68,0 68,5 69,0 69,5 V o lu m e ( Å ) 3
Tb+3 (mol %)
400°C
500°C
600°C
(b)
400 450 500 550 600 6 7 8 9 10 11 12 13 14 15 16
Zr0,99Eu0,01O2 Zr0,98Eu0,02O2 Zr0,96Eu0,04O2 Zr0,92Eu0,08O2
D(0 1 1 )( n m )
Temperatura (C) (a)
0 1 2 3 4 5 6 7 8
66,0 66,5 67,0 67,5 68,0 68,5 69,0 69,5 V o lu m e ( Å )
Eu+3 (mol %)
400C 500C 600C
Figura 17 - (a) Relação tamanho do cristalito X temperatura, (b) Relação Volume da célula unitária X Tm+3 mol%
Figura 18 - (a) Relação tamanho do cristalito X temperatura, (b) Relação Volume da célula unitária X (Tb+3 Eu+3 Tm+3) mol %
400 450 500 550 600 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
Zr0,99Tm0,01O2 Zr0,98Tm0,02O2 Zr0,96Tm0,04O2 Zr0,92Tm0,08O2
D(0 1 1 )( n m )
Temperatura (C)
(a)
0 1 2 3 4 5 6 7 8
66,0 66,5 67,0 67,5 68,0 68,5 69,0 69,5 V o lu m e ( Å ) 3
Tm+3 (mol %)
400C 500C 600C
(b)
400 450 500 550 600 5,0 5,5 6,0 6,5 7,0 7,5 8,0 8,5 9,0 9,5 10,0 10,5 D(0 1 1 )( n m )
Temperatura (C)
Zr0,99(Tb Eu Tm)0,01O2
Zr0,98(Tb Eu Tm)0,02O
Zr0,96(Tb Eu Tm)0,04O Zr0,92(Tb Eu Tm)0,08O
(a)
0 1 2 3 4 5 6 7 8
65,5 66,0 66,5 67,0 67,5 68,0 68,5 69,0 V o lu m e ( Å ) 3
(Tb+3 Eu+3 Tm+3) (mol %) 400C
4.3 - Método de Rietveld (DRX)
Para um estudo mais detalhado, foram realizadas analises de refinamento de DRX pelo método de Rietveld usando o programa Maud v. 2.33 nas amostras de ZrO2 dopada a 8% de TR calcinada a temperatura de 600°C. Através desta análise é
possível identificar as fases cristalográficas existentes nas amostras assim como quantificá-las, visto que os picos de difração presentes nas Figuras 19 a 22 apresentam um grande alargamento, com possibilidade de haver sobreposições de picos da fases tetragonal e cúbica.
Os refinamentos pelo método de Rietveld foram realizados para as amostras Zr0,92Tb 0,08O2, Zr0,92Eu 0,08O2, Zr0,92Tm 0,08O2 e Zr0,92(Tb Eu Tm)0,08O2,
representados pelas Figuras 19, 20, 21 e 22 respectivamente. O perfil de difração calculado pelo programa é representado pela linha vermelha indicando a fase cúbica e pela linha verde indicando a fase tetragonal, o perfil obtido experimentalmente está representado pela linha azul. Para uma melhor compreensão do refinamento são utilizadas reflexões em ângulos de maiores para a determinação das proporções das fases cúbicas e tetragonal. As varreduras de alto ângulo entre 70° e 75° tem com o objetivo que identificar algum pico nesta região referente a fase tetragonal. Segundo alguns autores (SRINIVASAN, R. et al, 1991) nesta faixa há uma sensível discrepância nos posicionamentos dos picos das fases tetragonal e cúbica.