Estudo de materiais mesoporosos funcionalizados com diferentes aminas
para captura do dióxido de carbono através do processo de adsorção
Marcela Nascimento Barbosa
_________________________________________
Tese de Doutorado
Natal/RN, setembro de 2013
INSTITUTO DE QUÍMICA
MARCELA NASCIMENTO BARBOSA
ESTUDO DE MATERIAIS MESOPOROSOS FUNCIONALIZADOS COM DIFERENTES AMINAS PARA CAPTURA DO DIÓXIDO DE CARBONO ATRAVÉS
DO PROCESSO DE ADSORÇÃO
Tese submetida ao Programa de Pós-Graduação em Química da Universidade Federal do Rio Grande do Norte como requisito para obtenção do título de Doutor em Química.
Orientador: Prof. Dr. Antonio Souza Araujo
Co-Orientador: Prof. Dr. Enríque Rodríguez Castellón
UFRN / Biblioteca Central Zila Mamede. Catalogação da Publicação na Fonte.
Barbosa, Marcela Nascimento.
Estudo de materiais mesoporosos funcionalizados com diferentes aminas para captura do dióxido de carbono através do processo de adsorção. / Marcela NascimentoBarbosa. – Natal, RN, 2013.
108 f.: il.
Orientador: Prof. Dr. Antônio Souza de Araújo. Co-orientador: Prof. Dr. Enríque Rodriguez Castellón.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Instituto de Química. Programa de Pós-Graduação em Química.
1. Adsorção de CO2- Tese. 2. Peneiras moleculares mesoporosas -
Tese. 3. Funcionalização - Tese. 4. Amina - Tese. I. Araújo, Antônio Souza de. II. Castellón, Enríque Rodriguez. III. Universidade Federal do Rio Grande do Norte. IV. Título.
AGRADECIMENTOS
Meus sinceros agradecimentos:
A Deus, por TUDO.
A minha Família, Célia Barbosa (Mãe), Maricele Barbosa (Irmã) e minhas avós Antônia e Paú, pelo apoio, incentivo, presença e suporte emocional.
Ao meu Pai Mário Barbosa (in memorian) que partiu para as Graças do Senhor deixando
como lema e exemplo de vida: A honestidade, Bondade e Dignidade. Deixo aqui toda a minha admiração, respeito e eternas saudades.
Ao meu avô Pedro Moreira (in memorian) pelo exemplo de homem que sempre foi. Deixo
aqui toda a minha admiração e respeito.
Ao meu orientador, Prof. Dr. Antonio Souza Araujo, pela orientação, amizade, paciência e por ter me convidado a fazer parte de seu grupo de pesquisa.
A todos os colegas e amigos do Laboratório de Catálise e Petroquímica pelos bons momentos de convivência e amizade.
Ao meu Co-orientador no exterior, Prof. Dr. Enríque Rodrígues-Castellón, ao amigo Álvaro Reyes Carmona e a todos os colegas de trabalho da Universidad de Málaga pelo acolhimento e atenção durante minha estadia na Espanha.
Aos meus VerdadeirosAmigos que torceram pela concretização deste trabalho e por estarem sempre ao meu lado quando precisei.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pela bolsa concedida e incentivo na pesquisa.
RESUMO
A intensa utilização de máquinas e motores queimando combustíveis despeja na atmosfera imensas quantidades de dióxido de carbono (CO2), causando a intensificação do Efeito Estufa.
As mudanças climáticas que vêm ocorrendo no mundo estão diretamente relacionadas às emissões de gases de efeito estufa, principalmente CO2, devido, sobretudo, ao uso excessivo
de combustíveis fósseis. A busca por novas tecnologias para minimizar os impactos ambientais decorrentes deste fenômeno vem sendo investigadas. O sequestro de CO2 é uma
das alternativas que pode ajudar a minimizar as emissões desses gases. O CO2 pode ser
capturado pela tecnologia pós-combustão, através do processo de adsorção, utilizando adsorventes seletivos para este fim. Com este objetivo, foram sintetizados, pelo método hidrotérmico a 100ºC, materiais mesoporosos do tipo MCM-41 e SBA-15. Após as sínteses os materiais foram submetidos à etapa de calcinação e, posteriormente, funcionalizados com diferentes tipos de aminas (APTES, MEA, DEA e PEI), através do método de refluxo. As amostras funcionalizadas com as aminas foram testadas nos ensaios de adsorção de CO2 afim
de avaliar suas capacidades de adsorção, bem como, foram submetidas a diversas análises de caracterização no intuito de avaliar a eficiência do método utilizado para a funcionalização com as aminas. As técnicas físico-químicas utilizadas foram: Difração de Raios-X (DRX), Adsorção e Dessorção de nitrogênio (BET/BJH), Microscopia eletrônica de varredura (MEV), Microscopia eletrônica de transmissão (MET), Análise elementar CNH, Termogravimetria (TG/DTG) e Espectroscopia fotoeletrônica de Raios-X (XPS). Os ensaios de adsorção de CO2
foram realizados nas seguintes condições: 100 mg de adsorvente, temperatura de 25 ºC sob fluxo de 100 mL/min de CO2, pressão atmosférica e com variação no tempo de adsorção de
10 a 210 min. Os difratogramas de Raios-X juntamente com as micrografias eletrônicas de transmissão para as amostras sintetizadas e funcionalizadas, MCM-41 e SBA-15, apresentaram os picos característicos da formação de estrutura mesoporosa hexagonal, evidenciando que a estrutura do mesmo foi obtida. O método de refluxo utilizado foi eficiente segundo as análises de elementar e XPS, na qual, mostrou a presença das aminas nos materiais de partida. As amostras funcionalizadas de SBA-15 foram as que tiveram melhor potencial como adsorvente para captura de CO2 quando comparadas com as amostras de
MCM-41, obtendo a máxima capacidade de adsorção para a amostra SBA-15-P.
Palavras Chave: Peneiras moleculares mesoporosas. Adsorção de CO2. Funcionalização.
ABSTRACT
Intensive use of machinery and engines burning fuel dumps into the atmosphere huge amounts of carbon dioxide (CO2), causing the intensification of the greenhouse effect.
Climate changes that are occurring in the world are directly related to emissions of greenhouse gases, mainly CO2, gases, mainly due to the excessive use of fossil fuels. The
search for new technologies to minimize the environmental impacts of this phenomenon has been investigated. Sequestration of CO2 is one of the alternatives that can help minimize
greenhouse gas emissions. The CO2 can be captured by the post-combustion technology, by
adsorption using adsorbents selective for this purpose. With this objective, were synthesized by hydrothermal method at 100 °C, the type mesoporous materials MCM - 41 and SBA-15. After the synthesis, the materials were submitted to a calcination step and subsequently functionalized with different amines (APTES, MEA, DEA and PEI) through reflux method. The samples functionalized with amines were tested for adsorption of CO2 in order to
evaluate their adsorption capacities as well, were subjected to various analyzes of characterization in order to assess the efficiency of the method used for functionalization with amines. The physic-chemical techniques were used: X- ray diffraction (XRD), nitrogen adsorption and desorption (BET/BJH), scanning electron microscopy (SEM), transmission electron microscopy (TEM), CNH Analysis, Thermogravimetry (TG/DTG) and photoelectron spectroscopy X-ray (XPS). The CO2 adsorption experiments were carried out under the
following conditions: 100 mg of adsorbent, at 25 °C under a flow of 100 ml/min of CO2,
atmospheric pressure and the adsorption variation in time 10-210 min. The X-ray diffraction with the transmission electron micrographs for the samples synthesized and functionalized, MCM-41 and SBA-15 showed characteristic peaks of hexagonal mesoporous structure formation, showing the structure thereof was obtained. The method used was efficient reflux according to XPS and elemental analysis, which showed the presence of amines in the starting materials. The functionalized SBA -15 samples were those that had potential as best adsorbent for CO2 capture when compared with samples of MCM-41, obtaining the maximum
adsorption capacity for SBA-15-P sample.
LISTA DE FIGURAS
Figura 1 - Representação esquemática do Efeito Estufa... 21
Figura 2 - Emissões dos Gases de Efeito Estufa no Brasil e no Mundo... 23
Figura 3 - Emissão total de gases do efeito estufa... 24
Figura 4 - Tecnologias para captura de CO2... 25
Figura 5 - Nomenclatura da adsorção... 27
Figura 6 - Adsorção física: atração entre as moléculas de uma superfície sólida e de um fluido... 28
Figura 7- Representação das Fases Estruturais da Família M41S... 34
Figura 8 - Materiais da família M41S: imagens de microscopia eletrônica de transmissão e difratograma de raios-X com os índices de Miler e as distâncias interplanares: (a) MCM-41, (b) MCM-48 e (c) MCM-50... 35
Figura 9 - Representação da isoterma de adsorção/dessorção de N2 para um material mesoporoso ordenado... 36
Figura 10 - Formação da estrutura hexagonal da peneira molecular... 37
Figura 11 - Padrões de Difração de Raios-X e Isoterma de Adsorção e Dessorção da SBA-15... 38
Figura 12 - Representação da estrutura da SBA-15 em 3D partindo da análise de microscopia de transmissão... 39
Figura 13 - Representação do mecanismo de interação do CO2 com o suporte a base de sílica funcionalizada com amina... 40
Figura 14 - Ilustração da funcionalização de grupos funcionais orgânicos ® em materiais mesoporsos... 41
Figura 15 - Sistema utilizado para a síntese hidrotérmica dos materiais mesoporosos... 42
Figura 16 - Fluxograma do procedimento de síntese da peneira molecular mesoporosa MCM-41... 44
Figura 17 - Fluxograma do procedimento de síntese da peneira molecular mesoporosa SBA-15... 45
refluxo... 48
Figura 20 - Sistema utilizado para os Ensaios de adsorção de CO2... 52
Figura 21 - Difratogramas de Raios-X das amostras de MCM-41 antes e após a funcionalização... 56
Figura 22 – Difratogramas de Raios-X das amostras de SBA-15 antes e após a funcionalização... 57
Figura 23 - Isotermas de adsorção e dessorção do MCM-41... 60
Figura 24 - Isotermas de adsorção e dessorção do MCM-41-A... 60
Figura 25 - Isotermas de adsorção e dessorção do MCM-41-P... 60
Figura 26 - Isotermas de adsorção e dessorção do MCM-41-M... 61
Figura 27 - Isotermas de adsorção e dessorção do MCM-41-D... 61
Figura 28 - Isotermas de adsorção e dessorção da SBA-15... 61
Figura 29 - Isotermas de adsorção e dessorção da SBA-15-A... 62
Figura 30 - Isotermas de adsorção e dessorção da SBA-15-P... 62
Figura 31 - Isotermas de adsorção e dessorção da SBA-15-M... 62
Figura 32 - Isotermas de adsorção e dessorção da SBA-15-D... 63
Figura 33 - Representação da formação do MCM-41... 66
Figura 34 - Micrografia eletrônica de varredura do MCM-41... 66
Figura 35 - Micrografias eletrônicas de varredura das amostras de MCM-41 com aminas... 67
Figura 36 - Micrografia eletrônica de varredura da SBA-15... 68
Figura 37 - Micrografias eletrônicas de varredura das amostras de SBA-15 com aminas 68 Figura 38 - Micrografia eletrônica de transmissão do MCM-41... 70
Figura 39 - Micrografia eletrônica de transmissão do MCM-41-A... 70
Figura 40 - Micrografia eletrônica de transmissão do MCM-41-D... 71
Figura 41 - Micrografia eletrônica de transmissão do MCM-41-M... 71
Figura 42 - Micrografia eletrônica de transmissão do MCM-41-P... 72
Figura 43 - Micrografia eletrônica de transmissão da SBA-15... 72
Figura 44 - Micrografia eletrônica de transmissão da SBA-15-A... 73
Figura 45 - Micrografia eletrônica de transmissão da SBA-15-D... 73
Figura 46 - Micrografia eletrônica de transmissão da SBA-15-M... 74
Figura 47 - Micrografia eletrônica de transmissão da SBA-15-P... 74
Figura 48 - Espectro fotoeletrônico geral do MCM-41... 75
Figura 50 - Espectro fotoeletrônico geral do MCM-41-D... 76
Figura 51 - Espectro fotoeletrônico geral do MCM-41-M... 77
Figura 52 - Espectro fotoeletrônico geral do MCM-41-P... 77
Figura 53 - Espectro fotoeletrônico geral da SBA-15... 78
Figura 54 - Espectro fotoeletrônico geral da SBA-15-A... 78
Figura 55 - Espectro fotoeletrônico geral da SBA-15-D... 79
Figura 56 - Espectro fotoeletrônico geral da SBA-15-M... 79
Figura 57 - Espectro fotoeletrônico geral da SBA-15-P... 80
Figura 58 - Espectros XPS N1s das amostras de MCM-41 funcionalizadas... 81
Figura 59 - Espectros XPS N1s das amostras de SBA-15 funcionalizadas... 82
Figura 60 - Curvas TG das amostras funcionalizadas MCM-41... 85
Figura 61 - Curvas TG das amostras funcionalizadas SBA-15... 86
Figura 62 - Capacidade de adsorção de CO2 das amostras de MCM-41 pura e funcionalizadas... 88
Figura 63 - Capacidade de adsorção de CO2 das amostras de SBA-15 pura e funcionalizadas... 88
Figura 64 - Modelo cinético de Pseudo-primeira ordem para as amostras de MCM-41... 91
Figura 65 - Modelo cinético de Pseudo-primeira ordem para as amostras de SBA-15... 92
Figura 66 - Modelo cinético de Pseudo-segunda ordem para as amostras de MCM-41... 92
LISTA DE TABELAS
Tabela 1 - Comparação abreviada dos dois tipos de adsorção... 29
Tabela 2 - Composições molares dos géis de sínteses dos materiais de partida... 43
Tabela 3 - Estruturas das Aminas Funcionalizadas... 47
Tabela 4 - Denominação para os materiais funcionalizados com aminas... 48
Tabela 5 - Parâmetros do arranjo hexagonal mesoporoso das amostras puras e funcionalizadas com aminas... 58
Tabela 6 - Propriedades texturais dos materiais sintetizados e funcionalizados. 64 Tabela 7 - Quantidade atômica dos elementos analisados por XPS... 83
Tabela 8 - Percentuais da composição elementar CHN das amostras... 84
Tabela 9 - Percentuais de perdas de massa das amostras funcionalizadas... 87
Tabela 10 - Capacidades de adsorção de CO2 dos materiais... 90
Tabela 11 - Parâmetros cinéticos de adsorção de Pseudo-primeira ordem dos materiais... 93
Tabela 12 - Parâmetros cinéticos de adsorção de Pseudo-segunda ordem dos materiais... 93
LISTA DE EQUAÇÕES
Equação 1 - n = ∆m / MM(CO2)... 52
Equação 2 - C. A. = n / m(ads)... 52
Equação 3 - dqt/dt = K1(qe-qt)………. 53
Equação 4 - log (qE - qt) = log (qE) – (K1/2,303) t... 53
Equação 5 - dqt/dt = K2(qe-qt)2………... 53
Equação 6 - t/qt = 1/ (K2qe2) + (1/qe)t... 54
Equação 7 - h = K2qe2... 54
Equação 8 - 1/d2(h,k,l) = 4(h2 + hk + k2) / 3ao2 + l2/c2... 55
Equação 9 - ao = 2 / raiz quadrada de 3 x d100... 55
Equação 10 - λCuKα = 2d(100) senθ... 55
LISTA DE ABREVIATURAS
MCM-41 e SBA-15 - Peneiras moleculares mesoporosas. BET - Área superficial conforme Brunauer-Emmett-Teller. BJH - Barret-Joiyner-Halenda.
CMC - Concentração micelar crítica. CTMABr - Brometo de cetiltrimetilamônio. APTES – 3-aminopropriletoxisilano
MEA – monoetanolamina DEA – dietanolamina PEI - polietilenoimina DRX - Difração de raios-X. TG – Termogravimetria.
IPCC - Intergovernmental panel on climate change.
IUPAC - International Union of Purê and Applied Chemistry (União internacional de
química pura e aplicada).
IV - Infravermelho..
LCT - Liquid crystal template.
M41S - Família de materiais mesoporosos que agrega a MCM-41, MCM-48 e MCM-50. MCM - Mobil’s composition of matter.
SUMÁRIO
1 INTRODUÇÃO... 17
2 OBJETIVOS... 19
2.1 GERAL... 19
2.2 ESPECÍFICOS... 19
3 REVISÃO BIBLIOGRÁFICA... 20
3.1 GASES DE EFEITO ESTUFA... 20
3.2 SEQUESTRO DE CARBONO E SUSTENTABILIDADE... 21
3.2.1 Tecnologias para Captura do Dióxido de Carbono... 25
3.2.1.1 Adsorção... 26
3.2.1.2 Absorção... 31
3.2.1.3 Separação por Membranas... 32
3.2.1.4 Criogenia... 33
3.3 MATERIAIS MESOPOROSOS DO TIPO MCM-41 E SBA-15... 33
3.4 FUNCIONALIZAÇÃO COM AMINAS PARA APLICAÇÃO EM ADSORÇÃO... 39
4 METODOLOGIA EXPERIMENTAL... 42
4.1 SÍNTESE DOS MATERIAIS MESOPOROSOS... 42
4.2 FUNCIONALIZAÇÃO DOS MATERIAIS MESOPOROSOS... 46
4.3 CARACTERIZAÇÃO DOS MATERIAIS MESOPOROSOS... 48
4.3.1 Difração de Raios-X... 49
4.3.2 Adsorção e Dessorção de Nitrogênio... 49
4.3.3 Microscopia Eletrônica de Varredura... 49
4.3.4 Microscopia Eletrônica de Transmissão... 50
4.3.5 Espectroscopia Fotoeletrônica de Raios-X... 50
4.3.6 Análise Elementar CHN... 51
4.3.7 Termogravimetria... 51
4.4 ENSAIOS DE ADSORÇÃO DE CO2... 51
4.5 ESTUDO CINÉTICO DE ADSORÇÃO DE CO2... 53
5 RESULTADOS E DISCUSSÕES... 55
5.1 CARACTERIZAÇÃO DOS MATERIAIS... 55
5.1.1 Difração de Raios-X... 55
5.1.3 Microscopia Eletrônica de Varredura... 65
5.1.4 Microscopia Eletrônica de Transmissão... 69
5.1.5 Espectroscopia Fotoeletrônica de Raios-X... 75
5.1.6 Análise Elementar CHN... 83
5.1.7 Termogravimetria... 84
5.2 ENSAIOS DE ADSORÇÃO... 87
5.3 ESTUDO CINÉTICO DE ADSORÇÃO DE CO2... 91
6 CONCLUSÕES... 96
1 INTRODUÇÃO
Acompanhamos, quase que diariamente, através de jornais, revistas, televisão e publicações científicas algumas catástrofes climáticas e as mudanças que estão ocorrendo, rapidamente, no clima mundial. Nunca se viu mudanças tão rápidas e com efeitos devastadores como têm ocorrido nos últimos anos por causa do tão debatido tema atual, denominado de aquecimento global. Este fenômeno climático, de larga extensão, é conhecido devido ao aumento da temperatura média da superfície da Terra que vem acontecendo nos últimos 50 anos. Entretanto, o significado deste aumento de temperatura é objeto de muitos debates entre os cientistas. Causas naturais ou antropogênicas (provocadas pela ação humana) têm sido propostas para explicar o fenômeno. Recentemente, muitos metereologistas e climatólogos têm afirmado publicamente que considera provado que as causas antropogênicas realmente estão influenciando na ocorrência do fenômeno. O IPCC (Painel Intergovernamental para as Mudanças Climáticas, estabelecidO pelas Nações Unidas e pela Organização Metereológica Mundial em 1988), no seu relatório mais recente, diz que a maioria do aquecimento observado durante os últimos 50 anos se deve muito, provavelmente, a um aumento do efeito estufa, havendo forte evidência de que o aquecimento seja devido a atividades humanas levando a emissões de gases de efeito estufa, sendo o principal deles o CO2, para a atmosfera (TAVONI, 2013).
As emissões de CO2 de origem antrópica ocorrem a partir da queima proposital ou
acidental de diferentes produtos orgânicos pelo ser humano: carvão, madeira e combustíveis fósseis (óleo diesel, gasolina e outros derivados de petróleo), principalmente. Assim, a geração de CO2 ocorre em atividades corriqueiras, domésticas, comerciais e industriais
(produção de aço, de cimento, de alumínio, de papel), tais como queima de carvão ou de lenha para churrasco ou de madeira em padarias, em cerâmicas e em outras indústrias. Também gera CO2 o uso de veículos motorizados, como motocicletas, caminhões, automóveis, aviões,
tratores e até mesmo aqueles movidos com biocombustíveis. Existem muitas técnicas que poderiam ser utilizadas para a redução dos níveis de CO2 na atmosfera, desde a diminuição do
consumo de energia, aumento da eficiência dos equipamentos para conversão e utilização de energia, substituição dos combustíveis por outros com menor conteúdo de carbono (por exemplo, gás natural ao invés de carvão), uso de biocombustíveis e a captura e armazenamento de CO2, gerado a partir de combustíveis fósseis ou emitidos a partir de
Se tratando de captura de CO2, os estudos tendem, por razões práticas, a concentrar-se
em conhecer melhor e aprimorar tecnologias já existentes ao longo das últimas décadas. No contexto de tecnologias existentes para captura de CO2 a partir de efluentes gasosos de
queima, os processos de adsorção podem ser uma alternativa para minimizar as emissões desses gases. Pesquisadores de vários países vêm buscando novas metodologias no aprimoramento de adsorventes para a captura de CO2, sendo o grande desafio atual encontrar
2 OBJETIVO
Neste capítulo segue o objetivo geral, bem como, os objetivos específicos do presente trabalho desenvolvido.
2.1 OBJETIVO GERAL
Sintetizar, funcionalizar e caracterizar os materiais mesoporosos com diferentes aminas, pelo método de refluxo e, posteriormente, aplicar os mesmos no processo de adsorção de CO2 visando à captura de gases emitidos de correntes gasosas industriais.
2.2 OBJETIVOS ESPECÍFICOS
Sintetizar os materiais mesoporosos tipo MCM-41 e SBA-15 pelo método hidrotérmico;
Funcionalizar, utilizando o método de refluxo, os materiais mesoporosos sintetizados com as aminas: 3-aminopropiltrietoxsilano (APTES), monoetanolamina (MEA), dietanolamina (DEA) e polietilenoimina (PEI).
Caracterizar os materiais obtidos por diversas técnicas físico-químicas de análises, tais como: Difração de raios-X (DRX), Termogravimetria (TG), Microscopia eletrônica de varredura (MEV), Microscopia eletrônica de transmissão (MET), Adsorção e Dessorção de nitrogênio (BET), Espectroscopia fotoeletrônica de Raios-X (XPS) e Análise elementar CHN;
Realizar os ensaios de adsorção de CO2 com os materiais funcionalizados e avaliar
suas potencialidades para a captura do CO2;
Determinar o percentual de carbono nas amostras funcionalizadas após os ensaios de adsorção de CO2 por Espectroscopia Fotoeletrônica de Raios-X;
3 REVISÃO BIBLIOGRÁFICA
3.1 GASES DE EFEITO ESTUFA
O fenômeno de efeito estufa, de acordo com a Figura 1 (Ramanathan et al. 1989), é
um processo que ocorre quando uma parte da radiação infravermelha emitida pela superfície da terra é absorvida por determinados gases presentes na atmosfera, sendo estes denominados de gases de efeito estufa (GEE). Como consequência, o calor fica retido, não sendo liberado para o espaço. O efeito estufa dentro de uma determinada faixa de temperatura é de vital importância, pois, sem ele, a vida como conhecemos não poderia existir. Este fenômeno mantém o planeta aquecido, garantindo a manutenção do mesmo. Uma parte dos raios do sol que irradiam a terra é absorvida e transformada em calor, outra parte deles é refletida pela superfície da terra de volta para o espaço (LUTGENS e TARBUCK, 1998).
Na atmosfera terrestre, os gases que absorvem a radiação infravermelha são principalmente o vapor d’água (H2O), o gás carbônico (CO2) e o ozônio (O3). Boa parte do
efeito estufa em nosso planeta deve-se à existência do gás carbônico: a radiação infravermelha é facilmente absorvida pelas moléculas de CO2, aumentando suas vibrações. Nuvens são
também importantes absorvedoras de radiação infravermelha. De fato, a água interage de diferentes maneiras com a radiação infravermelha, em todos os seus estados físicos. Outros absorvedores de radiação infravermelha são o metano (CH4), o óxido nitroso (NO2) e os
clorofluorcarbonos (CFC’s). Estes gases são capazes de reter as radiações infravermelhas na atmosfera e sem eles a radiação solar se dissiparia no espaço e o planeta seria cerca de 30 °C mais frio.
No mundo moderno, a intensa utilização de máquinas e motores queimando combustíveis despeja na atmosfera imensas quantidades de dióxido de carbono (CO2): cerca
Figura 1 - Representação esquemática do Efeito Estufa.
Fonte: (RAMANATHAN et al. 1989).
As mudanças climáticas que vêm ocorrendo no mundo, em escala cada vez maior, estão diretamente relacionadas às emissões de gases de efeito estufa, principalmente o dióxido de carbono (CO2), devido, sobretudo, ao uso excessivo de combustíveis fósseis. Grande parte
destes gases é produzida pela natureza, mas o acréscimo gerado pelo homem através da intensa atividade industrial e pelo aumento da demanda de energia primária no mundo está acarretando um desequilíbrio dos ciclos naturais do planeta. Na busca de soluções para reduzir as emissões e mitigar os efeitos das mudanças climáticas, a comunidade científica mundial, com apoio de empresas e governos, tem se dedicado a pesquisar e desenvolver tecnologias que suportem tal desafio (CIFUENTES, 2001).
3.2 SEQUESTRO DE CARBONO E SUSTENTABILIDADE
últimos 250 anos a utilização de combustíveis fósseis (carvão, petróleo e gás natural) para a produção de energia elétrica, aquecimento, indústria e transportes levou a um aumento significativo do CO2 emitido para a atmosfera. A utilização intensiva desses combustíveis
eleva as concentrações de gases estufa, contribuindo para o aquecimento global. Portanto, existe uma correlação direta do aumento das concentrações de CO2 na atmosfera com o
aumento da temperatura na Terra. É necessário rapidamente um conjunto de ações para impedir que as concentrações dos Gases com Efeito de Estufa na atmosfera, nomeadamente o CO2, aumentem. Concentrações superiores a 450 ppm têm uma elevada probabilidade de
causar aumentos de temperatura média superior a 2 ºC, com consequências potencialmente catastróficas a nível global (IPCC, 2007).
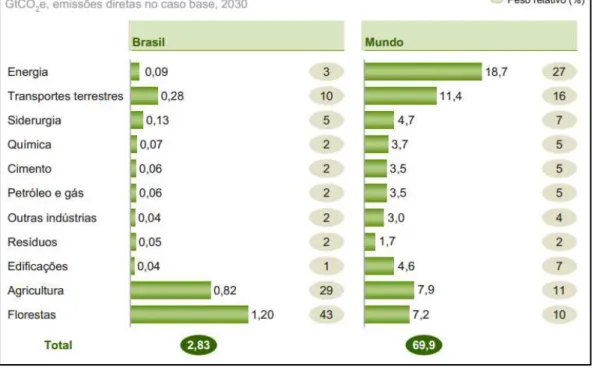
Se compararmos as emissões do Brasil hoje e em 2030 com o restante do mundo (Figura 2), observaremos comportamentos muito distintos. Uma das principais diferenças entre o Brasil e o restante do mundo é que, enquanto na média as emissões do setor de energia são as mais importantes (27%), no Brasil elas são a segunda exatamente abaixo em termos de menor peso (1,7%). O setor de transporte terrestre, outro setor de altíssima relevância para a média global, tem apenas peso moderado no País. Em oposição, os setores de agricultura e floresta, de relevância mediana na média global (22%), são os de maior destaque no País (72%). A minimização da emissão de CO2, contribuindo para diminuição do efeito estufa e
outros fenômenos climáticos, pode ser obtida por separação dos demais gases industriais, para utilização ou estocagem, usando tecnologia economicamente viável. Este gás tem excelentes aplicações que podem justificar o investimento para a sua obtenção, tais como na indústria de alimentos e de bebidas, na indústria química, em clínicas e hospitais e na recuperação avançada de poços maduros de petróleo, através da variação da viscosidade do óleo, sendo esta última uma das maiores perspectivas de mercado, onde grandes quantidades deste gás poderão ser usadas para aumentar a produção de óleo. As principais fontes de CO2 que podem
ser consideradas para o mercado de recuperação avançada de petróleo são as fontes naturais de reservatórios subterrâneos de CO2, subprodutos industriais com a purificação de gás
natural e produção de gás de síntese e emissões gasosas industriais. Destas, as fontes de menor custo é o CO2 de reservatórios subterrâneos e de subprodutos industriais. No entanto, a
Figura 2 - Emissões dos Gases de Efeito Estufa no Brasil e no Mundo.
Fonte: (MCT, 2010)
Mais recentemente, foi incorporada a visão ecológica como ação do efeito sinérgico do processo, já que entre os diversos gases poluentes, o dióxido de carbono é um dos principais gases geradores do efeito estufa. Atualmente, apesar de alguns autores considerarem que mesmo as investigações científicas altamente complexas ainda não são avançadas o suficiente para fornecer conclusões irrefutáveis acerca de como controlar e retroceder a poluição ambiental, especialmente à poluição atmosférica (DIG-IPP, 2008), pode-se verificar que muitas disposições adotadas em vários países estão sendo capazes de, ao menos, diminuir a taxa de aumento dos principais poluentes. O seqüestro de CO2 é
reconhecido pelo Protocolo de Quioto como um dos meios de se conseguir as reduções das emissões atmosféricas e se praticar a sustentabilidade (SAIKKU et al, 2008).
O conceito de desenvolvimento sustentável surgiu em 1987, como o “desenvolvimento que atende às necessidades do presente sem comprometer a habilidade de futuras gerações atenderem às suas próprias necessidades”. Tal conceito indica que a única forma de progresso sustentável é aquela que considera simultaneamente aspectos econômicos, ambientais e sociais (JOHNSTON et al., 2007). Neste sentido, a criação do mecanismo de créditos de
carbono visa a incentivar o investimento em práticas de redução das emissões de CO2.
variando de acordo com a atividade desenvolvida. Dessa forma, os créditos obtidos por reflorestamento valem menos do que aqueles resultantes da instalação de equipamentos capazes de reduzir a emissão de poluentes de uma unidade industrial.
O aspecto ecológico da retirada de CO2 do meio ambiente foi ainda mais contemplado
pela valorização econômica do processo, por que a legislação de cada país vinculado a este Protocolo determina os volumes máximos de emissão do gás. Um dos processos de remoção de CO2 mais difundidos industrialmente é a absorção utilizando aminas. Essa tecnologia é
comprovada industrialmente, com menor investimento e custo, para purificação a partir de gases de queima. No entanto, o processo de absorção utilizando soluções de aminas apresenta desvantagens como à corrosão dos equipamentos durante certo uso destas soluções de aminas (POLASEK e BULLIN, 1982).
Neste cenário, desponta a busca por processos aperfeiçoados e cada vez mais eficientes para o sequestro econômico de CO2 proveniente de fontes de emissões
estacionárias, evitando sua liberação à atmosfera. Assim, processos aprimorados para a captura de CO2 de correntes gasosas efluentes de plantas energéticas à base de combustíveis
fósseis são de essencial importância hoje. A meta do Departamento de Energia Americano é ter o potencial de sequestrar o total significativo de 1 Gt C/ano em 2025 e de 4 Gt C/ano em 2050 (DOE, 1999).
A Figura 3 apresenta a projeção das emissões de gases do efeito estufa dos países desenvolvidos e em desenvolvimento nos próximos 20 anos.
Figura 3 - Emissão total de gases do efeito estufa.
Fonte: (DOE, 1999) Países Desenvolvidos
3.2.1 Tecnologias para Captura do Dióxido de Carbono
Uma maneira de reduzir a quantidade de CO2 liberada ao meio ambiente seria contar
com mais fontes de energia alternativa que não produzem CO2. Essas alternativas incluem
energia hidrelétrica, eólica, nuclear, geotermal e das marés. Cada uma delas tem limitações e seria difícil fazer uma mudança rápida dos combustíveis fósseis para essas outras fontes. Desta forma, a captura de CO2 tem um grande potencial para fazer uma diferença relevante na
quantidade de dióxido de carbono emitida ao meio ambiente (KTEJO, 2009).
O método de captura de CO2 consiste em três etapas distintas. A primeira etapa é a
captura do CO2 de correntes gasosas emitidas durante a produção de energia, processos
industriais ou processamento de combustíveis. Segunda etapa consiste em transportar o CO2
capturado através de tubovias ou tanques, e por fim, a terceira etapa seria armazenar o gás em lençóis profundos de águas salinas, jazidas esgotadas de petróleo e gás ou em minas de carvão.
Muitos programas internacionais têm se dedicado à avaliação e desenvolvimento de tecnologias para a separação de CO2 de correntes industriais gasosas. As tecnologias para
captura de CO2 podem ser sub-divididas em tecnologias de pós-combustão, de pré-combustão
e de combustão com oxigênio, conforme a Figura 4.
Figura 4 - Tecnologias para captura de CO2.
Nas tecnologias de pós-combustão, consideradas o primeiro passo em projetos de captura de larga escala, o CO2 é separado dos gases exaustos após a combustão. Fontes de
CO2 provenientes de combustão em turbinas a gás, fornos e caldeiras totalizam um grande
montante deste gás lançado na atmosfera e logo, melhorar a economicidade de processos de captura em pós-combustão tem um papel crítico no esforço para mitigação das emissões. As tecnologias que se apresentam em processos industriais em pós-combustão são a absorção, a adsorção, a separação criogenica e as membranas semipermeáveis. Nas tecnologias de pré-combustão o gás natural ou combustível gaseificado é convertido em hidrogênio e CO2 em
uma reforma a vapor seguida de uma conversão de CO a CO2 (reação de “shift”). O CO2 a
alta pressão é separado do hidrogênio e comprimido para armazenamento, enquanto que o hidrogênio é enviado para combustão com o ar, gerando apenas nitrogênio e água. Na combustão com oxigênio o oxigênio puro é obtido de processo de separação do ar e empregado na combustão. O gás exausto é constituído apenas de CO2 e água, da qual o CO2 é
facilmente separado por condensação da água (TONTIWACHWUTHIKUL, 1996; SANTOS e DAVISON, 2006).
3.2.1.1 Adsorção
Denomina-se adsorção o processo onde uma molécula, o adsorvato/adsorbato, forma uma ligação com a superfície, adsorvente. A Figura 5 ilustra a nomenclatura da adsorção (adsorbato e adsorvente). A adsorção é um processo de interfaces gás/sólido. A área superficial é uma das características que afeta a capacidade adsorptiva de um determinado adsorvente (AKASH; O’BRIEN, 1996). As forças intermoleculares entre gases tais como, CO2 e a superfície de certos materiais sólidos, permitem a separação por adsorção. Conforme
Figura 5 - Nomenclatura da adsorção.
Fonte: (AKASH; O’BRIEN, 1996).
A adsorção física, também chamada de fisissorção, é um fenômeno pelo qual as moléculas de um fluido (gás, vapor ou líquido) são atraídas para uma superfície sólida, em função de uma força resultante da descontinuidade existente nas moléculas desta mesma superfície. A Figura 6, adaptada segundo Cardoso (1987), mostra que uma partícula situada em regiões internas de um sistema condensado (sólido) encontra-se em equilíbrio, pois a resultante das forças que atuam sobre ela é zero. A resultante de forças (R) é a responsável pela interação entre as moléculas de um fluido e a superfície de um sólido, gerando uma força de atração que pode se propagar por múltiplas camadas. Um fenômeno observado cotidianamente e que envolve forças de atração semelhantes a essas é a condensação de vapor d’água na superfície de um espelho. Estas forças são tipicamente conhecidas como forças de Van der Waals, de acordo com Ruthven (1984).
Adsorvarto
Figura 6 - Adsorção física: atração entre as moléculas de uma superfície sólida e de um fluido.
Fonte: (CARDOSO, 1987).
A partir deste princípio é possível o desenvolvimento de materiais sólidos específicos para a separação de componentes de uma mistura, combinando o fenômeno da adsorção física com outros, como o de peneira molecular e a utilização de sítios iônicos, para obter um sólido altamente seletivo a determinadas espécies moleculares.
A adsorção química, também chamada de quimissorção, é específica e é empregada na separação de misturas. Nela as moléculas (ou átomos) unem-se a superfície do adsorvente através da formação de ligações químicas (geralmente covalentes) e tendem a se acomodarem em sítios que propiciem o maior número de coordenação possível com o substrato. Uma molécula quimicamente adsorvida pode ser decomposta em virtude de forças de valência dos átomos da superfície e é a existência de fragmentos moleculares adsorvidos que responde, em parte, pelo efeito catalítico das superfícies sólidas.
Tabela 1 - Comparação abreviada dos dois tipos de adsorção.
Parâmetro Adsorção Física Adsorção Química
Adsorvente Todos os sólidos Alguns sólidos
Adsorvido Todos os gases (abaixo da
temperatura crítica) Todos os gases
Temperatura Baixa Alta
Calor de Adsorção Baixo (=ΔH cond.) Alto(=ΔH reação)
Taxa de adsorção Rápida Lenta
Cobertura Várias camadas Monocamada
Reversibilidade Reversível Irreversível
Importância Determinação da área
superficial e tamanho do poro Área de centros ativos e para a elucidação da cinética da
reação FONTE: BARBOSA, 2013.
A escolha do adsorvente a ser empregado no processo de adsorção é baseada, sobretudo, na seletividade e na capacidade de adsorção do sólido em relação ao que se quer separar ou capturar. Para a separação do CO2 dos gases de queima, a literatura indica que os
adsorventes mais adequados são as Zeólitas do tipo X, em especial a Zeólita 13X, que tem tamanho de poro superior ao diâmetro crítico molecular do dióxido de carbono (> 4,0 ºA) (SIRIWARDANE, 2000).
As propriedades de adsorção e dessorção da Zeólita 13X, da Zeólita natural ZS500A e do carvão ativado para separação do CO2 de uma mistura gasosa contendo 15% de CO2, 82%
de N2, 3% de O2 e mais vapor d’água foram estudadas por Siriwardane et al. (2000). Os
experimentos foram conduzidos tanto à pressão atmosférica quanto a altas pressões. Para a Zeólita 13X, os autores reportaram resultados bastante satisfatórios em ambos os casos. Os testes indicaram também maior seletividade desta Zeólita para o CO2 que pelos demais
constituintes da carga. Por sua vez, os testes realizados com carvão ativado indicaram maior capacidade de adsorção, porém, com menor capacidade de dessorção que a Zeólita 13X, ou seja, o CO2 adsorvido não é totalmente recuperado durante a etapa de dessorção, não sendo
preferencial pelo CO2 em comparação com os outros componentes presentes na corrente
gasosa. Os testes com a Zeólita natural ZS500A apresentaram resultados similares aos da Zeólita 13X, porém esta apresentou maior capacidade de captação do CO2.
Gomes e Yee (2002) desenvolveram trabalho experimental para separação de CO2 de
gás exausto pelo processo PSA (Pressure Swing Adsorption). No sistema estudado, a pureza
do N2 aumentou de 30 para 90% em presença de He como gás inerte. A concentração de CO2
presente na carga era de 10% ou menor. Em seus estudos os autores testaram alguns adsorventes, como as zeólitas 5A e 13X, com peneira molecular de carvão e com alumina. Concluíram que a zeólita 13X é a mais adequada para a separação do CO2 devido a sua alta
capacidade e características de adsorção adequadas.
Chue (1995) publicou um trabalho comparando o desempenho do carvão ativado e da zeólita 13X para a recuperação de CO2 de gases de queima por simulação do processo PSA.
Para tanto, o autor levantou isotermas de CO2 e N2 puros e a curva de equilíbrio da mistura
CO2/N2 para a zeólita 13X a 15 ºC e 830 mmHg. Dois tipos de cargas foram considerados: a
primeira com relação entre composição volumétrica de N2/CO2. O modelo foi desenvolvido
como sendo um processo adiabático, não isotérmico. Neste trabalho, o autor concluiu que a zeólita 13X é mais eficiente para este fim. Os autores reportam ainda ser possível obter uma pureza de 99% de CO2 com recuperação de 53% e 70%, respectivamente, para os dois tipos
de carga.
A zeólita 5A, por possuir diâmetro nominal de poro de 4,3 Aº, também pode ser utilizada para este fim. Crittenden e Thomas (1998), estudando a transferência de calor durante a adsorção, apresentaram curvas experimentais relacionando a taxa de CO2 captado
com o tempo a várias pressões para a zeólita 5A.
A capacidade de adsorção de CO2 de materiais a base de sílica modificados com
poliaminas, de acordo com estudos recentes, variou entre 0,25 e 2,8 mol/kg utilizando temperatura de adsorção de aproximadamente 70 oC (EBNER, 2012). O máximo de adsorção foi atingido à medida que houve um aumento da temperatura do sistema. Estes resultados mostram a importância de avaliar tanto a natureza do adsorvente como também das condições utilizadas no processo de adsorção.
Xu et al. (2002) estudaram um novo tipo de sólido adsorvente mesoporoso para
capturar CO2 na forma condensada nos poros. Peneira molecular do tipo MCM-41 de
adsorção de CO2 aumentou consideravelmente em comparação com o material mesoporoso
puro.
Estudos mais recentes vêm se dedicando intensivamente a investigar diversos tipos de materiais como alternativa de encontrar eficientes adsorventes na adsorção de CO2. No
entanto, alguns autores, além de buscarem novos adsorventes, buscam aprimorar as condições do processo de adsorção no intuito de obter resultados satisfatórios e promissores (GENGGENG, 2012; TANJA et al, 2012; YOUSSEF, 2011; ALIAKBAR, 2011;
REYNOLDS et al., 2012).
3.2.1.2 Absorção
A separação do dióxido de carbono de correntes gasosas esteve historicamente, em grande parte, atrelada às necessidades de separação do CO2 de gás de síntese, em plantas de
amônia. No processo de absorção o mesmo deve ser conduzido a pressões mais elevadas que a atmosférica, o que é favorável à absorção de uma maneira geral.
Na produção de gás de síntese, após a passagem pelo módulo de reatores de “shift” a maior parte do monóxido de carbono é convertida a dióxido de carbono, cuja remoção é crítica para a própria operação de plantas de amônia. O gás de processo que entra no sistema de remoção de CO2 consiste em uma mistura de nitrogênio, hidrogênio e dióxido de carbono
junto com pequenas quantidades de monóxido de carbono e outros componentes secundários. Removendo o gás carbônico do gás de processo não apenas diminui a quantidade de gases inertes na planta de amônia, como também remove um veneno que afeta o catalisador do conversor de amônia. Portanto, o conteúdo de gás carbônico no gás de síntese deve ser reduzido para valores, tipicamente, na faixa de 5 a 10 ppm em volume. A pressão do gás nestas unidades é de, no mínimo, 10 atm abs, sendo que há uma tendência das novas tecnologias em operar a pressões mais elevadas (PAITON, 1992).
Com a alta do preço do petróleo nos anos 80, houve um interesse em se recuperar CO2
Dentre as aminas mais comumente empregadas industrialmente, destacam-se as aminas primárias, como a monoetanolamina (MEA), as aminas secundárias, como a dietanolamina (DEA) e a diisopropanolamina (DIPA), aminas terciárias, como a Nmetildietanolamina (MDEA) e as aminas estericamente impedidas, como a 2-amino-2- metil-1-propanol (AMP). De todas as aminas mencionadas, a MEA distingue-se por sua maior reatividade. Contudo, apesar de seu baixo custo, a operação do processo de absorção com este solvente é significantemente mais cara, principalmente devido a: (i) grande quantidade de energia requerida para a regeneração do solvente; (ii) problemas operacionais como corrosão e formação irreversível de produtos de degradação do solvente com CO2, COS e CS2 e (iii)
maiores perdas do solvente por vaporização, devido a sua alta pressão de vapor (SHEILAN et al, 2007). Além disso, a MEA tem como desvantagem o fato de não ser seletiva na absorção de CO2 ou H2S.
3.2.1.3 Separação por Membranas
A separação de CO2 por membranas é uma tecnologia relativamente nova, embora seja
largamente usada na recuperação de hidrogênio. A aplicação comercial da separação de CO2
de metano por membranas tem sido utilizada com sucesso no tratamento de gás natural, recuperação de CO2 avançada de petróleo, entre outros. Nestes casos específicos, quando a
corrente de gás está a baixas pressões, a absorção por aminas é notadamente o processo mais viável economicamente, porém, quando esta corrente está a altas pressões, utilização de membrana pode vir a ser a tecnologia mais adequada. Este é o caso da corrente de gás de poço, provenientes da produção de petróleo e gás natural. Nesta corrente, a composição de CO2 varia consideravelmente durante a produção. Na literatura pode-se encontrar exemplos
de processos industriais de separação de gases por membrana. (NUNES e PEINEMANN, 2001).
membranas comerciais para separação de gases são fabricadas com celulose modificada, polissulfona tratada ou policarbonato substituído. Elas são, em geral, construídas de uma camada de separação não porosa muito fina sobre uma membrana porosa não seletiva para dar suporte à membrana porosa.
Os polímeros orgânicos são os materiais mais usados na separação de gases por membrana por possuírem seletividade adequada para esse fim. Ligas de paládio são os únicos materiais inorgânicos usados para separação de gases em escala comercial. Entretanto, nos últimos anos, a literatura especializada reporta que estudos com materiais inorgânicos têm sido desenvolvidos com resultados promissores para algumas misturas e sua comercialização parece ser eminente.
3.2.1.4 Criogenia
A destilação criogênica é um processo baseado na separação da mistura de gases por condensação e destilação a baixa temperatura. É atualmente o sistema mais utilizado para a produção em larga escala de O2 da separação de ar, porém os custos operacionais são altos.
Esta técnica tem sido utilizada na separação de líquidos e para liquefazer o CO2 – após a
separação, em alta concentração – por um longo tempo (LI et al, 2011). Entretanto, a
separação criogênica de CO2 é considerada menos efetivo que a absorção (DAMEN, 2006).
Como acontece com a maioria das novas tecnologias, para torná-las viáveis, técnica e economicamente, é necessária a utilização de muitas pesquisas visando à melhoria das já existentes e a descoberta de novos processos e materiais de alta eficiência.
3.3 MATERIAIS MESOPOROSOS DO TIPO MCM-41 E SBA-15
De acordo com a classificação proposta pela União Internacional de Química Pura e Aplicada, IUPAC, dependendo do tamanho de poro presente na estrutura do material, os sólidos porosos podem ser divididos em três categorias: microporosos, mesoporosos e macroporosos. Os sólidos microporosos compreendem poros com dimensões inferiores a 2 nm, os mesoporosos entre 2 e 50 nm e os macroporosos superiores a 50 nm (SING,1982). Dentre esses materiais, os mesoporosos têm despertado grande interesse e levado pesquisadores à preparação e investigação de seu potencial em várias áreas.
alta área específica, estes materiais estão sendo bastante promissores como adsorventes em processos de adsorção (PÉREZ-QUINTANILLA et al, 2006), sensores ópticos (CHEYSSAC
et al, 2006), na área de catálise (TAGUCHI e SCHUTH, 2005), liberação de fármacos
(VALLET-REGI et al, 2001).
A descoberta de uma nova classe de peneiras moleculares mesoporosas possibilitou novas oportunidades para a concepção de catalisadores heterogêneos. Foi a partir da década de 90, precisamente no ano de 1992, que pesquisadores da Móbil Oil Corporation anunciaram
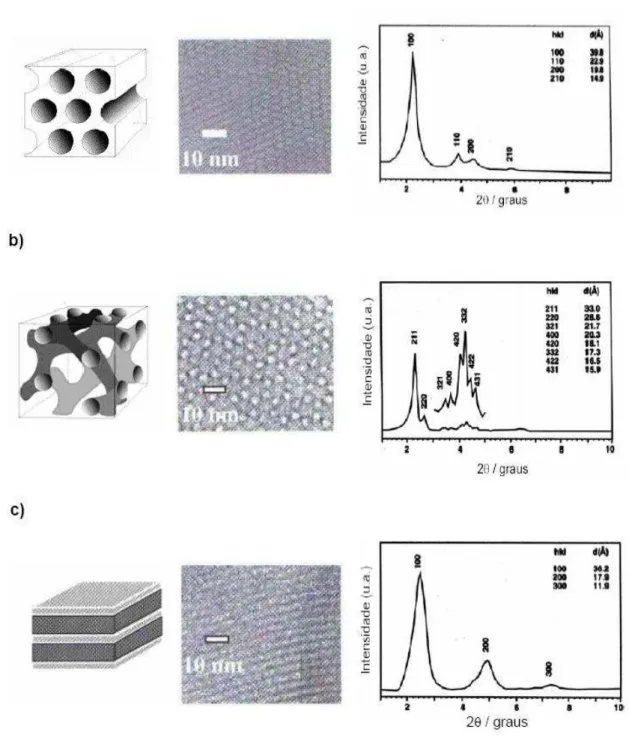
o surgimento desta família denominada de M41S. Encontramos nesta família alguns membros com estruturas hexagonal, cúbica e lamelar. De acordo com os pesquisadores, a fase hexagonal corresponde à peneira molecular MCM-41 apresentando sistema de poros unidimensional, a fase cúbica representa a peneira molecular MCM-48 apresentando sistema de poros tridimensional e a fase lamelar correspondente à peneira molecular MCM-50 (SAYARI, 1996). A Figura 7 apresenta as três fases estruturais pertencentes à família M-41S.
Figura 7 - Representação das Fases Estruturais da Família M41S.
Fonte: (SAYARI, 1996).
De maneira geral, essa nova classe de peneiras moleculares mesoporosas pode ser identificada pelas seguintes propriedades fundamentais (ROTH e VARTULI, 2005):
A presença de pelo menos um pico de difração em pequenos ângulos (Figura 8a).
Figura 8 - Materiais da família M41S: imagens de microscopia eletrônica de transmissão e difratograma de raios-X com os índices de Miler e as distâncias interplanares: (a) MCM-41,
(b) MCM-48 e (c) MCM-50.
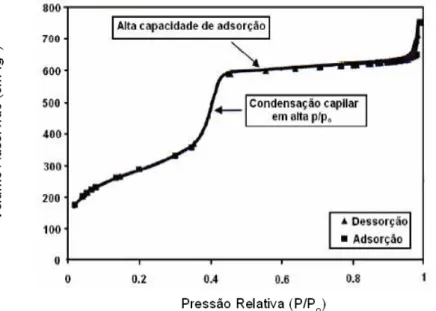
Figura 9 - Representação da isoterma de adsorção/dessorção de N2 para um material
mesoporoso ordenado.
Fonte: (ROTH e VARTULI, 2005)
A preparação de sílicas mesoporosas requer, pelo menos, três reagentes em quantidades apropriadas: uma fonte de sílica, um surfactante (direcionador) e um solvente (usualmente água). Outros reagentes, tais como: ácidos, bases, sais e co-solventes, também podem ser utilizados no intuito de aprimorar a qualidade final do material. O mecanismo de formação de sílicas mesoporosas ordenadas é basicamente um processo de auto-agregação de moléculas de surfactante, que funcionam como direcionadores estruturais, seguido da precipitação de um precursor inorgânico.
Neste processo, um surfactante e um solvente são misturados ocasionando a formação de micelas, cuja morfologia pode variar dependendo do tipo de surfactante. Em seguida, a fonte de sílica é adicionada à solução e um ácido ou uma base desencadeia a hidrólise do precursor de sílica transformando-o em um sol de oligômeros de silício. As interações entre os oligômeros e as micelas de surfactante resultam em uma reação de precipitação de um gel que gera a mesoestrutura. Durante essa etapa, ocorre a condensação dos oligômeros de silício. Dependendo das condições de síntese, as fases supramicelares podem evoluir de hexagonais para cúbicas ou lamelares. Quando o molde é removido por um determinado método de extração, obtém-se a sílica mesoporosa com um conjunto de cavidades que constituem, em certo modo, uma réplica da morfologia das micelas formadas durante o processo de síntese (HATTON et al, 2005). A Figura 10 mostra o esquema de síntese de sílica mesoporosa para a
Figura 10 - Formação da estrutura hexagonal da peneira molecular.
Fonte: (HATTON et al, 2005).
Após a descoberta das peneiras moleculares do tipo MCM-41 em 1992, seis anos depois uma nova família de materiais a base de sílica com mesoporos altamente ordenados foi sintetizada em um meio de acidez média pelo uso de copolímeros tri-blocos não iônicos comercialmente disponíveis (EOnPOmEOn, onde n e m são os números de monômeros) com extensos blocos de óxidos de polietileno (EO)n e óxidos de polipropileno (POm) (ZHAO, FENG e HUO, 1998). Diferentes materiais com diversos arranjos periódicos foram preparados e denominados materiais SBA (Santa Barbara acids). Uma extensa variedade de materiais SBA’s foram reportados na literatura, entre eles SBA-1 (cúbico) (KAO, WU e CHENG, 2006), 11 (cúbico), 14 (lamelar) (ZHAO, HUO e FENG, 1998), e SBA-16 (cúbico de corpo centrado) (VOORT, BENJELLOUN e VANSANT, 2002). A SBA-15 atraiu imediatamente muita atenção e agora é a mais intensamente estudada estrutura SBA (MEYNEN, COOL e VANSANT, 2009).
Zhao em 1998 reportou a síntese da SBA-15 com poros uniformes e largos e paredes finas, de 31 a 64 Å, usando condições ácidas e baixas concentrações do copolímero tri-bloco de estrutura EO20-PO65-EO20. O tamanho dos poros e a espessura da parede podem ser ajustados variando a temperatura (35º a 140ºC) e o tempo (11 a 72 horas) da reação.
interação entre diferentes alcanos e surfactantes. Surfactantes co-polimeros não iônicos possuem um grande número de monômeros e por essa razão podem possuir várias configurações.
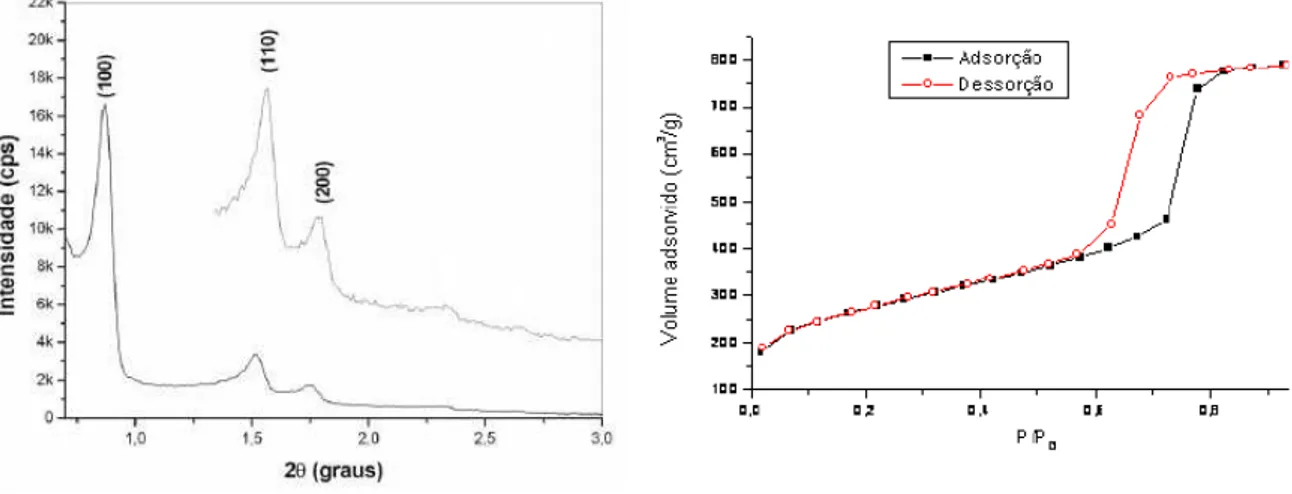
A Figura 11 apresenta duas técnicas que caracterizam a obtenção das peneiras moleculares mesoporosas do tipo SBA-15, sendo a figura 11a o difratograma padrão de Raios-X do material mesoporoso e a figura 11b a sua isoterma de adsorção e dessorção de N2.
Os planos cristalográficos em (100), (110) e (200), em ângulos entre 0,5 e 3,0o, mostrados no difratograma padrão são características de estruturas com plano de simetria P6mm, a qual é relacionada às estruturas com ordenamento hexagonal (ZHAO et al, 1998a, b). A isoterma (figura 11b) é classificada pela IUPAC como do tipo IV com histerese do tipo I (CIOLA, 1981; LEOFANTI et al, 1998). Este tipo de isoterma, associada a histerese do tipo I é
características de materiais com mesoporos cilíndricos e de tamanho uniforme, nos quais, acontece a condensação capilar durante a dessorção do nitrogênio, ocasionando a histerese (LEOFANTI et al., 1998; SONWANE e LUDOVICE, 2005).
Figura 11 - Padrões de Difração de Raios-X e Isoterma de Adsorção e Dessorção da SBA-15.
Fonte: (COUTINHO, 2006).
Figura 12 - Representação da estrutura da SBA-15 em 3D partindo da análise de microscopia de transmissão.
Fonte: (FREDDY, 2006).
A metodologia hidrotermal é usada para induzir a completa condensação, solidificação e melhoria na organização do material, a temperatura e pressão moderadas. Através desse método se tem alcançado materiais do tipo MCM-41 e SBA-15 com arranjos hexagonais bastante organizados (WANG et al, 2011; FURTADO et al, 2011).
3.4 FUNCIONALIZAÇÃO COM AMINAS PARA APLICAÇÃO EM ADSORÇÃO
Materiais mesoporosos do tipo MCM-41 e SBA-15 já se mostraram promissores em várias áreas de pesquisa, sendo uma delas na catálise e adsorção. No caso da adsorção de CO2
estes materiais podem ser utilizados como adsorventes para captura deste gás, no entanto, sabe-se que, na forma pura estes materiais possuem baixa capacidade de adsorção de CO2,
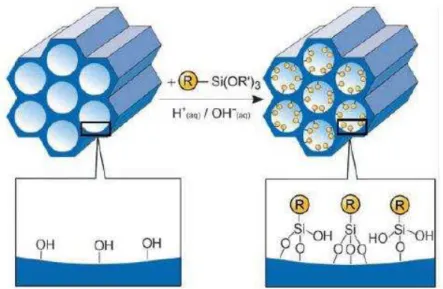
pois, não possuem sítios ativos para promover a interação com o dióxido de carbono. Com base nesse contexto, algumas alternativas vêm sendo estudadas no intuito de melhorar a capacidade de adsorção destes materiais, sem que isso interfira na sua estrutura promissora, bem como, nas suas características básicas. A funcionalização com aminas é uma das maneiras que se pode realizar para aumentar a capacidade de adsorção destes materiais, visto que, trabalhos de (XU et al, 2002), a introdução de grupos aminas em MCM-41 faz com que
este, aumente seu caráter como adsorvente elevando sua capacidade de adsorção de CO2. A
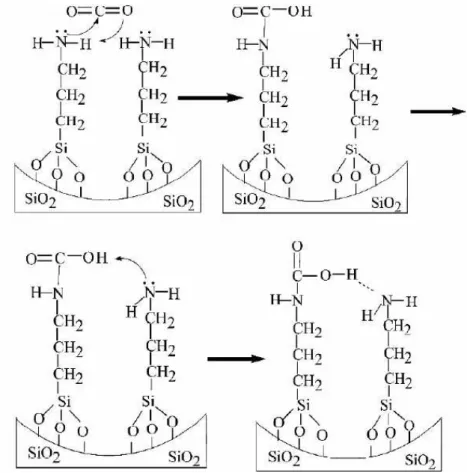
Figura 13 mostra como ocorre o mecanismo de ligação de uma amina funcionalizada no suporte mesoporoso com o dióxido de carbono. O grupo amina RNH2 possui átomo de
carbono formando ligações e por fim, estabilizando a quimissorção com o CO2. Como mostra
o mecanismo, a impregnação de grupos funcionais orgânicos adequados eleva o potencial do adsorvente favorecendo o processo de adsorção (ZHAO et al, 2007).
Figura 13 - Representação do mecanismo de interação do CO2 com o suporte a base de sílica
funcionalizada com amina.
Fonte: (ZHAO et al, 2007).
Figura 14 - Ilustração da funcionalização de grupos funcionais orgânicos R em materiais mesoporsos.
Fonte: (FROBA et al, 2006).
4 METODOLOGIA EXPERIMENTAL
Neste capítulo segue toda metodologia experimental realizada com os materiais mesoporosos sintetizados e funcionalizados, bem como, a metodologia empregada em todas as técnicas de caracterização físico-químicas utilizadas neste trabalho. Além disso, descreve os Ensaios realizados de adsorção de CO2 do tratamento cinético.
4.1 SÍNTESE DOS MATERIAIS MESOPOROSOS
Para a obtenção dos materiais mesoporosos do tipo MCM-41 e SBA-15 foi utilizado o método hidrotérmico, sendo o sistema apresentado na Figura 15.
Figura 15 – Sistema utilizado para a síntese hidrotérmica dos materiais mesoporosos.
Fonte: (BARBOSA, 2009).
Para a realização das sínteses das peneiras moleculares mesoporosas do tipo MCM-41 e SBA-15, foram utilizados os seguintes reagentes de partida:
Autoclave
MCM-41
Fonte de Silício – Sílica Gel (Aldrich, 95%);
Fonte de Sódio – Hidróxido de Sódio (Vetec, 99%);
Surfactante – Brometo de Cetiltrimetilamônio (CTMABr, Vetec, 98 %);
Solvente – Água destilada (H2O);
Solução para correção do pH – Ácido Acético (CH3COONa, 30 %).
SBA-15
Fonte de Silício – Tetraetilortosilicato (TEOS, Sigma-Aldrich, 98%);
Direcionador estrutural - Pluronic P123 (Copolímero Tribloco, BASF);
Fonte Ácida - Ácido clorídrico (Merck, HCl, 37%);
Solvente - Água destilada (H2O);
O MCM-41 foi sintetizado pelo método hidrotérmico de acordo com o procedimento experimental adaptado das sínteses de Araujo e Jaroniec (2000a) e de diversos trabalhos da literatura (BECK et al., 1992; SAYARI, 1996). Já a SBA-15 foi obtida de acordo com o
procedimento experimental de Zhao et al, (1998a).
As sínteses foram realizadas em recipientes em teflon de 200 mL introduzidos no interior do sistema (bloco digestor) (figura 15). A Tabela 2 mostra a composição molar dos géis de sínteses dos materiais.
Tabela 2 - Composições molares dos géis de sínteses dos materiais de partida.
Materiais Mesoporosos Composição do Gel
MCM-41 1 CTMABr. 2 NaOH. 4 SiO2. 200 H2O
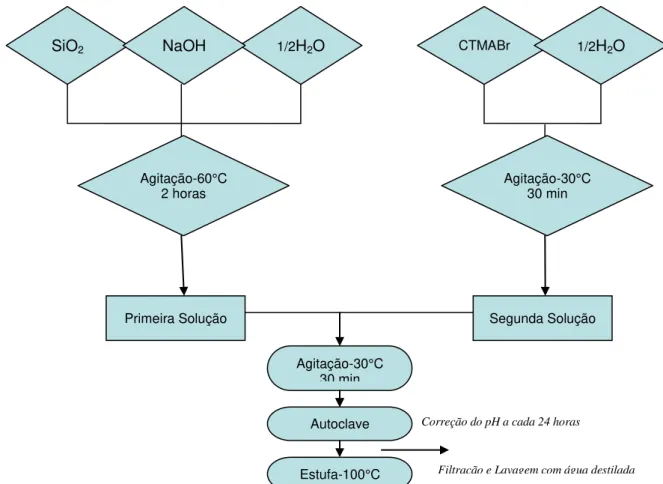
Para a obtenção da peneira molecular mesoporosa do tipo MCM-41, o gel de síntese foi preparado com a seguinte composição em gramas: 17,1125 CTMABr. 3,7348 NaOH. 11,6835 SiO2. 165 H2O. A síntese é baseada na preparação de duas soluções, onde a primeira
contem a fonte de silício, sódio e metade da água destilada, e a segunda contem o direcionador e a outra metade da água destilada. A primeira solução foi mantida sob agitação constante a 60 ºC durante 2 horas, enquanto que a segunda foi mantida em agitação apenas por 30 minutos em temperatura de aproximadamente 30 ºC. Posteriormente, a segunda solução foi adicionada à primeira, sob agitação por mais 30 minutos, a temperatura de 30 ºC. Em seguida, a mistura resultante foi inserida ao recipiente de teflon e, este último, levado para o bloco digestor, em aquecimento a 100 oC. O período de síntese do material foi de 5 dias consecutivos, sendo realizada a cada 24 horas a correção do pH do gel de síntese na faixa entre 9-10, utilizando a solução de ácido acético a 30 %. Finalmente, ao término da síntese, o material foi filtrado a vácuo, lavado com aproximadamente 100 mL de água destilada, seco em estufa, a uma temperatura de 100ºC e, em seguida, calcinado. Este procedimento de síntese do MCM-41 está representado esquematicamente na Figura 16.
Figura 16 - Fluxograma do procedimento de síntese da peneira molecular mesoporosa MCM-41.
SiO2 NaOH 1/2H2O CTMABr 1/2H2O
Primeira Solução Segunda Solução
Agitação-30°C 30 min
Autoclave
Estufa-100°C
Correção do pH a cada 24 horas
Agitação-60°C 2 horas
Agitação-30°C 30 min
Para a obtenção da peneira molecular mesoporosa do tipo SBA-15 foi utilizado o copolímero tribloco pluronic P123 (poli(óxido de etileno)-poli(óxido de propileno)-poli(óxido de etileno), PEO20PPO70PEO20)), ácido clorídrico 37%, água destilada e o tetraetilortosilicato
(TEOS). Inicialmente, foi adicionado ao P123 a água destilada e, em seguida, o ácido clorídrico, sob agitação e aquecimento a uma temperatura igual a 35 oC, durante duas horas, no intuito da dissolução completa do copolímero P123. Posteriormente, adicionou-se a fonte de sílica (TEOS) a esta solução. A mistura resultante foi mantida sob agitação a 35 oC durante 24 horas com valor de pH entre 0 e 1, para obtenção de um gel colóide. Após esse período o gel de síntese foi transferido para um recipiente de teflon e levado para o bloco digestor, sendo mantido sob aquecimento a 100 oC por 48 horas. Finalmente, ao término da síntese, o material foi filtrado a vácuo, lavado com 2% de ácido clorídrico em etanol, seco em temperatura ambiente e em seguida calcinado. Este procedimento de síntese da SBA-15 está representado esquematicamente na Figura 17.
Figura 17 -Fluxograma do procedimento de síntese da peneira molecular mesoporosa SBA-15.
Filtração e Lavagem com ácido/ álcool
Após a síntese hidrotérmica dos materiais lavados e secos, os mesmos foram submetidos à etapa de calcinação. Esta etapa foi necessária para a remoção do material orgânico presente nos canais mesoporosos dos materiais sintetizadas, assim como para obter o material final desejado. O sistema utilizado para este processo está representado na Figura 18. A calcinação do MCM-41 foi realizada a uma temperatura de 450 ºC durante 2 horas com uma rampa de aquecimento de 10ºC mim-1, sendo uma hora sob fluxo de nitrogênio e, após, mais uma hora sob fluxo de ar sintético, totalizando às duas horas de calcinação. Para a calcinação da SBA-15 o mesmo procedimento foi utilizado, no entanto, sem fluxo de nitrogênio e a uma temperatura igual a 550 oC durante 6 horas.
Figura 18- Sistema utilizado para a calcinação das peneiras moleculares mesoporosas MCM-41 e SBA-15. Onde: 1 e 2 – cilindros de nitrogênio e ar sintético respectivamente, 3 – válvula de seleção de gases, 4 – adsorvente para retenção de umidade, 5 – válvula de ajuste de vazão,
6 – forno e 7 – amostra.
Fonte: (CALDEIRA, 2011)
4.2 FUNCIONALIZAÇÃO DOS MATERIAIS MESOPOROSOS
temperatura de 70 0C, 1 grama de material mesoporoso, 3 mL de amina e 30 mL de solvente, ficando sob agitação durante 24 h. Posteriormente, o material foi filtrado e lavado com 50 mL de etanol e secos em seguida a 100 0C durante 24 h. Os materiais após funcionalizados foram denominados segundo a Tabela 4.
Tabela 3 - Estruturas das Aminas Funcionalizadas.
Aminas/Sigla Estrutura da Amina
APTES
MEA
DEA
Figura 19 - Sistema utilizado para a funcionalização das aminas pelo método de refluxo.
Tabela 4 – Denominação para os materiais funcionalizados com aminas.
Material Sintetizado Amina Denominação do material funcionalizado
MCM-41 APTES MCM-14-A
MEA MCM-41-M
DEA MCM-41-D
PEI MCM-41-P
SBA-15 APTES SBA-15-A
MEA SBA-15-M
DEA SBA-15-D
PEI SBA-15-P
4.3 CARACTERIZAÇÃO DOS MATERIAIS MESOPOROSOS
4.3.1 Difração de Raios-X (DRX)
Os difratogramas de Raios-X dos materiais do tipo SBA-15 foram obtidos através da varredura angular de 0,5 a 5 oC em um equipamento Rigaku modelo Mini Flex II, utilizando radiações de CuKα, em uma voltagem de 30 k/V e corrente de tubo de 30 m. A abertura da fenda foi de 0,15 oC e o feixe foi defasado em relação a amostra com velocidade de 0,5omin-1 e passo de 0,01o. Para a obtenção dos difratogramas de Raios-X dos materiais do tipo MCM-41 foi utilizada a mesma metodologia da SBA-15, porém, a distinção foi apenas no intervalo do ângulo 2θ de varredura: 1 a 10 oC.
4.3.2 Adsorção e Dessorção de Nitrogênio
As propriedades texturais dos materiais sintetizados e funcionalizados foram avaliadas a partir das isotermas de adsorção e dessorção de nitrogênio a -196 oC em um analisador de área superficial e porosidade ASAP 2020 da marca Micromeritics. Com a utilização desta técnica, foi determinada a área específica, o volume de poros e a distribuição do tamanho dos poros referentes aos materiais sintetizados e funcionalizados com as aminas. Inicialmente antes da adsorção de nitrogênio as amostras foram submetidas a um processo de desgaseificação por 12 horas. Neste processo foi utilizado uma temperatura de 200 oC e
pressão de 2,7 Pa, aproximadamente. A temperatura de -196 oC utilizada para a adsorção de
nitrogênio foi alcançada termostatizando o porta amostra com um Dewar com nitrogênio
líquido.
As isotermas de adsorção e dessorção de nitrogênio a -196 oC foram construídas com os volumes adsorvidos expressos em condições estáticas de pressão e temperatura a diferentes pressões relativas de equilíbrio. A área específica dos materiais foi determinada pelo método de BET e o volume total de poros pelo método do single point (LEOFANTI et al, 1998). O
método BJH foi utilizado para estimar o diâmetro médio e a distribuição dos poros, enquanto o método t-plot foi empregado na determinação do volume das amostras (LEOFANTI et al,
1998).
4.3.3 Microscopia Eletrônica de Varredura (MEV)
complementa os resultados obtidos a respeito dos materiais em estudo, visto que, para uma visualização aprofundada dos canais porosos e dos tubos de sílica de materiais tipo MCM-41 e SBA-15, a técnica de microscopia eletrônica de transmissão nos fornece essa real visualização. As análises de MEV foram obtidas em um equipamento modelo JEOL SM 840. O procedimento de preparação dos materiais para a análise consistiu na deposição de uma porção do sólido sobre uma fita adesiva de carbono fixada no porta-amostra. Em seguida, foi depositada uma fina camada de ouro, com o objetivo de dar uma excelente qualidade e resolução de imagem das amostras.
4.3.4 Microscopia Eletrônica de Transmissão (MET)
Para a visualização da estrutura de mesoporos e tubos de sílicas hexagonais dos materiais sintetizados e funcionalizados foi utilizado um microscópico eletrônico de transmissão, o qual consiste de um feixe de elétrons e um conjunto de lentes eletromagnéticas, que controlam o feixe encerrados em uma coluna evacuada com uma pressão cerca de 10-5 mmHg. Os materiais foram inseridos em um porta amostra e em seguida houve um recobrimento com carbono amorfo, através do sistema de sputtering. Esta análise foi realizada
em um microscópico modelo CM-200 da Philips (200KV) acoplada a um dispositivo de energia dispersiva (EDX) da EDAX.
4.3.5 Espectroscopia Fotoeletrônica de Raios-X (XPS)
Equipamentos de XPS consistem em uma fonte de Raio-X, um analisador de energia para o fotoelétron, e um detector de elétron. A análise para identificação de fotoelétrons requer que a amostra seja colocada em uma câmara de alto vácuo. Considerando que a energia de fotoelétron depende de energia do Raio-X, a fonte de excitação deve ser monocromática. A energia do fotoelétron é analisada por um analisador eletrostático, e os fotoelétrons são identificados por um tubo multiplicador de elétron ou um detector multicanal.
Os espectros fotoeletrônicos segundo a técnica de Espectroscopia Fotoeletrônica de Raios-X dos materiais foram obtidos em um espectrofotômetro Physical Eletronics PHI-5700 equipado com uma fonte dupla de radiação de Raios-X de Mg Kα (hυ = 1253,6 eV) e de Al Kα(hυ = 1483,6 eV). Os espectros foram registrados a um ângulo de 45 oC em um analisador,