UNIVERSIDADE ESTADUAL PAULISTA
FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA CAMPUS DE BOTUCATU
SUPLEMENTAÇÃO DE MONENSINA SÓDICA E/OU
ANTICORPOS POLICLONAIS EM DIETAS DE BOVINOS
JOVENS CONFINADOS.
ROBSON SFACIOTTI BARDUCCI
Dissertação apresentada ao
Programa de Pós-Graduação em Zootecnia como parte das exigências para obtenção do título de Mestre.
UNIVERSIDADE ESTADUAL PAULISTA
FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA CAMPUS DE BOTUCATU
SUPLEMENTAÇÃO DE MONENSINA SÓDICA E/OU
ANTICORPOS POLICLONAIS EM DIETAS DE BOVINOS
JOVENS CONFINADOS.
ROBSON SFACIOTTI BARDUCCI Zootecnista
ORIENTADOR: Prof. Dr. MÁRIO DE BENI ARRIGONI
Dissertação apresentada ao
Programa de Pós-Graduação em Zootecnia como parte das exigências para obtenção do título de Mestre.
FICHA CATALOGRÁFICA ELABORADA PELA SEÇÃO TÉCNICA DE AQUISIÇÃO E TRATAMENTO DA INFORMAÇÃO – SERVIÇO TÉCNICO DE BIBLIOTECA E DOCUMENTAÇÃO UNESP -FCA -
FCA - LAGEADO - BOTUCATU (SP)
Barducci, Robson Sfaciotti, 1984-
B247s Suplementação de monensina sódica e/ou anticorpos po-
liclonais em dietas de bovinos jovens confinados / Robson Sfaciotti Barducci. – Botucatu : [s.n.], 2010.
vii, 51 f.: il., color., tabs.
Dissertação (Mestrado) -Universidade Estadual Paulista,
Faculdade de Medicina Veterinária e Zootecnia, Botucatu, 2010.
Orientador: Mario de Beni Arrigoni Inclui bibliografia.
1. Imunização passiva. 2. Ionóforo. 3. Confinamento. 4. Aditivos alimentares. I. Arrigoni, Mario de Beni. II. Uni- versidade Estadual Paulista “Júlio de Mesquita Filho”(Cam- pus de Botucatu). Faculdade de Medicina Veterinária e Zootecnia. IV. Título.
Dedicatória
Aos meus pais, ROBSON e JANETE, pelas esperanças, incentivos, apoio, amor e sacrifícios incondicionais em mim depositados.
A minha irmã, Letícia, pelo afeto, carinho, compreensão e ajuda sempre que precisei.
Aos meus avós, João e Lucilde; Caetano e Ester, pelo apoio, força, carinho e amor.
Agradecimentos
A Deus, por me ter proporcionado o Dom da vida, por sempre ter me guiado pelos caminhos certos e por ser meu porto seguro nos momentos bons e ruins.
Ao Prof. Dr. Mário De Beni Arrigoni, meu orientador e amigo, pela oportunidade, confiança, abertura, companheirismo, dedicação e atenção em todos os momentos de minha formação acadêmica e profissional.
A minha família, pelo apoio e incentivo sem o qual esta vitória, e muitas outras, não teriam sido possíveis.
Aos meus amigos de longa data, Eduardo, Armando, Antonio Augusto, Maik, Henrique, Bruno, Guilherme, Thiago, João Lucas, Maurício, Jorginho. Uns perto, outros longe, uns mais, outros menos, mas todos me ajudaram a manter o meu equilíbrio e no caminho em momentos difíceis durante essa etapa.
A Faculdade de Medicina Veterinária e Zootencia da UNESP, Campus Botucatu – SP, por ter sido meu lar durante esses anos de graduação e pós-graduação, possibilitando o meu aprimoramento, tanto pessoal quanto profissional e acadêmico.
Ao Laboratório de Nutrição e Crescimento Animal da Escola Superior de Agricultura “Luiz de Queiroz” – ESALQ/USP pela atenção e carinho com as análises de perfil de ácidos graxos, em especial com a Carol e Tuca.
Ao meu companheiro, amigo e irmão Luis Marcelo Nave Sarti, por compartilhar comigo os estudos, as dúvidas, o dia a dia, a pesquisa, os momentos difíceis, de angústia e de satisfação, muito obrigado!
Aos veteranos e amigos Danilo Millen e Rodrigo Dias Lauritano Pacheco pela orientação e tempo dedicado ao planejamento, condução e conclusão desse trabalho, fica aqui o meu muito obrigado!
À amiga Samira Baldin, pelo companheirismo, dedicação, paciência e ajuda em todo o decorrer deste trabalho.
Ao amigo João Paulo S. T. Bastos pelo incentivo, apoio e força nos momentos importantes em que sempre esteve presente.
À amiga Carolina Tobias Marino pela disponibilidade, incentivo e pelos ensinamentos nos momentos importantes.
Aos amigos Fernando S. Parra e João Ricardo Ronchesel de mestrado e da cidade de Jaú que tanto me ajudaram em todos os momentos desse trabalho.
Aos estudantes de iniciação científica e nossos “braços direitos”: Nara Cônsolo, Thiago Leiva, Diogo Tomazela, Henrique Della Rosa, muito obrigado pela ajuda, sem vocês não teria conseguido.
À aluna de graduação Janaína, pelas horas dedicadas no laboratório de Bromatologia, muito obrigado.
Aos funcionários do setor de Confinamento de Bovinos de Corte: Cido, Dinho, Claudemir e Sidnei pela dedicação e vontade constante de fazer com que tudo desse certo.
Aos funcionários da UNESP responsáveis pelo setor de importação na reitoria, pela extrema dedicação e profissionalismo para fazer com que o produto fosse recebido no Brasil e desembaraçado no tempo necessário para não faltar a nossos animais.
À Cilene e Luis Carlos, funcionários do Departamento de Melhoramento e Nutrição Animal pelo constante suporte em questões burocráticas e entraves dentro da universidade.
A todos os estagiários de graduação em Agronomia, Veterinária e Zootecnia que de alguma forma ou outra deram sua contribuição para que essa dissertação fosse concluída com dignidade.
À Camas Incorporated Americana por fornecer sem custo nenhum para universidade o produto contendo o preparado de anticorpos policlonais.
À Fundação de Amparo à Pesquisa do Estado de São Paulo, FAPESP, pela bolsa de estudo (Processo no 2008/52544-6).
A todos que, de alguma forma, me auxiliaram com o andamento de meu Mestrado e condução do experimento. Desculpem-me se esqueci de alguém. São muitos e divido todos os méritos desse trabalho com todos vocês.
SUMÁRIO
CAPÍTULO 1... 7
1. CONSIDERAÇÕES INICIAIS...8
2. REVISÃO DE LITERATURA...10
2.1. Acidose Ruminal...10
2.2. Ionóforos - Monensina Sódica...15
2.3. Resistência bacteriana aos ionóforos x saúde humana...22
2.4. Preparado de Anticorpos Policlonais (PAP)...27
2.5. Ácidos graxos no consumo humano...30
3. REFERÊNCIAS BIBLIOGRÁFICAS...36
CAPÍTULO 2... 52
EFEITOS DA MONENSINA SÓDICA E/OU ANTICORPOS POLICLONAIS EM DIETAS DE BOVINOS JOVENS CONFINADOS. RESUMO... 53
ABSTRACT... 55
1. INTRODUÇÃO... 56
2. MATERIAL E MÉTODOS... 57
3. RESULTADOS..... 63
4. DISCUSSÃO... 65
5. CONCLUSÃO... 73
6. REFERÊNCIAS BIBLIOGRÁFICAS... 73
CAPÍTULO 3... 89
IMPLICAÇÕES... 90
1. CONSIDERAÇÕES INICIAIS
O mundo enfrentará, nos próximos anos, dois grandes problemas. Primeiro a deterioração ambiental e o esgotamento de recursos naturais e, segundo, a crescente pressão sobre a capacidade de alimentar uma população em rápido crescimento (Makiya e Traballi, 2009). Para solucionarmos estes problemas temos como missão o desenvolvimento de sistemas agroindústrias sustentáveis, além de éticos e rentáveis ao longo de toda sua cadeia.
Nas últimas cinco décadas, a oferta de alimentos aumentou substancialmente devido ao uso de novas tecnologias de produção, maior profissonalização dos produtores, melhores canais de comercialização e apoio mais intenso dos governos (Scolari, 2005), sendo eficiente em atender a demanda mundial por alimento. Porém, segundo projeções da FAO (2007), haverá nos próximos 20 anos um aumento de aproximadamente 1,4 bilhões de habitantes no mundo, fazendo a demanda mundial de carnes mais que dobrar entre os anos de 2000 e 2050, indo de 229 milhões de toneladas para 465 milhões de toneladas, representando um aumento de 103%. Em tempo, não é de hoje que cientistas e pesquisadores alertam que poderão faltar alimentos no mundo.
Contudo, em comunicado oficial emitido pela FAO (2007), é citada a potencialidade do crescimento brasileiro em relação à produção mundial de carne. O Brasil possui, hoje, o maior rebanho bovino do mundo (173 milhões de cabeças); é o maior exportador em volume (2 milhões de toneladas de carne) e o segundo maior produtor mundial de carne bovina (9.2 milhões de toneladas de carne), além de apresentar o terceiro maior consumo interno e quarto maior consumo per capita (ABIEC, 2009). Sem dúvidas, hoje o Brasil destaca-se por possuir ferramentas necessárias para se firmar como líder mundial na produção e pesquisa.
Frente a isso, o aumento de produtividade na pecuária não combina com aumento de área de pasto, tornando-se crescente o número de confinamentos no Brasil para atender a crescente demanda mundial por carne, sendo de necessidade a inclusão de grãos e seus coprodutos nas dietas.
relataram que, em relação à participação de ingredientes volumosos nas dietas, a inclusão média utilizada foi de 28,8%; sendo que 77,4% utilizam entre 56 e 80% de concentrado com base na matéria seca (MS) total da dieta.
De acordo com Cervieri (2005), a terminação de bovinos confinados representou, em 2004, cerca de 5% do total de animais abatidos, ou 1,9 milhão de animais. Já em 2008, de acordo com Millen et al. (2009), aproximandamente 8,70% ou 3,13 milhões de bovinos abatidos foram terminados em confinamentos. Isto indica o crescente aumento no número de bovinos confinados no Brasil, o qual é reflexo da crescente demanda mundial por carne. Por isso, fica claro que existe uma tendência de intensificação dos processos produtivos de carne, necessitando recorrer a ferramentas que permitam pequenos ajustes no sistema para que se possa explorar o máximo potencial produtivo do animal.
Dentre estas ferramentas, a manipulação da fermentação ruminal para melhorar o desempenho produtivo de ruminantes tem sido o objetivo de nutricionistas por décadas (Dilorenzo, 2004). Alguns dos objetivos, segundo Nagaraja et al. (1997), incluem: melhorar processos benéficos e minimizar, alterar ou eliminar processos ineficientes que causem prejuízos tanto para os microrganismos do rúmen quanto para o hospedeiro.
Nas últimas décadas, a utilização de ionóforos para bovinos tornou-se imprescindível na manipulação da fermentação ruminal, aumentando, assim, a eficiência no aproveitamento das dietas e também prevenindo desordens digestivas como acidose. No entanto, caso o Brasil queira continuar a solidificar sua posição de liderança dentro da produção de carne bovina, deverá se preocupar não somente em obter aumentos na produção e nos índices produtivos, mas também com as novas exigências dos mercados consumidores em relação ao produto que consomem e desejam consumir. Dentre estas, podemos destacar a crescente preocupação da Europa com a resistência ao uso de antibióticos na produção animal e, como os ionóforos são classificados atualmente como antibióticos, sua restrição ao uso nos sistemas de produção de ruminantes europeus é iminente (Newbold et al., 2001).
encontro da FAO/WHO Expert Committee on Food Additives (JECFA, 2009), organizado em Outubro de 2008, foram fixados limites máximos de utilização de aditivos (inclusive ionóforos) para a alimentação animal, porém essas disposições deverão ser revistas até 1 de Julho de 2011, levando em conta os novos conhecimentos científico.
Sendo assim, mesmo que nunca ocorra proibição efetiva de importação de carne em virtude do uso de antibióticos, é de grande importância o desenvolvimento de novas tecnologias de aditivos, principalmente, que melhorem os processos de fermentação ruminal, apresentem a mesma eficiência e economicidade dos ionóforos, sem trazerem riscos para saúde humana (Dilorenzo, 2004).
A seguir, uma nova tecnologia em modificadores de fermentação ruminal, a imunização contra populações específicas de bactérias ruminal, será discutido neste trabalho. Essa técnica constitui um enfoque novo com grande potencial devido às suas características, as quais são basicamente anticorpos considerados de origem natural e com baixo risco de contribuir para resistência microbiana.
O Capítulo 2, denominado “Efeitos da monensina sódica e/ou anticorpos policlonais em dietas de bovinos jovens confinados”, apresenta-se de acordo com as normas para publicação no periódico Journal of Animal Science. O objetivo deste estudo foi avaliar os efeitos da inclusão de anticorpos policlonais (contra as bactérias ruminais Streptococcus bovis, Fusobacterium necrophorum, Lactobacillus e endotoxina) e/ou monensina sódica no desempenho, características e perfil de ácidos graxos da carcaça em bovinos Brangus jovens confinados.
2. REVISÃO DA LITERATURA
2.1. Acidose Ruminal
quantidade de fibras a partir de forragens na dieta de bovinos confinados.
Segundo Owens et al. (1998), em bovinos a condição de acidose clínica e subclínica ocorre quando o animal ingere excessiva quantidade de carboidratos altamente fermentescíveis no rúmen, sendo esse um problema para ruminantes em confinamentos alimentados com dietas de alto grãos. Além disso, o processo de acidose está diretamente relacionado ao consumo, estado nutricional do animal e tempo de adaptação do rúmen (Ortolani, 1995; Bertocchi, 1998; Mohamed et al., 1998).
Com a introdução de amido ou outros carboidratos rapidamente fermentáveis nas dietas de confinamento, iniciam-se mudanças ruminais severas, as quais resultam em mudanças sistêmicas. Com a disponibilidade de glicose livre aumentada, estimula-se o crescimento de bactérias ruminal, consequentemente aumenta a produção de ácidos graxos de cadeia curta (AGCC) no fluido ruminal (> 100 mM), o que faz com que o pH ruminal diminua (Owens et al., 1998; Beauchemin et al., 2001), reduzindo dessa forma a motilidade, podendo surgirem rumenites e paraqueratose (Dirksen, 1989; Nocek et al., 1984). Acontece alteração no equilíbrio existente entre dois principais grupos de bactérias, as produtoras de lactato (Streptococcus bovis e Lactobacillus spp.,) e as utilizadoras de lactato (Selenomonas spp., Anaerovibrio spp., Megasphaera elsdenii e Propionibacterium spp.). A espécie Streptococcus bovis possui rápida taxa de crescimento (dobra a população a cada 12 minutos) e de degradação do amido (McCallister et al., 1990), o que explica o grande crescimento dessa espécie no estágio inicial da acidose. Normalmente esse microrganismo produz acetato, formato e etanol a partir de glicose, mas quando o pH atinge 5,6 ocorre mudança de produto de fermentação, que favorece somente a produção de lactato (Russel e Hino, 1985; Finlayson, 1986). O lactato gerado no rúmen pode ser tanto levógiro (L), como dextrógiro (D), variando suas concentrações de acordo com o pH, tempo de fermentação, assim como quantidade e tipo de carboidrato ingerido (Dunlop, 1972).
do gênero Lactobacillus encontram ambiente favorável para se proliferar, preenchem este nicho e continuam a produzir lactato em pH menor que 5,2 por serem tolerante ao ambiente ácido (Russel e Hino, 1985). Concomitantemente, o crescimento de bactérias que utilizam lactato como substrato é prejudicado. Portanto, independentemente da fonte de carboidratos utilizados na dieta, o acúmulo de lactato é esperado nessa faixa de pH (DiLorenzo, 2004).
Essas condições que conduzem à queda no pH, leva a diminuição do estímulo de mastigação, diminuição da secreção salivar e de íons bicarbonato, destruição de grande parte da microbiota ruminal, menor motilidade ruminal e menor mistura do alimento. Ocorre aumento da pressão osmótica do rúmen (quantidade de sólidos dissolvidos no fluído ruminal) o que inibe a absorção de AGCC (Owens et al., 1998). Esses fatos promovem um afluxo de líquidos vasculares (de água e em menor grau de íons do organismo para o interior do rúmen) a tal ponto que excede a capacidade tamponante do bicarbonato plasmático (Frazer, 1991; Galyean e Rivera, 2003). Toda a acidez dá lugar a um quadro de acidose metabólica, caracterizada por diminuição do pH e dos teores de bicarbonato sanguíneo, que podem causar ulcerações múltiplas do epitélio ruminal, em especial nas suas papilas, causando uma rumenite aguda (Owens et al., 1998; Nagaraja e Owens, 2007; Costa et al, 2008), permitindo a entrada, através da parede ruminal, de bactérias anaeróbias, principalmente Fusobacterium necrophorum, as quais chegam ao fígado, podendo causar abscessos. A eficiência hepática é prejudicada e, consequentemente, o desempenho animal.
A mudança de osmolaridade sanguínea causa inchaço nas pernas do animal e laminites (Nocek, 1997). Em animais muito afetados, a condição geral fica comprometida (Aslan et al., 1995; Afonso et al., 2002), resultando em desidratação, diarréia, batimentos cardíacos inconstantes, diminuição da circulação sanguínea periférica, redução do fluxo de sangue para os rins, choque e, em casos mais graves de acidose clínica, o animal pode morrer se a homeostase sanguínea não for restabelecida (Huntington, 1988).
(Schwartzkopf-Genswein et al., 2003).
Nesse cenário existem dois tipos de acidose, a clínica (aguda) e a subclínica (subaguda). Owens et al. (1998) separaram e caracterizaram os dois tipos de acidose de acordo com o pH e produção de ácidos orgânicos. Na acidose subclínica a faixa de pH é entre 5,6 e 5,2 e caracterizada pela alta concentração de AGCC, sendo o mais importante contribuidor para problemas de acidose crônica em muitos rebanhos. Na acidose clínica o pH é drasticamente reduzido, menor que 5,2 e caracteriza-se pelo acúmulo de lactato numa concentração de 40 mM (tanto na forma isomérica D quanto na L).
A acidose clínica se manifesta com uma doença visível, porém a acidose subclínica é mais difícil de identificar (Owens et al., 1998). Diminição no consumo e desempenho são comumente resultados de acidose subclínica (Koers et al., 1976; Owens et al., 1998). A razão pela qual alguns animais experimentam acidose subclínica enquanto outros são metabolicamente capazes de enfrentar esse desafio não está clara. Diferenças entre bovinos devem ser aliadas, em parte, pela estabilidade da população da microbiota ruminal, pela preferência alimentar e seletividade no cocho ou à taxa particular nas quais animais consomem o alimento, podendo afetar a secreção salivar para tamponar os ácidos produzidos durante a fermentação. Bovinos que consomem dietas de alto grão secretam somente 60 a 70%, em média, de saliva em comparação aos animais alimentados com forragem e a secreção de saliva entre animais que recebem a mesma dieta pode variar em até 25% (Bailey, 1961). Assim, não é surpresa que, sob modelos comerciais típicos de confinamento, o pH ruminal varie entre animais que recebem a mesma dieta. Contudo, a relação entre a variação individual da produção de saliva em animais e a incidência de acidose subclínica não tem sido estabelecida.
estratégias para prevenir e controlar a acidose.
De acordo com Brown et al. (2000), alta correlação entre consumo e o mais baixo pH ruminal diário em relação ao dia anterior em bovinos confinados foi observado, o que indica que os animais devem ajustar seu consumo subsequente se o pH está baixo, numa tentativa de limitar a produção de ácidos e restaurar as condições do pH em um nível adequado (próximo de 6,0) (Beauchemin et al., 2001). Consumir menos em um dia para compensar o exagero do dia anterior pode demonstrar o estágio de acidose subclínica. Muitos estudos têm concluído que uma grande variação na ingestão de matéria seca de bovinos com dietas de alto concentrado pode ser consequência da acidose (Fulton et al., 1979; Britton e Stock, 1987). Assim, as características individuais dos bovinos para se adaptarem aos modelos de alimentação também representam importante papel na modulação das desordens metabólicas.
Várias ferramentas de manejo e aditivos alimentares podem ser utilizado com o intuito de prevenir ou controlar a acidose, e a eficácia dessas ferramentas depende da extensão do problema e da natureza do produto.
Dentre as estratégias de manejo, a prática de manejo de cocho, tais como a alimentação programada, múltipla distribuição de alimentação por dia e consistente tempo de distribuição de alimentação, têm por objetivo reduzir a variabilidade na ingestão e prevenir distúrbios como acidose (Bauer et al., 1995; Gibb et al., 1998; Galyean, 2001).
Manejo de adaptação gradual às dietas de alto concentrado e técnicas como a restrição da quantidade de alimento oferecido ao animal podem se tornar interessantes para evitar ou diminuir distúrbios metabólicos. Em bovinos gradualmente adaptados às dietas de alto teor de concentrado, o acúmulo de lactato é prevenido; no entanto, o pH ruminal poderá ainda permanecer baixo devido à maior produção de AGCC (Nagaraja, 2003). Bevans et al. (2005) mostraram que os valores de pH ruminal tiveram variação muito maior no grupo de rápida adaptação (5 dias) comparado ao grupo com adaptação mais gradual (17 dias), o que representa uma maior oportunidade de ocorrência de acidose em alguns animais.
concentrado pode levar o hospedeiro a quadros de desordens metabólicas (Cheng et al., 1998; Owens et al., 1998). Estudos mostram que são necessários no mínimo 10 a 14 dias para se realizar a transição de dietas baseadas em forragens para dietas com alto concentrado (Schwatrzkopf-Geinswein, 2003).
Dentre as estratégias nutricionais, destaca-se também o uso de antibióticos ionóforos e não-ionóforos como aditivos. Os ionóforos vêm sendo utilizados há mais de 30 anos como promotores de crescimento em dietas de ruminantes, sendo a monensina a mais estudada. Sem dúvidas, o uso de ionóforos é um dos métodos mais efetivos para controlar e prevenir a acidose, por modificarem a composição da microbiota ruminal e reduzirem a ingestão de alimentos. Stock et al. (1995) relataram menores flutuações no consumo de MS em novilhos confinados que receberam monensina sódica.
No atual momento de intensificação dos sistemas de produção de bovinos de corte, é preciso cada vez mais efetuar ajustes para explorar ao máximo a eficiência dos animais, sem haver problemas de distúrbios metabólicos como acidose. Até o momento muito pouco se sabe em relação a esse distúrbio nos confinamentos brasileiros. Mais informações são necessárias a respeito da diferença na estabilidade da microbiota ruminal em dietas com produtos e coprodutos brasileiros entre raças taurinos e zebuínos.
2.2. Ionóforos - Monensina Sódica
Durante muito tempo procurou-se melhorar a fermentação ruminal por meio da manipulação da dieta, porém, nas últimas duas décadas, grande número de compostos químicos tem sido testado para os mesmos fins. Uma classe desses compostos que vem obtendo considerável sucesso como aditivos alimentares são os chamados ionóforos poliéster carboxílicos.
Atualmente os ionóforos são classificados pelo FDA (Foods and Drugs Administration) como antibióticos. Estudos revelaram que os antibióticos ionóforos são os mais usados no mundo em dietas de bovinos confinados e Millen et al. (2009) demostraram que 98,7% dos nutricionistas brasileiros utilizam esse aditivo.
ionóforos, a monensina provavelmente é o aditivo mais pesquisado em dietas de ruminantes.
Algumas das características de ação dos ionóforos e seus benefícios biológicos podem ser classificados em: aumento da eficiência do metabolismo da energia das bactérias ruminais e/ou do animal, alterando a proporção dos AGCC produzidos no rúmen (Perry et al., 1976) e diminuição da produção de metano (Russel e Strobel, 1989); melhoria do metabolismo do N pelas bactérias ruminais e/ou do animal, diminuindo a absorção de amônia e aumentando a quantidade de proteína de origem alimentar que chega ao intestino delgado (Bergen e Bates, 1984; Clary et al., 1993); diminuição das desordens resultantes da fermentação anormal no rúmen, como acidose, timpanismo (Owens et al., 1998); aumento do fluxo de ácido graxo insaturado (AGI) para o intestino delgado (Clary et al., 1993).
Em relação ao mecanismo de ação dos ionóforos, a mais direta ação é sobre as bactérias, na qual está relacionado a um processo chamando bomba iônica, que regula o balanço químico entre o meio interno e externo da célula. Os ionóforos, ao se ligarem à membrana celular das bactérias e protozoários e, provavelmente, à dos fungos ruminais, facilitam o movimento dos cátions através da membrana celular, alterando o transporte cinético celular de sódio (Na+), mudando dessa forma os requerimentos de energia para a mantença dos gradientes osmóticos (Degani e Elgavish, 1978; Saini et al., 1979). A monensina possui a seguinte afinidade: Na > K > Rb > Li > Cs, sendo a afinidade por Na+ de aproximandamente 10 vezes a afinidade por K+ (Pressman, 1976). Essas reações culminam em reduzida concentração intracelular de potássio (K+), baixo pH e maior concentração intracelular de sódio (Na+).
não opera eficientemente, provocando desequilíbrio e, devido à maior concentração de cátions dentro da célula, ocorre aumento da pressão osmótica, a água penetra em excesso e a célula “incha”, tendendo a romper-se. Desse modo, as bactérias acabam morrendo ou assumem um nicho microbiano sem expressão ruminal.
De fato ocorrem mudanças na população microbiana, selecionando as bactérias gram-negativas produtoras de ácido succínico ou que fermentam lactato e inibindo as gram-positivas produtoras de acetato, butirato, lactato e H2. Bactérias gram-positivas são, em muitos casos, mais sensíveis aos ionóforos do que espécies gram-negativas, mas esse modo de resistência não é bem definido, sendo que o argumento mais aceito parece estar relacionado à presença de uma segunda membrana que é impermeável a grandes partículas formada por proteínas, lipoproteínas e lipopolissacarídeos. Essa membrana possui canais de proteínas através da membrana com tamanho limite de aproximadamente 600 Dalton, denominadas porinas. A maioria dos ionóforos possui tamanho maior que 600 Dalton e, consequentemente, não passam através das porinas, o que torna as células impermeáveis aos ionóforos. Por outro lado, as bactérias gram-positivas possuem apenas uma camada espessa de peptidioglicano que, por ser porosa, não impede a ação dos ionóforos (Morais et al., 2006).
No entanto, os ionóforos podem aumentar o fluxo de íons em algumas bactérias gram-negativas, comportando-se inicialmente como gram-positivas. Como exemplo, a gram-negativa Fibrobacter succinogenes, uma bactéria que é sensível aos ionóforos. Além disso, com o passar do tempo, bactérias originalmente resistentes aos ionóforos podem tornar-se sensíveis e certas bactérias sensíveis, como as gram-positivas, podem desenvolver resistência aos ionóforos (Chen et al., 1979).
Johnson, 1981). Essa habilidade explica apenas um terço do aumento potencial da eficiência alimentar (Russel e Strubel, 1989), porém acredita-se que esse mecanismo de ação ser o principal efeito do ionóforo sobre o melhor desempenho ruminal.
Fuller e Johnson (1981) encontraram que a relação acetato:propionato diminuiu com ionóforos em dietas de alto grão. Em geral, a produção total de AGCC é pouco afetada, mas se observa significativa alteração em suas proporções. Enquanto as concentrações de acetato e butirato diminuem ou se mantém, a de propionato aumenta significativamente em resposta ao aditivo. A intensidade desses efeitos é dependente do nível de utilização de monensina e do tipo de dieta, esperando-se maior efeito dos ionóforos em dietas com maior participação de concentrado do que em dietas com mais volumoso, por causa da diferença na população microbiana predominante no rúmen, uma vez que os ionóforos atuam principalmente sobre os microrganismos gram-positivos.
Hungate (1966) propôs que a fermentação de propionato é mais eficiente energicamente do que a fermentação do acetato, isso porque propionato é o único AGCC que pode ser convertido à glicose, a qual então poder ser utilizada como fonte de energia para ruminantes. Assumindo que o propionato é essencial para o metabolismo energético dos ruminantes, sua maior disponibilidade contribuirá para diminuir o incremento calórico pelo fato de apresentar menor produção de calor ao ser metabolizado (Bergen e Bates, 1984), poupar aminoácidos normalmente destinados à gliconeogênese e promover, assim, síntese de proteína corporal.
Raun et al. (1976) encontraram que o efeito da monensina na melhora total da eficiência alimentar através das mudanças naturais da fermentação ruminal também está associada com a diminuição da produção de metano. A produção de metano in vitro parece ser reduzida parcialmente pela monensina em até 30% (Van Nevel e DeMeyer, 1977; Short, 1978; Chalupa et al., 1980). No entanto, a produção de metano nunca afeta mais que 12% da energia presente na dieta (Blaxter, 1962). Essa diminuição deve estar associada com a sensibilidade da bactéria metanogênica à monensina (Chen e Wolin, 1979) e pode ainda, estar associada à inibição do crescimento de protozoários, que produzem hidrogênio e são colonizados por bactérias que produzem metano (McAllister et al., 1996).
produção de metano, espera-se aumento na quantidade de energia disponível da dieta para absorção. As vantagens da utilização da monensina são o seu efeito sobre o metabolismo de energia e a eficiência do uso de energia para mantença e para crescimento (interesse, ganho, lucro), mostrando assim uma melhora na utilização dos alimentos (Brown et al., 1974).
Outro fator a ser considerado importante é a redução na variação de consumo (Burrin et al., 1988; Stock et al., 1995). O uso da monensina diminui o consumo sem alterar as taxas de ganho de peso vivo, tendo pouco efeito sobre o ganho diário de bovinos alimentados com dietas de alto concentrado (Potter et al., 1976; Perry et al., 1976; Raun et al., 1976). Erickson et al. (2003) reportaram que a monensina tende a fazer com que o animal reduza a taxa de ingestão, quantidade de alimento por refeição e aumenta o número de refeições diárias; fator esse importante para evitar o acúmulo de AGCC e assim a prevenir a ocorrência de acidose subclínica.
Ao analisar 228 ensaios que envolveram 11.274 bovinos alimentados com rações ricas em grãos que receberam ou não monensina, Goodrich et al. (1984) observaram que a monensina sódica aumentou 1,6% o ganho de peso, reduziu o consumo em 6,4% e melhorou a conversão alimentar em 7,5%. Resposta essa que pode ser bastante variável de acordo com o tipo do animal alimentado. Observaram que bovinos considerados ineficientes em converter alimento em ganho, respoderam melhor à adição da monensina na dieta do que animais com melhor conversão alimentar (Goodrich et al., 1984).
Raun et al. (1974a) relataram melhora no ganho de peso de 1,5 a 15%. Farlin (1975) relatou melhor taxa de conversão alimentar de 9,7% em Nebraska. Em revisão realizada por Tedeschi et al. (2003) com 228 ensaios, o fornecimento de monensina melhorou o ganho de peso diário de 1,6% a 1,8%, o consumo diminuiu de 4% a 6% e a conversão alimentar melhorou de 6% a 7,5% em bovinos em crescimento em condições de confinamento.
7,89 Kg de MS/dia no controle, para 7,23 Kg de MS/dia com a dose de 33g/t. No entanto, as dosagens de 22 a 33g/t apresentaram similiares quantidades de alimento consumido/100 Kg de carcaça.
Os mecanismos de redução do consumo de alimento quando se utiliza monensina ainda não são bem entendidos. Possivelmente pode ocorrer uma redução nas exigências energéticas do animal e melhora dos valores energéticos da dieta (Byers, 1980). No caso de animais em confinamento, em que o nível de energia (efeito fisiológico) regula o consumo, o aumento da eficiência energética favorece a redução do consumo de alimentos para satisfazer as necessidades nutricionais (Mertens, 1992).
Byers (1980) comparou animais controle e com monensina que receberam dietas isoenergéticas (mesma quantidade de energia metabolizável) e observou que a monensina melhorou a energia líquida para ganho (1,20 vs 1,32 Mcal/Kg) mais do que a energia líquida de mantença (1,66 vs 1,70 Mcal/Kg) da dieta sem diferença no consumo de MS. Porém, quando a monensina melhorou a energia metabolizável em 10%, os valores de energia líquida de mantença (1,66 vs 1,78 Mcal/Kg) foram melhores do que a energia líquida para ganho (1,20 vs 1,26 Mcal/Kg), apontando menor consumo para o tratamento com adição da monensina. Assim, o pesquisador sugeriu que o maior efeito da monensina é aumentar o valor da energia líquida de mantença da dieta e reduzir os requerimentos de ingestão de MS para a mantença.
A respeito dos efeitos da monensina na carcaça, Potter et al. (1976) indicaram que a utilização da monensina teve pouco efeito sobre as características da carcaça. Esses mesmos autores propuseram uma série de experimentos para determinar se a melhor eficiência alimentar obtida com o uso de monensina estava relacionado às mudanças na composição da carcaça e determinar a retenção de energia e proteína da dieta na carcaça. Somente com a dosagem de 79g/t um menor rendimento de carcaça foi encontrado. Os animais que receberam consumiram menor quantidade de energia digestível durante todo o período experimental, sendo o menor valor para o tratamento de 33g/t. Nenhuma diferença entre as características de carcaça foi encontrada. Houve aumento de energia retida na carcaça de 7 a 14%, enquanto a de N de 9 a 19% a mais que o controle. Os pesquisadores sugerem que a melhoria na eficiência alimentar está relacionada ao melhor uso da energia da dieta para ganho em carcaça.
características de carcaça, tornando-as ligeiramente mais magras, comparada a animais controle. Apenas área de olho-de-lombo (AOL) apresentou efeito positivo (0,61%). O rendimento de carcaça, escore de marmoreio, deposição de gordura, “quality grade” e “yield grade” foram afetados negativamente pelo uso de monensina (0,38; 39; 0,24; -0,69 e -0,31% respectivamente). Em outros estudos as características de carcaça não foram afetadas pelo tratamento com monensina (Brown et al., 1974; Embry e Swan, 1974; Farlin et al., 1975).
Vale lembrar que o papel do nutricionista animal é fazer com que os produtos da fermentação no rúmen sejam benéficos para o animal e econômico para o produtor a fim de se obter um menor desperdício de energia e, consequentemente, melhor aproveitamento dos alimentos utilizados.
Outro fator no qual a monensina comprovou ser eficaz é na prevenção de distúrbios metabólicos. A monensina reduz a probabilidade de timpanismo no confinamento, reduz a incidência de acidose e cetose, reduz a produção de calor e auxilia no controle de coccidiose. Distúrbios metabólicos, como a acidose e o timpanismo, são causados por distúrbios na fermentação ruminal. No entanto, essas condições são atenuadas ou reduzidas quando ionóforos são fornecidos aos animais, uma vez que influencia no consumo alimentar, na microbiota ruminal e, consequentemente, nos produtos finais da fermentação (McGuffey et al., 2001).
O primeiro mecanismo de ação da monensina em bovinos que receberam é o efeito inibitório sobre as bactérias que produzem lactato e são responsáveis pela acidose, Streptococcus bovis e Lactobacillus sp. (Nagaraja et al., 1981, 1982; Morais et al., 2006). Inversamente, a contagem da colônia de bactérias utilizando lactato não foi afetada pela presença da monensina (Nagaraja et al., 1981, 1982).
O segundo mecanismo na prevenção de acidose é pela mudança na dinâmica de alimentação de bovinos (Black e McQuilken, 1980; Cooper et al., 1999). Fanning et al. (1999) econtraram que a monensina reduziu a taxa de ingestão, quantidade de alimento por refeição e aumentou o número de refeições diárias sem afetar a ingestão de MS total ao dia.
et al., 2003).
Na cetose, durante o período em que os ruminantes encontram-se em balanço energético negativo, o organismo tenta suprir suas exigências de energia pela mobilização de gordura. O tecido adiposo libera ácidos graxos não esterificados no sangue, podendo ser oxidados, reesterificados ou metabolizados até a formação de corpos cetônicos. Esses processos são característicos de acetonemia. O aumento na produção de propionato, principal precursor da gliconeogênese, pela adição dos ionóforos na dieta alimentar tem demonstrado diminuir a concentração de corpos cetônicos em vacas recém-paridas, prevenindo a cetose (McGuffey et al., 2001).
O timpanismo é uma enfermidade não infecciosa, caracterizada pela excessiva produção de gás, principalmente CO2, devido à intensa fermentação ruminal. Timpanismo resulta a partir do excesso de produção de espuma estável no rúmen. O gás fica preso dentro do rúmen-retículo por falha no mecanismo da erutação causando uma distenção abdominal aguda. O caráter agudo da desordem frequentememnte conduz à morte dentro de horas depois da ingestão da refeição que provoca o timpanismo (Bartley et al., 1983).
Autores sugerem que o consumo de monensina pode diminuir a ocorrência do timpanismo espumoso em bovinos (Nagaraja et al., 1997). Essa queda está associada a uma diminuição na população de bactérias, como Streptococcus bovis que produzem mucopolissacarídeos que aumentam a viscosidade do líquido ruminal e dificultam a separação do gás no conteúdo ruminal (Cheng et al., 1998).
Toda ação do homem ou da monensina provém vantagens nutricionais e metabólicas para animais que receberam ionóforos sobre animais não que receberam. Aumento na produção animal a partir do uso de monenina parece ocorrer como resultado desses variados modos de ação, no qual provavelmente atua em conjunto, originando benefícios na eficiência alimentar e benefícios econômicos.
2.3. Resistência Bacteriana aos Ionóforos x Saúde Humana
transmitida de uma bactéria a outra por uma estrutura extracelular conhecida como plasmídeo. Na década de 80, bactérias resistentes às diversas drogas já eram comuns (Levy, 2002). Assuntos como saúde animal e humana, sustentabilidade da agricultura e pecúaria e órgãos públicos de saúde têm dominado a mídia por muitos anos (White, 1964; Lake, 1970; Roberts, 1970) e continua sendo relevante ainda hoje (Oliver et al., 2005). Mais recentemente, epidemiologia, bioseguridade da fazenda, segurança alimentar e proteção ambiental dominam e aumentam a proporção de nossas pesquisas. Nos últimos anos os ionóforos têm estado em evidência devido a sua possível proibição. A União Européia estabeleceu normas rigorosas de proibição no uso de alguns antibióticos utilizados na nutrição animal. A expectativa era que haveria uma total proibição do uso de ionóforos, atualmente considerados antibióticos, para os exportadores de carne para a Europa. Entre as exigências impostas pelos mercados consumidores dos produtos de origem bovina, a constatação de que os animais foram alimentados com rações isentas de antibióticos e promotores de crescimento estavam sendo considerados de suma importância.
Conforme o Regulamento (EC) Nº1831/2003 (EUROPA, 2003), ficou determinado a proibição da utilização de antibióticos e coccidiostáticos como aditivos para bovinos, de forma a prevenir uma possível relação entre o aumento da incidência de microrganismos resistentes aos antibióticos, observado na medicina humana, e o uso destas substâncias nas rações animais.
No entanto, em recente encontro da FAO/WHO Expert Committee on Food Additives (JECFA) organizado em Genebra, Suiça, em outubro de 2008, com a mais recente Directiva 2009/8/CE publicada em 11/02/2009 pelo Jornal Oficial da União Européia, algumas mudanças foram realizadas. Todas essas mudanças tiveram como objetivo promover princípios para avaliar a segurança alimentar de resíduos de drogas veterinárias (entre esses os ionóforos) na alimentação animal e estabelecer limites aceitáveis de consumos diários de aditivos e limite máximo de resíduo recomendado para certos medicamentos quando usados na produção de alimento de origem animal. As disposições apresentadas no anexo deverão ser revistas até 1 de Julho de 2011 para ter em consideração o desenvolvimento científico.
no leite ou na carne de ruminantes para o consumo dos humanos. Segundo a Food and Agriculture Organization of the United Nations/World Health Organization (FAO/WHO) por meio do Codex Alimentarius Comission (2009), o limite máximo para presença de monensina sódica no leite é da ordem de 2 µg/L. Para a carne bovina, esse valor está em torno de 10 µg/kg, sendo o fígado o órgão de eleição para detecção de resíduos de monensina com limite máximo de 20 µg/kg. Para muitos, um grande passo foi dado.
Os estados membros tiveram por meta colocar em vigor as disposições legislativas, regulamentares e administrativas necessárias para dar cumprimento a presente directiva, o mais tardar em 1 de Julho de 2009. A definição de limites máximos de monensina nos alimentos para animais, em conformidade com os anexos da presente directiva, tem como proposta assegurar um bom funcionamento do mercado interno e proteger a saúde animal e pública.
Porém, no Brasil, apesar de a monensina ser utilizada frequentemente em sistema de produção de bovinos, são desconhecidos os estudos que avaliaram riscos de resíduo de aditivo.
Do ponto de vista microbiológico, experimentos in vivo e in vitro indicam que apenas algumas bactérias ruminais são sensíveis aos ionóforos. Bergen e Bates (1984) notaram que as bactérias resistentes à monensina apresentavam a ação da enzima fumarato redutase na membrana celular que poderia contrabalancear o fluxo de íons para o interior do citoplasma causado pelos ionóforos. Bactérias gram-negativas são, na maioria das vezes, mais resistentes aos ionóforos, mas, mesmo assim, necessitam de um período de adaptação para isso. Cepas de Prevotella bryantii foram selecionadas para resistir à monensina a uma dose até 16 vezes maior que as suportadas por linhagens sensíveis. Ao se misturarem os dois tipos de cepas e suspender a adição de monensina no meio, observou-se que a cultura resistente foi substituída pela sensível (Callaway e Russel, 1999; Callaway e Russel, 2000).
A cada dia que passa os consumidores estão mais exigentes em relação ao uso de antibióticos como promotores de crescimento na indústria de alimentos de origem animal e preocupados com as consequências que estes podem provocar à saúde humana, conforme aponta pesquisa patrocinada pelo Whole Foods Market, a maior rede varejista de alimentos naturais e orgânicos dos Estados Unidos. A pesquisa foi realizada recentemente com 1.000 consumidores norte-americanos e apontou que 74% dos entrevistados se preocupam com a presença de resíduos de antibióticos deixados nos produtos finais. O trabalho mostrou que 59% das pessoas preferem evitar o uso desses produtos e consumir carne cuja origem seja livre de antibióticos.
Atualmente, não existem trabalhos na literatura que comprovem a resistência de bactérias ao uso de ionóforos a partir do enfoque nutricional. A idéia de que a resistência aos ionóforos é uma seleção fenotípica (adaptação fisiológica), sustentada por medições do fluxo de potássio monensina dependente, é mais aceita do que a mutação ou aquisição de genes externos (Russel e Houlihan, 2003). Além disso, genes responsáveis pela resistência das bactérias ruminais aos ionóforos não tem sido identificados e há uma pequena evidência de que a resistência aos ionóforos possa ser transferida de uma bactéria para outra. Devido a isso, o uso de ionóforos na alimentação animal provavelmente não tem um impacto significativo na transferência de resistência a antibióticos dos animais para os humanos (Russel e Houlihan, 2003).
resistentes, como os hospitais (Russel e Houlihan, 2003).
Mesmo assim, pelo fato de os ionóforos serem tecnicamente considerados antibióticos pelo FDA (Foods and Drugs Administration), seu uso na produção animal é considerado pela Organização Mundial de Saúde (OMS) um risco crescente à saúde humana. Há empenho de técnicos de órgãos oficiais e associações de consumidores em prol da restrição total ao uso de antibióticos como promotores de crescimento na Europa e argumentam que a resistência aos ionóforos coloca em posição de ameaça a saúde pública, mesmo com antibióticos convencionais. Porém, organizações, como a NCBA (National Cattlemans Beef Association) americana, fazem esforços para reclassificá-los como ionóforos, baseado no fato que estes não têm função terapêutica quando usados nas dietas de bovinos e não são usados como agentes terapêuticos em medicina humana. Toda essa discussão sobre a proibição do uso de antibióticos na alimentação animal tem sido recomendada por questão de precaução. A nova legislação inclui também barreiras à importação de produtos de origem animal provenientes de países que utilizam essas substâncias e agora, mais do que nunca, dos que utilizam de forma errônea. Desta forma, principalmente na Europa, a eliminação do uso dos promotores de crescimento e antibióticos, como a monensina, terá importantes implicações econômicas, esperando-se aumentos de 3 a 5% nos custos de produção.
Mesmo que nunca ocorra proibição efetiva de importação de carne por motivos relacionados ao uso de antibióticos, é de grande importância do desenvolvimento de novas tecnologias de aditivos que reduzam a inclusão de antibióticos na alimentação animal, especialmente ao se pensar na busca de maior valor agregado pago à carne brasileira. Cientistas e produtores devem atentar às tendências do mercado consumidor para o lançamento de novo produtos.
Em vista disso, pesquisadores têm concentrado esforços na busca de estratégias para evitar o uso de aditivos antibióticos na produção animal, lembrando que é a opinião do consumidor que determinará o maior ou menor uso na produção animal. Logo, a busca de tecnologias alternativas que possam suprir ao menos em equivalência o uso desses antibióticos no quesito produtividade constitui um importante diferencial de qualidade, agregando valor ao produto.
animais e para as pessoas que vão consumir seus produtos. Dentre esses, pesquisas com anticorpos policlonais vêm ganhando cada vez mais espaço nas indústrias de alimentação animal, sem comprometer o desempenho e os custos da produção.
2.4. Preparado de Anticorpos Policlonais (PAP)
Segundo Millen (2008), uma das alternativas para substituir a monensina, e que não tem recebido muita atenção até recentemente, é o mecanismo de imunização - o uso de anticorpos na produção animal. O conceito do mecanismo de imunização como ferramenta para atingir maior eficiência na fermentação ruminal e assim melhorar o desempenho animal é relativamente recente (Shu et al., 1999; Gill et al., 2000; Newbold et al., 2001; DiLorenzo et al., 2006; Millen et al., 2007; Blanch et al., 2009).
De uma maneira simples, o mecanismo de formação do produto com anticorpos para uso na alimentação de bovinos se dá da seguinte maneira: galinhas são vacinadas com pequenas doses de bactérias ruminais vivas (Streptococcus bovis, Fusobacterium necrophorum, Lactobacillus e endotoxina) e logo desenvolvem anticorpos específicos contra essas bactérias. Esses anticorpos passam, através de mecanismos fisiológicos, para a gema do ovo. Esta é utilizada então para se fazer o produto com anticorpos específicos que têm como alvo eliminar, do meio ruminal dos bovinos, bactérias cujos produtos da fermentação são indesejáveis (Shimizu et al., 1988).
Segundo DiLorenzo et al. (2006), a utilização de PAP contra Streptococcus bovis e Fusobacterium necrophorum teve sucesso em reduzir as populações dessas bactérias quando novilhos foram alimentados com dieta de alto grão. Com isso, os anticorpos podem ser eficazes na prevenção de efeitosnegativos no rúmen associados a estas bactérias e, possivelmente, no aumento do desempenho animal. A alta especificidade do anticorpo foi observada porque o mesmo não afetou as populações de outras bactérias testadas.
De acordo com DiLorenzo et al. (2008), novilhos Angus que receberam PAP contra Streptococcus bovis ou Fusobacterium necrophorum apresentaram maiores pesos vivos finais do que aqueles que não receberam ou receberam ambos os anticorpos. O efeito sobre o peso final pode ser atribuído ao maior ganho de peso diário observado em novilhos que receberam um ou outro anticorpo. Não foram observados efeitos em relação à ingestão de MS quando qualquer um dos anticorpos foi consumido. Entretanto, novilhos Angus que receberam PAP contra Streptococcus bovis apresentaram melhoria na eficiência alimentar, aumento no peso de carcaça quente e na espessura de gordura subcutânea e melhor classificação da carcaça quando comparados aos novilhos que receberam anticorpos ou novilhos que receberam ambos os anticorpos (Streptococcus bovis e Fusobacterium necrophorum). Os aumentos observados em gordura subcutânea e classificação da carcaça quando anticorpos contra Streptococcus bovis fora adicionados foram devido ao maior peso da carcaça.
Bastos et al. (2009) observaram que diferentes níveis (0; 1,5; 3,0 e 4,5 g/animal/dia) de PAP contra S. bovis, F. necrophorum e várias cepas de bactérias proteolíticas não alteraram o pH ruminal de vacas fistuladas alimentadas com dietas de alto concentrado. Já em experimento com vacas leiteiras, o preparado de anticorpos policlonais foi efetivo em manter o pH ruminal em animais em início de lactação (DiLorenzo et al., 2007).
Marino (2008), ao trabalhar com vacas canuladas no rúmen e alimentadas com dietas com alta proporção de concentrado, sendo estas compostas por três fontes energéticas (milho seco moído, grão úmido de milho e polpa cítrica), observou que o PAP contra S. bovis, F. necrophorum e várias cepas de bactérias proteolíticas foi tão eficaz quanto a monensina em manter o pH ruminal às 04h00min após a alimentação. Ainda, o efeito dos modificadores foi aditivo à inclusão da polpa cítrica nas dietas em elevar o pH ruminal. Entretanto, ao longo do dia, a inclusão do PAP não alterou o tempo em que o pH ruminal permaneceu abaixo de 6,0.
em porcentagem do peso vivo, animais que receberam PAP consumiram mais que aqueles que receberam monensina. O aumento da ingestão de MS devido ao uso de anticorpos na alimentação de bovinos confinados tem sido relatado por diversos autores (Shu et al., 1999; Gill et al, 2000; Shu et al., 2000 a).
Ao avaliar outros parâmetros, como AOL, gordura subcutânea, gordura da garupa, peso de carcaça quente e rendimento de carcaça, Pacheco et al. (2008) constataram que não houve efeitos entre os tratamentos com PAP ou monensina sódica (MON).
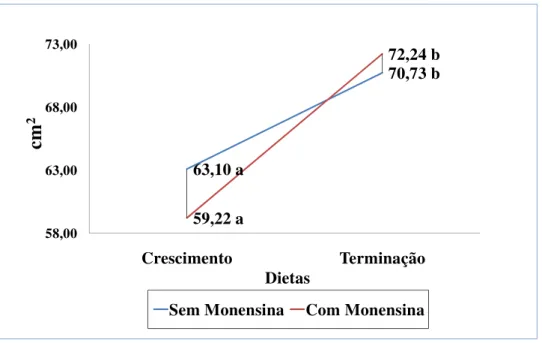
Sarti et al. (2009) estudaram a inclusão ou não de MON e PAP em dietas de alto concentrado para bovinos jovens Brangus em confinamento. Avaliaram a morfologia da parede ruminal e observaram que novilhos que receberam MON apresentaram maior área de superfície absortiva por cm2 de parede ruminal que aqueles não receberam MON, o que pode indicar maior absorção de AGCC e menor extensão de lesões. A inclusão de PAP não alterou os parâmetros de morfologia ruminal.
Millen et al. (2009) estudaram bovinos jovens Brangus e Nelore confinados com dieta de alto concentrado e que receberam MON ou PAP. Os animais que receberam MON tiveram melhor desempenho que aqueles que receberam PAP quando a dieta continha 85% de concentrado. Porém, considerando-se todo o período de confinamento não houve diferença no tocante ao desempenho entre os dois aditivos. No mesmo estudo, Mariani et al. (2009) avaliaram o comportamento alimentar dos animais confinados, onde bovinos que receberam MON reduziram a duração das refeições, levando a um maior número de refeições por dia e maior tempo de ruminação, comparados com os animais consumindo dietas contendo PAP.
2.5. Ácidos Graxos no Consumo Humano
O termo utilizado alimento funcional está aumentando como uma descrição genérica para os efeitos benéficos de alimentos ingeridos que vai além de seus valores tradicionais (Milner, 1999). Um relato da National Academy of Sciences definiu comida como “qualquer alimento ou ingrediente do alimento que deve fornecer benefícios à saúde, além dos nutrientes tradicionais que eles contêm” (NRC, 1994). Este conceito vem ganhando conciência e aceitação pelos consumidores.
Recentemente, a preocupação com a qualidade nutricional da carne vem ganhando força. A carne bovina, em especial, é considerada uma das carnes com maior efeito prejudicial à saúde humana, em razão de sua composição lipídica, constituída pelos ácidos graxos, principalmente os saturados e trans. Embora a mídia divulgue que normalmente a ingestão de gordura animal esteja associada a doenças cardiovasculares e cancerígenas, estudos têm demonstrado que o consumo moderado dessa gordura pode prevenir o desenvolvimento dessas mesmas doenças. Alguns ácidos graxos, particularmente os poliinsaturados, servem como matéria-prima para substâncias que regulam a imunidade, a coagulação sanguínea, a contração dos vasos e a pressão arterial (Simopoulos, 1999).
Os ácidos graxos trans são insaturados e, ao contrário dos ácidos graxos insaturados cis, possuem na sua ligação dupla os hidrogênios dispostos de forma transversal e são resultados da biohidrogenação ruminal ou de processos industriais. Em geral, o conceito de ácidos graxos trans traduz-se em efeitos prejudiciais à saúde humana. De acordo com Chiara et al. (2002), os ácidos graxos trans estão relacionados ao potencial arteriogênico, à modificação da fluidez das membranas celulares, ao aumento de doenças coronárias e seu principal efeito metabólico seria sua ação hipercolesterolêmica, que eleva o colesterol total e a lipoproteína de baixa densidade (LDL), reduzindo a lipoproteína de alta densidade (HDL) e resultando em significativo aumento da relação LDL/HDL. Essa relação é considerada o prognóstico mais importante para as doenças cardiovasculares (Chiara et al., 2002). No entanto, alguns estudos epidemiológicos demonstraram que essa relação de consumo de gordura, principalmente do tipo trans, são verdadeiras para alimentos de origem vegetal, mas não para gorduras de fontes animais (Medeiros, 2002).
de cadeia longa participam de vários processos metabólicos benéficos à saúde humana (Cook et al., 2001; Varela et al., 2004) e que as gorduras da carne de animais ruminantes, assim como o leite, são fontes naturais de alguns desses ácidos graxos para os humanos, como os isômeros de ácido linoléico conjugado (CLA), em particular o cis – 9, trans – 11 (French et al., 2000; Metz et al., 2008), representando uma fonte natural de CLA na dieta humana (Chin et al., 1992). Além do mais, ruminantes produzem naturalmente CLA, se encontrandopresente até em mais altas concentrações do que em carnes de não ruminantes ou em óleos vegetais (Chin et al., 1992; Lawson et al., 2001).
Existem duas formas dos ruminantes produzirem CLA. A primeira é por meio da biohidrogenação incompleta de ácidos graxos insaturados para ácidos graxos saturados realizado pelas bactérias ruminais (Shorland et al., 1955; Viviani, 1970). Na segunda, o próprio animal sintetiza endogenamente o CLA cis-9, trans-11 no próprio tecido a partir do C18:1 trans-11 (ácido vaccênico), ácido intermediário da biohidrogenação, sendo desejável como um produto fluente a partir do rúmen (Griinari et al., 2000). Esse processo envolve a enzima 9-desaturase, que está presente no tecido da glândula mamária e no tecido adiposo (Bauman et al., 1999; Corl et al., 2000). A 9-dessaturase também é encontrada em tecidos humanos, por isso, aumentos no consumo de ácido vaccênico (C18:1 trans-11) poderiam ter os mesmos efeitos benéficos associados à ingestão de CLA (Beorlegui, 2004).
Segundo Bauman et al. (1999) durante o processo de biohidrogenação pela ação dos microrganismos ruminais, o ácido linoléico (C18:2, cis9 cis12) passa inicialmente a rumênico (CLA - C18:2 cis-9 trans-11), depois a ácido vaccênico (C18:1, trans-11) e posteriormente a esteárico (C18:0). Esses ácidos graxos são absorvidos pelos animais e alcançam os tecidos. Pela ação das enzimas 9-dessaturase nos tecidos, o ácido esteárico (C18:0) pode ser transformado em ácido oléico (C18:1, cis-9) e o ácido vaccênico (C18:1, trans-11) pode ser transformado em CLA (C18:2 cis-9 trans-11).
Por muitos anos, somente a bacteria Butyrivibrio fibrisolvens era conhecida ser capaz de biohidrogenar (Kepler et al., 1966). Contudo, pesquisas demonstram que muitas espécies de bactérias fibrolíticas comumente encontradas no rúmen têm sido implicadas como responsáveis pela biohidrogenação e produção ruminal de CLA (Fay et al., 1990; Kim et al., 2000). Kemp e Lander (1984) dividiram as bactérias em dois grupos em função da reação e produtos finais da biohidrogenação. O grupo A de bactérias hidrogena o ácido linoléico e ácido linolênico ao C18:1 trans-11 (ácido vaccênico) e o grupo B de bactérias utilizam o C18:1 trans-11 (ácido vaccênico), originando o ácido esteárico (C18:0).
Apesar de referido como uma única molécula, o CLA é um grupo de isômeros de posições e geométricos em duplas ligações conjugadas (separadas apenas por uma ligação simples carbono-carbono). Há 56 possíveis isômeros geométricos e de posição do CLA (Yuraweez et al., 2001). Dois deles, todavia, alcançaram, nos últimos dez anos, lugar de destaque nas pesquisas de várias áreas como biologicamente ativos. Um deles é o C18:2 cis-9 trans-11, o mais abundante na natureza, abrangendo de 75 a 80% do CLA total (Yurawecz et al., 1998) e considerado ser o principal CLA que promove a saúde para o consumo humano (Pariza, 2004), pelo fato de ser um potente anticancerígeno (Pariza, 1991), reduzir a aterosclerose (Lee et al., 1994), reduzir a deposição de gordura corporal (Park et al., 1997) e imunomodulatório (Hayek et al., 1999). O outro isômero em destaque é o C18:2 trans-10 cis-12, que é um potente modulador de nutriente pelos diferentes tecidos (Simopoulos, 1991) e está relacionado principalmente à alteração do metabolismo de lipídios, reduzindo a síntese de gordura do leite (Pariza et al., 2001). Portanto, são duas moléculas com pequenas diferenças de posição e geometria de ligação, mas com ações diversas e intensas no metabolismo animal.
portanto, uma gama de oportunidade oferecida pelo uso das atividades metabólicas dos ácidos graxos que começa a ser explorada com o CLA.
Já é de conhecimento que importantes pesquisas para alterar o conteúdo de CLA tem tipicamente envolvido vacas em lactação (gordura do leite); mas relativamente poucos estudos têm extendido essas investigações para bovinos de corte em crescimento (gordura corporal) (Griinari e Bauman, 1999; Bauman et al., 2001). Geralmente a concentração de CLA está expressa em relação ao total de gordura e produtos lacteos e cárneos a partir de ruminantes tem concentração numa extensão de três a sete mg/g de gordura (Chin et al., 1992). Porém, a concentraçao de CLA pode variar amplamente (Chin et al., 1992; Lin et al., 1995; Banni e Martin, 1998).
Na Inglaterra, o Departamento do Coração (1994) recomendou que o consumo de gordura total representasse aproximadamente 30% do total de energia consumida e que o consumo de gordura saturada fosse no máximo 10% do total dessa energia. Ao mesmo tempo, recomenda que a relação de ácidos poliinsaturados:saturados seja superior a 0,4. Mais recentemente, nutricionistas têm focado no tipo de ácidos graxos poliinsaturados (AGPI) e no balanceamento da dieta entre o AGPI n-3, representado pelo ácido -linolênico (C18:3) e AGPI n-6, representado pelo ácido linoléico (C18:2).
Os ácidos graxos Omega 3 ( -3) e Omega 6 ( -6) são muitos diferentes quanto a sua ação no organismo humano. Enquanto os ácidos graxos -6 promovem inflamações e tumores, os ácidos graxos -3 agem como elemento protetor contra o câncer de mama (Homes et al., 1999; Sugano et. al., 2000). Essa proteção pode estar associada aos seus metabólitos, que são os eicosanoides com ação pró-inflamatórias menos potentes. Além disso, esse efeito pode ser devido à influência na atividade de enzimas e proteínas relacionadas à sinalização intramuscular e à proliferação celular (Bartsch et al., 1999). Porém, é importante manter o equilíbrio dietético entre as duas formas, uma vez que funcionam em conjunto, promovendo a saúde e o equilíbrio orgânico (Simopoulos, 2002). Segundo o Departamento de Saúde da Inglaterra (1994), para se obter uma saúde ideal, a razão -6/ -3 não deve ultrapassar o limite de 4 partes para o -6 e 1 parte para o -3.
Recentemente, a avaliação do perfil de ácidos graxos presentes nos produtos de bovinos tem despertado interesse da comunidade científica, principalmente de pesquisadores da área de nutrição e melhoramento genético animal, visando estabelecer dietas e genótipos que propiciem um produto final de melhor qualidade e benéfico à saúde humana.
Ainda para ilustrar a necessidade do estudo individual dos ácidos graxos vale a pena citar que, apenas quando o perfil de ácidos graxos foi detalhadamente estudado, pôde-se confirmar que a maior parte da depressão da gordura do leite é fruto da inibição direta na glândula mamária. Fica claro que é necessário caminhar para um grau de desagregação maior, até chegar aos ácidos graxos isoladamente. Neste particular, nenhum exemplo é mais eloquente do que o do CLA.
De acordo com Robelin, 1986, o perfil de ácidos graxos ingeridos é modificado pela fermentação ruminal, a qual varia em função do consumo e do tipo de dieta. Bauman et al. (2000) sugerem três vias de fatores da dieta para incremento de CLA e mudanças no perfil dos ácidos graxos: adição de substratos lipídicos ou C18:1 trans-11 (ácido vaccênico) no rúmen, alteração do ambiente ruminal afetando as bactérias envolvida na biohidrogenação do rúmen e a interação desses fatores. Além do mais, varios outros fatores podem afetar a composição de ácidos graxos da carne e do leite de bovinos, entre eles a relação volumoso: concentrado, adições de tampões, de ionóforos ou de óleos à dieta, o estágio de crescimento da pastagem, o grupo genético, heterose, condição sexual e idade do animal (Fellner et al.,1997; Freitas et. al., 2006; Kuss et. al., 2007; Menezes et. al., 2008).
Segundo Bauman et al. (2001), altas concentrações de C18:2 (ácido linoléico) inibem o último passo da biohidrogenação, permitindo o acúmulo de C18:1 trans-11(ácido vaccênico) no rúmen, que pode ser reconfigurado no tecido adiposo em CLA cis-9 trans-11, por meio da enzima 9-dessaturase.
lipólise e a biohidrogenação, resultando em carne com o perfil lipídico mais insaturado. Em um levantamento sobre a concentração de CLA na gordura da carne de bovinos na Australia e na Alemanha, foram verificadas concentrações de 2 a 3 vezes mais elevadas quando comparadas aos bovinos dos EUA (Shantha et al., 1994; Fritsche e Steinhart, 1998). Essa diferença está amplamente relacionada com a dieta.
Mir et al. (2004) adicionaram óleo de girassol na dieta de bovinos em confinamento e conseguiram aumentar em mais do que cinco vezes a concentração de CLA na carne. Isso demonstra que a escolha de alimentos ricos em ácido linoléico (C18:2), como o óleo de girassol, aumenta a quantidade de CLA na carne dos animais.
Medeiros et al. (2002) observaram que animais terminados em pastagens temperadas tendem a apresentar um maior teor de CLA e menor relação -6/ -3. Por outro lado, animais alimentados com pastagens tropicais tendem a ter menor teor de CLA. Os animais terminados em confinamentos tendem a ter maior relação -6/ -3.
Outro fato observado por Van Nevel e Demeyer (1995), em estudos in vitro, foi que a inclusão da monensina sódica na dieta, na qual diminuiu a taxa e a extensão da biohidrogenação, possibilitou o acúmulo de CLA e C18:1 trans-11 (ácido vaccênico) no conteúdo ruminal, pelo fato das bactérias que fazem a biohidrogenação serem gram-positivas (bactérias sensíveis aos ionóforos). Segundo alguns autores, os ionóforos possuem efeitos variáveis sobre a concentração de CLA (Dhiman et al., 1996; Chouinard et al., 1998b; Sauer et al., 1998). No entanto, não foram encontradas na literatura publicações em que tenha sido avaliado o efeito da monensina sobre o perfil de ácidos graxos de cadeia longa depositados na carcaça e somente alguns poucos estudos relacionaram a presença da monensina.
3. REFERÊNCIAS BIBLIOGRÁFICAS
AFONSO, J. A. B. et al. Efeito da monensina sódica sobre as características do suco ruminal na acidose láctica experimental em ovinos. Revista Brasileira Medicina Veterinária, v. 24, p. 203-210, 2002.
ASLAN, V. et al. Induced acute ruminal acidosis in goats treated with yeast (Saccharomyces cerevisiae) and bicarbonate. Acta Veterinaria Scandinavica, v. 36, p. 65-77, 1995.
ASSOCIAÇÃO BRASILEIRA DAS INDÚSTRIAS EXPORTADORAS DE CARNE.
Estatísticas: volume das exportações entre Janeiro e Dezembro, 2009. Disponível em: <http://abiec.com.br/downloado/stat_balanco.pdf>. Acesso em: 17 jan. 2010. BAILEY, C. B., BALCH, C. C. Saliva secretion and its relation to feeding in cattle. 1.The
composition and rate of secretion of parotid saliva in a small steer. British Journal of Nutrition, v. 15, p. 371-383, 1961.
BANNI, S., MARTIN J. C. Conjugated linoleic acid and metabolites. In SEBEDIO, J. J., CHRISTIE, W. W. (Eds.). Trans fatty acids inhuman nutrition. Dundee: Oily Press, 1998. p. 261-302.
BARTLEY, E. E. et al. Effects of lasalocid or monensin on legume or grain (feedlot) bloat. Journal Animal Science, v. 56, p. 1400-1406, 1983.
BARTSCH, H., NAIR, J., OWEN, R. W. Dietary polyunsaturated fatty acids and cancers of the breast and colorectum: emerging evidence for their role as risk modifiers.
Carcinogenesis, v. 20, p. 2209-2218, 1999.
BASTOS, J. P. S. T. Et al. Efeito do preparado de anticorpos policlonais (PAP) sobre o pH ruminal de bovinos recebendo dieta de alto concentrado. In SIMPÓSIO INTERNACIONAL DE NUTRIÇÃO DE RUMINANTES FMVZ-UNESP, 2., 2009. Anais… Botucatu: UNESP, FMVZ, 2009. 1 CD-ROM.
BAUER, M. L. et al. Efficacy of laidlomycin propionate to reduce ruminal acidosis in cattle. Journal Animal Science, v. 73, p. 3445-3454, 1995.
BAUMAN, D. E. et al. Biosynthesis of conjugated linoleic acid in ruminants. Journal Animal Science, 1999. Disponível em: <jas.fass.org/cgi/reprint/77/E-Suppl/1-ae.pdf>. Acesso em: 17 nov. 2009.