Programa de Pós-Graduação em Genética
MAYSA SUCCI
Alteração da expressão da Anexina-A1 e Galectina-1
na Progressão do Câncer Colorretal Esporádico
Programa de Pós-Graduação em Genética
MAYSA SUCCI
Alteração da expressão da Anexina-A1 e Galectina-1
na Progressão do Câncer Colorretal Esporádico
Dissertação apresentada para obtenção do título de Mestre em Genética.
Orientadora: Profa. Dra. Ana Elizabete Silva
Coorientadora: Profa. Dra. Eny Maria Goloni Bertollo
Succi, Maysa.
Alteração da expressão da Anexina-A1 e Galectina-1 na progressão do câncer colorretal esporádico / Maysa Succi. - São José do Rio Preto: [s.n.], 2013.
85 f. : il. ; 30 cm.
Orientador: Ana Elizabete Silva
Coorientador: Eny Maria Goloni Bertollo
Dissertação (mestrado) - Universidade Estadual Paulista, Instituto de Biociências, Letras e Ciências Exatas
1. Inflamação. 2. Câncer colorretal. 3. Anexina-A1. 4. Galectina-1. 5. Proliferação celular. I. Silva, Ana Elizabete. II. Goloni-Bertollo, Eny Maria. III. Universidade Estadual Paulista, Instituto de Biociências, Letras e Ciências Exatas. IV. Título.
CDU – 616.348
MAYSA SUCCI
Alteração da expressão da Anexina-A1 e Galectina-1
na Progressão do Câncer Colorretal Esporádico
Dissertação apresentada para obtenção do título de Mestre em Genética junto ao Programa de Pós-Graduação em Genética do Instituto de Biociências, Letras e Ciências Exatas da
Universidade Estadual Paulista “Júlio de Mesquita Filho”, Campus de São José do Rio Preto.
BANCA EXAMINADORA:
Profa. Dra. Ana Elizabete Silva UNESP – São José do Rio Preto Orientadora
Profa. Dra. Patricia Pintor dos Reis UNESP – Botucatu
Profa. Dra. Cristiane Damas Gil UNIFESP – São Paulo
O presente trabalho foi realizado no Laboratório de Citogenética e
Biologia Molecular Humana, no Laboratório de Imunomorfologia, ambos do
Departamento de Biologia do Instituto de Biociências, Letras e Ciências Exatas
(IBILCE) de São José do Rio Preto/SP - Universidade Estadual Paulista (UNESP), na
Unidade de Pesquisa em Genética e Biologia Molecular do Departamento de Biologia
Molecular da Faculdade de Medicina de São José do Rio Preto-SP (FAMERP) e no
Instituto de Anatomia Patológica e Citopatologia (IAPC) de São José do Rio Preto-SP,
com o apoio financeiro na forma de bolsa de estudos fornecido pelo Conselho Nacional
de Desenvolvimento Científico e Tecnológico (CNPq) e auxílio à pesquisa concedido
Dedicatória
Dedico este trabalho aos meus queridos pais, Roberto Succi e Maria Ignez
Marini Succi, por me darem a oportunidade e o incentivo para a realização dos meus
Agradecimentos
A Deus, pela vida, pela força e pelo imensurável amor.À minha orientadora, Profa. Dra. Ana Elizabete Silva, pela oportunidade e confiança em mim depositada e pelo exemplo de profissionalismo, dedicação e competência.
À minha coorientadora, Profa. Dra. Eny Maria Goloni Bertollo e a Profa. Dra. Érika Cristina Pavarino, que me acolheram em seu laboratório desde o estágio básico e estiveram sempre dispostas a me ajudar, proporcionando-me oportunidades para crescer profissionalmente.
À Profa. Dra. Sonia Maria Oliani, pelo conhecimento transmitido e pela contribuição na análise imuno-histoquímica das proteínas anexina-A1 e galectina-1.
Ao Instituto de Biociências, Letras e Ciências Exatas (IBILCE/UNESP), pela infraestrutura e pelo excelente ensino de qualidade que possibilitou tanto a minha formação profissional quanto pessoal.
Ao Programa de Pós-Graduação em Genética do IBILCE/UNESP e a todos os seus professores, pela constante manutenção e fortalecimento do curso de pós-graduação da Instituição.
Aos pacientes, sem os quais este trabalho não seria possível, obrigada pela contribuição com as amostras e, principalmente, pelo exemplo de perseverança. Sem mais palavras, a vocês eu dedico a frase de John Ruskin: “A maior recompensa para o trabalho do homem não é o que ele ganha com isso, mas o que ele se torna com isso”.
Aos médicos, residentes, enfermeiros e secretários do Serviço de Coloproctologia do Hospital de Base de São José do Rio Preto, em especial ao Dr. João Gomes Netinho, coordenador da equipe médica, pela colaboração na obtenção das amostras.
Ao Dr. Alaor Caetano, ao Dr. Wagner Colaiocovo e à enfermeira Aldenir Fresca, todos do Centro de Endoscopia Rio Preto, também pela colaboração na obtenção das amostras.
Ao Dr. Dalisio De Santi Neto, patologista do Hospital de Base de São José do Rio Preto, pelo auxílio com os diagnósticos anatomopatológicos e pela obtenção das amostras em blocos parafinados.
também pelo auxílio com os diagnósticos anatomopatológicos, pela obtenção das amostras em blocos parafinados e pelo auxílio com a técnica de imuno-histoquímica e análise da expressão do Ki-67.
À Profa. Dra. Cristiane Damas Gil e à Profa. Dra. Debora A. P. C. Zuccari, membros da banca examinadora do exame geral de qualificação, pelas importantes colocações que contribuíram muito para melhorar o meu trabalho.
À Profa. Dra. Cristiane Damas Gil e à Profa. Dra. Patricia Pintor dos Reis, membros da banca examinadora da defesa final, pela disponibilidade e colaboração.
Aos amigos do Laboratório de Citogenética e Biologia Molecular Humana (IBILCE/UNESP), Aline, Ana Flávia, Ayla, Fernanda, Luiz, Marcela, Nathália e Simone, companheiros de trabalho com quem aprendi e me diverti muito. Em especial à assistente de suporte acadêmico Joice Matos Biselli pelos ensinamentos e ajuda com as análises estatísticas.
Aos amigos da Unidade de Pesquisa em Genética e Biologia Molecular (UPGEM/FAMERP), em especial à Dra. Patrícia Matos Biselli Chicote, por ter me ensinado a técnica de PCR em tempo real.
Aos amigos do Laboratório de Imunomorfologia (IBILCE/UNESP), em especial à mestranda Caroline de Freitas Zanon, por ter me ensinado a técnica de imuno-histoquímica, e à Analice Andreoli pela ajuda com os cortes histológicos.
Aos amigos do Laboratório de Genômica Estrutural e Comparativa (IBILCE/UNESP), Bruna, Lucas, Mariana Maciel, Mariana Victoretti e Nedênia, obrigada pelos incentivos e pelo companheirismo.
A todos os amigos de graduação, em especial à Cássia, Renata, Tamires e Vívian, e de pós-graduação, em especial à Adriana, Ana Letícia, Elaine, Lucilene e Priscila, pela amizade e bons momentos compartilhados.
À minha família, em especial a minha vó Olívia, pelas orações, aos meus pais Roberto e Maria Ignez, às minhas irmãs Brunela e Thais por acreditarem em mim, proporcionando forças para que eu pudesse seguir em frente. Eu amo vocês!
Ao meu noivo Everton pelo carinho, incentivo e, principalmente, pela enorme paciência. Seu apoio foi fundamental para a elaboração deste trabalho.
À Fundação de Amparo a Pesquisa do Estado de São Paulo (FAPESP) pelo apoio financeiro na compra de materiais necessários para a realização desta pesquisa e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela concessão da bolsa de estudo.
Epígrafe
“ O único homem que está isento de erros
é aquele que não arrisca acertar”
Albert Einstein
“ A ciência é o melhor remédio
para medir nossa ignorância”
SUMÁRIO
LISTA DE ABREVIAÇÕES E SIGLAS ... i
LISTA DE FIGURAS ... iii
LISTA DE TABELAS ... vi
RESUMO ... vii
ABSTRACT ... viii
1. INTRODUÇÃO ... 1
1.1 Inflamação e câncer... 1
1.2 Câncer colorretal ... 3
1.3 Proteínas anti-inflamatórias Anexina-A1 e Galectina-1 ... 6
2. OBJETIVOS ... 14
3. MATERIAIS E MÉTODOS ... 15
3.1 Consideração sobre aspectos éticos ... 15
3.2 Casuística ... 15
3.3 Métodos para avaliação da expressão gênica ... 17
3.3.1 Extração, quantificação e avaliação da integridade do RNA total ... 17
3.3.2 Síntese e avaliação da integridade do cDNA ... 18
3.3.3 Quantificação da expressão gênica relativa por PCR quantitativa em tempo real (qPCR) ... 19
3.4 Análise imuno-histoquímica ... 22
3.5 Análises estatísticas ... 24
4. RESULTADOS ... 25
4.1 Expressão gênica relativa de ANXA1 e LGALS1... 25
4.2 Análise imuno-histoquímica das proteínas Anexina-A1 e Galectina-1 ... 28
4.3 Índice de proliferação celular (IP)... 32
5. DISCUSSÃO ... 35
6. CONCLUSÕES ... 42
7. REFERÊNCIAS BIBLIOGRÁFICAS ... 43
ANEXOS ... 54
Anexo I – Parecer do Comitê de Ética em Pesquisa ... 54
Anexo II – Termo de Consentimento Livre e Esclarecido ... 55
Anexo III – Questionário padronizado ... 56
i
LISTA DE ABREVIAÇÕES E SIGLAS
ABC do inglês ATP-Binding Cassette
ACTB do inglês β-actin (gene)
AD(s) Adenoma(s)
ADC(s) Adenocarcinoma(s)
ALXR do inglês Lipoxin A4 Receptor
ANX Anexinas
AnxA1 Anexina-A1 (proteína)
ANXA1 do inglês Annexin-A1 (gene)
APC do inglês Adenomatous Polyposis Coli (gene)
BSA Soroalbumina Bovina, do inglês Bovine Serum Albumin
CCR Câncer Colorretal
cDNA DNA complementar, do inglês complementary DNA
COX-2 Ciclooxigenase-2
cPLA2 Fosfolipase A2 citosólica, do inglês cytosolic Phosfolipase A2
Ct Ciclo threshold
CRD(s) Domínio(s) de Reconhecimento de Carboidratos, do inglês
Carbohydrate-Recognition Domains
DAB 3,3’-diaminobenzidina
DEPC Dietilpirocarbonato
DNA Ácido Desoxirribonucleico, do inglês Desoxirribonucleic Acid dNTP(s) Desoxirribonucleotídeo(s) Fosfatado(s)
E Eficiência de Amplificação
EGF Fator de crescimento epidermal, do inglês Epidermal Growth Factor
ERK Quinase regulada por sinais extracelulares, do inglês
Extracellular-Regulated Kinase
ERO Espécies Reativas de Oxigênio
ERN Espécies Reativas de Nitrogênio et al. e outros, do latim et alii
FAP Polipose Adenomatosa Familiar, do inglês Familial Adenomatous
Polyposis
FPR2 do inglês Formyl Peptide Receptor 2 Gal-1 Galectina-1 (proteína)
GAPDH do inglês Glyceraldehyde 3-Phosphate Dehydrogenase (gene)
GC(s) Glicocorticoide(s)
HNPCC Câncer Colorretal Hereditário Não-Polipoide, do inglês Hereditary
Non-Polyposis Colorectal Cancer
HRAS do inglês v-Ha-ras Harvey Rat Sarcoma Viral Oncogene Homolog (gene)
IL10 Interleucina 10, do inglês Interleukin 10
ii
IP Índice de Proliferação (celular)
KRAS do inglês v-Ki-ras2 Kirsten Rat Sarcoma Viral Oncogene Homolog
(gene)
LGALS1 do inglês Lectin, Galactoside-Binding, Soluble, 1 (gene)
MAPK Proteína quinase ativa por mitógeno, do inglês Mitogen-Activated Protein
Kinase
MgCl2 Cloreto de Magnésio
MGB do inglês Minor Groove Binder
mRNA RNA mensageiro, do inglês messenger RNA
pb Pares de Base
PBS Tampão Fosfato, do inglês Phosfate Buffer Solution
PCR Reação em Cadeia da Polimerase, do inglês Polymerase Chain Reaction qPCR PCR quantitativa, do inglês quantitative PCR
r Coeficiente de correlação
RNA Ácido Ribonucleico, do inglês Ribonucleic Acid
rpm Rotações Por Minuto
RQ Quantificação Relativa, do inglês Relative Quantification rRNA RNA ribossômico, do inglês ribosomal RNA
SEM Erro Padrão da Média, do ingles Standard Error of the Mean Ser27 Resíduo de Serina 27
shRNA do inglês short hairpin RNA
SMAD do inglês Mothers Against Decapentaplegic Homolog (gene)
Taq Thermus aquaticus
TNM
Classificação dos Tumores Malignos, do inglês TNM Classification (M: metástase à distância, N: envolvimento de linfonodos; T: tamanho do tumor)
TP53 do inglês Tumor Protein p53 (gene)
Tris-EDTA do inglês Tris(Hydroxymethyl)Aminomethane-Ethylenediamine
Tetraacetic Acid
U Unidades
ºC Grau Celsius (medida de temperatura)
nm Nanômetros (unidade de comprimento: 10-9 metros) µm Micrômetro (unidade de comprimento: 10-6 metros)
kDa Quilodaltons (unidade de massa: 1Da corresponde a 10-12 gramas) ng Nanogramas (unidade de massa: 10-9 gramas)
iii
LISTA DE FIGURAS
Figura 1. Inflamação favorece vários estágios da carcinogênese. A inflamação pode
contribuir na formação do tumor pela liberação de espécies reativas de oxigênio (ERO) e nitrogênio (ERN) que causam danos no DNA, prejudicam o sistema de reparo e alteram mecanismos epigenéticos que promovem a ativação de oncogenes e/ou a inativação de genes supressores de tumor. Durante o desenvolvimento tumoral, a geração excessiva de citocinas, quimiocinas e fatores de crescimento ativam, inapropriadamente, diversos fatores de transcrição de genes envolvidos na sobrevivência, proliferação e angiogênese. Além disso, a produção desses mediadores induzem o recrutamento adicional e a diferenciação de células do sistema imunológico no microambiente tumoral. Na fase metastática, as células inflamatórias continuam contribuindo com a produção de mediadores inflamatórios para promover a sobrevivência e aumentar a motilidade e a invasividade das células tumorais (adaptado de GRIVENNIKOV; KARIN, 2010)... 2
Figura 2. Anatomia colorretal evidenciando as três regiões de origem dos tumores.
Câncer de cólon proximal (originados próximos à flexura esplênica: ceco, cólon ascendente e cólon transverso), Câncer de cólon distal (localizados distalmente à flexura esplênica: cólon descendente e cólon sigmoide) e Câncer retal (LI; LAI, 2009).... ... .4
Figura 3. Progressão do câncer colorretal: sequência adenoma-carcinoma. A
progressão da mucosa colorretal normal para adenoma e deste para adenocarcinoma é caracterizada pelo acúmulo de mutações em genes particulares, como APC, KRAS,
SMAD2/4 e TP53, entre outras alterações genéticas e epigenéticas que podem ocorrer
em qualquer ponto da sequência (adaptado de DAVIES; MILLER; COLEMAN, 2005).... ... .5
Figura 4. Estrutura das Anexinas. (A) Representação esquemática da estrutura das
anexinas ligada à membrana (verde) de maneira dependente de Ca+2 (laranja), mostrando o domínio C-terminal formado por quatro “annexin repeats” (amarelo) e o domínio N-terminal (azul), localizado do lado oposto à superfície de ligação à membrana. (B) Estrutura molecular da Anexina-A1 na presença e ausência de Ca+2 (RESCHER; GERKE, 2004; GERKE; CREUTZ; MOSS, 2005, com adaptação).... ... .7
Figura 5. Mobilização da proteína AnxA1 em células ativadas (por exemplo, o
neutrófilo) e seu mecanismo de ação. Após a ativação celular, a AnxA1 citoplasmática é mobilizada em direção à membrana. Dependendo do tipo celular, a proteína pode ser exteriorizada e/ou secretada por três mecanismos: (A) ativação do transportador ABC,
iv
membrana específicos e secreção e (C) fusão de grânulos contendo a proteína com a membrana plasmática. Na presença de Ca2+, a AnxA1 extracelular sofre uma alteração conformacional que leva à exposição da região N-terminal e à ligação ao receptor FPR2 (também conhecido como ALXR), agindo de forma autócrina, parácrina e justácrina (contato célula-célula). A via AnxA1/FPR2 pode ser manipulada por glicocorticoides, os quais induzem a expressão dos genes da proteína e do receptor, aumentando, assim, os efeitos deste circuito anti-inflamatório (adaptado de PERRETTI; D’ACQUISTO,
2009).... ... .9
Figura 6. Estrutura das Galectinas. (A) Representação esquemática da estrutura da
família das galectinas. Com base nas características estruturais, as galectinas são classificadas em três grupos: prototype, chimera type e tandem-repeat type. O prototype apresenta um domínio de reconhecimento de carboidrato (CRD) por unidade e, geralmente, forma homodímeros compostos por duas subunidades ligadas não covalentemente. O chimera type é representado por uma proteína monomérica que consiste de apenas um CRD ligado a um curto peptídeo (com cerca de 120 aminoácidos) rico em prolina e glicina. O tandem-repeat type é caracterizado por proteínas formadas por dois CRDs distintos unidos em paralelo por um peptídeo de ligação que varia em relação à quantidade de aminoácidos; (B) Estrutura molecular da Galectina-1 (CAMBY et al., 2006; VASTA et al., 2009, com adaptações).... ... .11
Figura 7. Padrão eletroforético das subunidades 18S e 28S do rRNA em gel de agarose 1% corado com brometo de etídio. Colunas 1-2: amostras de adenoma
colorretal; Colunas 3-4: amostras de adenocarcinoma colorretal; Coluna 5: amostra de mucosa normal.... ... .18
Figura 8. Padrão eletroforético do gene ACTB evidenciando o fragmento de 613 pb em
gel de agarose 1,5% corado com brometo de etídio. M: Marcador de peso molecular de 100pb; Colunas 1-3: amostras de adenoma colorretal; Colunas 4-6: amostras de adenocarcinoma colorretal; Colunas 7-9: amostras de mucosa normal; C: Controle negativo da reação.... ... .19
Figura 9. Representação gráfica das curvas padrão dos genes ANXA1, LGALS1, ACTB e GAPDH, representando as quantidades iniciais de cDNA (ng/µ L) (eixo X) e os valores
da média de Ct das triplicatas (eixo Y)... ... .21
Figura 10. Expressão relativa em Log2 dos genes ANXA1 e LGALS1 por amostra de (A)
v
Figura 11. Expressão endógena da Anexina-A1 (AnxA1) na mucosa colorretal.
Imunorreatividade da AnxA1 em secções de tecido da mucosa colorretal pelo anticorpo policlonal rabbit anti-ANXA1 (Zymed Laboratories). Análise histológica mostrando imunomarcação moderada nas regiões epitelial e estromal da mucosa normal adjacente ao adenoma (AD) (A) e no AD (B). Observe imunopositividade mais intensa em ambas as regiões tanto da mucosa normal adjacente ao adenocarcinoma (ADC) (C) como no ADC (D). Contracoloração: Hematoxilina. Barras: 20µm. (E) Análise densitométrica (unidade arbitrária, u.a.) da expressão da AnxA1 na mucosa colorretal. Resultados apresentados em média ± SEM... ... .29
Figura 12. Expressão endógena da Galectina-1 (Gal-1) na mucosa colorretal.
Imunorreatividade da Gal-1 em secções de tecido da mucosa colorretal pelo anticorpo policlonal rabbit anti-Gal-1 (Zymed Laboratories). Imunopositividade moderada na porção basal do epitélio da mucosa normal adjacente ao adenoma (AD) (A) e dispersa no citoplasma das células epiteliais do AD (B). Imunomarcação moderada distribuída pelo citoplasma da mucosa normal adjacente ao adenocarcinoma (ADC) (C) e no ADC
(D). Observe que nos núcleos das células epiteliais e no estroma, a imunomarcação
moderada foi semelhante em todos os grupos experimentais. Contracoloração: Hematoxilina. Barras: 20µm. (E) Análise densitométrica (unidade arbitrária, u.a.) da expressão da Gal-1. Resultados apresentados em média ± SEM.... ... .30
Figura 13. Expressão do antígeno Ki-67 na mucosa colorretal. (A) Mucosa normal
vi
LISTA DE TABELAS
Tabela 1. Caracterização das amostras dos grupos de adenoma (AD) e adenocarcinoma
(ADC) colorretal quanto à idade, gênero, hábitos tabagista e etilista e sítio anatômico de origem das lesões. ... 16
Tabela 2. Comparação da expressão gênica relativa dos genes ANXA1 e LGALS1 entre
os grupos de adenoma (AD) e adenocarcinoma (ADC) colorretal e respectivas mucosas normais e entre os grupos... ... .25
Tabela 3. Comparação da expressão relativa dos genes ANXA1 e LGALS1 em relação as
variáveis idade, gênero, tabagismo e etilismo nos grupos de adenoma (AD) e adenocarcinoma (ADC) colorretal... ... .27
Tabela 4. Comparação da expressão relativa dos genes ANXA1 e LGALS1 em relação
ao sítio anatômico da lesão nos grupos de adenoma (AD) e adenocarcinoma (ADC) colorretal.... ... .28
Tabela 5. Valores médios de densitometria da expressão das proteínas Anexina-A1 e
Galectina-1 no citoplasma e núcleo do epitélio e no estroma dos grupos de adenoma (AD) e adenocarcinoma (ADC) colorretal em comparação a respectiva mucosa normal, e entre os grupos.... ... .32
Tabela 6. Comparação do IP entre os grupos de adenoma (AD) e adenocarcinoma
(ADC) colorretal e respectiva mucosa normal, e entre os grupos... ... .34
Tabela 7. Caracterização das amostras de pacientes com adenoma (AD) colorretal...57
Tabela 8. Caracterização das amostras de pacientes com adenocarcinoma (ADC)
vii
RESUMO
Introdução: Alterações nos níveis de expressão de moduladores da resposta
inflamatória, como a Anexina-A1 (AnxA1/ANXA1) e a Galectina-1 (Gal-1/LGALS1) têm sido observadas em diversos tipos de câncer. O câncer colorretal, um dos modelos da associação inflamação-câncer progride, na sequência, do epitélio normal para adenoma (AD) e adenocarcinoma (ADC). Objetivos: Avaliar a expressão gênica e proteica da AnxA1 e Gal-1 e o índice de proliferação celular (IP) em amostras de AD, ADC esporádico e das mucosas normais adjacentes, assim como investigar a ocorrência de correlação entre os níveis de expressão de ambos os mRNA e de associação com fatores de risco (idade, gênero, tabagismo e etilismo) e sítio anatômico de origem da lesão. Materiais e Métodos: As análises foram realizadas pelas técnicas de PCR quantitativa em tempo real (qPCR), para quantificar os níveis de mRNA de ANXA1 e
LGALS1 em 70 biópsias de lesão (27AD e 43ADC) e 58 de mucosa normal adjacente
(19 e 39 respectivamente), e de imuno-histoquímica, para caracterizar a expressão proteica da AnxA1 e Gal-1 em 25 biópsias de lesão (10AD e 15ADC) e 16 de mucosa normal adjacente (6 e 10 respectivamente), como também investigar o IP pela detecção do antígeno Ki-67 em 44 biópsias de lesão (19AD e 25ADC) e 16 de mucosa normal adjacente (8 em ambas). Resultados: A expressão relativa de ANXA1 apresentou-se elevada em comparação à mucosa normal tanto no AD (RQ=1,11; P=0,040), como no ADC (RQ=2,33; P<0,001). Contudo, LGALS1 apresentou expressão relativa aumentada apenas no ADC em comparação à mucosa normal (RQ=1,85; P<0,001), enquanto no grupo AD foi observada expressão basal (RQ=0,90; P=0,319). A comparação entre as lesões mostrou que ambos os genes apresentam-se significantemente mais expressos no ADC em comparação ao AD (ANXA1: P=0,039; LGALS1: P=0,019). Nos dois grupos de lesão foi observada correlação positiva entre expressão do mRNA dos referidos genes (AD: r=0,63, P=0,0004; ADC: r=0,73, P<0,0001). Contudo, não foram observadas associações entre os valores de expressão do mRNA de ANXA1 e LGALS1 e os fatores de risco como idade, tabagismo e etilismo e o sítio anatômico das lesões, mas no grupo ADC, o gene ANXA1 apresentou expressão relativa duas vezes maior nos indivíduos do gênero feminino (RQ=3,61; P=0,021) em comparação ao masculino (RQ=1,79). A análise imuno-histoquímica da AnxA1 revelou imunomarcação intensa em ADC e moderada em AD, enquanto a Gal-1 apresentou imunomarcação moderada no epitélio e no estroma em ambas as lesões. A análise de densitometria da AnxA1 evidenciou expressão mais elevada no citoplasma e núcleo do epitélio e no estroma do ADC (média±SEM: 191,1±2,25, 201,6±1,67, 194,1±1,50; P<0,001, P<0,001, P=0,002, respectivamente) em relação ao AD (média±SEM: 172,3±3,26, 187,4±2,44, 176,7±3,11, respectivamente), enquanto a Gal-1 apresentou médias de densitometria menores e sem diferenças significantes entre os grupos. O IP apresentou-se elevado em ambas as lesões, quando comparado às mucosas normais adjacentes, porém foi maior no ADC (IP=68,8%; P<0,001) em relação ao AD (IP=54,3%; P<0,001). Conclusão: A AnxA1 apresenta-se hiperexpressa na sequência AD-ADC, enquanto a Gal-1 parece ser mais expressa apenas no ADC, sugerindo o envolvimento dessas proteínas com ação anti-inflamatória na carcinogênese colorretal esporádica, que manifesta intensa atividade proliferativa.
Palavras-chave: inflamação; câncer colorretal; Anexina-A1; Galectina-1; proliferação
viii
ABSTRACT
Introduction: Changes in expression levels of inflammatory response modulators,
such as Annexin-A1 (AnxA1/ANXA1) and Galectin-1 (Gal-1/LGALS1) have been observed in several types of cancer. Colorectal cancer, one of the models of inflammation-cancer association, progresses, in sequence, from normal epithelium to adenoma (AD) and adenocarcinoma (ADC). Objectives: To evaluate the gene and protein expression of AnxA1 and Gal-1 and the cell proliferation index (IP) in samples of AD, sporadic ADC and adjacent normal mucosa, as well as to investigate the occurrence of correlation between the mRNA expression levels and association with risk factors (age, gender, smoking and drinking habits) and anatomic site of lesion origin. Materials and Methods: The analyzes were performed by quantitative real-time PCR (qPCR) technique to quantify the levels of ANXA1 and LGALS1 mRNA in 70 biopsies of lesions (27AD and 43ADC) and 58 adjacent normal mucosa (19 and 39 respectively), and immunohistochemistry technique to characterize the protein expression of AnxA1 and Gal-1 in 25 biopsies of lesions (10AD and 15ADC) and 16 adjacent normal mucosa (6 and 10 respectively), and also to investigate the IP by detection of Ki-67 antigen in 44 biopsies of lesions (19AD and 25ADC) and 16 adjacent normal mucosa (8 in both). Results: The relative expression of ANXA1 showed higher compared to adjacent normal mucosa in both AD (RQ=1.11; P=0.040) and ADC (RQ=2.33; P<0.001). However, LGALS1 mRNA showed overexpression only in ADC compared to normal mucosa (RQ=1.85; P<0.001), while in AD group it was observed basal expression (RQ=0.90; P=0.319). The comparison between lesions showed that both genes were significantly more expressed in ADC compared to AD (ANXA1: P=0.039; LGALS1: P=0.019). In both lesion groups it was observed positive correlation between the mRNA expression of these genes (AD: r=0.63, P=0.0004; ADC: r=0.73, P<0.0001). However, no association was observed between ANXA1 and
LGALS1 mRNA expression values and risk factors such as age, smoking and drinking
habits and anatomic site of lesions, but in ADC group, the ANXA1 gene showed relative expression 2-fold higher in female individuals (RQ=3.61; P=0.021) compared to males (RQ=1.79). The immunohistochemistry analysis of AnxA1 showed intense immunostaining in ADC and moderate one in AD, while Gal-1 showed moderate immunostaining in epithelium and stroma in both lesions. The densitometric analysis for AnxA1 revealed overexpression in cytoplasm and nucleus of epithelium and in stroma of ADC (mean±SEM: 191.±2.25, 201.6±1.67, 194.1±1.50; P<0.001, P<0.001,
P=0.002, respectively) related to AD (mean±SEM: 172.3±3.26, 187.4±2.44,
176.7±3.11, respectively), while the Gal-1 showed lower means of densitometry and without significant differences between groups. The IP showed higher in both lesions when compared to adjacent normal mucosa, however it was higher in the ADC (IP=68.8%; P<0.001) compared to AD (IP=54.3%, P<0.001). Conclusion: AnxA1 shows overexpressed in AD-ADC sequence, while Gal-1 seems to be overexpressed only in ADC, suggesting the involvement of these proteins with anti-inflammatory actions in sporadic colorectal carcinogenesis that shows intense proliferative activity.
Key-words: inflammation; colorectal cancer; Annexin-A1; Galectin-1; cell
Introdução | 1
1. INTRODUÇÃO
1.1 Inflamação e câncer
A inflamação, um mecanismo de defesa do hospedeiro, é uma resposta às
lesões provocadas em decorrência de infecções por vírus, bactérias, parasitas ou outros
estímulos nocivos, tendo como principal objetivo reparar o tecido danificado
restaurando sua função (KUNDU; SURH, 2012). No entanto, a persistência das células
inflamatórias no local da injúria leva ao estabelecimento da fase crônica, na qual podem
ocorrer alterações no controle homeostático das vias de sinalização celular, contribuindo
para transformação maligna (KUNDU; SURH, 2012). Dessa forma, a desregulação da
resposta inflamatória é considerada um componente indispensável na progressão
tumoral (COUSSENS; WERB, 2002).
As evidências de que a inflamação crônica está relacionada ao
desenvolvimento do câncer baseiam-se no fato de que muitos tipos de tumores
originam-se frequentemente em sítios de inflamação persistente (ITZKOWITZ; YIO,
2004; FERRONE; DRANOFF, 2010). Estudos epidemiológicos demonstram que
aproximadamente de 10 a 15% dos cânceres estão relacionados às infecções por
microorganismos, e que 25% dessa doença está associada à inflamação crônica,
independentemente da presença da infecção (CHIBA; MARUSAWA; USHIJIMA,
2012).
Mantovani et al. (2008) sugeriram duas vias para explicar a relação entre o
câncer e a inflamação: intrínseca e extrínseca. A via intrínseca é desencadeada por
eventos oncogênicos que promovem a expressão de genes relacionados à inflamação
nas células neoplásicas, induzindo a formação do microambiente inflamatório o qual,
por sua vez, acelera o desenvolvimento do tumor. Na via extrínseca, o câncer é
originado em tecidos severamente danificados em consequência de condições
inflamatórias pré-existentes. Assim, independentemente de sua origem, a ocorrência da
inflamação no microambiente tumoral promove, ainda mais, o desenvolvimento do
câncer.
Diferentes células inflamatórias são frequentemente encontradas em maior
concentração nos tumores, se comparadas ao tecido normal circundante. Isso pode
Introdução | 2
evadir a vigilância imunológica e subverter seus mecanismos para uma ação
pró-tumorigênica (GRIVENNIKOV; KARIN, 2010). Nesse caso, as células inflamatórias
produzem grandes quantidades de espécies reativas de oxigênio (ERO) e nitrogênio
(ERN), que podem causar danos no DNA, prejudicar o sistema de reparo e induzir
alterações genéticas e epigenéticas que provocam a ativação de oncogenes e/ou a
inativação de genes supressores tumorais (COUSSENS; WERB, 2002; CHIBA;
MARUSAWA; USHIJIMA, 2012). Além disso, secretam uma variedade de
mediadores, como citocinas, quimiocinas e fatores de crescimento que alteram o perfil
de expressão gênica promovendo a proliferação celular, angiogênese, sobrevivência e
metástase (BALKWILL; MANTOVANI, 2012). Dessa forma, a inflamação
proporciona um microambiente favorável ao desenvolvimento e à progressão do câncer
(GRIVENNIKOV; KARIN, 2010) (Figura 1).
Figura 1. Inflamação favorece vários estágios da carcinogênese. A inflamação pode
Introdução | 3
1.2 Câncer colorretal
Muitos dos cânceres que afetam os órgãos do aparelho digestório servem
como modelos da relação entre inflamação e câncer (FERRONE; DRANOFF, 2010;
CHIBA; MARUSAWA; USHIJIMA, 2012). Dentre eles, destacam-se o câncer gástrico,
relacionado à infecção pela Helicobacter pylori, o câncer hepático, frequentemente
induzido por infecção do vírus da Hepatite C, e o câncer colorretal (CCR), associado às
doenças inflamatórias intestinais (RIZZO et al., 2011; KUNDU; SURH, 2012). Este
último, também tem sido associado, mais recentemente, à infecção pela Fusobacterium
nucleatum (TOVEY et al., 2011; CASTELLARIN et al., 2012; KOSTIC et al., 2012),
uma bactéria em forma de bacilo, anaeróbica e Gram-negativa, com potencial
patogênico variável e capacidade pró-inflamatória (STRAUSS et al., 2011).
Os órgãos do aparelho digestório estão expostos a fatores endógenos e
exógenos, como alimentos ingeridos, microorganismos e outros agentes ambientais e,
por isso, são infiltrados por muitas células imunes tanto em condições fisiológicas
quanto em condições patológicas, variando constantemente os níveis de inflamação,
apoiando, assim, a perpetuação da inflamação crônica (CHIBA; MARUSAWA;
USHIJIMA, 2012). No intestino, a ocorrência da inflamação crônica pode levar à perda
do muco protetor, aumentando a permeabilidade aos agentes exógenos (SAKAGUCHI;
BRAND; REINECKER, 2001). Além disso, as células das criptas encontram-se em
constante estado de proliferação e diferenciação à medida que migram da membrana
basal à luz intestinal, onde ficam expostas aos agentes carcinogênicos, o que pode
contribuir para o processo de malignização celular, originando o CCR (PINHO, 2009).
O termo “câncer colorretal” abrange todas as neoplasias malignas de origem
epitelial localizadas no intestino grosso (cólon) e reto (BELOV; ZHOU;
CHRISTOPHERSON, 2011), podendo ainda ser dividido em três entidades (câncer de
cólon proximal, distal e retal) de acordo com os diferentes sítios anatômicos de origem
do tumor (LI; LAI, 2009) (Figura 2). O principal tipo histológico dessa neoplasia é o
adenocarcinoma (ADC), responsável por cerca de 95% dos casos, enquanto os demais
tipos histológicos incluem ADC mucinoso, carcinoma de células escamosas e
Introdução | 4
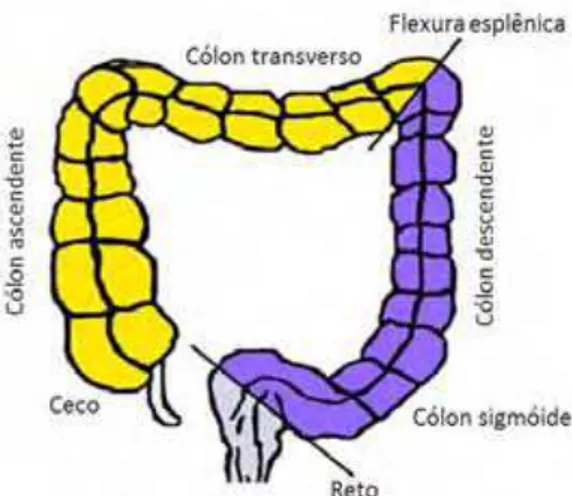
Figura 2. Anatomia colorretal evidenciando as três regiões de origem dos tumores.
Câncer de cólon proximal (originados próximos à flexura esplênica: ceco, cólon ascendente e cólon transverso), Câncer de cólon distal (localizados distalmente à flexura esplênica: cólon descendente e cólon sigmoide) e Câncer retal (LI; LAI, 2009).
O CCR é um problema mundial, ocupando a terceira posição entre os tipos
de câncer mais comumente diagnosticados (FERLAY et al., 2010), com incidência
anual de aproximadamente 1 milhão de casos e mortalidade maior que 500.000 (DILIP
et al., 2012). No Brasil, essa neoplasia encontra-se na terceira posição em incidência e,
de acordo com o Instituto Nacional de Câncer, foram estimados para o ano de 2012
14.180 novos casos em homens e 15.960 em mulheres (INCA, 2012). Apesar da
semelhança na incidência entre os gêneros, há diferenças quanto à sua localização no
intestino, uma vez que as mulheres desenvolvem, principalmente, o câncer de cólon,
enquanto os homens, o câncer de reto (SANTOS JR, 2007).
A busca pela compreensão dos mecanismos da carcinogênese colorretal vem
ganhando impulso nos últimos anos devido à sua incidência elevada e ao impacto na
vida dos indivíduos afetados (LI; LAI, 2009). Sabe-se que a história pessoal de
adenoma (AD) e familiar de CCR e de condições hereditárias, como Polipose
Adenomatosa Familiar (Familial Adenomatous Polyposis - FAP) e Câncer Colorretal
Hereditário Não-Polipoide (Hereditary Non-Polyposis Colorectal Cancer - HNPCC) ou
Síndrome de Lynch são fatores que predispõem ao aparecimento dessa neoplasia
(ITZKOWITZ; YIO, 2004). Além disso, associações com doenças inflamatórias
intestinais, como a retocolite ulcerativa e a doença de Crohn, também aumentam o risco
Introdução | 5
O CCR é considerado uma doença multifatorial, no entanto, acredita-se que
os fatores ambientais desempenham um papel mais importante do que a hereditariedade,
uma vez que o CCR esporádico corresponde anualmente a cerca de 90% dos casos
(ZAMPINO et al., 2009). Estima-se também que de 70 a 90% do desenvolvimento
dessa doença possa ser prevenido por mudanças no estilo de vida, pois os hábitos
tabagista e etilista e o consumo excessivo de alimentos de origem animal com alto teor
de gorduras e pequena quantidade de frutas, verduras e fibras, são considerados
importantes fatores de risco para o CCR esporádico (PARKIN, 2011; PARKIN; BOYD
2011a,b). Outros fatores de risco incluem a idade acima dos 50 anos, a obesidade, o
sedentarismo (BEYDOUN; BEYDOUN, 2008) e o diabetes (LARSSON; ORSINI;
WOLK, 2005).
Dentre os fatores genéticos envolvidos na etiologia do CCR esporádico
destaca-se, como evento inicial, uma mutação no gene supressor de tumor APC
encontrada em 80% dos casos, sugerindo que a tumorigênese colorretal esporádica siga
a sequência “adenoma-carcinoma”, assim como na FAP (CHEAH, 2009). A progressão da mucosa normal para AD, e deste para ADC, também está associada ao acúmulo de
mutações em genes como o TP53, KRAS e SMAD2/4, considerados de grande
importância para esse tipo de progressão tumoral, apesar de não explicarem com êxito o
surgimento de todos os CCRs (DAVIES; MILLER; COLEMAN, 2005), entre outras
alterações genéticas (Figura 3).
Figura 3. Progressão do câncer colorretal: sequência adenoma-carcinoma. A
progressão da mucosa colorretal normal para adenoma e deste para adenocarcinoma é caracterizada pelo acúmulo de mutações em genes particulares, como APC, KRAS,
SMAD2/4 e TP53, entre outras alterações genéticas e epigenéticas que podem ocorrer
Introdução | 6
Os pólipos adenomatosos (ou ADs) são protuberâncias que se projetam no
lúmen intestinal, classicamente considerados lesões pré-malignas que fazem parte das
etapas da carcinogênese colorretal. O período de tempo necessário para o
desenvolvimento do ADC a partir do AD é longo, mesmo com estimativas
conservadoras indicando um intervalo de 5 a 10 anos. Como observado, o surgimento
do AD e sua progressão para ADC é resultado do acúmulo de alterações genéticas e
epigenéticas que, dentre outras causas, promovem o desequilíbrio entre a apoptose e a
proliferação das células epiteliais da mucosa intestinal (DAVIES; MILLER;
COLEMAN, 2005).
Para avaliar a proliferação celular nesses tipos de tumores, a expressão do
antígeno Ki-67 tem sido frequentemente utilizada como marcador (MENEZES et al.,
2010; ANDRADE et al., 2011). O Ki-67 é uma proteína nuclear e nucleolar que está
presente apenas nas fases ativas do ciclo celular (G1, S, G2 e mitose) (SCHOLZEN;
GERDES, 2000) e ausente durante o processo de reparo do DNA, sendo, portanto,
considerado um excelente marcador de células em proliferação (SOUSA et al., 2012).
No tecido colorretal, pesquisas têm mostrado que a expressão do Ki-67 aumenta
gradualmente com o grau de displasia dos ADs (NUSSRAT et al., 2011; SOUSA et al.,
2012) e com a recorrência do tumor (MENEZES et al., 2010).
1.3 Proteínas anti-inflamatórias Anexina-A1 e Galectina-1
Já está bem estabelecido que os fatores envolvidos na resposta inflamatória
interagem formando complexas vias de sinalização molecular que, além de defender
contra a infecção e a injúria, podem contribuir para o processo tumorigênico. Dessa
forma, a relação entre o câncer e a inflamação pode ter um duplo papel
(RODRIGUEZ-VITA; LAWRENCE, 2010). O sistema imune também é capaz de reconhecer e eliminar
células cancerosas por meio de mediadores anti-inflamatórios endógenos que atuam
para manter a homeostasia da resposta imunológica e prevenir a lesão tecidual
(OLIANI; GIL, 2006). Entre eles, a Anexina-A1 e a Galectina-1 têm chamado a atenção
dos pesquisadores por desempenhar múltiplos papéis relacionados não apenas à
resolução da inflamação, mas também ao desenvolvimento e progressão de diversos
Introdução | 7
A Anexina-A1 (AnxA1) pertence a uma família multigênica de proteínas
estruturalmente relacionadas, caracterizadas pela presença de um domínio C-terminal
homólogo e por um domínio N-terminal variável em comprimento e composição que
possui sítios de fosforilação, acetilação e glicosilação. O domíno C-terminal, composto
por quatro ou, como na Anexina-A6, oito repetições de uma sequência conservada com
cerca de 70 aminoácidos, chamada “annexin repeats”, é responsável pela propriedade de ligação aos fosfolipídios carregados negativamente, de maneira dependente de cálcio
(Ca2+) (GERKE; MOSS, 2002; RESCHER; GERKE, 2004) (Figura 4).
Figura 4. Estrutura das Anexinas. (A) Representação esquemática da estrutura das
anexinas ligada à membrana (verde) de maneira dependente de Ca+2 (laranja), mostrando o domínio C-terminal formado por quatro “annexin repeats” (amarelo) e o domínio N-terminal (azul), localizado do lado oposto à superfície de ligação à membrana. (B) Estrutura molecular da Anexina-A1 na presença e ausência de Ca+2 (RESCHER; GERKE, 2004; GERKE; CREUTZ; MOSS, 2005, com adaptação).
Até o momento, foram identificadas treze proteínas que compõem a família
das anexinas (ANX) presente nos mamíferos (PERRETTI; D’ACQUISTO, 2009). A similaridade estrutural do domínio C-terminal pode explicar muitas das características
comuns da família como, por exemplo, suas atividades antifosfolipases, anticoagulantes
e anti-inflamatórias (RAYNAL et al., 1993), enquanto que o domínio N-terminal,
específico para cada proteína, interage com seus diferentes ligantes, conferindo a elas
inúmeras atividades funcionais dentro e fora das células (GERKE; CREUTZ; MOSS,
2005).
Introdução | 8
As ANX, em geral, são proteínas solúveis localizadas no citoplasma e se
ligam à membrana quando os níveis de Ca2+ estão elevados, interferindo, assim, na
organização da membrana e do citoesqueleto, no transporte de substâncias, no tráfego
de vesículas e no fluxo de íons (GERKE; CREUTZ; MOSS, 2005). Além disso, elas
podem deslocar-se em direção ao núcleo e ao exterior da célula, regulando diversas
funções celulares, tais como, diferenciação, migração, divisão, regulação do
crescimento, transdução de sinal, interação célula-matriz e apoptose (GERKE; MOSS,
2002; MUSSUNOOR; MURAY, 2008).
A AnxA1, a primeira representante da família que teve seu gene clonado
(WALLNER et al., 1986), possui massa molecular de 37 kDa e é codificada pelo gene
ANXA1 localizado na região cromossômica 9q12-q21.2 (MUSSUNOOR; MURAY,
2008). Essa proteína era conhecida como lipocortina-1 pelo fato de mimetizar a ação
anti-inflamatória dos glicocorticoides (GCs) (LIM; PERVAIZ, 2007). Ela inibe a ação
da fosfolipase A2 citosólica (cPLA2), enzima que fornece ácido araquidônico livre para
formação dos eicosanoides pró-inflamatórios, atuando como mediadora da resposta
inflamatória (FLOWER; BLACKWELL, 1979). Outras enzimas que podem ser alvos
da modulação da AnxA1 são, por exemplo, a óxido nítrico sintase induzida (iNOS) e a
ciclooxigenase-2 (COX-2). Além disso, a AnxA1 estimula a liberação da interleucina
10 (IL10), uma citocina anti-inflamatória que pode inibir a expressão de outras enzimas,
incluindo a iNOS e a COX-2 (PARENTE; SOLITO, 2004; VAGO et al., 2012).
Os mecanismos propostos para o efeito anti-inflamatório da AnxA1 são
diversos (SOLITO et al., 2003). Em condições fisiológicas, células como neutrófilos,
monócitos e macrófagos apresentam altas concentrações dessa proteína no seu
citoplasma. Sob condições de inflamação, a AnxA1 é deslocada para a superfície
externa da célula ou secretada, interagindo com receptores de superfície de forma
autócrina e parácrina, onde exerce sua função reguladora (PERRETTI; D’ACQUISTO,
2009). Além disso, a AnxA1 pode desencadear a apoptose dos leucócitos, contribuindo
para a resolução da inflamação (VAGO et al., 2012).
A externalização da AnxA1 na membrana plasmática dos leucócitos
ativados bloqueia a interação dessas células com o endotélio, impedindo sua
transmigração e o acúmulo de células inflamatórias nos locais de injúria (OLIANI, GIL;
Introdução | 9
estão totalmente esclarecidos, porém, estudos indicam que eles são célula-específicos e
incluem a ativação do transportador ABC (ATP-Binding Cassette), a fosforilação do
resíduo de serina 27 (Ser27) N-terminal e a fusão da membrana plasmática com grânulos
contendo a proteína (PERRETTI; D’ACQUISTO, 2009) (Figura 5).
Figura 5. Mobilização da proteína AnxA1 em células ativadas (por exemplo, o
neutrófilo) e seu mecanismo de ação. Após a ativação celular, a AnxA1 citoplasmática é mobilizada em direção à membrana. Dependendo do tipo celular, a proteína pode ser exteriorizada e/ou secretada por três mecanismos: (A) ativação do transportador ABC,
(B) fosforilação do resíduo Ser27 N-terminal, seguido da ligação a domínios de membrana específicos e secreção e (C) fusão de grânulos contendo a proteína com a membrana plasmática. Na presença de Ca2+, a AnxA1 extracelular sofre uma alteração conformacional que leva à exposição da região N-terminal e à ligação ao receptor FPR2 (também conhecido como ALXR), agindo de forma autócrina, parácrina e justácrina (contato célula-célula). A via AnxA1/FPR2 pode ser manipulada por glicocorticoides, os quais induzem a expressão dos genes da proteína e do receptor, aumentando, assim, os efeitos deste circuito anti-inflamatório (adaptado de PERRETTI; D’ACQUISTO, 2009).
Walther, Riehemann e Gerke (2000) observaram que a AnxA1 exerce sua
função por meio da interação direta com receptores de peptídeos formilados (FPRs -
Formyl Peptide Receptors) acoplados à proteína G. Estudos in vitro demonstraram que
o peptídeo Ac2-26 N-terminal da proteína pode ativar os três receptores da família FPR,
sendo eles o FPR1, o FPR2 (também conhecido como ALXR, o receptor da Lipoxina
Introdução | 10
Os níveis de AnxA1 também são regulados pelos GCs. Estes podem
contribuir para a ação regulatória da proteína aumentando sua expressão e induzindo a
síntese do seu receptor (PERRETTI; D’ACQUISTO, 2009). Além disso, tanto a AnxA1, quanto os GCs, interferem na atividade das moléculas de adesão como, por
exemplo, a selectina, contribuindo para a regulação do processo de transmigração dos
leucócitos (PARENTE; SOLITO, 2004).
A diversidade funcional da AnxA1 contribui para o seu duplo papel nos
mecanismos relacionados ao desenvolvimento do câncer, tanto em termos de atividade
protetora quanto de atividade oncogênica (YOM et al., 2011). Estudos demonstram
alterações na expressão dessa proteína em diversos tipos de câncer, sugerindo sua
atividade anti-inflamatória (ZHANG et al., 2010) ou sua contribuição com os processos
neoplásicos (MUSSUNOOR; MURAY, 2008). De modo geral, as ANXs estão
relacionadas a uma variedade de papéis durante a progressão tumoral, incluindo o
envolvimento nas vias de sinalização celular, motilidade celular, metástase,
angiogênese, proliferação, apoptose e resistência às drogas (HAYES; MOSS, 2004;
MUSSUNOOR; MURRAY, 2008).
A Galectina-1 (Gal-1) também é uma proteína que desempenha múltiplos
papéis na resposta inflamatória e no desenvolvimento do câncer
(CEDENO-LAURENT; DIMITROFF, 2012). Ela pertence a uma família evolutivamente
conservada de lectinas animais que compartilham domínios específicos de
reconhecimento de carboidratos denominados CRDs (Carbohydrate-Recognition
Domains), compostos por aproximadamente 130 aminoácidos, que são responsáveis
pela afinidade aos β-galactosídeos (ITO et al., 2012).
Atualmente, são conhecidas quinze galectinas nos mamíferos, sendo a Gal-1
a mais estudada no contexto da regulação da resposta imune (LIU; RABINOVICH,
2010; RABINOVICH; CROCI, 2012). Com base nas características estruturais, elas são
classificadas em três grupos: prototype, chimera type e tandem-repeat type. A Gal-1,
junto com a maioria das galectinas, pertence ao grupo prototype, normalmente
composto por proteínas homodiméricas formadas por dois CRDs semelhantes ligados
de forma não covalente (Figura 6) (VASTA et al., 2009; RABINOVICH; CROCI,
Introdução | 11
Figura 6. Estrutura das Galectinas. (A) Representação esquemática da estrutura da
família das galectinas. Com base nas características estruturais, as galectinas são classificadas em três grupos: prototype, chimera type e tandem-repeat type. O prototype apresenta um domínio de reconhecimento de carboidrato (CRD) por unidade e, geralmente, forma homodímeros compostos por duas subunidades ligadas não covalentemente. O chimera type é representado por uma proteína monomérica que consiste de apenas um CRD ligado a um curto peptídeo (com cerca de 120 aminoácidos) rico em prolina e glicina. O tandem-repeat type é caracterizado por proteínas formadas por dois CRDs distintos unidos em paralelo por um peptídeo de ligação que varia em relação à quantidade de aminoácidos; (B) Estrutura molecular da Galectina-1 (CAMBY et al., 2006; VASTA et al., 2009, com adaptações).
A Gal-1 foi o primeiro membro descrito da família das galectinas
(BARONDES et al., 1994). Essa proteína possui cerca de 14 kDa e é codificada pelo
gene LGALS1 (Lectin, Galactoside-Binding, Soluble, 1) localizado na região
cromossômica 22q12-q13 (MEHRABIAN et al., 1993). Assim como os demais
membros da família, a Gal-1 não apresenta peptídeo-sinal necessário para ser secretada,
sendo enviada para fora da célula por vias alternativas que, provavelmente, se
assemelham à bomba de Na+/K+ (CEDENO-LAURENT; DIMITROFF, 2012) ou ao
transporte de vesículas através da membrana plasmática (VASTA, 2009).
Algumas galectinas estão presentes em uma ampla variedade de tecidos,
enquanto outras são mais específicas, variando seus níveis de expressão sob diferentes
condições fisiológicas ou patológicas (LIU; RABINOVICH, 2005). A distribuição da
Gal-1 sugere sua função reguladora no sistema imunológico (ORTIZ-QUINTERO,
2009), pois ela pode ser encontrada em diversos tipos de células (HE; BAUM, 2004),
mas sua expressão apresenta-se elevada principalmente nas células do timo, dos nódulos
linfáticos, nos macrófagos ativados, nas células T e em locais imuno-privilegiados
como, por exemplo, a placenta e a córnea (LA et al., 2003).
Introdução | 12
As galectinas exercem suas funções tanto extra quanto intracelularmente
(CAMBY et al., 2006). Elas medeiam as interações entre as células e entre elas e os
componentes da matriz por meio da ligação aos glicoconjugados, podendo formar redes
ordenadas na superfície das células, modulando diversas funções biológicas (VASTA et
al., 2009; ITO et al., 2012). Dentro das células, essas proteínas podem regular vários
mecanismos, tais como: splicing, progressão do ciclo celular, diferenciação celular e
apoptose (LIU; RABINOVICH, 2005). Devido a essas diversas funções, as galectinas
podem atuar no controle da inflamação aguda e crônica associada a processos
infecciosos (VASTA et al., 2009), alergias, doenças autoimunes, arteriosclerose e
também no desenvolvimento do câncer (CAMBY et al., 2006; LIU; RABINOVICH,
2010).
Em relação à Gal-1, diferentes eventos oncogênicos foram descritos,
incluindo a regulação do ciclo celular e do crescimento, a adesão e a migração celular, a
proliferação, a transformação tumoral, a angiogênese, a apoptose e a metástase
(RABINOVICH, 2005; BARROW; RHODES; YU, 2011). O efeito modulador da Gal-1
sobre o sistema imunológico está relacionado à sua capacidade de induzir a apoptose
dos linfócitos T imaturos ou ativados, conferindo, assim, um privilégio imune para as
células tumorais (RUBINSTEIN et al., 2004; BANH et al., 2011).
Outro papel importante da Gal-1 na promoção do câncer é a sua interação
com moléculas da matriz extracelular, como a laminina, a fibronectina e a integrina,
regulando a adesão e a motilidade celular e, consequentemente, influenciando os
mecanismos de invasão das células cancerosas (HE; BAUM, 2004; BARROW;
RHODES; YU, 2011). No entanto, essa interação da Gal-1 com moléculas da matriz
pode também desencadear atividades anti-inflamatórias por bloquear os eventos de
sinalização celular que levam a infiltração e ao recrutamento dos leucócitos (VASTA et
al., 2009).
De acordo com Rabinovich (2005), a Gal-1 pode desempenhar múltiplas
funções, atuando de maneira benéfica ou maléfica de acordo com o tipo de célula e com
a sua localização. Enquanto a expressão elevada da Gal-1 promove a apoptose das
células T, contribuindo para a formação de um ambiente imunossuprimido que favorece
o desenvolvimento do tumor, em baixos níveis, ela pode inibir a adesão das células T
Introdução | 13
inflamatórias, protegendo o organismo contra a lesão tecidual (RABINOVICH, 2005;
CAMBY et al., 2006).
Apesar disso, estudos mostraram que a Gal-1 pode estar relacionada a várias
etapas da progressão do câncer por meio de diferentes mecanismos (RABINOVICH,
2005; ITO et al., 2012). Evidências indicam que a expressão dessa proteína é necessária
para dar início à transformação do tumor, pois, em níveis elevados, ela interage com o
oncogene HRAS, que contribui com diversos apectos da malignidade (PAZ et al., 2001).
Também deve ser considerado que alterações na expressão da Gal-1 foram observadas
em diferentes tipos de câncer em relação ao tecido normal (LIU; RABINOVICH, 2005)
e, frequentemente, são correlacionadas à agressividade, ao prognóstico ruim e à
aquisição do fenótipo metastático (RUBINSTEIN et al., 2004; CEDENO-LAURENT;
DIMITROFF, 2012).
As vias moleculares da inflamação relacionadas ao desenvolvimento do
câncer continuam sob investigação, uma vez que a identificação de moléculas alvo pode
levar a um melhor diagnóstico e tratamento dessa doença (MANTOVANI et al., 2008).
Alterações nos níveis de expressão gênica e proteica da AnxA1 e a Gal-1 têm sido
constatadas em diversos tipos de câncer e, entre eles, destacam-se alguns estudos em
órgãos do aparelho digestório, como o esôfago (XIA et al., 2002), o estômago
(BEKTAS et al., 2010; SATO et al., 2011; CHENG et al., 2012, JORGE et al., 2013) e
o CCR (WATANABE et al., 2008; SATO et al., 2011). Contudo, ainda são escassos
estudos em AD (SANJUÁN et al., 1997; HITTELET et al., 2003), uma condição
precursora desse tipo de câncer. Assim, considerando que não há um consenso sobre o
papel dessas proteínas na carcinogênese colorretal, estudos que investigam a expressão
da AnxA1 e Gal-1 durante a progressão maligna como na mucosa normal, no AD e no
ADC podem evidenciar mudanças nos níveis de expressão envolvidas no
Objetivos | 14
2. OBJETIVOS
Diante do exposto, o presente estudo teve por objetivos:
a) Avaliar a expressão relativa dos mRNA dos genes ANXA1 e LGALS1 em amostras de adenoma e adenocarcinoma colorretal esporádico e nas respectivas mucosas normais
adjacentes, pela técnica de PCR quantitativa em tempo real;
b)Investigar a correlação entre os níveis de expressão relativa dos genes ANXA1 e
LGALS1 e a associação entre esses níveis com os fatores de risco como idade,
gênero, hábitos tabagista e etilista, e com o sítio anatômico de origem das lesões;
c) Avaliar a expressão proteica da Anexina-A1 e Galectina-1 nas amostras de adenoma e adenocarcinoma colorretal esporádico e nas respectivas mucosas normais
adjacentes, pelo método imuno-histoquímico, e
d)Avaliar o índice de proliferação celular por meio da detecção do antígeno Ki-67 nas amostras de adenoma e adenocarcinoma colorretal esporádico e nas respectivas
Materiais e Métodos | 15
3. MATERIAIS E MÉTODOS
3.1 Considerações sobre aspectos éticos
Este projeto foi aprovado pelo Comitê de Ética em Pesquisa do
IBILCE/UNESP, conforme Parecer nº 028/11 (Anexo I), e desenvolvido segundo as
Normas Regulamentadoras de Pesquisas em Seres Humanos, Resolução CNS 196/96.
Após os devidos esclarecimentos sobre o projeto, foram obtidos de todos os
participantes o Termo de Consentimento Livre e Esclarecido (TCLE) (Anexo II) e um
questionário padronizado (Anexo III) contendo informações como identificação do
paciente, fatores de risco ambiental e histórico pessoal e familiar de câncer. Todas as
amostras coletadas foram referidas por código, resguardando, assim, a identificação dos
indivíduos.
3.2 Casuística
O estudo foi realizado a partir de biópsias coletadas da mucosa intestinal de
pacientes submetidos a cirurgia ou a exame colonoscópico, ambos realizados no Serviço
de Coloproctologia do Hospital de Base e no Centro de Endoscopia Rio Preto,
localizados em São José do Rio Preto-SP, no período de julho de 2011 a setembro de
2012. Foram incluídos neste estudo 70 indivíduos, sendo 27 com diagnóstico de AD
colorretal e 43 com ADC colorretal esporádico, conforme laudo de Exame
Anatomopatológico das referidas instituições. De cada indivíduo foram coletadas cerca
de três biópsias da lesão e outras três de tecido normal da região adjacente. Os tumores
foram classificados quanto ao sítio anatômico no intestino em cólon proximal (ceco,
cólon ascendente, ângulo hepático e cólon transverso), cólon distal (cólon descendente,
cólon sigmoide e transição reto-sigmoide) e reto (LI; LAI, 2009). Em razão de a maioria
das amostras serem coletadas durante o exame colonoscópico, o número de informações
sobre o estadiamento TNM (Anexo IV) foi escasso, não permitindo análises estatísticas.
Os critérios de exclusão utilizados foram tratamentos com anti-inflamatórios até dois
meses antes da coleta e também tratamentos prévios com quimioterápicos e
radioterápicos. Quanto aos fatores de risco ambiental como tabagismo e etilismo, foram
Materiais e Métodos | 16
toda a vida e etilistas aqueles que beberam mais que quatro drinques por semana
(KJAERHEIN; GAARD; ANDERSEN, 1998; AHRENDT et al., 2000).
Na Tabela 1 estão apresentados os dados referentes à caracterização das
amostras dos grupos AD e ADC. No grupo AD, constituído em sua maioria por
indivíduos do gênero feminino (60%), a média de idade foi 59,78±14,86 anos, enquanto
que no grupo ADC, composto em sua maioria por indivíduos do gênero masculino
(53,7%), a média de idade foi de 62,46±13,83 anos. Em ambos os grupos, a maioria dos
indivíduos não eram tabagistas nem etilistas e o sítio anatômico de origem da lesão mais
frequente foi o cólon proximal no grupo AD e o cólon distal no grupo ADC.
Tabela 1. Caracterização das amostras dos grupos de adenoma (AD) e adenocarcinoma
(ADC) colorretal quanto à idade, gênero, hábitos tabagista e etilista e sítio anatômico de origem das lesões.
Variáveis AD
n (%)
ADC
n (%)
Idade (anos)
Média ± SD 59,78 ± 14,86 62,46 ± 13,83 Variação 30 – 81 35 – 87 < 50 08 (32,0%) 09 (22,0%)
≥ 50 17 (68,0%) 32 (78,0%)
Gênero
Feminino 15 (60,0%) 19 (46,3%) Masculino 10 (40,0%) 22 (53,7%)
Tabagismo*
Não 15 (60,0%) 24 (58,5%) Sim 10 (40,0%) 17 (41,5%)
Etilismo*
Não 17 (68,0%) 27 (65,9%) Sim 08 (32,0%) 14 (34,1%)
Sítio Anatômico
Cólon Proximal 15 (55,6%) 11 (25,6%) Cólon Distal 07 (25,9%) 17 (39,5%) Reto 05 (18,5%) 15 (34,9%)
(
*) Para análise das variáveis Tabagismo e Etilismo o número total de amostras foi igual a 25 para o grupo AD e 41 para o grupo ADC. n=Número de indivíduos.
Após a coleta, as biópsias foram armazenadas a -20ºC em RNA Later
Solution (Ambion®), para preservação da integridade do RNA, até o momento da
Materiais e Métodos | 17
3.3 Métodos para avaliação da expressão gênica
3.3.1 Extração, quantificação e avaliação da integridade do RNA total
A extração do RNA total foi realizada com o TRIzol® Reagent (Invitrogen),
que permite a extração simultânea de RNA e DNA total. Para a extração de RNA total,
as biópsias foram dilaceradas e incubadas em um microtubo contendo 1 mL de TRIzol®
Reagent por 5 minutos. Em seguida, foram adicionados 200 µL de clorofórmio, os tubos
foram agitados e incubados em temperatura ambiente por 3 minutos, e após,
centrifugados a 12.000 rpm por 15 minutos a 4ºC. Formaram-se uma camada inferior
vermelha, uma interfase e uma fase aquosa incolor na porção superior, na qual o RNA
está presente. A fase aquosa foi transferida para outro microtubo, enquanto o restante
foi reservado a -20ºC para posterior extração de DNA. À fase aquosa foram adicionados
500 µL de álcool isopropílico para precipitação do RNA. As amostras foram incubadas
em temperatura ambiente por 10 minutos e, em seguida, centrifugadas a 12.000 rpm por
10 minutos a 4ºC. Após centrifugação, o sobrenadante foi descartado e foi adicionado
ao pellet 1 mL de etanol 75%. As amostras foram agitadas e novamente submetidas à
centrifugação a 12.000 rpm por 5 minutos a 4ºC. O sobrenadante foi novamente
descartado e as amostras foram mantidas a 37ºC por 10 minutos para secagem.
Posteriormente, o pellet foi eluído em 30 µL de água tratada com dietilpirocarbonato
(DEPC) (Ambion®), os tubos foram agitados, incubados em banho-maria a 55-60ºC por
10 minutos e estocados a -80ºC para uso posterior.
A quantificação de RNA total das amostras foi realizada por
espectrofotometria utilizando-se o equipamento NanoDrop® ND-1000
Spectrophotometer (Uniscience). Para isso, foram utilizados 2 µL de amostra de RNA
total. A razão da absorbância a 260 nm e a 280 nm foi utilizada para determinação da
pureza das amostras de RNA. Uma razão próxima do valor 2 é geralmente aceita para
classificar uma amostra de RNA como livre de proteínas, consideradas contaminantes
nocivos à amplificação in vitro. A mediana da razão 260 nm/280 nm das amostras de
AD e ADC foi 1,9 e das amostras de tecido normal foi 1,85. Após a quantificação, as
Materiais e Métodos | 18
A avaliação da integridade do RNA total das amostras foi realizada pela
detecção das subunidades de RNA ribossômico (rRNA) 18S e 28S por eletroforese em
gel de agarose 1% corado com brometo de etídio, cujo padrão das bandas pode ser
visualizado na Figura 7.
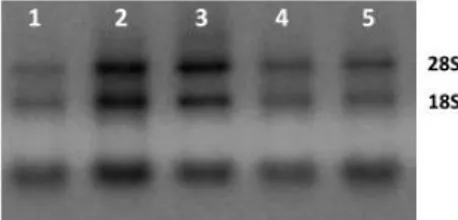
Figura 7. Padrão eletroforético das subunidades 18S e 28S do rRNA em gel de agarose 1% corado com brometo de etídio. Colunas 1-2: amostras de adenoma
colorretal; Colunas 3-4: amostras de adenocarcinoma colorretal; Coluna 5: amostra de mucosa normal.
3.3.2 Síntese e avaliação da integridade do cDNA
As amostras de RNA total foram submetidas à transcrição reversa do RNA
para síntese de DNA complementar (cDNA) utilizando-se o High Capacity cDNA
Archive Kit (Applied Biosystems) em uma reação com volume final de 20 PL. Para cada
reação foram utilizados 2 µL de tampão RT Buffer 10X, 0,8 µL de
desoxirribonucleotídeos trifosfatados (dNTP Mix) 100 mM, 2 µL de oligonucleotídeos
iniciadores RT Random Primers 10X, 1 µL da enzima MultiScribeTM Reverse
Transcriptase (50 U/µL), 0,5 µL de oligonucleotídeos de timina Oligo dtt (Invitrogen)
(0,5 µg/µ L), 1 µL da enzima RNAseOUTTM Recombinant Ribonuclease Inhibitor
(Invitrogen) (40 U/µL), 2,7 µL de água tratada com DEPC (Ambion®) e 10 µL de RNA
total na concentração de 100 ng/µ L. As reações compreenderam uma etapa inicial de 10
minutos a 25ºC seguida por incubação de 120 minutos a 37ºC. As amostras de cDNA
foram estocadas a -20ºC para uso posterior.
A avaliação da integridade do cDNA foi realizada por meio da amplificação
por PCR de um fragmento de 613 pb do gene E-actina (ACTB), utilizado como controle
para transcritos abundantes. As reações foram processadas em volume final de 20 µL,
sendo 2,0 µL de tampão 10X, 0,6 µL de MgCl2 50 mM, 1,4 µL de dNTPs 10 mM, 1,25
µL de oligonucleotídeos iniciadores 10 mM cujas sequências foram: sense 5’ -GGCATCGTGATGGACTCC-3’ e anti-sense 3’-GCTGGAAGGTGGACAGCG-5’, 0,3
Materiais e Métodos | 19
µL de cDNA (100 ng). As reações compreenderam uma desnaturação inicial de 4
minutos a 94ºC, 30 ciclos de 30 segundos a 94ºC, 1 minuto a 60ºC, para o anelamento
dos iniciadores, 1 minuto a 72ºC, para a extensão das cadeias e, por fim, 7 minutos a
72ºC para a extensão final. Os produtos da reação foram submetidos à eletroforese em
gel de agarose 1,5% corado com brometo de etídio, cujo padrão das bandas pode ser
visualizado na Figura 8.
Figura 8. Padrão eletroforético do gene ACTB evidenciando o fragmento de 613 pb em gel de agarose 1,5% corado com brometo de etídio. M: Marcador de peso
molecular de 100pb; Colunas 1-3: amostras de adenoma colorretal; Colunas 4-6: amostras de adenocarcinoma colorretal; Colunas 7-9: amostras de mucosa normal; C: Controle negativo da reação.
3.3.3 Quantificação da expressão gênica relativa por PCR quantitativa em tempo real (qPCR)
A quantificação da expressão gênica foi realizada utilizando-se ensaios
TaqMan® (Applied Biosystems) com sondas específicas para os genes alvos ANXA1
(Hs00167549_m1 inventoried) e LGALS1 (Hs00355202_m1 inventoried) e para os
genes de referência ACTB (Catalog#: 4352935E) e GAPDH (Glyceraldehyde
3-phosphate dehydrogenase) (Catalog#: 4352934E), utilizados como controles endógenos
da reação. As sondas TaqMan® MGB (minor groove binder) contêm o fluoróforo FAM
ligado à extremidade 5’ e um supressor (quencher) não fluorescente ligado à
extremidade 3’.
Durante a qPCR, a sonda TaqMan® MGB hibridiza-se especificamente à sua
sequência complementar entre os oligonucleotídeos iniciadores sense e anti-sense. A
intensidade da fluorescência na reação é determinada pelo cálculo do ΔRn (ΔRn=Rn+ -Rn-), onde Rn+ corresponde à intensidade de emissão do fluoróforo FAM / intensidade
de emissão do ROX em determinado momento; e Rn- corresponde à intensidade de
emissão do fluoróforo FAM / intensidade de emissão do ROX antes da amplificação. O
fluoróforo ROX é utilizado como controle interno passivo, pois a fluorescência emitida