JOSÉ BENEDITO CARVALHO FERNANDES
CARACTERIZAÇÃO DE FATORES DE VIRULÊNCIA EM ISOLADOS DE
Escherichia coli DE MASTITE BOVINA
Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Medicina Veterinária, para obtenção do título de Magister Scientiae.
VIÇOSA
JOSÉ BENEDITO CARVALHO FERNANDES
CARACTERIZAÇÃO DE FATORES DE VIRULÊNCIA EM ISOLADOS DE
Escherichia coli DE MASTITE BOVINA
Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Medicina Veterinária, para obtenção do título de Magister Scientiae.
APROVADA: 12 de dezembro de 2008.
_______________________________ _______________________________ Prof. Paulo Sérgio de Arruda Pinto Prof. José Dantas Ribeiro Filho
_______________________________ _______________________________ Profa Márcia Rogéria de Almeida Dra Cláudia Lúcia de Oliveira Pinto
_______________________________ Prof. Luís Augusto Nero
AGRADECIMENTOS
A Deus, razão de tudo e todos, que através de seus desígnios me colocou nesta instigante e com certeza, profícua empreitada.
Aos meus pais, sustentáculos de todo esse processo, veículos da inspiração divina que se faz presente neste experimento, em especial a minha mãezinha que acompanhou os primeiros passos desse trabalho e que presenciará o seu desfecho junto do Criador - Saudades!!
À Professora Maria Aparecida Scatamburlo Moreira, pela orientação, paciência, exemplo e principalmente, pela confiança em me ceder esse espaço, além de ter apostado e estimulado o andamento deste trabalho, e principalmente aguardar ansiosa pelo seu desfecho!
À minha incansável e comprometida esposa Juliana, que me incentivou nos momentos mais difíceis e soube suportar e aceitar minha ausência. Saiba que a certeza de que vamos colher frutos desta empreitada é o meu alimento!
Aos estagiários e amigos Larissa, Newton e Isabel, pela dedicação, companheirismo e enriquecedor convívio, seja no laboratório ou distante dele, em ambientes regados a piadinhas “Newtonianas” e extensas gargalhadas
“Isabelianas”.
À Professora Célia Moraes e Professora Márcia Rogéria, por terem gentilmente aberto as portas de seus laboratórios no BIOAGRO para que eu realizasse parte dos experimentos. E ao Professor Patarroyo, que atestou a confecção de meu cartão de identificação para que pudesse adentrar em horas
“escusas” no mesmo BIOAGRO.
Ao Professor Domingos, pelo incentivo, troca de idéias, por ter aberto espaço em seu laboratório na Unicamp e ter me auxiliado, mesmo a distância.
Ao Professor Tomomasa Yano - um grande entendedor do conteúdo desta dissertação, por ter nos cedido a maioria dos controles utilizados.
À Professora Rosa Maria Silva, Unifesp, Campinas, por ter cedido mais um isolado de E. coli para ser utilizado como controle neste experimento.
Ao Professor Nero e à Professora Paula, pelo auxílio, sugestões e por todo o apoio durante a ausência da Professora Cida.
À colega Ana Carolina, Unicamp, que mesmo a distância foi uma grande incentivadora e teve participações decisivas em certas fases deste experimento.
Aos funcionários do Setor de Medicina Veterinária Preventiva e Saúde Pública da UFV, principalmente ao Luiz Carlos e ao Marquinhos, por toda dedicação e disponibilidade em todos os momentos em que precisei.
À Embrapa Gado de Leite, Coronel Pacheco, na pessoa da Dra. Maria Aparecida, que gentilmente cedeu à maioria dos isolados de E. coli deste experimento.
A toda a minha família, que, de forma uníssona, me cobrou e incentivou. À Rosi, pelo apoio burocrático durante todo o curso de mestrado, principalmente no período próximo à defesa.
À Universidade Federal de Viçosa, em especial ao Departamento de Veterinária e ao BIOAGRO pela oportunidade profissional.
E a todos os que contribuíram com seus conhecimentos e experiências para a realização desse sonho.
BIOGRAFIA
JOSÉ BENEDITO CARVALHO FERNANDES, filho de Benedito Alves Fernandes e Maria Antonieta Carvalho Fernandes (in memoriam), nasceu em 03 de agosto de 1966, na cidade de Caxambu, estado de Minas Gerais.
Em março de 1987, iniciou o curso de Farmácia e Bioquímica na Universidade Federal de Juiz de Fora, MG, finalizando-o em dezembro de 1990.
Em janeiro de 1991, ingressou no Programa de Residência em Análises Clínicas no Laboratório Central – Hospital Universitário (UFJF), por dois anos, tendo recebido o Título de Especialista em Análises Clínicas.
Fez parte do Quadro de Oficiais Bioquímicos Temporários do Exército Brasileiro de janeiro de 1993 até abril de 1996, tendo atuado junto ao Laboratório de Análises Clínicas (LAC), do Hospital Geral do Exército, em Juiz de Fora.
Atua no mercado privado de Análises Clínicas de Viçosa desde 1996, sendo atualmente proprietário da empresa Hemolab Análises Clínicas, junto ao Hospital São Sebastião. Participante da Comissão de Controle de Infecções Hospitalares (CCIH) deste nosocômio como Microbiologista.
SUMÁRIO
LISTA DE FIGURAS ... vii
LISTA DE QUADROS ... viii
LISTA DE TABELAS ... viii
RESUMO ... ix
ABSTRACT ... xi
1. INTRODUÇÃO ... 1
2. REVISÃO DE LITERATURA ... 3
3. JUSTIFICATIVA E OBJETIVOS ... 16
4. MATERIAL E MÉTODOS ... 17
4.1. Culturas bacterianas ... 17
4.2. Produção de toxinas e de fatores citotóxicos de necrose (FCN) ... 18
4.3. Produção de hemolisinas ... 19
4.4. Teste de resistência aos antimicrobianos ... 20
4.5. Resistência ao soro ... 22
4.6. Produção de biofilmes ... 23
4.7. Pesquisa do antígeno capsular K1 ... 24
4.8. Caracterização genotípica – Reação em cadeia de polimerase (PCR) . 24 5. RESULTADOS E DISCUSSÃO ... 26
5.1. Produção de toxinas e de fatores citotóxicos de necrose ... 26
5.2. Pesquisa de hemolisinas ... 32
5.3. Resistência aos antimicrobianos ... 34
5.4. Resistência ao soro ... 37
5.5. Produção de biofilmes ... 40
5.6. Pesquisa do antígeno capsular K-1 ... 41
5.7. Caracterização genotípica ... 43
5. CONCLUSÃO ... 46
LISTA DE FIGURAS
Figura 1. Monocamada de células Vero intactas, sem adição de filtrado bacteriano (Controle negativo). 400X. ... 30 Figura 2. Monocamada de células Vero após 24h de incubação com adição do
filtrado bacteriano de E. coli 3E Efeito citotóxico ausente. 400X. ... 30 Figura 3. Monocamada de células Vero após 48h de incubação com adição do
filtrado bacteriano de E. coli 3E. Efeito citotóxico: alongamento e morte celular inicial. 400X. ... 30 Figura 4. Monocamada de células Vero após 72h de incubação com adição do
filtrado bacteriano de E. coli 3E. Efeito citotóxico: morte celular (células dispersas no meio). 400X ... 30 Figura 5. Monocamada de células Vero após 48h, incubação com adição do
filtrado bacteriano de E. coli 25. Efeito citotóxico: arredondamento compatível com verotoxina. 400X. ... 30 Figura 6. Monocamada de células Vero após 48h de incubação com adição do
filtrado bacteriano, E. coli 3888. Efeito citotóxico: arredondamento compatível com verotoxina. 400X. ... 30 Figura 7. Ação de -hemolisina (seta preta) produzida pela Escherichia coli
FVL-16 (controle positivo).em Agar Sangue 5% após 3h de incubação a 37ºC. ... 33 Figura 8. Ações de enterohemolisina (seta branca) produzida pela Escherichia
coli C3888 (controle positivo) e de -hemolisina (seta preta) produzidas pela Escherichia coli FVL-16 (controle positivo) após 24h de incubação a 37ºC . ... 33 Figura 9. Cepa de Escherichia coli ATCC 25922 em Ágar Muller Hinton.
Controle de medida dos halos. ... 35 Figura 10. Isolado de Escherichia coli 30 em Ágar Muller Hinton apresentando
LISTA DE QUADROS
Quadro 1. Linhagens de Escherichia coli utilizadas nos estudos como controles positivos de diferentes fatores de virulência e suas origens. ... 18 Quadro 2. Antimicrobianos, marcas, concentrações e interpretações de zonas
de inibição para avaliação de padrões de sensibilidade de microrganismos. ... 21 Quadro 3. Marcadores de virulência de Escherichia coli, suas funções, local
onde são codificados e patotipos que os expressam com mais freqüência ... 25
LISTA DE TABELAS
Tabela 1. Perfil de resultados de isolados de Escherichia coli em ensaios de citotoxidade em células Vero ... 27 Tabela 2. Caracterização genotípica, realizada por Reação em Cadeia de
Polimerase (PCR), dos isolados de Escherichia coli testados frente a fatores de colonização, toxinas, marcadores extraintestinais e outros mais relacionados com agentes da mastite ... 29 Tabela 3. Combinações de marcadores de virulência detectados em isolados
de Escherichia coli obtidos de leite mastítico ... 31 Tabela 4. Perfil de resistência dos isolados de Escherichia coli encontrado
frente aos antimicrobianos testados ... 35 Tabela 5. Valores de absorvância definindo o perfil de resistência dos isolados
de Escherichia coli encontrado frente ao soro tratado. ... 39 Tabela 6. Valores de absorvância definindo o perfil de resistência dos isolados
de Escherichia coli encontrado frente ao soro não tratado. ... 40 Tabela 7. Resultados gerais da detecção dos fatores de virulência de isolados
RESUMO
FERNANDES, José Benedito Carvalho, M. Sc., Universidade Federal de Viçosa, Dezembro de 2008. Caracterização de fatores de virulência em isolados de Escherichia coli de mastite bovina. Orientadora: Maria Aparecida Scatamburlo Moreira. Co-Orientadores: Paula Dias Bevilacqua e Luís Augusto Nero.
ABSTRACT
FERNANDES, José Benedito Carvalho, M. Sc., Universidade Federal de Viçosa, December, 2008. Characterization of virulence factors in
Escherichia coli isolates from bovine mastitis. Adviser: Maria Aparecida Scatamburlo Moreira. Co-Advisers: Paula Dias Bevilacqua and Luís Augusto Nero.
1. INTRODUÇÃO
Dentre os aspectos sanitários, a mastite é reconhecidamente uma das principais doenças que afetam a bovinocultura destinada à exploração leiteira. A doença resulta em prejuízos econômicos ao produtor, como também perigos aos consumidores do ponto de vista da Saúde Pública, uma vez que o leite e seus derivados podem se tornar potenciais veículos de transmissão de patógenos e toxinas.
No Brasil, cerca de 80% das vacas em produção leiteira apresentam no mínimo um quarto mamário acometido por mastite. Esta enfermidade varia entre a forma subclínica, onde os sinais de inflamação não são visualizados macroscopicamente, e a forma clínica, que possui diferentes níveis de comprometimento e pode determinar a morte do animal. Algumas cepas patogênicas de Escherichia coli são freqüentemente associadas a casos de mastite bovina, principalmente em sua forma clínica. E. coli é um microrganismo de origem ambiental altamente adaptativo, existindo como comensal e patogênico. Sua habilidade de adquirir DNA exógeno, incluindo genes de virulência, é conhecida, o que contribui para o desenvolvimento de cepas patogênicas adaptadas à glândula mamária e potencialmente causadoras de mastites.
2. REVISÃO DE LITERATURA
Por mais de meio século após ter sido descoberta, Escherichia coli foi considerado como o maior comensal nas fezes e possuidor de baixa virulência. Esta visão mudou progressivamente com o reconhecimento da complexidade da microbiota fecal e da variedade de infecções superficiais similares às infecções intestinais causadas por E. coli. À identificação de uma larga variedade de fatores de virulência específicos, seguiu-se a definição da base individual de doenças. Deste modo, E. coli é considerado como um dos patógenos mais virulentos desde a sua descoberta (SUSSMAN, 1997).
E. coli apresenta-se como um bacilo Gram-negativo, curto e reto, não esporulado, usualmente móvel devido à presença de flagelos peritríquios. Freqüentemente apresentam fímbrias e ocorrem isolados ou aos pares em crescimentos de culturas em meios líquidos. A cápsula ou microcápsula pode estar presente e algumas linhagens a produzem como uma profusa e viscosa camada polissacarídica. É um anaeróbio facultativo, capaz de se desenvolver por metabolismo fermentativo. Possui temperatura ótima de crescimento a 37oC em uma grande variedade de meios de cultura (SUSSMAN, 1997).
determinada, tem-se assumido que algumas cepas de E. coli que possuem determinados grupos O apresentariam vantagens no carreamento de material genético relacionado à codificação de determinados fatores de virulência, incluindo a produção de toxinas (EVANS et al., 1977).
Cepas patogênicas de E. coli causadoras de várias infecções severas em animais e humanos (BEAN et al., 2004) são classificadas em duas principais categorias: as entéricas e as extra-intestinais (KUHNERT et al., 2000). E. coli entéricas são agrupadas em: E. coli enterotoxigênicas (ETEC), E. coli enteropatogênicas clássica (EPEC), E. coli produtoras de shiga toxina ou enterohemorrágicas (STEC ou EHEC), E. coli enteroinvasivas (EIEC), E. coli enteroagregativas (EAggEC) e a E. coli aderentes e difusas (DAEC). E. coli patogênicas extra-intestinais são genericamente chamadas ExPEC, e englobam principalmente E. coli uropatogênicas (UPEC) e E. coli causadoras de meningite neonatal (NMEC). Todas estas E. coli são agrupadas basicamente pela produção de fatores de virulência que conseqüentemente manifestam-se nos sinais clínicos no homem e nos animais (GYLES, 1992).
Fatores de virulência são definidos como estruturas, produtos ou estratégias que contribuem para a bactéria aumentar sua capacidade em causar infecção (TRABULSI, 2005). Alguns fatores de virulência estão mais envolvidos com a colonização (adesinas e invasinas) e outros com as lesões ao hospedeiro (toxinas).
Adesão é a estratégia que as bactérias usam para se fixar nas células e nos tecidos do organismo. A capacidade de aderir de maneira firme é mediada por finos filamentos de natureza protéica, que se projetam da superfície bacteriana, denominados fatores de colonização, fímbrias, pili ou definidas coletivamente como adesinas. Este mecanismo de adesão permite a liberação de diferentes toxinas do agente para o interior celular, a invasão destas células e/ou a disseminação sistêmica pelo hospedeiro (GYLES, 1992; SUSSMAN, 1997).
processo induzido pela bactéria quando envolve outras células não fagocitárias e dependente de diferentes proteínas chamadas de invasinas, que podem estar localizadas na membrana externa da bactéria ou serem injetadas no seu citosol (TRABULSI, 2005).
Certas linhagens de E. coli isoladas de mastites clínicas demonstram habilidade para aderir e invadir células epiteliais mamárias bovinas (MAC-T cells) in vitro, em processo dependente do inóculo, tempo e fatores relacionados ao agente (DOPFER et al., 2000).
A ocorrência das diferentes apresentações clínicas depende de propriedades ou fatores de virulência, que determinam o grau de patogenicidade do agente. Alguns destes fatores são componentes intrínsecos da estrutura bacteriana, também denominados endotoxinas (CASTRO e YANO, 1992). Outros, porém, constituem-se de diferentes tipos de exotoxinas (enterotoxinas, verotoxinas, hemolisinas e Fatores Citotóxicos de Necrose), bem como propriedades que permitem a multiplicação em meio com restrição de ferro ou a multiresistência aos antimicrobianos (GYLES, 1992; SUSSMAN, 1997; TRABULSI, 2005).
Embora os métodos fenotípicos demonstrem a presença de fatores de virulência, em condições de laboratório, geralmente os genes que codificam esses fatores não são expressos ou se são, em níveis baixos. Estes genes são fortemente regulados por uma variedade de fatores, os quais in vitro podem inibir suas expressões, dificultando sua detecção fenotípica (KUHNERT et al., 2000). A biologia molecular tem facilitado o estudo dos fatores de virulência em bactérias com base na detecção de seus respectivos genes (PASS et al., 2000).
significa também perda de material genético (COSTA, 2008). Além destas perdas, há ainda um risco potencial à Saúde Pública, já que pode promover a veiculação de patógenos causadores de zoonoses e de toxinfecções alimentares (WELLS et al., 1998; REED e GRIVETTI, 2000). Ainda, há a preocupação a nível social, por agravar problemas como desnutrição, mortalidade infantil, fome e quedas nos lucros pelo proprietário e conseqüentemente perda do seu poder aquisitivo (FONSECA e SANTOS, 2000).
A mastite causada por E. coli pode variar de uma simples inflamação local até severas alterações sistêmicas com atonia rumenal, desidratação, choque toxêmico resultando na morte do animal (WENZ et al., 2006). As infecções por E. coli na glândula mamária estão relacionadas ao comportamento oportunista do agente, que é veiculado pelas fezes dos animais e chega pela via ascendente infectando o animal via canal do teto (EBERHART, 1979; RADOSTITS et al., 2002).
Considerando um alto grau de versatilidade e adaptabilidade deste microrganismo, pode-se mencionar a existência de algumas cepas de E. coli altamente adaptadas, que têm adquirido específicos atributos de virulência e conferem uma maior habilidade de sobrevivência em novos nichos, o que permite a elas causar um largo espectro de doenças (KAPER e NATARO, 2004). Comparações entre os genomas de E. coli patogênicas e a E. coli K12 (não patogênica) revelam que o genoma da primeira contém aproximadamente 25% de DNA genômico a mais do que a não patogênica (KAPER e NATARO, 2004). Estes atributos de virulência são freqüentemente codificados por elementos genéticos que podem ser mobilizados entre diferentes isolados para criação de novas combinações de fatores de virulência, ou em elementos genéticos que podem ter sido móveis, mas passar a estar incorporados ao genoma. Somente as mais prósperas combinações de fatores de virulência persistem e se tornam verdadeiros e específicos patotipos de E. coli que seriam capazes de causar doenças em animais sadios (KAPER e NATARO, 2004).
(Nemeth et al., 1994), em contraste com a ausência de produção de enterotoxina termoestável 1 (ST1), termolábil (LT) e verotoxinas (SANCHEZ-CARLO et al., 1984;VALENTE et al., 1988; BARROW e HILL, 1989; HOGAN et al., 1990). Dados semelhantes foram encontrados por Lipman et al. (1995), que detectaram em 55% de culturas de E. coli isoladas de leite mastítico gene relacionado com a fímbria F17, mas nenhum para enterotoxina LT, ST1, Fator citotóxico de necrose 2 (FCN 2) e verotoxina.
Barrow e Hill (1989) pesquisaram fatores de virulência em 237 culturas de E. coli isoladas de mastite na Grã-Bretanha, e observaram a produção de α -hemolisina, enterotoxina e verotoxina, respectivamente, em cinco, um e 0,5% dos isolados, e ainda relacionam a resistência a um ou mais antimicrobianos em 22% dos isolados, destacando os maiores índices para estreptomicina (18%), tetraciclina (15%), sulfonamida (15%) e ampicilina (14%). Índices semelhantes foram encontrados por Hogan et al. (1990), ao determinarem a produção de enterohemolisinas em 76 culturas de E. coli isoladas de mastite clínica bovina nos EUA e encontraram efeito hemolítico em 3,9 e 2,6% das culturas semeadas e ágar sangue preparado com hemácias de ovinos e bovinos, respectivamente.
E. coli pode ser caracterizada pela detecção dos fatores de virulência em testes fenotípicos e/ou pela presença dos genes de virulência em ensaios genotípicos (STUBER et al., 2003). A identificação desses fatores fenotípicos e moleculares de culturas de E. coli isoladas de leite mastítico é importante no estudo de seus mecanismos de patogenicidade, além da epidemiologia da doença, contribuindo para o controle, profilaxia e tratamento da mastite.
Enterotoxinas termolábeis - LT
Gyles e Barnum (1969) identificaram uma enterotoxina célula-livre que foi associada com culturas de E. coli isoladas de quadros de diarréia em suínos, mas termolábeis e antigenicamente relacionadas com a toxina colérica produzida pela bactéria Vibrio cholerae.
detectada em isolados obtidos de outros animais (HONDA et al., 1981; GEARY et al., 1982).
Outra enterotoxina termolábil, LT do tipo 2 (LT2), foi detectada em E. coli SA53 isoladas de fezes de búfalos na Tailândia. Embora compartilhe muitas propriedades biológicas com a LT1, não é neutralizada por antisoros contra toxina colérica ou LT1 (GREEN et al., 1983; PICKETT et al., 1986). A toxina causa arredondamento de células adrenais Y1 e CHO (células de ovário de Hamster chinês) assim como o aumento da atividade de Adenilato ciclase em células eucarióticas (GREEN et al., 1983), mas, ao contrário da LT1, que é codificada por um plasmídeo, LT2 é cromossomicamente codificada (PICKETT et al., 1986).
Fatores Citotóxicos de Necrose - FCN
FCN foram primeiramente descritos em isolados de E. coli originários de infecções extra-intestinais em humanos (CAPRIOLI et al., 1983), e são caracterizados como substâncias termolábeis que causam a formação de células gigantes em células Vero, HeLa e CHO, e produzem necrose quando injetados intradermicamente em coelhos. Culturas de E. coli que produzem FCN têm sido freqüentemente isoladas de suínos, bovinos e cães (GONZÁLES e BLANCO, 1985;MACLAREN e WRAY, 1986; PRADA et al., 1991; MAINIL et al., 1999). Embora FCN tenham sido detectados em uma grande variedade de sorogrupos de E. coli, muitos isolados demonstram uma estreita relação com alguns grupos de antígenos O, a saber: O2, O4, O6, O22, O32, O75, O83 e O88 (HOLLAND, 1990).
de fluido nas dobras intestinais do coelho e elongação de células HeLa (De RYCKE et al., 1987; De RYCKE e PLASSIART, 1990).
Ambos os tipos de FCN são proteínas monoméricas de 110 a 115kDa (CAPRIOLI et al., 1984; OSWALD e De RYCKE, 1990). Muitos isolados produtores de FCN1 também produzem uma hemolisina que é codificada pelos genes de FCN no fragmento 37-kb de DNA, característica não comum às cepas produtoras de FCN2 (CAPRIOLI et al., 1987; BLANCO et al., 1990; De RYCKE e PLASSIART, 1990). Pohl et al. (1993) sugerem que, ocorra subestimação do real envolvimento do FCN em afecções em animais, em virtude da grande maioria dos estudos investigarem os FCN somente em cepas hemolíticas de E. coli.
Verocitotoxinas - VT
Cepas de E. coli verotoxigênicas (VTEC) foram primeiramente descritas por Konowalchuk et al. (1977), devido à observação de seus filtrados causarem danos irreversíveis em Células Vero e HeLa. As toxinas responsáveis, verotoxinas (VT), possuem propriedades biológicas, físicas e antigênicas semelhantes às da Shiga toxina da Shigella dysenteriae (O’BRIEN et al., 1982). Conseqüentemente, essas toxinas são também conhecidas como toxinas Shiga-like. O tipo de VT neutralizado por anti-Shiga toxina foi designado VT1. Um segundo tipo de toxina, primeiramente demonstrado em uma cepa de E. coli O157, não é neutralizado por anti-Shiga toxina e foi denominado VT2 (SCOTLAND et al., 1985).
Culturas de VTEC isoladas de animais possuem uma grande variação de sorogrupos (SMITH et al., 1988; HOLLAND, 1990), e são relacionados a diversas doenças em bovinos e suínos (HOLLAND, 1990), e isolados de casos de doença do Edema (DOBRESCU, 1983;SMITH et al., 1983).
Hemolisinas
como fator de virulência em infecções por E. coli em humanos e animais (BEUTIN, 1991).
A habilidade de certos isolados de E. coli para lisar eritrócitos de diferentes espécies de mamíferos, foi primeiramente descrita por Kayser em 1903, notando que após a filtração, os sobrenadantes de culturas de E. coli possuíam atividade hemolítica, sugerindo que não estivessem ligadas às células bacterianas. Dudgeon e Pulvertaft (1927) também reportaram atividade hemolítica em culturas de E. coli, mas não puderam demonstrar hemolisinas em filtrado de culturas. Eles defendiam que toda atividade estava associada com a célula de E. coli..
Smith em 1963 foi o primeiro a diferenciar claramente hemolisinas em processo semelhante ao utilizado por Lovell e Rees (1960), demonstrando que sob certas condições de crescimento, alguns isolados hemolíticos de E. coli produziam hemolisinas livres e ligadas às células bacterianas, simultaneamente. Hemolisinas ligadas às bactérias não foram neutralizadas por antisoros preparados contra hemolisinas não ligadas, indicando que as duas hemolisinas poderiam ser diferentes (SMITH, 1963). Smith designou o fator hemolítico ligado à célula como β-hemolisina e o fator célula-livre como α -hemolisina.
Um novo tipo de hemolisina chamada enterohemolisina foi descrita a partir de isolados de E. coli originários de gastrenterites infantis (BEUTIN et al., 1988). O termo enterohemolisina foi relacionado ao fato de se apresentarem a partir de alguns sorogrupos de EPEC (LEVINE, 1987). Entretanto, a produção de enterohemolisina foi mostrada ser associada com VTEC (BEUTIN et al., 1991). Assim como β-hemolisina, a enterohemolisina se mostrou associada com as células bacterianas (BEUTIN, 1991).
A possível influência da composição do meio de crescimento na síntese e atividade da α-hemolisina foi discutida, e o Ca++ foi reportado ser essencial tanto para ativação (SNYDER e ZWADYK, 1969), para estabilidade (NICAUD et al., 1985), quanto para favorecer a ligação da toxina na membrana do eritrócito (LUDWIG et al., 1988). Em contrapartida, não se apresenta como essencial para atividade da enterohemolisina (BEUTIN, 1991).
geralmente menor e visualmente mais turva que a produzida por α-hemolisina. As hemolisinas são ainda diferenciadas pelo intervalo de tempo necessário para detecção da hemólise: α-hemólise já pode ser detectada após três horas de incubação (produzida na fase logarítmica), enquanto a enterohemolisina requer incubação “overnight” (produzida na fase estacionária) (BEUTIN et al., 1988).
Em trabalhos com cepas hemolíticas de E. coli observou-se uma associação entre a ocorrência de produção de hemolisinas e a ocorrência de enterites (GREGORY, 1962) em suínos, assim como doenças de outros animais (SMITH e HALLS, 1967). Porém, não foi demonstrada uma relação direta do papel da hemolisina nestas doenças. A associação significativamente mais alta entre infecções extraintestinais com a microbiota normal, praticamente conduz ao consenso de que E. coli hemolíticas são mais relacionadas como agentes causais em doenças que isolados não hemolíticos. Assim, os estudos evoluíram na importância das hemolisinas como um fator de virulência (CAVALIERI, 1984; SUSSMAN, 1997; MAINIL, 1999; RIBEIRO, 2006).
Na espécie bovina, a produção de α-hemolisina por isolados de E. coli parece não estar diretamente associada à ocorrência de distúrbios entéricos. Estudos têm demonstrado a associação de linhagens de E. coli hemolíticas, isoladas de infecções extra-intestinais em bovinos, com a produção de determinados fatores de virulência, tais como FCN, resistência ao soro e adesinas fimbriais P (MAINIL et al., 1999).
Com relação a genética das hemolisinas, plasmídeos contendo determinantes para hemolisinas já foram demonstrados antes (SMITH e HALLS, 1967). O mecanismo através do qual a α-hemolisina é produzida e excretada parece ter controle genético bastante complexo. Tecnologias de DNA recombinantes foram usadas para o entendimento na produção das hemolisinas e verificação do seu potencial papel na virulência de linhagens de E. coli hemolíticas (CAVALIERI, 1984).
Antígenos capsulares
Bactérias Gram-negativas possuem uma membrana externa à sua camada de mureína, composta basicamente por lipopolissacarídeos (LPS), que é o antígeno somático “O” dos tipos selvagens destas bactérias. Alguns anticorpos direcionados contra este antígeno geralmente aglutinam estas bactérias. Estudos sorológicos com E. coli realizados inicialmente por Kauffmann (1944) e Kauffmann (1954) e revisados por Ørskov et al. (1977) mostraram que a aglutinação de muitos isolados por antisoros-O homólogos ocorrem somente após aquecimento. Este efeito inibidor é devido à presença de antígenos distintos do antígeno O que estão presentes em um envelope extracelular, ou cápsula, que recobre o antígeno O do LPS.
A cápsula protege as bactérias patogênicas contra defesas não específicas do hospedeiro, mais especificamente a ação do Sistema Complemento e fagocitose. Assim, bactérias encapsuladas tendem a ser mais virulentas, e suas cápsulas consideradas fatores de virulência. Anticorpos K específicos, formados em uma fase recente da infecção, superam o efeito protetor das cápsulas, não sendo reconhecidas como estranhas pelo hospedeiro. Como resultado, anticorpos não são produzidos e o hospedeiro é vulnerável a esta cepa patogênica especificamente (SUSSMAN, 1997).
Resistência ao soro
resistência ao poder bactericida do soro é considerada como um determinante da patogenicidade bacteriana (TAYLOR, 1983).
O Sistema Complemento, maquinário central deste mecanismo de defesa, pode ser ativado através da via clássica (com a presença do anticorpo) ou através da via alternativa - C3 shunt (sem a presença do anticorpo). Ambas levarão à formação do complexo de ataque a membrana que rompe a membrana externa permitindo que a lisozima sérica degrade o peptideoglicano, que finalmente causa a bacteriólise (WRIGHT e LEVINE, 1981).
A resistência ao soro foi atribuída a vários fatores: LPS, antígeno capsular K1 (TAYLOR, 1983) e a presença de plasmídeos codificadores de proteínas de membrana externa como a TraT e a Iss (BINNS et al., 1982). A proteína TraT é a maior proteína da membrana externa e se encontra em grande número de cópias na superfície celular bacteriana, e parece interferir com a opsonização ao complemento em sua ativação pela via alternativa, restringindo e alterando o sítio de ligação na membrana bacteriana pelo C3 (exclusão de superfície) e conseqüentemente inibindo a fagocitose (AGUERO et al., 1984). A proteína Iss é codificada pelo gene iss (increased serum survival), que é responsável pelo bloqueio do complexo terminal do sistema do complemento que atua na membrana celular e causa a lise da célula. Portanto, ele confere à bactéria resistência ao Sistema Complemento (BINNS et al., 1982).
Resistência aos antimicrobianos
Outra propriedade de virulência encontrada em isolados de E. coli é denominada fator de resistência aos antimicrobianos ou fator “R”. Este fator pode ser transmitido a outros microrganismos da mesma espécie, favorecendo a manutenção de linhagens resistentes às diferentes drogas, dificultando conseqüentemente, tratamentos antimicrobianos para infecções desencadeadas por esses microrganismos (TRABULSI, 2005).
descreveu a presença de resistência em isolados de E. coli de mastite bovina, à pressão seletiva exercida pelo uso indevido de antimicrobianos na terapia de mastite, ou mesmo, no tratamento de outras afecções em bovinos. Linton et al. (1972) mencionam uma maior ocorrência de resistência aos antimicrobianos em linhagens de E. coli isoladas de pessoas provenientes de áreas rurais, que mantêm contato estreito com animais, comparativamente aos indivíduos provenientes de centros urbanos. Também ressaltaram o risco de veiculação de cepas de E. coli multi-resistentes para o homem, mediante o consumo de produtos e subprodutos de origem bovina, como o leite. Evidências adicionais, como as apontadas por Hirsch e Wiger (1978),se referem a isolados de E. coli de origem animal, adquiridas pelo homem por via oral, que podem transferir o fator R a isolados do mesmo microrganismo de origem humana.
Antibioticoterapia é o tratamento preconizado para mastite. O uso de antimicrobianos deve ser feito mediante os resultados apresentados pelo antibiograma, seguindo as normas do Clinical and Laboratory Standards Institute (CLSI). O uso inadequado dos antimicrobianos pode promover a eliminação de resíduos de drogas no leite (responsáveis por quadros de anemia, distúrbios gastrointestinais e reações de hipersensibilidade no homem), interferir com a produção de subprodutos lácteos, ou mesmo favorecer a ocorrência de cepas multi-resistentes aos antimicrobianos convencionais (TAVARES, 1996;COSTA, 1999).
Biofilmes
agentes etiológicos em produzir biofilmes nos tecidos lesados, e assim desenvolver uma resistência inata à maioria dos antimicrobianos e desinfetantes, driblando os mecanismos de defesas do hospedeiro.
Biofilme é uma comunidade estruturada de células bacterianas fechadas dentro de uma matriz polimérica produzida pelos próprios microrganismos e aderida a uma superfície viva ou inerte (COSTERTON et al., 1999). Constitui um modo de proteção em ambientes hostis, e pode ter um papel importante na virulência da bactéria (van HOUDT e MICHIELS, 2005). Vários determinantes de superfície em E. coli são importantes na formação de biofilmes, como flagelos, fímbrias, curli, pili conjugativos, proteínas auto-transportadoras e produção de exopolissacarídeos (van HOUDT e MICHIELS, 2005). Estas observações indicam claramente a ocorrência de uma interação complexa entre o agente e o hospedeiro, e que a compreensão da cadeia envolvida na formação de biofilmes por E. coli pode elucidar seu poder de virulência (van HOUDT e MICHIELS, 2005).
3. JUSTIFICATIVA E OBJETIVOS
Considerando os prejuízos decorrentes da mastite, o aumento da prevalência de E. coli nos casos da doença, como também a importância do agente em Saúde Pública, o presente estudo tem como objetivo geral investigar a presença de fatores de virulência em isolados de E. coli obtidos de casos de mastite clínica, interrelacioná-los e estabelecer provável ligação com a infecção clínica.
4. MATERIAL E MÉTODOS
Os experimentos foram realizados nos seguintes laboratórios: i) Laboratório de Doenças Bacterianas (LDBAC) e no ii) Laboratório de Virologia Animal (LVA), ambos pertencentes ao Departamento de Medicina Veterinária da Universidade Federal de Viçosa (UFV).
4.1. Culturas bacterianas
Foram utilizadas 27 isolados de E. coli obtidos de amostras de leite mastítico, sendo seis pertencentes à bacterioteca do LDBAC e 21 pertencentes à bacterioteca do Laboratório de Microbiologia da EMBRAPA - Gado de Leite, Juiz de Fora, Minas Gerais. Cada isolado foi proveniente de um animal com mastite clinica.
Para confirmar a pureza e a identificação dos isolados foram realizados testes morfotintoriais e bioquímicos. Os resultados foram comparados com os do Manual de Bergey (SCHEUTZ e STROCKBINE, 2005).
turbidez semelhante a escala 1 de MacFarland, valor correspondente a 3 x 108 Unidades Formadoras de Colônias/mL (UFC/mL). A partir dessas culturas, diluições subseqüentes foram realizadas a fim de se atingir a concentração adequada para cada um dos experimentos descritos a seguir.
Quadro 1. Linhagens de Escherichia coli utilizadas nos estudos como controles positivos de diferentes fatores de virulência e suas origens.
Linhagem Marcador Origem
E. coli O157: H7 Verotoxina tipo1(VT1) Dr. J.M. Lord, University Warwick,UK E. coli J2 Verotoxina tipo 2 (VT2) Dr. Y. Takeda, Jiisen University, Japan E. coli 40T Toxina termolábil 1 (LT1) L. R. Trabulsi, Instituto Butantã, SP, Brasil. E. coli B62 Toxina termolábil 2 (LT2) A. F. P. Castro, USP, SP, Brasil. E. coli C3388 Enterohemolisina (EntHly) L. Beutin, R. Koch Institute, Germany E. coli MR48 Fator citotóxico de necrose 1 (FCN1) J. Blanco, LREC*
E. coli FVL-16 FCN1 e α-hemolisina (αHly) J. Blanco, LREC E. coli B26a Fator citotóxico de necrose 2 (FCN2) J. Blanco, LREC E. coli J96 Resistência ao soro Dra. Rosa Maria Silva, Unifesp, Campinas, SP, Brasil
E. coli ATCC25922 Resistência Bacteriana American Type Culture Collection, Manassas, Virginia, USA
* Laboratório-referência de E. coli da Faculdade de Veterinária, Universidade de Santiago de Compostela, Espanha.
4.2. Produção de toxinas e de fatores citotóxicos de necrose (FCN)
4.2.1. Obtenção do sobrenadante
4.2.2. Preparo das Culturas Celulares
Foram utilizadas células Vero (Rim de macacos verdes africanos) provenientes do LVA. As células estocadas à -86ºC foram rapidamente descongeladas à temperatura ambiente, e em seguida transferidas para garrafas contendo Meio Essencial Mínimo (MEM) (Cultilab, Campinas, Brasil) suplementado com 10% de Soro Fetal Bovino (Cultilab, Campinas, Brasil), Penicilina 1,6mg/L e Estreptomicina 0,4mg/L. Posteriormente, as garrafas foram incubadas em atmosfera de 5% de CO2 à 37ºC por 48h, até a formação de uma monocamada celular homogênea.
Após 48h de incubação, foi realizado o descarte do meio de cultura e adicionado solução de tripsina salina (Sigma, Steinheim, Alemanha), com intuito de promover o deslocamento do tapete celular (tripsinização). Em seguida, as células foram novamente ressuspendidas em MEM (Cultilab). Finalmente, 400µL esta suspensão de células foram distribuídas em microplacas contendo 24 orifícios e incubadas em atmosfera de 5% de CO2, a 37oC por mais 24h.
Após a formação da monocamada celular nas microplacas, foi adicionado em duplicata 50µL de filtrado acrescido de Mitomicina C nas seguintes diluições: 1/20, 1/40, 1/80, 1/160, 1/320, 1/640 e 1/1.280 às culturas celulares. As alterações morfológicas foram analisadas após 24, 48 e 72 horas de incubação em microscópio óptico de luz invertida.como reportado por Yano et al. (1986). A formação de células gigantes e multinucleadas foi considerada compatível com a produção de FCN, enquanto que para a caracterização de isolados produtores de verotoxinas, foi considerado o efeito inicial de arredondamento e concomitante “enrugamento”, seguidos de perda da viabilidade celular. A produção de LT foi detectada pela presença de células com aparência alongada, apresentando espessamento da parede e filamentos dendríticos.
4.3. Produção de hemolisinas
4.3.1. Preparo da placa de Ágar sangue
O Ágar Tripticase de Soja (TSA, Difco, Lawrence, KS, EUA) foi autoclavado e mantido a uma temperatura de aproximadamente 50ºC, para a manutenção da sua forma líquida. Em paralelo, cinco mL de sangue de carneiro desfibrinado foi lavado três vezes em solução tampão de Phosphate Buffered Saline (PBS), pH 7,4, com centrifugações a 3.000 X g por cinco minutos, entre as lavadas. Após a lavagem final, foi ressuspendido em cinco mL de PBS e incorporado à 100mL de TSA. Concomitantemente foi acrescido 10mM de CaCl2 (Merck, Rio de Janeiro, Brasil), homogeneizado e distribuído em placas de Petri previamente esterilizadas. Utilizou-se aproximadamente 12mL por placa.
4.3.2. Semeadura na forma de placa Mestra
Foi utilizada a semeadura na forma de placa mestra, usando 4µL da cultura previamente crescida em caldo BHI. Em seguida, as placas foram incubadas à 37ºC e avaliadas após 3, 6, 18 e 24h.
Foram consideradas produtoras de α-hemolisinas os isolados que apresentaram hemólise entre três e seis horas com aumento progressivo do halo translúcido, hemólise total, ao longo das 24h de incubação. Os isolados que apresentaram hemólise parcial, entre 18 e 24h de incubação, foram consideradas produtoras de Enterohemolisinas.
4.4. Teste de resistência aos antimicrobianos
Quadro 2. Antimicrobianos, marcas, concentrações e interpretações de zonas de inibição para avaliação de padrões de sensibilidade de microrganismos.
Antimicrobianos Concentração/ Disco (μg)
Diâmetro zona de inibição Resistente Intermediário Sensível
Neomicina a 30 < 12 13 - 16 > 17
Gentamicina a 10 < 12 13 - 14 > 15
Cefoperazona b 75 < 15 16 - 20 > 21
Cefalexina a 30 < 14 15 - 17 > 18
Ceftiofur a 30 < 17 18 - 20 > 21
Ampicilina a 10 < 13 14 - 16 > 17
Florfenicol a 30 < 14 15 - 18 > 19
Sulfadiazina+trimetoprim
(Sulfadiatrin) c 25 < 10 11 - 15 > 16
Marcas: (a) Cefar, SP, Brasil; (b) Oxoid, SP, Brasil; (c) CECON, SP, Brasil.
As culturas obtidas foram diluídas em escala seriada decimal até atingir a concentração estimada de 3 x 105 UFC/mL. Em seguida, com auxílio de um
“swab” estéril, um alíquota da cultura foi espalhada sobre toda superfície das placas de Petri contendo 20mL de Ágar Müeller Hinton (Oxoid, Hampshire, Inglaterra), para se obter um inóculo uniforme e homogêneo. Após dois minutos, discos de antimicrobianos foram posicionados na superfície do ágar em posições eqüidistantes, e as placas foram incubadas a 37ºC por 18 horas. Todos os testes foram realizados em duplicata para cada isolado.
Para monitorar a precisão e acurácia dos procedimentos envolvidos, verificar a qualidade dos meios de cultura e dos antimicrobianos empregados foi utilizado a cepa padrão E. coli ATCC 25922 recomendada pelo CLSI.
4.5. Resistência ao soro
Para identificar os isolados de E. coli resistentes ao soro foi seguida a metodologia de Pelkonen et al. (1987), com modificações descritas a seguir. Foi obtido um “pool” de soros provenientes da coleta de sangue de 10 bovinos adultos, clinicamente sadios, totalizando 49mL de soro. Este “pool” foi dividido em sete alíquotas de sete mL e congelado a -86ºC até o uso.
Foram obtidas três formas de soro a serem desafiados contra os isolados em análise: i) soro inativado, considerado sem atividade do complemento, obtido pela incubação por 30 minutos a 56ºC; ii) soro tratado com a incorporação de Ácido etileno-glicol-tetra-acético, EGTA (Sigma, Steinheim, Alemanha) e Cloreto de Magnésio - MgCl2 (Isofar, Rio de Janeiro, Brasil) nas concentrações finais de 10mM e 5mM, respectivamente, para inibir a atividade do complemento pela via clássica e por ultimo, iii) soro normal sem quaisquer tratamentos.
Após reativação dos isolados em caldo BHI, 500µL de cada cultura foram adicionados a 4,5mL de BHI, e incubados a 37ºC por 90 minutos, sob agitação a 170rpm. Após esta etapa, as culturas foram centrifugadas a 1.500 X g por 15 minutos a 4ºC. O sobrenadante foi descartado e três mL de PBS pH 7,4 foram adicionados para ressuspender o sedimento.
A resistência ao soro foi analisada por um teste turbidimétrico usando placas de micro titulação em fundo chato (TPP). Para a realização do teste, 120µL de PBS foram colocados nos orifícios da primeira fileira da microplaca, e 120µL da suspensão bacteriana distribuídos nas subseqüentes.
Foram adicionados 60µL de soro, para uma concentração final de 33% nos orifícios da microplaca, que foi levada ao shaker por 15 segundos e depois incubada a 37ºC. A absorbância em comprimento de onda de 630ηm foi mensurada nos seguintes tempos após a adição do soro: zero, 30, 60, 90, 120 e 180 minutos. Cada isolado foi testado em triplicata para o soro normal e tratado; para o soro inativado utilizou-se uma amostra por isolado, para controle de crescimento. A leitura de fundo (branco) foi considerada a primeira fileira da microplaca na qual continha somente soro e solução PBS.
que apresentaram fração sobrevivente superior a 90%, ou seja, maior turvação, e os que ficaram entre esses dois valores foram considerados intermediários.
4.6. Produção de biofilmes
Para detectar a produção de biofilmes foi seguida a metodologia de Stepanovic et al. (2004).
Após reativação dos isolados em caldo BHI (Oxoid), 20µL de cada cultura a 3 x 105 UFC/mL 108 UFC/mL foram adicionados em triplicata nas cavidades de uma microplaca de poliestireno (TPP), com 96 orifícios e fundo em forma de “U” previamente esterilizadas em radiação ultravioleta (UV), juntamente com 230µL de caldo BHI novo. O controle negativo foi o caldo BHI estéril no volume de 250µL no orifício da placa. Após incubação a 37°C por 24 horas, os conteúdos semeados foram desprezados e cada cavidade foi lavada com 300µL de água destilada estéril, por três vezes. Em cada cavidade foi adicionado 250µL de Metanol (Labsynth, Diadema, São Paulo, Brasil) e após 15 minutos o conteúdo foi desprezado, seguindo-se de uma fase para aeração até secagem completa à temperatura ambiente. Em seguida, as cavidades foram preenchidas com 250µL de Cristal Violeta 1% (Reagen, Rio de Janeiro, Brasil) e depois de 10 minutos o excesso de corante foi retirado em água corrente e adicionado 250µL de Ácido Acético Glacial a 33% (Chemco, Campinas, Brasil). Os valores de densidade óptica (D.O.) foram mensurados no leitor de microplaca (Bio-tech ELx800, Winooski, EUA) em comprimento de onda de 570ηm e a média aritmética das triplicatas calculadas.
Baseando-se nas D.O produzidas pelos isolados (D.Oi) e tomando-se por base a D.O. média do controle negativo (D.OC), os isolados foram classificados segundo Stepanovic et al. (2004) nas seguintes categorias:
i) não produtor (D.Oi. ≤ D.OC),
ii) fraco produtor [D.OC < D.Oi. ≤ (2 x D.OC)],
4.7. Pesquisa do antígeno capsular K1
Foi utilizado um teste presuntivo de aglutinação em látex para a detecção qualitativa direta de antígenos K1, denominado kit Pastorex TM Meningitis (Bio-Rad, Hercules, Califórnia, EUA). Alíquotas das culturas obtidas foram aquecidas em banho-maria por três minutos a 100ºC. Após resfriamento, as suspensões foram submetidas à centrifugação a 1.400 X g por 10 minutos, e utilizadas conforme especificações do fabricante, procedendo-se a leitura macroscópica dos testes sob uma luz incandescente de alta intensidade. A aglutinação é evidente quando a amostra contendo antígenos bacterianos reage com os respectivos anticorpos aderidos ao látex.
4.8. Caracterização genotípica – Reação em cadeia de polimerase (PCR)
Quadro 3. Marcadores de virulência de Escherichia coli, suas funções, local onde são codificados e patotipos que os expressam com mais freqüência
Marcador de Virulência (Atividade)
Fenótipo/Função Localização Genômica
Patotipo de E. coli Associado
Fatores de colonização
Tipo 1 Adesina Fimbrial Cromossomo Todos
K99(F5) Adesina Fimbrial Plasmidial ETEC
F41 Adesina Afimbrial Cromossomo ETEC
Cs31A Adesina Afimbrial Plasmidial ETEC
F17 Adesina Fimbrial Cromossomo ETEC
F165 Adesina Fimbrial Cromossomo EXPEC
Eae Intimina Cromossomo EPEC, EHEC
Toxinas
STa Toxina Plasmidial; transposon ETEC
STb Toxina Plasmidial; transposon ETEC
LT1 Toxina Plasmidial ETEC
LT2 Toxina Cromossomo ETEC
EAST-1 Toxina cromossomo Plasmidial; Vários
VT1 Toxina Bacteriófago EHEC
VT2 Toxina Bacteriófago EHEC
FCN Toxina FCN1 cromossomo e FCN2 plasmidial (vir) ETEC
CLDT Toxina Cromossomo Vários
Extra-intestinais
Pap Adesina fimbrial Cromossomo ExPEC
Sfa Adesina fimbrial Cromossomo ExPEC
Afa Adesina afimbrial Cromossomo ExPEC
aer Aerotaxia Cromossomo Vários
saa Adesina Cromossomo EHEC
Ehly Enterohemolisina Bacteriófago EHEC
Hly α-hemolisina Plasmidial EHEC
Outros
Kps Cápsula Cromossomo MNEC
ipaH Invasinas Plasmidial EIEC
5. RESULTADOS E DISCUSSÃO
5.1. Produção de toxinas e de fatores citotóxicos de necrose
Dos 27 isolados, apenas quatro deles: E. coli 1, 2, 3H e 4 (14,8%) não apresentaram alterações morfo-estruturais compatíveis com efeitos citotóxicos, e tiveram o experimento levado até 72h sem alterações (Tabela 1).
Dois isolados, E. coli 25 e 3888 apresentaram alterações compatíveis com o padrão de verotoxina, arredondamento celular e enrugamento (shriveled), resultados confirmados pela detecção molecular do gene vt2 da toxina VT2. Os demais isolados, embora tenham apresentado alterações sugestivas de efeito citotóxico, não puderam ser analisados com especificidade suficiente a ponto de serem classificadas (YANO et al., 1986; BLANCO et al., 1990; SALVADORI et al., 2003), apesar de alguns deles apresentarem genes para outras toxinas, como a STb e EAST-1 (Tabela 2).
Tabela 1. Perfil de resultados de isolados de Escherichia coli em ensaios de citotoxidade em células Vero
Isolados 24h/Título 48h/Título 72h/Título Efeitos Visualizados
1 - - - -
2 - - - -
3E - +/80 +/80 Alongamento e morte celular
3H - - - -
4 - - - -
5 - - +/1280 Morte celular
23 - +/1 +/1 Morte celular
24 - +/160 +/320 Alongamento e morte celular
25 - +/1 +/1 Arredondamento celular
26 - +/20 +/40 Morte celular
27 +/1 +/1 +/1280 Alongamento e morte celular
29 - - +/1280 Morte celular
30 - - +/640 Morte celular
39 - +/1 +/1 Morte celular
51 - - +/1280 Morte celular
53 - +/1280 +/1280 Morte celular
54 - +/1280 +/1280 Morte celular
219 - +/1280 +/1280 Alongamento e morte celular
2058 - - +/1 Morte celular
3397 +/20 +/320 +/1280 Alongamento, filamentos e morte celular
3536 - +/1280 +/1280 Alongamento e morte celular
3888 +/1 +/1 +/1 Arredondamento celular
3889 - - +/40 Morte celular
3890 +/20 +/40 +/320 Alongamento e morte celular
3901 - +/1 +/1 Alongamento, filamentos e morte celular
3922 +/1 +/1 +/1 Morte celular
3950 - +/1 +/1 Células arredondadas e com filamentos
Controles
O157:H7(VT1) +/1 +/80 +/320 Células arredondadas e morte celular
J2(VT2) - +/1 +/1280 Células arredondadas e morte celular
40T(LT1) +/1 +/20 +/1280 Alongamento e morte celular
B62(LT2) - +/1 +/20 Células triangulares e morte celular
MR48(FCN1) - +/1 +/40 Morte celular
B26(FCN2) - +/1 +/20 Morte celular
h = horas.
63%). E após 72h de incubação 22% dos isolados apresentam efeitos citotóxicos (positividade acumulada 85%). Na análise das 48h obteve-se o efeito citotóxico em um maior número de isolados, mas em menores títulos. Porém, na análise das 72h foi obtido o efeito citotóxico até nos maiores títulos, considerando que a partir daí haveria perda da especificidade do experimento, pois já na presença de um filtrado bastante diluído a instabilidade do tapete celular já se manifestava por si só, e o experimento não foi levado à frente.
As Figuras 1 a 4 ilustram a evolução do efeito citotóxico apresentado pela monocamada de células Vero, diante da adição do filtrado bacteriano com Mitomicina C do isolado E. coli 3E (efeito citotóxico inespecífico). As Figuras 5 e 6, mostram, respectivamente os isolados de E. coli 25 e 3888, que apresentaram efeitos citotóxicos com características morfo-estruturais compatíveis com efeito de verotoxinas.
Tabela 2. Caracterização genotípica, realizada por Reação em Cadeia de Polimerase (PCR), dos isolados de Escherichia coli testados frente a fatores de colonização, toxinas, marcadores extraintestinais e outros mais relacionados com agentes da mastite
Isolados
Fatores de Colonização Toxinas Marcadores extraintestinais Outros
Fi
m
bria
Tipo
1
K99 F41
Cs3 1A F1 7 F1 65
eae STa STb LT1 LT2
EAST
-I
VT(1
/2
)
CNF CLDT Pap sfa AFA aer saa Ehl
y
hly kps ipaH
CVD 43 2 Fi lo ge n ia *
1 + - - - + - - - -/- - - A
2 + - - + - - - -/- - - B1
3E + - - + - - - -/- - - B1
3H + - - + - - - - + - - - -/- - - A
4 + - - - -/- - - A
5 + - - - + -/- - - + - - A
23 + - - + - - - - + - - - -/- - - A
24 + - - + - - - -/- - - A
25 + - - - + - - - -/+ - - - A
26 + - - - + - - - -/- - - A
27 + - - - + - - - -/- - - A
29 + - - - + - - - -/- - - A
30 + - - + - - - - + - - - -/- - - + - - + - - - A
39 + - - - -/- - - A
51 + - - + - - - + -/- - - B1
53 + - - - + - - - -/- - - A
54 + - - - + - - + -/- - - B1
219 + - - - -/- - - A
2058 + - - - -/- - - A
3397 + - - - + - - - -/- - - A
3536 + - - - -/- - - + - - - A
3888 + - - - + - - - -/+ - - - A
3889 + - - - + - - - -/- - - A
3890 + - - + - - - - + - - - -/- - - A
3901 + - - - -/- - - A
3922 + - - - -/- - - A
3950 + - - - + - - - -/- - - A
Figura 1. Monocamada de células Vero intactas, sem adição de filtrado bacteriano (Controle negativo). 400X.
Figura 2. Monocamada de células Vero após 24h de incubação com adição do filtrado bacteriano de E. coli 3E Efeito citotóxico ausente. 400X.
Figura 3. Monocamada de células Vero após 48h de incubação com adição do filtrado bacteriano de E. coli 3E. Efeito citotóxico: alongamento e morte celular inicial. 400X.
Figura 4. Monocamada de células Vero após 72h de incubação com adição do filtrado bacteriano de E. coli 3E. Efeito citotóxico: morte celular (células dispersas no meio). 400X
Figura 5. Monocamada de células Vero após 48h, incubação com adição do filtrado bacteriano de E. coli 25. Efeito citotóxico: arredondamento compatível com verotoxina. 400X.
Tabela 3. Combinações de marcadores de virulência detectados em isolados de Escherichia coli obtidos de leite mastítico
Combinações de marcadores* Numero de
Isolados (%) Isolados
Fímbria tipo 1, Cs31A, STb, Pap, aer 1 (3,7) 30
Fímbria tipo 1, Cs31A, STb 3 (11,1) 3H, 23 e 3890
Fímbria tipo 1, EAST-1, kps 1 (3,7) 5
Fímbria tipo 1, STb, VT2 2 (7,4) 25 e 3888
Fímbria tipo 1, Cs31A, EAST-1 1 (3,7) 51
Fímbria tipo 1, STb, EAST-1 1 (3,7) 54
Fímbria tipo 1, STb 8 (29,6) 1, 26, 27, 29, 53, 3397, 3889 e 3950
Fímbria tipo 1, Cs31A 3 (11,1) 2, 3E e 24
Fímbria tipo 1, Pap 1 (3,7) 3536
Fímbria tipo 1 6 (22,2) 4, 39, 219, 2058, 3901 e 3922
Total 27 (100)
* Legenda na Tabela 1.
O gene astA, responsável pela codificação da enterotoxina termoestável EAST1, foi presente em três isolados (11,1%). Osek (2003) refere-se a esta toxina como sendo um fator de virulência em potencial na patogênese de diarréia em humanos e animais (especialmente em suínos) por linhagens de EAggEC. Kaper e Nataro (2004) também admitem esta correlação, mas citam os trabalhos de Menard e Dubreuil (2002) que mencionam presença do gene para enterotoxina EAST1 em E. coli comensais. Não há associações desse gene em cepas de E. coli causadoras de mastite, porém relatos de Bertin et al. (1998), que trabalharam com 56 culturas de E. coli isoladas a partir de vacas com diarréia ou septicemia, demonstraram a presença de EAST1 em 66% de suas amostras. Além disso, a enterotoxina EAST1 foi detectada entre 87% de E. coli Cs31A positivas, ficando estabelecida uma estreita relação entre EAST1 com o fator de aderência Cs31A, observação esta também encontrada no isolado E. coli 51 deste experimento (Tabela 3).
discorda dos achados de outros estudos. Ao investigarem a ocorrência de FCN em 553 isolados de E. coli isoladas em diferentes afecções em vários tipos de animais, na Bélgica, entre 1977 e 1992, Pohl et al. (1993) detectaram sete (24,1%) culturas produtoras de FCN em 29 culturas de E. coli hemolíticas isoladas de mastite. Destas, seis culturas foram caracterizadas como FCN1 e uma FCN2. No mesmo estudo, os autores afirmaram que a ocorrência descrita provavelmente esteja subestimada, em virtude de o estudo restringir-se a isolados hemolíticos do agente. Isso não se aplica neste trabalho, pois todos os isolados foram submetidos aos testes. Ribeiro et al. (2006) detectou efeito citopático compatível com FCN em apenas um isolado (0,8%) de E. coli causadora de mastite clínica.
Como culturas de VTEC são isoladas a partir de fezes de bovinos, a possibilidade de se isolar este tipo de E. coli em mastites foi explorada por Nemeth et al. (1994). Entretanto, somente 8% dos isolados foram citotóxicos em células Vero. Da mesma forma, Barrow e Hill (1989), previamente mostraram que somente um isolado (0,5%) dos 237 de E. coli causadoras de mastite produziu verotoxinas. Também esses mesmos autores verificaram efeito citopático em células Vero compatível com a produção de VT em cinco isolados (4,2%), oriundos de 80 casos de mastite clínica e 40 de mastite subclínica. Esta baixa porcentagem está de acordo com o resultado deste trabalho, onde apenas dois isolados E. coli 25 e 3888 (7,4%) (Tabela 1), foram produtores de citotoxidade em células Vero e amplificaram para o gene da verotoxina VT2 (Tabela 2). Entretanto, Sandrini et al. (2007) estudando a presença de VTEC em 60 propriedades rurais da bacia leiteira de Pelotas-RS, verificaram a presença dessa em 49% (119/243) nas fezes dos animais testados, em 5% (3/60) das amostras de água para consumo humano, em 8,35% (5/60) das amostras de água para consumo animal e em 5% (3/60) das amostras de leite.
5.2. Pesquisa de hemolisinas
coli FVL-16 e C3888, de α-hemolisina e enterohemolisina, respectivamente, apresentaram resultados positivos. As Figuras 7 e 8 mostram a ação da α- e enterohemolisinas dessas culturas controle nas placas de Agar sangue.
Barrow e Hill (1989) ao pesquisarem fatores de virulência em 237 E. coli isoladas de mastite na Grã-Bretanha, observaram a produção de hemolisinas
(α-hemolisinas) em apenas 5% e descreveram essa característica, juntamente com outros fatores de virulência, como marcadores normalmente associados com tipos invasivos ou enteropatogênicos de E. coli. Assim, pelo fato de que apenas alguns isolados apresentaram este fator, consideraram que no geral, as amostras analisadas não definiam um padrão, mas sim refletiam uma ocorrência ocasional em comparação com padrões intestinais.
Figura 7. Ação de -hemolisina (seta preta)
produzida pela Escherichia coli FVL-16
(controle positivo).em Agar Sangue 5% após 3h de incubação a 37ºC.
Figura 8. Ações de enterohemolisina (seta
branca) produzida pela Escherichia coli
C3888 (controle positivo) e de -hemolisina
(seta preta) produzidas pela Escherichia
coli FVL-16 (controle positivo) após 24h de
incubação a 37ºC .
1999) concluem que as hemolisinas devem contribuir na virulência de E. coli no desenvolvimento da mastite, embora, provavelmente, não representem mecanismos essenciais na ocorrência de infecções clínicas na glândula mamária bovina (RIBEIRO et al., 2006). Isto poderia explicar a ausência dessas hemolisinas nos isolados de E. coli estudados, visto que foram isolados de mastite clinica. Têm-se observado a produção de α-hemolisina em índices iguais ou superiores a 30% em outras afecções extra-intestinais nos animais e no homem, notadamente em peritonites, meningites, infecções urinárias e septicemias (LUDWIG e GOEBEL, 1997). Nestas, a disponibilização do ferro mediante a ação hemolítica de determinados isolados de E. coli, bem como a ação nos neutrófilos, são mecanismos bem caracterizados na virulência do agente. Desta forma, a produção deste fator de virulência provavelmente contribui na patogenicidade de E. coli na mastite, embora pareça não representar um fator primário no estabelecimento de infecções clínicas na glândula mamária bovina (RIBEIRO et al., 2006).
No presente estudo, nenhum isolado apresentou efeito compatível com a produção de enterohemolisina. Semelhante à α-hemolisina, a produção de enterohemolisina provavelmente não possui relação direta com o estabelecimento de mastite. Entretanto, sua detecção em linhagens de E. coli, assume importância no contexto de Saúde Pública em virtude de relatos de sua eventual associação com VTEC ou EPEC (BEUTIN et al., 1988; LUDWIG e GOEBEL, 1997).
5.3. Resistência aos antimicrobianos
Embora os isolados apresentarem-se não resistentes in vitro frente à maioria dos antimicrobianos testados, nove (33,3%) apresentaram-se resistentes ao Sulfadiatrim, enquanto quatro (14,8%) foram resistentes a Ampicilina (Tabela 4). Foram encontrados também isolados de E. coli apresentando resistência intermediária a Neomicina (3,7%) e ao Sulfadiatrim (18,5%). Dados apresentados na Tabela 4.
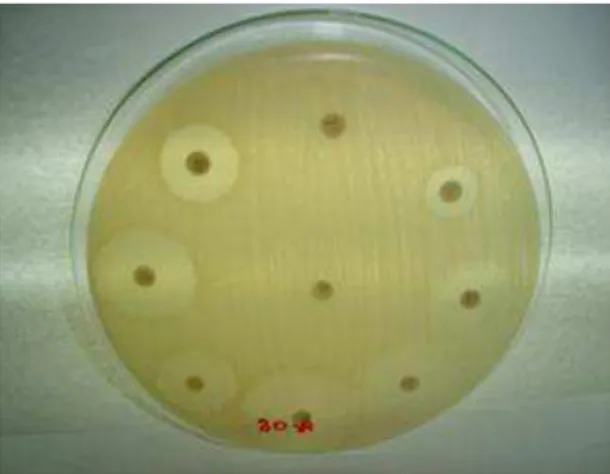
Gentamicina e Florfenicol; seguida da Neomicina com 96,3% de sensibilidade. Quatro isolados (14,8%), E. coli 30 (Figura 10), 3536, 3890 e 3950 apresentaram resistência simultânea à Ampicilina e ao Sulfadiatrim (Tabela 4).
Tabela 4. Perfil de resistência dos isolados de Escherichia coli encontrado frente aos antimicrobianos testados
Antimicrobianos N
o
de Isolados Sensíveis
No de Isolados Intermediários
No de Isolados Resistentes
Ampicilina 23 (85,2%) - 4 (14,8%)
Cefalexina 27 (100%) - -
Cefoperazone 27 (100%) - -
Ceftiofur 27 (100%) - -
Enrofloxacina 27 (100%) - -
Florfenicol 27 (100%) - -
Gentamicina 27 (100%) - -
Neomicina 26 (96,3%) 1 (3,7%) -
Sulfadiatrim 13 (48,2%) 5 (18,5%) 9 (33,3%)
N = número de isolados.
Figura 9. Cepa de Escherichia coli ATCC
25922 em Ágar Muller Hinton. Controle de medida dos halos.
Figura 10. Isolado de Escherichia coli 30 em Ágar Muller Hinton apresentando perfil de resistência à Ampicilina e ao Sulfadiatrim, simultaneamente.
dos antimicrobianos ensaiados, ressaltando a resistência simultânea a cinco drogas, em oito cepas (6,1%). Barrow e Hill (1989), na Inglaterra, referiram a resistência a um ou mais antimicrobianos em 22% dos isolados, destacando os maiores índices de resistência do agente para ampicilina (14%). Neste presente estudo 33,3% dos isolados foram resistentes para Sulfadiatrim, e 14,8% para Ampicilina.
Em relação à crescente resistência “in vitro” aos antimicrobianos em E. coli isoladas de mastite, Ribeiro (2006), cita os estudos de Stephan e Rüsch (1997) realizados na Alemanha que demonstraram em 95 isolados, 29% dos seus isolados resistentes (uma a sete drogas), com os maiores índices constatados para sulfametoxazol (23,1%), tetraciclina (19%) e ampicilina (16,8%). Ribeiro et al. (2006) também verificaram as maiores taxas de resistência para Ampicilina (24,1%) e da Sulfa-Trimetoprim (12,5%), embora tenham identificado 13,3% de isolados resistentes a Ceftiofur, enquanto no presente estudo 100% foram sensíveis.
Os achados neste estudo relacionados ao perfil de resistência dos isolados de E. coli aos antimicrobianos usados no tratamento da mastite definem um padrão de baixa resistência, comparados com os estudos de Soogard (1982); Barrow e Hill (1989) e de Ribeiro et al.( 2006).
5.4. Resistência ao soro
Apenas um isolado foi considerado sensível (3,7%), 11 intermediários (40,7%) e 15 deles (55,5%) resistentes a ação do soro bovino in vitro (Tabelas 5 e 6).
Os isolados de E. coli puderam ser divididos nos três grupos mencionados, de acordo com o seu crescimento na presença de 33% de soro bovino. Para todos os grupos, a curva de crescimento se apresentou similar na presença do soro normal e tratado com EGTA, definindo uma curva padrão, segundo a metodologia adotada.
Na década de 80, Sanchez-Carlo et al. (1984), analisando 184 culturas de E. coli isoladas de vacas com mastite clínica aguda, desafiadas contra produção de enterotoxinas, poder de invasividade e resistência ao soro, concluíram que a habilidade de resistência ao soro foi a única propriedade que poderia estar relacionada com virulência, pois a quase totalidade de seus isolados (99,5%) se apresentaram resistentes e somente um se apresentou fracamente sensível. Em nosso estudo, embora 55,5% dos isolados foram dados como resistentes, pode-se considerar a parcela dos isolados com comportamento intermediário (40,7%), como “potencialmente” resistentes ao soro, elevando o perfil de resistência para quase totalidade dos isolados tomados para análise, já que somente um deles se mostrou sensível autêntico, onde podemos estabelecer no mínimo, uma estreita correlação com as observações de Carroll (1973) e Sanchez-Carlo (1984). Considerando as observações de Nemeth et al. (1991) que também encontrou uma comparativamente baixa porcentagem de isolados resistentes (64%) em relação a outros achados, relacionou esta diferença com a possibilidade de ser devido às variações nas metodologias e na concentração do soro usado em outras pesquisas.