MARCO ANTONIO GOMES VALENTE JUNIOR
Avaliação de inibidores voláteis de corrosão por técnicas eletroquímicas sobre o aço.
Dissertação apresentada ao Instituto de Química, Universidade Estadual Paulista, como parte dos requisitos para obtenção do título de Mestre em Química.
Orientador: Prof. Dr. Cecilio Sadao Fugivara Co-Orientador: Prof. Dr. Assis Vicente Benedetti
FICHA CATALOGRÁFICA
Valente Junior, Marco Antonio Gomes
V154a Avaliação de inibidores voláteis de corrosão por
técnicas eletroquímicas sobre o aço / Marco Antonio Gomes Valente Junior. – Araraquara : [s.n], 2014
102 f. : il.
Dissertação (mestrado) – Universidade Estadual Paulista, Instituto de Química
Orientador: Cecilio Sadao Fugivara
1. Físico-química. 2. Inibidores. 3. Corrosão. 4. Aço. 5. Sobrepotencial catódico. I. Título.
Marco Antonio Gomes Valente Junior
Nome Marco Antonio Gomes Valente Junior
Filiação Marco Antonio Gomes Valente e Mirian Cleide Cavalcante de Oliveira
Valente
Nascimento 25/05/1989
Endereço
Residencial: Av. Alberto Toloi,
Quitandinha – Araraquara, SP – Brasil Telefone: 17 99744-3731
e-mail: m.valentejr@yahoo.com.br Endereço
Profissional: Universidade Estadual Paulista Júlio de Mesquita Filho,
Instituto de Química de Araraquara, Departamento de Físico-Química Rua Professor Francisco Degni nº55
Quitandinha - Araraquara 14800-900, SP - Brasil Telefone: 16 33016600
Formação acadêmica/titulação
2012 – atual Mestrado em andamento em Química (Conceito CAPES 6).
Universidade Estadual Paulista Júlio de Mesquita Filho, UNESP, Brasil.
Título: Estudo da eficiência de inibidores voláteis de corrosão aplicado nos aços laminados a frio.
Orientador: Cecilio Sadao Fugivara.
Bolsista do: Conselho Nacional de Desenvolvimento Científico e Tecnológico.
2008 – 2011 Graduação em bacharelado em química.
Trabalhos completos publicados em anais de congressos
1. VALENTE JUNIOR, M. A. G. ; BENEDETTI, A. V. ; NOCE, R. D. ; FUGIVARA, C. S. . Influence of Buffer Solution on the Tafel Parameters by Varying the Cathodic Overpotential Applied to Steel in Chloride Media. In: 10th Symposium on
Electrochemical Methods in Corrosion Research, 2012, Maragogi, AL. 10th Symposium on Electrochemical Methods in Corrosion Research, 2012. p. 18 -1-18 - 3.
2.VALENTE JUNIOR, M. A. G. ; FUGIVARA, C. S. ; BENEDETTI, A. V. . Influência do sobrepotencial catódico na obtenção dos parâmetros eletroquímicos obtidos das curvas de polarização.. In: XXIII Congresso de Iniciação Científica da Unesp, 2011, São Pedro. XXIII Congresso de Iniciação Científica da Unesp, 2011.
3.VALENTE JUNIOR, M. A. G. ; FUGIVARA, C. S. ; FERREIRA, E. A. ; BENEDETTI, A. V. . ESTUDO DE INIBIDORES À BASE DE AMINAS NA
CORROSÃO DO AÇO EM MEIO DE ÁGUA- ETANOL CONTENDO CLORETOS. In: XXII Congresso de Iniciação Científica da Unesp, 2010, Araraquara-SP. Anais do XXII Congresso de Iniciação Científica da Unesp, 2010. p. 4569-4572.
Resumos expandidos publicados em anais de congressos
1. VALENTE JUNIOR, M. A. G. ; ROSA, P. C. ; FUGIVARA, C. S. ; BENEDETTI, A. V. . INIBIDORES DE AMINAS NA CORROSÃO DO AÇO. In: XXI Congresso de Iniciação Científica da UNESP, 2009, São José do Rio Preto, SP. XXI Congresso de Iniciação Científica da UNESP. São Paulo: CGB/PROpe UNESP, 2009. p. 09256-09259.
Resumos publicados em anais de congressos
1. VALENTE JUNIOR, M. A. G. ; FUGIVARA, C. S. ; BENEDETTI, A. V. . Curvas de polarização cíclica com medidas in situ de pH local para avaliação de inibidores à base de aminas. In: XIX Simpósio Brasileiro de Eletroquímica e Eletroanalítica, 2013, Campos de Jordão. XIX Simpósio Brasileiro de Eletroquímica e Eletroanalítica, 2013.
2.VALENTE JUNIOR, M. A. G. ; BENEDETTI, A. V. ; FUGIVARA, C. S. .
Apresentações de Trabalho
1. VALENTE JUNIOR, M. A. G. ; FUGIVARA, C. S. ; BENEDETTI, A. V. . Curvas de polarização cíclica com medidas in situ de pH local para avaliação de inibidores à base de aminas. 2013. (Apresentação de Trabalho/Simpósio).
2.TEXEIRA, D. A. ; VALENTE JUNIOR, M. A. G. ; FUGIVARA, C. S. ; BENEDETTI, A. V. ; Silva, S. C. ; NOCE, R. D. . ESTUDO TEÓRICO E EXPERIMENTAL DE INIBIDORES DE CORROSÃO NO ELETRODO DE ZINCO EM SOLUÇÃO COM DIFERENTE PH. 2013. (Apresentação de Trabalho/Simpósio).
3. VALENTE JUNIOR, M. A. G. ; FUGIVARA, C. S. ; BENEDETTI, A. V. .
AVALIAÇÃO DOS PARÂMETROS DE TAFEL VARIANDO O SOBREPOTENCIAL CATÓDICO NO AÇO EM SOLUÇÃO CONTENDO CLORETOS. 2012.
(Apresentação de Trabalho/Congresso).
4. VALENTE JUNIOR, M. A. G. ; FUGIVARA, C. S. ; BENEDETTI, A. V. . Influência do sobrepotencial catódico na obtenção dos parâmetros eletroquímicos obtidos das curvas de polarização.. 2011. (Apresentação de Trabalho/Congresso).
5. VALENTE JUNIOR, M. A. G. ; FUGIVARA, C. S. ; FERREIRA, E. A. ; BENEDETTI, A. V. . ESTUDO DE INIBIDORES À BASE DE AMINAS NA
CORROSÃO DO AÇO EM MEIO DE ÁGUA- ETANOL CONTENDO CLORETOS. 2010. (Apresentação de Trabalho/Congresso).
AGRADECIMENTOS
Aos meus pais por todo apoio e incentivo.
Ao Prof. Dr. Cecílio Sadao Fugivara pela amizade, paciência e ensinamentos.
Ao Prof. Dr. Assis Vicente Benedetti e o Grupo de Eletroquímica de Materiais e pelas discussões e ajudas no laboratório.
Aos funcionários da seção de pós-graduação e biblioteca.
Aos integrantes e ex-integrantes da república Espanha 1515 da qual fiz parte durante esses anos.
Aos amigos da república Xurupitas Farm
RESUMO
Neste trabalho foi estudada a eficiência de inibidores voláteis de corrosão (VCI) aplicados na proteção contra a corrosão do aço CFF (chapa fina a frio). Para avaliar os inibidores foram determinadas as resistências de polarização e alguns parâmetros cinéticos empregando as técnicas de curvas de polarização cíclica (CPP), espectroscopia de impedância eletroquímica (EIS) e Polarização linear (PL). Também foi investigada a influência do sobrepotencial catódico nas curvas de polarização e o efeito do pH próximo à superfície do eletrodo nos parâmetros cinéticos, por meio de medidas simultâneas dos valores de pH empregando um eletrodo de W/WOx. Os inibidores avaliados foram: etanolamina (ETA),
ciclohexilamina (CHA), diciclohexilamina (DCHA), ácido caprílico (H-CAP), caprilato de sódio (Na-CAP), caprilato de etanolamina (ETA-CAP), caprilato de ciclohexilamina (CHA-CAP) e caprilato de diciclohexilamina (DCHA-CAP). Estes inibidores foram dissolvidos e estudados nas soluções: a) NaCl 0,1 mol L-1 e b)
tampão borato (TB) + NaCl 0,1 mol L-1 (pH 6,7). Os resultados obtidos mostraram
que os parâmetros das curvas de Tafel dependem do sobrepotencial catódico aplicado no início das curvas de polarização, pois alteram o valor do pH na superfície do eletrodo devido às reações de redução do oxigênio e da água, que produzem hidroxilas, além de remover o filme de óxidos. Observou-se que estes efeitos são minimizados nas medidas utilizando-se solução tampão. A eficiência dos inibidores não apresenta variação significativa entre as diferentes técnicas eletroquímicas. No entanto, as eficiências destes inibidores variam conforme o pH da solução de NaCl 0,1 mol L-1 ou TB + NaCl 0,1 mol L-1, mostrando que as aminas
protonadas não foram eficientes, enquanto as aminas desprotonadas passivam a superfície do eletrodo devido ao aumento do pH da solução (> 11,7). Os caprilatos de aminas foram eficientes tanto na solução de NaCl quanto em tampão borato. Entretanto, apenas com o caprilato de sódio na solução tampão não foi eficiente. A presença da amina na solução contendo íons caprilatos pode induzir a formação de espécies insolúveis ou podem induzir a adsorção dos caprilatos. Os caprilatos de aminas mostraram uma eficiência contra a corrosão superior a 80%. No entanto, os resultados obtidos não concordam com os da literatura feitos em câmara úmida.
ABSTRACT
In this work, the efficiency of volatile corrosion inhibitors (VCI), applied to the protection against corrosion of CFF steel, was studied. In order to evaluate the inhibitors, it was determined the polarization resistances and some kinetic parameters by using the following electrochemical techniques: cyclic polarization curves, electrochemical impedance spectroscopy (EIS), and linear polarization. In addition, it was investigated the influence of cathodic overpotential on the polarization curves and the effect of pH close to the electrode surface on the kinetic parameters. The latter was conducted by means of simultaneous measurements of the pH values employing a W/WOx electrode. The evaluated inhibitors were: ethanolamine (ETA),
cyclohexylamine (CHA), dicyclohexylamine (DCHA), caprylic acid (H-CAP), sodium caprylate (Na-CAP), ethanolamine caprylate (ETA-CAP), cyclohexylamine caprylate (CHA-CAP), dicyclohexylamine caprylate (DCHA-CAP). These inhibitors were dissolved and studied in the following solutions: a) 0.1 mol L-1 NaCl and b) borate
buffer (BB) + 0.1 NaCl mol L-1. The obtained results showed that the parameters of
Tafel curves depend on the cathodic overpotential applied in the beginning of the polarization curves. These parameters alter the pH on the electrode surface due to the oxygen reduction and water reactions which produce hydroxyls ions besides removing the oxides film. It was noticed that these effects are minimized when a buffer solution is employed. The inhibitors efficiency does not show a significant variation with respect to the different used electrochemical techniques. However, the inhibitors efficiency varies as a function of the used solution pH (0.1 mol L-1 NaCl or
BB + 0.1 NaCl mol L-1) showing that the protonated amines were not efficient while
the unprotonated amines passivate the electrode surface owing to an increase in the solution pH (> 11.7). The amines caprylates were efficient on both NaCl and BB solutions. Meanwhile, only the BB solution containing sodium caprylate was not efficient. The presence of amine in the solution containing caprylates ions may induce the formation of insoluble species or may induce the caprylates adsorption. The amines caprylates exhibited an efficiency against corrosion higher than 80% which are not in agreement with results from the literature conducted in humidity chambers.
LISTA DE ABREVIATURAS E SIGLAS
VCI – Inibidores voláteis de corrosão CFF – Chapa de aço lamanado a frio CPP – Curvas polarização cíclica
EIS – Espectroscopia de impedância eletroquímica PL – Polarização linear
ηcat. – Sobrepotencial catódico
W/WOx – Tungstênio/Óxido de tungstênio
ETA – Etanolamina CHA – Ciclohexilamina DCHA – Diciclohexilamina
H-CAP – Ácido caprílico ou octanóico Na-CAP – Caprilato de sódio
ETA-CAP – Caprilato de etanolamina CHA-CAP – Caprilato de ciclohexilamina DCHA-CAP – Caprilato de diciclohexilamina TB – Solução tampão borato (pH 6,7)
ECorr – Potencial de corrosão
ECA – Potencial de circuito aberto
iCorr - Corrente de corrosão
βa – Coeficiente de Tafel anódico
βc – Coeficiente de Tafel catódico
Erepass – Potencial de repassivação
Einv – Potencial de inversão do sentido da varredura
RSG – Resistência de Stern-Geary
RTC – Resistência de transferência de carga
RPL – Resistencia da polarização linear
SUMÁRIO
1. INTRODUÇÃO………..11
2. REVISÃO BIBLIOGRÁFICA...13
2.1. Inibidores voláteis de corrosão...13
2.2. Curvas de polarização...23
2.3. Aço CFF (Chapa Fina laminado a Frio)...25
2.3.1. Composições químicas da superfície do ferro...25
2.3.2. Reações de redução ...27
2.4. Eletrodo de W/WOx para medida de pH local ...31
3. OBJETIVOS...33
4. PROCEDIMENTO EXPERIMENTAL...34
5. RESULTADOS E DISCUSSÃO...37
5.1. Efeito do sobrepotencial catódico...38
5.2. Efeito dos inibidores...51
5.2.1. Potencial de circuito aberto (ECA)...51
5.2.2. Curvas de polarização cíclica (CPP)...61
5.2.3. Diagramas de impedância (EIS)...76
5.2.4. Polarização linear (RPL)...91
6. CONCLUSÕES...95
1. INTRODUÇÃO
As peças metálicas após passar pelo processo de conformação devem ser armazenadas e transportadas muitas vezes durante longo período de tempo antes de serem efetivamente utilizadas. Para evitar sua degradação na superfície das peças durante o período de transporte e armazenamento, as peças fabricadas devem receber uma proteção temporária contra a ação da umidade e de poluentes atmosféricos corrosivos (VUORINEN; KÁLMÁN; FOCKE, 2004).
Uns dos protetores temporários bastante empregados nas peças metálicas são os inibidores voláteis de corrosão (VCI – Volatile Corrosion Inhibitor), compostos que se vaporizam e condensam sobre a superfície metálica tornando-a menos suscetível à corrosão (BASTIDAS; CANO; MORA, 2005). A principal vantagem do VCI em relação aos métodos convencionais de controle da corrosão, além da facilidade da sua remoção após abertura do invólucro, é que o transporte na fase gasosa permite atingir toda a superfície metálica sem a necessidade da aplicação direta sobre o metal. O filme de VCI formado sobre o metal é bastante fino e, portanto, não interfere no tratamento subsequente da superfície protegida, como na fosfatização e pintura eletroforética. (BASTIDAS; CANO; MORA, 2005).
A literatura (VALDES et al., 2006)mostra que existe um grande esforço para encontrar VCI específico e mais eficiente para determinados metais, além de desenvolver métodos alternativos que demandam menos tempo ao da câmara úmida para testes de corrosão de peças metálicas em contato com VCI. O teste de câmara úmida, conforme a norma IEC 68-2-30 (1980) é adotada no controle da qualidade pelos transportadores. Por outro lado, os ensaios de corrosão empregando técnicas eletroquímicas são rápidos, mas a amostra metálica deve estar em contato com uma lâmina bastante espessa de um eletrólito condutor (VALDES et al., 2006), condição que não é observada durante armazenagem e transporte dessas peças metálicas. Isso torna obrigatório o desenvolvimento de metodologias mais simples, eficientes e rápidas para avaliar a eficiência dos compostos VCI.
As metodologias eletroquímicas empregadas na avaliação da eficiência do VCI baseiam-se na obtenção de curvas de polarização (CP) (QURASHI; JAMAL, 2002, p. 387) e espectros de impedância eletroquímica (EIS) (SUDHEER et al.,
peças metálicas estão em contato com vapor de água e de VCI e, portanto, não ficam imersas numa solução. No entanto, o armazenamento e transporte são feitos num ambiente cuja umidade pode condensar e formar um filme do líquido ou gotículas sobre parte da superfície (BASTIDAS; CANO; MORA, 2005).
De um modo geral, os métodos que utilizam células eletroquímicas com uma fina camada de solução (100 a 200 µm) têm apresentado bons resultados (CANO et al., 2005; ZHANG et al., 2006; SUDHEER et al., 2012). Entretanto, outros trabalhos (QURAISHI; ANSARI; RAWAT, 2009; KANNAN; LAVANYA; NATESAN, 2012) utilizaram células eletroquímicas convencionais para avaliar os inibidores voláteis de corrosão, cujo volume de solução empregado é muito espesso. Porém, as diferentes espessuras de solução sobre a amostra metálica pode influenciar na difusão do oxigênio até a superfície e, portanto, influenciar na velocidade de corrosão e na composição do filme formado ocasionando diferentes interpretações.
Li et al. (1997) concluíram que a natureza da superfície metálica é um fator
determinante para a performance dos inibidores, e por isso é comum a utilização de soluções ácidas (LI et al., 1997; CAO, 1996; MORAD, 2000; LI, 2009) para avaliar a eficiência dos inibidores, pois nesta condição a exposição do metal base com o ambiente é maior, devido à decapagem dos filmes de óxidos protetores, e consequentemente a interação com os inibidores é facilitada. Entretanto, os VCIs não deveriam ser avaliados em meio ácido, já que alguns estudos mostraram que a volatilização dos sais ocorre num intervalo de pH entre 5,5 e 8,5 (BASTIDAS; CANO; MORA, 2005). Rammelt, Koehler e Reinhard (2009, 2011) demostraram por meio de testes eletroquímicos (EIS, OCP e CP) que a eficiência dos sais de VCIs está diretamente relacionada com o pH da solução utilizada. Os resultados mostram também que a proteção de metais ferrosos em embalagens é mais eficaz sob condições neutras e ligeiramente alcalinas (pH < 9,0) do que em condições fortemente alcalinas ou ácidas, que dependendo do metal, podem causar um processo de limpeza de óxidos na superfície, além de tornarem a superfície mais sensível ao ataque de contaminantes ocasionando uma corrosão localizada.
a espessura e composição da camada de óxidos e hidróxidos presentes na superfície do eletrodo devido à presença de íons cloretos. Estas informações são importantes para entender os resultados obtidos durante uma curva de polarização, pois o processo de redução do oxigênio sobre o ferro pode variar com o pH próximo a superfície (pH local), modificando assim a composição química da superfície (ZECEVIC; DRAZIC; GOJKOVIC, 1989).
Por estas razões, neste trabalho investigou-se por meio de técnicas eletroquímicas a influência do pH (local e na solução) na avaliação dos inibidores voláteis de corrosão em soluções contendo íons cloretos.
2. REVISÃO BIBLIOGRÁFICA
2.1. Inibidores voláteis de corrosão
Os inibidores voláteis de corrosão (VUORINEN; KÁLMÁN; FOCKE, 2004; BASTIDAS; CANO; MORA, 2005) apresentam várias vantagens em relação aos métodos comuns de proteção contra a corrosão. Dentre estas vantagens está o baixo custo de operação, a facilidade de aplicação e não interferem nos tratamentos posteriores da superfície protegida. Estes inibidores são utilizados na forma de filmes plásticos ou embalagens de papel infestado com VCI, grânulos envolvidos em saches (VUORINEN; KÁLMÁN; FOCKE, 2004; BASTIDAS; CANO; MORA, 2005).
O VCI é definido por ser um composto que produza uma fina camada protetora sobre a superfície do metal limitando desta forma a penetração de espécies corrosivas (VUORINEN; KÁLMÁN; FOCKE, 2004). Estes compostos utilizados como VCIs podem ser: nitritos orgânicos (aço carbono e latão), carbonatos orgânicos (aço), benzoatos orgânicos (aço), cromatos orgânicos (bronze) e fosfatos orgânicos (alumínio) (BASTIDAS; CANO; MORA, 2005). Damborenea, Bastidas e Vázquez (1997) utilizaram as aminas como VCI para a inibição da corrosão do ferro e suas ligas, pois apresentam outras vantagens como baixo peso molecular e solubilidade em meio aquoso relativamente alto. Normalmente, a maioria dos inibidores de corrosão orgânicos tem um ou mais átomos eletronegativos (por exemplo, o oxigênio, nitrogênio e enxofre) na forma de grupos funcionais e/ou ligações insaturadas (VUORINEN; KÁLMÁN; FOCKE, 2004).
como tampão, mantendo o pH na interface metal-inibidor, proporcionando uma ótima proteção à corrosão (BASTIDAS; CANO; MORA, 2005).
A atuação do VCI na superfície metálica pode ser descrito de dois modos (BASTIDAS; CANO; MORA, 2005): (a) as moléculas são volatilizadas e se rompem quando alcançam à superfície metálica; ou (b) o inibidor se dissocia antes de chegar à superfície metálica e satura o ar em contato com o metal com os grupos protetores. O equilíbrio do sistema e a adsorção na superfície podem ser influenciados pela quantidade de vapor de água existente no ambiente, principalmente se a solubilidade do VCI neste meio for alta. O valor do pH local depende do VCI dissolvido na fina camada sobre a superfície metálica e pode definir a atuação destes inibidores e a composição química da superfície metálica.
A eficiência do VCI depende bastante da sua pressão de vapor, natureza do inibidor, temperatura e pressão ambiente. O aumento da temperatura pode afetar o comportamento do VCI, pois geralmente ocorre a redução de sua eficiência devido à dessorção da superfície. Caso esta pressão seja bastante elevada, o inibidor poderá se adsorver e/ou condensar em grande quantidade na superfície metálica, dificultando as etapas posteriores de tratamento como a fosfatização do aço. Além disso, uma vaporização pronunciada levará a um rápido consumo do VCI diminuindo o período de proteção. Entretanto, se a pressão de vapor for muito baixa, o inibidor não irá cobrir totalmente a superfície antes do ataque por agentes corrosivos. Os valores de pressão de vapor à temperatura ambiente podem variar entre 10-2 a 10-7
mmHg (VUORINEN; KÁLMÁN; FOCKE, 2004; BASTIDAS; CANO; MORA, 2005). O tamanho da cadeia carbônica é outro fator que afeta a eficiência dos inibidores, geralmente cadeias de 6 a 12 carbonos melhoram a atuação do inibidor (DAMBORENEA; BASTIDAS; VÁZQUEZ, 1997).
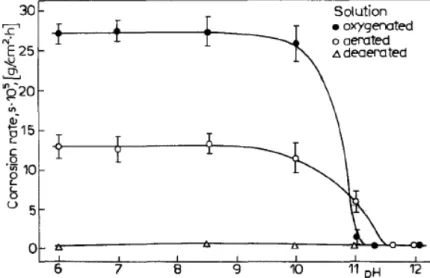
A atuação dos ácidos carboxílicos sobre o ferro foi estudada desde a década de 70. Mrowczynski e Szklarska-Smialowska (1975, p. 192) estudaram o efeito do ácido caprílico dissolvido em soluções aquosas desarejadas contendo íons sulfatos no intervalo de pH 6 - 12. Os resultados mostraram que a presença do ácido caprílico inibe a corrosão do ferro, mas sua eficiência diminui com o aumento do pH, além de afetar a cinética do crescimento de filmes na superfície do eletrodo. Nestas mesmas soluções, MROWCZYNSKI e SZKLARSKA-SMIALOWSKA (1979, p. 201), também estudaram a influência do oxigênio na inibição do ferro, e concluíram que a capacidade inibidora dos ácidos carboxílicos na solução de Na2SO4 é causada por
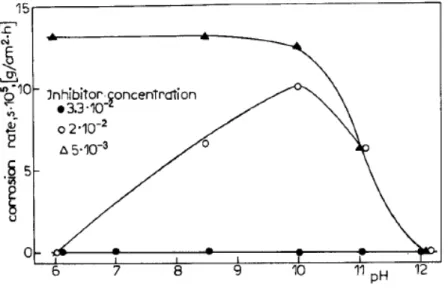
uma ação sinérgica entre o oxigênio dissolvido e os ânions carboxilatos. Estes autores mostraram que em soluções contendo íons sulfatos e ácido caprílico 0,020 mol L-1 (Figura 1), a resistência de polarização medido a partir do potencial de 0 V, é sempre maior em soluções arejadas e com pH 6. Entretanto, em pH 12, não se observa diferenças nos valores das resistências tanto em solução arejada como na desarejada. Além disso, verificaram que existe uma concentração crítica para que o ácido seja um efetivo inibidor (Figura 2).
Figura 1 – Relação entre a resistência de polarização e o potencial do eletrodo de ferro nas soluções desarejadas (curvas 1 e 2) e arejadas (curvas 1` e 2`) contendo íons sulfatos e o ácido caprílico na concentração de 0,020 mol L-1.
Figura 2 – Efeito do pH e concentração do ácido caprílico (em mol L-1) na taxa de
corrosão do ferro em solução arejada contendo íons sulfatos.
Fonte: Mrowczynski; Szklarska-smialowska (1979, p. 201)
Forker, Reinhard e Rahner (1979) mostraram que em soluções oxigenadas, os sais de ácidos fracos passivam o ferro somente quando o pH da solução excede um valor crítico, denominado pHc. Este valor de pH depende do oxigênio dissolvido
na solução (CO2), da natureza do sal (pKa) e a concentração do sal do ácido fraco
(Cs). Forker, Reinhard e Rahner (1979) também mostraram que esta dependência
varia conforme equação 1:
pHc = log Cs – log CO2 + pKa – constante (1)
Posteriormente, Reinhard, Radtke e Rammelt (1992) calcularam a concentração crítica mínima para que ocorra a passividade do ferro pelos ácidos fracos. No caso dos caprilatos a concentração crítica é ≥ 0.010 M e o pHc ≥ 5.9 (Tabela 1). Reinhard,
Tabela 1 – Condições para que ocorra a passivação química do ferro em soluções saturadas com ar contendo alguns ácidos carbônicos a 25°C.
Fonte: Reinhard; Radtke; Rammelt (1992)
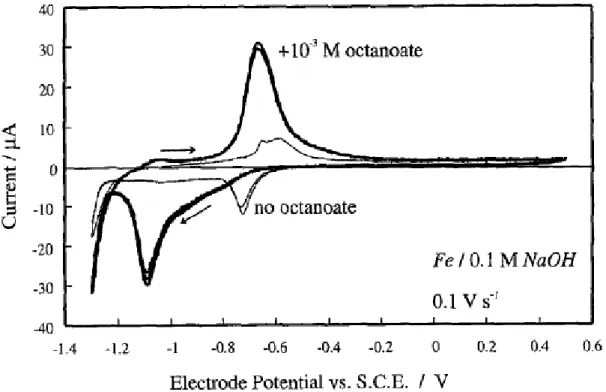
Zhu, Kelsall e Spikes (1996) estudaram a presença do ácido octanóico em soluções fortemente alcalinas sobre o ferro com a finalidade de reduzir o atrito entre o contato sólido-sólido. Estes autores mostraram que na presença dos íons caprilatos (CH3(CH2)6CO2-), o pico da corrente anódica (Figura 3) depende da
adsorção do caprilato que compete com as hidroxilas, causando a formação de octanoato de Fe (II):
Fe0 + 2CH
3(CH2)6CO2- = Fe(CH3(CH2)6CO2)2 + 2e- (2)
e octanoato de Fe (III):
Fe(CH3(CH2)6CO2)2 + CH3(CH2)6CO2- = Fe(CH3(CH2)6CO2)3 + e- (3)
Figura 3 – Voltamograma cíclico para o eletrodo de ferro em NaOH 0,100 mol L-1
(linha fina) + octanoato 10-3 mol L-1 (linha espessa).
Fonte: Zhu; Kelsall; Spikes (1996)
Alguns trabalhos (JEYAPRABHA; SATHIYANARAYANAN; VENKATACHARI, 2005; LI et al. 1997) mostraram que no ferro, a presença das aminas na solução de H2SO4 0,5 mol L-1 ocorre um efeito de inibição devido a um processo de adsorção. Li
Figura 4 – Possível mecanismo de adsorção das aminas: (a) quimissorção na superfície metálica; (b) ligações de hidrogênio formando um filme passivo.
Fonte: Li et al (1997)
No entanto, Luo, Guan e Han (1998) estudando a influência das aminas sobre o aço em soluções ácidas contendo íons cloretos, mostraram que a eficiência de inibição destas aminas protonadas não é devido à adsorção, mas pelo ataque dos íons cloretos na superfície. Por consequência, a aproximação das aminas por interação eletrostática aumenta a concentração destas espécies até atingir o produto de solubilidade ocorrendo à precipitação do sal de cloridrato orgânico (cloreto de amina) na superfície do eletrodo. Na Figura 5 observa-se o esquema de precipitação do íon cloreto de amina sobre a superfície do aço em soluções ácidas contendo íons cloretos.
Figura 5 – Esquema da precipitação do cloreto de amina sobre a superfície do aço em soluções ácidas contendo íons cloretos.
A adsorção de carboxilatos de aminas também foi estudada em meio ácido. Szauer e Brandt (1981) estudaram oleatos de aminas em meio de H2SO4 e
concluíram que os sais tendem a adsorver quimicamente na superfície do ferro. Além disso, devido aos grupos funcionais das aminas, os adsorvatos podem formar ligações transversais causando interações laterais na camada protetora.
De um modo geral, estas observações concordam com o mecanismo de proteção dos VCIs representado na Figura 6 (BASTIDAS; CANO; MORA, 2005), onde o grupo funcional (R1), ligado ao núcleo (R0) da molécula inibidora, é
responsável pela subsequente adsorção na superfície metálica. O grupo funcional (R2) conectado ao grupo R0, determina a espessura e a natureza protetora do filme
adsorvido formada.
Figura 6. Esquema do mecanismo de inibição dos VCIs.
Fonte: Bastidas; Cano; Mora (2005)
Tabela 2 – Características físico-químicas dos inibidores e precursores.
Nome Etanolamina Ciclohexilamina Diciclohexilamina Ácido Caprílico
Fórmula estrutural
Massa Molecular
(g mol-1) 61,08 99,17 181,32 144,21
Pressão de vapor
(mmHg) 0,2 (20°C)
10 (22°C)
23 (37,7°C) 12 (37,7°C) 1 (78°C)
Solubilidade em água
(g L-1) Miscível Miscível < 1 0,68
pKa 9,50 10,64 ---- 4,90
Densidade (g L-1) 1,012 (25°C) 0,867 (25°C) 0,912 (20°C) 0,910 (25°C)
Densidade de vapor
(vs. ar) 2,1 3,42 6 5
Baker (1954) estudou a eficiência de aminas, ácidos carboxílicos e sais de aminas com nitritos e benzoatos. O procedimento adotado por Baker (1954) foi suspender uma amostra de aço laminado a frio dentro de um tubo de ensaio tampado contendo o VCI por 20 horas a 75°F. Após este tempo, o tubo era aberto para a adição de 0,25 ml de água destilada e em seguida era fechado e armazenado por uma semana a 150°F. No fim do teste a amostra era retirada e analisada. As amostras foram avaliadas por estimativa da superfície total não corroída. Baker (1954) classificou o grau de proteção dos VCIs em 5 escalas arbitrariamente: 0, 25, 50, 75 e 100%. Em seu trabalho, Baker (1954) observou que os carboxilatos de aminas são mais eficientes quando comparados com os nitritos de aminas.
Posteriormente, a eficiência de inibição de alguns carboxilatos de aminas no aço foi determinada por Vuorinen e Skinner (2002). Os resultados foram obtidos pelo teste de Skinner (1993), onde a amostra metálica é exposta a uma atmosfera corrosiva e contendo VCI por 72 horas a 33°C, após o teste as eficiências são obtidas por perda de massa.
A Tabela 3 mostra os valores das eficiências dos VCIs obtidos por Baker (1954) e Vuorinen e Skinner (2002). Baker (1954) considerou um VCI eficiente caso sua inibição fosse > 50%, enquanto que Vuorinen e Skinner (2002) consideraram > 90%. Nesta Tabela estão apresentadas as eficiências dos VCIs que serão estudados neste trabalho.
Tabela 3 – Eficiência dos VCIs obtidos por testes de câmara úmida.
VCI Baker (1954) Vuorinen e Skinner (2002)
Etanolamina 75% ----
Ciclohexilamina 50% ----
Diciclohexilamina 75% ----
Ácido Caprilíco 75% ----
Caprilato de Etanolamina ---- > 90%
Caprilato de Ciclohexilamina ---- 25%
Caprilato de Diciclohexilamina ---- 50%
2.2. Curvas de polarização
As curvas de polarização são utilizadas para avaliar a taxa de corrosão de diversos materiais metálicos em contato com diferentes meios corrosivos apresentando diferentes tipos de corrosão. A partir destas medidas determinam-se o potencial de corrosão (ECorr), a corrente de corrosão (iCorr) e os coeficientes de Tafel,
anódicos (βa) e catódicos (βc) (SIEBERT, 1985, p. 65).
Geralmente, as curvas de polarização são obtidas varrendo-se o potencial entre a região de sobrepotenciais negativos (ramo catódico) até a região de sobrepotenciais positivos (ramo anódico). As curvas podem ser registradas variando-se o potencial e registrando a corrente e vice-versa, e teoricamente são lineares quando colocadas em gráfico semi-logarítmico. Da intersecção do potencial de corrosão com uma ou ambas correntes anódica ou catódica, determina-se a corrente de corrosão que permitirá calcular a velocidade de corrosão. As curvas experimentais fornecem gráficos semi-logarítmicos que nem sempre correspondem a uma reta devido à interferência de reações de eletrodo (SIEBERT, 1985, p. 65).
Entretanto, existem algumas limitações no método de extrapolação de Tafel para a determinação das taxas de corrosão. Dentre essas limitações tem-se: (1) a necessidade de pelo menos um dos ramos da curva E - log i estar sob o efeito de polarização por ativação; (2) a corrosão precisa ser uniforme, ou seja, corrosão generalizada; (3) a exigência de que ao menos uma das regiões de Tafel seja linear e bem definida, i.e., extensa o suficiente para traçar uma reta com número significativo de pontos; (4) as mudanças do potencial do eletrodo (sobrepotencial, equação 4) durante a obtenção da curva de polarização não podem produzir reações adicionais, além das que já ocorrem na corrosão (MCCAFFERTY, 2005, p. 3202). No entanto, dependendo da solução, do metal e do sobrepotencial catódico aplicado, duas reações de redução podem ocorrer.
= E aplicado – E Circuito Aberto (4)
Durante a polarização anódica pode ocorrer dissolução do metal (M) produzindo íons metálicos, enquanto que na polarização catódica, moléculas de água (equação 5) podem ser reduzidas no catodo para formar íons OH-:
ou, no caso de soluções aquosas arejadas ou saturadas com oxigênio, este é completamente reduzido a OH- (equação 6), independente do pH da solução e da
concentração de Cl- (MIYATA; ASAKURA, 2002, p. 589):
2 H2O + O2 + 4e- → 4OH- (6)
A formação de OH- (equações 5 e 6) elevam os valores de pH próximo à superfície do eletrodo de trabalho, cuja corrosão está sendo avaliada.
Miyata e Asakura (2002, p. 589), utilizando um eletrodo de disco rotatório de Fe mostraram que em baixas velocidades de varredura (0,5 mV s-1) as polarizações catódicas não apresentaram uma histerese significativa, mas em velocidade maiores (100 mV s-1) observou-se histerese. Este comportamento pode ser explicado pela formação de hidróxidos na surperficíe do eletrodo conforme a reação (DÍEZ-PÉREZ et al., 2001):
M0 + 2OH- M(OH)
2.3. Aço CFF (Chapa Fina laminada a Frio)
2.3.1. Composições químicas da superfície do ferro
As espécies formadas na superfície do eletrodo variam diretamente com o pH. A partir dos diagramas de Pourbaix, (Figura 7), cujo gráfico Eh – pH, representa as
possíveis espécies em equilíbrio num sistema eletroquímico. (REFAIT; GÉNIN, 1993, p. 797). Refait e Génin (1993, p. 797) mostraram que a oxidação de um precipitado de hidróxido de ferro na presença de excesso de cloreto ferroso dissolvido leva à obtenção de uma ferrugem verde (GR1), cuja fórmula é: 3 Fe(OH)2
• Fe(OH)2Cl.nH2O, e, portanto, contém um íon Fe3+ para um íon Cl-. Esta relação
sugere que a oxidação de Fe2+ para Fe3+ é influênciada pela presença do íon
cloreto.
Refait e Génin (1993, p. 797) ainda notaram que quando a razão (R) entre Cl
-/OH- é de aproximadamente 1,143, a reação de formação de GR1 é dada pela
equação:
7Fe(OH)2 + Fe2+ + 2Cl- + ½O2 + (2n + 1)H2O 2[3Fe(OH)2 • Fe(OH)2Cl• nH2O] (8)
Para valores de R > 1,75, o hidróxido inicial é um hidróxido ferroso contendo cloreto, provavelmente 2Fe(OH)2 • FeOHCl, que também será transformado em GR1.
Figura 7 – Diagrama de equilíbrio Eh – pH a 25°C, com [Cl-] = 0,35 mol L-1 para o
sistema Fe - GR1 - γ-FeOOH – H2O – Cl-. Onde GR1= Fe4(OH)8Cl-.
Fonte: Refait; Génin (1993, p. 797).
Figura 8 – Taxa de corrosão do ferro em soluções contendo íons sulfatos em função do pH e concentração de oxigênio.
2.3.2. Reações de Redução
Jovancicevic e Bockris (1986, p. 1797) estudaram o mecanismo de redução do oxigênio num eletrodo de disco rotatório sobre o ferro em solução neutra e concluíram que a taxa dessa reação sobre ferro passivado é maior que em ferro puro. Além disso, a redução do oxigênio no ferro puro ocorre por um mecanismo que envolve 4e- com formação de pequena quantidade de H2O2. No entanto, sobre uma
superfície passiva, a reação envolve 2e- com geração de H2O2. Zecevic, Drazic e
Gojkovic (1989), mostraram nestas mesmas condições, histereses significativas nas curvas de polarização, devido às mudanças que ocorrem na camada de óxidos/hidróxidos de ferro devido à formação durante a varredura de potencial a partir da reação de redução do oxigênio.
Wroblowa e Qaderi (1990, p. 231) estudaram a redução de oxigênio sobre aço em solução alcalina (NaOH 1 mol L-1) e os resultados obtidos sugeriram que na
região de potencial negativo vs. o eletrodo reversível de hidrogênio (RHE), o único
produto da reação de redução são os íons OH- gerados através de uma série de
mecanismos. Esta geração de OH- pode alterar o pH próximo a superfície do
eletrodo, afetando assim a redução de O2. Gojkovic, Zecevic e Drazic (1994)
mostraram que a redução do O2 pode ser afetada em solução com pH > 11, pois a
partir deste valor as propriedades acido-base do filme passivo mudam e o Fe(OH)2 é
transformado em FeOOH- diminuindo a cinética de redução do O
2, já que um dos
sítios da reação é o Fe(II)ox e Fe(III)ox.
A redução de oxigênio também é afetada pela presença dos íons cloretos, pois estes se adsorvem sobre o ferro diminuindo assim a interação das moléculas de O2 na superfície do eletrodo (LI et al., 2010). Porém, em soluções não tamponadas e
com pH < 10, as variações de pH e a presença dos íons cloretos não afetam a corrente catódica (MIYATA; ASAKURA, 2002, p. 589). Cáceres, Vargas e Herrera (2009) observaram nas curvas de polarização com baixa concentração dos íons cloretos (0,02 – 0,1 mol L-1) um aumento inicial da taxa de corrosão conforme o aumento do tamanho dos pites. Após cerca de 3 horas, a taxa atinge um máximo e começa a diminuir devido à formação de um filme de óxidos cobrindo a superfície e dificultando a difusão do oxigênio.
o pH da solução (VELA; VILCHE; ARVIA, 1986; LI; CAI; LUO, 2004; DÍEZ-PÉREZ et al., 2001; SHIMUKI et al., 1996; RUBM, 1993). A solução tampão estabiliza rapidamente a superfície do ferro devido à formação de um filme fino e compacto de óxidos/hidróxidos (DÍEZ-PÉREZ et al., 2001).
Díez-Pérez et al. (2001) estudaram o crescimento do filme de hidróxidos e óxidos no eletrodo de ferro imerso nas soluções tampão borato de pH 7,5 e 8,4 por voltametria cíclica (Figura 9). Neste voltamograma, o pico I está relacionado com a dissolução do ferro por meio das reações 9 e 10:
Figura 9 – Voltamograma cíclico do eletrodo de ferro imerso nas soluções tampão borato de pH 7,5 (linha contínua) e 8,4 (linha pontilhada). v = 5 mV s-1.
Fonte: Díez-Pérez et al. (2001)
Fe0
(s) Fe2+ + 2e- (9)
Fe0
(s) + 2OH-(aq) Fe(OH)2(s) + 2e- (10)
Fe2+
(aq) + 3OH-(aq) Fe(OH)3(s) + 1e- (11)
O pico IIb e sua redução associada (pico IIb`) correspondem à oxidação dos óxidos/hidróxidos de ferro (II) formados no primeiro estágio de passivação, para um filme de óxidos de ferro (II) e ferro (III) como descrito na reação 12:
5FeO(s) + 2H2O Fe3O4/Fe2O3(s) + 4H+ + 4e- (12)
A composição final do filme de óxidos de ferro na região III contém principalmente íons Fe3+ com cerca de 7% de Fe2+ dependendo do potencial
aplicado. Díez-Pérez et al. (2001) apresentaram também um modelo esquemático do crescimento do filme de hidróxidos de ferro (II) com o potencial aplicado (Figura 10). Nota-se que na Figura 10a a superfície do eletrodo é livre de óxidos e hidróxidos de ferro, esta observação já havia sido comprovada por Jovancicevic et al. (1987) que comprovaram que para a redução completa dos óxidos/hidróxidos de ferro para Fe0 é necessário aplicar um potencial catódico em torno de -0,97 V numa
Figura 10 – Esquema do crescimento do filme de hidróxidos de ferro (II) com o potencial aplicado versus Ag|AgCl|KClsat..
2.4. Eletrodo de W/WOx para medida de pH local.
Na literatura (VONAU; GUTH, 2006, p. 746) encontra-se vários sensores de pH preparados para medir as variações da concentração hidrogeniônica, muitas vezes localizadas em microambientes, utilizando fios ou nanofios de metais/óxidos metálicos ou não metais com seus respectivos óxidos. Dentre os metais o que tem sido mais utilizado é o tungstênio/óxido de tungstênio. O eletrodo de tungstênio/óxido de tunsgstênio se comporta conforme a equação de Nernst no intervalo de pH 2-11 (WAKKAD; RIZK; EBAID, 1955; LUO; LU; IVES, 1992; TADA; SUWARA; KANEKO, 2004; PASTI; LAZAREVIC-PASTI; MENTUS, 2012).
Os eletrodos de óxido de tungstênio podem ser preparados a partir da oxidação do fio de tungstênio ao ar em temperaturas elevadas, por oxidação em ácido nítrico, por anodização a potencial ou corrente controlada, ou por varredura potenciodinâmica, etc. O óxido de tungstênio formado sobre o próprio tungstênio ou sobre outro substrato metálico é montado em microcapilares de vidro ou empregado diretamente na forma em que foi preparado para ser utilizado de forma fixa.
Os diagramas do potencial do eletrodo de W/WOx e o pH foi proposto por
Pourbaix (1974, p.406), que apresentou os potenciais e as reações de equilíbrio para o tungstênio e seus óxidos:
W + 2H2O WO2 + 4H+ + 4e- (13)
EWO2 / W = -0,119 – 0,0591 pH (14)
2WO2 + H2O W2O5 + 2H+ + 2e- (15)
E W2O5/ WO2 = -0,031 -0,0591 pH (16)
W2O5 + H2O 2WO3 + 2H+ + 2e- (17)
EWO3/ W2O5 = -0,029 -0,0591 pH (18)
A preparação do eletrodo W/WOx é uma etapa importante na obtenção da linearidade do potencial com o pH. Pašti et al. (2012) estudaram a linearidade desse eletrodo preparando de 4 diferentes formas de crescimento dos óxidos e concluíram que os óxidos obtidos por meio da voltametria cíclica forneceram os melhores resultados. O eletrodo preparado por varredura potenciodinâmica para o crescimento do óxido de tungstênio produziu o eletrodo mais estável com resposta linear no intervalo de pH 3-10. O pré-tratamento realizado com varredura de potencial no eletrodo de W/WOx foi aplicado com bons resultados (TORRESI et al.,
3. OBJETIVOS
Estudar a eficiência de compostos inibidores voláteis de corrosão (VCI) empregando técnicas eletroquímicas convencionais como curvas de polarização (CP) e impedância eletroquímica (EIS) e comparar com alguns resultados de câmara úmida da literatura.
Específicos
- Desenvolver ou adaptar metodologias em testes eletroquímicos convencionais a corrosão do aço CFF em meio de cloretos e VCIs capazes de reproduzir as condições de armazenamento e transporte das peças na presença do VCI;
- Estudar o efeito dos sobrepotenciais catódico e anódico no valor do pH local próximo à superfície da amostra e também na determinação dos parâmetros eletroquímicos.
4. PROCEDIMENTO EXPERIMENTAL
Os estudos eletroquímicos foram feitos numa chapa fina de aço laminada a frio (CFF) de 2x2 cm2 com a composição: C: 0,0043; Mn: 0,31; S: 0,017; Si: 0,015 e
Al: 0,006 % m/m. As chapas foram polidas com lixas 600 e 1200, seguida de limpeza no ultrassom com isopropanol durante 5 minutos.
As medidas eletroquímica foram feitas numa célula de vidro com tampa de PTFE e na base continha um anel de Viton, expondo uma área à solução de 1 cm2.
Todas as medidas foram relacionadas com esta área geométrica. Como eletrodo auxiliar foi usado uma rede de platina de grande área soldada em vidro. Os potenciais foram medidos em relação ao eletrodo de referência de Ag/AgCl/KClsat
inserido num capilar de Luggin.
O valor do pH da solução próximo à superfície (cerca de 2 mm) da placa de aço (pH local) foi obtido a partir da medida do potencial do eletrodo W/WOx (Alfa
Aesar, 99,99%) versus Ag/AgCl/KClsat.. O eletrodo de W/WOx foi preparado a partir
de um disco de tungstênio de 0,25 mm soldado em tubo de vidro de 5 mm, polido com lixa 1200, seguido de 100 ciclos de anodização potenciodinâmica entre -0,5 V a 1,2 V (Ag/AgCl/KClsat.) a 50 mV s-1, em H2SO4 0,5 mol L-1 (PASTI;
LAZAREVIC-PASTI; MENTUS, 2012).
As soluções empregadas na obtenção da curva de pH versus potencial do
eletrodo de W/WOx foram: H3BO3 ajustado com HCl (pH 3,4); H3BO3 (pH 4,8); NaCl
0,1 mol L-1 (pH 6,3); H
3BO3 + Na2B4O7 (pH 6,9 e pH 8,4); Na2B4O7 (pH 9,2) e
Na2B4O7 ajustado com NaOH (pH 11,0 e pH 12,7). Todas as soluções continham
NaCl 0,1 mol L-1. O eletrodo de W/WOx foi calibrado antes de cada medida de pH
local.
As curvas de polarização foram obtidas em soluções aquosas de NaCl 0,1 mol L-1 (pH 6,3) ou H3BO3 0,35 mol L-1 + Na2B4O7 0,0375 mol L-1 (Tampão Borato -
TB) + NaCl 0,1 mol L-1 (pH 6,7). Antes das medidas das curvas de polarização foi registrado o potencial de circuito aberto (ECA) durante 60 min. Nas curvas de
polarização foram aplicados diferentes sobrepotenciais iniciais (ηcat) variando entre
-0,05 V; -0,1 V; -0,2 V; -0,3 V; -0,4 V e -0,5 V vs. ECA até +0,4 V(ηfinal) vs.ECA a 0,17
mV s-1. Nas curvas de polarização com medidas de pH local foram empregados 2
O ferro dissolvido durante as curvas de polarização foi analisado por espectrometria de absorção atômica. A concentração dos íons Fe(II) foi determinado, coletando 0,5 ml de solução próximo à superfície do eletrodo nos potenciais de: -0,85; -0,72; -0,60; -0,40; -0,29 e -0,10 V vs. Ag/AgCl/KClsat..
Os VCIs utilizados foram etanolamina (ETA), ciclohexilamina (CHA), diciclohexilamina (DCHA), ácido caprílico (H-CAP), caprilato de etanolamina (ETA-CAP), caprilato de ciclohexilamina (CHA-CAP) e caprilato de diciclohexilamina (DCHA-CAP). A procedência dos reagentes foram todas da Sigma Aldrich de qualidade P.A. Os sais foram preparados pela reação do ácido caprílico (H-CAP) com etanolamina (ETA), Ciclohexilamina (CHA) ou Diciclohexilamina (DCHA), na proporção 1:1 dissolvidos em etanol à temperatura ambiente e secos a 50°C.
A concentração da maioria dos inibidores nas soluções de NaCl e TB + NaCl foi de 0,020 mol L-1 e 0,100 mol L-1. Contudo, nestas soluções a diciclohexilamina
(DCHA) e o ácido caprílico (H-CAP) não se dissolvem em concentrações maiores que cerca de 0,005 mol L-1. Em concentrações maiores as soluções ficam turvas. A
dissolução dos inibidores na solução de NaCl altera o valor do pH da solução, isto é, aumenta na etanolamina (ETA), ciclohexilamina (CHA) e diciclohexilamina (DCHA) e diminui na solução de H-CAP. A dissolução dos inibidores na solução tampão (TB) também altera o pH da solução, mas o pH foi ajustado com ácido bórico ou hidróxido de sódio até o valor de pH 6,7.
As curvas de polarização e os espectros de impedância eletroquímica foram obtidos num potenciostato EG&G \ PAR 283 e FRA Solartron 1255 controlado pelo programa PowerSuite (medidas de circuito aberto e curvas de polarização) e M398 (EIS), ambos da EG&G PAR. Os valores de potencial para determinação do pH local foram medidos num multímetro digital HP 34401A com impedância de entrada > 1010.
As medidas no modo ZRA (zero resistance ammeter) dos valores de corrente com resistência nula e potencial de circuito aberto simultaneamente foram feitos no potenciostato EG&G\PAR com o programa PowerSuite. Nesta medida, foi empregado como referência, um eletrodo de Ag/AgCl/KClsat. e a medida de corrente
foi feita entre os eletrodos de trabalhos e o terra do potenciostato conectado no eletrodo de disco de Pt com diâmetro de 1 mm .
impedância eletroquímica aplicando uma amplitude senoidal de 10 mV (rms) sobre o valor de ECA, partindo de 100 kHz a 10 mHz com 10 pontos por década de
frequência. Os dados de impedância eletroquímica (EIS - Electrochemical Impedance Spectroscopy) foram tratados com o programa BOUKAMP (1989). A representação dos diagramas foram plotados de diferentes maneiras: A) Nyquist:
Zreal = f (–Zimag), B) Admitância: Yreal = f (Yimag), C) Bode: módulo da impedância
imaginária (|Zimag|) = f (log f), D) Bode: módulo da impedância (|Z|) = f (log f) e E)
Bode: ângulo de fase = f (log f); (c) A polarização linear (PL) foi realizada aplicando-se um sobrepotencial de -15 a +15 mV/ECA, a 0,17 mV s-1; (d) Polarização cíclica
potenciodinâmica (CPP - Cyclic Potentiodynamic Polarization) com aplicação de ηcat
= -0,1 V e velocidade de 0,17 mV s-1 até a densidade de corrente anódica atingir 5
mA cm-2, quando o sentido da varredura foi invertido até chegar ao valor do potencial inicial.
Em todas as medidas realizadas em solução tampão (pH 6,7) foi feito um pré-tratamento aplicando um potencial de -0,9 V (Ag/AgCl/KClsat.) para a remoção dos
5. RESULTADOS E DISCUSSÃO
5.1. Efeito do sobrepotencial catódico
A Figura 11A mostra que o potencial do eletrodo W/WOx medido em
diferentes soluções cujos valores de pH estabilizam em torno de 16 min. Na solução de pH 6,3, o potencial foi de -0,2 V vs. Ag|AgCl|KClsat. 3 mol L-1, próximo do valor da
literatura (TADA; SUWARA; KANEKO, 2004). A curva de padronização (Figura 11B) do eletrodo W/WOx mostra uma relação linear do potencial com o pH para 3,4 pH
12,7. Este comportamento permaneceu praticamente constante durante todas as medidas de pH local, inclusive com adição de inibidores.
O potencial de circuito aberto (ECA) do eletrodo de aço (Figura 12A) logo após
a imersão em NaCl 0,1 mol L-1 (pH 6,3) começa em torno de -0,65 V e decresce para cerca de -0,68 V. A Figura 12B mostra que o pH local aumenta até um valor aproximado de 10,5. Isto indica que o cloreto ataca a superfície do aço contendo um filme inicial de óxidos/hidróxidos, e, posteriormente, forma um filme poroso de hidróxidos e cloretos que expõe a superfície do aço, diminuindo o potencial do eletrodo. Na solução TB + NaCl 0,1 mol L-1 (pH 6,7), foi medido um pH local = 6,5 e
Figura 11 – (A) Variação do potencial do eletrodo de W/WOx em soluções com
diferentes valores de pH contendo 0,1 mol L-1 NaCl e (B) Padronização do potencial vs. pH.
0
4
8
12
16
-0.6
-0.4
-0.2
0.0
A)
t / min
E W / W Ox / V v s . A g|A gC l| K C l 3 m ol L -1 3,4 4,8 6,3 6,9 8,4 9,2 11,0 12,7
pH
3
6
9
12
-0.60
-0.45
-0.30
-0.15
0.00
E
W / WO x/ V
vs.
A
g|A
gCl
| K
Cl
3 m
ol
L
-1pH
E
W / WOx= 0,029 V- 0,045pH
r
2=0,9970
B)
Figura 12 – (A) ECA do eletrodo de aço em NaCl 0,1 mol L-1 (pH 6,3) e TB + NaCl
0,1 mol L-1 (pH 6,7) e (B) Variação do pH local durante a medida do E
CA.
0 15 30 45 60
-0.700 -0.675 -0.650 -0.625 -0.600
E
/ V
vs.
Ag|Ag
Cl
| KCl 3 mol
L
-1
NaCl 0,1 mol L-1 (pH 6,3) TB + NaCl 0,1 mol L-1 (pH 6,7)
t / min
A)
X Axis Title
0 15 30 45 60
0 2 4 6 8 10 12 14
NaCl 0,1 mol L-1 (pH 6,3) TB + NaCl 0,1 mol L-1 (pH 6,7)
pH lo
ca
l
t / min
B)
0 2 4 6 8 10
Fonte: Autor (2014)
De acordo com Kim e Pyun (1996, p. 1093), na superfície do ferro ocorre adsorção da água formando um filme de FeOH(ad) (equações de 19 a 23).
Fe0 + H2O ↔ Fe.H2O(ad) (19)
Fe.H2O(ad) ↔ Fe.OH(ad) + H+ + e- (20)
ou
Fe.H2O(ad) ↔ Fe.OH-(ad) + H+ (21)
e Fe.OH
-(ad) ↔ FeOH(ad) + e- (22)
Dependendo do sobrepotencial anódico e o pH da solução, a espécie FeOH(ad) pode
ser dissolvida na solução:
FeOH(ad)→ FeOH+(aq) + e- (23)
FeOH+(aq) + H+ → Fe2+ + H2O (23a)
ou crescimento do filme de óxidos (AMARAL; MARTINI; MULLER, 2001):
Fe(OH)(ad) + OH-(aq) ↔ Fe(OH)2 + e- (24)
e
3Fe(OH)2 → Fe3O4 + 2H2O + 2H+ + 2e- (25)
Contudo, na presença de cloretos, este compete com a água e íons OH- e se
adsorve na superfície do ferro formando FeCl(ad), levando à espécies solúveis de
FeCl+
(aq) (equações 26 e 27).
Fe0 + Cl- ↔ FeCl(ad) + e- (26)
e
FeCl(ad) ↔ FeCl+(aq) + e- (27)
MacFarlane e Smedley (1986, p. 2240) admitiram que para baixos sobrepotenciais, a velocidade de dissolução do ferro é acelerada pelos íons cloreto e hidróxidos com um coeficiente de Tafel de 0,075 V / déc, conforme o mecanismo:
Fe.H2O + Cl- = [FeClOH]-(ad) + H+ + e- (28)
[FeClOH]
-(ad) FeClOH + e- (29)
FeClOH + H+ Fe2+ + Cl- + H
Aplicando elevados sobrepotenciais, a velocidade depende dos íons hidroxilas e o valor do coeficiente de Tafel diminui para 0,040 V / déc. Neste caso, o mecanismo predominante é o mesmo encontrado nas reações 20 a 25.
A Figura 13A mostra as curvas de polarização do aço em NaCl 0,1 mol L-1
aplicando diferentes sobrepotenciais catódicos iniciais (cat,). O processo de redução
do oxigênio é termodinamicamente favorecido nos potenciais próximos ao de corrosão do aço e, portanto, nessas soluções o coeficiente de Tafel catódico deve estar relacionado com a redução de oxigênio em meio aquoso. A formação de OH -(equações 5 e 6) próximo à superfície do eletrodo eleva os valores de pH e por isso, nestas curvas observa-se que o aumento do valor de cat, até -0,50 V desloca o
potencial de corrosão para valores mais negativos em relação ao potencial de circuito aberto. No entanto, as curvas de polarização não dependem tanto do cat inicial para a solução tampão (Figura 13B). Isso indica que na solução tampão não há alterações significativas nos valores de pH local, concordando com a evolução do
ECA com o tempo (Figura 12A).
O deslocamento do ECorr (Figura 13A) pode ser causado pela remoção do
filme de óxidos/hidróxidos durante a varredura de potenciais na região de sobrepotenciais negativos (JOVANCICEVIC et al., 1987) e também devido à geração de bolhas de H2, proveniente da reação de redução da água que
contribuem para o destacamento do filme. Além disso, aplicando cat de -0,5 a -0,4 V verifica-se também que a corrente anódica não aumenta conforme o potencial aplicado, chegando a diminuir para cat, de -0,50 V. Isso sugere a formação de um
Figura 13 – Curvas de polarização do aço, aplicando diferentes sobrepotenciais iniciais. v = 0,17 mV s-1.A) NaCl 0,1 mol L-1 (pH 6,3) e B) TB + NaCl 0,1 mol L-1 (pH
6,7).
-1.25
-1.00
-0.75
-0.50
-0.25
-8
-7
-6
-5
-4
-3
lo
g ( i /
A cm
-2
)
E / V
cat.
-0,050 V
-0,100 V
-0,200 V
-0,300 V
-0,400 V
-0,500 V
A)
-1.25
-1.00
-0.75
-0.50
-0.25
-8
-7
-6
-5
-4
-3
lo
g (i /
A
cm
-2
)
E / V
cát.-0,050 V
-0,100 V
-0,200 V
-0,300 V
-0,400 V
-0,500 V
B)
0 2 4 6 8 10
Na Figura 13B observa-se entre os sobrepotenciais catódicos (cat) de -0,05 a
-0,50 V que as curvas de polarização são praticamente constantes, ao contrário do observado em NaCl 0,1 mol L-1 cujas curvas se deslocam para valores mais
negativos com o aumento do sobrepotencial catódico. Para a solução tampão borato, este fato deve estar relacionado com o efeito tampão que neutraliza os íons OH- formados durante a descarga da água ou redução de oxigênio.
A Figura 14A mostra a variação do pH local com o potencial partindo de diferentes valores de sobrepotencial catódicos. Com o aumento do sobrepotencial catódico se observa que o pH local da solução de NaCl 0,1 mol L-1 aumenta bastante devido à geração de hidroxilas nas adjacências da superfície do aço. A dissolução do aço na presença de hidroxilas causa o crescimento de filmes de hidróxidos-cloretos de ferro que precipitam causando o bloqueio parcial da superfície do eletrodo. Entretanto, na solução tampão ocorreu um pequeno aumento no valor do pH local de 8 para 9, quando cat variou de -0,40 V para -0,50 V. Isto significa que a solução tampão não consegue manter o pH local aplicando elevados sobrepotenciais catódicos.
Na Figura 14A observa-se para o aço em NaCl 0,1 mol L-1 que na varredura
Figura 14 – Variação do pH local do eletrodo de aço durante as curvas de polarização aplicando diferentes sobrepotenciais iniciais. A) NaCl 0,1 mol L-1 (pH
6,3) e B) TB + NaCl 0,1 mol L-1 (pH 6,7).
-1.25
0
-1.00
-0.75
-0.50
-0.25
2
4
6
8
10
12
14
pH lo
ca
l
E / V
cat.-0,050 V
-0,100 V
-0,200 V
-0,300 V
-0,400 V
-0,500 V
A)
-1.25
0
-1.00
-0.75
-0.50
-0.25
2
4
6
8
10
12
14
pH
loca
l
E / V
cát.-0,050 V
-0,100 V
-0,200 V
-0,300 V
-0,400 V
-0,500 V
B)
Figura 15 – Variação do pH local e concentração do ferro próximo a superfície do aço, medido durante a curva de polarização do aço em solução de NaCl 0,1 mol L-1.
-0.90
0
-0.75
-0.60
-0.45
-0.30
2
4
6
8
10
12
14
pH
lo
ca
l
E / V
vs.
Ag|AgCl| KCl 3 mol L
-1pH local
0
100
200
300
400
[Fe]
C
on
ce
ntr
aç
ão
/ m
g L
-1
Fonte: Autor (2014)
Na Tabela 4 observa-se os parâmetros cinéticos obtidos das curvas de polarização para o eletrodo de aço para as soluções de NaCl e TB. Nesta Tabela, os coeficientes de Tafel anódicos (βa) para o aço em NaCl 0,1 mol L-1, variaram entre
0,06 a 0,07 V dec-1 quando os valores de
cat aplicados foram de -0,05 a -0,2 V.
Entretanto, aumentando os valores de cat, para -0,30, -0,40 e -0,50 V não foi possível obter o βa devido à formação de um filme de hidróxidos de ferro na
superfície, cuja natureza varia com o aumento do sobrepotencial catódico inicial, dificultando a determinação deste parâmetro. Um potencial mais negativo inicial deve reduzir o filme de óxido formado naturalmente e, portanto, gerando mais hidroxilas pela redução da água, o que facilita a formação do filme de óxidos/hidróxidos no ramo anódico, alterando o coeficiente de Tafel anódico. Neste caso, as extrapolações de Tafel para obtenção dos parâmetros foram feitos somente a partir da extrapolação do ramo catódico.
catódicos (c) de -0,12 a -0,59 V déc-1. A variação no coeficiente de Tafel catódico pode estar associada principalmente ao transporte e redução de oxigênio em meio aquoso (JOVANCICEVIC; BOCKIRS, 1986, p. 1797) sobre o filme de óxido/hidróxido contendo cloretos cuja natureza está variando conforme sobrepotencial catódico inicial aplicado, o que levaria a um aumento do coeficiente de Tafel catódico.
Em geral, os mecanismos de redução de oxigênio sobre superfícies passivas de ferro sugerem a formação de peróxido (redução via formação de H2O2) com
coeficiente de Tafel catódico próximo a 0,08 V dec-1 (GOJKOVIC; ZECEVIC; DRAZIC, 1994). A taxa de redução do oxigênio é maior em superfícies passivadas do que na livre de óxidos (JOVANCICEVIC; BOCKIRS, 1986, p. 1797). Para soluções contendo cloretos, o coeficiente de Tafel catódico é em torno de 0,13 V dec-1 (MIYATA; ASAKURA, 2002, p. 589). Entre
cat. = -0,30 e -0,50 V, ocorre a
redução do óxido, além da redução da água (equação 5) com geração de OH
-causando a formação de uma camada de hidróxidos e cloretos, além da geração de bolhas de H2 que diminui a solubilidade local de oxigênio resultando num valor de c
mais elevado (> 0,40 V déc-1) devido à lenta difusão do oxigênio até a superfície do
Tabela 4 – Parâmetros das curvas de polarização do aço iniciando em diferentes sobrepotenciais catódicos. A) NaCl 0,1 mol L-1
(pH 6,3) e B) TB + NaCl 0,1 mol L-1 (pH 6,7) .
ηcat
-0,05 V -0,10 V -0,20 V -0,30 V -0,40 V -0,50 V
A) NaCl 0,1 mol L-1 (pH 6,3)
ECA / V -0,68 -0,67 -0,67 -0,68 -0,68 -0,67
ECorr / V -0,68 -0,68 -0,68 -0,76 -0,80 -0,84
iCorr / µA cm-2 9 9 4 7 10 13
βa / V dec-1 0,06 0,07 0,06 ---- ---- ----
βc / V dec-1 -0,12 -0,20 -0,18 -0,27 -0,38 -0,59
B) TB + NaCl 0,1 mol L-1 (pH 6,7)
ECA / V -0,68 -0,68 -0,68 -0,68 -0,68 -0,68
ECorr / V -0,68 -0,68 -0,68 -0,70 -0,71 -0,71
iCorr / µA cm-2 10 17 15 7 7 10
βa / V dec-1 0,08 0,11 0,11 0,10 0,10 0,11
βc / V dec-1 -0,08 -0,15 -0,14 -0,11 -0,13 -0,13
Na solução tampão, os coeficientes de Tafel anódico para o eletrodo de aço variam pouco com o sobrepotencial catódico inicial aplicado e o valor médio de a = 0,10 0,01 V dec-1. Nesta solução tampão, a produção de hidroxilas durante a descarga da água é neutralizada pelo efeito tampão da solução e, com isso não influencia significativamente nos parâmetros das curvas de Tafel. O processo catódico que ocorre próximo ao potencial de corrosão deve ser preponderantemente devido à redução de oxigênio sobre uma superfície de ferro com uma camada fina de hidróxidos. A Figura 16 mostra que na solução tampão contendo cloretos existe uma pequena variação nos valores de c com o sobrepotencial catódico cujo valor médio nos coeficientes de Tafel catódico foi de c = -0,13 0,02 V dec-1. Estes
valores concordam com o da literatura (LI et al, 2010).
Figura 16 – Variação do cobtidos aplicando-se diferentes sobrepotenciais iniciais.
0.0
0.1
0.2
0.3
0.4
0.5
0.00
0.15
0.30
0.45
0.60
NaCl 0,1 mol L
-1(pH 6,3)
TB + NaCl 0,1 mol L
-1(pH 6,7)
c/ V
déc
-1
-
cat./ V
Fonte: Autor (2014)
A Figura 17 mostra o comportamento da corrente de corrosão (iCorr) do aço
imerso na soluções de NaCl 0,1 mol L-1 e TB + NaCl 0,1 mol L-1. Na solução de
-0,20 V foi menor que a medida em TB + NaCl devido à formação em circuito aberto de um filme de hidróxidos/cloretos de ferro pelo ataque dos cloretos e redução do oxigênio dissolvido na água gerando hidroxilas (equação 6). Na solução tampão, a espessura do filme de óxidos/hidróxidos na superfície do aço será menor devido ao pequeno aumento do pH local, diminuindo a formação das hidroxilas. Devido a este fato, a superfície do aço estará mais exposta ao ataque dos cloretos, causando aumento na corrente. Aumentando os sobrepotenciais catódicos para -0,30 a -0.50 V, na solução de NaCl, a maior geração de H2 pode levar ao destacamento do filme
de hidróxidos facilitando o ataque do cloreto na superfície do aço, causando aumento da corrente. Neste mesmo intervalo de elevados sobrepotenciais catódicos na solução tampão, a diminuição da corrente é causada pela formação de um filme de hidróxidos gerados pelo excesso de íons OH- formados na redução da água e que ultrapassam a capacidade da solução tampão.
Figura 17 – Variação da iCorrobtidos aplicando-se diferentes sobrepotenciais iniciais.
0.0
0.1
0.2
0.3
0.4
0.5
4
8
12
16
20
NaCl 0.100 M (pH 6.3)
TB + NaCl 0.100 M (pH 6.7)
i
Corr
/
A
cm
-2
cat./ V
Na Figura 18 verifica-se que os valores da diferença ECA- ECorr obtidos das
curvas de polarização do aço em solução tampão são praticamente constantes até o sobrepotencial inicial de -0,20 V e depois aumentam em cerca 0,030 V aplicando sobrepotencial catódico de -0,50 V. Na solução de NaCl 0,1 mol L-1, a variação de ECA - ECorr aumenta bastante a partir do sobrepotencial catódico de -0,30 V
chegando a uma diferença de 0,170 V em cat = -0,50 V. Aplicando sobrepotenciais bastante elevados na região da redução catódica da água, a geração de grande quantidade de bolhas de hidrogênio, remove o filme de hidróxidos e expõe a superfície ao ataque dos cloretos levando o potencial de corrosão para valores mais negativos.
Figura 18 – Variação da diferença entre os potencias de circuito aberto e de corrosão (ECA – ECorr) em função do sobrepotencial catódico inicial
0.0
0.1
0.2
0.3
0.4
0.5
0
40
80
120
160
200
E
CA-E
Cor
r