PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS
TESE DE DOUTORADO
Síntese de catalisadores do tipo LaNi
xFe
1-xO
3como precursores
catalíticos
para reação oxidação parcial do metano
Daniele de Macedo Henrique Martinelli
Orientadora: Profa. Dra. Dulce Maria de Araújo Melo
Tese N.º 90/PPGCEM
DANIELE DE MACEDO HENRIQUE MARTINELLI
Síntese de catalisadores do tipo LaNi
xFe
1-xO
3como precursores
catalíticos
para reação oxidação parcial do metano
Tese apresentada ao Programa de Pós-graduação em Ciência e Engenharia de Materiais da Universidade Federal do Rio Grande do Norte como parte dos requisitos para a obtenção do título de doutora em Ciência e Engenharia de Materiais.
Orientadora: Profa. Dra. Dulce Maria de Araújo Melo
Fevereiro de 2011
Seção de Informação e Referência
Catalogação da Publicação na Fonte. UFRN / Biblioteca Central Zila Mamede
Martinelli, Daniele de Macedo Henrique.
Síntese de catalisadores do tipo LaNixFe1-xO3 como precursores catalíticos para reação oxidação parcial do metano / Daniele de Macedo Henrique Martinelli. – Natal, RN, 2011.
113 f. : il.
Orientadora: Dulce Maria de Araújo Melo.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Tecnologia. Programa de Pós-Graduação em Ciência e Engenharia de Materiais.
À Professora Dulce Maria de Araújo Melo, pela sua orientação, por toda
ajuda, não só profissional como pessoal, pela confiança que sempre teve em mim,
AGRADECIMENTOS
A Deus por sempre olhar para mim.
A minha filha por ter me dado razão para viver e procurar ser sempre feliz
A meu esposo Martinelli por todo amor e paciência
A minha família, pelo amor, carinho, compreensão, incentivo e
ensinamentos.
A ANP – PRH-30 pelo apoio financeiro.
Ao programa de pós-graduação em ciência e Engenharia de materiais.
Aos amigos de laboratório: Patrícia Pimentel, Júlio, Bruno, Priscilla,
Kellyanny, Auristela, Renata, Danilo, Diego, Gabi, Maria Luiza, Rodrigo
Melo pela ajuda direta ou indireta em meu trabalho, pela amizade, pelos
momentos de luta e descontração que tivemos durante estes anos.
Agradecimento especial: À João Ribeiro pela grande ajuda durante toda a
realização deste trabalho, principalmente durante a minha gravidez; À
Rodrigo Santiago pelas análises de TG e disponibilidade de tempo,
mesmo sem tê-lo e principalmente à Felipe Oliveira, pela imensa ajuda
nesta reta final do meu trabalho.
Ao CTGAS-ER pelas análises de TPR e pelas reações de oxidação parcial
do metano, em especial a Cláudio e Juan, por toda ajuda
A minha avó por ser tão especial.
RESUMO
Catalisadores a base de níquel têm sido empregados em diversos tipos de reações de reforma, inclusive na oxidação parcial do metano para obtenção de H2 ou gás de
síntese (H2 + CO). Normalmente, altos níveis de conversão são obtidos por estes
catalisadores, entretanto, a desativação por deposição de carbono ainda é um problema a ser solucionado. Diversas abordagens têm sido empregadas no intuito de minimizar este problema, dentre as quais tem se destacado nos últimos anos a utilização de óxidos com estrutura perovisquita e/ou estruturas relacionadas. Paralelamente, o uso de metodologias de sínteses mais rápidas, fáceis, aplicáveis em escala industrial e que permitam o controle das características microestruturais destes catalisadores, pode em conjunto, prover a solução para este problema.
A nível de comparação perovisquitas do tipo LaNixFe1-xO3 (x=0, x=0,3 e x=0,7) foram
preparados por dois métodos: precursores poliméricos (pechini) e autocombustão assistida por microondas. Todas as amostras foram calcinadas a 900 °C/4h para obtenção das fases desejadas. Os pós-obtidos foram caracterizados por análise termogravimétrica, espectroscopia na região do infravermelho, difração de raios-X, medidas de área superficial especifica, redução à temperatura programada.
As amostras calcinadas foram testadas na reação de oxidação parcial do metano, sendo avaliados os respectivos níveis de conversão, seletividade e a resistência à deposição de carbono. Após calcinação a fase desejada foi obtida para todas as amostras independente do método de síntese, sugerindo claramente a formação de pós cristalinos. De acordo com o resultados obtidos pelo refinamento Rietveld, observou-se a formação de 70,0% de LaNi0,3Fe0,7O3 e 30,0 % de La2O3 para as
amostras LN3F7-900-P e LN3F7-900-M e 41,6% de LaNi0.7Fe0.3O3; 30,7% de
La2NiO4 e 27,7 % de La2O3 para as amostras LN7F3-900-P e LN7F3-900-M. Os
perfis de redução à temperatura programada da amostra LaNiO3 apresentou pico de
redução em torno de 510 °C, já a amostra LaFeO3 apresentou pico de redução
acima de 1000°C. Dentre os catalisadores estudados o que apresentou maior nível de conversão de metano foi LaNiO3 obtido pelo método pechini, de uma maneira
geral os catalisadores obtidos pelo método pechini apresentaram melhores resultados de conversão que os catalisadores obtidos pela autocombustão assistida por microondas.
ABSTRACT
Nickel-bases catalysts have been used in several reform reactions, such as in the
partial oxidation of methane to obtain H2 or syngas (H2 + CO). High levels of
conversion are usually obtained using this family of catalysts, however, their
deactivation resulting from carbon deposition still remains a challenge. Different
approaches have been tested aiming at minimizing this difficulty, including the
production of perovskites and related structures using modern synthesis methods
capable of producing low cost materials with controlled microstructural characteristics
at industrial scale. To establish grounds for comparison, in the present study
LaNixFe1-xO3 (x=0, 0.3 or 0.7) perovskites were prepared following the Pechini
method and by microwave assisted self-combustion. All samples were sub sequently
calcined at 900 °C to obtain the target phase. The resulting ceramic powders were
characterized by thermogravimetric analysis, infrared spectroscopy, X ray diffraction,
specific area and temperature programmed reduction tests. Calcined samples were
also used in the partial oxidation reaction of methane to evaluate the level of
conversion, selectivity and carbon deposition. The results showed that the calcined
samples were crystalline and the target phase was formed regardless of the
synthesis method. According to results obtained by Rietveld refinement, we observed
the formation of 70.0% of LaNi0.3Fe0.7O3 and 30.0% of La2O3 for samples
LN3F7-900-P, LN3F7-900-M and 41,6% of LaNi0.7Fe0.3O3, 30.7% of La2NiO4 and 27.7% of La2O3
for samples LN7F3-900-P and LN7F3-900-M.Temperature-programmed profiles of
the LaNiO3 sample revealed the presence of a peak around 510 °C, whereas the
LaFeO3 sample depicted a peak above 1000°C. The highest l evel of methane
conversion was obtained for LaNiO3 synthesized by the Pechini method. Overall,
catalysts prepared by the Pechini method depicted better conversion levels
compared to those produced by microwave assisted self-combustion.
LISTA DE FIGURAS
Figura 2.1 Duas diferentes apresentações para a estrutura cúbica ideal da
Perovisquita...17
Figura 2.2 – Distorções (a) ortorrômbica e (b) romboédrica da estrutura perovisquita. ...20
Figura 2.3 – Série de Ruddlesden-Popper. (a) Para n =1 e (b) Para n = 2. ...29
Figura 2.4 – Reações envolvidas no método Pechini...35
Figura 2.5 – Infraestrutura do Hidrogênio para uso com fins energéticos. ...43
Figura 2.6 – Esquema de uma membrana cerâmica não porosa...54
Figura 3.1 - Esquema da linha reacional para oxidação parcial do metano. ...68
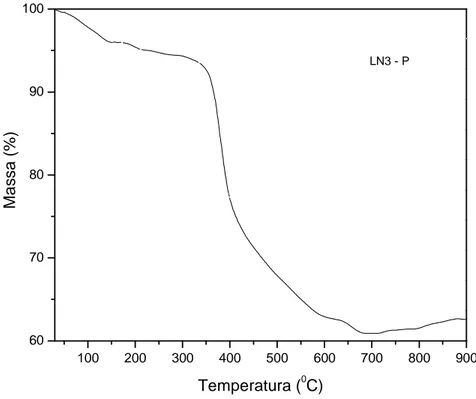
Figura 4.1– Curva TG do precursor catalítico LN3 – P...73
Figura 4.2 – Curva TG do precursor catalítico LN3-M...73
Figura 4.3 - Curva TG do precursor catalítico LF3-P...74
Figura 4.4 - Curva TG do precursor catalítico LF3-M ...75
Figura 4.5 - Curva TG do precursor catalítico LN7F3-P ...76
Figura 4.6 - Curva TG do precursor catalítico LN7F3-M ...76
Figura 4.7 - Curva TG do precursor catalítico LN3F7-P ...77
Figura 4.8 - Curvas TG e DTG do precursor catalítico LN3F7 – M ...78
Figura 4.9 – Difratograma de raios-X para as amostras (a) LF9 – P e (b) LF9 – M .79 Figura 4.10 – Difratograma de raios-X para as amostras (a) LN9 – P e (b) LN9-M .80 Figura 4.11 – Difratograma de raios-X para as amostras (a) LN7F3-900-P e (b) LN7F3-900-M ...81
Figura 4.12 – Difratograma de raios-X para as amostras (a) LN3F7-900-P e (b) LN3F7-900-M ...82
Figura 4.13 - Espectro de absorção na região do IV das amostras LN3-P e LN3-M.84 Figura 4.14 - Espectro de absorção na região do IV das amostras LF3-P e LF3-M..85
Figura 4.15 - Espectro de absorção na região do IV das amostras P e LN7F3-M ...86
Figura 4.16 - Espectro de absorção na região do IV das amostras P e LN3F7-M ...87
Figura 4.17-Perfil de redução por temperatura programada para a amostra LN9-P .90 Figura 4.18-Perfil de redução por temperatura programada para a amostra LN9-M.90 Figura 4.19-Perfil de redução por temperatura programada para as amostras (a) LF9 – P e (b) LF9 – M ...91
Figura 4.20-Perfil de redução por temperatura programada para as amostras (a) LN7F3–900-P e (b) LN7F3–900-M...92
Figura 4.21-Perfil de redução por temperatura programada para as amostras (a) LN3F7–900-P e (b) LN3F7–900-M...93
Figura 4.22 – Conversão do metano e seletividade para CO e CO2 usando o catalisador LN9-P...95
Figura 4.23 – Conversão do metano e seletividade para CO e CO2 usando o catalisador LN9-M ...96
Figura 4.24 – Razão entre H2 e CO utilizando o catalisador LN9...97
Figura 4.25 - Conversão do metano e seletividade para o H2, CO e CO2 utilizando o catalisador LN7F3-900-P ...98
Figura 4.27 - Razão entre H2 e CO utilizando os catalisadores LN7F3 – 900 – M e
LN7F3 – 900 – P. ...99 Figura 4.28 - Conversão do metano e seletividade para o H2, CO e CO2 utilizando o
catalisador LN3F7 – 900 – P ...100 Figura 4.29 - Conversão do metano e seletividade para o H2, CO e CO2 utilizando o
catalisador LN3F7 – 900-M ...102 Figura 4.30- Razão entre H2 e CO utilizando os catalisadores LN3F7 – 900 – M e
LN3F7 - 900-P...102 Figura 4.31 - Conversão do metano e seletividade para CO e CO2 utilizando o
LISTA DE TABELAS
Tabela 3.1- Reagentes utilizados na síntese dos óxidos. ...59 Tabela 3.2 – Quantidade de moles utilizados para a preparação dos catalisadores LaNiO3 LaFeO3 LaNi0,3Fe0,7O3 LaNi0,7Fe0,3O3...61
2 REVISÃO BIBLIOGRÁFICA ...16
2.1 Óxidos com estrutura perovisquita...16
2.1.1 Análises de transições entre várias estruturas perovisquitas ...18
2.1.2 Papel dos cátions na posição A e B ...21
2.1.3 Estruturas das perovisquitas não estequiométricas ...22
2.1.4 Composição superficial das perovisquitas...24
2.1.5 Adsorção de oxigênio nas perovisquitas ...25
2.1.6 Estabilidade das perovisquitas em atmosfera redutora ...26
2.1.7 Perovisquitas em camadas ...28
2.1.8 Emprego de Perovisquitas como Catalisador...30
2.2 Métodos de síntese...33
2.2.1 Método dos precursores poliméricos (Método Pechini)...34
2.2.2 Combustão microondas...36
2.2.3 Método sol-gel...40
2.2.4 Método da Co-precipitação ...41
2.3 Produção de H2 para fins Energéticos ...42
2.4 Conversão do Metano a Gás de Síntese ...44
2.5 Reações para Obtenção de Gás de Síntese...44
2.5.1 Reforma a Vapor do Metano ...44
2.5.2 Reforma a Seco do Metano...47
2.5.3 Oxidação Parcial do Metano ...49
2.5.4 Reforma autotérmica ...53
2.5.5 Reforma com membrana...53
2.6 Deposição do carbono ...55
3 PROCEDIMENTO EXPERIMENTAL...59
3.1 Reagentes utilizados...59
3.2 Preparação dos catalisadores...59
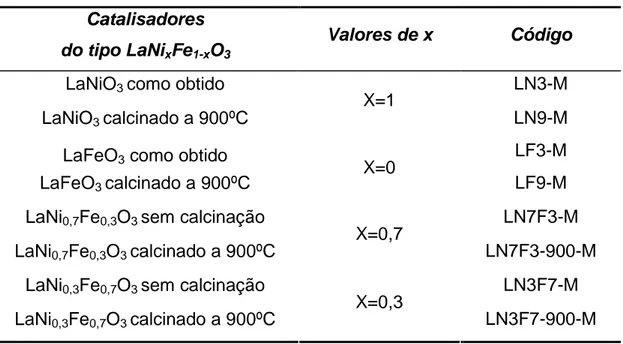
3.3 Codificação das amostras preparadas...62
3.4 Caracterização dos catalisadores ...63
3.4.1 Análise Termogravimétrica (ATG) ...63
3.4.2 Espectroscopia de absorção na região do infravermelho (IV) ...63
3.4.3 Difração de Raios-X (DRX) ...64
3.4.4 Área superficial específica (AS) ...65
3.4.5 Redução à temperatura programada (RTP) ...67
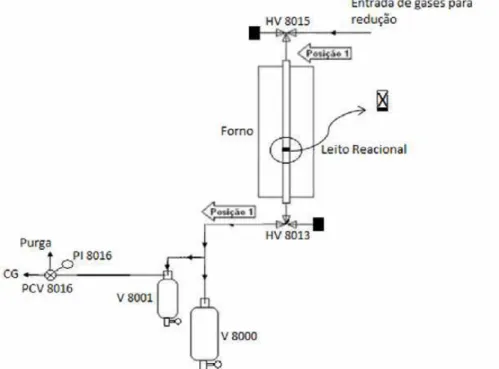
3.4.6 Ensaio Catalítico ...68
4 RESULTADOS E DISCUSSÕES ...72
4.1 Análise termogravimétrica...72
4.2 Difração de Raios-X ...78
4.3 Espectroscopia de absorção na região do infravermelho ...83
4.4 Área superficial específica ...88
4.5 Redução à temperatura programada (RTP)...89
4.6 Reação de oxidação parcial do metano ...94
1 INTRODUÇÃO E OBJETIVOS
O metano é o principal componente das reservas mundiais de gás
natural e quase todas as opções de transformações deste hidrocarboneto, envolvem
sua conversão inicial ao gás de síntese (mistura de CO e H2). Atualmente, o uso
principal do gás de síntese é para fabricação de amônia, metanol, síntese de
hidrocarbonetos via processos de síntese de Fischer-Tropsch, uso de hidrogênio
puro para indústrias petroquímicas e refinarias, na redução de minérios de ferro e
também, para alimentação direta de células a combustível para geração de energia
elétrica alternativa [TRIMM, D. L.,1997; TRIMM, D. L., 1999]
O principal processo industrial de produção de gás de síntese é a
reforma catalítica a vapor do metano. No entanto, este processo é altamente
endotérmico, utiliza reatores em que somente 40 % da energia fornecida é
consumida pela reação e sofre algumas limitações, como baixa seletividade para CO
e alta razão H2/CO. Além disso, as condições reacionais necessárias levam à
desativação do catalisador por deposição de carbono na superfície do mesmo. A
viabilidade econômica de processos como a síntese de Fischer- Tropsch, que
utilizam o H2 e o CO como matéria-prima, depende de rotas mais eficientes para a
obtenção do gás de síntese [Kohei Urasaki, 2005]. Sendo assim, rotas alternativas
têm sido estudadas, tais como: oxidação parcial catalítica do metano, reforma do
metano com CO2 e reforma autotérmica.
Por vários anos, muitos esforços foram direcionados para o
desenvolvimento de catalisadores que mostrassem alta atividade e que
apresentassem resistência à formação de depósitos de carbono. Diversos
catalisadores metálicos foram estudados. Metais nobres do grupo VIII-A, com
exceção do ósmio, e não nobres como Cu, Ni e Co, depositados em diferentes tipos
de suporte, têm sido estudados como catalisadores para a reforma do metano com
CO2 [Bradford, M. e Vannice, M.; 1996].
Dentre estes catalisadores, os metais nobres mostraram-se melhores
quando comparados ao Ni, pois este último se desativa rapidamente devido à
deposição de carbono. No entanto, o alto custo dos metais nobres torna atrativo o
desenvolvimento de catalisadores de Ni para utilização industrial e um dos desafios
consiste em torná-lo mais resistente à deposição de carbono. [LIMA, S. M. e ASSAF,
A adição de óxidos de metais alcalinos ou alcalinos terrosos e de
lantanídeos [CAO, L. e colaboradores, 1997], ou a utilização de espécies metálicas
altamente dispersas [BARTHOLOMEW, C. H.; 1982]sobre o suporte tem contribuído
para a redução da formação de carbono, aumentando a estabilidade catalítica. O
uso de precursores com estrutura tipo perovisquita, com fórmula geral ABO3, que
apresentam alta estabilidade térmica, podem ser a resposta para o problema de
desativação [GOLDWASSER , M. R. e colaboradores, 2003; DE ARAÚJO G. C.;
2005].
As perovisquitas tem sido extensamente estudadas por suas
interessantes propriedades catalíticas, óticas, magnéticas e condutoras. Em geral,
essas propriedades são potencialmente influenciadas pelo método de síntese,
condições de calcinação (temperatura, tempo e atmosfera) e substituições dos sítios
A e/ou B. O efeito destas variáveis tem sido estudado com o objetivo de aperfeiçoar
o desempenho catalítico do material. A atividade catalítica de óxidos com estrutura
perovisquita em diferentes reações pode ser modificada pela substituição parcial do
sítio A. Entretanto a atividade catalítica de perovisquitas é principalmente
determinada pelo metal que ocupa o sítio B [TANAKA, H. e MISONO, M., 2001].
Diversos métodos de síntese têm sido propostos para a preparação de
óxidos mistos como as perovisquitas e estruturas relacionadas, dentre outros,
visando à obtenção de materiais com alta homogeneidade química, pequeno
tamanho de partícula e alta pureza. Métodos como sol–gel, Pechini, co-precipitação
e combustão ou autocombustão, têm sido amplamente citados pela literatura. A
autocombustão destaca-se como uma técnica promissora para a preparação destes
óxidos por permitir a obtenção de materiais com todas as características desejadas
e ainda ser um método extremamente fácil e rápido, podendo ser aplicado em
escala industrial. A autocombustão assistida por microondas vem sendo empregada
com grande sucesso na preparação de materiais com propriedades ópticas,
magnéticas e catalíticas. Entre as suas vantagens com relação a outros métodos,
destacam-se a facilidade, rapidez, baixo custo e homogeneidade química dos
produtos obtidos [BARROS, B.S., 2009].
O uso de microondas promove um aquecimento mais homogêneo da
solução precursora da síntese (sais metálicos + combustível), fazendo com que a
implica maior homogeneidade e maior pureza, além de menor gasto de energia e
tempo para a preparação de pós com características nanométricas [BARROS, B.S.,
2009].
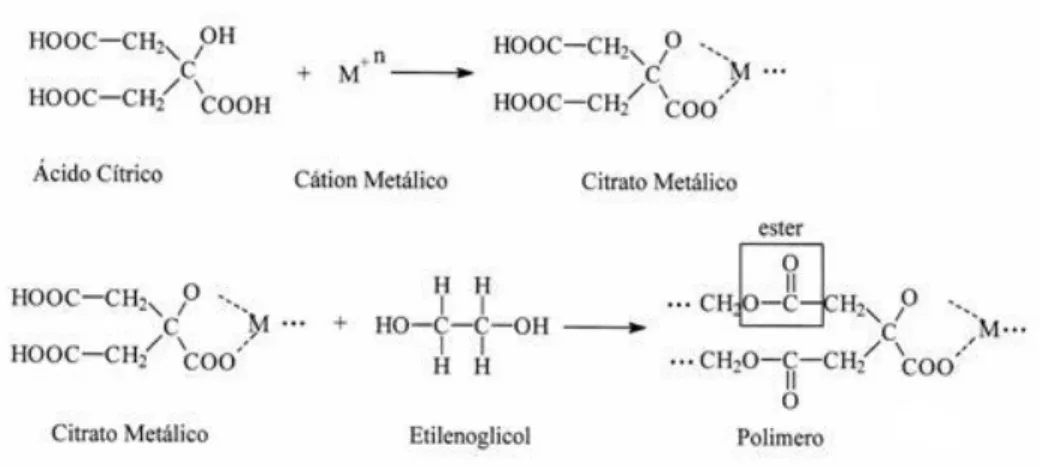
O método dos precursores poliméricos ou método Pechini tem sido
bastante investigado para a síntese de nanopartículas. Utilizam-se amplamente o
ácido cítrico e o etilenoglicol. O ácido cítrico, com três grupos ácido carboxílico e um
grupo alcoólico na molécula, forma quelatos bastante estáveis com vários íons
metálicos e, juntamente com o etilenoglicol, sofre facilmente esterificação em
temperaturas moderadas (~100ºC). O sistema polimérico resultante tem uma
distribuição uniforme de cátions por toda a rede. Assim, o polímero retém
homogeneidade na escala atômica e deve ser calcinado em temperaturas
controladas para produzir óxidos de finas partículas [VOLPE, M.A; 2001].
O método Pechini se destaca em relação aos outros métodos de
síntese química, pois garante uma composição química reprodutível, com
granulometria controlada, estrutura cristalina estável e alta pureza.
Entretanto, os problemas de aglomeração e agregação ainda não são
adequadamente tratados. Outro problema encontrado no método é a remoção
efetiva de grandes quantidades de orgânicos e a grande perda de massa durante o
tratamento térmico.
Uma das aplicações recentes que as perovisquitas a base de Ni e Fe
têm apresentado é como catalisadores promissores para reação de oxidação parcial
do metano.
Este trabalho trata do desempenho de perovisquitas do tipo LaNixFe
1-xO3 obtidas por dois diferentes métodos de síntese: Pechini e combustão assistida
por microondas na reação de oxidação parcial do metano.
Estes três elementos La, Ni, Fe foram escolhidos de acordo com os
dados da literatura: lantânio é um terra rara que ajuda na prevenção da formação de
coque, o níquel é muito ativo frente a reação de oxidação parcial de metano e o ferro
é especialmente interessante porque o raio iônico é próximo ao de Ni.
Os dois metais (Ni, Fe) podem estar envolvidos em perovisquitas de
lantânio: LaNiO3, LaFeO3, mas também em perovisquitas mistas como LaNixFe1-xO3 .
A reatividade das estruturas trimetálicas de La - Ni - Fe na reação de
oxidação parcial de metano tem sido estudada com foco sobre o efeito da presença
importante é a evolução das estruturas de catalisadores em teste e sua possível
regeneração [H. PROVENDIERe colaboradores, 1999].
Dentro deste contexto este trabalho teve como principais
objetivos: Sintetizar perovisquitas do tipo LaNixFe1-xO3 pelo método pechini e
autocombustão assistida por microondas; verificar a influência do grau de
substituição de Ni por Fe na estrutura perovisquita e a influência do método de
síntese no comportamento catalítico das amostras na reação de oxidação parcial do
2 REVISÃO BIBLIOGRÁFICA
2.1 Óxidos com estrutura perovisquita
Nos últimos anos, a pesquisa de novos óxidos do tipo perovisquita tem
sido intensificada devido ao vasto campo de propriedades e aplicações que estes
materiais oferecem.
O uso de óxidos tipo perovisquita como catalisadores foi estudado pela
primeira vez por MEADOWCROFT, em 1970, na redução eletroquímica de oxigênio.
Os óxidos tipo perovisquitas são caracterizados por possuírem uma
única estrutura capaz de aceitar uma grande faixa de defeitos [TEJUCA, L.G. e
colaboradores, 1989] e por exibirem propriedades do estado sólido que são
relativamente fáceis de controlar e modificar mediante trocas na composição
química, dando lugar a interessantes propriedades catalíticas. Estes sólidos são
altamente resistentes a altas temperaturas, estáveis mecânica e quimicamente em
condições de reação e apresentam interessantes propriedades condutoras e
dielétricas [GOLDWASSER, M.R. e colaboradores, 2000].
Dentre essas propriedades podemos citar estabilidade térmica a altas
temperaturas, supercondutividade, atividade catalítica e eletrocatalítica,
propriedades ópticas, dentre outras.
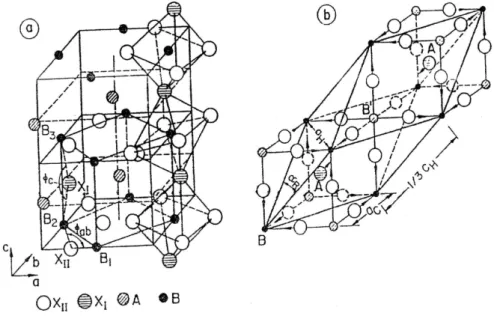
As perovisquitas são óxidos cerâmicos mistos com estrutura do tipo
ABO3, onde os cátions com raios iônicos maiores têm número de coordenação 12 e
ocupam o sítio A, e os cátions com raios menores apresentam número de
coordenação 6 e localizam-se no sítio B, conforme é apresentado na Figura 2.1. O
oxigênio finaliza o empacotamento da estrutura cúbica, formando também um
octaedro no qual um átomo do sítio B ocupa o centro [ VOLPE, M.A; 2001].
O sítio A é ocupado por um metal de terras raras ou metal alcalino e o
B, por um metal de transição [GOLDWASSER, M.R. e colaboradores, 2005].
Os íons A são, dependendo da aplicação, cataliticamente inativos e os
íons metálicos ativos que ocupam a posição B são colocados a distâncias
relativamente grandes um do outro, fazendo com que uma molécula reagente
de um íon A ou B, produzindo assim uma ampla diversidade de compostos
[CHUFFA, P.A. e ASSAF, J. M.,1999].
Cátions com raio iônico relativamente grande (Ca+2 ou Sr+2) substituem preferencialmente os cátions do sítio A e cátions com raio iônico pequeno (Co, Ni ou
Mn) ocupam os sítios B.
A estrutura cristalina é função da composição (substituição nos sítios A
e B) e estequiometria do oxigênio, a qual é influenciada pela temperatura e pressão
parcial de oxigênio [FLORIO, D. Z., 2004].
Figura 2.1 Duas diferentes apresentações para a estrutura cúbica ideal da Perovisquita.
Perovisquitas são materiais interessantes para aplicações catalíticas e
de fundamental importância na área da catálise. Muitos estudos têm sido uma
tentativa de esclarecer a relação entre a atividade catalítica e as propriedades
químicas e físicas da superfície e em massa de óxidos mistos. As vantagens do uso
de perovisquitas como catalisadores são listados abaixo: [H. TANAKA e M. MISONO
2001]
1. Ampla variedade de composição e elementos constituintes, mantendo a
estrutura básica inalterada.
2. Sua estrutura pode ser bem caracterizada.
3. Valência, estequiometria e vacâncias podem variar amplamente.
O lantânio é um dos principais elementos terras raras e o óxido deste
elemento é comumente utilizado como promotor estrutural e eletrônico em varias
aplicações no campo da catálise ambiental [COLUSSI, S. e colaboradores, 2007].
Muita atenção tem sido dada as perovisquitas à base de lantânio
(LaBO3), B = Ni, Co ou Mn, devido à sua alta atividade catalítica e estabilidade
térmica em reações de oxidação de hidrocarbonetos. O sistema LaNiO3 é um dos
mais conhecidos. O Níquel tem carga 2+, mas assume a carga 3+ em óxidos de terras raras [NORMAN, A.K.e MORRIS, M.A, 1999].
Perovisquitas deste tipo chegam a apresentar atividades que são
comparáveis àquelas observadas nos metais nobres [TEJUCA, L G. e
colaboradores; 1989]
A substituição parcial dos cátions A, geralmente um metal terra rara,
com elementos que apresentam estados de valência diferente de 3+, tem sido freqüentemente estudado [ISUPROVA, L. A e colaboradores, 2001; INABA, H. e
colaboradores, 2001].
Os niquelatos de terras raras, puros ou suportados, têm sido testados
como catalisadores industriais potencialmente importantes. As aplicações catalíticas
para esses materiais estão relacionados com a existência de mais de um estado de
oxidação dos metais de transição d, a presença de defeitos e a alta mobilidade dos
íons de oxigênio existentes nestas estruturas [GOMES, D.K.S., 2005].
.
2.1.1 Análises de transições entre várias estruturas perovisquitas
As ligações em perovisquitas do tipo ABO3 são predominantemente
iônicas. Portanto, o raio iônico é usado para pesquisar a respeito de sua estrutura
geométrica. O sistema freqüentemente usado é o publicado por SHANNON e
PREWITT [1969] e por SHANNON [1976].
Os raios iônicos RA e RB dos íons A e B com número de coordenação
12 e 6, respectivamente, e o raio do oxigênio RO, encontram-se nas relações: RB = (
√2 – 1) RO e RA = RO. Portanto, na estrutura de uma perovisquita ideal os íons B
adaptam-se exatamente dentro do sítio octaédrico, ou seja, estão coordenados a
oxigênio, tal que os ânions e cátions estão tão próximos que entram em contato.
Então a constante de rede αo (equação 2.1) pode ser calculada como:
αo = 2 . √2 . Ro = 2 . (RO + RB) = √2 . (RA + RB) (equação 2.1)
Se o tamanho do raio iônico não permitir a construção de uma rede
perovisquita ideal, ele sofre distorção, o qual está mencionado por um fator de
tolerância (equação 2.2) introduzido por GOLDSCHMIDT [1926].
)
(
2
B OO A
R
R
R
R
t
+
+
=
(equação 2.2)Por definição, o fator de tolerância t é igual a 1 em uma rede de
perovisquita ideal. Um decréscimo de t inicia uma deformação da rede, contudo, a
estrutura pode permanecer sem distorção se t for desprezivelmente menor que 1. De
acordo com GOLDSCHMIDT, a estrutura perovisquita distorcida é estável se 1,0 ≥ t
≥ 0,8.
Além da relação entre os raios iônicos, outra condição fundamental
para a formação da perovisquita é a eletroneutralidade, isto é, a soma das cargas
dos íons A e B deve ser igual ao total de cargas dos ânions X. Isso pode ser obtido,
no caso dos óxidos, pela distribuição de carga da forma A1+B5+O3, A2+B4+O3 ou
A3+B3+O3. Por outro lado, a substituição parcial dos íons A e B para originar óxidos
complexos é possível, desde que se mantenha a estrutura perovisquita. TEJUCA,
FIERRO e TASCÓN [1989] mostraram que a maioria dos elementos podem ser
incluídos no arranjo de perovisquitas, muitos deles em ambas, posições A e B. A
estrutura ideal da perovisquita, com fatores de tolerância muito próximos à unidade,
é muito rara e é obtida a temperaturas de calcinações elevadas. Em outras
condições, aparecem diferentes distorções da estrutura perovisquita. Assim, durante
muitos anos, acreditou-se que o composto CaTiO3 possuía estrutura cúbica, mas
estruturas distorcidas com simetria ortorrômbica, romboédrica, tetragonal,
monoclínica e triclínica, mas os três últimos tipos são muito raros e têm sido muito
pouco caracterizados. As distorções mais conhecidas e estudadas são a
ortorrômbica e a romboédrica. No caso da simetria ortorrômbica, os valores de t
devem se situar entre 0,75 e 0,9, produzindo uma distorção cooperativa dos
octaedros dando lugar a este tipo de simetria.
A Figura 2.2 (a) mostra um tipo de distorção que pode ocorrer na
estrutura perovisquita. A distorção é obtida inclinando-se o octaedro de oxigênio de
tal maneira, que os átomos A se deslocam ao longo das direções pseudocúbicas
(110) ou das direções (010). A verdadeira célula ortorrômbica é referida geralmente
como “O-ortorrômbica”, caracterizada por uma relação de parâmetros da rede (c/a) >
√2, que se distingue da estrutura “O”-ortorrômbica”, com (c/a) < √2. Este último
arranjo é o resultado de uma sobreposição da distorção Jahn-Teller da estrutura
perovisquita.
Quando não há nenhum dobramento octaédrico, pode ocorrer uma
pequena deformação da simetria cúbica para romboédrica. Isto ocorre com fatores
de tolerância 0,9 < t < 1,0. A distorção romboédrica, algumas vezes se refere à
“estrutura LaAlO3”, com uma simetria R3c [TEJUCA. FIERRO e TASCÓN. 1989].
Sua relação com a estrutura de estabilidade ideal é mostrada na Figura 2.2 (b)
Figura 2.2 – Distorções (a) ortorrômbica e (b) romboédrica da estrutura perovisquita.
2.1.2 Papel dos cátions na posição A e B
Os óxidos mistos tipo perovisquita são sistemas ideais para estudar o
modo pelo qual as propriedades do estado sólido, tanto coletivas (elétricas,
magnéticas, funções termodinâmicas) quanto locais (defeitos, campo cristalino),
influenciam nas propriedades catalíticas. Isto se deve, fundamentalmente, ao amplo
conhecimento destas propriedades [GOODNOUGH e LONGO, 1970; NOMURA,
1978] e às suas variações nos sólidos.
De acordo com NITADORI e MISONO [1985], a atividade catalítica do
composto LaBO3 (B = Fe, Co e Mn), na oxidação de hidrocarbonetos e monóxido de
carbono, é afetada pela natureza do cátion na posição B. Para explicar esse fato,
considera-se o estado eletrônico dos elétrons d do cátion na posição B [YAMAZOE e
TERAOKA, 1988], a energia de ligação B-O [WELLER, 1983] e a energia de
estabilização do campo cristalino [GUSHEE; KAZ e WARD, 1988].
Nos óxidos tipo perovisquita, os orbitais 2p do oxigênio e os orbitais s e
p externos do metal B, formam uma banda de valência e uma banda anti-ligante de
alta energia, com os orbitais d do íon B ocupando uma zona intermediária de
energia. Portanto, os orbitais d são, em princípio, os responsáveis pelas
propriedades de transporte eletrônico. Pelo fato da distância entre os dois átomos B
vizinhos ser muito grande (5,5 Ǻ), a superposição entre seus orbitais é muito
pequena e a interação se produz através de oxigênio intermediário. No que diz
respeito à ligação B-O-B, os orbitais d se dividem em orbitais σ (eg) e π (t2g), sendo
esta energia de ligação mais elevada para os orbitais σ que para os π. Isto faz com
que os orbitais t2g sejam localizados, enquanto que os eg tenham um certo caráter
itinerante. Por isso, a geometria de ligação B-O-B determina o caráter localizado ou
itinerante dos elétrons do átomo B.
Quando os óxidos tipo perovisquita são estudados do ponto de vista
catalítico, a atividade do oxigênio da rede, a capacidade de cedê-lo ou captá-lo, sua
estequiometria e as diferentes fases geradas nestes processos, são fatores cruciais.
Um dos parâmetros mais usados em nível teórico, quando são
realizadas correlações entre propriedades catalíticas e este tipo de propriedade do
óxido (atividade do oxigênio da rede), é a energia de ligação do oxigênio com os
(Me-O) = (Hf – Hs.m – n.Do/2) / (Cn.m) (equação 2.3)
Onde Hf é a entalpia de formação do óxido MemOn, Hs é a energia de sublimação do
metal. Do é a energia de dissociação do oxigênio e Cn é o número de coordenação
do cátion.
Todas as correlações estão baseadas na natureza do cátion na
posição B, que influenciam notavelmente na atividade catalítica do catalisador, tal
como foi demonstrado por diversos autores.
NITADORI e MISONO [1985] estudaram o efeito do cátion na posição
A e encontraram que o efeito do lantanídeo (cátion na posição A) é relativamente
pouco intenso e a atividade esperada dos catalisadores tipo perovisquita é similar
àquela dos óxidos de metais de transição na posição B. Por outro lado, as atividades
catalíticas observadas com os óxidos de terras raras foram mais baixas que nas
perovisquitas correspondentes.
Outros estudos foram conduzidos por PENA [1990], que correlacionou
a natureza dos cátions na posição A com a atividade na oxidação total de isobuteno
e concluiu que na série de perovisquita estudada a atividade catalítica cresce na
seguinte a ordem:
DyCoO3 <<<GdCoO3 < LaCoO3 < SmCoO3 < PrCoO3 < NdCoO3
Estas variações foram inferiores às encontradas quando, fixando-se o
cátion na posição A, varia-se o cátion na posição B. Entretanto, não podem ser
desprezadas.
2.1.3 Estruturas das perovisquitas não estequiométricas
A inexistência de estequiometria em óxidos puros e óxidos mistos
permitem, habitualmente, a estabilização de íons em estados de valência não usuais
e a co-existência de diferentes coordenações. SMITH [1993] definiu a inexistência
oxigênio em relação ao número de sítios na subrede de cátions. A não
estequiometria é definida como sendo o conteúdo de oxigênio em excesso,
necessário para compensar a carga dos cátions constituintes em seu estado de
oxidação normal. Os desvios da estequiometria, devido fundamentalmente a
deficiências catiônicas (nas posições A ou B), deficiências de oxigênio ou excesso
de oxigênio [PEDERSEN e LIBBY, 1972], produzem também um distanciamento da
estrutura ideal da perovisquita. Em catálise heterogênea, os sistemas mais
estudados são os que apresentam um elemento alcalino, alcalino terroso ou
lantanídeo como cátion na posição A e na posição B, um metal de transição da
primeira série. A deficiência nas posições A se produz facilmente, visto que o
esqueleto estrutural de octaedros BO3 permanece inalterado. Um exemplo deste tipo
de não estequiometria é o Cu0,5TaO3 ortorrômbico, com uma distribuição ordenada
dos íons Cu(ll) sobre os sítios A [LONGO e SLEIGTH, 1975].
As vacâncias nos sítios B das perovisquitas não são tão comuns, já
que a deficiência catiônica nas posições B não está energeticamente favorecida e
acontece somente quando os cátions A e o oxigênio (camadas AO3) se estruturam
em um empacotamento hexagonal compacto, o que dá lugar a octaedros BO3 que
dividem as faces. Os empacotamentos intercrescem originando uperfíci diferentes
segundo sua proporção e ordenamento. Entretanto, se conhecem exemplos com
este tipo de defeito, que apresentam geralmente uma estequiometria complexa, tal
como aquela observada nos compostos BaSm2/3UO6 e Ba2CeSb4/5º6 [RAUSER e
KEMMLER-SACK. 1980].
As vacâncias aniônicas são mais comuns que as não estequiométricas
catiônicas. Desse modo, nos óxidos tipo perovisquita, as vacâncias de oxigênio são
mais comuns [BREARD e colaboradores, 2002]. Nos óxidos ABO3-x, não se
encontram planos cristalográficos de cisalhamento (Crystaligraphic Shear Planes,
CSP), senão uma grande variedade de superestruturas devido ao ordenamento das
vacâncias. Um dos óxidos tipo perovisquita mais conhecidos com vacâncias
aniônicas, é o que exibe a estrutura brownmillerita como os compostos Ca2Fe205 e
Ca2FeAIO5. Estas estruturas podem ser consideradas perovisquitas com deficiências
aniônicas com um sexto dos sítios aniônicos, porém estas vacâncias estão
ordenadas de tal forma, que se alternam os planos BO2 (001) da estrutura
pseudocúbica e as colunas alternantes (110) do oxigênio são perdidas [GRENIER;
O conteúdo de oxigênio ou o grau de não estequiometria dos óxidos
tipo perovisquita, dependem do método de preparação utilizado e da atmosfera,
temperatura e tempo dos tratamentos térmicos [PEDERSEN e LIBBY, 1972].
2.1.4 Composição superficial das perovisquitas
Os íons, na posição B das perovisquitas ABO3, são os mais ativos em
numerosas reações em fase heterogênea. Visto que estes íons estão situados em
distâncias relativamente grandes uns dos outros (≈0,4nm), cada molécula reagente
pode interagir somente com um centro. A superfície representa uma
descontinuidade do cristal: a simetria e a coordenação dos íons Na+ e Bm+ (n+m=6) se perde na superfície, pelo fato da superfície apresentar uma grande tendência em
completar sua coordenação através da reação com moléculas gasosas [FIERRO,
1993]. Dessa forma, a análise dos espectros fotoeletrônicos de raios X de muitos
compostos tipo perovisquita ABO3, expostos a umidade ou reduzidos em fluxo de
hidrogênio, indicam a presença de mais de uma espécie de oxigênio. Isto quer dizer
que o oxigênio da rede (O2-) vem acompanhado por outras espécies de oxigênio menos ricas em elétrons, tais como OH- e CO32-. Quantidades ainda menores de
óxidos individuais AOx e BOy podem não ser completamente incorporadas à
estrutura perovisquita durante a síntese e, por isso, ficarão na superfície. Como
conseqüência deste depósito, a composição superficial se desvia, em muitos casos,
da estequiométrica. É de se esperar, que estas diferenças na composição
superficial, em relação à estequiométrica, modifiquem tanto as propriedades
catalíticas, quanto as propriedades de adsorção das perovisquitas.
FIERRO e TEJUCA [1987] observaram, por meio de um estudo de
espectroscopia fotoeletrônica de raios X (XPS), que os espectros dos níveis internos
B 2p3/2 e La 3d5/2 das perovisquitas LaBO3 (B = Cr, Mn, Co, Ni, Rh), tratadas em ar a
700 e 900°C, não mostraram mudanças significativas das linhas B 2p3/2 e La 3d5/2
com a temperatura.
Os espectros O1s de todos os membros da série exibiram um pico a
529,7 – 530,0 eV, correspondentes a íons O2-, junto a outro pico a 531,4 – 532,6 eV, que aumentava em intensidade e se deslocava para valores mais elevados de
pico foi atribuído ao oxigênio adsorvido (provavelmente O-) de modo similar àqueles encontrados por ICHIMURA, INOUE e YASUMORI [1980] bem como YAMAZOE,
TERAOKA e SEIYAMA [1981] para a espécie de oxigênio adsorvido das
perovisquitas LaCoO3.
VOORHOEV, REMEIKA e TRIMBLE [1976] encontraram que a
atividade catalítica dos óxidos tipo perovisquitas ABO3, nas reações de oxidação,
dependia da concentração superficial dos íons metálicos em um estado de oxidação
diferente de 3+ e, portanto, de seu caráter não estequiométrico. MILT e
colaboradores [1996] prepararam perovisquitas LaFeO3 e LaCoO3, pelo método de
combustão, e obtiveram perovisquitas altamente cristalinas e monofásicas, mas com
heterogeneidade superficial. Através da análise de superfície, usando XPS os
autores determinaram que as camadas mais externas destas perovisquitas diferiam
na estrutura e composição mássicas, contendo altas concentrações de espécies
carbonatadas mais elevadas que aquelas encontradas nas perovisquitas preparadas
por métodos mais convencionais.
GUNASEKARAN e colaboradores [1996] ao realizarem a
caracterização superficial, estudaram as propriedades catalíticas na reação de
oxidação de metano com perovisquitas La0,8Sr0,2BO3 (B = Mn, Cr, Fe, Co e Y) e
concluíram que, não apenas a concentração superficial do metal ativo influi na
reação de oxidação, como também a natureza do íon B é um importante parâmetro.
2.1.5 Adsorção de oxigênio nas perovisquitas
A interação do oxigênio nas perovisquitas tem sido estudada,
principalmente, por causa da importância destes materiais como catalisadores em
reações de oxidação – redução.
O desempenho particular destes materiais, como catalisadores de
oxidação, foi explicado em termos da facilidade relativa com que as espécies de
oxigênio podem ser liberadas da superfície do catalisador [PENA e FIERRO, 1981].
Dois tipos de espécies de oxigênio (adsorvido na superfície e oxigênio de rede), com
diferentes forças de ligação, estão presentes na superfície de óxidos tipo
perovisquitas. Admite-se que o oxigênio adsorvido torna-se ativo e reage com os
oxigênio de rede. Estas considerações estão consistentes com a classificação de
VOORHOEV, REMEIKA e TRIMBLE [1976] das reações de oxidação em
perovisquita, nos processos suprafacial e intrafacial, que ocorrem em baixas e altas
temperaturas, respectivamente [FIERRO, 1990].
YAMAZOE, TERAOKA e SEIYAMA [1981] realizaram experimentos de
adsorção de oxigênio, desde a temperatura ambiente até 750°C, e observaram dois
picos de dessorção na curva do composto La1-xSrxCoO3. O pico em temperatura
mais baixa (Tipo α) foi atribuído ao oxigênio adsorvido na superfície, enquanto o pico
em altas temperaturas (Tipo β) foi devido ao oxigênio da rede cristalina. Estas
espécies podem ser detectadas por espectroscopia fotoeletrônica de raios X
combinada com estudos de dessorção de oxigênio a temperatura programada
[TABATA; HIRANO e SUZUKI, 1998]. Foi considerado que o pico a altas
temperaturas (Tipo β) está mais especificamente associado ao cátion B, embora ele
seja também afetado pela substituição do cátion A (normalmente um lantanídeo).
Em uma recente contribuição, YOKOI e UCHIDA [1998] observaram
que a quantidade de oxigênio dessorvido e a temperatura de dessorção do oxigênio
(Tipo β) do LaBO3 (B = Cr, Mn, Fe, Co, Ni) tendem a diminuir com o aumento do
número atômico do metal de transição. O valor da força de ligação B-0 torna-se
menor com o aumento do número atômico de B, sugerindo que a temperatura de
dessorção do oxigênio é afetada pela interação eletrônica entre o oxigênio adsorvido
e o íon metal de transição (B3+).
2.1.6 Estabilidade das perovisquitas em atmosfera redutora
Os estudos a respeito da redutibilidade das perovisquitas podem ser
realizados em atmosfera de monóxido de carbono, porém, devido ao fato de se obter
resíduos carbonáceos, é recomendável conduzir os mesmos em atmosfera de
hidrogênio para eliminar este efeito. Este é o caso do composto LaRhO3 que foi
reduzido em atmosfera de monóxido de carbono, obtendo-se uma perda de peso
equivalente à redução de 75% da espécie Rh3+ a Rh0, a 580°C e, ao se aumentar a temperatura, obteve-se um aumento no peso, devido à formação de depósitos de
carbonatos ou carvão [TASCÓN; OLIVÁN e TEJUCA, 1984]. FIERRO e TEJUCA
[1985, 1986] estudaram a série de óxidos LaMO3 (M = Cr, Mn, Fe, Ni, Rh). Eles
observaram que a facilidade de redução aumentava da espécie Cr3+ à Ni3+, na série de perovisquitas de LaM03. A mesma tendência foi encontrada com os óxidos
simples de ferro, cobalto e níquel [ANDERSON, 1956]. Por outro lado, encontrou-se
que os óxidos do tipo LaMO3 (M = Fe, Co, Ni) eram mais estáveis em atmosfera de
hidrogênio que os óxidos simples do tipo NiO, Fe203, Co304 [WACHOWSKl; ZlELISKl
e BUREWICZ, 1981], o que indica maior estabilidade dos cátions dos metais de
transição na estrutura perovisquita.
Os experimentos de redução à temperatura programada também
mostraram que a estabilidade dos óxidos tipo perovisquita aumentava com o
aumento no tamanho do íon A. Notou-se, ainda, que as diferentes etapas de
redução correspondiam a diferentes mecanismos de redução. Tais mecanismos
podem ser estudados mediante experimentos de cinética de redução em condições
isotérmicas. Assim, no composto LaNiO3 [FIERRO; TASCÓN e TEJUCA, 1985] a
espécie Ni3+ se reduzia a Ni2+ de acordo com o modelo de contração de esfera e a espécie Ni2+ a Ni°, de acordo com o modelo de nucleação. A dife rença entre os dois mecanismos de redução é arbitrária, devido ao fato de que o modelo de contração
de esfera se inicia com uma nucleação muito rápida e o mecanismo de nucleação
termina de acordo com o modelo de contração de esfera. Segundo PIERRÔ,
TASCÓN e TEJUCA [1984] o processo de redução do composto LaMO3 ocorre em
uma etapa única, controlada pela formação e crescimento dos núcleos de redução
da superfície, seguida da diminuição da massa do catalisador.
O cátion na posição A possui um papel importante na redutibilidade
das perovisquitas. Por exemplo, ARAKAWA, OHARA e SHIOKAWA [1986]
mostraram através de análise termogravimétrica que a extensão da redução do
cobalto, em atmosfera de hidrogênio dos óxidos LnCoO3, aumentava a partir do
LaCoO3 até o EuCoO3, com a diminuição do raio iônico do elemento lantanídeo. A
mesma seqüência de redução foi encontrada por FUTAI, YONGHUA e HUI [1986]
por meio de experimentos de redução à temperatura programada. Estes autores
[FUTAI; YONGHUA e Hul, 1986] encontraram uma relação direta entre a
redutibilidade e a soma das energias das ligações Ln-O e Co-O, isto é, a facilidade
de redução aumenta com a diminuição da energia de ligação.
Os processos de redução-oxidação de perovisquitas podem ser
ocorre a sinterização das espécies oxidadas ou reduzidas. Pode-se dizer que,
mediante os tratamentos de redução ou ciclos redox, o metal na posição B, uma vez
reduzido, se encontra em um estado altamente disperso em uma matriz composta
pelo óxido do metal na posição A. Desse modo, dependendo do grau de sinterização
a que foi submetido à estrutura perovisquita por causa da redução, é possível
reverter este processo e obter, ou não, uma única fase perovisquita após a
reoxidação [CRESPIN e HALL, 1981].
2.1.7 Perovisquitas em camadas
Perovisquitas em camadas consistem infinitas camadas 2D da estrutura tipo
ABO3, que estão separados por camadas. A fórmula geral para as camadas é:
Na+1BnO3n+1. As características que as diferem das perovisquitas convencionais são:
1) a separação por camadas, e 2) a compensação das camadas.
As perovisquitas podem ser vistas como o membro n = da série dos
compostos de Ruddlesden-Popper (RP), com a estrutura K2NiF4 estando no extremo
oposto (n = 1). As fases de RP são constituídas de n camadas consecutivas de
perovisquita (ABO3) alternadas com uma camada de “sal de rocha” (“rock-salt”)
(AO), ao longo da direção cristalográfica c. As fases RP são formadas por blocos de
octaedros BO6 com vértices compartilhados que extendem-se ao infinito no plano xy
e tem uma espessura de n octaedros paralelos ao eixo z. Após as primeiras
observações da magnetoresistência colossal na fase n = , as propriedades
eletrônicas de outros membros da série foram estudadas. Porém, a
magnetoresistência colossal não é observada em amostras do sistema n = 1.
Os exemplos mais claros disto são n = 1 e n = 2, conhecidas como fases de
Ruddleson-Popper (La2NiO4 e La3Ni2O7), Figura 2.3. Para estas fases, o La é o
Figura 2.3 – Série de Ruddlesden-Popper. (a) Para n =1 e (b) Para n = 2.
O sistema Lan+1NinO3n+1 tem sido amplamente investigado como um
possível material catódico de temperatura intermediária devido à sua elevada
condutividade iônica e eletrônica [SKINNER, S. J. e KILNER, J.A., 2000; WAN, J.,
2007].
A estrutura cristalina Lan+1NinO3n+1, para n = 1 tem sido estudado por
diversos grupos [VORONINA, V.I., 2001; POLTAVETS, V. V. e colaboradores, 2006].
Essa estrutura, à temperatura ambiente é tetragonal, enquanto que para n = 2 e 3,
as estruturas são ortorrômbicas.
As perovisquitas tridimensionais têm sido muito estudadas; em
particular, as manganitas de camadas com n = 2 tem começado a ganhar
importância devido à sua inerente anisotropia e suas conseqüências para o estudo
da física de baixa dimensionalidade [J. F. MITCHELL e colaboradores, 1999]. A
magnetoresistência colossal pode ser fortemente melhorada em sistemas com
dimensionalidade reduzida [ROSENKRANZ,S. e colaboradores,1998].
Devido ao forte acoplamento entre os graus de liberdade orbital e da rede que
existem nestes sistemas, um entendimento das propriedades magnéticas e de
transporte requer um conhecimento completo dos efeitos da rede cristalina.
2.1.8 Emprego de Perovisquitas como Catalisador
Neste item serão apresentados os resultados de alguns trabalhos
relacionados com o uso da perovisquita como catalisador, com a substituição parcial
de alguns metais nesta estrutura, e trabalhos que têm relação com este trabalho.
É conhecido que a substituição parcial dos metais na estrutura perovisquita
do sistema catalítico pode provocar alterações na matriz original e, portanto, no seu
comportamento catalítico. Este procedimento pode alterar as propriedades da
estrutura, transformando e neutralizando os sítios, modificando a estrutura eletrônica
do metal e a atividade e seletividade catalítica.
Segundo SLAGTERN e OLSBYE [1994], as interações geradas pela
formação de ligações entre óxidos de níquel e terras raras permitem aumentar a
temperatura de redução do óxido de níquel. No entanto, particularmente para
LaNiO3, a estabilidade térmica é baixa sob atmosfera redutora e a formação de
coque ainda é relevante. Nestas condições, os autores concluíram que a adição de
um terceiro metal na estrutura perovisquita pode estabilizar o sistema catalítico e
limitar o crescimento da partícula metálica.
Foi constatada a alta eficiência de precursores de perovisquita tipo
LaNixFe1-xO3 na reforma a seco do metano para produção de gás de síntese. Esse
sistema de perovisquitas foi obtido via o método sol-gel com ácido propiônico, sendo
a calcinação realizada a 750°C por 4 horas, resulta ndo em solução sólida altamente
homogênea de LaFeO3 e LaNiO3. Os autores observaram, depois dos testes
catalíticos, através de espectros de DRX, que para valores de x > 0,1 o Ni foi
totalmente reduzido; observaram também que Ni e NiO foram depositados sobre
La2O3 para perovisquitas inicialmente ricas em Ni (x = 0,9 e 1,0). Para 0,2 ≤ x ≤ 0,7
parte da estrutura ficou presente como uma perovisquita LaFeO3 e La2O3 e Ni
metálico foram então observados [PROVENDIER, H.; 1998].
Lima e Assaf [2006] também realizaram um estudo com perovisquitas tipo
LaNi1-xFexO3, preparadas pelo método de precipitação, como precursores de
catalisadores para a reforma a seco do metano e observaram a formação de uma
solução sólida em todas as amostras. Foi observado pelos autores que a amostra
não substituída (LaNiO3) desativou-se rapidamente com o tempo de reação devido à
formação de carbono na superfície do catalisador, confirmado por análise de
estrutura perovisquita resultou em aumento da estabilidade do catalisador e a
formação de carbono não foi mais observada. No entanto, a substituição parcial de
Ni por Fe conduziu ao decréscimo dos valores de conversão do metano, pois o Fe
contribuiu para redução de deposição de carbono, mas substituiu parcialmente os
sítios ativos de Ni para a reação de reforma a seco.
No trabalho de NAM e colaboradores [1998] foi relatado o resultado de
estudos sobre a reforma a seco do metano utilizando catalisadores tipo perovisquita
La1-xSrxNiO3 (x = 0, 0,1), cujas atividade catalítica e a estabilidade foram
comparadas com catalisadores convencionais de Ni suportado, 5%Ni/SiO2 e
5%Ni/Al2O3 calcinados a 700°C. Apesar da atividade inicial da perovisquita LaNiO3 a
700°C ter sido mais baixa que aquelas dos catalisad ores de Ni impregnados, a sua
atividade aumentou consideravelmente com o tempo antes de alcançar um estado
estacionário. Não tendo sido detectado carbono na superfície da perovisquita LaNiO3
depois da reação, os autores concluíram que a desativação pelo coque foi impedida
devido à boa dispersão de partículas de Ni, provenientes da própria redução da
perovisquita de LaNiO3.
Óxidos tipo perovisquita de La1-xSrxNiO3 foram sintetizados pelo
método de auto-combustão e testados como precursores de catalisadores na reação
de reforma do metano com CO2 a 700°C [VALDERRAMA, G. e colaboradores;
2005]. As análises de difração de raios-X mostraram que a redução das
perovisquitas ocorrem através de espécies intermediárias para produzir Ni0, La2O3 e
SrO. A perovisquita LaNiO3 foi a mais ativa dentre as estudadas, enquanto que
La2NiO4 não foi ativa na reação de reforma a seco. Foi observado que a atividade
catalítica depende do conteúdo de estrôncio, seguindo a seguinte seqüência:
LaNiO3 > La0,6Sr0,4NiO3 > La0,9Sr0,1NiO3.
A alta atividade catalítica encontrada para estes precursores sólidos foi
devido à presença de níquel metálico durante o curso da reação e à formação da
fase de La2O2CO3 que permitiu a oxidação do metano e a regeneração da fase de
La2O3, suprimindo a formação de depósitos carbonáceos.
BATIOT-DUPEYRAT e colaboradores [2003], usando óxido tipo perovisquita
LaNiO3 como material de partida para reforma do metano com CO2, estudaram a
Três picos de redução foram observados na análise de TPR, sendo o principal pico
em 630°C. O primeiro pico de redução (200-500°C) fo i correspondente à formação
de La4Ni3O10 de acordo com a equação 2.4:
4LaNiO3 + 2H2→ La4Ni3O10 + Ni0 + 2H2O (Equação 2.4)
O segundo passo de redução (600-650°C) deveu-se à f ormação da fase
espinélica La2NiO4, de acordo com a equação 2.5:
La4Ni3O10 + 3H2→ La2NiO4 + 2Ni0 + La2O3 + 3H2O (Equação 2.5)
O terceiro pico foi atribuído à redução completa (680-750°C):
La2NiO4 + H2→ Ni0 + La2O3 + H2O (Equação 2.6)
Os autores estudaram a influência da temperatura de reação (700°C e 800°C)
e observaram que depois da reação a 800°C foram det ectadas somente as fases de
Ni0 e La2O3, as mesmas presentes no início da reação; a 700°C, as fases
predominantes foram Ni0 e La2NiO4. Isto levou à sugestão de que esta
transformação de fase resulta da reação de CO2 com La2O3 e Ni, de acordo com a
reação:
Ni + La2O3 + CO2→ CO + La2NiO4 (Equação 2.7)
A formação da fase espinélica envolve a migração de átomos de níquel das
partículas de Ni0 sobre La2O3 ou a presença de partículas de Ni0 ultra dispersas
capazes de reagir facilmente com La2O3 e CO2. Isto mostra que a fase espinélica
pode ser considerada como um intermediário, onde a reação de reforma seca
ocorreria por um mecanismo de dois passos, sendo o primeiro a ativação de CO2
(Equação 2.7) com a formação de CO e La2NiO4, e o segundo, a redução de
La2NiO4 por CH4 da seguinte forma:
CH4 + La2NiO4→ CO + 2H2 + La2O3 + Ni0 (Equação 2.8)
CHOUDHARY e colaboradores [1996], estudaram a oxidação parcial
seletiva do metano para produção de gás de síntese sobre perovisquitas LaNiO3,
extremamente baixos (≈ 0,8 ms). Também foram estudadas as reações simultâneas
de oxidação parcial, reforma a vapor e reforma com CO2 do metano para produção
de gás de síntese sobre LaNiO3 em pequenos tempos de contato (≈ 9 ms) e em
diferentes temperaturas e razões de alimentação CH4/O2.
Verificaram que a perovisquita LaNiO3 tem um alto potencial como catalisador
para a oxidação parcial seletiva do metano na produção de gás de síntese a tempos
de contato extremamente baixo (≈ 0,8 ms), uma vez que, durante o processo
catalítico, ela é transformada em Ni0/La2O3, forma ativa do catalisador para a reação
de reforma. No entanto, a perovisquita com substituição parcial ou completa de
níquel por cobalto mostrou desempenho inferior no processo catalítico. Quando as
reações simultâneas foram conduzidas sobre a perovisquita LaNiO3 a 800 – 850°C e
alta velocidade espacial (tempo de contato ≈ 9 ms) o gás de síntese (com razão
H2/CO de 2.0) pôde ser obtido com alta conversão (>90%) e alta seletividade
(aproximadamente 100% para ambos H2 e CO), podendo o processo ser operado de
modo mais eficiente, requerendo pouca ou nenhuma energia externa, em
conseqüência do acoplamento das reações exotérmicas de oxidação e das reações
endotérmicas de reforma com vapor e CO2 sobre o mesmo catalisador.
2.2 Métodos de síntese
Existe um grande número de métodos para a síntese de perovisquitas,
mas para se determinar o melhor é necessário, inicialmente, saber para que fim será
utilizado o óxido obtido. As propriedades destes sistemas dependem em grande
parte do caminho de síntese, especialmente sua textura e superfície específica,
estados de oxidação dos cátions e a estequiometria do oxigênio [DE LIMA, S. M.;
2006].
O método ideal deve dar lugar a óxidos de excelentes propriedades
catalíticas e deve ser altamente reprodutível, de forma que permita comparar
propriedades de diferentes sistemas.
Materiais cerâmicos como os óxidos, são em geral preparados a partir
da purificação de minerais ou por métodos convencionais de preparação a partir de
misturas de constituintes óxidos, hidróxidos e/ou carbonatos. Estes materiais
material homogêneo e constituído por uma única fase, procedimentos de preparação
que fazem uso de repetidas misturas, aquecimentos prolongados e elevadas
temperaturas. Desvantagens como, baixa área superficial e controle limitado da
microestrutura inerente aos processos a altas temperaturas tendem a ser superadas
através da preparação destes materiais por outros métodos, tais como,
co-precipitação, sol-gel, Pechini, reação de combustão, etc.. Estes métodos garantem a
obtenção de materiais com composição química reprodutível e controlada, alta
pureza, homogeneidade e tamanho de partícula rigidamente controlado.
2.2.1 Método dos precursores poliméricos (Método Pechini)
O método dos precursores poliméricos vem sendo bastante reportado
na literatura, por apresentar alta qualidade das propriedades. Logo, vários materiais
têm sido preparados por este método e com uma variedade de aplicações, tais
como: fotoluminescência (SrSnO3) [UDAWATTE e colaboradores, 2000], pigmento
cerâmico (ZnTiO4) [SOUZA e colaboradores, 2005], catalisador (LaNiO3)
[FERNANDES e colaboradoes, 2002], entre outras.
O método dos precursores poliméricos, comparado com outros
métodos tradicionais, oferece a posibilidade de materiais com uma boa
homogeneidade química, reprodutibilidade e um bom controle estequiométrico
[MELO e colaboradores, 2006].
Este método foi desenvolvido originalmente por Pechini, em 1967
(Pechini, 1967) e se tornou popular por H. Anderson, que originalmente aplicou o
método para fabricar pós de perovisquita [LESSING, 1989]. Atualmente, é utilizado
na síntese de diversos óxidos policatiônicos.
O método Pechini consiste na formação de quelatos entre os cátions
metálicos (dissolvidos como sais numa solução aquosa) com um ácido carboxílico
(preferencialmente o ácido cítrico) e, em seguida, uma reação de poliesterificação
utilizando uma poliálcool (preferencialmente etileno glicol), promovendo, dessa
forma, a polimerização. Vários sais de cátions podem ser usados, tais como,
carbonatos, cloretos, hidróxidos, isopropóxido e nitratos [LESSING, 1989]. O
aquecimento da resina, a aproximadamente 300 ºC, provoca a ruptura do polímero
(combustão de parte da matéria orgânica), resultando na formação do pó precursor,
adequado é realizado para a eliminação do material orgânico e a obtenção da fase
desejada.
O etileno glicol proporciona uma imobilização do complexo metal–ácido
cítrico (quelato) em uma rígida rede polimérica altamente ramificada, reduzindo a
segregação dos metais durante o processo de pirólise a altas temperaturas,
garantindo uma composição final estequiométrica [UDAWATTE e colaboradores,
2000; POPA e colaboradores, 2002]. Isto é de vital importância para a síntese de
óxidos multicomponentes com composição complexa [KAKIRANA e YOSHIMURA,
1999].
A idéia principal do método é manter a estequiometria dos íons
metálicos na resina polimérica, ou seja, que os íons metálicos estejam distribuídos
atomisticamente por toda a estrutura polimérica, de forma que a ruptura da rede do
polímero não comprometa a distribuição homogênea destes íons metálicos, uma vez
que essa distribuição determina a homogeneidade do óxido final [KAKIHANA, 1996].
Este método recebeu atenção considerável por sua simplicidade.
A Figura 2.4 ilustra as reações envolvidas no método Pechini.
Figura 2.4 – Reações envolvidas no método Pechini
O ácido cítrico é muito utilizado como agente quelante, pela sua
monovalentes), enquanto, o etileno glicol é bastante utilizado como agente
polimerizante, pois possui grande afinidade de complexação metal-ácido cítrico.
O ácido cítrico contém três grupos carboxílicos (-COOH), o etileno
glicol dois grupos hidroxílicos (-OH) em cada molécula, logo reações sucessivas de
esterificação podem ocorrer para a formação da resina polimérica [KAKIHANA,
1996].
O método dos precursores poliméricos, em relação a outras técnicas, apresenta
vantagens e desvantagens [KAKIRANA e YOSHIMURA, 1999]:
Vantagens:
• Homogeneidade química dos multicomponentes em escala atômica;
• Temperaturas de calcinações relativamente baixas;
• Controle direto e preciso da estequiometria de sistemas complexos;
• Pós-cerâmicos com partículas muito finas;
• Simplicidade de processamento;
• Maior reprodutibilidade
• Flexibilidade,
Desvantagem:
Grande quantidade de matéria orgânica, que pode levar à formação de carbonato
como fase secundária e de fortes aglomerados.
Apesar de o método já oferecer a vantagem de obter partículas finas, a síntese pode
ser aprimorada com o processo de moagem.
2.2.2 Combustão microondas
A síntese por reação de combustão, também conhecida como síntese
auto-propagante, é uma técnica onde reações exotérmicas são usadas para produzir
uma variedade de pós cerâmicos.
O processo é baseado no principio de que, uma vez iniciada por uma
fonte externa, uma reação exotérmica muito rápida ocorre, tornando-se
auto-sustentável e resultando em um produto final (óxido), dentro de um curto período de
tempo. A técnica é uma maneira fácil, segura e rápida para a produção de
pós-cerâmicos, tendo como principais vantagens: requerer menos energia que os
processos convencionais de síntese de materiais cerâmicos e tempo de