UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
REDE NORDESTE DE BIOTECNOLOGIA
GABRIELA LIBERALINO LIMA
CONSERVAÇÃO DE MATERIAL GENÉTICO DE ESPÉCIES
SILVESTRES DO BIOMA CAATINGA UTILIZANDO A
MANIPULAÇÃO DE OÓCITOS INCLUSOS EM FOLÍCULOS
OVARIANOS PRÉ ANTRAIS (MOIFOPA)
GABRIELA LIBERALINO LIMA
CONSERVAÇÃO DE MATERIAL GENÉTICO DE ESPÉCIES
SILVESTRES DO BIOMA CAATINGA UTILIZANDO A
MANIPULAÇÃO DE OÓCITOS INCLUSOS EM FOLÍCULOS
OVARIANOS PRÉ ANTRAIS (MOIFOPA)
Tese apresentada ao Programa de Pós-Graduação em Biotecnologia da Rede Nordeste de Biotecnologia (RENORBIO) como requisito parcial para a obtenção do título de Doutor em Biotecnologia.
Área de Concentração: Biotecnologia em Agropecuária
Linha de Pesquisa: Biotecnologia da Reprodução Animal
Orientador: Prof. Dr. Alexandre Rodrigues Silva.
GABRIELA LIBERALINO LIMA
CONSERVAÇÃO DE MATERIAL GENÉTICO DE ESPÉCIES
SILVESTRES DO BIOMA CAATINGA UTILIZANDO A
MANIPULAÇÃO DE OÓCITOS INCLUSOS EM FOLÍCULOS
OVARIANOS PRÉ ANTRAIS (MOIFOPA)
Tese apresentada ao Programa de Pós-Graduação em Biotecnologia da Rede Nordeste de Biotecnologia (RENORBIO) como requisito parcial para a obtenção do título de Doutor em Biotecnologia.
BANCA EXAMINADORA
__________________________________________
Prof. Dr. Alexandre Rodrigues Silva Universidade Federal Rural do Semi Árido
Orientador
______________________________________
Prof. Dr. Moacir Franco de Oliveira Universidade Federal Rural do Semi Árido
Examinador
______________________________________
Profa. Dra. Alexsandra Fernandes Pereira Universidade Federal Rural do Semi Árido
Examinadora
______________________________________
Profa. Dra. Lúcia Daniel M. Silva Universidade Estadual do Ceará
Examinadora
______________________________________
Profa. Dra. Maria Denise Lopes Universidade Estadual Paulista - Botucatu
Dedico esta tese à memória do meu querido avô João Liberalino Neto, exemplo de força, perseverança e carinho.
“Seja a mudança que você quer ver no mundo.”
AGRADECIMENTOS
A Deus, por ter iluminado meus caminhos, permitindo que eu chegasse até aqui.
A minha família, por ter me ensinado os verdadeiros valores da vida e ter me guiado sempre pelo melhor caminho, mostrando que nem sempre este é o mais fácil.
Especialmente a minha mãe, Catarina Lúcia Liberalino, pelo amor e dedicação não só nestes últimos quatro anos, mas durante toda minha vida. Por ter exercido inúmeras vezes o papel de mãe, pai e amiga, contribuindo para a vitória em mais uma de várias batalhas da minha vida, dedico minha profunda gratidão e meu amor.
Ao meu pai, Genildo Eufrázio de Lima, pelo exemplo de amor e fé, pelas palavras sábias e bem colocadas nos momentos mais difíceis. Pelo ombro nos momentos de lágrimas e pela sabedoria nas horas de maior desespero. Jamais teria conseguido chegar até aqui se não fosse pelo fato do Sr. me mostrar que quase sempre as coisas fogem do nosso controle e temos que tentar manter a serenidade nestes momentos.
Ao meu padrasto Gileno Marques, por toda a ajuda e suporte que sempre me ofereceu, obrigada por sempre estar disposto a ajudar e pela preocupação.
Aos meus irmãos, Fernando Liberalino Fernandes, Amanda Danielly Lima e Silva e Jemima Queren Lima e Silva, pelo amor e amizade que me deram forças para chegar até aqui.
Ao meu sobrinho Rafael, fofo de titia, que na sua inocência sempre me lembra que o valor da vida está nas coisas mais simples.
Ao meu avô, João Liberalino Neto (in memorian), por ter me apoiado tantas vezes
ao longo dessa caminhada. Por me ensinar a ter humildade, força e dedicação em tudo na vida. Apesar de não estar presente fisicamente, sua lembrança será constante.
A minha avó, Ilda Martins Liberalino, pela atenção e pelo amor dedicado durante todos esses anos. Pelo apoio e exemplo de fé e dedicação como avó e mãe, eu agradeço.
A todos os meus outros familiares, especialmente a tia Francisca Nazaré Liberalino, a tia Gilda e Kédma por terem fornecido uma base forte na qual pude me apoiar para conseguir chegar a esta nova fase da minha vida.
vários momentos. Só tenho a agradecer por ter você em todos os momentos e na falta de uma definição melhor para o meu sentimento em relação a você fica o eu te amo!
Ao meu professor e orientador, Dr. Alexandre Rodrigues Silva, pela oportunidade e pela confiança depositada durante todos estes anos. Meus agradecimentos por todas as plavaras de incentivo e também pelas repreensões, ou seja, por todos os ensinamentos os quais me fizeram amadurecer nesses anos. Para mim sempre foi uma honra dizer a todos que sou sua orientada e, da experiência no laboratório desde 2006, levo o exemplo de competência que sempre foi a sua maior característica. Meu muito obrigada por tudo!
A minha segunda família, a equipe do LCGA, meu vocabulário é muito limitado para que eu consiga expressar com palavras toda a minha gratidão e carinho por todos vocês. Agradeço a TODOS, aos antigos e aos novos, os quais contribuíram direta ou indiretamente com a conclusão de mais uma etapa, mas também pela contribuição na minha vida. Minha especial gratidão a Thibério, que é meu colega desde o início, que me ajuda desde 2006, aguenta meu chororô desde então e sempre o povo vai saindo e a gente restando kkk. Especial obrigada a Ana Liza e Gislayne Peixoto (Aninha e Gy), por toda a contribuição não só nos perrengues do lab, mas principalmente pelo suporte e ajuda psicológica (heheh) durante todo esse tempo. Com certeza sem vocês tudo teria sido muito mais difícil ou até impossível, portanto meu muito obrigada por TUDO! Não menos especial é o meu agradecimento a três anjinhos que me ajudaram DEMAIS principalmente nessa reta final, Andréia, Lívia e minha “pupila” Camila. Muitissimo obrigada por tudo, pelo suporte dentro e fora do lab, Camila, coitadinha, madrugada a dentro conferindo as referencias comigo!!! Muito muito obrigada Keilla por toda a paciência, pelos excelentes conselhos desde o mestrado! Agradeço ainda a Constância por todo o apoio técnico e pelos conselhos e palavras sábias nos momentos mais críticos (kkk).
Ao meu coorientador de sempre, o prof Dr Moacir e toda sua equipe, meus agradecimentos por sempre estarem a disposição para colaborar, de forma imprescindível durante todas as etapas do experimento (coletas, no processamento das amostras, na redação...). Meu agradecimento especial ao Sr Almeida por estar sempre disposto a ajudar, seja nos fins de semana, feriado, férias e sempre de bom humor!!! Meu obrigada aos alunos do prof Moacir, especialmente a Felipe Venceslau por toda a contribuição ao longo desses anos e pela paciência, principalmente nos momentos do processamento das amostras.
Ao prof. Dr. José Ricardo de Figueiredo e a profa. Dra. Ana Paula Ribeiro Rodrigues, meus eternos coorientadoes, e sua equipe (LAMOFOPA-UECE), por terem me recebido tão bem durante os experimentos, por me proporcionarem a oportunidade de trabalhar em conjunto com uma equipe tão eficiente! A todos os integrantes do LAMOFOPA, em especial a Dra Ticiana, Dra Valdevane, a Simone, a Rebecca, a Laritza e Giovanna, por toda ajuda e pela amizade em todos os momentos, meus sinceros agradecimentos.
palavras para expressar todo o amor e carinho que tenho por vocês, sem dúvidas a minha vida seria em tons de cinza sem vocês!
Agradeço ainda a profa Dra Carolina Madeira Lucci e sua equipe que me receberam tão bem na Universidade de Brasília. Muito obrigada pela ajuda e pela mobilização de toda a equipe, que em pouco tempo tentaram contornar as dificuldades encontradas na microscopia eletrônica das amostras.
Meu obrigada a meu outro anjinho Wesley de Paiva, por todo o apoio nas aulas, sem sua ajuda tenho mais do que certeza de que não teria conseguido chegar até aqui! Agradecimento especial ao prof Francisco Silvestre por ter me incentivado nas horas em que me sentimais incapaz, mais diminuída, por me mostrar que posso alcançar meus objetivos. A Arthur Brilhante, por todo o apoio, por me mostrar a luz no fim do túnel quando tudo parecia apenas desespero, por me alegrar com usas brincadeiras nas horas em que estava mais pra baixo.
Meu agradecimento mais mais do que especial a profa Dra. Alexsandra Pereira, que em tão pouco tempo se tornou tão especial na minha vida. Meus sinceros agradecimentos por toda a sabedoria, por toda a paciência, por me emprestar seus ouvidos para as minhas choradeiras (kkk), que Deus continue te iluminando mais e mais, pois você é uma pessoa iluminada, continue sendo essa pessoa tão sábia, que cativa todos ao seu redor. Muitissimo obrigada por tudo. Meu agradecimento a profa Nilza Dutra, pelo exemplo de determinação e força, por ser uma pessoa tão disposta a sempre ajudar. Agradeço de todo o coração pelas palavras, pelos conselhos e pela ajuda em todos os momentos! Seja sempre este exemplo de amor com os animais.
A todos os meus amigos que smepre estiveram presentes na alegria e na tristeza, na saúde e na doença (kkk), esse nosso “relacionamento” tão antigo (desde 2004) e tão maravilhoso! Apesar da família ter aumentado, sempre seremos as 7!!! Amo todas vocês! Minha gratidão eterna a Maria Alice, Carla Monadeli, Fabrícia Filgueira, Geyanna e Gezanna Nunes, Isabella Barros, Leíse Gomes e Maíra Lima, por terem sido uma verdadeira família durante todo esse tempo.
Aos componentes da banca por terem aceitado o convite de participarem deste momento tão importante da minha vida.
E para finalizar, minha gratidão eterna aos animais, em especial aos meus bebês (Pandoro, Mio, Mia, Mica e Amy) e aos animais que contribuíram para os experimentos, minha fonte de inspiração, minha razão por estar aqui concluindo este módulo da vida. Minha gratidão diária pela lição de amor e respeito, por me fazerem ver a cada dia como temos que melhora, como ainda temos o que aprender para chegarmos perto de ser um ser tão superior, tão sublime. Sem eles nada disso teria sentido.
Agradeço a todos que contribuíram direta ou indiretamente para este momento!
Lima, G L. CONSERVAÇÃO DE MATERIAL GENÉTICO DE ESPÉCIES SILVESTRES DO BIOMA CAATINGA UTILIZANDO A MANIPULAÇÃO DE OÓCITOS INCLUSOS EM FOLÍCULOS OVARIANOS PRÉ ANTRAIS (MOIFOPA)
RESUMO - O objetivo da presente tese foi utilizar a manipulação de oócitos inclusos em folículos ovarianos pré antrais (MOIFOPA) como ferramenta para o resgate e otimização do uso de gametas femininos oriundos de espécies silvestres do bioma Caatinga. A tese foi dividida em quatro experimentos. No primeiro, foi realizada a estimativa e descrição das características histológicas e ultraestruturas dos folículos pré antrais (FOPA) de cutias (Dasyprocta leporina), nos quais foram estimados 4419.8 ± 532.26 e 5397.52 ± 574.91
folículos para os ovários direito e esquerdo, respectivamente, sendo a maioria (86,63%) pertencente a categoria de folículos primordiais (P<0,05). A maior parte da população consiste de folículos morfologicamente normais (70,78%), apresentando núcleo oocitário grande e central, com citoplasma uniforme. Na avaliação ultraestrutural verificou-se a presença de um grande número de mitocôndrias arredondadas e gotas de lipídios. No segundo experimento, foi realizada a estimativa e a descrição das características dos FOPA de preás (Galea spixii), bem como avaliação do efeito da vitrificação em superfície
sólida (VSS) sobre a morfologia de FOPA in situ. O total de 416,0 ± 342,8 FOPA foi
estimado por par de ovários e a presença de uma grande quantidade de folículos primários foi evidenciada (P<0,05). A maior parte dos FOPA apresentou-se morfologicamente normal (94,6%), possuindo núcleo oocitário contendo grânulos condensados de heterocromatina. Mitocôndrias com formato arredondado ou alongado representaram as organelas mais abundantes. Quanto a VSS, o protocolo utilizando o dimetilsulfóxido (DMSO) 3M possibilitou a preservação de 69,5% de FOPA morfologicamente normais, sendo evidenciado através da análise por microscopia de luz e eletrônica de transmissão. No terceiro experimento, foi realizada a avaliação do efeito da VSS sobre a morfologia e viabilidade de FOPA in situ de catetos (Pecari tajacu). Não foram observadas diferenças
entre os tratamentos, onde o uso dos crioprotetores DMSO, etilenoglicol (EG) e dimetilformamida (DMF), independente da concentração utilizada (3 ou 6 M) promoveu a preservação da morfologia de mais de 70% dos FOPA. Quanto a viabilidade, os crioprotetores DMSO e EG, demonstraram melhor manutenção da mesma. O quarto experimento teve por objetivo avaliar o efeito do α MEM+ ou TCM199 associados ou não a 50 ng de FSHr sobre a morfologia, ativação e crescimento de FOPA de catetos, cultivados in vitro (CIV) durante 1 ou 7 dias e o efeito sobre a matriz extracelular (MEC).
Após 7 dias de CIV apenas o TCM199/FSH manteve a proporção de FOPA intactos similar ao dia 1 (63,2%), contudo nenhuma diferença foi observada entre os tratamentos (P>0,05). Adicionalmente, um aumento na proporção de FOPA em desenvolvimento foi verificada (P>0.05). Através da análise com Ag-NOR, observou-se que apenas o tratamento com TCM199/FSH manteve a proporção de proliferação celular similar ao dia 1 (P>0.05). A coloração com picrosirius red revelou que a MEC permaneceu intacta em todos os tratamentos (P>0.05). Assim, como conclusão geral, o uso da MOIFOPA nas referidas espécies permitiu o conhecimento de aspectos relacionados a sua morfofisiologia reprodutiva, possibilitando tanto a conservação do material genético destas espécies, com a possibilidade de formação de bancos de germoplasma, como a elucidação de mecanismos relacionados a sobrevivência e desenvolvimento dos FOPA in vitro.
Palavras-Chave: folículos pré antrais, vitrificação em superfície sólida, cultivo in vitro,
Lima, G L. GERMPLASM CONSERVATION FROM WILD SPECIES OF CAATINGA BIOME USING THE MANIPULATION OF OOCYTES ENCLOSED IN PREANTRAL FOLLICLES (MOEPF)
Abstract – The objective of the present thesis was to use the manipulation of oocytes enclosed in preantral follicles (MOEPF) as a tool for the female gametes rescue and optimization, from wild species of Caatinga biome. The thesis was divided into 4 experiments. At first experiment, it was performed the estimative and description of the agouti (Dasyprocta leporina) preantral follicles (PF) histologic and ultrastructural
features, in which it was estimated 4419.8 ± 532.26 and 5397.52 ± 574.91 follicles for the right and left ovary, respectively, and the majority (86,63%) belonged to the primordial follicles category (P<0.05). Most of the population consists of morphologically normal follicles (70.78%), presenting a large and central nuclei and uniform cytoplasm. At ultrastructural evaluation it was verified the presence of a great number of round mitochondrias associated to lipid droplets. In the second experiment, it was performed the estimative and description of yellow-toothed cavies (Galea spixii) PF
characteristics, also, the evaluation of the effect of solid surface vitrification (SSV) on the
in situ PF morphology. The total of 416.0 ± 342.8 PF was estimated for the ovary pair
and the presence of a large quantity of primary follicles (P<0.05) was evidenced. Most of the PF was morphologically normal (94.6%), in which the oocyte nuclei presented condensed granules of heterochromatin. Round or elongated shaped mitochondria constituted the most abundant organelles. In regard of the SSV, the protocol using the dimethylsulfoxide (DMSO) 3M possibility the preservation of 69.5% of morphologically normal PF, which was evidenced by the light and transmission electronic microscopy. At third experiment, the evaluation of the SSV procedure on the morphology and viability
in situ PF form collared peccaries (Pecari tajacu) was performed. No differences were
observed among treatments, in which the use of DMSO, ethylene glycol (EG) and dimethylformamide (DMF) as cryoprotectants, regardless its concentration, promoted the morphology preservation of much than 70% of PF. Concerning the PF viability, the DMSO and EG promoted the best preservation. The fourth experiment aimed to evaluate the effect of α MEM+ or TCM199 associated or not to 50 ng of FSHr on the morphology, activation and growth of collared peccaries PF, in vitro cultured (IVC) during 1 or 7 days
and the effect on the extracellular matrix (ECM). After 7 days of IVC only the use of TCM199/FSH maintained the proportion of intact PF, similar to day 1(63.2%), however, no differences were observed among treatments (P>0.05). Also, an improvement of the proportion of intact growing PF was verified (P>0.05). By the Ag-NOR analysis it was observed that only the treatment using TCM199/FSH promoted the maintenance of cell proliferation similar to day 1 (P>0.05). The picrosirius red stain revealed that ECM remained intact in all treatments (P>0.05). Thus, as the general conclusion, the use of MOEPF in the refereed species allowed the knowledge of aspects related to its reproductive morphology and physiology, enabling the germplasm conservation, with the possibility of germplasm bank formation, as the elucidation of mechanisms related to the PF survive and in vitro development.
Keywords: preantral follicles, solid surface vitrification, in vitro culture, FSHr, α MEM+,
LISTA DE ABREVIATURAS E SIGLAS
% Porcentagem
± Mais ou menos
< Menor
> Maior
~ Semelhante
μg/mL Micrograma por mililitro
ºC Graus Celsius
°C/min Graus Celsius por minuto
µm Micrômetro
α MEM+ Meio Essencial Mínimo alfa
ANOVA Análise de Variância
Ag-NOR Regiões organizadoras de nucléolo argentafins
ATRs Técnicas de Reprodução Assistida
bm Membrana Basal
BMPs 4 Proteínas Morfogenéticas Ósseas 4
BMPs 7 Proteínas Morfogenéticas Ósseas 7
BMPs 15 Proteínas Morfogenéticas Ósseas 15
CIV Cultivo in vitro
CL Corpora Lutea
cm Centímetros
CPA Crioprotetor
DAB Diaminobenzidine
DMF Dimetilformamida
DMSO Dimetilsulfóxido
EG Etilenoglicol
EGF Fator de Crescimento Epidermal
ECM Matriz Extracelular Ovariana
FCS foetal calf serum
FGF Fator de Crescimento Fibroblástico
Fig Figura
FSH Hormônio Folículo Estimulante
FSHr Recombinant follicle stimulating hormone (hormônio folículo estimulante recombinante)
G Grama
GC Células da Granulosa
GCC Células da Granulosa com citoplasma
GCN Células da Granulosa com núcleo
GDF- 9 Fator de Crescimento e Diferenciação 9
GPx Glutationa Peroxidase
h Hora
ICMbio Instituto Chico Mendes de Conservação da Biodiversidade ICSI Injeção Intracitoplasmática de Espermatozoides
IGFs 1 Fatores de Crescimento Semelhantes à Insulina 1 IGFs 2 Fatores de Crescimento Semelhantes à Insulina 2
IgG Immunoglobulin G
iPS Induced pluripotent stem cells (células tronco pluripotentes induzidas)
ITS Insulina, Transferrina e Selênio
IVC In vitro culture
IVF In vitro fertilization
IUCN (International Union for Conservation of Nature) União Internacional de Conservação da Natureza
Kg Kilograma
KGF Fator de Crescimento de Queratinócitos
KL Quilolitros
Km Quilômetros
Km² Quilômetros Quadrados
kV Quilovolt
LAMOFOPA Laboratório de Manipulação de Folículos Ovarianos Pré Antrais
Li Gotas de Lipídios
LN2 Nitrogênio Liquido
M Molar
MIV Maturação in vitro
MEC Matriz Extracelular
MEM Meio Essencial minimo
mL Mililitro
MOIFOPA Manipulação de Oócitos Inclusos em Folículos Ovarianos Pré Antrais
mm3 Milimetros cubrico
M Mitocôndria
min Minutos
Mm Milimolar
MNPF Morfologia Normal dos Folículos Pré Antrais
mol/L Mol por litro
nº número
NASA Administração Nacional do Espaço e da Aeronáutica
ng Nanograma
Nm Nanômetro
ON Núcleo do Oócito
NOR Regiões Organizadoras de Nucléolos
OPS Open Pulled Straw
PBS Solução salina fosfatada tamponada
PCNA Antígeno Nuclear de Proliferação Celular
PFs Folículos pré – antrais
pg/ml Picograma por mililitro
pH Potencial hidrogeniônico
PrOH Propaneodiol
RENORBIO Rede Nordeste de Biotecnologia
RN Rio Grande do Norte
RNA Ácido Ribonucleico
ROS Espécies Reativas ao Oxigênio
RT Temperatura Ambiente
s Segundos
SDS Dodecil sulfato de sódio
SEM Erro Padrão e Média
SF Congelamento lento
SUC Suplementado com Sacarose
TCM199 Meio de Cultivo Celular 199
TEM Microscopia de Transmissão Eletrônica
TES Tris – metil- aminoetano
Tris Tris-hidroximetil-aminomethane
UECE Universidade Estadual do Ceará
VEGF Fator de Crescimento de Endotélio Vascular
VIP Peptídeo Intestinal Vasoativo
VSS Vitrificação em Superfície Sólida
UFERSA Universidade Federal Rural do Semi-árido
LISTA DE FIGURAS
Figura 1. Exemplar de cateto (Pecari tajacu) adulto criado em cativeiro... 24
Figura 2: Folículos pré antrais de catetos (Pecari tajacu). Folículos primordiais
(A), folículos pluriovulares (B), contento 2 oócitos. Hematoxilina eosina. Barra de escala: 50µm... 26
Figura 3: Exemplar de cutia (Dasyprocta leporina) adulto cirado em
cativeiro... 27
Figura 4: Par de ovários de cutias (Dasyprocta leporina)... 29
Figura 5: Exemplar de preá (Galea spixii) adulto criado em cativeiro... 30
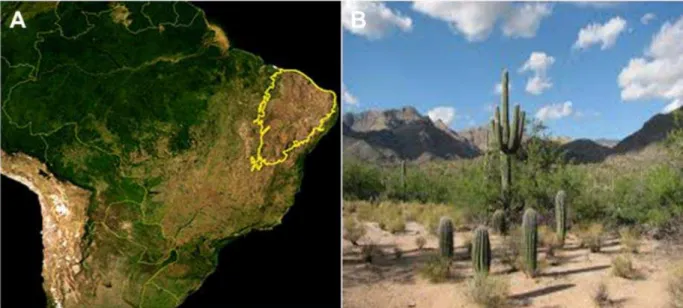
Figura 6: Localização do bioma da Caatinga como definido pelo IBAMA. Imagem de satélite da NASA (A). Vegetação típica da Caatinga, composta por plantas xerófilas (B)... 32
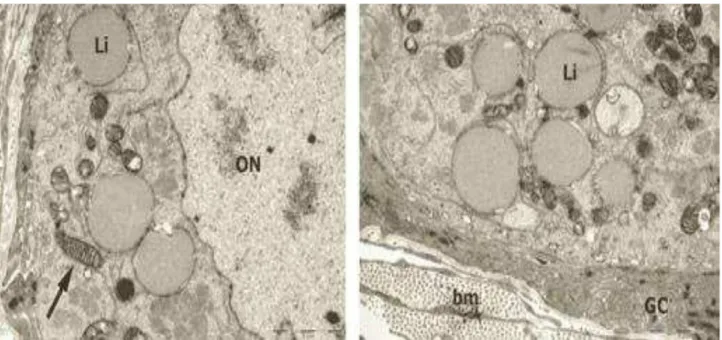
Figura 7: Micrografias eletrônicas de folículos ovarianos de catetos (Pecari tajacu). ON, núcleo do oócito; Li, gotas de lipídios; mitocôndrias (setas); GC,
células da granulosa; bm, membrana basal... 44
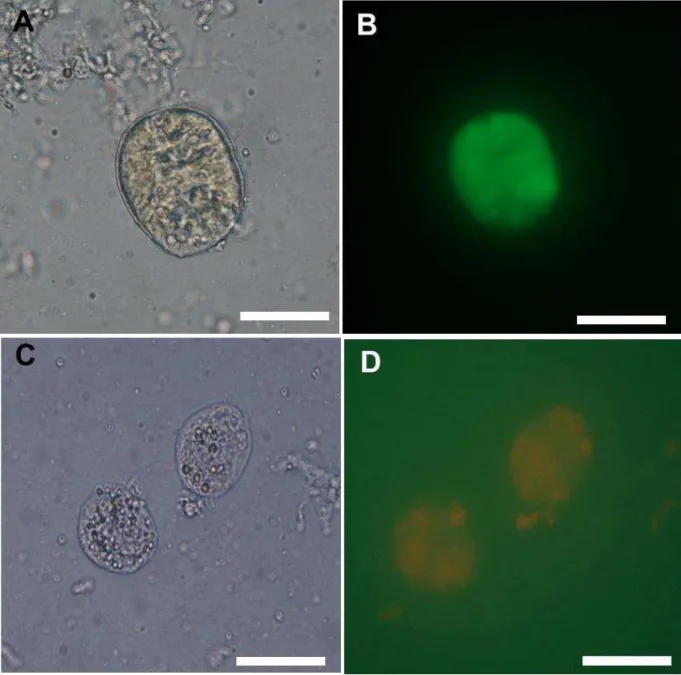
Figura 8: Fotomicrografias de folículos pré antrais isolados de catetos (Pecari tajacu) e submetidos a análise por microscopia de fluorescência, utilizando-se os
fluoróforos calceína – AM e iodeto de propídio. Folículos pré antrais viáveis sob microscópio de luz invertido (A e C) são marcados com calceína - AM (B) enquanto os não viáveis (D) marcados com iodeto de propídio (D). Barra de escala: 20 µm...
45
Figura 9: Fotomicrografias de folículos pré antrais de catetos (Pecari tajacu),
marcados com Ag-NOR (A) e PCNA (B), indicando proliferação das células da granulsoa... 46
Figura 10: Fotomicrografia de tecido ovariano de catetos (Pecari tajacu) cujas
fibras de colágenos apresentam-se coradas com picrosirius red. Barra de escala: 50µm ... 47
CAPÍTULO 2
Figure 1. Histological assessment of ovary of Dasyprocta Leporina. Germinative
epithelium (arrow), tunica albuginea (*), stroma (S) and follicles (full narrows).
(40x). Scale bar: 50 µm………... 100
Figure 2. Histological features of agouti (Dasyprocta leporina) ovary. Primordial
fusiform cells appearing as concentric layers externally at the granulosa layers. (D) polyovular follicles (arrow) containing two oocytes surrounded by only one
layer of granulosa cells. Scale bar: 50 µm………... 101
Figure 3. Histological features of agouti (Dasyprocta leporina) ovary.
Degenerated follicles presenting oocyte shrinkage (arrows). Scale bar: 50 µm….. 103
Fig. 4. Electron micrographs of ovarian follicles of Dasyprocta leporina. ON,
nuclei oocyte; n, nucleolus. Li, lipid droplets; mitochondria (m), GA, Golgi
apparatus; * vacuoles. GC, granulosa cell………... 104
Fig. 5. Electron micrographs of ovarian follicles of Dasyprocta leporina. (a) ON,
oocyte nuclei; Li, lipid droplets; mitochondria (m) (b) GCN, granulosa cell nuclei; GCC, granulosa cel cytoplasm; intercellular junctions (arrows) between
granulosa cell……….. 104
CAPÍTULO 3
Fig. 1. Photomicrographs of Galea spixii ovarian sections. Aggregates of
primordial follicles displaying an oocyte surrounded by one layer of flattened cells (full arrows) and primary follicle, displaying an oocyte with homogenous cytoplasm surrounded by one complete layer of cuboidal granulosa cells (head arrow – A). Secondary follicle showing two or more layers of cuboidal granulosa cells (B). Polyovular follicle (arrows) containing two oocytes surrounded by only one layer of granulosa cells (C). Degenerated follicles displaying oocyte cytoplasm retraction and disorganization of granulosa cells
(D)……….. 124
Fig. 2. Electron micrographs of ovarian primordial follicles of Galea spixii. (A)
ON, oocyte nuclei; m, round mitochondrias; GN, flattened nuclei of granulosa cell surrounding the oocyte. (B) n, nucleoulus; heterochromatin clumps (arrowhead); nuclei pores (full arrows); m, mitochondrias; Li, lipid droplets; few
profiles of endoplasmic reticulum (arrow)……… 125
Fig. 3. Electron micrographs of ovarian primary follicles of Galea spixii. (A) ON,
irregular oocyte nuclei; m, elongated mitochondrias associated to (Li) lipid droplets (B) OC, oocyte cytoplasm; GN, cuboidal nuclei of granulosa cell
surrounding the oocyte………... 126
Fig. 4. Electron micrographs of ovarian follicles of Galea spixii after
vitrification. (A)* vacuoles; mitochondrias (arrows); GN, nuclei of granulosa cell surrounding the oocyte. (B) swollen mitochondrias (arrows)………... 127 Fig. 5. Photomicrographs of fresh and vitrified ovarian sections from yellow-toothed cavies (Galea spixii). Morphologically normal preantral follicles before
(full arrows - A) and after vitrification (B). Note the presence of pluriovular follicles (arrowhead – A). Degenerated follicles displaying oocyte cytoplasm retraction retraction and disorganization of granulosa cells layers, after
vitrification (arrows - C)………. 128
Fig 1. Photomicrographs of fresh and vitrified ovarian sections from Pecari tajacu. Morphologically normal preantral follicles before (A) and after
vitrification (B). Degenerated follicles displaying oocyte cytoplasm retraction and disorganization of granulosa cells layers, after vitrification (arrows - C)... 147 Fig. 2. Electron micrographs of Pecari tajacu ovarian follicles before (A) and
after vitrification (B and C). (A) oocyte nuclei (ON), granulosa cells (GC), lipid droplets (Li) and round mitochondria (arrows) were the most abundant organelles. (B) Some vacuoles (*) and swollen mitochondrias (arrows) were observed after vitrification process. (C) A few alterations (*) was observed in Lipid droplets (Li) distributed among oocyte cytoplasm (OC)………... 148
CAPÍTULO 5
Figure 1.Histological features of collared peccaries ovarian preantral follicles. Normal follicles from non-cultured group (A), after 1 (C) and 7 days (D) exhibited ocyte with homogenous cytoplasm (Oc), central nucleus (N) and intact and organized granulosa cells (GC). Degenerated follicle from non-cultured (B) showed cytoplasmic retraction (arrow) or disorganization of granulosa cells. Hematoxylin- eosin stain. Scale bar: 50 µm... 168
Figure 2.Percentages of primordial follicles in the fresh control (noncultured tissue) and 1 or 7 day cultured tissue in MEM or TCM199 medium containing FSH or not. * differs significantly from control follicles (P<0.05). a,b – indicates differences in the same treatment at different days of IVC. A-C - indicates differences in the same day of IVC among treatments……… 170
Figure 3. Percentages of growing follicles in the fresh control (noncultured tissue) and 1 or 7 day cultured tissue in MEM or TCM199 medium containing FSH or not. * differs significantly from control follicles (P<0.05). a,b – indicates differences in the same treatment at different days of IVC. A-C - indicates differences in the same day of IVC among treatments……….. 171
Figure 4. Photomicrograph of Ag-NOR and immunohistochemistry for PCNA o collared peccaries ovarian preantral follicles. A,B,C – PFs exhibiting NOR (arrows) on granulosa cells before and after I or 7 days of IVC, respectively. D,E – PFs showing a few granulosa cells labelled with PCNA before and after 7 days of IVC, respectively. F – note PCNA staining in the oocytes from primordial follicles of collared peccaries. Scale bar: A - C 20 µm; D – F 50 µm………... 172
Figure 5.Percentage of collagen in the collared pecaries ovarian tissue analyzed by picrosirius red technique. * differs significantly from control follicles (P<0.05). a,b – indicates differences in the same treatment at different days of IVC. A-C - indicates differences in the same day of IVC among treatments……... 174
Figure 6. Collagen fibers labelled by picrosirius red stain. Note the fibers stained in red in collared peccaries ovarian tissue before (A) and after 1 (B) or 7 days
LISTA DE TABELAS
CAPÍTULO 2
Table 1. Preantral follicular population (Mean ± standard error) of agouti (Dasyprocta leporina) ovaries at different categories of follicles……… 102
Table 2 – Diameter of ovarian preantral follicles, oocytes and nuclei (µm) from (Dasyprocta leporina), among follicle categories (mean ± standard error)……… 102
CAPÍTULO 3
Table 1. Preantral follicular population (Mean ± standard error) of Spixi’s yellow-toothed cavies (Galea spixii) ovaries (n = 6 pairs) at different categories
of follicles……….. 123
Table 2. Diameter of ovarian preantral follicles, oocytes and nuclei (µm) from Spixi’s yellow-toothed cavies (Galea spixii), among follicle categories (mean ±
standard error)……… 123
Table 3. Percentage (normal/total) of morphologically normal ovarian preantral follicles from Spixi’s yellow-toothed cavies (Galea spixii) from control and after
solid surface vitrification (SSV)……….. 127
CAPÍTULO 4
Table 1. Percentage (normal/total) of morphologically normal ovarian preantral follicles from collared peccaries (Pecari tajacu) from control and after solid
surface vitrification (SSV) using 3 or 6M of dimethylsulfoxide (DMSO),
ethylene glycol (EG) and dimethylformamide (DMF)………... 148
Table 2. Percentage (viable/total) of viable ovarian preantral follicles from collared peccaries (Pecari tajacu) from control and after solid surface
vitrification (SSV) using 3 or 6 M of dimethylsulfoxide (DMSO), ethylene glycol
(EG) and dimethylformamide (DMF)……… 149
CAPÍTULO 5
Table 2: Average of development organizing regions of nucleolus (NORs) per nucleus of granulosa cells of collared peccaries preantral follicles before (control group – uncultured) and after in vitro culture…... 173
SUMÁRIO
1. INTRODUÇÃO... 22
2. REVISÃO DE LITERATURA... 24
2.1. CARACTERÍSTICAS GERAIS E REPRODUTIVAS DAS FÊMEAS SILVESTRES EM ESTUDO... 24
2.1.1 Catetos... 24
2.1.2 Cutias... 26
2.1.3 Preás... 30
2.2. IMPORTÂNCIA ECOLÓGICA E PRODUTIVA DESTAS ESPÉCIES... 31
2.2.1 Importância do cateto... 33
2.2.2 Importância das Cutias e dos Preás... 34
2.3. ASPECTOS GERAIS E IMPORTÂNCIA DA MANIPULAÇÃO DE OÓCITOS INCLUSOS EM FOLÍCULOS OVARIANOS PRÉ-ANTRAIS (MOIFOPA) ... 35
2.3.1. Caracterização e estimativa da população folicular ovariana... 37
2.3.2. Criopreservação de tecido ovariano... 38
2.3.3. Cultivo in vitro de gametas femininos... 40
2.3.4. Métodos para avaliação da morfologia e viabilidade folicular.... 43
3. JUSTIFICATIVA……….. 48
4. HIPÓTESES CIENTÍFICAS... 50
5. OBJETIVOS... 51
6. REFERÊNCIAS BIBLIOGRÁFICAS... 52
7. CAPÍTULO 1 CRYOPRESERVATION IN MAMMALIAN CONSERVATION BIOLOGY: CURRENT APPLICATIONS AND POTENTIAL UTILITY…… 72
8. CAPÍTULO 2 MORPHOMETRY, ESTIMATION AND ULTRASTRUCTURE OF OVARIAN PREANTRAL FOLLICLE POPULATION IN AGOUTI (Dasyprocta leporina)... 94
VITRIFICATION OF COLLARED PECCARIES OVARIAN TISSUE (Pecari tajacu Linneaus, 1758) USING DISTINCT CRIOPROTECTANTS… 139 11.CAPÍTULO 5
IN VITRO DEVELOPMENT OF COLLARED PECCARIES (Pecari tajacu)
OVARIAN PREANTRAL FOLLICLES………... 157
12.CONCLUSÕES... 187
13.PERSPECTIVAS... 188
ANEXOS... 189
ANEXO I – CARTA DE SUBMISSÃO DOS ARTIGOS ... 190
22
1. INTRODUÇÃO
O Brasil apresenta-se como um dos principais alvos do desmatamento e caça predatória, uma vez que está estre os países mais ricos em biodiversidade (MITTERMEIER et al., 2005). Notavelmente, o bioma Caatinga é o único considerado exclusivamente brasileiro, correspondendo a 11% do território nacional e o mais alterado pela ação humana (SILVA et al., 2003a). Dentre as espécies encontradas neste bioma, destacam-se os catetos (Pecari tajacu), cutias (Dasyprocta leporina) e preás (Galea spixii), as quais têm sido caçadas pela população local para serem utilizadas como uma
fonte alternativa de proteína animal (SILVA et al., 2010). Estes animais possuem uma importante função ecológica, atuando diretamente na dinâmica das populações vegetais e animais (FONTANA et al., 2003; FONSECA et al., 1994), podendo ainda constituir modelos experimentais para outras espécies de ungulados e roedores que estão vulneráveis a extinção (PUKAZHENTHI et al., 2006). Os catetos, por exemplo, apesar de terem sua população mundial classificada como estável (IUCN, 2014), tem desaparecido do seu habitat natural em algumas regiões do Brasil como os biomas Mata Atlântica e Caatinga (GONGORA et al., 2011).
Nesse contexto, estratégias de conservação in situ, como a preservação dos habitats, são as melhores formas de conservação da diversidade biológica, por permitirem
a continuação dos processos evolucionários naturais (ANDRABI; MAXWELL, 2007). Contudo, elas podem ser ineficientes em casos de populações reduzidas ou quando a maioria de indivíduos remanescentes está localizada em áreas desprotegidas (COSTA; MARTINS 2008).Assim, uma grande atenção vem sendo dada a métodos e técnicas de manutenção de espécies ex situ, seja in vivo ou in vitro (COMIZZOLI et al., 2010),
merecendo destaque a criação de bancos de germoplasma (SILVA et al., 2012). Entretanto, como a maioria dos trabalhos está voltada para a manipulação e conservação de gametas masculinos (; CASTELO et al., 2010; BEZERRA et al., 2014; SANTOS et al., 2014a; COSTA et al. 2014; SILVA et al., 2014; CAMPOS et al., 2014; SILVA et al., 2013), informações a respeito do desenvolvimento e aplicações de biotécnicas relacionadas às fêmeas ainda são escassas (LIMA et al., 2013, 2014; PRAXEDES et al., 2014; WANDERLEY et al., 2012).
23
ferramentas para o resgate e preservação de material genético oriundo de animais silvestres (STOOPS et al., 2011). Porém, a disponibilidade de oócitos consiste em um fator limitante (SMITZ E CORTVRINDT, 2002), uma vez que estas técnicas requerem oócitos competentes oriundos de folículos antrais ou pré ovulatórios, os quais estão presentes em pequenas quantidades no ovário (ROSSETTO et al. 2009). Uma alternativa seria o uso de oócitos provenientes de folículos pré antrais (FOPA), os quais representam em torno de 95% de toda a população de folículos do ovário (SILVA et al., 2003b). Dessa forma, muitos esforços são destinados ao desenvolvimento e adaptação de sistemas eficientes de CIV, tanto em espécies domésticas como silvestres (MAGALHÃES et al., 2009; XU et al., 2011; YIN et al., 2013), permitindo ainda a obtenção de informações acerca dos mecanismos envolvidos na foliculogênese. Contudo, as condições necessárias para o desenvolvimento completo dos FOPAs in vitro ainda não são conhecidas,
especialmente para as espécies silvestres (MATOS et al., 2007a).
Nesse sentido, visando a otimização do uso desse material genético vem sendo desenvolvida a biotécnica de MOIFOPA, a qual tem por objetivo o resgate e a manipulação in vitro de FOPA visando o seu crescimento e maturação, quando não é mais
possível acontecer esses eventos no próprio ovário (FIGUEIREDO et al., 2008). Em geral, é uma ferramenta importante para conhecer as características da população ovariana das diferentes espécies (LOPES et al., 2006; DAVOODIAN et al., 2011), bem como sua foliculogênese avaliando o efeito de diferentes substâncias (gonadotrofinas, fatores intra-ovarianos) no desenvolvimento oocitário inicial (FIGUEIREDO et al., 2007a). Além disso, esta biotécnica abrange a criopreservação de tecido ovariano (SANTOS et al., 2008), sendo esta uma etapa importante, uma vez que poderá manter a viabilidade folicular até que seja realizado o CIV ou transplante ovariano (FAUSTINO et al., 2011).
24
2. REVISÃO DE LITERATURA
2.1 Características gerais e reprodutivas das fêmeas em estudo
2.1.1. Catetos
Os catetos (Pecari tajacu Linneaus, 1758) (Figura 1), conhecidos popularmente
como caititus, porcos-do-mato ou pecaris, pertencem à ordem dos Artiodactila, subordem Suiforme, família dos Tayassuideos e gênero Pecari (GRUBB, 2005). Nessa família,
ainda são encontradas duas outras espécies, o queixada (Tayassu pecari) e o taguá
(Catagonus wagneri), sendo que no Brasil, ocorre naturalmente apenas o cateto e o
queixada (GONGORA et al., 2011).
Figura 1. Exemplar de cateto (Pecari tajacu Linneaus, 1758) adulto mantido em cativeiro.
25
dorsal próximo à cauda, cuja secreção tem odor forte e coloração esbranquiçada (SOWLS, 1984), com importante papel no reconhecimento individual e movimento do bando (WALLACH; BOEVER, 1983).
Cada indivíduo pode pesar até 30 Kg (SOWLS, 1997), sendo o seu peso médio de 15-28 Kg (BODMER; SOWL, 1993). Em geral vivem aproximadamente 15 anos na natureza e em cativeiro até 24 anos (MENA et al., 2000). Os machos e as fêmeas são bem parecidos em tamanho e coloração dos pelos, contudo os jovens possuem uma cor marrom amarelada com uma faixa preta no membro posterior. A única diferença visual externa entre machos e fêmeas é a presença do escroto no macho (WALLACH et al., 1983). A maturidade sexual nos machos é atingida aos 11 meses e a das fêmeas entre 8 e 14 meses MAYOR et al., 2004).
As fêmeas são classificadas como poliéstricas não estacionais, sendo capazes de reproduzir durante todo o ano (MAYOR et al., 2004). Seu ciclo estral nas regiões tropicais tem duração de 22,6 a 38 dias, com ovulação espontânea (PINHEIRO et al, 2001) e apresenta taxa de duas ovulações por ciclo (MAYOR et al., 2004).
Animais mantidos em cativeiro na caatinga apresentaram ciclo estral com duração média de 21,0 ± 5,7 dias, sendo aproximadamente seis dias de fase estrogênica, com valor médio de 55,6 pg/ml para este hormônio e 15 dias de fase progesterônica. Não foram verificadas correlações entre as dosagens de estrógeno e progesterona com as alterações na citologia vaginal. O acompanhamento da dinâmica folicular ovariana por meio de ultrassonografia é de difícil realização, devido, principalmente, ao reduzido tamanho do folículo pré-ovulatório (MAIA et al., 2014).
A receptividade sexual dura de 2 a 4 dias (MAYOR et al., 2007a; MAUGET et al., 1997) e a cópula ocorre entre os dias 1 e 2 após o pico de estradiol (MAYOR et al., 2007a). No dia da cópula, a vulva se mostra avermelhada, intumescida e com presença de muco. Após a cópula, em algumas fêmeas observa-se a presença de um tampão gelatinoso que sela a abertura vaginal. A média da duração da gestação é de 138 ± 5 dias (MAYOR et al., 2005), e o tamanho da ninhada é de 1,7 a 1,9 filhotes (GOTTDENKER E BODMER, 1998).
26
glândulas uterinas, a aréola. Onde ela é o único fator ultra-estrutural relacionado a transferência de materiais através do trofoblasto (SANTOS et al, 2002).
Especificamente sobre os gametas, foi realizada a estimativa da população folicular ovariana, sendo de 33.273,45 ± 3.019,30 folículos por ovário, dos quais a maioria pertence à categoria de folículo primordial (30.466,59 ± 5194,75 folículos - 91,56%). No ovário desta espécie, foi ainda descrita a presença de folículos pluriovulares (Figura 2) (LIMA et al., 2013). Neste mesmo estudo, as características ultraestruturais dos FOPA utilizando-se a microscopia eletrônica de transmissão foi descrita. Adicionalmente, salienta-se que estudos sobre a aplicação de biotécnicas que visem o aumento do potencial reprodutivo e a conservação dos gametas femininos dos P. tajacu
são ainda escassos, mas ressalta-se que são de grande importância tanto para a preservação da espécie, como para a sua manutenção em cativeiro.
Figura 2. Folículos pré antrais de catetos (Pecari tajacu Linneaus, 1758). Folículos
primordiais (A), folículos pluriovulares (B), contento 2 oócitos. Hematoxilina eosina. Barra de escala: 50 µm.
2.1.2. Cutias
27
família Dasyproctidae, gênero Dasyprocta spp. Esse gênero possui 11 espécies
registradas, porém existem muitos questionamentos a respeito dessa classificação, pois algumas espécies foram denominadas apenas com base na distribuição geográfica. Destas, sete espécies habitam o território brasileiro: Dasyprocta leporina; Dasyprocta coibae; Dasyprocta fuliginosa; Dasyprocta guamara; Dasyprocta leporina; Dasyprocta prymnolopha; Dasyprocta punctata. (IUCN, 2014), sendo as espécies Dasyprocta leporina e Dasyprocta prymnolopha as mais frequentes no Nordeste brasileiro (WOODS;
KILPATRICK, 2005).
Figura 3. Exemplar de cutia (Dasyprocta leporinaLichtenstein, 1823) adulto mantido em
cativeiro.
A espécie D. leporina, é uma das mais distintas do gênero (LANGE, 1998),
28
Este roedor possui tamanho médio de 50 cm de comprimento, do focinho a base da cauda. A altura média de uma cutia é 23 cm e seu peso varia entre 1,5 a 2,8 kg, seu corpo é espesso e sua cabeça, levemente alongada, sendo suas orelhas, relativamente pequenas. Adicionalmente, apresentam quatro dentes incisivos longos e curvos, cujas características macroscópicas revelam estrutura semelhante a de outros mamíferos (OLIVEIRA et al., 2012).
Para diferenciar os machos das fêmeas é necessário fazer sexagem pela palpação, onde se observa facilmente a diferença entre o pênis proeminente do macho e as duas pregas vaginais da fêmea, formando a vulva. A fase impúbere das cutias ocorre do nascimento até cinco meses de idade. Dos seis a oito meses ocorre a chamada fase de transição da pré-puberdade à puberdade, sendo esta atingida de nove a dez meses e a presença do macho pode influenciar no início da puberdade em fêmeas (GUIMARÃES et al. 2009).
Fêmeas de D. leporina, apresentam um ciclo sexual do tipo poliéstrico contínuo e
há presença de uma membrana de oclusão vaginal, o perineum ou opérculo, o qual só se
abre no estro e no parto (WEIR et al., 1971). Em estudo conduzido com animais da Caatinga verificou-se que o ciclo estral apresenta duração média de 28 dias com variação de 24 a 31 dias. Neste estudo, foi realizada a citologia vaginal esfoliativa para acompanhar o ciclo estral destas fêmeas e concluiu-se que esta é uma técnica eficiente para detectar as variações nas proporções de células vaginais durante o ciclo estral, permitindo a distinção das fases foliculares e luteínicas. Além disso, a ultrassonografia apresenta-se como uma ferramenta prática e confiável para a avaliação do ovário, porém, não proporciona um acompanhamento preciso da dinâmica das estruturas ovarianas, desse modo, não permitindo o monitoramento da ovulação (CAMPOS, 2013).
O período de gestação destes roedores oscila em torno de 104 dias e a quantidade de filhotes por parto varia de um a três, mas a maioria das fêmeas tem em média dois filhotes por parto, os quais possuem o corpo totalmente coberto de pêlos, os olhos abertos e se locomovem com facilidade (CHAVES & SANTOS, 2005). A ocorrência de estro pós parto já foi relatada nesta espécie, ocorredo entre os 18 e 20 dias pós parto (WEIR, 1971). Sua placenta possui uma forma esférica e uma estrutura lobada, estando conectada ao útero através da mesoplacenta (RODRIGUES et al., 2003).
29
superfície externa lisa com pequenas áreas translúcidas, sugestivas da presença de folículos em diferentes ordens.
Histologicamente, cada ovário apresenta-se organizado semelhante aos demais mamíferos domésticos, ou seja, revestido por epitélio cúbico simples, tendo como base uma camada de tecido conjuntivo rico em fibras, a qual penetra por meio da margem mesovárica, para o interior do órgão, conduzindo vasos sanguíneos. No gênero
Dasyprocta sp. foi descrita a presença de grande quantidade de corpos lúteos acessórios,
que possivelmente auxiliam na produção de progesterona durante a gestação (WEIR, 1971). Com relação aos dados morfométricos, o ovário direito apresenta em média um peso de 0,082 g; comprimento de 0,83 cm; largura de 0,49 cm e espessura de 0,24 cm, enquanto que o ovário esquerdo possui um peso de 0,058 g; comprimento de 0,74 cm; largura de 0,45 cm e espessura de 0,23 cm (ALMEIDA et al., 2003). Apesar de todas estas informações morfométricas, existe ainda uma carência de dados acerca das população folicular nesta espécie.
Figura 4. Par de ovários de cutias (Dasyprocta leporina).
Além disso, no que se refere à aplicação de biotécnicas, já foi descrita a criopreservação lenta de FOPA in situ de D. leporina criadas em cativeiro na Caatinga,
30
De acordo com o que foi abordado, as informações à respeito das características reprodutivas das fêmeas desta espécie são muito vagas e generalistas. Portanto, o desenvolvimento de biotécnicas que permitam a obtenção de maiores informações específicas sobre os gametas femininos da D. leporina permitiria a otimização do seu uso,
aumentando seu potencial produtivo e reprodutivo.
2.1.3. Preás
O preá (Galea spixii Wagler, 1831) (Figura 5) pertence à ordem Rodentia, a qual
é considerada a mais diversa e numerosa entre os mamíferos por apresentar 29 famílias, 380 gêneros e 1814 espécies. Ainda, a espécie pertence a infraordem Hystricognathi, família Caviidae, subfamília Caviinae e gênero Galea (REIS et al., 2006). O gênero Galea
Meyen, 1832 inclui atualmente quatro espécies viventes reconhecidas, G. musteloides
Meyen, 1832, G. spixii Wagler, 1831, G. flavidens Brandt, 1835 e G. monasteriensis
Solmsdorf et al., 2004.
Figura 5. Exemplar de preá (Galea spixii) adulto mantido em cativeiro.
31
de 375-405 g, respectivamente, sendo portanto muito menor que o porquinho da índia (Cavia porcellus) (OLIVEIRA et al., 2008). É um animal bastante sociável que se
reproduz em qualquer época do ano, até mesmo nas épocas secas e na ausência de abundância de alimento. As fêmeas podem, inclusive, manter a gestação mesmo sem condições nutricionais ideais (LARCHER, 1981).
Os preás atingem maturidade sexual em média aos 55-90 dias. As fêmeas tem ciclo estral com duração de 16 a 19 dias e estro de 6 a 11 dias, período de gestação em média de 68 dias (FMU, 2000), com ninhadas em média de dois a quatro filhotes (LARCHER, 1981), tendo o sistema de acasalamento classificado como poligâmicos (TARABORELLI & MORENO, 2009). Segundo Santos et. al. (2014b), os órgãos genitais femininos de G. spixiispixii adultas compreendem dois ovários com folículos em
diversos estados de desenvolvimento, estando localizado na região cortical com folículos primários vistos em maior número; a região medular é compreendida por vasos e tecidos finos. Ainda, é constituído por tubas uterinas, cujo epitélio e camada muscular se modificam ao longo das regiões do istmo, ampola e infundíbulo; útero duplo e dois cornos uterinos com glândulas, os quais se abrem em uma única cérvix, a qual se conecta com a vagina pelo fórnix; uma vagina com epitélio variado entre diferentes animais; uma vulva com clitóris transpassado pela uretra; ausência de vestíbulo vaginal e a presença de uma membrana de oclusão vaginal.
Assim, ainda não há estudos específicos sobre as características da população folicular ovariana desta espécie, assim como métodos que visem sua conservação, sendo estes de grande relevância para a preservação da espécie e aumento do seu potencial reprodutivo.
2.2. Importância ecológica e produtiva destas espécies
32
1% corresponde a conservação de proteção integral, as mais restritivas quanto ao uso (MINISTÉRIO DO MEIO AMBIENTE, 2000).
Figura 6. Localização do bioma da Caatinga segundo o IBAMA. Imagem de satélite da NASA (A). Vegetação típica da Caatinga, composta por plantas xerófilas (B). Fonte: domínio público.
Essa ação antrópica vem causando uma significativa redução da biodiversidade, com a diminuição da população de várias das cerca de 148 espécies de mamíferos que compõem a fauna desta região (OLIVEIRA et al., 2003), destacando-se nessa situação os catetos, cutias e preás (SILVA et al., 2010). Estes animais possuem importante função ecológica, podendo disseminar sementes de espécies vegetais pelas fezes (FONTANA et al., 2003) e podem atuar diretamente na dinâmica das populações vegetais em função da alimentação (FONSECA et al., 1994). Além de sua importância econômica e ecológica estes três animais podem constituir modelos experimentais para outras espécies de roedores e ungulados que estão vulneráveis a extinção.
33
2.2.1. Importância do cateto
O cateto desempenha importante função ecológica no equilíbrio e na composição de cadeias alimentares, participando da cadeia trófica como parte da dieta de grandes felinos (GARLA, 1998), podendo ainda atuar na dinâmica das populações vegetais em função da alimentação (PAINTER 2004; KEUROGHLIAN, 2003).
A IUNC classifica o cateto quanto ao risco de extinção como espécie menos preocupante, mas enfatiza que em algumas regiões as populações desses animais estão desaparecendo de seus habitats naturais (GONGORA et al., 2011). No Brasil, esta espécie já é considerada quase ameaçada no bioma Mata Atlântica, onde sofreu e ainda sofre redução populacional devido à pressão de caça, à perda de qualidade e à fragmentação de habitat (DESBIEZ et al., 2012). A caça predatória é um dos principais fatores responsáveis pela redução na sua população porque, além da carne, existe grande interesse em seu couro, para os quais há uma grande demanda no mercado internacional (NOGUEIRA FILHO; CUNHA NOGUEIRA 2000). De acordo com Bodmer & Robson (1999), estima-se que 20 mil catetos são caçados, por ano, na Amazônia peruana, proporcionado uma renda anual de aproximadamente U$ 270 mil dólares para o setor rural com a venda da carne.
A possibilidade da criação desses animais em cativeiro surge como forma de diminuir a caça predatória, gerando uma fonte alternativa de proteína e renda para a população, podendo, ainda, se tornar uma solução para o aproveitamento de áreas improdutivas de propriedades rurais, uma vez que ela já está adaptada ao ambiente (NOGUEIRA; NOGUEIRA – FILHO 2011). Nesse sentido, em regiões como noSudeste do Brasil a criação comercial destes animais representam uma fonte alternativa de renda para pequenos, médios e grandes produtores rurais (NOGUEIRA FILHO; CUNHA NOGUEIRA 2000), uma vez que os custos com a criação comercial do cateto chegam a ser de 3,5 a 7,0 vezes a menor quando comparado à implantação de uma suinocultura (OLIVEIRA et al., 2009).
34
produtores obtêm, em média R$10,00 por kg de peso vivo, entretanto esta renda pode ser maior caso o produtor agregue valor com o beneficiamento desta, chegando a R$35,00/kg de carne (OLIVEIRA et al., 2009).
O couro de cateto é coberto de pequenos círculos castanho escuros que os distinguem dos couros de animais domésticos (NOGUEIRA FILHO; CUNHA NOGUEIRA 2000) e por apresentar maciez e resistência (OLIVEIRA et al., 2009) há uma grande demanda no mercado internacional. A Itália, Alemanha e França são os principais países importadores e os produtos confeccionados (calçados, luvas, casacos, carteiras e cintos) são exportados principalmente para os Estados Unidos e Japão (SOWLS, 1997; FANG et al., 2008), sendo vendidos a preços altos. Para exemplificar,
o preço de um par de luvas, que utiliza menos de 0,25 m2 por unidade é comercializado
por até US$ 195,00 (OLIVEIRA et al., 2009). Segundo Barbarán (1999), a Argentina exportou no período de 1980-1996, mais de 700 mil peles de cateto, representando uma importante fonte de renda para aquele país.
2.2.2. Importância das cutias e dos preás
A população das cutias e preás é considerada estável e não preocupante (CATZEFLIS et al 2014), mas ambas populações tem sofrido significativa redução, tanto pela caça predatória como pela destruição de seu habitat natural (HOSKEN & SILVEIRA, 2001). As cutias sofrem ainda mais o efeito da caça descriminada por representarem uma fonte protéica alternativa (RODRIGUES et al., 2003). Por exemplo, em Trinidad e Tobago, na América Central, a carne de cutia é considerada uma especiaria, e por esta razão, esse animal tem sido intensivamente caçado (ROOPCHAND, 2002).
Já foi demonstrado que estes animais se adaptam bem em cativeiro, o que favorece o desenvolvimento de técnicas para sua criação e posterior difusão a criatórios interessados (DEUTSCH; PUGLIA, 1990). Esta criação poderia contribuir para preservação da espécie e possibilitar o estudo de suas particularidades fisiológicas e de exploração de seu potencial zootécnico (PACHALY et al., 1999; LOPES et al., 2004). Contudo, o potencial para exploração econômica da cutia, no que se refere aos seus hábitos alimentares, os aspectos reprodutivos, comportamentais e sanitários, necessita de mais estudos (ALBUQUERQUE, 1991).
35
fazerem tocas no solo para moradia promovem também a aeração do terreno. Ao urinarem e defecarem em suas tocas auxiliam no retorno dos nutrientes e sais minerais para a solo e, por fim, ainda ajudam na germinação de sementes e provável fixação de uma nova planta por possuírem hábitos de enterrar os alimentos (COSTA et al., 2013; HOSKEN; SILVEIRA, 2001).
Estes dois roedores são muito importantes para o equilíbrio da cadeia alimentar, servindo de alimento para diversas espécies, como aves de rapina, cobras, canídeos e felinos selvagens (HOSKEN; SILVEIRA, 2001; OLIVEIRA, et. al, 2008). Além de fonte de proteína para a população local, que apresenta cerca de 27 milhões de pessoas que vivem na região do bioma caatinga, a maioria carente e dependente dos recursos do bioma para sobreviver (MINISTERIO DO MEIO AMBIENTE, 2014).
Estas espécies, assim como outros roedores são potenciais constituintes de modelos experimentais para outras espécies de roedores que estão vulneráveis a extinção como a Dasyprocta ruatanica, o rato-candango (Juscelinomys candango), e duas espécies
de rato-do-mato (Kunsia fronto; Wilfredomys oenax) considerados criticamente
ameaçados e o ouriço-preto (Chaetomys subspinosus) considerável vulnerável a extinção
pelo ICMbio (ICMBIO, 2014). Isso é possível graças a algumas características específicas, como pequeno tamanho, baixo custo de manutenção e curto período de gestação (PUKAZHENTHI et al., 2006; BJÖRKMAN et al., 1989). Espécies utilizadas como modelos experimentais como animais domésticos e silvestres não ameaçados são essenciais para o desenvolvimento de protocolos de reprodução assistida que posteriormente possam ser aplicados a estas, auxiliando na sua conservação (WANDERLEY et al., 2012). Estes modelos podem ainda ser aplicados a estudos em humanos (CARTER, 2007).
2.3. Aspectos gerais e importância da Manipulação de Oócitos Inclusos em Folículos Ovarianos Pré-Antrais (MOIFOPA)
36
cavidade repleta de líquido folicular circundando o oócito, respectivamente (SANTOS et al., 2008).
Os FOPA representam cerca de 90 a 95% de toda população folicular earmazenam a maioria dos oócitos presentes em ovários mamíferos. Contudo, a maior parte destes folículos (99,9%) não chega até à ovulação, sendo eliminada por atresia folicular (FIGUEIREDO et al., 2007b). Nesse contexto, visando evitar a enorme perda folicular que ocorre naturalmente in vivo, foi desenvolvida a biotécnica de MOIFOPA, a qual tem
por objetivo a manipulação in vitro de FOPAs objetivando seu crescimento e maturação,
quando não é mais possível acontecer esses eventos no próprio ovário. Porém, como os sistemas de cultivo in vitro ainda não estão bem estabelecidos para todas as espécies, a criopreservação de tecido ovariano pode representar uma alternativa para o sucesso desta biotécnica (SANTOS et al., 2008), uma vez que poderá manter a viabilidade folicular até que seja realizado o CIV ou transplante do ovário (FAUSTINO et al., 2011).
A MOIFOPA é uma biotécnica de grande importância tanto para a pesquisa fundamental ou básica, quanto para a reprodução animal. Com relação à pesquisa fundamental, contribui para a elucidação dos mecanismos implicados na foliculogênese na fase pré antral. No tocante a reprodução animal, o isolamento de milhares de FOPA a partir de um único ovário e posterior CIV dos oócitos neles inclusos até o estágio de maturação poderá contribuir para a multiplicação de animais de alto valor zootécnico ou em vias de extinção (FIGUEIREDO et al., 2008). Ela apresenta ainda inúmeras outras vantagens, como aumento da eficiência reprodutiva de animais de alto valor zootécnico ou perigo de extinção, redução do intervalo entre gerações, recuperação de animais eliminados por problemas sanitários, uso de animais que não respondem a tratamentos de superovulação, obtenção de descendentes de um animal mesmo após sua morte, otimização e padronização de outras biotécnicas como a fecundação in vitro (FIV),
clonagem e transgenia (FIGUEIREDO et al., 2007b)
37
2.3.1. Caracterização e estimativa da população folicular ovariana
Muitos trabalhos vêm sendo realizados no sentido de estimar a população folicular ovariana em diversas espécies mamíferas (bugio-preto - Alouatta caraya -LOPES et al.,
2006; dromedário - Camelus dromedarius - NILI et al., 2004; gatas domésticas – Felis catus - CARRIJO et al., 2010), isso porque parâmetros qualitativos e quantitativos da
população folicular estão relacionados ao potencial reprodutivo das fêmeas. Adicionalmente, um conhecimento mais aprofundado sobre o desenvolvimento folicular auxilia no aumento da eficiência de biotécnicas reprodutivas (COMIZZOLI et al., 2010). Nesses estudos, tem-se constatado que o número total de folículos varia entre as diferentes espécies, nas quais a população folicular pode ser afetada por fatores como idade, raça, níveis hormonais, status reprodutivo, nutrição e fatores genéticos (SCARAMUZZI et al., 1993).
Nos suínos domésticos, espécie filogeneticamente mais próxima aos catetos, foi estimado que a população de folículos primordiais atinge valores tão altos quanto 420 000 (GOSDEN; TELFER, 1987). Por outro lado, nos catetos, a população ovariana de FOPAs foi estimada em apenas 33.273 por ovário. Nesta espécie, assim como a maioria dos mamíferos, os folículos primordiais corresponderam a maioria destes (91%). A hipótese de que o citoplasma do oócito desta espécie continha uma grande quantidade de lipídios foi corroborada através da análise ultraestrutural dos mesmos (LIMA et al., 2013). Entretanto, esta característica não impediu a sua conservação sob baixas temperaturas (até 8ºC) por curtos períodos (até 36 h), sendo confirmada a preservação através da análise da morfologia e viabilidade com azul de Trypan (LIMA et al., 2014).
Em espécies de roedores, como camundongos, foi demonstrado que a população folicular ovariana é de aproximadamente 1 500 folículos (SHAW et al., 2000). Nesta espécie foi observada a concentração de folículos em diferentes estágios de desenvolvimento na região cortical do ovário, sendo a média de folículos primordiais de 111,56 em fêmeas com 30 dias de idade e de 44,20 em fêmeas com 180 dias. Já os folículos primários se comportaram de maneira inversa, aumentando seu número com o aumento da idade (LANNA, 2009). É importante ressaltar que mesmo nas demais espécies de roedores, os estudos sobre as características dos folículos ovarianos ainda são escassos, com poucas informações sobre este assunto.
Em Myocastor coypus, um roedor histricomorfo nativo da América do Sul, foi
38
dispersa no ovário, entre o tecido intersticial, dividindo o espaço com corpos lúteos ativos e acessórios. Nesta espécie o diâmetro de folículos primordiais, primários e secundários foi de 35,7; 56,8 e 93,4 µm, respectivamente (FELIPE et al., 1999).
Em cutias e preás, até o presente momento, não há estudos acerca da estimativa e caracterização da sua população folicular ovariana, sendo de grande importância o conhecimento destas para o desenvolvimento e adaptação de outras biotécnicas.
2.3.2. Criopreservação de tecido ovariano
A criopreservação de germoplasma é uma alternativa que diminui as limitações impostas pelo tempo e pela distância para a conservação de diversas espécies silvestres (COSTA; MARTINS 2008). Embora a maioria dos trabalhos seja voltada para a criopreservação de espermatozoides e oócitos, estudos orientados na preservação de tecido ovariano (JEWGENOW et al., 2011) e células somáticas (BEN-NUN et al., 2011) vem crescendo, no intuito de resgatar folículos ovarianos imaturos ou células pluripotentes, respectivamente (COMIZZOLI et al., 2012). Especificamente a respeito das diversas aplicações da criobiologia, originou-se um artigo, o qual se encontra anexado ao final desta revisão de literatura.
A obtenção dos gametas femininos pode ser realizada através de punções foliculares, biópsias do tecido ovariano, ovariectomia uni ou bilateral ou colheita do ovário imediatamente após a morte do animal, independentemente da idade (DOMINGUES et al., 2007). E, visando sua preservação, pode ser realizada a estocagem do tecido ovariano, dos folículos isolados ou dos oócitos maduros ou imaturos (LERMEN et al., 2009).
A opção de criopreservar o tecido ovariano evita muitas das limitações encontradas na preservação de oócitos maturados, como a pequena quantidade dessas estruturas encontrada nos ovários e possíveis efeitos deletérios de sua conservação em baixas temperaturas (SANTOS et al., 2010). Adicionalmente, dada a sua ampla aplicação na reprodução assistida associada ao transplante, a possibilidade de retomada da função ovariana e a facilidade de manuseio do tecido, a maioria dos trabalhos tem se concentrado na criopreservação de tecido ovariano (FAUSTINO et al., 2011).
39
quantidade de material genético feminino (SANTOS et al., 2010). Estes folículos são mais resistentes a baixas temperaturas, uma vez que seu oócito possui menor taxa metabólica; ausência de fuso meiótico, zona pelúcida e grânulos da cortical; e menor quantidade de gotas lipídicas do que oócitos maturados (HOVATTA, 2005). Adicionalmente, ele pode ser obtido de animais de qualquer idade (incluindo fetos), bem como imediatamente após a sua morte (CLEARY et al., 2001). Sua maior limitação é a dificuldade na preservação do próprio ovário, considerando-se a diversidade de tipos celulares e componentes deste tecido (HOVATTA, 2005).
Independente de se utilizar tecido ou oócito isolado, a criopreservação envolve as etapas de exposição ao agente crioprotetor ou período de equilíbrio; resfriamento; armazenamento; descongelação ou aquecimento e remoção do agente crioprotetor (SANTOS et al., 2008). A adição deste último é indispensável em ambos os métodos utilizados, sendo um fator crucial para o seu sucesso, sua presença é necessária para que as células resistam às injúrias resultantes da criopreservação (MYCOCK et al., 1995). Contudo, os metabólitos resultantes da sua degradação pela célula podem ser tóxicos, sendo este um fator limitante para o sucesso da utilização dos mesmos (FAHY, 2010).
A congelação lenta, método convencional, é caracterizada pela utilização de baixas concentrações de agentes crioprotetores e pela redução gradual da temperatura geralmente controlada por um freezer programável (NAIK et al., 2005). Embora seja um método bastante difundido, a sua utilização envolve altos custos, uma vez que necessita de um freezer programável, bem como seu uso leva a formação de cristais de gelo intracelulares, responsáveis por danos celulares irreversíveis durante a criopreservação (MORATÓ et al., 2008). A formação destes cristais de gelo ocorre devido a um estado de alta instabilidade provocado pelo super-resfriamento da água intracelular, sendo o principal responsável pela ruptura mecânica da membrana plasmática das células (ZHMAKIN, 2008). Além disso sua formação pode ocorrer durante a descongelação, na qual há o crescimento dos microcristais como resultado da recristalização da água (SALLE et al., 2002).
40
comportar-se como um sólido, porém sem cristalização (MUKAIDA; OKA 2012), e altas taxas de congelação (20.000 a 40.000°C/min - LIN et al., 2008).
A vitrificação é uma alternativa a congelação lenta uma vez que é prática, envolve menor custo na execução e maior rentabilidade econômica (VAJTA et al., 1998). Em geral, pode ser realizada em qualquer laboratório ou até na sala de cirurgia, simultaneamente a cirurgia do paciente/animal, e ainda a campo, até mesmo imediatamente após a morte de um animal, sendo considerado o desenvolvimento mais significativo na criobiologia até hoje (AMORIM et al., 2011). No futuro, espera-se que este método se torne método mais adequado para a criopreservação de qualquer célula ou tecido (MUKAIDA; OKA 2012).
Devido a carência de informações básicas sobre a fisiologia das espécies silvestres e simples estudos como tolerância osmótica dos oócitos ou testes de toxicidade, a criopreservação de gametas femininos ainda não é uma técnica bem estabelecida, principalmente para estas espécies (COMIZZOLI et al. 2012).
2.3.3. Cultivo in vitro de gametas femininos
O desenvolvimento de um sistema que permita o crescimento in vitro de FOPA e
que resulte em oócitos aptos a serem maturados e fecundados in vitro seria de grande
importância, pois possibilitaria o estudo dos fatores que controlam a foliculogênese e ainda promoveria o crescimento e a maturação oocitária associado com a multiplicação e diferenciação das células da granulosa (HARTSHORNE, 1997), contribuindo, assim, para a preservação a longo prazo de células germinativas femininas (MAO et al., 2002). Contudo, as condições necessárias para o completo desenvolvimento in vitro de folículos pré-antrais, especialmente em animais silvestres, ainda não foram estabelecidas, uma vez que as informações sobre a regulação do crescimento folicular e oocitário na fase pré-antral são ainda insuficientes (MATOS et al., 2007a).