UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE - UFRN CENTRO DE BIOCIÊNCIAS - CB
DEPARTAMENTO DE OCEANOGRAFIA E LIMNOLOGIA - DOL LABORATÓRIO DE BIOLOGIA PESQUEIRA - LABIPE PROGRAMA DE PÓS-GRADUAÇÃO EM BIOECOLOGIA
AQUÁTICA
Descrição do ciclo gametogênico do ouriço-branco, Tripneustes ventricosus
(Lamarck, 1816), no Arquipélago de Fernando de Noronha – PE, Brasil.
Arthur Antônio Machado
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE - UFRN CENTRO DE BIOCIÊNCIAS - CB
DEPARTAMENTO DE OCEANOGRAFIA E LIMNOLOGIA - DOL LABORATÓRIO DE BIOLOGIA PESQUEIRA - LABIPE PROGRAMA DE PÓS-GRADUAÇÃO EM BIOECOLOGIA
AQUÁTICA
Descrição do ciclo gametogênico do ouriço-branco, Tripneustes ventricosus
(Lamarck, 1816), no Arquipélago de Fernando de Noronha – PE, Brasil.
Dissertação apresentada ao Departamento de Oceanografia e Limnologia do Centro de Biociências da Universidade Federal do Rio Grande do Norte, como parte dos requisitos exigidos para obtenção do título de mestre em Bioecologia Aquática.
Aluno: Arthur Antônio Machado Orientador: Jorge Eduardo Lins de Oliveira Co-orientador: Ricardo Clapis Garla
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN / Biblioteca Central Zila Mamede
Machado, Arthur Antônio.
Descrição do ciclo gametogênico do ouriço-branco, Tripneustes ventricusus (Lamarck, 1816), no Arquipélago de Fernando de Noronha – PE, Brasil / Arthur Antônio Machado. – Natal, RN, 2007.
41 f.
Orientador: Jorge Eduardo Lins de Oliveira. Co-orientador: Ricardo Clapis Garla.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Departamento de Oceanografia e Limnologia. Programa de Pós-Graduação em Bioecologia Aquática.
1. Tripneustes ventricosus – Dissertação. 2. Tripneustes ventricosus – Reprodução – Dissertação. 2. Hotelaria – Dissertação. 3. Fernando de Noronha (PE) – Dissertação. I. Oliveira, Jorge Eduardo Lins de. II. Garla, Ricardo Clapis. III. Universidade Federal do Rio Grande do Norte. IV. Título.
Descrição do ciclo gametogênico do ouriço-branco, Tripneustes ventricosus
(Lamarck, 1816), no Arquipélago de Fernando de Noronha – PE, Brasil.
Arthur Antônio Machado
Banca Examinadora:
Orientador: Jorge Eduardo Lins Oliveira (UFRN)
Co-Orientador: Ricardo Clapis Garla (UFRN)
Sergio Rosso (USP)
Carlos Renato Rezende Ventura (MN/UFRJ)
i
Agradecimentos
Gostaria de agradecer,
Ao Prof. Dr. Jorge Eduardo Lins por aceitar me orientar no mestrado e
disponibilizar o LABIPE, Laboratório de Biologia Pesqueira, para a realização do trabalho.
Ao Dr. Ricardo Clapis Garla pelo convite para trabi alhar no projeto e pela co-orientação.
À Prof. Dr. Liana Mendes pela amizade e ajuda junto ao IBAMA.
Ao Prof. Dr. Wagner Molina pelas críticas construtivas ao meu trabalho.
Ao Prof. Dr. Carlos Renato Rezende Ventura pelo aceite ao convite para
participação na banca examinadora.
Ao Prof. Dr. Sergio Rosso pelo aceite ao convite para participação na banca
examinadora.
Ao CNPQ, Conselho Nacional de Desenvolvimento Científico e Tecnológico, pelo
apoio financeiro ao projeto e pela concessão da bolsa de mestrado.
Ao IBAMA pela liberação da licença de pesquisa para o trabalho ser realizado
dentro de uma Unidade de Conservação e pela liberação das instalações do IBAMA em
Fernando de Noronha para permanência dos pesquisadores.
Ao biólogo e patologista Hévio de Freitas pela atenção, qualidade e rapidez na
confecção das lâminas histológica.
À doutora Aline Grill pela amizade e por ajudar na manipulação com os ouriços no
LABIPE.
Aos colegas de LABIPE: Tatiana, Bertran, Garcia, Helena, Lorena, Fran e Seu
ii
Agradecimentos pessoais
Aos meus pais, Piolho e Ivana, e meus irmãos, Felipe e Carol, por tudo.
À i ha a orada Lore a Lolozi ha Collares, por e fazer u a pessoa ais
feliz.
Aos meus amigos do coração, Igor e Augusto, por me incentivarem a vim pra Natal
e me receberem muito bem.
Aos amigos Eduardo, Cesar, Fernando, Augustinha, Eduardo Junior e Aline
Bai i ha , pelas ajudas e Natal.
Aos Professores José Luiz Attayde e Márcio Zikán por me ensinarem Ecologia.
Às amizades feitas em Natal: Venécios, Cintia, Sofia, CBI, Nicole, Natália, Rodrigo,
Karen, Karin, Andréia, Talita, Alexandre, Audra, Mauro, Mauricio, Tais, Sara, Ligia,
Henrique, Luca, Renata, CQ, Dani, Marcelo, Danielle, Nana Lua, entre outros.
À galera da HolmeS: Júlia, Lolozinha, Curiri, Arnaldo, Joaca e Cida.
Aos amigos de sempre da FURG: Ricardo Curiri, Saulo, Da iel Bob Ma kot, Rafa
Guedes, Fernando Magaiver, Rodrigo Torres, Mauro Japa, Igor Pará, Mathias, André Ugri,
Felipe Caron, Felipe Casulo, Rogério, Rossana, Lucas, Bel, Juliana Jusp, Juliana Susi, Paula,
Rafael Thierry, Clara, Thiago, Alice, Pedro Patú, Wilson, Ana, Martina, Eduardo, Natália,
Paulinha, Marianna, Elaine, etc, por me ajudarem com artigos e outras coisas para facilitar
a realização da dissertação.
Aos que partiram: Rafael B2, Atila e Miguelito.
E à Água, o que seria de nós sem ela!
iii
SUMÁRIO
SUMÁRIO III
LISTA DE FIGURAS V
RESUMO VII
ABSTRACT VIII
1. INTRODUÇÃO 1
2. OBJETIVO GERAL 4
2.1.OBJETIVOS ESPECÍFICOS 4
3. MATERIAL E METÓDOS 5
3.1.ÁREA DE ESTUDO 5
Região do Air France 6
Baía do Sueste 7
3.2.DESCRIÇÃO E TERMINOLOGIA DA ORGANIZAÇÃO TISSULAR E CELULAR DA GÔNADA DOS
EQUINÓIDES 8
3.3.ETAPAS EM CAMPO 10
3.4.ETAPAS NO LABORATÓRIO 11
Índice Gonadal 11
Preparação das Lâminas Histológicas 11
Análises Microscópicas 11
Razão Sexual 11
Estudo Piloto 12
3.5.ANÁLISE DOS DADOS 12
4. RESULTADOS E DISCUSSÃO 14
4.1.DESCRIÇÃO DOS ESTÁGIOS DO CICLO GAMETOGÊNICO EM T. VENTRICOSUS 14
4.1.1. Fêmeas 14
a) Reserva 16
b) Proliferação 17
c) Em maturação 17
d) Maturação máxima 18
e) Emissão de gametas ou desova 19
4.1.2 Machos 20
a) Reserva 21
iv
c) Em maturação 22
d) Maturação máxima 23
e) Emissão de gametas ou desova 23
4.1.3. Comparação dos estágios gametogênicos entre os sexos 23
4.2.RAZÃO SEXUAL 25
4.3.FREQÜÊNCIA DOS ESTÁGIOS GAMETOGÊNICOS 25
4.4.ÍNDICE GONADAL 27
5. CONCLUSÕES 30
6. REFERÊNCIAS BIBLIOGRÁFICAS 31
v
Lista de Figuras
FIGURA 1:LOCALIZAÇÃO GEOGRÁFICA DO ARQUIPÉLAGO DE FERNANDO DE NORONHA E LOCAIS DE COLETA DE T. VENTRICOSUS(AIR FRANCE E BAÍA DO SUESTE). ______ 6
FIGURA 2:REGIÃO DO AIR FRANCE ______________________________________ 7
FIGURA 3:BAÍA DO SUESTE. ___________________________________________ 8
FIGURA 4:A-REPRESENTAÇÃO ESQUEMÁTICA DA ANATOMIA INTERNA DE UM OURIÇO-DO -MAR, SEGUNDO RUPPERT &BARNES (1996);B-VISTA DO OURIÇO ABERTO PELA
LANTERNA DE ARISTÓTELES;C-AS 5 GÔNADAS DISTRIBUÍDAS NO T. VENTRICOSUS;
D-GÔNADAS DE T. VENTRICOSUS. ___________________________________ 9
FIGURA 5:GÔNADAS DE UM INDIVÍDUO DE T. VENTRICOSUS COLETADO NO ARQUIPÉLAGO DE FERNANDO DE NORONHA (REGIÕES DA GÔNADA,A-ABORAL,M-MEDIANA,P:
ORAL). ______________________________________________________ 12
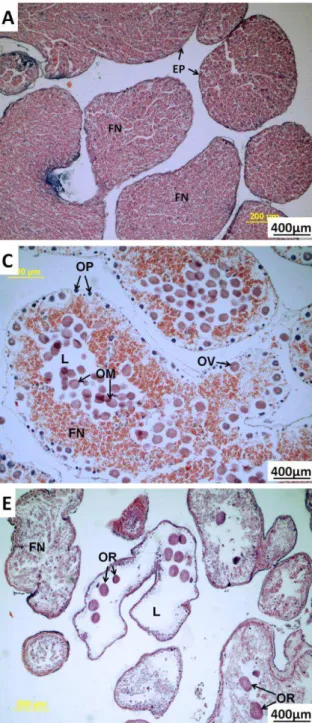
FIGURA 6:ESTÁGIOS DO CICLO GAMETOGÊNICO EM FÊMEAS DE T. VENTRICOSUS NO
ARQUIPÉLAGO DE FERNANDO DE NORONHA:(A)RESERVA;(B)PROLIFERAÇÃO;(C)
EM MATURAÇÃO;(D)MATURAÇÃO MÁXIMA E (E)EMISSÃO DE GAMETAS.
FN-FAGÓCITOS NUTRITIVOS;EP-EPITÉLIO GERMINAL;L-LÚMEN;OP-OVÓCITOS PRÉ -VITELOGÊNICOS;OV-OVÓCITOS VITELOGÊNICOS;OM-OVÓCITOS MADUROS;
OR-OVÓCITOS REMANESCENTES.AUMENTO 100X. _________________________ 15
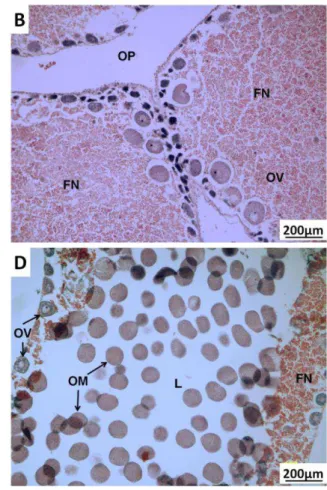
FIGURA 7:ESTÁGIOS DO CICLO GAMETOGÊNICO EM FÊMEAS DE T. VENTRICOSUS NO
ARQUIPÉLAGO DE FERNANDO DE NORONHA:(A)RESERVA;(B)PROLIFERAÇÃO;(C)
EM MATURAÇÃO;(D)MATURAÇÃO MÁXIMA E (E)EMISSÃO DE GAMETAS.
FN-FAGÓCITOS NUTRITIVOS;L-LÚMEN;OP-OVÓCITOS PRÉ-VITELOGÊNICOS;
OV-OVÓCITOS VITELOGÊNICOS;OM-OVÓCITOS;OR-OVÓCITOS REMANESCENTES.
AUMENTO 200X. _______________________________________________ 16
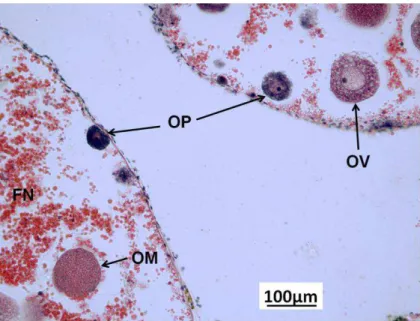
FIGURA 8:GÔNADA DE FÊMEA DE T. VENTRICOSUS NO ESTÁGIO EM MATURAÇÃO COM OVÓCITOS EM TODOS OS ESTADOS.OP-OVÓCITOS PRÉ-VITELOGÊNICOS;
OV-OVÓCITOS VITELOGÊNICOS;OM-OVÓCITOS ___________________________ 18
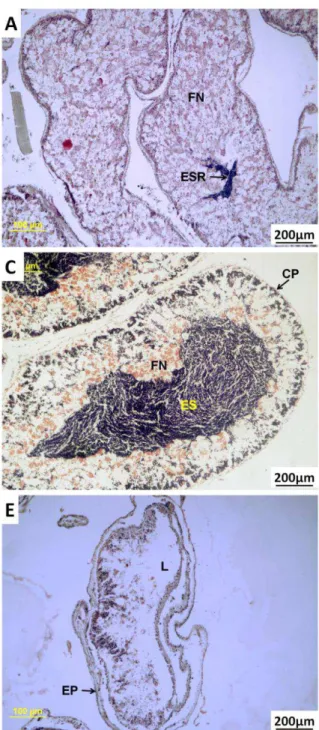
FIGURA 9:ESTÁGIOS DO CICLO GAMETOGÊNICO EM MACHOS DE T. VENTRICOSUS NO
ARQUIPÉLAGO DE FERNANDO DE NORONHA:(A)RESERVA;(B)PROLIFERAÇÃO;(C)
EM MATURAÇÃO;(D)MATURAÇÃO MÁXIMA E (E)EMISSÃO DE GAMETAS.
FN-FAGÓCITOS NUTRITIVOS;EP-EPITÉLIO GERMINAL;L-LÚMEN;CP-CÉLULAS PRIMÁRIAS;ES-ESPERMATOZÓIDES;ESR-ESPERMATOZÓIDES REMANESCENTES.
AUMENTO 200X. _______________________________________________ 20
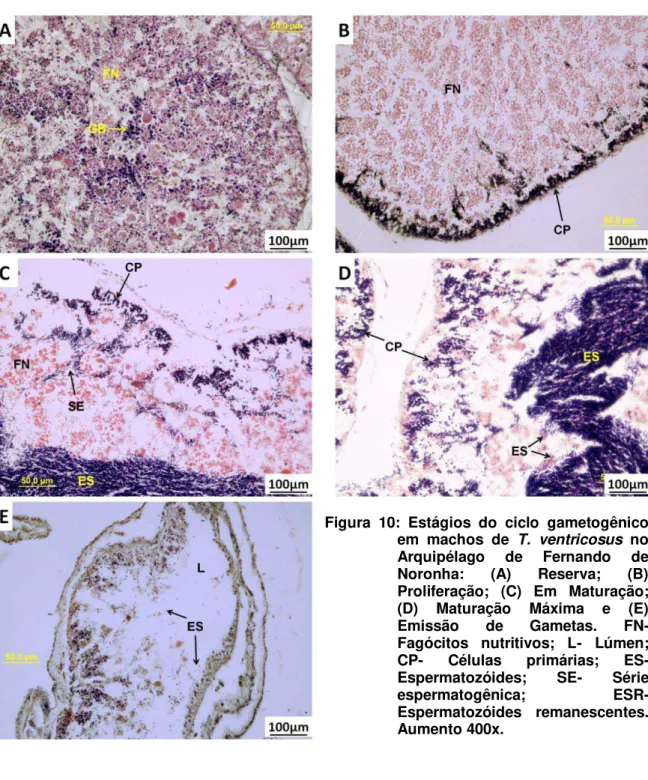
FIGURA 10:ESTÁGIOS DO CICLO GAMETOGÊNICO EM MACHOS DE T. VENTRICOSUS NO
ARQUIPÉLAGO DE FERNANDO DE NORONHA:(A)RESERVA;(B)PROLIFERAÇÃO;(C)
EM MATURAÇÃO;(D)MATURAÇÃO MÁXIMA E (E)EMISSÃO DE GAMETAS.
ES-vi
ESPERMATOZÓIDES;SE-SÉRIE ESPERMATOGÊNICA;ESR-ESPERMATOZÓIDES REMANESCENTES.AUMENTO 400X. _________________________________ 21
FIGURA 11:ESTÁGIOS DO CICLO GAMETOGÊNICO EM FÊMEAS (COLUNA DA ESQUERDA) E MACHOS (COLUNA DA DIREITA) DE T. VENTRICOSUS NO ARQUIPÉLAGO DE FERNANDO DE NORONHA:(A)RESERVA;(B)PROLIFERAÇÃO;(C)EM MATURAÇÃO;(D)
MATURAÇÃO MÁXIMA E (E)EMISSÃO DE GAMETAS.FN-FAGÓCITOS NUTRITIVOS;
L-LÚMEN;OP-OVÓCITOS PRÉ-VITELOGÊNICOS;OV-OVÓCITOS VITELOGÊNICOS;
OM-OVÓCITOS;OR-OVÓCITOS REMANESCENTES ;CP-CÉLULAS PRIMÁRIAS;
ES-ESPERMATOZÓIDES;SE-SÉRIE ESPERMATOGÊNICA;ESR-ESPERMATOZÓIDES REMANESCENTES.AUMENTO 200X. _________________________________ 24
FIGURA 12:RAZÃO SEXUAL DE T. VENTRICOSUS NO ARQUIPÉLAGO DE FERNANDO DE
NORONHA ENTRE OS MESES DE DEZEMBRO DE 2006 E JULHO DE 2007. _______ 25
FIGURA 13:FREQÜÊNCIA DOS ESTÁGIOS GAMETOGÊNICOS EM FÊMEAS (A) E MACHOS (B) DE T. VENTRICOSUS NO ARQUIPÉLAGO DE FERNANDO DE NORONHA ENTRE
DEZEMBRO DE 2006 E JULHO DE 2007. _______________________________ 26
FIGURA 14:ÍNDICE GONADAL EM FÊMEAS (A), MACHOS (B) E EM AMBOS OS SEXOS (C) DE T. VENTRICOSUS NO ARQUIPÉLAGO DE FERNANDO DE NORONHA ENTRE OS MESES DE DEZEMBRO DE 2006 E JULHO DE 2007. _______________________ 28
FIGURA 15:ÍNDICE GONADAL EM RELAÇÃO AOS ESTÁGIOS GAMETOGÊNICOS, PARA FÊMEAS E PARA MACHOS DE T. VENTRICOSUS NO ARQUIPÉLAGO DE FERNANDO DE
vii
Resumo
Os ouriços-do-mar são conhecidos organismos bentônicos dos ecossistemas costeiros de águas rasas das regiões tropicais e temperadas. O impacto das populações de ouriços em algumas comunidades é dependente da sua densidade e o conhecimento da história de vida destes animais é importante para compreender a ecologia destas interações. Entre 2000 a 2005 ocorreu uma expansão em algumas populações de Tripneustes ventricosus no Arquipélago de Fernando de Noronha. Em 2004 foi iniciado um programa de monitoramento da dinâmica populacional da espécie no local, quando foi constatada a escassez de informações básicas sobre a biologia e a reprodução da mesma, apesar de sua ampla distribuição geográfica e importância econômica em partes de sua área de ocorrência. Nesse contexto, o presente trabalho enfoca a biologia reprodutiva de
viii
Abstract
1
1. INTRODUÇÃO
O Filo Echinodermata é composto por animais com formas corporais peculiares como as estrelas-do-mar (Classe Asteroidea), os lírios-do-mar (Classe Crinoidea), as serpentes-do-mar (Classe Ophiuroidea), os pepinos-do-mar (Classe Holothuroidea), os ouriços-do-mar e as bolachas-da-praia (Classe Echinoidea) (Ventura et al. 2006). O Filo Echinodermata apresenta aproximadamente 6.000 espécies e a Classe Echinoidea, a qual inclui os ouriços-do-mar, atualmente possui cerca de 950 espécies (Ruppert & Barnes, 1996). Estes últimos desempenham importantes papéis ecológicos nas comunidades marinhas, ocupando vários níveis tróficos como herbívoros, carnívoros, detritívoros e onívoros. Além disso, várias espécies apresentam grande importância comercial (Lawrence, 1987).
Os ouriços-do-mar são conhecidos organismos bentônicos dos ecossistemas costeiros de águas rasas das regiões tropicais e temperadas. A herbivoria e raspagem do substrato realizada durante a alimentação destes animais podem exercer considerável impacto na estrutura e na dinâmica das comunidades subtidais rasas (Harrold & Pearce, 1987). Em algumas regiões, as altas densidades de ouriços podem desnudar grandes áreas de macroalgas e criar extensos clarões nos campos de algas (Underwood et al. 1991), alterando dessa forma a estrutura física e biológica da comunidade (Leinaas & Christie, 1995). Como a natureza do impacto das populações de ouriços em algumas comunidades é dependente da sua densidade, o conhecimento da história de vida destes animais é importante para compreender a ecologia destas interações (Williamson & Steinberg, 2002).
2 É uma espécie de ouriço comum em águas rasas em profundidades de até 30m, podendo habitar campos de algas, areia com cascalho, rochas e recifes (Lawrence, 2007), e apresenta uma preferência por localidades com alta hidrodinâmica (Ogden & Lobel, 1978; Aseltine, 1982). O ouriço-branco geralmente é herbívoro e alimenta-se principalmente de algas pardas, mas pode ser onívoro ou planctívoro em situações nas quais a matéria vegetal é escassa. Para a alimentação do ouriço-branco deve haver um fluxo forte de água e mudanças de temperatura têm efeito na taxa de alimentação (Moore, 1966).
T. ventricosus apresenta grande importância comercial no Caribe e foi
provavelmente o primeiro ouriço-do-mar para o qual a pesca foi manejada, com a criação de uma temporada de defeso durante o pico da temporada de desova em Barbados desde 1879. No entanto tal tentativa falhou e sua pesca praticamente entrou em colapso na década de oitenta, possivelmente em razão da sobrepesca e da poluição (Scheibling & Mladenov, 1987).
3 Vários trabalhos sobre a reprodução de invertebrados marinhos têm focalizado os equinodermos como organismos particularmente apropriados para estudos desta natureza devido à sua pouca mobilidade, tamanho corporal relativamente grande e ciclo reprodutivo anual (Byrne, 1990; Drummond, 1995; Bentley, 1998; Byrne et al., 1998; Williamson & Steinberg, 2002; Tavares, 2004). Algumas espécies de equinóides são largamente utilizadas como materiais para estudos embriológicos e há mais de cinco décadas o desenvolvimento embrionário e o ciclo reprodutivo de várias espécies têm sido investigados em regiões tropicais e temperadas (Lawrence, 1987; Strathmann, 1987; Pearse e Cameron, 1991; Williamson & Steinberg, 2002; Tavares, 2004). Além de sua utilização como modelos de desenvolvimento embrionário, os estudos sobre reprodução assumem especial importância no fornecimento de informações básicas sobre biologia das espécies, as quais podem ser aplicadas na aqüicultura, manejo pesqueiro e controle em situações de grande expansão populacional.
4 Dessa forma, em 2004 foi iniciado um programa de monitoramento da dinâmica populacional de T. ventricosus no AFN, quando foi constatada a escassez de informações básicas sobre a biologia e a reprodução da espécie (Cameron, 1986; Lawrence, 2007), apesar de sua ampla distribuição geográfica e importância econômica em partes de sua área de ocorrência. Nesse contexto, o presente trabalho enfoca a biologia reprodutiva de T. ventricosus com ênfase na descrição dos estágios gametogênicos, com vistas ao preenchimento da lacuna que existe sobre a biologia reprodutiva da espécie e também para fornecer subsídios para o entendimento de suas flutuações populacionais e de seu manejo no AFN.
2. OBJETIVO GERAL
Analisar qualitativamente o ciclo reprodutivo de T. ventricosus no AFN.
2.1. Objetivos Específicos
Descrever os principais eventos da gametogênese;
5
3. MATERIAL E METÓDOS
3.1. Área de estudo
O Arquipélago de Fernando de Noronha é formado por 21 ilhas e ilhotas e situa-se nas coordenadas 3° 54'S de latitude e 32° 25'W de longitude (Figura 1), a uma distância de 360 km de Natal, capital do Estado do Rio Grande do Norte (Ferreira et al. 1990).
O clima é tropical, quente e oceânico com estações bem definidas. A pluviometria média anual é de 1.300 mm, com maiores índices entre março e maio e estiagem entre agosto e janeiro. A temperatura média é de 25,4°C. Os ventos constantes têm direção predominante SE, velocidade média 6,6 m/seg., com maiores intensidades entre julho e agosto. A umidade relativa tem média anual de 81%. A insolação média máxima ocorre no mês de novembro (312,5 h) e mínima em abril (216,8 h) (Ferreira et al. 1990).
O Arquipélago de Fernando de Noronha sofre a ação da Corrente Sul Equatorial que exerce influência na distribuição das isotermas dessa massa d’água, com a indução de ressurgências que atingem a camada eufótica nas áreas dos bancos mais profundos (Travassos, 1999). A evaporação é geralmente maior do que a precipitação pluviométrica, proporcionando altos valores de temperaturas e salinidades superficiais, com média de 24°C e amplitude de 4°C e
salinidade acima de 35,0‰, inibindo a convecção na coluna d’água (Bezerra Jr., 1999).
6
Figura 1: Localização geográfica do Arquipélago de Fernando de Noronha e locais de coleta de T. ventricosus (Air France e Baía do Sueste).
Região do Air France
7
Figura 2: Região do Air France
Baía do Sueste
8
Figura 3: Baía do Sueste.
3.2. Descrição e terminologia da organização tissular e celular da gônada dos equinóides
9
Figura 4: A- Representação esquemática da anatomia interna de um ouriço-do-mar, segundo Ruppert & Barnes (1996); B- Vista do ouriço aberto pela Lanterna de Aristóteles; C- As 5 gônadas distribuídas no T. ventricosus; D- Gônadas de T. ventricosus.
A parede da gônada é formada por quatro camadas: o peritôneo, o tecido conetivo, o tecido muscular e o epitélio germinal que por sua vez envolve o lúmen (Giese, 1959; Strathmann & Strathmann, 1972; Tavares, 2004).
O ciclo gametogênico dos equinóides inicia-se com a multiplicação e a diferenciação das células precursoras dos gametas, em seguida com o acúmulo e liberação de gametas maduros e um período de repouso ou recessão da atividade gonadal, onde gametas residuais ou remanescentes são reabsorvidos.
10 As oogônias transformam-se em ovócitos primários (pré-vitelogênicos) ainda junto ao epitélio germinal. A partir dessa fase inicia-se gradualmente o crescimento celular, quando então pode ser visualizado um grande e conspícuo núcleo que ao completar seu desenvolvimento denomina-se vesícula germinal. O gameta feminino assume a forma típica de ovócito vitelogênico. Durante a vitelogênese a presença de interdigitações e microvilosidades unindo os gametas e os fagócitos nutritivos garantem a transferência de nutrientes por difusão ou pinocitose (Tavares, 2004).
As espermatogônias durante a espermiogênese transformam-se em espermatócitos, onde ocorre síntese de proteína e de glicogênio provavelmente para o aumento do citoplasma celular. Os espermatócitos diferenciam-se e acumulam-se entre os fagócitos nutritivos formando camadas e colunas empilhadas. A meiose inicia-se entre os espermatócitos primários próximos ao lúmen gonadal. Os espermatozóides acumulam-se e são estocados até a emissão dos gametas (Tavares, 2004).
Ao longo do ciclo gonadal os fagócitos nutritivos apresentam mudanças de tamanho do seu conteúdo citoplasmático: elas são pequenas e pouco diferenciadas quando as gônadas estão cheias de gametas e após a liberação destes, os fagócitos nutritivos aparecem especialmente ativos na fagocitose de gametas não liberados (residuais ou remanescentes). Com o repouso da atividade reprodutiva os fagócitos nutritivos aumentam de tamanho e número até preencherem toda a gônada o que caracteriza para algumas espécies de equinóides uma fase de aumento de peso do órgão e de reserva nutritiva. O lúmen é obliterado quando os fagócitos nutritivos estão desenvolvidos. Nos estágios iniciais da gametogênese as células gaméticas apresentam-se organizadas sobre a lâmina basal formando uma espessa camada (Tavares, 2004).
3.3. Etapas em campo
11 sendo a cada mês 10 indivíduos na baia do Sueste e 10 no Air France. Dos indivíduos coletados foram mensurados em campo o diâmetro da carapaça e o peso drenado.
3.4. Etapas no laboratório
No laboratório as gônadas dos indivíduos coletados foram removidas, onde foi mensurado o peso das gônadas, e em seguida fixadas em formol 4% salino neutro antes de realizar os estudos histológicos.
Índice Gonadal
Para cada indivíduo foi calculado um índice gonadal (IG%), correspondente ao potencial reprodutivo, como IG = peso úmido da gônada (g) x 100/ peso úmido do indivíduo (g) (após drenagem dos fluidos internos) (Vaïtilingon et al., 2005). Preparação das Lâminas Histológicas
Para preparação das lâminas histológicas foi retirada de uma fração de aproximadamente 3,5 cm3 de tecido gonadal, que foi desidratado em série
alcoólica crescente, diafanizado em xilol, impregnado e emblocado em parafina. Cortes histológicos de 7μm de espessura do material emblocado em parafina foram obtidos com o auxílio de um micrótomo manual, e posteriormente montados em lâminas e corados com soluções de Hematoxilina de Harris e Eosina aquosa (ver Apêndice 1 para detalhes).
Análises Microscópicas
Os cortes foram examinados em microscópio com diferentes aumentos, para determinação do sexo de cada indivíduo e avaliação do seu estágio de desenvolvimento gonadal, o qual foi baseado na aparência da maior parte dos ácinos. Para cada sexo a determinação do período reprodutivo foi feita através da distribuição da freqüência relativa (%) de indivíduos com gônadas em cada estágio de maturidade nos meses de coleta.
Razão Sexual
12
Estudo Piloto
Inicialmente realizou-se um estudo piloto com cinco indivíduos para verificar a homogeneidade dos estágios gametogênicos em todas as porções (aboral, mediana e oral) de cada uma das cinco gônadas de um mesmo indivíduo (Figura 5).
Figura 5: Gônadas de um indivíduo de T. ventricosus coletado no Arquipélago de Fernando de Noronha (Regiões da gônada, A- Aboral, M- Mediana, P: Oral).
Nesse estudo piloto foi observado que a gametogênese é homogênea dentro de cada gônada e entre as gônadas de um mesmo indivíduo. Todas as porções (aboral, mediana e oral) de todas as cinco gônadas de cada ouriço analisado apresentaram o mesmo estágio gametogênico. Conseqüentemente, somente uma seção da parcela média de uma gônada de cada indivíduo foi examinada depois disso. Williamson & Steinberg (2002) também observaram a homogeneidade dos estágios gametogênicos ao longo da gônada e entre todas de um mesmo ouriço em Holopneustes purpurascens.
3.5. Análise dos dados
A razão sexual foi calculada através da relação r = número total de fêmeas/número total de indivíduos e analisada estatisticamente pelo teste de “Qui -quadrado” (χ2) (onde, H
o: r é igual a 0,5; H1: r é diferente de 0,5), assumindo um
14
4. Resultados e Discussão
Os indivíduos machos e fêmeas foram classificados tomando como base estágios de escalas de maturação sexual, usualmente descritos para a classe Echinoidea, como os descritos por Byrne (1990), Lamare et al. (2002) e Tavares (2004). Dentre os trabalhos citados, não há um consenso do número de estágios, os quais variam desde cinco até seis estágios. Quando apenas cinco estágio são considerados, os mesmos são: 1) Proliferação, 2) Em maturação, 3) Maturação máxima, 4) Emissão de gametas ou Desova, 5) Reserva. Quando seis estágios são considerados, o estágio “Emissão de gametas” é subdividido em “Parcialmente desovado” (Partly spawned) e “Desovado” (Spent). Para a descrição do ciclo gametogênico de T. ventricosus foram utilizados apenas cinco estágios, pelo fato de que nesta espécie as fases “Parcialmente desovado” (Partly spawned) e Desovado (Spent) na verdade constituem subdivisões de um mesmo estágio.
4.1. Descrição dos estágios do ciclo gametogênico em T. ventricosus
4.1.1. Fêmeas
15
16
Figura 7: Estágios do ciclo gametogênico em fêmeas de T. ventricosus no Arquipélago de Fernando de Noronha: (A) Reserva; (B) Proliferação; (C) Em Maturação; (D) Maturação Máxima e (E) Emissão de Gametas. FN- Fagócitos nutritivos; L- Lúmen; OP- Ovócitos pré-vitelogênicos; OV- Ovócitos vitelogênicos; OM- Ovócitos; OR- Ovócitos remanescentes. Aumento 200x.
a) Reserva
17 e Arbacia lixula. Brewin et al. (2000) também observou a presença de ovócitos remanescentes em indivíduos da espécie Evechinus sp. Durante a vitelogênese, a presença de interdigitações e microvilosidades unindo os gametas e os fagócitos nutritivos, garante a transferência de nutrientes por difusão ou pinocitose. Algumas imagens de proliferação podem ser confundidas com esta fase. No entanto os ovócitos pré-vitelogênicos (OP), quando presentes, não se destacam nem em quantidade nem em coloração.
b) Proliferação
No estágio de Proliferação o lúmen (L) se encontra ocupado por fagócitos nutritivos. Entretanto, junto à parede dos ácinos, podem ser observados ovócitos pré-vitelogênicos com intensa basofilia (Figuras 6B e 7B). A partir dessa fase inicia-se gradualmente o crescimento celular (vitelogênese), quando então pode ser visualizado um grande e conspícuo núcleo que ao completar seu desenvolvimento denomina-se vesícula germinal. O gameta feminino assume a forma típica de ovócito vitelogênico (OV) (Figura 6B). Este mesmo padrão de distribuição dos gametas na periferia do ácino no estágio proliferação foi observado em outras espécies por Kelly (2000) em Psammechinus miliaris, por Brewin et al. (2000) em Evechinus sp. E por Vaïtilingon et al. (2005) em
Tripneustes gratilla.
Esse estágio é caracterizado pelo crescimento em tamanho e número dos ovócitos pré-vitelogênicos (média do diâmetro = 43,56 μm). As gônadas em Proliferação contem ovócitos vitelogênicos (OV) que ainda estão em contato com a parede do ácinos e estão cercados por fagócitos nutritivos que preenchem o lúmen (Figura 6B). O tamanho desses ovócitos vitelogênicos em média é 97,69 μm de diâmetro.
c) Em maturação
18 ovócitos pré-vitelogênicos (OP) são encontrados aderidos à parede do tecido gonadal. Com a diferenciação celular os ovócitos vitelogênicos (OV) apresentam a região nuclear bastante visível e envolvida por uma vesícula germinativa que pode ocupar até a metade do citoplasma da célula. Com a maturação, os gametas passam a apresentar uma coloração mais acidófila (mais clara). Neste estágio a vitelogênese é um processo continuo e ovócitos em todos os estados estão presentes (Figura 8). Esse estágio é bem característico em equinóides, sendo semelhante em várias espécies: E. Lucunter (Tavares, 2004), T. gratilla (Vaïtilingon et al., 2005) e P. miliaris (Kelly 2000).
Figura 8: Gônada de fêmea de T. ventricosus no estágio Em Maturação com ovócitos em todos os estados. OP- Ovócitos pré-vitelogênicos; OV- Ovócitos vitelogênicos; OM- Ovócitos
d) Maturação máxima
19 O estágio de Maturação Máxima com a presença dos ovócitos maduros preenchendo o lúmen é comum em algumas espécies de ouriços como E.lucunter e A. lixula (Tavares, 2004), Centrostephanus rodgersiiin (Byrne et al., 1998),
Evechinus sp. (Brewin, 2000), Holopneustes purpurascens (Williamson &
Steinberg, 2002), P. miliaris (Kelly, 2000) e T. gratilla (Vaïtilingon et al. 2005).
e) Emissão de gametas ou desova
20
4.1.2 Machos
As Figuras 9 e 10 abaixo apresentam os cinco estágios do ciclo gametogênico em machos de T. ventricosus em aumentos de 200 e 400 vezes respectivamente, descritos a seguir.
21
Figura 10: Estágios do ciclo gametogênico em machos de T. ventricosus no Arquipélago de Fernando de Noronha: (A) Reserva; (B) Proliferação; (C) Em Maturação; (D) Maturação Máxima e (E) Emissão de Gametas. FN- Fagócitos nutritivos; L- Lúmen; CP- Células primárias; ES- Espermatozóides; SE- Série espermatogênica; ESR- Espermatozóides remanescentes. Aumento 400x.
a) Reserva
22 grânulos basófilos (GB) distribuídos irregularmente. O estágio Reserva para ambos os sexos se assemelha pelo total preenchimento do lúmen pelos fagócitos nutritivos, sendo o mais difícil para determinar o sexo. Tavares & Borzone (2006) observaram as diferenças nos tamanhos dos grânulos de fagócitos nutritivos para poder diferenciar o sexo nesse estágio.
b) Proliferação
O estágio Proliferação é caracterizado pelo início do desenvolvimento de uma camada de células sexuais primárias (CP), espermatogônias e espermatócitos, na parede do ácino, formando uma camada periférica contínua (primórdios das colunas espermáticas). O lúmen ainda é preenchido predominantemente pelos fagócitos nutritivos (FN) (Figuras 9B e 10B). Pequenas quantidades de espermatozóides podem ser encontradas no lúmen gonadal envolvidos pelo tecido de reserva, fagócitos nutritivos (FN), que ainda preenche grande parte do ácino. Nesse estágio ocorre o início da diferenciação celular dos espermatócitos (CP) em espermatozóides. O padrão de distribuição dos gametas no estágio Proliferação para machos da espécie T. ventricosus foi semelhante ao observado em P. miliaris (Kelly, 2000), H. purpurascens (Williamson & Steinberg, 2002), E. lucunter e A. lixula (Tavares, 2004) e T. gratilla (Vaïtilingon et al. 2005).
c) Em maturação
23 também conseguiu evidenciar claramente a série espermatogênica em E. lucunter e A. lixula.
d) Maturação máxima
No estágio Maturação Máxima uma densa massa de espermatozóides (ES) preenche quase todo o ácino, permanecendo ás vezes uma fina camada de fagócitos nutritivos e células primárias (CP) junto ao epitélio germinal (EP) (Figuras 9D e 10D). Algumas séries espermatogênicas ainda são presentes, ligando os espermatozóides (ES) produzidos pelas células primárias (CP) ao centro do ácino e os fagócitos nutritivos são quase inexistentes nesse estágio. Tal estágio foi observado por Williamson & Steinberg (2002) em H. purpurascens, e por Vaïtilingon et al. (2005) em Tripneustes gratilla, com o mesmo padrão de concentração dos gametas preenchendo quase todo o ácino no estágio Maturação Máxima para ambos os sexos.
e) Emissão de gametas ou desova
No estágio Emissão de Gametas o lúmen apresenta-se com espaços vazios (Figuras 9E e 10E). Em algumas imagens junto ao epitélio germinal (EP) aparece uma fina camada com fagócitos nutritivos (FN). Foi observado gônadas no estágio desova com espermatozóides remanescentes (Figura 10E).
4.1.3. Comparação dos estágios gametogênicos entre os sexos
24
25
Reserva; (B) Proliferação; (C) Em Maturação; (D) Maturação Máxima e (E) Emissão de Gametas. FN- Fagócitos nutritivos; L- Lúmen; OP- Ovócitos pré-vitelogênicos; OV- Ovócitos vitelogênicos; OM- Ovócitos; OR- Ovócitos remanescentes ; CP- Células primárias; ES- Espermatozóides; SE- Série espermatogênica; ESR- Espermatozóides remanescentes. Aumento 200x.
4.2. Razão Sexual
Para as amostras de fevereiro e abril de 2007 não foi possível a preparação das lâminas histológicas devido a problemas com a preservação das gônadas, o que impossibilitou identificar o sexo dos indivíduos nestes meses. A razão sexual (0,5:1) entre número total de fêmea / número total de indivíduos foi aceita para os 80 indivíduos coletados nas duas localidades (49 fêmeas e 31 machos, χ²= 0,06625 df = 1 p < 0,796877) (Figura 12). Em janeiro de 2007 na localidade do Air France não ocorreu a presença de machos dentre os 10 ouriços coletados e por isso a amostragem difere da razão de 05:1. Não foram observados indivíduos hermafroditas ao longo dos meses de coleta. A razão sexual de 0,5:1 é comum nos equióides (Williamson & Steinberg, 2002; Tavares & Borzone, 2006). A razão sexual do ouriço-branco em três locações nas Ilhas Virgens estudadas por Gilliken
et al. 1974 revisado por Lawrence (2007) foi de 0,5:1.
Média Erro Padrão Dez/2006 Jan/2007 Maio/2007 Jul/2007 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 1,1 n ú me ro d e f ê me a s / n ú me ro t o ta l d e in d iv íd u o s
Figura 12: Razão sexual de T. ventricosus no Arquipélago de Fernando de Noronha entre os meses de dezembro de 2006 e julho de 2007.
4.3. Freqüência dos estágios gametogênicos
26 observado apenas na coleta de maio 2007, chegando a 30%. O estágio desova foi observado em dezembro 2006 (9,09%) e janeiro 2007 (6,35%). Nas amostragens de julho de 2007 foram observados apenas dois estágios, em maturação (58,33%) e maturação máxima (41,67%).
A
B
27 Em relação aos machos, o padrão de distribuição dos estágios gametogênicos foi semelhante ao das fêmeas (Figura 13B). O período de reserva predominou nos meses de dezembro 2006 (88,89%), janeiro 2007 (100%), e maio 2007 (90%). Nos machos o estágio de proliferação ocorreu em maio de 2007 (10%) e julho de 2007 (12,5%). Os Estágios em maturação (50%) e maturação máxima (37,5%) foram observados apenas na amostragem de julho 2007.
Tanto para os machos quanto para as fêmea foi observado que a evolução do estágio gametogênico desde a reserva até a maturação máxima, ocorreu entre dezembro de 2006 e julho 2007. Em julho de 2007 o estágio de Maturação máxima não chegou a 50% para ambos os sexos, mostrando que no intervalo de 8 meses o ciclo gametogênico ainda não estava completo. Tal fato sugere que o ciclo gametogênico de T. ventricosus no AFN é parte de um ciclo anual e não apresenta duas desovas por ano, conforme relatado por Moore (1966) e Lawrence (1987) em outras localidades. Além disso, a freqüência de estágios do ciclo foi semelhante entre as duas áreas estudadas, ao contrário das populações de E.
lucunter em Barbados, que apresentaram diferenças na periodicidade da liberação
de gametas. Nesta última, as populações localizadas numa área de menor agitação da água apresentaram dois eventos de emissão contrastando com a população submetida a condições mais severas, onde foi registrada apenas uma época de eliminação de gametas (Lewis & Storey, 1984).
4.4. Índice Gonadal
28 machos aumentando ao longo das coletas, e atingindo a maior média no mês de julho de 2007.
A
B
C
Figura 14: Índice Gonadal em fêmeas (A), machos (B) e em ambos os sexos (C) de T. ventricosus no Arquipélago de Fernando de Noronha entre os meses de dezembro de 2006 e julho de 2007.
29
ventricosus no sul da Flórida ocorreu na primavera e também no outono. Dentre
os quatro meses coletados no presente estudo, o mês de julho de 2007 foi o que mostrou uma maior produção gonadal, com a presença de gametas maduros de ambos os sexos (Figura 14). Além disso, os valores do índice gonadal do Air France e da Baía do Sueste apresentam-se em ordem é crescente entre os meses de dezembro 2006 a julho de 2007, corroborando com a tendência de um ciclo reprodutivo anual (Figura 14C).
Observa-se também que para todos os meses de coleta o índice gonadal dos indivíduos coletados na Baía do Sueste foi sempre superior aquele obtido para o Air France. Nos equinodermos as demandas metabólicas destinadas à atividade reprodutiva são tão intensas que os organismos despendem a maior de parte do ano preparando-se tanto nutricionalmente como fisiologicamente (Williamson & Steinberg, 2002). Os ouriços tipicamente alocam energia para as gônadas antes e durante a gametogênese (Pearse & Cameron, 1991). Apesar do baixo número de dados, a relação do índice gonadal e o ciclo gametogênico também foi observada para T. ventricosus (Figura 15).
Macho Fêmea
RESERVA
PROLIFERAÇÃOEM MATURAÇÃOMATURAÇÃO MÁXIMADESOVA 0 5 10 15 20 25 30 Ín d ic e G o n a d a l (% )
30
5. Conclusões
31
6. Referências Bibliográficas
AMSLER, C. D.; MC CLINTOCK J. B.; BAKER, B. J. (1999). An antarctic feeding triangle: defensive interactions between macroalgae, sea urchins, and sea anemones. Mar Ecol Prog Ser. 183: 105-114.
ANDREW, N. L.; MAC DIARMIDE, A. B. (1991). Interrelations between sea urchins and spiny lobsters in northeastern New Zealand. Mar. Ecol. Prog. Ser. 70: 211-222.
ASELTINE, D.A. (1982). Tripneustes ventricosus and Lytechinus variegatus (Echinoidea: Toxopneustidae): habitat differences and the role of water turbulence. Master’s thesis. Ohio
State University. 145 pp.
BENTLEY, A. C. (1998). Reproductive cycle and gonadal histology of Echinodiscus biperforatus along the southern coast of South Africa. In: Proceedings of the 9th International Echinoderms Conference. San Francisco, 571-576.
BEZERRA JR., J. L. (1999). Comunidade planctônica do nêuston: malaco e ictiofauna na zona econômica exclusiva (ZEE) do nordeste do Brasil (REVIZEE). 153p. Tese de Mestrado. UFPE.
BREWIN, P.E.; LAMARE, M.D.; KEOGH, J.A.; MLADENOV, P.V. (2000). Reproductive variability over a four-year period in the sea urchin Evechinus (Echinoidea: Echinodermata) from differing habitats in New Zealand. Marine Biology, v.137, 543-557.
BYRNE, M. (1990). Annual reproductive cycles of the commercial sea urchin Paracentrotus lividus from an exposed intertidal and a sheltered subtidal habitat on the west coast of Ireland. Mar. Biol., Berlin, v.104, 275-289.
BYRNE, M.; ANDREW, N. L.; WORTHINGTON, D. G.; BRETT, P. A. (1998). Reproduction in the diadematoid sea urchin Centrostephanus rodgersii in contrasting habitats along the coast of New South Wales, Australia. Marine Biology, v.132, 305-318.
CAMERON, R.A. (1986). Reproduction, larval occurrence and recruitment in Caribbean sea urchins. Proc. of the Invertebrate larval biology workshop held at Friday Habour Marine Lab.
– Univ. of Washington. v.39, n 2, 332-346.
DRUMMOND, A. E. (1995). Reproduction of the sea urchins Echinometra mathaei and Diadema savigny on the South African eastern coast. Mar. Fresh. Res., v.46, 751-455.
ELNER, R; VADAS, R.L. (1990). Interference in ecology: the sea urchin phenomenon in the northwest Atlantic. Am. Naturalist 136: 108-25.
32 GIESE, A. C (1959). Comparative physiology: annual reproductive cycle of marine invertebrates.
Ann. Rev. Physiol.,New York, v.21, 547-576.
HALEY, M.P. & SOLANDT, J.L. (2001). Populations fluctuations of the sea urchins Diadema antillarum and Tripneustes ventricosus at Discovery Bay, Jamaica: a case of biological sucession ? Caribbean Journal of Science, v.37, n. 3-4, 239-245.
HARROLD, C.; PEARCE, J. S. (1987). The ecological role of echinoderms in kelp forests. Echinoderm Stud 2:137–233.
HENDLER, G.; MILLER, J.; PAWSON, D.; KIER, P. (1995). Sea Stars, Sea Urchins, and Allies: Echinoderms of Florida and the Caribbean. Washington: Smithsonian Institution Press.
KELLY, M.S. (2000). The reproductive cycle of the sea urchin Psammechinus miliaris (Echinodermata: Echinoidea) in a Scottish sea loch. J. Mar. Biol. Ass. v. 80, 909-919.
LAMARE, M.D.; BREWIN, P.E.; BARKER, M.F.; WING, S.R. (2002). Reproduction of the sea urchin Evechinus chloroticus (Echinodermata: Echinoidea) in a New Zealand fiord. New Zealand J. of Marine and Freshwater Res., v 36, 7-19.
LAWRENCE, J.M. (1975). On the relationship between marine plants and sea urchins. Oceanogr. Mar. Biol. Ann. Rev. 13: 213-86.
LAWRENCE, J. M. (1987). The functional biology of echinoderms. Baltimore: Johns Hopkins Univ. Press. 340 p.
LAWRENCE, J.M. (2007). Edible Sea Urchins: Biology and Ecology, Elsevier Science.
LEINAAS, H. P.; CHRISTIE, H. (1995). Effects of removing sea urchins (Strongylocentrotus droebachiensis): stability of the barren state and succession of kelp forest recovery in the east Atlantic. Oecologia. v. 105, 524-536.
LEWIS, J. B. & STOREY, G. S. (1984). Differences in morphology and life history traits of the echinoid Echinometra lucunter from different habitats. Mar. Ecol. Prog. Ser., Oldendorf, v.15, p. 207-211.
LUBCHENCO, J; GAINES, S. D. (1981). A Unified Approach to Marine Plant-Herbivore Interactions. I. Populations and Communities. Ann. Rev. Ecol. Sys. 12:405-37.
MC CLANAHAN, T. R. (1997). Recovery of fish populations from heavy fishing: Does time heal all? Proc 8th In Coral Reef Sym, 2:2033-2038.
MC CLANAHAN, T.R.; POLUNIN, N. & DONE, T. (2002). Ecological states and the resilience of coral reefs. Conserv. Ecol. v 6, n 2, p 18-45.
MOORE, H. (1966). Ecology of Echinoids. Pp. 74-82 in R. Boolootian, ed. Physiology of Echinodermata. New York: Interscience Publishers.
33 PEARSE, J. S. & CAMERON, R. A. (1991). Echinodermata: Echinoidea. In: Reproduction of marine invertebrates: Echinoderms and Lophophorates. Giese Pearse & Pearse (Eds.). California: Boxwood Press. v.4, 513-662.
ROGERS-BENNETT, L. (2007). The ecology of Strogylocentrotus franciscanus and
Strongylocentrotus purpuratus. in Lawrence, J.M. (ed.) Edible Sea Urchins: Biology and Ecology. Elsevier Science B.V. Amsterdam. p. 393-426.
RUPPERT, E.E. & BARNES, R.D. (1996). Zoologia dos invertebrados, 6ª edição, São Paulo, Editora Roca.
SCHEIBLING, R.E. & MLADENOV, P.V.. (1987). The decline of the sea urchin, Tripneustes ventricosus, fishery of Barbados: a survey of fishermen and consumers. Marine Fisheries Review 49(3), p. 62-69.
SCHEIBLING, R. E. & MLADENOV, P. V. (1988). Distribution, abundance and size structure of Tripneustes ventricosus on traditional fishing grounds following the collapse of the sea urchin fishery in Barbados. Echinoderm Biology, 449-455.
SHARP, W. C. (2000). Destructive Urchin Grazing in a Seagrass Bed in Western Florida Bay: When should resource managers intervene? A Synthesis document of the Florida Bay Adjacent Marine Systems Science Program. Florida Bay Education Project - University of Florida.
STRATHMANN, R. R. & STRATHMANN, M. F. (1972). The relationship between adult size and brooding in marine invertebrates. Am. Nat., Chicago, v.119, n. 1, 91-101.
STRATHMANN, M. F. (1987). Reproduction and development of marine invertebrates of the Northern Pacific coast. 2. Ed. Washington: University Washington Press. 670 p.
TAVARES, Y. A. G. (2004). Biologia reprodutiva dos equinóides Echinometra lucunter (Linnaeus, 1758) e Arbacia lixula (Linnaeus, 1758) na Ilha da Galheta, litoral paranaense, Brasil. 115p.
TAVARES, Y.A.G. & BORZONE, C.A. (2006). Reproductive cycle of Mellita quinquiesperforata (Leske) (Echinodermata, Echinoidea) in two contrasting beach environments. Revista Brasileira de Zoologia. v. 23 (2), p. 573-580.
TRAVASSOS, P. (1999). L’étude des relations thons-environnement dans l’océan Atlantique intertropical ouest : cas de l’albacore (Thunnus albacares, Bonnaterre 1788), du germon
(Thunnus alalunga, Bonnaterre 1788) et du thon obèse (Thunnus obesus, Lowe 1839).
Tese de Doutorado. l’UNIVERSITE PARIS.
UNDERWOOD, A. J.; KINGSFORD, M. J.; ANDREW, N. L. (1991). Patterns in shallow subtidal marine assemblages along the coast of New South Wales. Austral Ecology v.16 (2), 231–
34 VAÏTILINGON, D.; RASOLOFONIRINA, R.; JANGOUX, M. (2005). Reproductive Cycle of Edible Echinoderms from the Southwestern Indian Ocean. Western Indian Ocean J. Mar. Sci. v. 4 (1), p. 47–60.
VENTURA, C. R. R.; LIMA, R. P. N.; NOBRE, C. C.; VERÍSSIMO, I.; ZAMA, P. C. (2006). Capítulo 9. Filo Echinodermata. In: LAVRADO, H. P. & IGNACIO, B. L. (Eds.). Biodiversidade bentônica da região central da Zona Econômica Exclusiva brasileira. Rio de Janeiro: Museu Nacional. 339-389 (Série Livros n. 18).
35
APÊNDICE 1
Procedimentos para preparação das lâminas histológicas para identificação dos estágios do ciclo gametogênico de T. ventricosus no Arquipélago de Fernando de Noronha:
1- Banho em Xilol I - 10 minutos 2- Xilol II - 10 minutos
3- Álcool absoluto I - 5 min.
4- Álcool etílico absoluto II - 5 min. 5- Álcool etílico absoluto III - 5 min. 6- Álcool etílico 95% - 5 min.
7- Álcool etílico 80% - 5 min.
8- Lavagem das lâminas em água corrente - 10 min.
9- Lavagem das lâminas em água destilada com duas trocas de 5 min. cada. 10- Solução de Hematoxilina de Harris - 5 a 10 min.
11- Lavagem em água corrente
12- Diferenciação em solução de álcool-ácido (rapidamente ) 13- Lavagem em água corrente- 3 a 5 min.
14- Álcool etílico 95% - lavar bem (4 imersões) 15- Solução de Eosina- 5 min.
16- Álcool etílico absoluto IV- 4 imersões 17- Álcool etílico absoluto V- 4 imersões 18- Álcool etílico absoluto VI- 4 imersões 19- Álcool etílico absoluto VII - 4 imersões