UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
ADESÃO, PROLIFERAÇÃO E GENOTOXICIDADE CELULAR DE CELULOSE BACTERIANA MODIFICADA POR PLASMA
NAISANDRA BEZERRA DA SILVA
ii
ADESÃO, PROLIFERAÇÃO E GENOTOXIDADE CELULAR DE CELULOSE BACTERIANA MODIFICADA POR PLASMA
Naisandra Bezerra da Silva
Orientador: Prof. Dr. Clodomiro Alves Júnior
Co-orientadora: Profa Dra Silvia Regina Batistuzzo de Medeiros
Natal RN
2010
iii
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMAS DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Coordenadora do Programa de Pós-Graduação em Ciências da Saúde: Profª. Drª. Técia Maria de Oliveira Maranhão
CATALOGAÇÃO NA FONTE
S586a
Silva, Naisandra Bezerra da.
Adesão, proliferação e genotoxicidade celular de celulose
bacteriana modificada por plasma / Naisandra Bezerra da Silva. – Natal, 2011.
79f.
Orientador: Profº Drº Clodomiro Alves Júnior. Coorientadora: Profª Drª Silvia Regina Batistuzzo de Medeiros.
Tese (Doutorado) – Programa de Pós-Graduação em Ciências da Saúde. Centro de Ciências da Saúde. Universidade Federal do Rio Grande do Norte.
1. Enxerto de pele – tese. 2. Teste de biocompatibilidade – tese. 3. Acetobacter Xylinus – tese. 4. Gluconacetobacter Xylinus – tese. I. Alves Júnior, Clodomiro. II. Medeiros, Silvia Regina Batistuzzo de. III. Título.
iv
NAISANDRA BEZERRA DA SILVA
ADESÃO, PROLIFERAÇÃO E GENOTOXIDADE CELULAR DE CELULOSE BACTERIANA MODIFICADA POR PLASMA
Presidente da Banca: Prof. Dr. Clodomiro Alves Junior (UFRN)
BANCA EXAMINADORA:
Profa. Dra. Christina Alves Peixoto (UFPE) Prof. Dr. Gilberto Weissmuller (UFRJ)
Prof. Dr. Carlos Augusto Galvão Barboza (UFRN)
Prof. Dr. Custódio Leopoldino de Brito Guerra Neto (UFRN)
v
“Escuta e serás sábio. O começo da sabedoria é o silêncio.”
vi
DEDICATÓRIA
A Deus, pela presença constante em minha vida, me guiando pelos caminhos
certos que me trouxeram paz e conquistas.
Aos meus pais: Vicente e Norma pela compreensão da minha ausência em
casa e pela confiança sempre em mim depositada, além dos ensinamentos que
vii
Ao Prof. Dr. Clodomiro Alves Junior pela oportunidade e confiança em mim depositada. Homem sábio de grande inteligência, simples, humilde e amigo
que nas horas difíceis utilizou sua paciência e compreensão ao conduzir
minha orientação.
A Profa Dra Silvia Regina Batistuzzo de Medeiros, exemplo de pesquisadora, pela efetiva colaboração na orientação desta pesquisa e pelos importantes
ensinamentos transmitidos.
Aos meus amigos Prof. Dr. Carlos Eduardo Bezerra de Moura e Prof. Dr. Hugo de Oliveira Rocha por toda amizade, ajuda e ensinamentos passados
durante essa jornada.
Ao Prof. Dr. Francisco Miguel Portela Gama e Dra Susana Moreira, cujas contribuições foram indispensáveis à realização desse trabalho.
Aos Professores Dr. Edivaldo da Silva Trindade e Dra. Célia Regina Cavichiolo Franco por todas as contribuições com as análises de
microscopia.
A minha irmã Selma e ao meu noivo Marcello por toda torcida e incentivo. Aos meus amigos Kaline, Cleysivam, Karina, que desde a graduação fazem
parte da minha vida como verdadeiros irmãos.
viii
Ao pessoal do BIOPOL, LabPlasma e LBMG por tantos momentos compartilhados. Especialmente à Jailma, Jeffersom, Joana, Juliana, Juliane,
Raniere, Manuella, Michelle, Roseane, Danilo, Igor e Aroldo por todas as
contribuições nos experimentos.
Aos amigos da Pós-Graduação Bianca, Joel, Nedinaldo, Ewerton e Antenor pelos momentos de descontração entre as aulas e a amizade consolidada
durante o curso.
Ao Chefe do Departamento de Morfologia Prof. Celcimar Alves Câmara e aos colegas da disciplina de Histologia Prof. Dr. Gustavo da Cunha Lima e
Profa Dra Christina da Silva Camillo por todo apoio.
ix
Resumo... xi
1 INTRODUÇÃO... 01
1.1 Objetivos... 03
1.1.1 Objetivo geral... 03
1.1.2 Objetivos específicos... 03
2 REVISÃO DA LITERATURA... 04
2.1 A celulose bacteriana... 04
2.2 Modificação de superfície... 05
2.3 Plasma... 06
2.4 Genotoxidade... 07
3 ANEXAÇÃO DOS ARTIGOS... 10
3.1BC nanofibres: In vitro study of genotoxicity and cell proliferation . 10 3.2 Adhesion, cell proliferation and genotoxicity of bacterial cellulose surfaces modified by plasma ……….. 18
3.3 Influence of argon-ion bombardment of titanium surfaces on the cell behavior………..… 50
3.4 Effect of titanium surface modified by plasma energy source on genotoxic response in vitro ……….……….. 57
4. COMENTÁRIOS, CRÍTICAS E SUGESTÕES... 66
4.1 Expectativas futuras... 66
4.2 Publicação/divulgação... 68
4.3 Dificuldades... 70
5. REFERÊNCIAS... 71
x 3T3 - Fibroblastos
CAs - Aberrações cromossômicas
CB - Celulose bacteriana
CBP - Celulose bacteriana modificada por plasma
CHO K1 - Chinese hamster ovary K1
CSAs - Aberrações tipo cromossômicas
CTAs - Aberrações do tipo cromatídica
DNA - ácido desoxirribonucleico
MEV - Microscopia de electronica de varredura
MFA - Microscopia de força atômica
MTT - 3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl-tetrazolium (MTT)
NFs - Nanofibras
xi
ulcerações ou como enxerto. Modificações em sua superfície podem
determinar respostas no funcionamento celular dos tecidos adjacentes,
influenciando sua biocompatibilidade. Este estudo apresenta a primeira
avaliação da influência de nanopartículas de celulose bacteriana e de
membranas de celulose bacteriana com superfície modificada por plasma
(CBP) no comportamento e genotoxicidade celular. Inicialmente, a proliferação
celular foi avaliada com o teste MTT e danos ao DNA foram avaliados
utilizando-se os testes Cometa e Kado, sob a influencia das concentrações de
0,1; 0,5 e 1,0 mg/ml de nanofibras de CB em contato com fibroblastos 3T3 e
células CHO-K1. Os resultados obtidos nessas análises revelaram que a
proliferação celular, para os dois tipos de células, foi cerca de 15-20% menor
na presença de NFs, após 72h de cultivo celular, independentemente da
concentração utilizada, estas também não promoveram dano significativo ao
DNA. Em um segundo trabalho, membranas de celulose bacteriana foram
submetidas ao plasma em atmosfera contendo 70%N2 e 30% de O2. Posteriormente foram caracterizadas por MEV e AFM e submetidas aos
ensaios cometa, micronúcleo, de adesão e proliferação celular. Os resultados
revelaram que o plasma modificou a superfície da CBP produzindo uma
rugosidade de aproximadamente 70± 5,1 nm. Na CBP, as células tornaram-se
mais alongadas com proliferação maior, provavelmente, influenciadas pelo
xii
ser testado in vivo com futuro potencial para implante artificial.
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma farmacologia, entre outros. Atualmente, nesta área, observa-se um crescente
interesse no desenvolvimento de novos biomateriais utilizados no reparo ou
substituição de tecidos e órgãos lesionados.
O sucesso clínico de dispositivos moldados com qualquer biomaterial
depende da interação entre as células do organismo implantado e a superfície
do material utilizado (1). Assim, para o desenvolvimento de um material clinicamente aplicável, a modificação de superfície é uma ferramenta eficaz
que pode aumentar sua biofuncionalidade (2).
As características da superfície de um biomaterial como
rugosidade/topografia (3), energia (4) e carga (5) determinam sua interação com fluidos corporais que, por sua vez desencadeiam uma cascata de reações
governando a resposta celular (adesão, proliferação e diferenciação), e
definem a biocompatibilidade do material (6). Diversas são as técnicas (métodos mecânicos, químicos e físicos) utilizadas com o objetivo de modificar a
superfície e, portanto garantir uma resposta biológica funcionalmente
adequada. Dentre os métodos físicos destaca - se o tratamento à plasma (7-9), sua utilização permite modificar as propriedades da superfície através da
criação de novos grupos funcionais, mudanças topográficas, adição/subtração
química à superfície. Neste contexto, materiais como titânio, hidroxiapatita e
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma no Laboratório de processamento de materiais por plasma (LabPlasma) da
UFRN.
Superfícies de titânio, submetidas ao plasma, revelaram que variações
na microtopografia ou na molhabilidade podem afetar a proliferação de células
tronco pré-osteoblasticas ou ainda, proporcionar menor efeito genotóxico em
células CHO-K1 (ovário de hamster chinês). Desse modo, os trabalhos:
“Influence of Argon-ion bombardment of titanium surfaces on the cell behavior”
e “Effect of titanium surface modified by plasma energy source on genotoxic
response in vitro”, anexados a este estudo, corroboram com a idéia de que as
propriedades da superfície podem alterar a resposta funcional da célula frente
a um biomaterial. Diante disso, surgiu a possibilidade de ampliar a aplicação da
celulose bacteriana através da modificação de sua superfície.
A celulose bacteriana (CB), sintetizada por Gluconacetobacter xylinus
tem se revelado um biomaterial extremamente versátil e promissor (10,11). Apresenta diversas vantagens estruturais que a levam a ser considerada um
curativo biológico natural. É utilizada como substituto temporário da pele, no
tratamento de feridas, queimaduras, úlceras, corrupções, e abrasões dérmicas
(12-15); como prótese vascular, na liberação de medicamentos e na regeneração
tecidual guiada (10,16).
Diante das possíveis aplicações da celulose bacteriana na área de terapia
celular; que a interação material-tecido parece estar intimamente relacionada
com os tratamentos de superfície aplicados aos biomateriais; e que poucos
estudos biológicos têm se preocupado em avaliar o efeito do tratamento da
superfície sobre a biocompatibilidade da celulose bacteriana; este estudo
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma 1.1.1 OBJETIVO GERAL
Avaliar a adesão e proliferação celular sobre nanofibras de celulose
bacteriana, e superfícies de celulose bacteriana tratadas por plasma
verificando ainda suas genotoxicidades.
1.1.2 OBJETIVOS ESPECÍFICOS
Caracterizar nanofribas de celulose bacteriana através de microscopia de transmissão;
Avaliar a proliferação de fibroblastos 3T3 frente a diferentes concentrações de nanofibras de CB pelo método MTT.
Analizar a genotoxicidade de NFs de CB a partir dos testes cometa e Ames;
Submeter membranas de celulose bacteriana ao tratamento a plasma, modificando suas superfícies, e caracteriza-las através de XPS, MFA e
MEV;
Avaliar a proliferação e adesão de células CHO-K1, em membranas de CB tratadas e sem tratamento a plasma, através dos métodos MTT e
cristal violeta;
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma 2. REVISÃO DA LITERARURA
O desenvolvimento de polímeros biodegradáveis com superfícies de
porosidades adequadas para o apoio mecânico e orientação tecidual, desperta
o interesse da engenharia de tecidos. Ainda, em alguns casos, superfícies
portadoras de fatores de crescimento para acelerar o processo de cura quando
colocadas in vivo(2). Nesse sentido, membranas de celulose bacteriana atraem
a atenção de diversos pesquisadores sendo utilizadas principalmente como
implante de pele ou de mucosas graças a sua semelhança, morfológica, à
associação de fibras colágenas da derme ou da lâmina própria.
2.1 A celulose bacteriana (CB)
A celulose bacteriana é um exopolissacarídeo liberado na superfície
bacteriana através de poros na membrana plasmática sob a forma de longas
fibrilas, que podem se agregar originando uma película (Figura 01). Sua
biogênese geralmente dependente da fosforilação da glicose por glucoquinases
(17) e ocorre na interface entre o meio de cultura e a superfície gasosa (18,19).
Apresenta diversas características que a diferem da celulose vegetal, é obtida
livre de lignina e hemicelulose (10). Possui maior cristalinidade, resistência à tração, elasticidade e durabilidade (20). Sua estrutura forma uma barreira física contra infecções e promove alta capacidade de absorver e reter água.
Morfologicamente é composta por feixes densos de microfibrilas muito finas de
tamanho nanométrico. Embora muito porosa, seus poros são relativamente
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Figura 01: Membrana de celulose bacteriana
A celulose bacteriana mostrou ser biocompatível quando associada ao
tecido ósseo, à pele, vasos sangüíneos, fibroblastos e hepatócitos de ratos e
coelhos (27-32). Apesar de ser biodegradável no ambiente, permanece por longos períodos em contato com os tecidos quando implantada. Segundo Islam
e Tanaka (33) uma exposição contínua a determinados compostos pode gerar efeitos bioacumulativos que alteram diversas funções celulares ou ainda
proporcionam efeitos mutagênicos, carcinogênicos e/ou teratogênicos. Apesar
dos avanços recentes, a celulose bacteriana ainda não é amplamente utilizada
ou investigada principalmente quanto à resposta celular, genotoxicidade e seus
riscos mutagênicos.
2.2 Modificação de superfície
As propriedades de superfície de um biomaterial são determinantes para
respostas das células na interface célula-biomaterial, consequentemente
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma propriedades a microtopografia/rugosidade tem apresentado alto poder de
alterar a adesão, migração, morfologia, apoptose, ativação
gênica/diferenciação e ativação de macrófagos (35-38).
Na busca por uma superfície ideal, de acordo com suas possibilidades
de aplicação, várias pesquisas têm sido desenvolvidas com o intuito de
modificar as superfícies por diversos tipos de processos(8). Estes envolvem métodos mecânicos, químicos e físicos de tratamento de superfície, gerando
assim, vários graus de texturas (39,40). Entretanto, dentre os diferentes métodos existentes, aqueles que utilizam o plasma como fonte energética são os que
mais avançam nos últimos anos, devido principalmente, à sua versatilidade (41). O tratamento à plasma merece destaque pois permite modificações na
superfície do material sem comprometer suas propriedades intrínsecas como o
módulo de elasticidade e resistência (42) . Ainda, por necessitar de pequeno tempo de tratamento, possuir baixo custo e não ser prejudicial ao meio
ambiente (42).
2.3 Plasma
O plasma é o quarto estado da matéria e consiste numa atmosfera
contendo elétrons, íons, partículas neutras e partículas energéticas (43). Em nível laboratorial, pode ser obtido através de uma descarga elétrica em um gás,
pela aplicação de uma diferença de potencial entre dois elétrodos inseridos
numa câmara, com pressões inferiores a 100 Pa. A diferença de potencial
resulta em uma aceleração de elétrons que colidirão com átomos e moléculas
neutras do gás, produzindo íons e novos elétrons. Os íons produzidos são
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma convencionais (44).
No processo de erosão por plasma (plasma etching) as condições da
descarga são modificadas de modo a diminuir a taxa de sputtering. Isto
significa dizer que apenas íons do gás da descarga estão presentes no plasma.
Se a atmosfera é composta por elementos muito reativos como o oxigênio, por
exemplo, íons desse elemento reagem com átomos da superfície que se
pretende modificar e, por volatilização dos produtos da reação, serão criados
poros na superfície (45).
Esta técnica permite produzir uma textura uniforme superficialmente,
devido a facilidade do controle do processo para gerar a rugosidade, quer seja
através do aumento da energia de bombardeamento e /ou número de íons
bombardeantes(41,42).
2.4 Genotoxicidade
Testes de citotoxicidade in vitro desempenham um papel importante na
avaliação da biocompatibilidade de novos materiais utilizados para a confecção
de implantes. O padrão internacional ISO-10993-5 (Avaliação biológica de
dispositivos médicos, testes de citotoxicidade in vitro), define os métodos de
ensaio a serem utilizados para a determinação de citotoxicidade in vitro.
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma sendo as avaliações feitas considerando-se diferentes parâmetros, tais como
potencial genotóxico, aderência celular, proliferação, alterações morfológicas e
alterações do metabolismo (47).
Um composto/material é considerado genotóxico quando é capaz de
promover lesões na molécula de DNA, contudo estas lesões podem ser
reparadas ou não pelos sistemas de reparo celular. Caso o reparo não ocorra e
haja permanência da lesão, uma mutação pode ser instalada. Deste modo, um
agente é dito mutagênico quando é capaz de modificar a seqüência
nucleotídica original da molécula de DNA.
A quantificação do risco genotóxico e mutagênico de biomateriais, pode
ser realizada através de diversos bioensaios entre estes merecem destaque o
teste Cometa e micronúcleo que têm sido utilizados internacionamelmente
como um sistema de triagem para detectar a predisposição de risco genotóxico
e/ou mutagênico de novos químicos e drogas.
O teste cometa (single cell gel eletrpphoresis –SCGE) detecta danos no
DNA que não foram corrigidos, através de imagens semelhantes a um cometa
geradas por migração eletroforética dos fragmentos de DNA em relação ao
núcleo principal da célula (48,49).
Micronúcleos são pequenos corpos extra nucleares, expressos em
células que estão se dividindo, podendo ser fragmentos de cromossomos ou
cromossomos inteiros mal segregados durante a mitose. Assim, os
micronúcleos não são incluídos no núcleo da célula filha durante a telófase
(50,51). A indução de micronúcleos pode ser resultado de compostos
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma linhagens de Salmonella typhimurium, derivadas da linhagem parental LT2,
auxotrófica para a histidina (his-), geradas em laboratório para detectar mutações do tipo deslocamento de quadro de leitura, substituição de pares de
bases ou danos oxidativos ao DNA. Essas linhagens não se proliferam em
meio de cultura mínimo, sem histidina, a menos que ocorram mutações que
restaurem a síntese desse aminoácido. A frequência de mutação reversa pode
ser medida pela contagem do número de colônias que crescem em meio
mínimo após a exposição de uma população bacteriana frente a um agente
mutagênico(54).
O ensaio de aberrações cromossômicas é uma técnica citogenética
clássica onde danos no DNA, em nível cromossômico são acessados durante a
metáfase celular. Aberrações cromossômicas (CAs) são mudanças na estrutura
ou no número normal dos cromossomos, que podem ocorrem
espontaneamente ou resultar de um tratamento químico ou físico. Levando-se
em conta a morfologia, as CAs podem ser divididas em duas classes:
aberrações tipo cromossômicas (CSAs), as quais consistem em quebras de
dupla fita de DNA envolvendo um ou múltiplos cromossomos; e as aberrações
do tipo cromatídica (CTAs), as quais envolvem somente uma das duas
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma 3. ANEXAÇÃO DOS ARTIGOS
3.1 BC nanofibres: In vitro study of genotoxicity and cell proliferation Revista: Toxicology letters
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma 3.2 Adhesion, cell proliferation and genotoxicity of bacterial cellulose surfaces modified by plasma
Revista: Submetido ao Journal Biomedical Materials Research Part A
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Batistuzzo3, Fabia K. Andrade4 , Renata A. N. Pértile4 , Francisco M. Gama4, Clodomiro Alves Jr5.
1Department of Morphology, Bioscience Center (BC), Federal University of Rio Grande do Norte (UFRN), Natal-RN, ZC 59072-970, Brazil.
2Department of Biochemistry, (BC), Federal University of Rio Grande do Norte. 3Department of Cell Biology and Genetics, (BC), Federal University of Rio Grande do Norte.
4IBB, Institute for Biotechnology and Bioengineering, University of Minho, Campus de Gualtar, ZC 4710-057 Braga, Portugal.
5Department of Mechanical Engineering - Center of Technology, Federal University of Rio Grande do Norte.
* Corresponding Author:
Federal University of Rio Grande do Norte
Department of Morphology, Bioscience Center
Natal-RN, ZC 59072-970, Brazil.
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Abstract: Bacterial cellulose (BC) has a wide range of potential applications, namely as temporary substitute skin in the treatment of skin wounds, such as
burns, ulcers and grafts. Surface properties determine the functional response
of cells, an important factor for the successful development of biomaterials. This
work evaluates the influence of bacterial cellulose surface treatment by plasma
(BCP) on the cellular behavior and its genotoxicity potential. The modified
surface was produced by plasma discharge in N2 and O2 atmosphere, and the roughness produced by ion bombardment characterized by scanning electron
microscopy (SEM) and atomic force microscopy (AFM). Cell adhesion, viability
and proliferation on BCP were analysed using crystal violet staining and the
3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl-tetrazolium (MTT) method. Genotoxicity
was evaluated using the comet and cytokinesis block micronucleus assay. The
results show that the plasma treatment changed surface roughness, producing
an ideal cell attachment, evidenced by more elongated cell morphology and
improved proliferation. The excellent biocompatibility of BCP was confirmed by
genotoxicity tests, which showed no significant DNA damage. The BCP has
therefore great potential as a new artificial implant.
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma
Gluconacetobacter xylinum has proved to be a remarkably versatile and
promising biomaterial. It can be used in a wide variety of technological
applications, such as paper products, electronics, acoustics, and biomedical
devices [1][2].
Bacterial cellulose has been demonstrated to be a valuable temporary
skin substitute for the treatment of skin wounds, such as burns, ulcers, grafts,
as an adjuvant in dermal abrasions [3-5], as a vascular graft, in the release of
drugs and in tissue guided regeneration [1,6].
Bacterial cellulose has several characteristics that differ from plant
cellulose, such as higher crystallinity, tensile strength, elasticity and durability
[7]. Its nanostructure is a physical barrier against infection and increases water
absorption and retention. It has been shown to be biocompatible when
associated with bone tissue, skin tissue, blood vessels, fibroblasts and
hepatocytes of rats and rabbits [9-13] and the nanofibres did not exhibit
genotoxicity [14]. Despite recent advances, with the creation of new
biomaterials using bacterial cellulose, few studies have investigated cellular
responses or genotoxic and mutagenic risks.
Despite its excellent properties, BC is composed of dense microfibrils
with relatively small pores [15][6] that can influence its ability to perform as a
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma membrane surface, resulting in larger pores or increased roughness, may be a
way to expand its use.
The use of plasma as an energetic source for surface modification seems
to be a good option for the surface modification of BC, not compromising its
mechanical properties. Plasma can also be beneficial in changing surface
topography, increasing surface roughness, in addition to cleaning / sterilizing
and increasing surface wettability [20][21].
Plasma is the fourth state of matter. It is produced by an electric
discharge in gas, by applying a voltage between two electrodes inserted in a
chamber, at low pressures. Because of this voltage, electrons are accelerated and collide with plasma particles, forming neutral particles, ions, excited
particles and electrons. The ions produced are accelerated to the cathodically
polarized electrode, taking part in a series of effects [22]. Among these effects
is the breaking of molecule chains, the formation of new functional groups
and/or morphological alterations, such as microporosity [23].
To improve BC-cell interaction, the former was treated by plasma and
characterized according to both changes generated on the surface and cellular
response. In the present work we used a plasma atmosphere containing a
mixture of 70% N2 and 30% O2 because of the results found in our earlier study, which elsewhere was shown to significantly increase polyester surface
roughness[24][25], resulting in altered surface wettability.
Therefore, the objective of this study was to evaluate the effect of
bacterial surface modification, resulting from plasma treatment, on in vitro cell
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Preparation of BC substrates
The bacterial cellulose membranes were produced according to Moreira
et al. [14] and subsequently treated in a plasma reactor, using an atmosphere
with a gas mixture containing N2 (70%) and O2 (30%). The plasma reactor used for the treatment (Fig. 1)) consists mainly of a reaction chamber, a vacuum
system, and a power system. In addition to two electrodes and an adjusting
ring, the plasma chamber also included a glass cylinder (400 mm in length and
320 mm in diameter), for a total volume of 0.32m3. The ends of the tube were sealed by two stainless steel flanges. The connection of the bottom flange held
vacuum, pressure sensors and thermocouples. The power supply had a
continuously adjustable output up to 1500V DC and 2A current. The samples,
measuring 2.5 cm × 5.0 cm, were fixed on the inner chamber, using an
adjustment ring, and placed between two electrodes, 4 cm from the cathode, as
suggested by Costa et al. [24]. This distance was necessary to avoid thermal
alterations on the surface during processing, given that the cathode reached
temperatures above 150oC during previous experiments.
All treatments were performed under the same conditions (Table 1).
Voltage, current, pressure and cathode temperature were measured and
controlled on the control panel. After stabilization, the plasma was initiated to
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma analyzed using a Nova NanoSEM 200 scanning electron microscope
(Netherlands), with accelerating voltage of 5kV.
Surface roughness was assessed by measuring the roughness
parameter, Ra (roughness average), Rp (mean peak) and Rv (valleys) using
atomic force microscopy (AFM - SPM9500J3 Shimadzu). Each sample was
scanned at six different randomly selected locations; the total scan area was
approximately 15 x 15 µm2. The values were calculated from the 5 x 5 µm2 area in the middle of the scanned area.
Determination of contact angles – wettability
Water contact angles were measured using a face contact angle meter
(OCA 20, Dataphysics, Germany). The contact angle of the untreated and
treated bacterial cellulose surfaces was measured by the sessile drop method
[26], in which a 2µL droplet of ultra pure water (Milli Q) was placed on a
horizontal BC surface and observed with a face contact angle meter. The
images were captured and the angle formed by the tangent of the droplet with
the surface was measured.
Analysis of X-ray photoelectron spectra (XPS)
XPS analysis was performed using an ESCALAB 200A, VG
Scientific (UK) with PISCES software for data acquisition and analysis.
For analysis, an achromatic Al (Kα) X-ray source operating at 15kV (300
W) was used, and the spectrometer, calibrated to the Ag 3d5/2 (368.27 eV)
reference, was operated in CAE mode with 20 eV pass energy. Data acquisition
was performed at a pressure below 1.E-6 Pa. Survey scan spectra were
high-Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma to the hydrocarbon component (C-C) in the C 1s spectra at 285 eV.
Cell culture
Chinese hamster ovary (CHO-K1) cells were cultivated in Dulbecco’s
Modified Eagle’s Medium (DMEM – Invitogen), supplemented with 10% fetal
bovine serum (FBS -Gibco, Germany) 100 UI/mL of penicillin and 100 μg/mL
of streptomycin. The culture was incubated at 37oC in a humidified atmosphere of approximately 5% CO2. Confluent cells, grown to confluence in 75 mL TPP culture flasks were then detached with 0.15 % trypsin (Cultlab, Brasil) for 5 min,
5 mL of complete medium was added, and the cells were centrifuged at 1800
rpm for 5 min. After the pellet was suspended in 1mL of fresh medium, CHO K1
was counted with a Neubauer chamber and used in the assays. The cells were
seeded on Discs of BC (1cm in diameter) with treated (BCP) and untreated
plasma (BC). In all the negative controls the cells were cultivated on the plastic
tissue culture plate. For comet assay and micronuclei respectively the positive
controls were treated with 100 mM/mL of hydrogen peroxide and 0.1µg/mL of
mitomycin C. Each treatment was performed in triplicate to ensure
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Cell adhesion
CHO-K1 cells were detached from the subculture with 0.15% trypsin
(Cultlab, Brazil) for 5 min, resuspended, and plated on BC membranes placed
on 24-well plate at a cell population density of 5 X 105 cells/mL in DMEM supplemented with 10% FBS and antibiotics. The media were removed from
three samples out of nine in each group (BC, BCP) at 1, 2 and 3 hours of
incubation, respectively, and the unattached cells were washed away twice with
PBS at 37oC. The material was subsequently fixed in methanol PA ice for 5 min and washed again with PBS. Attached cells were stained with a solution of
0.2% crystal violet in 2% methanol for 5 min at room temperature. Stained cells
were washed with PBS and the bound dye was solubilized with 100 mL of
solubilization buffer (v/v mixture of 0.1M Na3C6H5O7 and 50% ethanol) to be transferred to 96-well plates. Absorbance (optical density, OD) was measured
using ELISA analyzer (Spectra µQuant – Biotec – MKX 200) at 570 nm. Cell
morphology was also observed by SEM at 24h and 48h to inspect cell
accommodation in the membranes. Cell-seeded samples were fixed with 1%
glutaraldehyde buffer (pH 7.4) for 1h, dehydrated using a gradation series of
ethanol/distilled water mixtures (30%, 50%, 70%, 90%, 100%). The critical
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma tetrazolium bromide - Invitrogen) solution, prepared using DMEM, was added to
each well and incubated for 4h. The MTT was subsequently removed from the
wells and 1mL of absolute ethanol added and mixed. Aliquots (200µL) of the
culture medium were transferred to 96-well plates and quantified
spectrophotometrically (µQuant – Biotec – MKX 200) for absorbance with a
microplate reader (TPP) at 570 nm.
Cytokinesis block micronucleus (CBMN)
Exponentially growing cells were cultured on BC or BCP membranes or
plastic well plates for controls until reaching 80% confluence. CHO-K1 cells
were then washed twice with phosphate-buffered saline (PBS) prior to a 72h
incubation in fresh medium (DMEM) containing 10% FBS and 5.0µg/mL
cytochalasin-B (cyt-B, Sigma) at 37oC, as described by Fenech [27], with some alterations [28]. At the end of cyt B treatment, the cells were washed twice with
PBS, trypsinized and harvested by centrifugation at 1500 rpm for 5 min. The
pellet was resuspended in 5% KCL at ambient temperature for 5 min. They
were then re-centrifuged, fixed in 20:1 (v/v) methanol/acetic acid, placed on a
clean microscope slide and stained with 5% (v/v) Giemsa for 10 min at 60ºC.
For each bacterial cellulose membrane sample, 3000 binucleated cells (i.e.
1000 from each of the two slides prepared from the triplicate cultures), were
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma microscopy at a magnification of 200-1000x. All sides were coded for blind
analysis.
Comet assay
The alkaline comet assay was performed, as described by Singh et al.
[29], with some adaptations. The cells that were on the BC, BCP and controls
(1.0 x 106 - 25µL) were embedded in 75µL of 0.75% low melting point agarose. After the agarose solidified the slides were placed in lysis buffer (2.5 M NaCl,
100 mM EDTA and 10 mM Tris; pH 10.0) containing freshly added 1% (v/v)
Triton X-100 and 10% (v/v) dimethyl sulphoxide for 12h at 4oC. After treatment with lysis buffer, the slides were washed in PBS and incubated in freshly
prepared alkaline buffer solution (300 mM NaOH and 1 mM EDTA; pH ≥ 13) for
20 min, and DNA was submitted to electrophoresis for 30 min at 25 V
(0.90V/cm) and 300 mA, after which the buffer solution was neutralized with 0.4
M Tris-HCl (pH 7.5) and the DNA stained with 50µL ethidium bromide
(20µg/µL). All the above steps were conducted under dim light to prevent
additional DNA damage. Each electrophoresis run was considered valid only if
the negative and positive controls yielded the expected results. Observations
were made at 400x magnification using a florescence microscope (Nikon
Eclipse E200). At least 100 randomly selected images were analyzed from each
sample and the DNA damage was analyzed with the DEMO version of Comet
Assay IV software and CASP software package. Tail moment comet parameter
measures were used as DNA damage indicators, since they are considered the
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma were considered significant when p < 0.05.
RESULTS AND DISCUSSION
Surface characterization and wettability
It is well known that not only surface material chemistry but also surface
properties such as roughness/topography have an effect on protein adsorption,
cytoskeleton
alignment
and cellular responses (e.g. cell attachment,adhesion, spreading, proliferation and differentiation) of biomaterials [30-33]. In
this study, we evaluated the surface roughness generated in bacterial cellulose
membranes modified by plasma.
The hydrophilicity/hydrophobicity of a material is a relevant
biocompatibility property that can be estimated by through contact angle
measurementsusing liquids with well characterized properties In this work, the
water contact angles were measured. The results showed that the incorporation
of nitrogen using the plasma treatment did not modify the contact angles (BC:
26.68 ± 1.187; BCP: 28.50 ± 0.532); however, the nanofibrous BC structure was
altered, to a significant extent, as can be seen by SEM (Fig. 2). It is well known
that plasma modification leads to increased surface roughness. These changes
in surface topography are mostly caused by the physical erosion promoted by
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma fibres to some extent, leading to a more porous and rough material, also
detected by AFM. Figures 2b and 2d show the nanofibrous structure of BC and
BCP membranes, respectively. The BCP surface appeared rougher (Fig. 2d),
as compared to the untreated, smoother BC (Fig. 2b).
A detailed knowledge of each single surface feature through AFM image
analysis is crucial when studying the behaviour of a cell that comes into contact
with the surface. This is because the cell can extend filopodia, i.e., highly motile
nanostructures, to gather information from the surrounding environment by
interacting individually with every single topographical surface feature [35][36].
AFM surface topography and profiles of 2 samples with different surface
roughness are shown in figure 3. The results obtained in the analysis of
surfaces without cells, show higher peaks on the BCP surface (495.5 nm), while
on BC it was 308.7 nm (Fig. 3). Average roughness (Ra) was significantly
higher in the treated cellulose (Ra=70.312 ± 5.1 nm) while BC showed Ra of
42.752 ± 6.0 nm. Mean peak (Rp) and mean valley (Rv) were also higher in
BCP (541.397 ± 62.8 nm and 402.538 ± 33.7 nm, respectively), while for BC the
values were 159.872 ± 24.3 nm and 149.092 ± 18.1 nm, respectively. The
plasma treatment thus led to a rough surface texture. Increased porosity and
roughness may have a positive effect on nutrient permeability and cell
communication when using BC in tissue engineering applications.
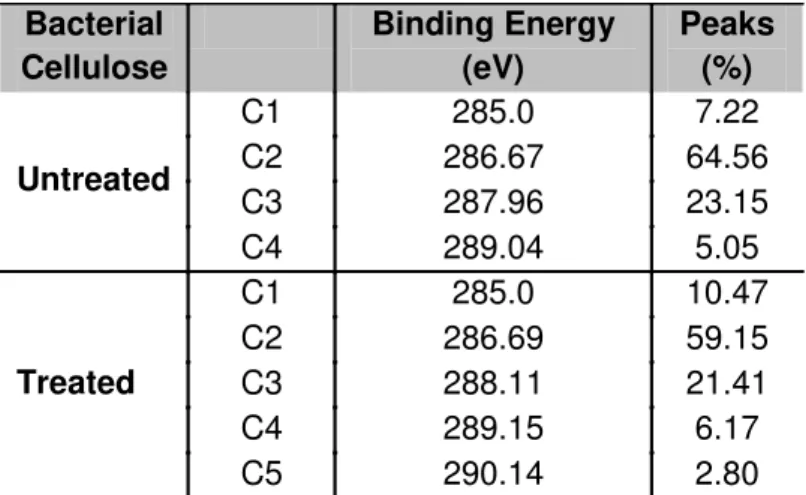
X-ray photoelectron spectroscopy (XPS)
The O/C atomic ratio of the untreated and plasma- treated BC were
0.82 and 0.83, respectively (Table 2), comparable to the theoretical value of
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma and its spectra deconvolution are well documented. There is general
agreement on the assignment of components C1, C2, C3 and C4 of the C 1s
peak in wood-derived material. C1 corresponds to carbon linked only to
hydrogen or carbon (-C-H, -C-C); C2 is assigned to carbon linked to a single
oxygen atom (-C-O), whereas C3 binds two non-carbonyl oxygen atoms
(O-C-O), or a single carbonyl oxygen atom (-C=O) and C4 represents carbon atoms
linked to a carbonyl and a non-carbonyl oxygen atom (O–C=O). The
appearance of C1 and C4 may be due to either contamination or a chemical
change in cellulose structure, as reported in the literature [37-39]. In this work,
BC exhibited 4 carbon peaks, corresponding to C1, C2, C3 and C4 and BCP
showed an additional peak (C5), which corresponds to carbon linked to three
oxygen atoms (O-CO-O). According to Hua et al. [40], the formation of the C4
and C5 functionality is due to modification of O-C-O linkages. It is noteworthy
that the formation of C5 is possible only through the cleavage of the C1-C2
carbons of the pyranoside ring followed by ex situ post plasma oxidation [40].
The N 1s component was decomposed in only one peak at a binding
energy of 400.7 eV. In carbonaceous materials, this value (400.5 + 0.3 eV) is
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Cell adhesion and proliferation
The results from the adhesion assay showed that BCP substrate was
unable to enhance the adhesion of CHO-K1 after 1, 2 and 3h incubation after
plating (figure 5A). Indeed, the cell adhesion is similar on BC and BCP. This is
partly in line with the result of previous studies, which showed that fibroblast
attachment to microgrooved substrates is low at early stages of the culture,
drastically increasing at later phases [43][44]. A reasonable explanation for this
observation is that the formation of organized cell-substrate contact junctions is
hampered on textured surfaces. As a consequence, no stable cell adhesion can
be ensured, resulting initially in reduced attachment percentages. The cell is
likely in the process of exploring and probing the surface [43].
Surface roughness can affect cell adhesion due to increased or
decreased contact area, which is proportionate to the interfacial adhesive force.
Therefore, surface roughness may influence the contact area of the cell
membrane with the substrate [45]. According to Mansur and Mansur [46] and
Dunn and Zicha [47], cell spreading is usually divided into three main interaction
levels: (a) not spread: cells were still spherical in appearance, protrusions or
lamellipodia were not yet produced; (b) partially spread: at this stage, cells
begin to spread laterally at one or more sides, but the plasma membrane
extensions are not completely confluent; and (c) fully spread. The latter model
(c) yields the best result for material cell hosting, which was observed on the
BCP surface (Fig. 2C and D).
The cells on the membranes underwent morphological changes to
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma precondition for cell growth. Therefore, the observation of nonspreading cells
are indicative of undesirable surface properties [48]. Thus, greater proliferation
was indeed evident in BCP, with roughness of 70.312 ± 5.1 nm at 2, 4 and 6
days (Fig. 5B). Similar results were found by Khan et al. [45] and Fan et al. [49]
for neurons.
Genotoxicity using the Comet assay and Cytokinesis block micronucleus (CBMN)
In vitro genotoxicity tests play an important role in evaluating the
biocompatibility of novel implant materials. The international standard
ISO-10993-3 (biological evaluation of medical devices: tests for in vitro genotoxicity)
defines the test methods to be used for the determination of in vitro
genotoxicity. There are two common types of genotoxicity tests: 1) the comet
assay is a versatile and sensitive method for measuring single and
double-strand breaks in DNA [50]; 2) the in vitro cytokinesis block micronucleus assay
is used to detect substances or materials that induce the formation of small
membrane- bound DNA fragments in the cytoplasm of interphase cells.
In this work, bacterial cellulose membranes, untreated or plasma treated,
did not induce DNA damage on exposed CHO-K1 cells, as measured by the
comet test. Indeed, the respective values of tail moment 6.61 ± 1.27 and 7.07 ±
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma and BCP (Fig. 6), but without a significant increase when compared to the
negative control (0.97 ± 0.3). A significant difference in tail moment was only
observed in the positive control (p <0.001). It has been generally estimated that
some 104 lesions are induced in a mammalian cell genome every day by spontaneous chemical reactions and during cellular metabolism. The most
predominant among these are spontaneously generated or products of reactive
oxygen species (ROS reaction) [51]. ROS are the major source of endogenous
DNA damage in aerobic organisms and the hydroxyl radical is the most reactive
of these radicals. The interaction of hydroxyl radicals with the genomic DNA
results in a plethora of modified bases and sugars, 8, 5'- cyclopurine - 2'-
deoxynucleosides, DNA - protein cross-links, abasic sites and strand breaks
[52]. Bacterial cellulose may promote an increase in ROS, but since it does not
cause significant damage to DNA, no oxidative stress leading to cell death is
generated.
Cytokinesis block micronucleus (CBMN) frequency is shown in table 4.
Other nuclear alterations, such as nucleoplasmic bridges, buttons, and nuclear
bubbles were not found in this work. Cells grown on the BCP and BC surfaces
did not reveal a statistically significant number of micronuclei. Taken together,
the results of these tests show that neither treated nor untreated bacterial
cellulose surfaces exhibit genotoxicity. However, it is important to emphasize
that an in-depth and complete biocompatibility analysis, taking into account
genotoxic and mutagenic effects, has only been carried out in bacterial cellulose
in studies conducted by Schmitt et al. [53] and Moreira et al. [14] and others,
such as Miyamoto et al. [13], take into account only aspects related to the
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma This work presents the first evaluation of the influence of plasma
treatment on the modification of bacterial cellulose surfaces. The main following
conclusions may be highlighted: plasma, in a nitrogen and oxygen atmosphere,
changed the surface of bacterial cellulose; the treatment promoted an increase
in roughness of 42.752 ± 4.0 nm to 70.312 ± 5.1 nm in the treated cellulose; cell
adhesion of these surfaces, for up to three hours, is low; in BCP, cell
morphology became more elongated and cell proliferation was highest, likely
owing to the increase in surface roughness; the new surface generated was not
genotoxic. Given the above findings, this work generated a new biomaterial that
can be tested in vivo, with potential use as a new artificial implant.
Acknowledgements
Funding through the FCT (Fundação Ciência e Tecnologia)/CNPq (National Council for Scientific and Technological Development) bilateral program is gratefully acknowledged.
Conflict of Interest
No benefit of any kind will be received either directly or indirectly by the
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma REFERENCES
1. Czaja WK, Young DJ, Kawecki M, Brown RM Jr. The Future Prospects of
Microbial Cellulose in Biomedical Applications. Biomacromolecules
2007;8:1-12.
2. Klemm D, Heublein B, Fink HP, Bohn A. Cellulose: fascinating biopolymer
and sustainable raw material. Angew chem int edit 2005; 44:3358-3393.
3. Fontana JD, de Souza AM, Fontana CK, Torriani IL, Moreschi JC, Gallotti
BJ, de Souza SJ, Narcisco GP, Bichara JA, Farah LF Acetobacter cellulose
pellicle as a temporary skin substitute. Appl Biochem Biotechnol
1990;24:253-264.
4. Frankel VH, Serafica GC, Damien CJ. Development and testing of a novel
biosynthesized XCell for treating chronic wounds. Surg Technol Int
2004;12:27-33.
5. Maneerung T, Tokura S, Rujiravanit R. Impregnation of silver nanoparticles
into bacterial cellulose for antimicrobial wound dressing. Carbohydrate
Polymers 2008;72:43-51.
6. Fang B, Wan YZ, Tang TT, Gao C, Dai KR. Proliferation and Osteoblastic
Differentiation of Human Bone Marrow Stromal Cells on
Hydroxyapatite/Bacterial Cellulose Nanocomposite Scaffolds. Tissue Eng
2009;15:1091-1098.
7. Svensson A, Nicklasson E, Harrah T, Panilaitis B, Kaplan DL, Brittberg M,
Gatenholm P. Bacterial cellulose as a potential scaffold for tissue
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Dehydrated Microbially Derived Cellulose for in Vivo Implantation. U.S.
Patent 6.599.518 2003.
10. Klemm D, Schumann D, Udhardt U, Marsch S. Bacterial synthesized
cellulose-artificial blood vessels for microsurgery. Prog Polym Sci
2001;26:1561-1603.
11. Märtson M, Viljanto J, Hurme T, Laippala P, Saukko P. Is cellulose sponge
degradable or stable as implantation material? An in vivo subcutaneous
study in the rat. Biomaterials 1999;20:1989-1995.
12. Kino Y, Sawa M, Kasai S, Mito M. Multiporous Cellulose Microcarrier for the
Development of a Hybrid Artificial Liver Using Isolated Hepatocytes. J Surg
Res 1998;79:71-76.
13. Miyamoto T, Takahashi S, Ito, H, Inagaki H. Tissue biocompatibility of
cellulose and its derivatives. J Biomed Mater Res A 1989;23:125-133.
14. Moreira S, Silva NB, Almeida-Lima J, Rocha HAO, Batistuzzo SRM, Alves C.
Jr. Gama FM. BC nanofibres: In vitro study of genotoxicity and cell
proliferation. Toxicol lett 2009;189:235-241.
15. Hutchens SA, Benson RS, Evans BR, O’Neill HM, Rawn CJ. Biomimetic
synthesis of calcium-deficient hydroxyapatite in a natural hydrogel.
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma 16. Stromme M, Brohede U, Atluri1 R, Garcia-Bennett AE. Mesoporous
silica-based nanomaterials for drug delivery:evaluation of structural properties
associated with release rate. Nanomed. Nanobiotechnol 2009;1:140-148.
17. Otsuka M, Nakagawa H, Ito A, Higuchi WI. Effect of geometrical structure on
drug release rate of a three-dimensionally perforated porous apatite/collagen
composite cement. J Pharm Sci 2010;99:286-292.
18. Bäckdahl H, Helenius G, Bodin A, Nannmark U, Johansson BR, Risberg B,
Gatenholm P. Mechanical properties of bacterial cellulose and interactions
with smooth muscle cells. Biomaterials 2006;27:2141-2149.
19. Zaborowska M, Bodin A, Bäckdahl H, Popp J, Goldstein A, Gatenholm P.
Microporous bacterial cellulose as a potential scaffold for bone regeneration.
Acta Biomater Article in Press 2010.
20. Strobel M, Lyons CS, Mittal KL. Plasma surface modification of polymers:
relevance to adhesion. Tokyo: VSP;1994. 290 p.
21. Alves C Jr, Guerra Neto CLB, Morais GHS, Silva CF, Hajek V. Nitriding of
titanium disks and industrial dental implants using hollow cathode discharge.
Surf Coat Technol 2005;194: 196-202.
22. Howatson A M, Descargas electricas em gases. Madrid: Urmo; 1965.198 p.
23. Caiazzo F, Canônico P, Nigro R, Tagliaferri V. Eletrode discharge for plasma
surface treatment of polymeric materials, J Mater Process Technol
1996;58:96-99.
24. Costa THC, Feitor MC, C. Alves Jr, Freire PB, Bezerra CM. Effects of gas
composition during plasma modification of polyester fabrics. J Mater
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Simultaneous Determination of Surface Tension and Density of Polymer
Melts Using Axisymmetric Drop Shape Analysis. J Colloid Interface Sci
1999;210:172-181.
27. Fenech M. Cytokinesis-block micronucleus cytome assay. Nat Protoc
2007;2:1084-1104.
28. Tavares JCM, Cornélio DA, Silva NB, Moura CEB, Queiroz JDF, Sá JC,
Alves C. Jr, Batistuzzo SEM. Effect of titanium surface modified by plasma
energy source on genotoxic response in vitro. Toxicology 2009;262:138-145.
29. Singh NP, McCoy MT, Tice RR, Schneider EL. A Single Technique for
Quantification of Low Levels of DNA Damage in Individual Cells. Exp Cell
Res 1988;175:184-191.
30. Yim EKF, Pang SW, Leong KW. Synthetic nanostructures inducing
differentiation of human mesenchymal stem cells into neuronal lineage. Exp
Cell Res 2007; 313:1820-1829.
31. Zan Q, Wang C, Dong L, Cheng P, Tian J. Effect of surface roughness of
chitosan-based microspheres on cell adhesion. Appl Surf Sci
2008;255:401-403.
32. Kulangara K, Leong KW. Substrate topography shapes cell function. Soft
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma 33. Chen S, Jones JA, Xu Y, Low HY, Anderson JM, Leong KW.
Characterization of topographical effects on macrophage behavior in a
foreign body response model. Biomaterials 2010;31:3479-3491.
34. Vesel A, Junkar I, Cvelbar U, Kovac J, Mozetic M. Surface modification of
polyester by oxygen and nitrogen-plasma treatment, Surf Interface Anal
2008;40:1444-1453.
35. Dalby MJ, Giannaras D, Riehle MO, Gadegaard N, Affrossman S, Curtis
ASG. Rapid fibroblast adhesion to 27 nm high polymer demixed
nano-topografy. Biomaterials 2004;25:77-83.
36. Senesi GS, D’Aloia E, Gristina R, Favia P, d’Agostino R. Surface
characterization of plasma deposited nano-structured fluorocarbon coatings
for promoting in vitro cell growth. Surf Sci 2007; 601:1019-1025
37. Carlsson CMG, Stroem G. Reduction and oxidation of cellulose surfaces by
means of cold plasma. Langmuir 1991;7:2492-2497.
38. Sapieha S, Verreault M, Klemberg-Sapieha JE, Sachet E, Wertheimer MR.
X-Ray photoelectron study of the plasma fluorination of lignocelluloses. Appl
Surf Sci 1990;44:165-169.
39. Belgacem MN, Czeremuszkin G, Sapieha S, Gandini A. Surface
characterization of cellulose fibers by XPS and IGC. Cellulose
1995;2:145-157.
40. Hua ZQ, Sitaru R, Denes F, Young RA. Mechanisms of Oxygen- and
Argon-RF-Plasma-Induced Surface Chemistry of Cellulose. Plasmas Polym
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma on activated carbon. Carbon 1995;33:1021-1027
43. Walboomers XF, Ginsel L A, Jansen J A. Early spreading events of
fibroblasts on microgrooved substrates. J Biomed Mater Res A
2000;51:529-534.
44. Lee S, Kim S, Rhyu I, Chung W, Leesungbok R, Lee K. Influence of
microgroove dimension on cell behavior of human gingival fibroblasts
cultured on titanium substrata. Clin Oral Impl Res 2009;20: 56-66.
45. Khan SP, Auner GG, Newaz GM. Influence of nanoscale surface roughness
on neural cell attachment on siliconv. Nanomedicine 2005;1:125-129.
46. Mansur AAP, Mansur HS. Preparation, characterization and
cytocompatibility of bioactive coatings on porous calcium-silicate-hydrate
scaffolds. Mater Sci Eng C 2010;30:288-294.
47. Dunn GA, Zicha D. Dynamics of fibroblast spreading. J Cell Sci
1995;108:1239-1249.
48. Sun Y, Lacour SP, Brooks RA, Rushton N, Fawcett J, Cameron RE.
Assessment of the biocompatibility of photosensitive polyimide for
implantable medical device use. J Biomed Mater Res A 2008;90:648-655.
49. FanYW, Cui FZ, Hou SP, Xu QY, Chen LN, Lee I-S, Culture of neural cells
on silicon wafers with nano-scale surface topograph. J Neurosci Methods
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma
50. Collins AR, Oscoz AA, Brunborg G, Gaivão I, Giovannelli L, Kruszewski M,
Smith CC, Stetina R. The comet assay: topical issues. Mutagenesis
2008;23:143-151.
51. Lindah T. Instability and decay of the primary structure of DNA. Nature
1993;362:709-715.
52. Evans MD, Dizdaroglu M, Cooke MS. Oxidative DNA damage and disease:
Induction, repair and significance. Mutat Res 2004;567:01-61.
53. Schmitt, DF, Frankos, VH, Westland J, Zoetis T. Toxicologic evaluation of
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma
=2 μm and 6500 X and 9000 X magnification; (C) and (D)show elongated CHO-K1 cells in BCP at 24 and 48 hours, scale bars = 5 μm and 3000 X and 3500 X magnification. (b) and (d) show the nanofibrous structure BC and BCP membranes, respectively; scale bars = 1μm and 100000 X magnification.
Figure 3. Three-dimensional AFM images and surface profile of two lines of analysis (A-B and C-D) in the top and bottom diameter of the samples. (A) Untreated bacterial cellulose; (B) Treated bacterial cellulose
Figure 4. Deconvolution of the carbon peak for (a) BC and (b) BCP and (c) nitrogen peak for BCP.
Figure 5. (A) Histogram of CHO K1 cell adhesion in treated and untreated bacterial cellulose at 1, 2 and 3h. (B) Histogram of cell proliferation at 2, 4 and 6 days. Each bar represents an average of CHO-K1±standard deviation (n=3 in each group containing three equal experiments, *p < 0.001).
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Figure 01
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Figure 05
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma Table 1 - Conditions in all the treatments carried out in
plasma reactor
Parameter Value
Time 30 min
N2 Flow 10 sccm
O2 Flow 4 sccm
Current 0,2 A
Pressure 4 mbar
Voltage 425 V
Table 2 - BC elemental composition analysed by XPS
Surface Modification Oxygen (%) Carbon (%) Nitrogen (%)
O/C N/C
BC 45.20 54.79 0.01 0.82 0.0001
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma
Untreated C2 286.67 64.56
C3 287.96 23.15 C4 289.04 5.05
Treated
C1 285.0 10.47 C2 286.69 59.15 C3 288.11 21.41 C4 289.15 6.17 C5 290.14 2.80
Table 4 - Mean frequency of binucleated cells with micronuclei (BNMN) in 3000 cells for PC, NC, BCP and BC groups, and their percentage ***p<0.001.
Treatments BNMN %
Positive control *** 85±17.09 0.28
Negative control 13± 3.51 0.04
BCP 15± 1.73 0.05
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma 3.3 Influence of argon-ion bombardment of titanium surfaces on the cell
behavior
Revista: Surface & Coatings Technology
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma 4. COMENTÁRIOS, CRÍTICAS ESUGESTÕES
A possibilidade de ingressar em uma Pós-graduação com caráter
multidisciplinar foi fundamental para o desenvolvimento deste trabalho.
Pesquisadores das áreas da saúde (biológos, farmacêuticos, veterinários,
dentistas) e engenharia atuaram de forma interdisciplinar para a realização do
projeto “Funcionalização de superfícies de nanofibras de celulose bacteriana
para aplicação em regeneração tecidual - CNPq nº 27/2006 - Projetos
Conjuntos de P&D&I /Portugal - CNPq/GRICES” do qual esta pesquisa fez
parte.
4.1 Expectativas Futuras
Nossos resultados poderão servir de subsídios na escolha de uma
superfície de celulose bacteriana mais adequada ao uso terapêutico. Nesse
sentido, este estudo poderá resultar nos seguintes processos e produtos:
1. Uso do plasma a baixa pressão para modificação de superfícies de celulose bacteriana;
2. Confecção de scaffolds de celulose bacteriana tratada por plasma para testes in vivo;
3. Desenvolvimento de uma biomembrana de CBP que poderá ser testada na liberação controlada de fármacos;
4. Realização de ensaios in vivo com a celulose bacteriana tratada por
Adesão, proliferação e genotoxicidade celular de celulose bacteriana modificada por plasma
in vitro quanto a sua biocompatibilidade, genotoxicidade e mutagenicidade,
antes da sua aplicação in vivo e da liberação de seu uso para produção de
implantes, (52-54) existe a possibilidade de criação da linha de pesquisa:
Genotoxicidade e mutagenicidade de biomateriais.
Atualmente sou professora assistente da disciplina de Histologia da
Universidade Federal do Rio Grande do Norte, concluir o curso de doutorado é
indispensável à minha progressão e ascensão como pesquisadora. Atuo na
base de pesquisa: Plasticidade Morfofuncional dos Sistemas Orgânicos.
Microscopia Celular e Tecidual. Pretendo, a partir de agora, fortalecer nossa
linha de pesquisa: Biologia Celular, caracterização estrutural e ultraestrutural,
adesão, proliferação, diferenciação e morte celular. Orientar alunos na
graduação e pós-graduação e elaborar novos projetos que serão submetidos
às instituições de fomento. Ressalto ainda, que com os excelentes resultados
obtidos, durante o desenvolvimento deste trabalho, surgiu a oportunidade de
ingressar em um pós-doutorado com a aprovação do projeto “Produção,
caracterização e avaliação da atividade antitumoral de nanogeis de fucanas
extraídas de algas do litoral do Nordeste - EDITAL MCT/CNPQ Nº 62/2008”.
Cooperação internacional entre a Universidade Federal do Rio Grande do