UNIVERSIDADE FEDERAL DE MINAS GERAIS
INSTITUTO DE CIÊNCIAS BIOLÓGICAS
DEPARTAMENTO DE PARASITOLOGIA
Avaliação da efetividade do atual Programa de
Vigilância e Controle da Leishmaniose Visceral sobre
as taxas de prevalência e incidência da infecção
assintomática por
Leishmania (Leishmania) infantum,
Belo Horizonte MG.
Iara Caixeta Marques da Rocha
Belo Horizonte
II
Iara Caixeta Marques da Rocha
Efetividade do Programa de Vigilância e Controle da
Leishmaniose Visceral sobre as taxas de incidência e
prevalência da infecção assintomática por
Leishmania
(Leishmania) infantum,
Belo Horizonte MG.
Belo Horizonte
Instituto de Ciências Biológicas da UFMG
2015
Tese de Doutorado apresentada ao Programa
de Pós Graduação em Parasitologia do Instituto
de Ciências Biológicas da Universidade Federal
de Minas Gerais, como parte dos requisitos para
obtenção do título de Doutor em Ciências.
Área de concentração: Epidemiologia das Doenças
Infecciosas e Parasitárias
III
Tese desenvolvida no Laboratório de Epidemiologia das Doenças Infecciosas e Parasitárias, do Departamento de Parasitologia ICB/UFMG
Instituições parceiras:
Centro de Pesquisas René Rachou - Laboratório de Pesquisas Clínicas Prefeitura Municipal de Belo Horizonte
Colaboradores:
Dra. Ilka Afonso Reis – Departamento de Estatística ICEX / UFMG
Dr. Edward José de Oliveira – Laboratório de Pesquisas Clínicas / Centro de Pesquisas
René Rachou (FIOCRUZ)
Dra. Vanessa Peruhype Magalhães Pascoal – Laboratório de Biomarcadores de
Diagnóstico e Monitoração / Centro de Pesquisas René Rachou (FIOCRUZ)
Financimento:
FAPEMIG/MS/SES-MG – PPSUS, Número: CDS-APQ-00343-10
CNPQ/Universal Número: 478528/2012-4 /2012
Aprovado pelos comitês de ética em pesquisa:
Universidade Federal de Minas Gerais (nº 253/09) Prefeitura de Belo Horizonte (n° 080.2008)
IV
Agradecimentos
A Deus por me dar foco e perseverança ao longo dessa trajetória.
Aos meus maravilhosos pais, que me surpreendem a cada dia com um amor incondicional, capaz de me sustentar e me estruturar para enfrentar qualquer desafio.
Ao meu eterno namorado e amigo Varlei, que esteve presente em todos os momentos da minha caminhada. Agradeço pelo companheirismo, carinho, apoio, paciência e compreensão.
A professora Mariângela Carneiro, minha querida orientadora, que tanto admiro como pessoa e profissional. Responsável por uma parte muito importante da minha formação. Obrigada pela confiança, amizade, incentivo e pelos ensinamentos que levarei por toda a vida.
A professora Ilka Afonso Reis do ICEX-UFMG, pela relevante colaboração nas análises estatísticas. Uma convivência de muito ganho e aprendizado. Obrigada pela disponibilidade, entusiasmo e interesse pelo trabalho.
A professora Norma, minha querida orientadora de mestrado, responsável pelo início de todo o meu percurso acadêmico. Carinhosa, acolheu-me com uma convivência alegre e cheia de ensinamentos, que fizeram com que eu a adimirasse muito.
Ao Dr. Edward José de Oliveira, Dra. Vanessa Peruhype Magalhães e à Gisele Macedo, do Laboratório de Análises Clínicas da FIOCRUZ, onde foram processadas e analisadas as amostras biológicas das crianças. Agradeço pela orientação e todo o suporte prestado para realização dos testes laboratoriais.
A equipe acadêmica brilhante do Laboratório de Epidemiologia de Doenças Infecciosas e Parasitárias. Agradeço pela convivência sempre leve, divertida, construtiva e agradável. Foi um crescimento trabalhar com todos vocês! Letícia e Thaís, que além da parceria acadêmica, me presentearam com duas grandes amizades para a vida. Obrigada Wendel e Valdelaine por toda a colaboração, disponibilidade e participação indispensável para a conclusão deste trabalho. Obrigada Maria Helena pela atenção, apoio e incentivo constantes. Agradeço à Fernanda, Débora, Thaisinha, Gabriela e Carla, pela ajuda na logística e organização do trabalho de campo. Fizemos um excelente trabalho em equipe, que foi fundamental para o sucesso desta etapa.
Aos amigos da Gerência Regional de Controle de Zoonoses Norte – PBH. Especialmennte Diogo, Ivan, Guilherme, Simone, Terezinha, Margareth e Ronaldo, que me proporcionam sorrisos fáceis e fazem todos os dias valerem a pena. Meus sinceros agradecimentos pela amizade, compreensão e apoio de todos vocês, que acompanharam de perto a maior parte desta trajetória.
V
VI
Lista de figuras
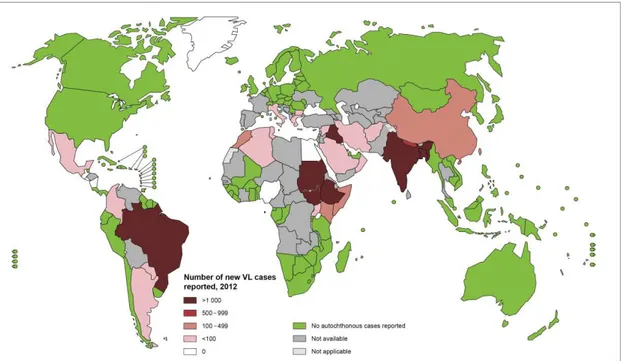
Figura 1: Distribuição geográfica da Leishmaniose visceral no mundo
Figura 2: Casos de LVH e óbitos ocorridos em Belo Horizonte no período de 2005 a 2014.
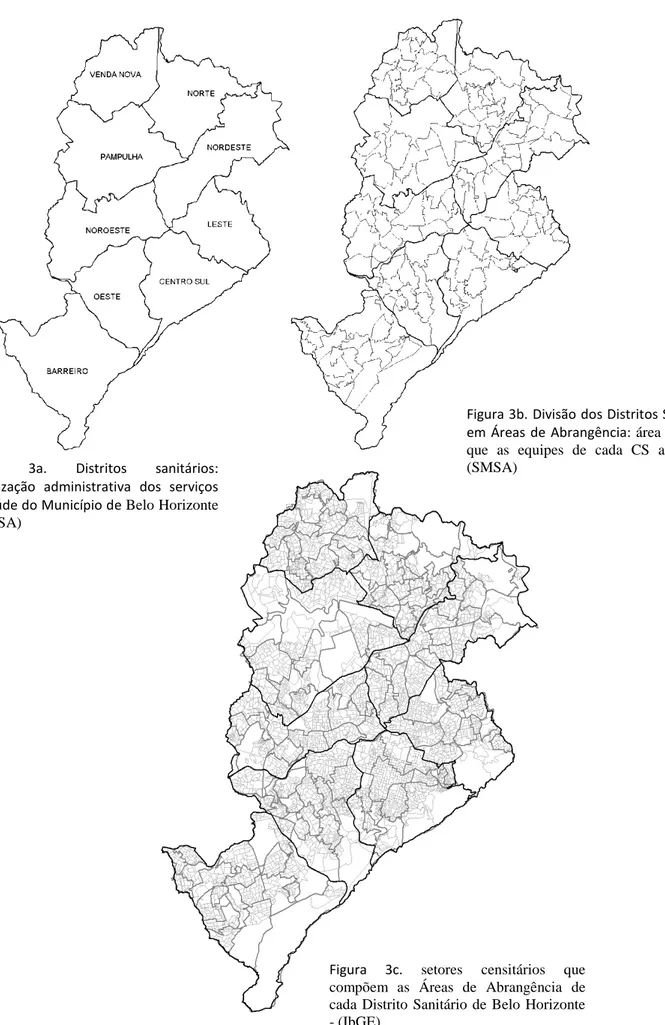
Figura 3c. setores censitários que compõem as Áreas de Abrangência de cada Distrito Sanitário de Belo Horizonte - (IbGE)
Figura 3b. Divisão dos Distritos Sanitários em Áreas de Abrangência: área territorial que as equipes de cada CS atendem - (SMSA)
Figura 3a. Distritos sanitários: organização administrativa dos serviços de saúde do Município de Belo Horizonte - (SMSA)
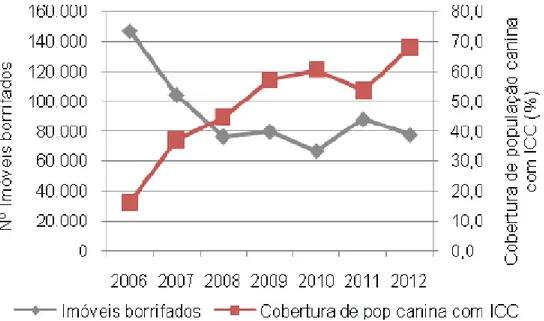
Figura 4: Evolução da cobertura de população canina com ICC e prevalência de sororreatividade canina, Belo Horizonte, 2006-2012 (SMSA, 2013)
Figura 5: Resultados dos exames de ELISA e de ELISA +RIFI em amostras de sangue canino coletadas em Belo Horizonte, 2006-2012 (Boletim de Vigilância em saúde, 2013).
Figura 6: Evolução da estratégia de controle químico vetorial e cobertura da população canina por ISCC, Belo Horizonte, 2006-2012 (SMSA, 2013).
Figura 7: Série temporal de prevalência de sororreatividade canina e de casos de LVH em LV, Belo Horizonte, 2006-2012 (SMSA, 2013).
Figura 8: Localização geográfica das áreas de estudo no município de Belo Horizonte, Minas Gerais, Brasil e estratificação das AA por incidência acumulada de LVH no DS Noroeste, onde as áreas estão situadas – 2006 a 2009.
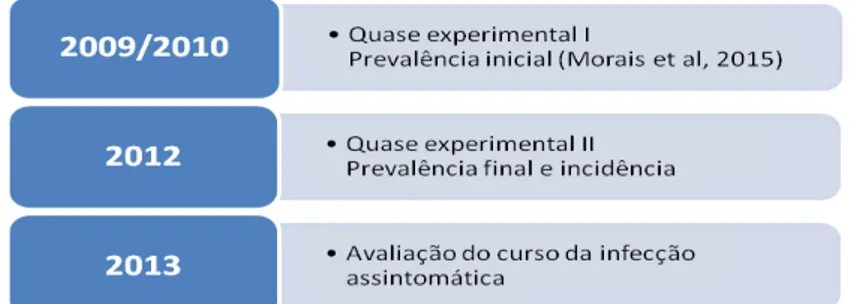
Figura 9: Delineamento geral do estudo: abordagem epidemiológica quase experimental para estimativa das taxas de prevalência inicial, final e coorte e posteriormente, avaliação do curso da infecção assintomática por L. infantum
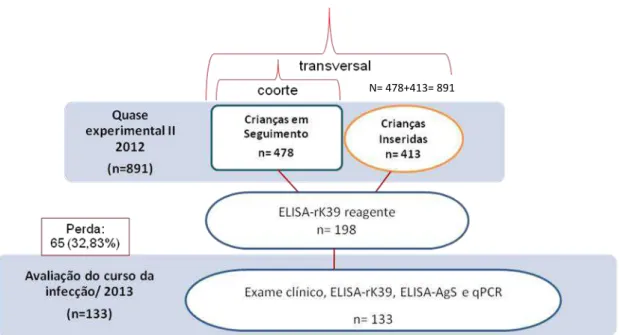
VII Figura 11: Distribuição geográfica da amostra total de 891 crianças participantes do estudo quase experimental II.
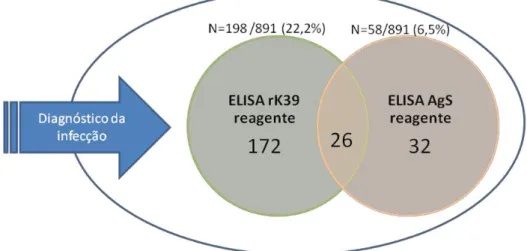
Figura 12: Número de amostras que apresentaram testes de ELISA-rK39 e ELISA-AgS reagentes para L. infantum no delineamento transversal do estudo quase experimental II e amostras que apresentaram sorologia reagente nos dois testes.
Figura 13: Número de amostras que apresentaram testes de ELISA-rK39 e ELISA-AgS reagentes para L. infantum no delineamento coorte do estudo quase experimental II e amostras que apresentaram sorologia reagente nos dois testes.
Figura 14: Fluxograma dos estudos quase experimental I, quase experimental II e avaliação do curso da infecção assintomática por L. infantum por meio de ELISA-rK39.
Figura 15: Etapa de Avaliação do Curso da Infecção Assintomática por L. infantum: Amostra avaliada por meio de exames clínico e laboratoriais.
Figura 16: Número de amostras que apresentaram testes sorológicos de ELISA-rK39 e ELISA-AgS reagentes e qPCR positivo na etapa de avaliação do curso da infecção assintomática por L. infantum
Figura 17: Representação gráfica da distribuição da amostra de crianças por idade nas três áreas de intervenção.
Figura 18: Representação gráfica da curva de infecção da amostra de crianças por faixa etária, nas três áreas de intervenção.
Figura 19: Representação gráfica da distribuição da amostra de crianças da coorte por idade nas três áreas de intervenção.
VIII Figura 21: Representação gráfica do percentual de crianças com amostras reagentes e não reagentes no teste sorológico ELISA-rK39 por faixa etária.
Figura 22: Representação gráfica do percentual de crianças com amostras reagentes e não reagentes no teste sorológico ELISA-rK39 por classe econômica das famílias.
Figura 23: Representação gráfica do percentual de infecção assintomática por L. infantum associada à variável “árvore na vizinhança”, considerando 659 imóveis visitados.
Lista de tabelas
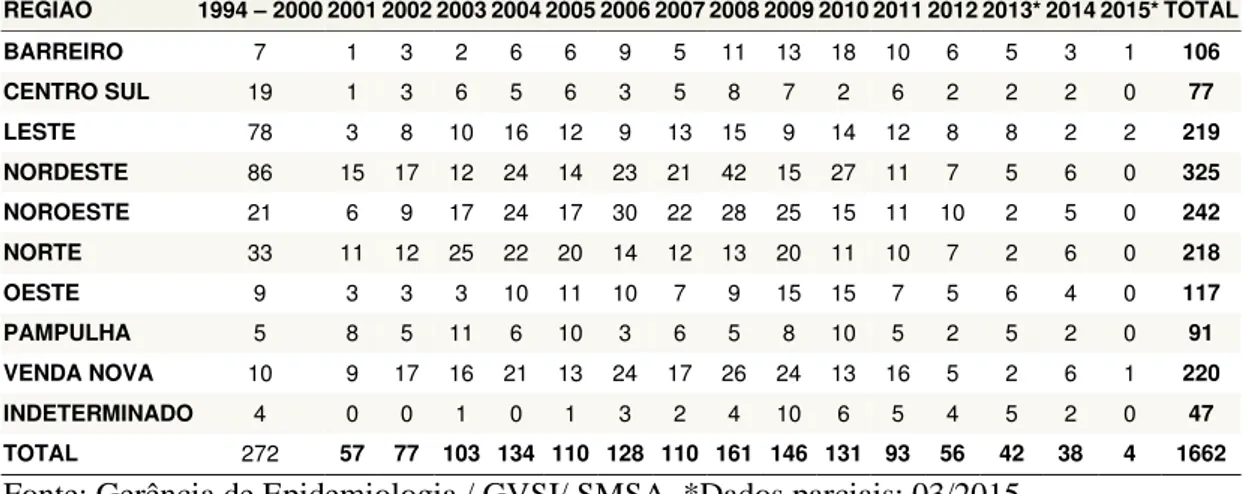
Tabela 1: Casos de LVH ocorridos em Belo Horizonte, por região de residência (Barreiro, Centro Sul, Leste, Nordeste, Noroeste, Norte, Oeste, Pampulha e Venda Nova).
Tabela 2: Dados do PVC-LV: Série temporal da prevalência canina e de casos de LVH nas áreas de estudo (2006-2013). Fontes: SCZOO e Sinan
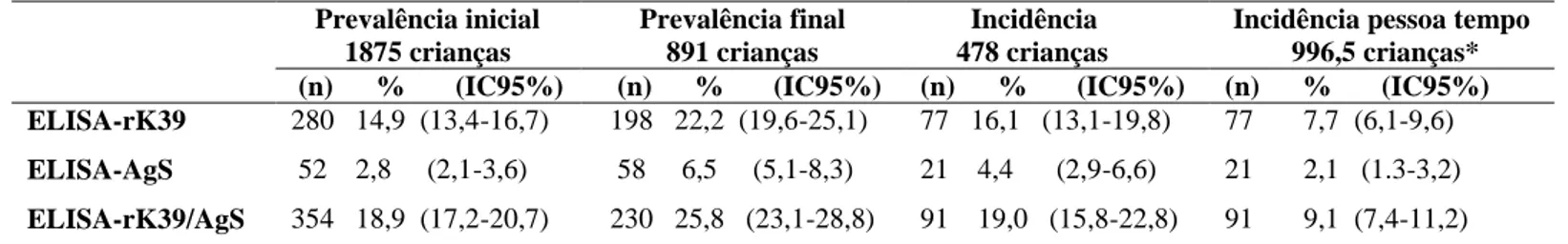
Tabela 3: Comparação entre estimativas gerais de prevalência inicial, prevalência final e incidência de acordo com os testes sorológicos ELISA-rK39 e ELISA-AgS.
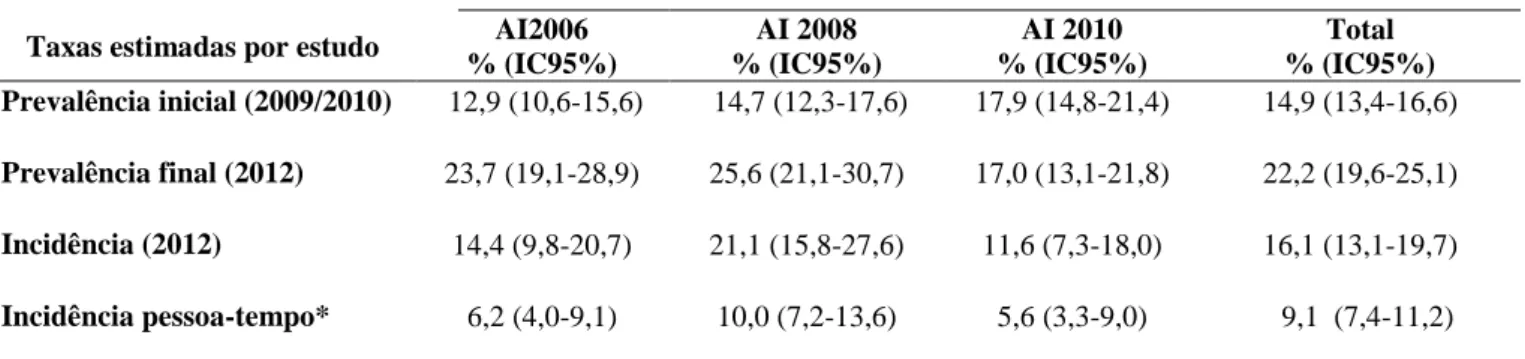
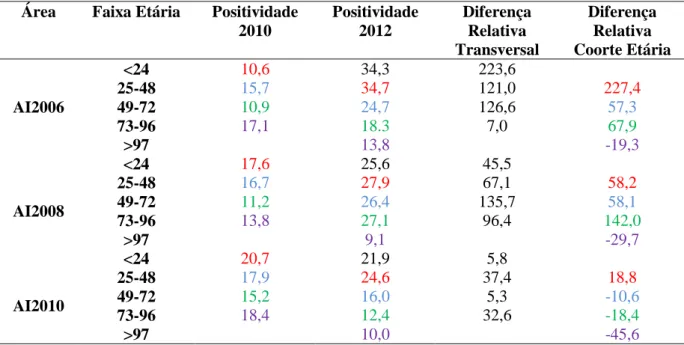
Tabela 4: Taxas de prevalência e incidência da infecção assintomática por L.infantum estimadas por ELISA-rK39 nas áreas com diferentes tempos de intervenção pelo PVC-LV: Estudos quase experimental I e II
Tabela 5: Análise transversal para comparação das taxas de prevalência da infecção assintomática estimadas nos estudos quase experimental I e II. Comparação por faixa etária (diferença relativa transversal) e por coorte etária (diferença relativa coorte etária).
Tabela 6: Avaliação laboratorial do curso da infecção assintomática por L. infantum por meio dos testes ELISA-rK39, ELISA-AgS e qPCR - 2013.
Tabela 7: Análise descritiva da amostra de crianças participantes do estudo quase experimental II (delineamento transversal).
IX Tabela 9: Avaliação da efetividade das estratégias de controle do PVC-LV sobre a infecção por L. infantum nas áreas com diferentes tempos de intervenção: Estudo quase experimental II, delineamento transversal, Belo Horizonte, 2012.
Tabela 10: Análise descritiva da amostra de crianças participantes do estudo de coorte.
Tabela 11: Análise descritiva das características das residências e das famílias participantes do estudo quase experimental II (delineamento coorte).
Tabela 12: Avaliação da efetividade das estratégias de controle do PVC-LV sobre a infecção por L. infantum nas áreas com diferentes tempos de intervenção: Estudo quase experimental II, delineamento coorte.
Tabela 13: Modelo logístico multinível para avaliação dos fatores associados à infecção assintomática por L. infantum em crianças.
Tabela 14: Modelo logístico multivariado final para avaliação dos fatores associados à infecção assintomática por L. infantum em criança residente no domicílio (“casa positiva”).
Lista de abreviaturas
AI2006 – Área de intervenção 2006 AI2008 - Área de intervenção 2008 AI2010 - Área de intervenção 2010 AA- Área de abrangência
BH- Belo Horizonte
CCEB- Critério de classificação socioeconômica do Brasil CS- Centro de saúde
DNA- ácido desoxirribonucleico
DPP- Dual Parth Platform ou Plataforma de Duplo Compartilhamento DS- Distrito sanitário
EDTA- Ethylenediamine tetraacetic acid) ou ácido etilenodiamino tetra-acético ELISA- Enzyme Linked Immunosorbant Assay ou ensaio imunoenzimático ELISA-AgS- Enzyme Linked Immunosorbant Assay (com antigeno solúvel)
X ELISA-rK39 - Enzyme Linked Immunosorbant Assay (com antigeno recombinante rK39) FUNASA- Fundação Nacional de Saúde
HIV- Vírus da imunodeficiência humana
IbGE- Instituto brasileiro de geografia e estatística IDMR- Intradermorreação de Montenegro
IR- Índice de reatividade IRR- Razão de incidência
ISCC- Inquérito sorológico censitário canino IVS- Índice de vulnerabilidade à saúde LV- Leishmaniose visceral
LVA- Leishmaniose visceral americana LVC- Leishmaniose visceral canina LVH- Leishmaniose visceral humana MS- Ministério da Saúde
OR- Odds Ratio
PBH- Prefeitura de Belo Horizonte
PSF/SUS- Programa de saúde da família / Sistema Único de Saúde PVC- LV- Programa de Vigilância e Controle da Leishmaniose Visceral qPCR- Quantitative polymerase chain reaction
RIFI- Ensaio de imunofluorescência indireta
RISPA- REDE INTERAGENCIAL DE INFORMAÇÃO PARA A SAÚDE RNA- Ácido ribonnucleico
SBMT- Sociedade Brasileira de Medicina Tropical SES- Secretaria Estadual de Saúde
SINAN- Sistema de informação de agravos de notificação compulsória SM- Salários mínimos
XI TRALD- Teste Rápido Anti-Leishmania donovani
XII
Resumo
Este estudo avaliou por meio dos delineamentos epidemiológicos transversal e coorte, a efetividade das estratégias do Programa de Vigilância e Controle da Leishmaniose Visceral (PVC-LV), sobre a infecção por Leishmania infantum em crianças. O estudo foi conduzido no ano de 2012 em três áreas de Belo Horizonte, com diferentes tempos de intervenção pelo PVC-LV (Área de intervenção 2006: AI2006, Área de intervenção: AI2008 e Área de intervenção: AI2010).
No delineamento transversal foram avaliadas 891 crianças. As taxas de prevalência por ELISA-rK39, nas AI2006, AI2008 e AI2010 foram respectivamente 23,7% (IC95% 19,1-28,9), 25,6% (IC95% 21,1-30,7) e 17,0 (IC95% 13,1-21,8). Observou-se, que as taxas de prevalência da infecção assintomática, quando comparadas às taxas de prevalência estimadas em 2010 por Morais. (2011), mostraram 83,7% de aumento na área com maior tempo de intervenção (AI2006), 74,1% de aumento na área com tempo intermediário de intervenção (AI2008) e diminuição de 5% na área controle, com menor tempo de intervenção (AI2010).
XIV
Abstract
This study evaluated by cross-sectional and cohort epidemiological designs the effectiveness of the strategies of the Surveillance and Control Program of Visceral Leishmaniasis (SCP-VL) in the infection with Leishmania infantum in children. The study was conducted in 2012 in three areas of Belo Horizonte, with different intervention times by SCP-VL (Intervention area 2006: IA2006, intervention area: IA2008 and intervention area: IA2010).
In the cross-sectional design 891 children were evaluated. Prevalence rates by ELISA-rK39 in the IA2006, IA2008 and IA2010 were respectively 23.7% (95% CI 19.1 to 28.9), 25.6% (95% CI 21.1 to 30.7) and 17 0 (95% CI 13.1 to 21.8). When compared with prevalence rates estimated at 2010 by Morais. (2011), the prevalence rates of asymptomatic infection increased 83.7% in the area with greater intervention time (IA2006), 74.1% in the area with intermediate intervention time (IA2008) and decreased 5% in the control area, with shorter intervention time (IA2010).
XV circulation but is not associated with human desease. The asymptomatic infection by L.
infantum was associated with child's age, family socioeconomic status, education of
XVI
RESUMO ...XII
ABSTRACT ... XIV
1-INTRODUÇÃO ... 1
2-REVISÃO BIBLIOGRÁFICA ... 2
2.1.LEISHMANIOSE VISCERAL ... 2
2.2.EPIDEMIOLOGIA E URBANIZAÇÃO DA LEISHMANIOSE VISCERAL HUMANA (LVH) ... 4
2.3.INFECÇÃO ASSINTOMÁTICA POR L. INFANTUM ... 8
2.4.DIAGNÓSTICO DA INFECÇÃO POR L. INFANTUM NO HOMEM ... 10
2.5.FATORES ASSOCIADOS À INFECÇÃO POR L. INFANTUM ... 12
2.6.PROGRAMA DE VIGILÂNCIA E CONTROLE DA LEISHMANIOSE VISCERAL (PVC-LV) NO BRASIL E EM BELO HORIZONTE ... 15
2.7.AVALIAÇÃO DA EFETIVIDADE DAS ESTRATÉGIAS DO PVC-LV NO BRASIL ... 23
2.8.INDICADORES E DESENHOS EPIDEMIOLÓGICOS PARA AVALIAÇÃO DA EFETIVIDADE DAS ESTRATÉGIAS DO PVC-LV ... 28
3. JUSTIFICATIVA ... 30
4. OBJETIVO GERAL ... 31
5. OBJETIVOS ESPECÍFICOS ... 31
6. MATERIAL E MÉTODOS ... 32
6.1.ÁREAS DE ESTUDO ... 32
6.2.DELINEAMENTO DO ESTUDO ... 35
6.3.AMOSTRA ... 37
6.4.COLETA DE DADOS E DE AMOSTRAS BIOLÓGICAS ... 37
6.5.EXAMES SOROLÓGICOS ENZYME-LINKED IMMUNOSORBENT ASSAY (ELISA) ... 38
6.6.ENSAIOS DE QPCR– ETAPA DE AVALIAÇÃO DO CURSO DA INFECÇÃO POR L. INFANTUM ... 41
6.7.AVALIAÇÃO DA EFETIVIDADE DAS ESTRATÉGIAS DE CONTROLE SOBRE A TRANSMISSÃO DE L. INFANTUM NAS ÁREAS DE INTERVENÇÃO ... 42
6.8.ANÁLISE DOS FATORES ASSOCIADOS À INFECÇÃO ASSINTOMÁTICA POR L. INFANTUM ... 44
7. RESULTADOS ... 45
7.1.POPULAÇÃO ESTUDADA ... 45
7.2.INFECÇÃO ASSINTOMÁTICA: ESTIMATIVAS DE PREVALÊNCIA E INCIDÊNCIA ... 48
7.3.AVALIAÇÃO DO CURSO DA INFECÇÃO ASSINTOMÁTICA POR L. INFANTUM DIAGNOSTICADA POR ELISA-RK39 ... 53
7.4.ANÁLISE DE PREVALÊNCIA ... 55
7.5.ANÁLISE DE INCIDÊNCIA ... 59
7.6.AVALIAÇÃO DOS FATORES ASSOCIADOS À INFECÇÃO POR L. INFANTUM ... 64
8. DISCUSSÃO ... 67
8.1.CONSIDERAÇÕES METODOLÓGICAS ... 69
8.1.1.VÍCIOS DE SELEÇÃO DAS ÁREAS ... 69
8.1.2.VÍCIOS DE INFORMAÇÃO ... 69
8.1.3.CONSIDERAÇÕES SOBRE O DELINEAMENTO DO ESTUDO ... 70
8.1.4.AMOSTRA DE CRIANÇAS ... 71
8.1.5.SELEÇÃO DAS ÁREAS DE ESTUDO ... 71
XVII
8.1.7.ANÁLISE DE PERDAS ... 73
8.1.8.DIAGNÓSTICO DA INFECÇÃO ASSINTOMÁTICA POR L. INFANTUM ... 73
8.2.AVALIAÇÃO DA EFETIVIDADE DO PVC-LV ... 75
8.3.AVALIAÇÃO DO CURSO DA INFECÇÃO ASSINTOMÁTICA POR L. INFANTUM ... 82
8.4.FATORES ASSOCIADOS À INFECÇÃO ASSINTOMÁTICA RECENTE POR L. INFANTUM ... 83
9. CONCLUSÕES ... 86
10. REFERÊNCIAS BIBLIOGRÁFICAS ... 87
11. ANEXOS ... 100
ANEXO1-PARECER COEPUFMG2013 ... 100
ANEXO2-TERMO DE CONSENTIMENTO LIVRE ESCLARECIDO(TCLE)-ESTUDO QUASE EXPERIMENTALII– CRIANÇAS E MENORES DE 18 ANOS... 101
ANEXO3-TERMO DE CONSENTIMENTO LIVRE ESCLARECIDO (TCLE)–AVALIAÇÃO DO CURSO DA INFECÇÃO.CRIANÇAS E MENORES DE 18 ANOS ... 105
ANEXO4-TERMO DE ASSENTIMENTO DO MENOR ... 108
ANEXO5-MANUAL DE APLICAÇÃO DO QUESTIONÁRIO ... 110
ANEXO6-QUESTIONÁRIO ... 123
ANEXO7-CRITÉRIO DE CLASSIFICAÇÃO ECONÔMICA BRASIL (CCEB):SISTEMA DE PONTOS: ... 131
ANEXO8-TABELA COMPLEMENTAR: ANÁLISE DESCRITIVA COMPLETA DAS CARACTERÍSTICAS DAS FAMÍLIAS, DAS CRIANÇAS PARTICIPANTES, DAS RESIDÊNCIAS, DA VIZIHANÇA, DO RESERVATÓRIO E DO VETOR.DELINEAMENTO TRANSVERSAL DO ESTUDO QUASE EXPERIMENTAL II ... 133
ANEXO9-TABELA COMPLEMENTAR: ANÁLISE DESCRITIVA COMPLETA DAS CARACTERÍSTICAS DAS FAMÍLIAS, DAS CRIANÇAS PARTICIPANTES, DAS RESIDÊNCIAS, DA VIZIHANÇA, DO RESERVATÓRIO E DO VETOR.DELINEAMENTO DE COORTE DO ESTUDO QUASE EXPERIMENTAL II ... 137
ANEXO10-MODELOS FINAIS PARA ANÁLISE DE EFETIVIDADE DO PVC-LV NAS ÁREAS: ANÁLISES UNIVARIADAS E MODELOS MULTIVARIADOS DOS DELINEAMENTOS TRANSVERSAL E COORTE, COM AS VARIÁVEIS DE AJUSTAMENTO ... 141
ANEXO11-FICHA DE INVESTIGAÇÃO –INVESTIGAÇÃO DE LEISHMANIOSE VISCERAL EM PACIENTES ASSINTOMÁTICOS ... 142
1
1-Introdução
A leishmaniose visceral (LV) é uma doença negligenciada, que atinge em torno de 200 mil a 400 mil pessoas anualmente em todo o mundo (WHO, 2015). No Brasil o agente etiológico é a Leishmania (leishmania) infantum, transmitida principalmente por flebotomíneos da espécie Lutzomyia longipalpis [Lutz & Neiva, 1912] e os reservatórios urbanos são os cães domésticos (LAINSON & SHAW, 1978; SILVA et al., 2001).
No Brasil, a partir da década de 1980, houve uma mudança no perfil epidemiológico da doença. A LV deixou de ser caracterizada como uma doença predominantemente rural e estabeleceu-se no meio urbano (ARIAS et al., 1996; MS, 2006). A introdução e dispersão de L. infantum em áreas urbanas está associada a múltiplas condições com complexas interações, entre elas: as alterações ambientais, os movimentos migratórios, a ocupação desordenada da periferia da cidade, a alta densidade das populações humana e canina e as condições inadequadas de vida da população (COSTA et
al., 2007; WERNECK et al., 2008).
Belo Horizonte é um dos municípios brasileiros com alta densidade populacional, que apresenta maior letalidade por LV (PBH, 2015). O primeiro caso autóctone de LV em Belo Horizonte foi confirmado em 1994 e desde então, houve investimento na estruturação do Programa de Vigilância e Controle da Leishmaniose Visceral (PVC-LV), com início das atividades como inquérito sorológico censitário canino (ISCC) e controle químico vetorial (FIUZA et al.,2008). Atualmente, para tentar controlar a expansão da doença, o PVC-LV inclui medidas como: diagnóstico precoce e tratamento dos casos humanos, identificação e eutanásia de cães infectados, controle vetorial e educação em saúde (MS, 2006).
Tem sido demonstrado em diversos estudos epidemiológicos em áreas endêmicas de LV, grande contingente de indivíduos com infecção assintomática por L. infantum (CALDAS et al., 2001; CALDAS et al., 2002; NASCIMENTO et al., 2005; MORENO et
al., 2006; MOURA et al., 2012; MARQUES et al., 2012). A estimativa das taxas de
2 de controle adotadas (COSTA et al., 2002; SOUZA et al., 2008; ROMERO et al., 2009; MARQUES et al., 2012).
No Brasil, são escassos os estudos conduzidos com a finalidade de avaliar a efetividade das estratégias do PVC-LV em áreas endêmicas para LV (ASHFORD et al., 1998; OLIVEIRA & ARAÚJO, 2003; SOUZA et al., 2008; COSTA et al., 2007; WERNECK et al., 2008; RIBAS et al., 2013; WERNECK et al., 2014). Os poucos estudos realizados com esse objetivo, são ensaios comunitários, que utilizam intervenções experimentais para comparar, por exemplo, áreas que receberam diferentes tipos de intervenção, como controle químico dirigido ao vetor, controle do reservatório canino, controle do reservatório canino associado ao controle químico do vetor e áreas controle que não receberam intervenções (COSTA et al., 2007; WERNECK et al., 2008; SOUZA et
al., 2008; WERNECK et al., 2014).
Avaliação da efetividade do PVC-LV da forma que é conduzida na rotina do serviço teve inicio em Belo Horizonte em 2009 (MORAIS, 2011). Áreas com diferentes históricos e tempos de intervenção do PVC-LV foram comparadas por meio de um estudo quase-experimental. Foi demonstrada menor prevalência de infecção em crianças residentes na área com maior tempo de intervenção pelo PVC-LV quando comparada a área controle (MORAIS, 2011).
O presente estudo é a continuidade do trabalho iniciado em 2009 por Morais (2011). Tem como objetivo avaliar em estudo quase experimental, a efetividade das estratégias de controle do PVC-LV sobre a infecção assintomática, por meio de nova estimativa da taxa de prevalência da infecção em um delineamento transversal e da taxa de incidência em uma coorte de crianças. Além disso, avaliar fatores individuais e contextuais potencialmente associados à infecção assintomática por L.infantum.
2-Revisão Bibliográfica
2.1. Leishmaniose Visceral
3
Leishmania (Leishmania) donovani, transmitida por vetores do gênero Phlebotomus
(PEARSON et al., 1996; WHO, 2015). Na Europa e nas Américas a LV é uma zoonose, cujo agente etiológico é a Leishmania (Leishmania) infantum, transmitida por vetores do gênero Phlebotomus e Lutzomyia (DEANE, 1958). No Brasil, a leishmaniose visceral americana (LVA) tem como vetores, flebotomíneos da espécie Lutzomyia longipalpis [LUTZ & NEIVA, 1912], que é considerado o flebotomíneo com maior grau de adaptação aos ambientes urbanos modificados pelo homem (RANGEL et al., 2008). O Lutzomyia
longipalpis adapta-se facilmente às condições peridomiciliares e intradomiciliares
(YOUNG et al., 1992, RANGEL et al., 2008). Este flebotomíneo tem hábito alimentar oportunista e faz seu repasto sanguíneo também em humanos, principalmente durante o período crepuscular noturno (ARIAS et al., 1996). O Lutzomyia cruzi também foi identificado em focos de transmissão no país (MS, 2006).
Os reservatórios da LVA pertencem a um grupo específico de mamíferos da família
Canidae, sobretudo cães, raposas e lobos, podendo ainda envolver outros animais como
4 (BADARÓ et al., 1994; NASCIMENTO et al., 1996), no entanto, o impacto desses achados sobre a transmissão da doença no contexto urbano é desconhecido.
A LV é considerada doença negligenciada (WHO, 2015) e nos países endêmicos, não há investimento do setor privado no desenvolvimento de métodos mais eficientes de diagnóstico, nem tampouco da indústria farmacêutica no desenvolvimento de novos fármacos para tratamento. O setor público, apesar dos recursos escassos e infraestrutura inadequada e precária, é o órgão que concentra maior investimento no tratamento, diagnóstico e controle da LV. Devido à expansão da doença e o aumento do número de casos, dentre as doenças tropicais, a LV passou a ser considerada prioridade pela Organização Mundial da Saúde (WHO, 2015).
2.2. Epidemiologia e urbanização da Leishmaniose Visceral Humana (LVH)
A LV é um grave problema de saúde pública. Estima-se que 200 a 400 mil novos casos ocorram no mundo a cada ano (WHO, 2015). Aproximadamente 90% dos casos ocorrem em 6 países: Índia, Bangladesh, Nepal, Etiópia, Sudão e Brasil (WHO, 2015). Nas Américas, aproximadamente 90% dos casos de leishmaniose visceral ocorrem no Brasil (MS, 2006) (Figura 1). O registro do primeiro caso da doença no Brasil ocorreu em 1913, em material de necropsia de paciente proveniente de Boa Esperança, Mato Grosso (ALENCAR et al., 1991).
5 A LVA é zoonose de grande relevância para a saúde pública devido à sua urbanização, expansão geográfica e alta letalidade. A partir da década de 1980, houve mudança no padrão epidemiológico de transmissão da LV no Brasil. A doença tradicionalmente relatada nas áreas rurais, com ocorrência focal em paisagens de pé de serra e boqueirões, estabeleceu-se no meio urbano (ALVIM et al., 1986; COSTA et al., 1990; MS, 2006). Anteriormente predominava em áreas pobres do Nordeste e nas últimas décadas expandiu para as cidades de médio e grande porte (ARIAS et al., 1996; STEINDEL et al., 2013). A transmissão tem sido descrita em centros urbanos como Belo Horizonte (MG), Rio de Janeiro (RJ), Corumbá (MS), Araçatuba (SP), Palmas (TO), Três Lagoas (MS), Campo Grande (MS), entre outros. Está registrada em 19 das 27 Unidades da Federação e apresenta transmissão autóctone em aproximadamente 1.600 municípios (MS, 2006; SBMT, 2011).
6 Tabela 1: Casos de LVH ocorridos em Belo Horizonte, por região de residência (Barreiro, Centro Sul, Leste, Nordeste, Noroeste, Norte, Oeste, Pampulha e Venda Nova).
REGIÃO 1994 – 20002001200220032004200520062007200820092010201120122013*20142015*TOTAL
BARREIRO 7 1 3 2 6 6 9 5 11 13 18 10 6 5 3 1 106
CENTRO SUL 19 1 3 6 5 6 3 5 8 7 2 6 2 2 2 0 77
LESTE 78 3 8 10 16 12 9 13 15 9 14 12 8 8 2 2 219
NORDESTE 86 15 17 12 24 14 23 21 42 15 27 11 7 5 6 0 325
NOROESTE 21 6 9 17 24 17 30 22 28 25 15 11 10 2 5 0 242
NORTE 33 11 12 25 22 20 14 12 13 20 11 10 7 2 6 0 218
OESTE 9 3 3 3 10 11 10 7 9 15 15 7 5 6 4 0 117
PAMPULHA 5 8 5 11 6 10 3 6 5 8 10 5 2 5 2 0 91
VENDA NOVA 10 9 17 16 21 13 24 17 26 24 13 16 5 2 6 1 220
INDETERMINADO 4 0 0 1 0 1 3 2 4 10 6 5 4 5 2 0 47
TOTAL 272 57 77 103 134 110 128 110 161 146 131 93 56 42 38 4 1662
Fonte: Gerência de Epidemiologia / GVSI/ SMSA. *Dados parciais: 03/2015
Figura 2: Casos de LVH e óbitos ocorridos em Belo Horizonte no período de 2005 a 2014.
7 história natural da infecção. As condições ecológicas tipicamente rurais parecem apenas ter sido transferidas para as cidades (WERNECK, 2008b).
A introdução e a dispersão de L. infantum em áreas urbanas estão associadas a diversos fatores ambientais, sociais, econômicos e sanitários que interagem entre si. Os movimentos migratórios do campo para as cidades causaram alterações ambientais e levaram à ocupação desordenada das periferias das cidades. Fatores como alta densidade das populações humana e canina, saneamento precário e condições inadequadas de habitação, também estão relacionados ao processo de dispersão da doença (COSTA et al., 1990; COSTA et al., 2007; WERNECK, 2008b). O processo migratório por sua vez, trouxe para a periferia das cidades, cães originários de áreas endêmicas, que contribuíram para a disseminação da doença no meio urbano (BARATA et al., 2005). Possivelmente, o desmatamento ocasionado pela expansão das cidades, reduziu a disponibilidade dos animais que são fonte de alimentação para o vetor, tornando o cão e o homem, fontes mais acessíveis (BARATA et al., 2005). Existe a hipótese de que a transmissão no ambiente urbano seja heterogênea, uma vez que os variados cenários de transmissão oriundos das diferenças intra-urbanas apresentam maior ou menor semelhança com o padrão rural, formando um mosaico de realidades sociais, culturais e ambientais (WERNECK, 2008b; ARAUJO et al, 2013).
A presença do Lutzomyia longipalpis tem sido registrada em diferentes nichos ecológicos, desde os peridomicílios rurais até urbanos. A característica do ciclo biológico do L. longipalpis, com criadouro em matéria orgânica, dificulta o controle vetorial e favorece sua adaptação no ambiente domiciliar e peridomiciliar (SANTOS et al., 1998). No Município de Raposa no Maranhão, o estudo que avaliou a taxa de infecção natural por
Leishmania sp em flebotomíneos, por meio de reação em cadeia polimerase (PCR),
mostrou que todos os flebotomíneos infectados foram encontrados no peridomicílio (FELIPE et al., 2001). A mudança de hábito e a capacidade de adaptação do vetor são fatores que contribuem para aumentar a transmissão da LV no meio urbano (BARATA et
al., 2005).
8 ambiente urbano, exige abordagens analíticas, que considerem a estrutura intrínseca das variáveis (WERNECK, 2008b).
2.3. Infecção assintomática por L. infantum
Diversos estudos epidemiológicos em áreas endêmicas de LVA têm demonstrado grande número de indivíduos infectados com L. infantum sem manifestações clínicas da doença (BADARÓ et al., 1986; CALDAS et al., 2001; CALDAS et al., 2002; NASCIMENTO et al., 2005; MORENO et al., 2006; BARÃO et al., 2007; De GOUVEA
et al., 2008; FELIPE et al., 2011; MORAIS, 2011; CARNEIRO et al., 2011; MOURA et
al., 2012; MARQUES et al., 2012). Sabe-se que a ocorrência da infecção assintomática por L. infantum excede consideravelmente a ocorrência de adoecimento por LV. Segundo
Badaró et al. (1986), para cada caso clínico de LV há pelo menos 18,5 indivíduos com infecção assintomática e em áreas de alta prevalência, para cada 6,5 assintomáticos tem-se um doente. No Município de Raposo, Maranhão, a relação infecção doença foi de 119:1 segundo o teste de IDRM e 28:1 de acordo com ELISA em estudo realizado com crianças na faixa etária de 0 a 5 anos (CALDAS et al., 2001).
Não se sabe ao certo o significado destes indivíduos na epidemiologia da doença, no entanto a infecção assintomática é indicador usado em estudos epidemiológicos para conhecimento das taxas de transmissão de L. infantum e avaliação da efetividade das estratégias de controle sobre a transmissão do parasito (COSTA et al., 2007; WERNECK
et al., 2008; SOUZA et al., 2008; WERNECK et al., 2014).
Estudos que demonstraram estimativas de altas taxas de prevalência e incidência da infecção assintomática por L. infantum em diferentes regiões do país, são brevemente descritos nesse tópico.
9 assintomática por L. infantum, diagnosticada por meio de ELISA no soro de indivíduos adultos (FELIPE et al., 2011). No estudo de Moura et al. (2012), conduzido na Ilha de São Luiz, Maranhão, Brasil, a prevalência da infecção assintomática por L. infantum em humanos foi de 9,7% quando estimada por ELISA e 71,3% quando estimada por IDRM. Em Araçatuba a prevalência estimada para a infecção assintomática por L. infantum, detectada por meio de teste imunocromatográfico foi de 18,4% na área que apresenta maior número de casos de LVH e baixo nível socioeconômico e de 4,8% na área com melhor condição socioeconômica e menor número de casos da doença (BARÃO et al., 2007). Em Sabará, Minas Gerais, região Sudeste do Brasil, as taxas de prevalência de infecção por L.
infantum, estimadas em uma amostra de 1.604 habitantes, variaram entre 2,4 e 5,6%,
dependendo do teste utilizado (reação de imunofluorescência indireta (RIFI), ELISA e teste de fita imunocromatográfico) (MORENO et al., 2006).
Estudo conduzido entre 2009 e 2010, em Belo Horizonte, Minas Gerais, Brasil, estimou a prevalência da infecção assintomática por L. infantum em 1.875 crianças de zero a sete anos de idade. Os resultados dos ensaios sorológicos realizados no estudo de base mostraram que, das crianças avaliadas, 52 (2,8%; 95% CI 2,1-3,6) apresentaram amostras reativas para ELISA antígeno solúvel (ELISA-AgS), e 280 (14,9%; 95% IC 13,4-16,6) apresentaram amostras reativas para ELISA-rk39, totalizando 317 crianças com resultados positivos em pelo menos uma das técnicas sorológicas. A taxa de prevalência geral foi 18,9% (IC 95% 15,3-18,7), considerando crianças com amostras reagentes nos dois testes (MORAIS, 2011). Esse trabalho, serviu como linha de base para o presente estudo e para o estudo de Marques et al. (2012), que quantificou a carga parasitária por qPCR nas amostras de indivíduos com infecção assintomática e estimou prevalência de 13,9%, levando em consideração a amostra total de 1875 crianças.
É importante ressaltar que as altas taxas de infecção detectadas nos diversos trabalhos, revelam um grande contingente de indivíduos com resistência imunológica celular para a infecção por L. infantum, ou seja, os resultados indicam que muitos indivíduos infectados em uma área endêmica são resistentes à doença (BARBOSA, 2010). Isso pode sugerir, que repetidas infecções são comuns nas áreas endêmicas, levando ao desenvolvimento da imunidade celular e resistência à doença (CRESCENTE et al., 2009).
10 (COSTA et al., 2002; FAKHAR et al., 2008; CARNEIRO et al., 2011; MARQUES et al., 2012; SILVA et al., 2013). No estudo de Marques et al. (2012), em Belo Horizonte, 22,1% das crianças apresentaram resultados de qPCR positivos no início do estudo, mas apenas 5,0% mantiveram-se positivas após um ano de seguimento. Segundo os autores, este resultado leva a inferir que a infecção assintomática pode ser autorregulada, com o aclaramento parcial ou total de parasitas. Entretanto, deve-se considerar que nas áreas urbanas, a ocorrência de infecções subclínicas ocasionadas pela exposição permanente do homem às picadas infectantes é preocupante, pois há em paralelo, a circulação do vírus HIV, o que pode ocasionar co-infecção com L. infantum (DEDET et al., 2000).
2.4. Diagnóstico da infecção por L. infantum no homem
Os testes de diagnóstico da infecção por L. infantum são ferramentas para identificar as áreas de transmissão. Embora os cães sejam os principais reservatórios de L. infantum em áreas urbanas, a prevalência de humanos portadores assintomáticos do parasito pode servir como um indicador de expansão e manutenção de transmissão (COSTA et al., 2002; RIERA et al., 2004; ROMERO et al., 2009). O diagnóstico de infecção assintomática por
L. infantum tem assumido crescente importância nos últimos anos. Ademais, a
identificação da infecção poderia auxiliar na avaliação da efetividade das medidas de controle (SILVA et al., 2013).
Uma importante limitação na condução de estudos epidemiológicos em humanos é a dificuldade em diagnosticar a infecção assintomática por L. infantum, devido aos baixos níveis de anticorpos circulantes e a reduzida carga parasitária (PIARROUX et al., 1993; MORENO et al., 2009; RIERA et al., 2004). O método de ELISA é o mais utilizado atualmente em estudos epidemiológicos para triagem da infecção por L. infantum, principalmente quando um número grande de indivíduos é amostrado. No entanto, vários estudos têm demonstrado que o teste de ELISA é mais adequado para diagnosticar a infecção em pessoas que apresentam sinais e sintomas clínicos de LVH. É uma técnica sensível, no entanto é pouco precisa na detecção de casos subclínicos ou assintomáticos. Quando utilizada em inquéritos epidemiológicos, grande número de assintomáticos é passível de ser desconsiderado, e a real ocorrência da infecção pode ser subestimada (MORENO et al., 2009).
11 parasitas intactos ou moléculas solúveis. Estes antígenos apresentam reações cruzadas principalmente com outras espécies de parasitos da família Trypanosomatidae, pacientes com malária, tuberculose e toxoplasmose (BRAY, 1976). Uma alternativa aos AgS são os antígenos recombinantes. Entre eles, o antígeno recombinante rK39, muito utilizado em estudos no Brasil (ROMERO et al.,2009; NASCIMENTO et al, 2005; MORENO et al., 2005; MORENO et al., 2009; MARQUES et al., 2012; SILVA et al., 2013), que é específico para as espécies do complexo L. donovani (BADARÓ et al., 1996). No estudo de Badaró et al. (1996), foram observadas sensibilidade de 99% e especificidade de 100%. Meta analise realizada por Chappuis et al. (2006) estimou sensibilidade e especificidade do antígeno rk39 respectivamente de 93% (IC95% 87-97,1) e 90,6% (IC95% 66,8-97,9).
As técnicas moleculares não são os métodos de escolha para triagem, mas têm sido considerados complementares na detecção de assintomáticos (MARQUES et al., 2012). Geralmente os resultados entre as técnicas sorológicas e moleculares têm baixa concordância (MORENO et al., 2009, MARQUES et al., 2012., ORSINI et al., 2012). A discordância entre resultados pode ocorrer, pois além da dificuldade de diagnosticar a infecção assintomática, estas técnicas são baseadas em diferentes parâmetros para detecção de infecção: anticorpos e DNA genômico (MARQUES et al., 2012).
Várias publicações comparam e/ou discutem o desempenho de diferentes métodos de diagnóstico para a infecção assintomática por L. infantum.
Em Sabará, MG, observou-se discordância entre resultados dos testes ELISA-AgS e ELISA-rK39, RIFI e teste imunocromatográfico com antígeno rK39 (TRALd), encontrando estimativas de prevalência da infecção assintomática, que variaram entre 1,1 a 11,9%, dependendo do critério adotado (MORENO et al., 2006).
Avaliação da prevalência de infecção assintomática, por meio das técnicas de ELISA-AgS e ELISA-rK39, além da intradermorreação de Montenegro foi realizada em 1520 crianças menores de 15 anos, no Maranhão. Os resultados mostraram prevalências similares para os dois antígenos utilizados na técnica de ELISA sendo de 19,4% para rk39 e 19,7% para AgS (NASCIMENTO et al., 2005).
12
amazonensis (RIFI) e teste imunocromatográfico com antígeno rK39 (TRALd). Os autores concluíram que, devido às diferenças na positividade dos testes utilizados, juntamente com a baixa concordância entre os resultados, não é possível selecionar o melhor teste para o diagnóstico de infecção assintomática por L. infantum. O melhor desempenho para diagnósticos de casos clínicos de LVH foi obtido pelas técnicas de RIFI e TRALd. Maiores sensibilidade (69%) e especificidade (100%) foram obtidas com ELISA utilizando antígenos recombinantes.
Marques et al. (2012) empregaram o diagnóstico molecular para estimar a infecção assintomática por L. infantum por meio de qPCR em estudo conduzido em Belo Horizonte em 2009. O primeiro conjunto de ensaios de qPCR foi realizado em amostras de sangue de 559 crianças coletadas em papel filtro. Destas amostras, 317 testaram reagentes em pelo menos um teste sorológico no estudo transversal realizado em 2009 e 242 foram amostras com resultados negativos, selecionadas aleatoriamente. A qPCR identificou 82 amostras infectadas. Destas, 49 (59,8%) apresentaram sorologia reagente e 33 (40,2%) apresentaram sorologia negativa. Após 12 meses do início da coorte, que avaliou 199 crianças, os teste qPCR em amostras de sangue total coletadas produziram os seguintes resultados: de 44 (22,1%) crianças com resultados de qPCR positivos no início do estudo, apenas 10 (5,0%) mantiveram-se positivas, e 34 (17,1%) tornaram-se negativas. De 155 (77,9%) crianças, com resultados negativos na qPCR, 131 (65,8%) mantiveram-se negativas, e 24 (12,1%), tornaram-se positivas. Observou-se que o sangue periférico de crianças assintomáticas tinha uma quantidade baixa e flutuante de DNA de Leishmania. Além disso, observou-se uma diminuição significativa na parasitemia após um ano de seguimento. Silva et al. (2013), em estudo para o diagnóstico de infecção assintomática por Leishmania em área endêmica de LV, observaram que não houve concordância entre o resultado da PCR, dos exames sorológicos e do teste cutâneo.
2.5. Fatores associados à infecção por L. infantum
13 Segundo Werneck et al. (2008), os variados cenários de transmissão oriundos das diferenças intra-urbanas apresentam maior ou menor semelhança com o padrão rural, formando um verdadeiro mosaico de realidades sócio cultural ambiental, que incidem na dinâmica da doença. Estes fatores favorecem o contato entre seres humanos, vetores e outros animais.
Alguns estudos conduzidos em regiões distintas do Brasil apontam fatores semelhantes associados à infecção por L. infantum. Alguns são apontados como fatores de risco em determinados estudos e como fatores de proteção em outros. A seguir são apresentados estudos que discutem fatores associados à infecção assintomática.
Em estudo prospectivo realizado em crianças de zero a cinco anos no município de Raposa, na ilha de São Luís, Maranhão, utilizando regressão de Cox, a infecção por L. infantum foi associada com a idade da criança (⩾2 anos), a localização das habitações (Vila Nova) e relato de parentes com LVH. Banhar-se fora da casa e brincar ao ar livre 18:00-20:00 horas foram identificados como fatores de risco em algumas análises, mas não em outras. Presença de flebotomíneos no intra e peridomicílio e animais como cães ou galinhas em casa ou na vizinhança apareceram como fatores de risco em algumas análises, mas em outras, eles inesperadamente parecia proteger contra a infecção (CALDAS et al., 2002).
Nascimento et al. (2005) avaliaram fatores sócio-econômicos, ambientais e hábitos de vida associados à infecção por L. infantum no Município de São José de Ribamar, Maranhão. No teste de quiquadrado foi observada associação entre leishmaniose na família, tipo de abastecimento de água e aplicação de inseticida com a infecção por L.
infantum diagnosticada por IDRM. Nenhuma associação com infecção por L. infantum foi
observada utilizando-se o diagnóstico por sorologia ELISA-rK39 ou ELISA-AgS. Entretanto, não foram aplicados modelos multivariados para ajustamento.
14 associadas à infecção foram: família conhecer o vetor, não ter o lixo coletado, lixo não removido ou queimado, criar pássaros, proximidade de áreas erodidas. Os fatores de risco identificados foram associados às condições das moradias, presença de animais e probabilidade de contato com flebotomíneos (MORENO et al., 2005).
Estudo conduzido em Araçatuba, SP, mostrou associação entre nível socioeconômico e a distribuição de casos assintomáticos humanos. A presença de cães na casa não mostrou associação com a infecção humana. De acordo com os autores, possivelmente a presença e número de cães em casa são confundidos com fatores socioeconômicos, que geram um ambiente favorável para reprodução do vetor (BARÃO et al., 2007).
Modelo multinível de incidência da LV em Teresina, Piauí, Brasil, também identificou baixas condições socioeconômicas, além do aumento da vegetação, como fatores associados à alta incidência de LVH. O aumento da prevalência da infecção canina precedeu o aumento da incidência de LVH. Baixas condições socioeconômicas tiveram um efeito amplificador sobre a associação entre infecção canina e a incidência de LV humana (WERNECK et al., 2007). O que se observa é que o ambiente característico e propício à ocorrência da LV é geralmente aquele de baixo nível socioeconômico, prevalente em grande medida no meio rural e na periferia das grandes cidades. Entretanto, estas características vêm se modificando, principalmente, nos estados das regiões Sudeste e Centro-Oeste, onde a LV se encontra urbanizada (MS, 2006).
Em estudo transversal realizado no Município de Raposa, Maranhão, Brasil, para avaliar os fatores de risco para a infecção com L. infantum, detectada por IDRM, a análise de regressão logística mostrou que a presença de flebotomíneos dentro e fora da habitação foi um fator de risco, e idade inferior a 10 anos foi um fator de proteção contra a infecção assintomática. Os autores também destacam que a precariedade das condições de vida da população fortalece a cadeia epidemiológica da LV (PONTE et al., 2011).
Estudo realizado com 361 indivíduos nos municípios que compõem a Ilha de São Luís no Estado do Maranhão, Brasil, analisou os fatores associados à infecção assintomática por
L. infantum em membros da família e vizinhos de pacientes com LVH. A infecção foi
15 pessoas que apresentaram infecção assintomática por L. infantum, 18% residiam junto com pessoas que apresentaram LV clínica em momento anterior ao inquérito (FAKHAR et al., 2008).
Os fatores associados à infecção por L. infantum são controversos entre diferentes estudos. São necessários mais estudos com longos períodos de seguimento, utilizando-se preferencialmente análises multiníveis robustas e mais abrangentes para compreensão desses fatores.
2.6. Programa de Vigilância e Controle da Leishmaniose Visceral (PVC-LV) no Brasil e em Belo Horizonte
A Vigilância Epidemiológica é um dos componentes do Programa de Controle da Leishmaniose Visceral (PVC-LV), que tem como objetivo principal a redução da taxa de letalidade e do grau de morbidade, bem como diminuir o risco de transmissão. Para alcançar esses objetivos, o PVC-LV no Brasil é baseado em três pilares (i) detecção precoce e tratamento de casos humanos, (ii) controle do reservatório canino, (iii) controle vetorial (MS, 2006).
Dentre outros objetivos específicos da vigilância epidemiológica da LV, propostos pelo Ministério da Saúde destacam-se: identificação das áreas vulneráveis e/ou receptivas para transmissão da LV; avaliação da autoctonia referente ao município de residência; investigação do local provável de infecção; conhecimento da distribuição e monitoramento da dispersão do vetor; condições necessárias para que os profissionais da rede de saúde possam diagnosticar e tratar precocemente os casos; condições necessárias para adoção de medidas preventivas, de controle e destino adequado do reservatório canino; investigação de todos os supostos óbitos de LV; monitoramento da tendência da endemia considerando a distribuição no tempo e no espaço; indicação das ações de prevenção de acordo com a situação epidemiológica; desencadeamento e avaliação do impacto das ações de controle; monitoramento dos eventos adversos aos medicamentos (MS, 2006).
16 Estadual (MS, 2006). No âmbito da proteção coletiva, é proposto controle químico com uso de inseticida piretróide de ação residual, em áreas prioritárias. Recomenda-se que nas áreas selecionadas para controle químico, de acordo com a classificação epidemiológica, sejam realizados dois ciclos de borrifação com o inseticida durante o ano, com intervalo de três a quatro meses. Esta medida é dirigida apenas para o inseto adulto, com objetivo de evitar e/ou reduzir o contato entre o inseto transmissor e a população humana. Outras medidas mais pertinentes são propostas, como o manejo ambiental, por meio da limpeza de quintais, terrenos e praças públicas, a fim de alterar as condições do meio, que propiciem o estabelecimento de criadouros de formas imaturas do vetor (MS, 2006).
Quanto ao reservatório canino, as ações de monitoramento em municípios de transmissão moderada a intensa, incluem a realização de inquérito sorológico censitário canino (ISCC). Este tipo de inquérito tem objetivo de identificar cães infectados para a realização da eutanásia, bem como, de avaliar a prevalência da LVC nas áreas (MS, 2006). Como medidas preventivas recomenda-se controle da população canina errante por meio de programas de esterilização dos animais e medidas de proteção individual, como uso de coleiras impregnadas com deltametrina 4% nos cães (MS, 2006). Alguns estudos demonstram que coleiras impregnadas com inseticida são eficazes na proteção dos cães contra o vetor (KILLICK-KENDRICK et al., 1997), mas a estratégia é dispendiosa, uma vez que apenas uma pequena parcela da população pode custear esse método de controle, que não é disponibilizado pelo serviço público (NASCIMENTO et al., 2008). O controle de cães infectados com Leishmania é difícil (OLIVEIRA et al., 2008), pois a eutanásia é controversa, nem sempre bem aceita pela população e os cães eutanasiados com LVC são prontamente substituídas por outros susceptíveis (NUNES et al., 2008). A busca por uma vacina eficaz contra a LVC, também tem sido uma das principais preocupações de diversos grupos de pesquisas (GENARO et al., 1996, PALATINIK et al., 1993), mas não faz parte das medidas de controle adotadas pelo Ministério da Saúde (MS, 2006).
17 no período crepuscular e noturno, em ambientes onde habitualmente o vetor pode ser encontrado (MS, 2006).
Entre as medidas de controle, o Ministério da Saúde inclui também, as atividades de educação em saúde, que devem estar inseridas em todos os serviços que desenvolvem as ações de controle da LV, requerendo o envolvimento efetivo das equipes multiprofissionais. Estas atividades consistem em levar conhecimento à população, por meio da divulgação da ocorrência da LV na região, alerta sobre os sinais clínicos, os serviços para o diagnóstico e tratamento, as medidas de controle que competem ao poder público e medidas de proteção relacionadas às atitudes e práticas da população, como por exemplo, o cuidado permanente com o manejo ambiental do domicílio e do peridomicílio (MS, 2006).
18
Figura 3b. Divisão dos Distritos Sanitários em Áreas de Abrangência: área territorial que as equipes de cada CS atendem - (SMSA)
Figura 3a. Distritos sanitários: organização administrativa dos serviços de saúde do Município de Belo Horizonte - (SMSA)
19 Desde 1994, ano em que foi confirmado o primeiro caso de LV no Distrito Sanitário Leste, o município investiu na estruturação do PVC-LV e foram iniciadas atividades de controle, como ISCC e controle químico do vetor (FIUZA et al., 2008). A partir de 2004, quando foi publicado pelo Ministério da Saúde, o primeiro Manual do PVC-LV, Belo Horizonte adequou-se às orientações propostas e estratificou as áreas AA dos CS considerando a incidência acumulada de casos nos últimos cinco anos. Posteriormente, seguindo a padronização do Ministério da Saúde, o período de análise passou a ser de três anos.
Os estratos foram constituídos a partir dos de pontos de corte nos percentis de incidência acumulada de LVH nas AA: ≤0,1= baixa transmissão; 0,1 a 0,6 = média transmissão; 0,7 a 0,9 = alta transmissão; > 0,9 = muito alta transmissão.
As áreas sem casos no período foram classificadas como sem transmissão. As ações de controle são recomendadas para áreas com média a muito alta transmissão (SMSA, 2006).
As atividades do PVC-LV são executadas em todos os DS e direcionadas de acordo com a realidade epidemiológica existente. São realizadas ações programadas para controle vetorial e educação em saúde, visando atingir principalmente conjuntos de setores censitários com maior risco de ocorrência de LVH, além de informações sobre a infecção canina e a situação ambiental de cada área (FIUZA et al., 2008, SMSA, 2013). A partir de 2007, alguns distritos sanitários passaram a utilizar além da estratificação por incidência acumulada de LVH, o Índice de Vulnerabilidade à Saúde (IVS) (SMSA, 2003), como mais um indicador na definição de áreas a serem priorizadas para ISCC e controle vetorial químico (MORAIS et al., 2007).
O ISCC ocorre casa a casa, nas áreas em que esta atividade é programada. A partir de 2008 as áreas para controle químico vetorial passaram a ser priorizadas considerando-se os resultados obtidos nos ISCC, na situação ambiental das áreas e na localização dos casos humanos (SMSA, 2013).
20 Figura 4: Evolução da cobertura de população canina com ICC e prevalência de sororreatividade canina, Belo Horizonte, 2006-2012 (SMSA, 2013).Fonte: GECOZ/GVSI/SMSA
21 Figura 5: Resultados dos exames de ELISA e de ELISA +RIFI em amostras de sangue canino coletadas em Belo Horizonte, 2006-2012 (SMSA, 2013). Fonte: GECOZ/GVSI/SMSA
Devido à instabilidade do antígeno utilizado na RIFI, houve aumento da discordância entre os testes, interferindo no diagnóstico da LVC. Diante desta evidência o Ministério da Saúde determinou a alteração do protocolo de diagnóstico da LVC no país e a RIFI foi eliminada do novo protocolo. Atualmente o diagnóstico da LVC no país é realizado por meio de triagem pelo teste imunocromatográfico rápido Dual Path Platform (TR DPP), que emprega uma combinação de proteína A conjugada com antígeno recombinante K28 (fragmentos K26, K39 e K9). Caso a amostra seja reagente no teste DPP é realizado o teste de ELISA. O cão com LVC é aquele que apresentar amostra reagente em ambos os testes (DPP e ELISA) (ASSIS et al., 2008; RANGEL et al., 2013).
22 Figura 6: Evolução da estratégia de controle químico vetorial e cobertura da população canina por ISCC, Belo Horizonte, 2006-2012 (SMSA, 2013). Fonte: GECOZ/GVSI/SMSA
A série temporal de casos de por LVH em Belo Horizonte nos últimos anos, mostrou redução concomitante à da sororreatividade canina, o que sugere impacto positivo das ações de controle no município (Figura 7) (SMSA, 2013).
23
2.7. Avaliação da efetividade das estratégias do PVC-LV no Brasil
Para direcionar adequadamente medidas de controle é fundamental considerar heterogeneidades espaciais da distribuição de vetores e outros fatores de risco, como variações na susceptibilidade das populações e diferenças intra-urbanas no contato do vetor com o hospedeiro. Deve-se considerar que a efetividade das medidas de controle pode ser influenciada por fatores como o nível de transmissão, o número de indivíduos susceptíveis, o tamanho das populações de cães e vetores, o nível socioeconômico, e às características do domicílio, peridomicílio e espaço físico (microclima, vegetação, altitude, relevo, etc) (WERNECK, 2008b).
Os métodos convencionais utilizados para controlar a doença mostraram-se ineficazes para deter sua expansão. A disseminação cada vez maior da Leishmaniose visceral humana (LVH) e a ocorrência de novos casos em áreas anteriormente não afetadas apontam para a necessidade de conhecer melhor as particularidades de cada área de transmissão para direcionar medidas de controle mais efetivas (WERNECK et al., 2008; MOURA et al., 2012).
Efetividade segundo Pereira. (1995) é definida como o grau em que determinada intervenção, procedimento, regime ou serviço produz um resultado benéfico, quando
empregado no “mundo real”, em uma população definida; é o resultado verdadeiramente
observado nas condições habituais de uso. Até o momento poucos estudos foram conduzidos com o objetivo de avaliar a efetividade das estratégias do PVC-LV em áreas endêmicas para LV no Brasil (ASHFORD et al., 1998; OLIVEIRA & ARAÚJO, 2003; SOUZA et al., 2008; COSTA et al., 2007; WERNECK et al., 2008; WERNECK et al., 2014). Os estudos realizados com esse objetivo, geralmente, utilizavam intervenções experimentais comunitárias para comparar, por exemplo, áreas que receberam apenas controle químico do vetor, áreas onde foi realizado apenas controle do reservatório canino, áreas em que o controle do reservatório canino foi associado ao controle químico do vetor e áreas sem intervenções (WERNECK et al., 2008; COSTA et al., 2007; SOUZA et al., 2008; WERNECK et al., 2014).
24 no ano de 2000, um comitê de consultores especialistas para discussão conjunta das estratégias do PVC-LV, com o objetivo de reavaliar e redirecionar as ações de controle (COSTA et al., 2001). Naquela ocasião, com base na literatura foi enfatizado que a prioridade do PVC-LV deveria ser dada para o controle de vetores e não de reservatórios. No entanto, por falta de alternativas viáveis, o PVC-LV é baseado até o momento principalmente no reservatório canino.
Alguns autores avaliaram a efetividade das estratégias de controle sobre a prevalência (RIBAS et al., 2013) e incidência de casos de LVH (ASHFORD et al., 1998; OLIVEIRA & ARAÚJO, 2003). Outros autores avaliaram a efetividade destas estratégias sobre a transmissão do parasito, por meio de inquéritos epidemiológicos para estimar taxas de infecção por L. infantum (COSTA et al., 2007; SOUZA et al., 2008; WERNECK et al., 2008; WERNECK et al., 2014). Por tratar-se de doença rara, a presença de casos humanos de LV não é um indicador preciso para a distribuição da transmissão do parasito. Portanto, a estimativa das taxas de prevalência e incidência e a distribuição espacial da infecção assintomática por L. infantum, parecem ser as melhores estratégias para a compreensão da transmissão do parasito e monitoramento dos esforços para o controle. Quando a estimativa das taxas de infecção por L. infantum é realizada em populações de crianças, o dado pode fornecer conhecimento mais preciso acerca da circulação recente do parasito e auxiliar na avaliação da efetividade das estratégias de controle sobre a transmissão (SOUZA et al., 2008; ROMERO et al., 2009; MARQUES et al., 2012).
Oliveira & Araújo. (2003) avaliaram as ações do Programa de Controle da Leishmaniose Visceral no Município de Feira de Santana, Bahia, Brasil, no período de 1995 a junho de 2000. O grupo avaliou a correlação entre a incidência de casos humanos e as ações de controle realizadas no período. Não foi observada associação entre a prevalência de cães com sorologia positiva e a incidência de casos humanos, tomando como base a prevalência canina em um ano e a incidência de casos humanos no ano seguinte por localidade. As variáveis que permaneceram no modelo final foram: percentual de prédios trabalhados para inquérito canino e borrifação e número de ciclos de inquérito canino, capazes de explicar 40% da incidência de casos humanos.
25 cada uma delas submetida a 4 tipos de intervenção: 1) borrifação intradomiciliar e de anexos residenciais; 2) borrifação intradomiciliar e eutanásia de cães infectados; 3) combinação de borrifação intradomiciliar e de anexos e eutanásia canina; 4) apenas borrifação intradomiciliar. Os resultados deste estudo apontam para um efeito protetor da eutanásia de cães infectados na incidência de infecção pela L. infantum adicionalmente ao potencial efeito protetor propiciado pela borrifação intradomiciliar. A proteção oferecida pela remoção de cães infectados sugere que esta estratégia pode reduzir as fontes de infecção para flebotomíneos. Entretanto, a borrifação de anexos, associada ou não à eutanásia canina, não adicionou efeito protetor significativo ao induzido pela borrifação intradomiciliar. Na linha de base desse estudo, estimou-se 42% de prevalência da infecção por L.infantum em 367 indivíduos por meio de exame sorológico ELISA e incidência acumulada de 35%, no período de seis meses a um ano de seguimento (COSTA et al, 2007).
Outro ensaio comunitário foi realizado para avaliação das estratégias de controle da LV em coorte de 2.362 crianças entre zero e doze anos de idade, residentes em área endêmica do Município de Feira de Santana, Estado da Bahia, Brasil. A incidência de infecção foi avaliada mediante inquéritos soroepidemiológicos em três áreas identificadas como: a) área controle; b) área submetida à borrifação com inseticida; e c) área submetida à combinação de borrifação com inseticida e triagem com eutanásia de cães soropositivos. A incidência da infecção foi de 2,74; 2,51 e 1,94 casos/100 crianças-ano, nas áreas controle, áreas submetidas à borrifação e áreas submetidas à borrifação e triagem com eliminação de cães, respectivamente. Considerando-se como referência as áreas-controle, o risco relativo para infecção nas áreas com uma intervenção foi de 0,99 (IC95% 0,46-2,10); e com a combinação de duas intervenções, de 0,74 (IC95%: 0,34-1,62). Embora os dados sugiram uma redução da incidência de infecção nas áreas de intervenção, a diferença não foi estatisticamente significativa (SOUZA et al., 2008).
Ashford et al. (1998) avaliaram o efeito da remoção de cães infectados por
Leishmania sp. sobre a soroconversão canina e a incidência de leishmaniose visceral em
26 Werneck et al. (2014) realizaram estudo randomizado de intervenção comunitária em Teresina, Piauí, para avaliar o efeito do controle vetorial com inseticidas e da eliminação de cães infectados, sobre a incidência de infecção humana por L. infantum diagnosticada por IDRM. Apenas a eutanásia de cães sem associação à borrifação, mostrou-se efetiva, em algumas análises, na redução da incidência da infecção. Estes autores concluíram que há necessidade urgente de revisão do PVC-LV no Brasil, tendo em vista a baixa efetividade da eutanásia de cães e efeito não significativo do controle vetorial com inseticida sobre a incidência de infecção. Sugerem que as intervenções sejam direcionadas de acordo com o risco e com os cenários diferentes de transmissão.
Estudo recente de simulação com base em modelos matemáticos para a transmissão de LV para humanos demonstrou que a eutanásia de cães foi a estratégia menos eficaz dentre as estudadas. O controle vetorial e o uso de coleiras impregnadas com inseticidas nos cães foram as estratégias mais eficazes no controle da LVH. O tratamento e a vacinação de cães também foram ineficazes para a redução da ocorrência da doença no homem (RIBAS et al., 2013).
A limitada efetividade da eliminação de cães como medida de controle da LV, apontada em alguns estudos, pode estar relacionada ao intervalo de tempo entre a realização da coleta e a eutanásia do cão com exame sorológico reagente, falta de continuidade da ação, reposição rápida da população canina, outros reservatórios de LV e persistência de cães falso-negativos devido à baixa sensibilidade dos testes de diagnóstico (DANTAS et al., 2006). A permanência de cães infectados impede a redução da transmissão para níveis nos quais seria possível o controle (BRAGA et al., 1998). Além disso, há uma reposição do reservatório canino, que pode ocorrer por migração de cães para áreas sob intervenção do PVC-LV. No estudo de Moreira et al. (2004), a reposição de animais recolhidos chegou a 50% da população canina em estudo, sendo que destes, 15% já se encontravam infectados ao serem introduzidos na população. Em Araçatuba, observou-se reposição canina de 39% dos cães recolhidos, no período de agosto de 2002 a julho de 2004 (NUNES et al., 2008).
27 quase experimental que estimou a prevalência da infecção assintomática em crianças, em áreas com diferentes históricos e tempos de intervenção pelo programa de controle. Os resultados demonstraram menor prevalência de infecção assintomática nas crianças residentes na área com maior tempo de intervenção pelo PVC-LV. Observou-se tendência decrescente na série temporal de ocorrência de casos de LVH e prevalência canina. Inferiu-se pelos resultados deste estudo transversal, que as estratégias de controle realizadas nas áreas de estudo, demonstraram efetividade sobre a transmissão recente de L. infantum e sobre a prevalência da doença em cães e humanos (MORAIS, 2011).
O PVC-LV atualmente é baseado em medidas cuja eficácia é questionada e a relação custo-eficácia tem sido pouco analisada. Enquanto isso, as pesquisas científicas existentes, não apontam para alternativas seguras e economicamente viáveis, além disso, é improvável a realização de pesquisas capazes de produzir dentro de um prazo razoável, alternativas práticas e viáveis de controle, que extrapolem as medidas que são atualmente estabelecidas e que tenham custo acessível (OLIVEIRA et al., 2008). Existe não só a necessidade de uma melhor definição das áreas prioritárias para direcionamento das ações de controle, mas também da implementação de um sistema de monitoramento das atividades e vigilância epidemiológica, o que poderia permitir melhor avaliação das estratégias do PVC-LV nas diversas regiões do Brasil (DANTAS et al., 2006).
Técnicas e conhecimentos de mecanismos eficazes para evitar expansão urbana e da leishmaniose visceral existem, mas exigem compromisso político-social, bem como a alocação de recursos para fornecer condições salubres de habitação para as populações em risco (ARIAS et al., 1996). Parte das limitações e da baixa efetividade das ações pode decorrer da descontinuidade das ações, observada em algumas áreas, além de outras variáveis que por desconhecimento podem ser desconsideradas no processo de transmissão e conseqüentemente, no planejamento das ações de controle da LV (GONTIJO & MELO, 2004).