UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE ANÁLISES CLÍNICAS E TOXICOLÓGICAS PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
ANTONNYO PALMIELLY DIÓGENES LIMA
Estudo da resposta Th17 no transplante renal alogênico: contribuição do eixo
quimiotático CCR6/CCL20 e dos polimorfismos gênicos em IL17A e IL17RA.
NATAL
ANTONNYO PALMIELLY DIÓGENES LIMA
Estudo da resposta Th17 no transplante renal alogênico: contribuição do eixo
quimiotático CCR6/CCL20 e dos polimorfismos gênicos em IL17A e IL17RA.
Dissertação apresentada ao Programa de Pós-Graduação em Ciências Farmacêuticas da Universidade Federal do Rio Grande do Norte como requisito para obtenção do título de Mestre em Ciências Farmacêuticas.
Orientadora: Profª Drª Janaína Cristiana de Oliveira Crispim Freitas Coorientadora: Drª Julieta Genre
NATAL
Lima, Antonnyo Palmielly Diogenes.
Estudo da resposta Th17 no transplante renal alogênico: contribuição do eixo quimiotático CCR6/CCL20 e dos polimorfismos gênicos em IL17A e IL17RA / Antonnyo Palmielly Diogenes Lima. - Natal, 2015. 76f: il.
Coorientadora: Drª Julieta Genre.
Orientadora: Profª Drª Janaína Cristiana de Oliveira Crispim Freitas.
1. Células Th17. - Disertação. 2. Imunohistoquímica- Dissertação. 3. Interleucina17A Dissertação. 4. Ligante de quimiocina 20
-Dissertação. 5. Receptor de interleucina-17A - -Dissertação. 6.
Receptor de quimiocina 6 - Disertação. I. Freitas, Janaína Cristiana de Oliveira Crispim. II. Genre, Julieta. III. Título.
RN/UF/BSA01 CDU 616.61-089.843 Catalogação da Publicação na Fonte
DEDICATÓRIA
AGRADECIMENTOS
Sobretudo à Professora Janaína Crispim, pela sábia orientação e acompanhamento em todas as etapas de desenvolvimento deste trabalho. A Drª Julieta Genre, pela co-orientação e contribuição neste projeto.
Ao Prof. Dr. Maurício Galvão Pereira, pela colaboração indispensável à realização deste trabalho. Agradeço também a toda equipe do ambulatório do transplante renal.
Ao Prof. Dr. Francisco Pignataro Lima, pela atenção dedicada à análise histopatológica dos espécimes renais, ao Prof. Luiz Reginaldo da Rocha e a sua esposa Rogéria, pelo processamento dos espécimes renais e auxílio na padronização da imunohistoquímica.
A farmacêutica Renata Gomes, pelo fornecimento das amostras de DNA dos controles saudáveis.
Ao técnico do Laboratório de Patologia Ítalo, pelo suporte nas quantificações das marcações obtidas na imunohistoquímica.
A equipe do Laboratório de Pesquisa em Imunopatologias (LAPIM), pelo convívio. Agradeço em especial ao técnico Kleyton e ao doutorando Giovani que contribuíram bastante na padronização das técnicas usadas neste trabalho.
LIMA, Antonnyo Palmielly Diógenes. Estudo da resposta Th17 no transplante renal alogênico: contribuição do eixo quimiotático CCR6/CCL20 e dos polimorfismos gênicos em IL17A e IL17RA. 2015. 76f. Dissertação - Programa de Pós-Graduação em Ciências Farmacêuticas, Universidade Federal do Rio Grande do Norte, Natal, 2015.
RESUMO
O transplante renal é a melhor forma de tratamento para indivíduos que perderam a função do rim. Pacientes transplantados renais necessitam de rigoroso esquema imunossupressor para evitar rejeição. Nesse processo células T helper do sistema imunológico exercem papel chave na resposta contra o enxerto, sendo as células Th17 recentemente investigadas por produzirem IL-17, uma potente citocina pró-inflamatória cujo papel na rejeição também vem sendo descrito. O aumento da expressão de células Th17 tem importante associação ao desenvolvimento da rejeição no microambiente renal, no entanto o provável mecanismo ainda não está bem compreendido. Esse estudo teve como objetivo avaliar a resposta Th17 a partir da influência exercida pelo eixo quimiotático CCR6/CCL20 e por variantes genéticas na IL-17 e seu receptor IL-IL-17RA. Para isso, realizou-se um estudo caso controle envolvendo 148 pacientes transplantados do Hospital Universitário Onofre Lopes/UFRN no qual se avaliou por imunohistoquímica a expressão proteica da IL-17 e das quimiocinas CCR6/CCL20 e por PCR-RFLP as variantes genéticas em IL17A e IL17RA. Nossos resultados demonstraram não haver influência dos polimorfismos gênicos sobre o desfecho do enxerto ou sobre a expressão proteica da IL-17. No microambiente do enxerto renal encontramos várias fontes produtoras de IL-17: células epiteliais tubulares, células glomerulares, neutrófilos e células do infiltrado intersticial, por sua vez a expressão do eixo quimiotático CCR6/CCL20 ficou restrita a células do epitélio tubular. Houve uma leve correlação linear positiva entre a presença de IL-17 e a expressão do eixo quimiotático CCR6/CCL20 no microambiente do enxerto renal. Acreditamos que, aliado aos nossos resultados, estudos posteriores com aumento do “n” amostral e um maior controle sobre as variáveis que envolvem a obtenção do espécime renal, podem determinar com maior clareza a influência exercida pelo eixo quimiotático CCR6/CCL20 e a exercida por polimorfismos genéticos em citocinas, sobre o controle da resposta Th17 nos processos de rejeição ao aloenxerto renal.
LIMA, Antonnyo Palmielly Diógenes. Th17 response in allogeneic renal transplantation: contribution of CCR6/CCL20 axis and genetic polymorphisms in IL17A and IL17RA. 2015. 76f. Thesis - Postgraduate Program in Pharmaceutical Sciences, Federal University of Rio Grande do Norte, Natal, 2015.
ABSTRACT
Kidney transplantation is the best treatment for patients who have lost kidney function. Renal transplant patients require accurate immunosuppressive drugs to prevent rejection. In this process T helper cells of the immune system perform key role in the immune response to the graft, and recently the Th17 cells has been investigated by production of IL-17 potent proinflammatory cytokine whose role in the rejection has also been described. Increased of Th17 cell expression has an important association with the development of rejection in renal microenvironment, however the likely mechanism is not well understood. This study aimed to evaluate the Th17 response from the influence of the chemotactic axis CCR6/CCL20 and genetic variants in IL-17 and IL-17RA. We conducted a case-control study involving 148 patients transplanted at the University Hospital Onofre Lopes/UFRN in which assessed by immunohistochemistry protein expression of IL-17 and chemokines CCR6/CCL20 and by PCR-RFLP genetic variants in IL17A and IL17RA. Our results showed no influence of genetic polymorphisms on the outcome of the graft or the protein expression of IL-17. In renal graft microenvironment found several sources producing IL-17: tubular epithelial cells, glomerular cells, neutrophils and cell interstitial infiltration, in turn the expression of chemotactic axis CCR6/CCL20 was restricted to the tubular epithelium cells. There was a slight positive linear correlation between the presence of IL-17 and expression of chemotactic axis CCR6/CCL20 in the microenvironment of renal graft. Therefore, we believe that, combined with our results, further studies with increased "n" sample and greater control over the variables involved in obtaining the renal specimen, can determine more clearly the influence of chemotactic axis CCR6 / CCL20 and polymorphisms in cytokines related to Th17 profile on the control of this cell subtype response in rejection processes to renal allograft.
LISTA DE ILUSTRAÇÕES
FIGURA 1 - RESPOSTA IMUNE AOS TRANSPLANTES...20
FIGURA 2 - MODELO TEÓRICO DA AÇÃO DE TH17 E DO EIXO QUIMIOTÁTICO
CCR6/CCL20 EM INJÚRIA RENAL...26
FIGURA 3 - GEL DE ELETROFORESE EM AGAROSE A 2% APÓS PCR-RFLP PARA
OS POLIMORFISMOS ESTUDADOS NOS GENES IL17A E IL17RA...32
FIGURA 4 - ANÁLISE HISTOPATOLÓGICA...33
FIGURA 5 - PRINCIPAIS TIPOS DE REJEIÇÃO CELULAR AGUDA CONFORME
CLASSIFICAÇÃO DE BANFF 2007...43
FIGURA 6 - IMUNOHISTOQUÍMICA PARA IL-17A...44
FIGURA 7 - QUANTIFICAÇÃO DA IMUNOHISTOQUÍMICA PARA IL-17A...45
FIGURA 8 - GRÁFICOS DE BOX-PLOT DA QUANTIFICAÇÃO
IMUNOHISTOQUÍMICA PARA IL-17A FRENTE AOS ALELOS DO rs2275913...46
FIGURA 9 - GRÁFICOS DE DISPERSÃO DE PONTOS ENTRE PARÂMETROS
QUANTITATIVOS DA IL-17A E POLIMORFONUCLEARES...47
FIGURA 10 - IMUNOHISTOQUÍMICA PARA CCR6/CCL20...48
FIGURA 11 - QUANTIFICAÇÃO DA IMUNOHISTOQUÍMICA PARA CCR6...49
FIGURA 12 - GRÁFICOS DE DISPERSÃO DE PONTOS ENTRE AS DENSIDADES DE
MARCAÇÃO DA IL-17A E DAS QUIMIOCINAS...50
FIGURA 13 - GRÁFICOS DE DISPERSÃO DE PONTOS ENTRE OS PARÂMETROS
LISTA DE TABELAS
TABELA 1 - CARACTERIZAÇÃO DA AMOSTRA………....36
TABELA 2 - CARACTERÍSTICAS CLÍNICAS E DEMOGRÁFICAS DOS INDIVÍDUOS
TRANSPLANTADOS………..37
TABELA 3 - FREQUÊNCIA DA DISTRIBUIÇÃO DOS POLIMORFISMOS rs2275913 E
rs4819554 NOS INDIVÍDUOS CONTROLES E TRANSPLANTADOS COM E SEM REJEIÇÃO...38
TABELA 4 - EQUILÍBRIO DE HARDY-WEINBERG VERIFICADO PELO TESTE
QUIQUADRO DE QUALIDADE DE AJUSTE………..…39
TABELA 5 - PARÂMETROS DE FUNÇÃO RENAL CONFORME POLIMORFISMO
rs2275913 EM DIFERENTES PERÍODOS APÓS O TRANSPLANTE...41
TABELA 6 - PARÂMETROS DE FUNÇÃO RENAL CONFORME POLIMORFISMO
rs4819554 EM DIFERENTES PERÍODOS APÓS O TRANSPLANTE...42
TABELA 7 - ÁREA, DENSIDADE E NÚMERO DE CÉLULAS MARCADAS PARA
IL-17 CONFORME DESFECHO DOTRANSPLANTE………...46
TABELA 8 - ÁREA E DENSIDADE DE MARCAÇÃO PARA CCR6 E CCL20
LISTA DE ABREVIATURAS E SIGLAS
A>G: adenina mais frequente do que guanina
ABTO: Associação Brasileira de Transplante de Órgãos
BLAST: Basic Local Alignment Search Tool
CCL/CXCL: ligante de quimiocina
CCR/CXCR: receptor de quimiocina
CD: grupo de diferenciação
CKD-EPI: chronic kidney disease - epidemiology collaboration
DNA: ácido desoxirribonucleico
dNTP: deoxinucleotídeo
HLA: Antígeno Leucocitário Humano
HRP: horseradish peroxidase
LSAB: streptavidina conjugada a biotina
MCP-1: proteína quimioatraente de monócitos
MHC: Complexo Principal de Histocompatibilidade
MMP: metaloproteinase
NCBI: National Center for Biotechnology Information
NOS: óxido nitríco sintetase
PAS: ácido periódico de Schiff
PCR-RFLP: Reação em Cadeia da Polimerase - Polimorfismo por Tamanho dos Fragmentos
de Restrição.
PvuII: enzima de restrição extraída de Proteus vulgaris
RORγt: receptor órfão do ácido retinoico
rs2275913: sequência de referência do SNP 2275913
SNP: polimorfismo de um único nucleotídeo
Taq polimerase: polimerase extraída de Thermus aquaticus
TCR: receptor de célula T
TGF-β: fator de crescimento tumoral
Th: linfócito T helper
TIF: tempo de isquemia fria
TNF-α: fator de necrose tumoral
SUMÁRIO
1 INTRODUÇÃO... 14
2 FUNDAMENTAÇÃO TEÓRICA... 16
2.1 Transplante renal... 16
2.2 Imunologia do transplante renal... 18
2.3 Células Th17... 20
2.4 Polimorfismos gênicos em IL17A e IL17RA... 22
2.5 Eixo quimiotático CCR6/CCL20... 23
3 OBJETIVOS... 27
4 METODOLOGIA... 29
4.1 População de estudo e aspectos éticos... 29
4.2 Delineamento do estudo... 29
4.3 Extração de DNA... 30
4.4 Desenho de primers e reação em cadeia da polimerase... 31
4.5 Polimorfismo por comprimento dos fragmentos de restrição... 32
4.6 Avalição histopatológica e imunohistoquímica... 33
4.7 Quantificação da imunohistoquímica... 34
4.8 Análise estatística... 35
5 RESULTADOS... 36
5.1 Características clínicas e demográficas dos indivíduos em estudo... 36
5.2 Polimorfismos gênicos em IL17A e IL17RA: distribuição alélica e genotípica... 36
5.3 Polimorfismos gênicos em IL17A e IL17RA e parâmetros de função renal... 39
5.4 Avaliação histopatológica... 40
5.5 Imunohistoquímica para interleucina-17A... 43
5.6 Imunohistoquímica para o eixo quimiotático CCR6/CCL20... 47
6 DISCUSSÃO... 52
7 CONCLUSÕES... 57
REFERÊNCIAS... 58
ANEXO ... 66
APÊNDICE A... 69
APÊNDICE B... 71
1 INTRODUÇÃO
De um modo geral, a rejeição ao aloenxerto é orquestrada, principalmente, pelo infiltrado de linfócitos T, células dendríticas e células inflamatórias no microambiente renal (TURKA e LECHLER, 2009). As células T helper (Th) CD4+desempenham relevante papel nesse processo. Os subtipos Th1 e Th2 foram implicados durante um longo período como os principais responsáveis pelo desenvolvimento da rejeição mediada por células T (MOSMANN e COFFMAN., 1989). Contudo, o modelo Th1/Th2 tem se demonstrado simplista à elucidação do mecanismo de rejeição celular, de modo que outro subtipo de linfócito T CD4+ tem chamado atenção, sendo denominado linfócito Th17 (HARRINGTON et al., 2005; HEIDT et al., 2010; STEINMAN, 2007).
As células Th17 expressam o fator de transcrição RORγ (receptorórfão relacionado ao ácido retinoico) e diferenciam-se a partir de células T CD4+virgens pela ação de TGF-β (fator de crescimento e transformação beta) e das interleucinas 6 e 21, assim como dependem da IL-23 à estabilização da produção da sua linhagem (ACOSTA-RODRIGUEZ et al., 2007; MIOSSEC et al., 2009; WILSON et al., 2007). A interleucina-17 (IL-17A) constitui a principal substância sintetizada pelas células Th17, sua ação é mediada pela interação com o receptor de interleucina-17A (IL-17RA), e consiste principalmente na mobilização de neutrófilos, linfócitos T efetores e no estímulo à produção de citocinas pró-inflamatórias na resposta imune contra fungos, bactérias extracelulares, inclusive no transplante renal (CRISPIM, J. C. et al., 2009; GAFFEN, 2011; KORN et al., 2009).
Recentemente, estudos demonstram que a produção e a função de interleucinas e seus respectivos receptores são regulados pela presença de polimorfismos em um único nucleotídeo (SNPs) nos genes responsáveis pela codificação dessas moléculas. Nesse contexto, o gene IL17A, relacionado com a codificação da interleucina-17A, e o gene IL17RA, relacionado com a codificação do receptor IL17RA, apresentam diversas variantes genéticas, das quais os SNPs rs2275913 (G>A) e rs4819554 (A>G) têm sido associados ao desenvolvimento de diversas doenças autoimunes, bem como à rejeição ao transplante renal (ESPINOZA et al., 2011; HAYASHI et al., 2012; KARIMI et al., 2014; KIM et al., 2012; SARAIVA et al., 2013).
inflamados. De fato, trabalhos prévios em modelos experimentais de glomerulonefrite, demonstram que a expressão do receptor de quimiocina 6 (CCR6) e seu ligante CCL20 parecem desempenhar um papel fundamental no recrutamento direto de outras células Th17 CCR6+para o rim (PAUST et al., 2012).
2 FUNDAMENTAÇÃO TEÓRICA
2.1 Transplante renal
O primeiro transplante de sucesso em seres humanos foi o de rim, realizado na década de 50, entre irmãos gêmeos idênticos (MURRAY et al.,1953). Contudo, somente a partir da compreensão dos mecanismos biológicos envolvidos na tolerância e rejeição de órgãos é que o transplante de órgãos passou a ser considerado como uma alternativa terapêutica no tratamento de doenças terminais. A natureza imunológica da rejeição ao transplante foi estabelecida somente na década de 40, quando experimentos realizados por Medawar demonstraram que enxertos de pele eram rejeitados devido a uma resposta imune do hospedeiro contra o tecido enxertado (GIBSON e MEDAWAR., 1943; MEDAWAR., 1944).
Medawar demonstrou que essa forte resposta desencadeada contra os enxertos de pele era consequência da presença de antígenos provenientes do doador, ausentes no receptor, cuja interação entre esses antígenos e o sistema imune do receptor culminava com a rejeição e perda do tecido enxertado. Entre 1953 e 1956, Billingham, Brent e Medawar demonstraram um mecanismo de tolerância neonatal, no qual a transferência adotiva de células alogênicas do baço e medula óssea de camundongo doador induziam tolerância no camundongo receptor devido ao desenvolvimento incompleto do seu sistema imune em período neonatal (STARZL e ZINKERNAGEL., 2001). Estes achados foram fundamentais na perspectiva de que em condições tolerogênicas o transplante renal em humanos poderia ser bem sucedido (BRENT L., 1997).
Na década de 50 o primeiro transplante renal foi realizado com sucesso em Boston no Estado de Massachusetts, nos Estados Unidos (MERRILL et al., 1984). E em 1962, Murray e sua equipe realizaram uma série de transplantes renais com doadores vivos não-relacionados (doadores sem grau de parentesco com o receptor), utilizando pela primeira vez em humanos terapia imunossupressora medicamentosa com Azatioprina como base do tratamento pós-transplante – até então a imunossupressão para o transplante era realizada por irradiação de raiosa fim de inibir a ação do sistema imune do receptor por depleção da medula óssea.
anos, enquanto que para doadores vivos relacionados esse tempo era de 7 anos (CALNE., 1969).
O transplante de órgãos pode ser considerado uma das grandes conquistas terapêuticas do último século. De fato, os anos 50 representaram um grande marco na história dos transplantes, no qual o avanço das técnicas cirúrgicas aliado à compreensão genética e imunológica do fenômeno de rejeição e tolerância ao órgão transplantado contribuiu significativamente para o seu sucesso. Contudo, em relação ao transplante de rim, ainda pode-se obpode-servar que a sobrevida do enxerto, em 10 anos pós-transplante, nos dias de hoje não é diferente daquela obtida no século passado, demonstrando que embora existam avanços nesta área ainda há muito que se compreender para melhorar tal sobrevida.
O Brasil, conforme dados de 2013 do IRODaT (Registro Internacional de Doação e Transplante de Órgãos), ocupa a segunda posição, entre 30 países pesquisados, em número de transplantes renais realizados. Segundo dados da Associação Brasileira de Transplante de Órgãos (ABTO), houve um aumento significativo no número de transplantes de rim realizados em nosso país, variando de 3.046 em 2002 a 5.433 no ano de 2013. No estado do Rio Grande do Norte, local do presente estudo, também houve um aumento considerável, de 14 para 54 transplantes de rim, durante esse mesmo período.
A principal causa da necessidade de realização do transplante de rim é a insuficiência renal crônica, correspondente ao estágio cinco da doença renal crônica (DRC). A insuficiência renal é a condição em que os rins perdem a capacidade de efetuar suas funções básicas, podendo ocorrer de forma súbita e rápida, levando a um quadro de insuficiência renal aguda, ou de forma lenta, progressiva e irreversível caracterizando a insuficiência renal crônica. Os critérios para a definição de doença renal e insuficiência crônica no Brasil são os mesmos propostos pela National Kidney Foundation, agência dos Estados Unidos, através de seu documento Kidney Disease Outcome Quality Initiative (KDOQI):
a) DRC: Lesão presente por um período igual ou superior a três meses, definida por anormalidades estruturais ou funcionais do rim, com ou sem diminuição da taxa de filtração glomerular (TFG), evidenciada por anormalidades histopatológicas ou de marcadores de lesão renal, incluindo alterações sanguíneas ou urinárias, ou ainda dos exames de imagem; e TFG <60 mL/min/1,73 m2por um período igual ou superior a três meses, com ou sem lesão renal.
Quando a doença renal crônica atinge o estado terminal, a única forma de tratamento é a terapia de substituição renal em uma de suas alternativas: hemodiálise, diálise peritoneal ou transplante. Para a escolha do tipo de terapia ao qual o paciente será submetido, alguns fatores são levados em consideração como o nível da taxa de filtração glomerular, presença e intensidade de sinais e sintomas de uremia, disponibilidade de terapia renal substitutiva e as preferências dos pacientes e familiares. Contudo, dentre estas três formas de tratamento o transplante renal é sempre a melhor opção terapêutica, tanto do ponto de vista médico, quanto social e econômico (WYLD et al., 2012; SANCHO e DAIN., 2008).
De uma forma geral, os transplantes podem ser classificados de acordo com a origem do enxerto em: autólogo, quando há transplante em um mesmo indivíduo de um local para outro; isogênico, quando o transplante é realizado entre indivíduos geneticamente idênticos, isto é, membros de uma mesma espécie com histocompatibilidade para antígenos idêntica, tais como gêmeos idênticos; e alogênico, entre indivíduos de uma mesma espécie mas geneticamente diferentes. De acordo com a relação doador/receptor, os transplantes classificam-se, ainda, em três tipos, sendo eles doador vivo relacionado, vivo não-relacionado e cadáver (RIELLA, 2010).
Por fim, o transplante renal melhora a qualidade de vida e reduz o risco de mortalidade na maioria dos pacientes com DRC terminal. Contudo, tais indivíduos necessitam de acompanhamento clínico por nefrologista durante pelo menos seis meses após o transplante, em razão do surgimento de co-morbidades, como infecções oportunistas por Pneumocystis jirovecii, citomegalovírus, parvovírus e Mycobacterium tuberculosis, doenças cardiovasculares, anemia por deficiência de eritropoietina, diabetes mellitus tipo 2, distúrbios no metabolismo ósseo e, principalmente, devido ao risco da rejeição do órgão transplantado (BRIGGS, 2001; MIX et al., 2003).
2.2 Imunologia do transplante renal
Respostas imunológicas contra o rim podem ocorrer em qualquer momento do transplante. Lesões isquêmicas podem ser provocadas imediatamente após a cessação do fluxo de sangue arterial para o rim. Tais lesões ativam a resposta imune inata, por meio de citocinas pró-inflamatórias liberadas no local, e adicionalmente agravam-se após a reperfusão do enxerto, quando mecanismos de regeneração e reparo ocorrem em paralelo a apoptose, autofagia e necrose celular, em um conjunto de processos que caracterizam os danos de isquemia-reperfusão (KOSIERADZKI e ROWIŃSKI, 2008).
A isquemia seguida de reperfusão regula a superexpressão de moléculas do antígeno leucocitário humano (HLA) em células do enxerto, provocando a liberação de uma cascata de quimiocinas, citocinas pró-inflamatórias e moléculas de adesão no tecido renal. O aumento na expressão de moléculas do HLA intensifica a resposta imune e aumenta o infiltrado de células no enxerto levando assim a um aumento do risco de rejeição (KIM et al., 2008). Moléculas de HLA expressas em células dendríticas do doador ou do receptor são as responsáveis pelos mecanismos de alorreconhecimento do órgão doado e desencadeiam o processo de rejeição.
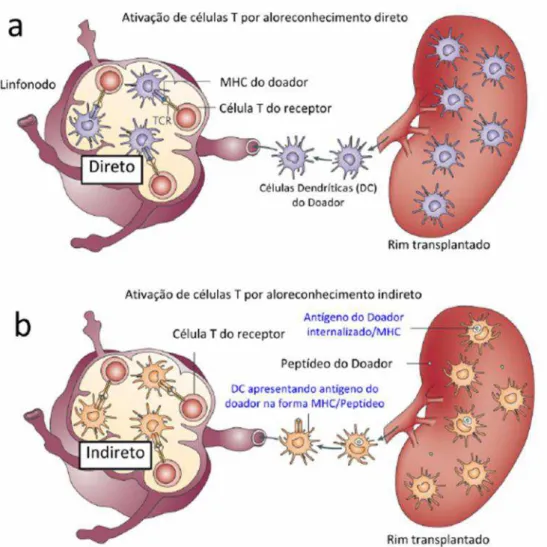
A ativação de linfócitos na resposta imune aos transplantes tem início quando as células dendríticas do doador, residentes no órgão transplantado, ativam os linfócitos T do receptor nos órgãos linfoides secundários por alorreconhecimento direto (Figura 1a). De modo que, as células dendríticas expressando MHC estranho ao organismo do receptor, desencadeiam uma resposta direta via receptor dos linfócitos T (TCR). Paralelamente, estas moléculas de MHC são processadas por outras células dendríticas, as do receptor, que ativam linfócitos em um mecanismo de alorreconhecimento indireto (Figura 1b) (PONTICELLI, 2012).
O processo de rejeição pode ocorrer em diferentes etapas de acordo com o tempo que leva para se instaurar (LECHLER et al., 2003), a rejeição hiperaguda de origem humoral é conhecidamente prevenível, sendo as rejeições de origem celular aguda e crônica o alvo de muitos estudos no campo dos transplantes na tentativa de se compreender sua fisiopatogênese (BRENNAN et al., 2011; DILILLO et al., 2011; MEIER-KRIESCHE et al., 2004; SMITH et al., 2011). A rejeição aguda ocorre quando há ativação, proliferação e diferenciação de linfócitos T, já a rejeição crônica pode se desencadear tanto por fatores imunológicos quanto por fatores não imunológicos que culminam em esclerose glomerular, fibrose intersticial e atrofia tubular (GANJI e HARIRIAN, 2012).
Atualmente, os principais agentes imunossupressores utilizados em vários esquemas de manutenção incluem inibidores da calcineurina, inibidores de mTOR, fármacos antimetabólitos, inibidores da síntese de nucleotídeos e corticosteroides (HALLORAN, 2004). Regimes de manutenção convencionais consistem em uma combinação de imunossupressores que diferem pelo mecanismo de ação, mas que o resultado final a ser atingido é o mesmo: redução das respostas imunes humoral e celular ao aloenxerto.
Figura 1. Resposta imune aos transplantes. TCR, receptor de célula T; MHC, complexo principal de histocompatibilidade; DC, célula dendrítica. Adaptado: TURKA, L. A.; LECHLER, R. I. Towards the identification of biomarkers of transplantation tolerance. Nature Reviews Immunology. Issue 7, v.9, p.521-526, 2009.
2.3 Células Th17
subdivididos em Th1 ou Th2 (MOSMANN e COFFMAN., 1989), de acordo com seu perfil de produção de citocinas, são bem conhecidos na fisiopatologia do transplante. Porém, em 2005, outro subtipo de células T helper foi descoberto e denominado Th17, devido sua capacidade em secretar interleucina-17 (PARK et al., 2005; HARRINGTON et al., 2005). Em murinos, as células Th17 produzem citocinas tais como IL-17, IL-22, IL-26, IL-6 e fator de necrose tumoral (TNF)-e atuam sobre as células endoteliais, fibroblastos, células epiteliais e macrófagos, induzindo-as a produzir uma variedade de quimiocinas (CXCL1, CXCL2, CXCL5, CCL2 e CCL5), óxido nítrico sintetase (NOS)-2, metaloproteinases (MMP)-3, fator estimulante de colônias (CSF), de granulócitos (G-CSF) e granulócitos e macrófagos (GM-CSF), além de citocinas pró-inflamatórias IL-1, IL-6 e TNF-(ROMAGNANI et al., 2009).
Citocinas como 6 e 23 tem papel fundamental no perfil de resposta Th17. A IL-6 participa da ativação do fator de transcrição RORγt em células T CD4+
virgens por duas diferentes vias de diferenciação das células Th17: uma delas dependente de TGF-β e a outra em consonância com IL-1β e IL-23 que promovem um fenótipo mais inflamatório às células Th17 (DAS et al., 2009; GHORESCHI et al., 2010; PETERS et al., 2011). Essas células mediam um perfil de resposta caracterizado principalmente pela presença de intenso infiltrado neutrofílico, que usualmente é ausente em processos inflamatórios mediados por células Th1 e Th2. Nesse sentido, o paradigma Th1/Th2 na imunologia do transplante passou a ser reavaliado principalmente pelas evidências da participação da IL-17, citocina produzida pelas células Th17, em diferentes modelos de rejeição, in vivo, in vitro e em pacientes transplantados renais (CRISPIM et al., 2009; IL MIN et al., 2009; LI TING, 2011; LOVERRE et al., 2011; ODOBASIC et al., 2011; YANG et al., 2012).
A célula Th17 tem seu papel no transplante atribuído principalmente a potente ação pró-inflamatória da IL-17. Embora a diferenciação das células Th17 via IL-6 e IL-21 tenha sido descrita no ano de 2005, a primeira evidência da participação de IL-17 na rejeição ao transplante renal foi registrada em 1998, quando se observou que essa citocina tinha a capacidade de ativar células epiteliais tubulares induzindo-as a secretar IL-6, IL-8 (CXCL8) e MCP-1 (CCL2) (VAN KOOTEN et al., 1998). A partir de então outros trabalhos mostraram a
expressão de IL-17 em associação à rejeição aguda e alterações subclínicas no transplante em modelo experimental (LOONG et al., 2000; HSIEH et al., 2001).
produção de IL-17 (DE MENEZES NEVES et al., 2013). Sistemicamente já havia sido demonstrado uma maior produção de IL-17 no sangue periférico de pacientes com rejeição aguda (CRISPIM et al., 2009). De fato, Chung et al., (2012) por meio de estudo de seguimento com pacientes transplantados renais, demonstrou que nos indivíduos com elevado percentual de células Th17 no período inicial pós-transplante, havia maior risco de disfunção do aloenxerto após 1 ano do transplante.
Embora as células Th17 estejam relacionadas à rejeição de órgãos transplantados, os estudos publicados em transplante renal limitam sua detecção quase que exclusivamente à produção de IL-17 (LOONG et al., 2002; VAN KOOTEN et al., 1998; WOLTMAN et al., 2000). Deste modo, mesmo que a participação destas células tenha sido descrita em diferentes tipos de rejeição ainda não se sabe definitivamente qual seu papel nos processos de rejeição ao transplante renal (ABADJA et al., 2012). Portanto, compreender fatores que regulam as ações dessa citocina, bem como mecanismos que atuem sobre o recrutamento de células Th17 ao microambiente renal é de fundamental importância à compreensão do envolvimento da IL-17 e de ThIL-17 no transplante renal.
2.4 Polimorfismos gênicos em IL17A e IL17RA
A interleucina-17 faz parte de uma família de citocinas composta por 6 membros designados de IL-17A-F. Da qual, o principal representante, a IL-17A, também conhecida por IL-17, interage com o receptor de interleucina-17A (IL-17RA) e desempenha funções na imunidade contra fungos e bactérias extracelulares, além de possuir papel relevante na rejeição ao transplante de rim, conforme descrito acima (GAFFEN, 2011; KORN et al., 2009; MIOSSEC e KOLLS, 2012; MIOSSEC et al., 2009).
O gene IL17A, localizado no cromossomo 6 (lócus p12.2), promove a síntese de IL-17. Até o momento 144 variantes genéticas têm sido descritas nesse gene, das quais os polimorfismos em um único nucleotídeo (SNPs) são os principais focos de pesquisa em doenças autoimunes (NCBI, dbSNP 2014). Dentre esses SNPs, o rs2275913 (G>A) da região promotora desse gene merece destaque, visto que recentemente tem sido associado a regulação da produção de IL-17.
(HAPMAP, 2014), sendo que a presença desse último foi associada à maior produção de IL-17A, devido ao aumento da afinidade do NFAT (Fator Nuclear de Células T Ativadas) - um regulador crítico da produção dessa interleucina - pelo seu motivo de ligação, na região promotora da IL-17. Desta forma, tem se especulado que indivíduos portadores do alelo A (AA e AG) apresentam níveis séricos acentuados da interleucina-17A em relação aos portadores do genótipo GG para esse SNP e são, portanto, mais propensos ao desenvolvimento de doenças autoimunes e rejeição a transplantes (ESPINOZA et al., 2011).
Por sua vez, o gene IL17RA sintetiza o receptor IL-17RA para atuar na via de transdução de sinal mediada por IL-17. Localiza-se no cromossomo 22 (lócus q11.1) e apresenta cerca de 924 variantes genéticas descritas em humanos (NCBI, dbSNP 2014). O polimorfismo rs4819554 (A>G) localiza-se na região promotora de IL17RA, a 809 pares de bases do início da região codificadora. Em média, na população mundial, 25% dos indivíduos possuem o alelo G enquanto que os 75% restantes o alelo A (HAPMAP, 2014). A presença desse SNP foi associada ao desenvolvimento de alopecia areata, diabetes pós-transplante e doença renal crônica em estágio terminal. Em relação a esta última, a presença do alelo A sugeriu maior susceptibilidade ao desenvolvimento de DRC (KIM et al., 2012). Em recente publicação, um grupo de pesquisadores da Espanha encontrou piores valores da TFG (menor do que 60ml/min/1,73m2) em portadores de diabetes mellitus tipo 2 com genótipo AA para o rs4819554 quando comparados aos indivíduos que carreavam os genótipos GA ou GG (COTO et al., 2015). Acredita-se que a presença do alelo A no rs4819554 pode afetar a ligação de fatores de transcrição, entre eles o AP-4, à região promotora do gene IL17RA (VERMA et al., 2012).
Finalmente, a influência dos polimorfismos em IL17A e IL17RA sobre os processos de rejeição ao aloenxerto renal ainda não foi totalmente estabelecida. Assim, visto o potencial envolvimento do eixo IL-17A/IL-17RA sobre essa condição clínica, espera-se esclarecer a provável influência dessas variantes genéticas sobre o desenvolvimento da disfunção do enxerto renal.
2.5 Eixo quimiotático CCR6/CCL20
processo inflamatório, as quimiocinas participam promovendo a ativação de integrinas, envolvidas na adesão das células aos vasos sanguíneos. Além disso, sua expressão tecidual gera gradientes quimiotáxicos responsáveis pela migração direcionada e manutenção das células nesses locais. Isto significa que a expressão de uma quimiocina, em um determinado tecido, e a presença de um receptor específico em um leucócito, contribuem para a especificidade da migração celular (MOSER e LOETSCHER, 2001).
As duas principais classes de quimiocinas são a CC e CXC, denominadas conforme o padrão conservado dos resíduos de cisteína encontrados em cada classe. Até o momento, aproximadamente, 50 quimiocinas foram descritas: 29 CC, 17 CXC e o restante pertencente a classes menos numerosas XC e CX3C. Os receptores das quimiocinas pertencem a família dos
receptores acoplados a proteína G e podem se ligar a diferentes quimiocinas (ZLOTNIK e YOSHIE, 2012). Em nosso estudo investigamos, exclusivamente, o eixo CCR6/CCL20.
O ligante de quimiocina 20 (CCL20) é regulado por mediadores pró-inflamatórios. Neutrófilos, células mononucleares e linfócitos Th17 são fontes de CCL20. Além disso, o ligante está predominantemente expresso nas mucosas teciduais do intestino e pulmão, fígado e timo. Por isso, postula-se que a expressão constitutiva do CCL20, na ausência de ativação do sistema imune, desempenha papel fundamental na homeostase do sistema imune (LEE et al. 2013; COOK et al., 2000; SCHUTYSER, STRUYF e VAN DAMME 2003). Por sua vez, o receptor de quimiocina 6 (CCR6) é um receptor acoplado a proteína G expresso em células dendríticas, células B, células T de memória e linfócitos T BOWMAN et al., 2000; GREAVES et al., 1997; YANG, et al., 1999a. Entre as células T CD4+o CCR6 está expresso em células Th17 e T regulatórias (Tregs) (OO et al., 2012).
alguns autores associam essa dualidade à expressão do CCR6 em células Th17 com fenótipo regulatório (KLEINEWIETFELD e HAFLER, 2013).
No transplante renal já é bem descrito o envolvimento de quimiocinas relativas aos subtipos de células Th1 (CXCL10/CXCR3) e Th2 (CCL2/CCR2) nos processos de rejeição. Nesse contexto, vários estudos apontam para o papel crucial exercido, principalmente, por CXCL10 e CXCR3 no desenvolvimento de rejeição aguda, através do estabelecimento de um infiltrado celular rico em células Th1, em detrimento de células Th2 (HANCOCK et al., 2000; LO et al., 2011). Por sua vez, não há associação prévia entre a ação do eixo quimiotático CCL20/CCR6 e o recrutamento de células Th17 ao aloenxerto renal.
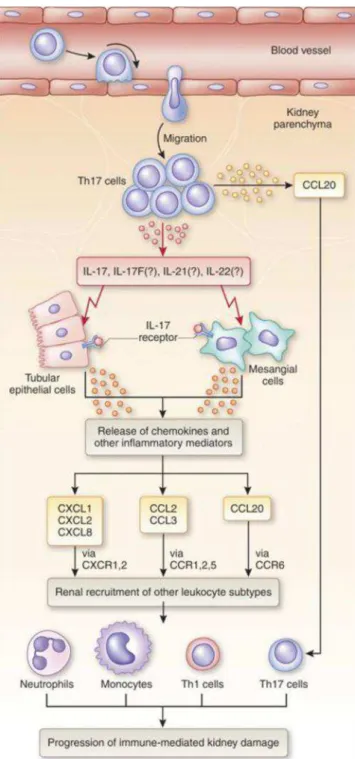
Em modelos experimentais de glomerulonefrite, especula-se que células Th17 são recrutadas a partir do sangue periférico e migram ao parênquima renal sob ação da quimiocina CCL20 previamente produzida nesse ambiente. Em seguida, as próprias células Th17 produzem mais CCL20 que recruta outras células do mesmo fenótipo, bem como também produzem IL-17A e IL-17F que se ligam a receptores IL-17RA localizados em células tubulares epiteliais e células mesangiais, resultando na secreção de quimiocinas CXCL1, CXCL2, CXCL8, CCL2, CCL3 e CCL20 responsáveis pelo recrutamento de neutrófilos, monócitos, células Th1 e células Th17, via receptores CXCR1, CXCR2, CCR1, CCR2, CCR5 e CCR6 presentes nessas células. Finalmente, resultando na progressão do dano renal imune mediado (Figura 2) (PAUST et al., 2012; TURNER, PAUST, STEINMETZ e PANZER, 2009).
3 OBJETIVOS
Investigar mecanismos envolvidos com a participação de células Th17 no transplante renal, e ainda, correlacionar estes achados com o impacto na sobrevida do enxerto.
Detalhadamente, os objetivos do projeto são:
Determinar os polimorfismos rs2275913 e rs4819554 em pacientes transplantados renais e associá-los ao risco do desenvolvimento de rejeição.
Uma vez que há diferenças na produção de IL-17A e IL-17RA conforme o SNP encontrado. Espera-se investigar esses polimorfismos em pacientes transplantados renais, através da técnica de PCR-RFLP a partir do DNA oriundo do sangue periférico dos indivíduos em estudo. Dessa forma, será verificado, se a presença desses SNPs está associada ao maior risco de rejeição do aloenxerto, obedecendo, assim, ao padrão encontrado para o maior risco de desenvolvimento de doenças autoimunes.
Avaliar a expressão proteica da interleucina-17 em espécimes de enxerto renal e correlacionar o padrão de marcação com a presença do polimorfismo rs2275913.
Tendo em vista as variações da expressão de IL-17 sistemicamente conforme a presença de determinados polimorfismos, principalmente aqueles localizados na região promotora. Objetiva-se determinar se a presença do polimorfismo rs2275913 influencia na expressão proteica da interleucina 17 no microambiente do aloenxerto renal.
Identificar a expressão proteica do eixo quimiotático CCR6/CCL20 no microambiente do aloenxerto renal dos indivíduos em estudo.
Quantificar a marcação obtida com a expressão proteica da IL-17 e do eixo quimiotático
CCR6/CCL20 nos espécimes renais.
4 METODOLOGIA
4.1 População de estudo e aspectos éticos
Trata-se de um estudo observacional do tipo caso-controle, com aquisição dos dados e amostras de forma retrospectiva e prospectiva. A população de estudo foi composta por 148 pacientes transplantados renais, acompanhados pelo serviço do transplante renal do Hospital Universitário Onofre Lopes (HUOL), e por 175 doadores de medula óssea do HEMOVIDA cadastrados no REDOME (Registro Nacional de Doadores de Medula Óssea), ambas as instituições localizadas na cidade de Natal, Rio Grande do Norte.
O estudo foi executado entre o período de 2013 a 2015, sob a aprovação do Comitê de Ética em Pesquisa da Universidade Federal do Rio Grande do Norte (CEP-HUOL, PROTOCOLO NÚMERO: 289.318 em “ANEXO”) e conforme os princípios da Declaração de Helsinki e da resolução do Conselho Nacional de Saúde Nº 196 (CNS/196). Participaram do estudo os indivíduos que perfizeram os critérios de inclusão: resultados sorológicos negativos antes do transplante para citomegalovírus, Toxoplasma gondii, vírus da hepatite B e C, vírus da imunodeficiência humana e Trypanosoma cruzi, resultado do cross-match negativo, uso do esquema imunossupressor de manutenção com tacrolimus (0,1 mg/kg/dia), micofenolato (1g duas vezes/dia CellCept®ou 720 mg duas vezes/dia Myfortic®) e prednisona (5mg/dia), além de voluntariamente concordarem em assinar o Termo de Consentimento Livre e Esclarecido (APÊNDICE B). Estando excluídos os menores de 18 anos e portadores de doenças com envolvimento imunológico tais como câncer, artrite reumatoide, colite ulcerativa, doença periodontal crônica, psoríase entre outras doenças autoimunes.
4.2 Delineamento do estudo
Além disso, formou-se um grupo restrito para estudo imunohistoquímico composto por indivíduos que apresentaram sinais de rejeição ao longo do transplante e, portanto, necessitaram submeter-se ao procedimento de biópsia do tecido renal. Tais lâminas foram obtidas junto ao arquivo de biópsias do Departamento de Patologia da Universidade Federal do Rio Grande do Norte, após processamento e análise pelo Patologista.
Finalmente, por análise dos prontuários médicos foram levantados dados demográficos e epidemiológicos dos doadores e dos receptores do transplante, além de informações clínicas como a etiologia da doença que conduziu à perda renal, índice de reatividade contra painel de células (PRA) no pré-transplante, tempo de isquemia fria, tratamento imunossupressor, compatibilidade HLA, ocorrência de infecções virais, tipo de doador, valores de creatinina e ureia durante os 3 primeiros meses, 6 primeiros meses e primeiro ano após o transplante.
4.3 Extração de DNA
Para a análise dos polimorfismos gênicos rs2275913 e rs4819554, foi realizada extração do DNA genômico (DNAg) pelo método de mini salting out, descrito por Salazar e colaboradores (1998) com algumas modificações.
Inicialmente, 4mL de sangue em EDTA foram coletados dos indivíduos em estudo. A seguir as amostras foram centrifugadas a 140g por 5 minutos. Retirou-se o anel de leucócitos e transferiu-se para um microtubo estéril de 1,5mL, onde foi adicionada a solução de Lise I (10 mmol/L Tris-HCl, pH 8,0; 10 mmol/L KCl; 10 mmol/L MgCl2; 2 mmol/L EDTA, pH 8,0;
25 mL/L Triton X-100). Em seguida, as amostras foram submetidas a sucessivas seções de lavagens e centrifugações a 1.500g até que se obtinha um sedimento esbranquiçado composto por leucócitos. A esse sedimento foi adicionada solução de Lise II (10 mmol/L Tris-HCl, pH 8,0; 10 mmol/L KCl; 10 mmol/L MgCl2; 2 mmol/L EDTA, pH 8,0; 0,4 mol/L NaCl; 10 g/L
de dodecil sulfato de sódio), seguiu-se uma etapa de homogeneização, sendo então adicionado o NaCl 5M. Posteriormente, foi realizada centrifugação a 12.000g por 5 minutos, com o intuito de precipitar o concentrado de proteínas e suspender a solução contendo o DNA. Esta última foi transferida a um microtubo estéril de 1,5mL, onde se adicionava etanol absoluto responsável por desidratar e precipitar o DNA. Finalmente, foi realizada lavagem em etanol a 70%, o sedimento com DNA era seco e reidratado com 50μ Lde água Milli-Q autoclavada.
média, obtiveram-se amostras com quantificações superiores a 100ng/μ Le pureza entre 1,80 e 2,00, sendo ideais à reação em cadeia da polimerase.
4.4 Desenho de primers e reação em cadeia da polimerase
A fim de se amplificar especificamente as regiões contendo os polimorfismos gênicos rs2275913 e rs4819554, foram desenhados iniciadores (primers) na plataforma do NCBI (Primer designing tool em http://www.ncbi.nlm.nih.gov/tools/primer-blast/), o BLAST, que determina a probabilidade de uma sequência de nucleotídeos de se alinhar a outras regiões que não a desejada, também foi realizado nessa plataforma. O software OligoAnalyzer 6.0 foi utilizado para verificar as características físico-químicas, como temperatura de melting, energia livre de Gibbs, estabilidade da região 3’, conteúdo GC e a formação de estruturas secundárias entre primers. Assim, os primers desenhados delimitaram o comprimento dos amplicons para estudo dos polimorfismos rs2275913 e rs4819554, em respectivamente 514 e 430 pares de bases.
Para realizar a Reação em Cadeia da Polimerase (PCR), quando necessário, o DNA extraído foi diluído a uma concentração final de 100ng/μ L em água Milli-Q autoclavada. A seguir, foi conduzida a amplificação do material genético para um volume final de 25μ L/microtubo, contendo: 19,13μ L de água Milli-Q autoclavada, 2,5μ L do tampão da Taq polimerase 10x, 1μ L de DNA a 100ng/μ L,0,75μ L de MgCl2a 50mM, 0,5μ L domix de dNTP
a 10mM, 0,12μ L da Taq polimerase 5U/μ L e 0,5μ L a 20pmol dos primers foward 5' AGGTACATGACACCAGAAGACC-3' e reverse: 5'- TGCCCACGGTCCAGAAATAC-3' para o rs2275913 do IL17A, e 0,5μ L a 20pmol dos primers foward 5'-GGAAGAGAGGAGAGGCGAAT-3' e reverse: 5'- CACCCCTTTGCCTGGTTCTG-3' para o rs4819554 do IL17RA. Então, os microtubos foram colocados no termociclador (MyCycler™ Bio-rad, USA) e as condições utilizadas foram as mesmas para ambos SNPs: desnaturação inicial a 94°C por 5min, 35 ciclos compostos por desnaturação a 94°C por 30s, anelamento a 60°C por 30s e extensão a 72°C por 30s, por fim uma etapa de extensão final a 72°C por 7min.
4.5 Polimorfismo por comprimento dos fragmentos de restrição
A diferenciação entre os SNPs foi feita pela clivagem dos amplicons produzidos, utilizando RFLP (Polimorfismo por Comprimento dos Fragmentos de Restrição). Inicialmente, para cada amostra, foi preparada uma solução contendo enzima de restrição, tampão específico para enzima de restrição e água Milli-Q autoclavada. A cada solução foram adicionados os amplicons a serem genotipados, sendo então submetidas à digestão em banho-maria a 37ºC por 10 horas.
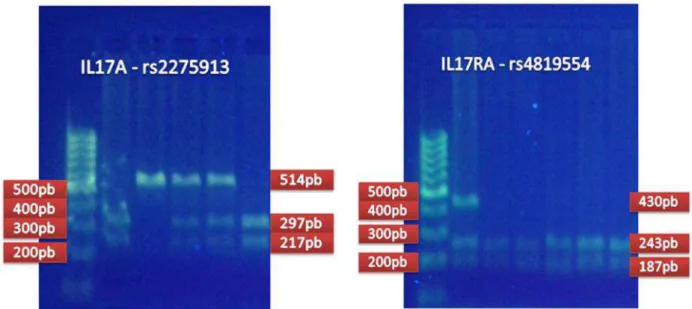
Para o rs2275913 utilizou-se a enzima XagI (Thermo Scientific, Waltham, MA, EUA), obtendo-se um fragmento com 514 pares de bases quando havia o genótipo AA, 514, 297 e 217 pares de bases para heterozigotos e fragmentos com 297 e 217 pares de bases caso o genótipo GG estivesse presente. Por sua vez, no gene IL17RA após amplificação da região contendo o rs4819554, foi utilizada a enzima de restrição PvuII (Thermo Scientific, Waltham, MA, EUA), obtendo-se fragmentos com 243 e 187 pares de bases em portadores do genótipo AA e 430 pares de bases nos portadores do genótipo GG, os heterozigotos apresentaram 3 fragmentos: 430, 243 e 187 pares de bases (figura 3).
Figura 3. Gel de eletroforese em agarose a 2% após PCR-RFLP para os polimorfismos estudados nos genes IL17A e IL17RA. O marcador de peso molecular possui escala de 100 pares de bases.
foi determinado por comparação direta com o marcador de peso molecular (escala 100pb) adicionado ao primeiro e ao último poço do gel de agarose.
4.6 Avaliação histopatológica e imunohistoquímica
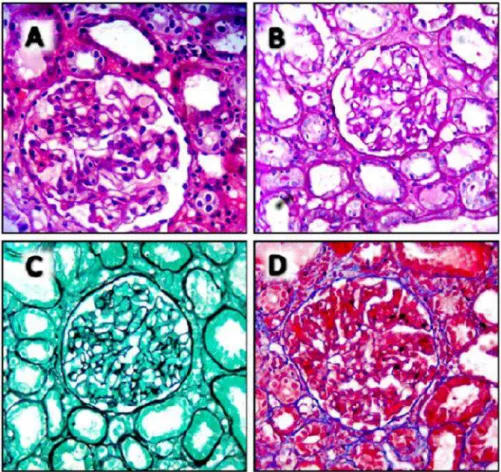
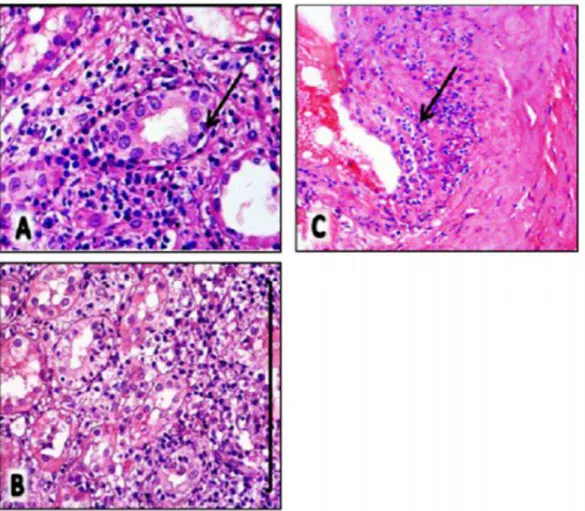
Rotineiramente, as amostras de enxerto renal obtidas dos pacientes transplantados com suspeita de rejeição são processadas e incluídas em blocos de parafina, sendo a análise histológica realizada em cortes de 4μ m de espessura, corado com hematoxilina/eosina, Tricrômico de Masson e prata metenamina pelo Patologista do Departamento de Patologia da UFRN integrado ao HUOL (Figura 4).
Figura 4. Análise histopatológica. A) hematoxilina-eosina; B) PAS; C) PAS metenamina prata; D) tricrômico de Masson. Aumento de 400x. (Imagens gentilmente cedidas pelo prof. Dr. Francisco Pignataro).
Previamente, as lâminas silanizadas contendo os cortes foram desparafinizadas em xilol absoluto, desidratadas em álcool absoluto e reidratadas em água destilada. A seguir, procedeu-se a recuperação antigênica por 30 min no calor úmido em um ambiente levemente ácido com citrato pH 6,0 (IL-17A e CCR6) e em um ambiente alcalino com Tris-EDTA pH 9,0 (CCL20). O bloqueio de enzimas endógenas foi realizado com peróxido de hidrogênio a 3% durante pelo menos 30 minutos. Posteriormente, as lâminas foram incubadas em leite desnatado (rico em caseína) a 1%, a fim de se obter bloqueio de ligações proteicas inespecíficas. O tensoativo tween 20 foi utilizado como agente permeabilizante. Em seguida, as lâminas foram incubadas, separadamente, com os anticorpos primários anti-IL17A policlonal humano de origem de cabra (R&D Systems, Minneapolis, MN, EUA), anti-CCR6 monoclonal humano de origem de camundongo (R&D Systems, Minneapolis, MN, EUA) e anti-CCL20 policlonal humano de origem de coelho (Abcam, Cambridge, MA, EUA) diluídos na proporção de 1:50, 1:200 e 1:200 (Anticorpo:BSA/Tween), respectivamente, a fim de se investigar a participação de células produtoras da IL-17 CCR6+/CCL20+no infiltrado celular intraenxerto. A detecção dos anticorpos primários foi realizada com o kit LSAB + System-HRP (Dako Cytromation, Carpinteria, CA, USA) e a revelação da reação com o substrato cromógeno 3,3 diaminobenzidina (Dako Cytromation, Carpinteria, CA, USA). A contracoloração foi realizada com Hematoxilina de Harris. No final, as lâminas foram montadas em bálsamo do canadá.
Amostras de tonsila humana normal foram utilizadas como controle positivo em cada reação realizada, por sua vez o controle negativo foi feito com amostras de rim as quais não se adicionava o anticorpo primário.
4.7 Quantificação da imunohistoquímica
vazios presentes na imagem. Por sua vez, a densidade reporta o somatório dos valores da intensidade de todos os pixels de um objeto contado. Por último, foi feita uma média dos valores obtidos de área e densidade das 10 fotos retiradas para cada caso.
4.8 Análise estatística
5 RESULTADOS
5.1 Características clínicas e demográficas dos indivíduos em estudo
Um total de 148 pacientes transplantados renais e 175 indivíduos controles saudáveis foram arrolados no estudo, características sumarizadas na tabela 1. Não houve diferenças na distribuição de gênero entre os grupos estudados, contudo foi notado que o grupo dos controles foi composto por uma população mais jovem do que o grupo dos transplantados.
Tabela 1. Caracterização da amostra.
Homens Mulheres Idade (anos)
(média ± DP)*
Idade mínima e máxima (anos) Transplantados 85 (57,4%) 63 (42,6%) 42,8 ± 13,5 18–71
Controles 93 (53,1%) 82 (46,9%) 31,0 ± 8,7 19–56
*
P valor < 0,05, diferença estatisticamente significativa. DP: desvio padrão.
Sobre os indivíduos transplantados foram levantados dados clínicos e demográficos relativos a todo o período pós-transplante (tabela 2). Entre os 148 indivíduos recrutados, 111/148 (74,3%) não apresentaram rejeição do órgão transplantado e o restante 37/148 (25,7%) exibiram rejeição aguda (21 ou 14,2%) ou nefropatia crônica do aloenxerto (17 ou 11,5%). Foi evidenciada diferença estatisticamente significativa na idade atual e na idade ao transplantar entre os grupos de indivíduos que apresentaram rejeição e os que não apresentaram rejeição (P = 0,003 e P = 0,000, respectivamente).
Por outro lado, variáveis como gênero, etnia, natureza do doador, tempo de isquemia fria, tipo de diálise, painel de anticorpos, compatibilidade HLA, doença que conduziu a perda do rim entre outras aparentemente não exerceram influência sobre o desfecho do rim transplantado (tabela 2).
5.2 Polimorfismos gênicos em IL17A e IL17RA: distribuição alélica e genotípica
Tabela 2. Características clínicas e demográficas dos indivíduos transplantados
Variável Grupo
sem rejeição n = 111
Grupo rejeição
n = 37
P valor
Gênero N(%) Homens Mulheres
Idade (anos) média ± DP Idade atual
Idade ao transplantar Etnia autodeclarada N(%)
Branca Negra
Tipo de Doador N(%) Cadavérico
Vivo
Doença renal de base N(%) Indeterminada
Hipertensão Síndrome nefrótica Glomerulonefrite crônica Nefropatia diabética Doença renal policística Outras
Uso de ganciclovir N(%) Sim
Não
Tipo de diálise N(%) Hemodiálise Outro
Tempo de diálise (anos) mediana ± IIQ* Tempo de isquemia fria (horas) mediana ± IIQ* Painel de reatividade a anticorpo I N(%)**
0% 1% a 50% 51% a 100%
Painel de reatividade a anticorpo II N(%)** 0%
1% a 50% 51% a 100%
Compatibilidade HLA-A N(%)** 0
1 2
Compatibilidade HLA-B N(%)** 0
1 2
Compatibilidade HLA-DR N(%)** 0
1 2
Parâmetros bioquímicos no pré-transplante Ureia (mg/dL) mediana ± IIQ*
Creatinina (mg/dL) média ± DP
CKD EPI (mL/min/1,73m2) mediana ± IIQ*
61 (55,0) 50 (45,0)
44,72 ± 13,57 41,12 ± 13,92
51 (45,9) 60 (54,1) 85 (76,6) 26 (23,4) 37 (33,4) 30 (27,0) 6 (5,4) 10 (9,0) 8 (7,2) 9 (8,1) 11 (9,9) 45 (40,5) 66 (59,5) 101 (91,0) 10 (9,0) 3,0 ± 3,0 14,0 ± 12,5
94 (84,7) 16 (14,4) 1 (0,9) 97 (87,4) 10 (9,0) 4 (3,6) 52 (46,8) 48 (43,2) 11 (10,0) 52 (46,8) 48 (43,2) 11 (10,0) 24 (21,6) 67 (60,4) 20 (18,0)
96,0 ± 58,0 8,05 ± 2,61 6,7 ± 2,89
24 (64,9) 13 (35,1)
37 ± 11,55 31,16 ± 13,02
15 (40,5) 22 (59,5) 26 (70,3) 11 (29,7) 11 (29,7) 11 (29,7) 4 (10,9) 2 (5,4) 2 (5,4) 1 (2,7) 6 (16,2) 21 (56,8) 16 (43,2) 30 (81,1) 7 (18,9) 3,0 ± 4,5 12,0 ± 16,8
34 (91,9) 1 (2,7) 2 (5,4) 33 (89,2) 4 (10,8) 0 (0,0) 17 (45,9) 17 (45,9) 3 (8,2) 21 (56,8) 14 (37,8) 2 (5,4) 8 (21,6) 25 (67,6) 4 (10,8)
107,0 ± 46,5 8,31 ± 3,04
7,2 ± 4,08
Tabela 3. Frequência da distribuição dos polimorfismos rs2275913 e rs4819554 nos indivíduos controles e transplantados com e sem rejeição.
Gene / SNP Transplantados renais
(%)
Controles saudáveis
(%)
P valor
RC (IC 95%)
Transplantados (%) P valor
RC (IC 95%) sem
rejeição
com rejeição IL17A rs2275913
Alelo G 210 (70,9) 265 (75,7) - 1,0 (Ref.) 156 (70,3) 54 (73,0) - 1,0 (Ref.)
Alelo A 86 (29,1) 85 (24,3) 0,18 0,78 (0,55-1,11) 66 (29,7) 20 (27,0) 0,77 0,88 (0,49-1,58)
Genótipo GG 75 (50,7) 101 (57,7) - 1.0 (Ref.) 55 (49,5) 20 (54,1) - 1,0 (Ref.)
Genótipo GA 60 (40,5) 63 (36,0) 0,34 0.78 (0,49-1,24) 46 (41,4) 14 (37,8) 0,69 0,84 (0,38-1,84) Genótipo AA 13 (8,8) 11 (6,3) 0,38 0.63 (0,27-1,48) 10 (9,1) 3 (8,1) 1,00 0,82 (0,21-3,31) GA + AA 73 (49,3) 74 (42,3) 0,22 1,33 (0,86-2,06) 56 (50,5) 17 (45,9) 0,71 1,19 (0,57-2,53)
IL17RA rs4819554
Alelo A 217 (73,3) 259 (74,0) - 1,0 (Ref.) 162 (73,0) 55 (74,3) - 1,0 (Ref.)
Alelo G 79 (26,7) 91 (26,0) 0,86 0,96 (0,68-1,37) 60 (27,0) 19 (25,7) 0,88 0,93 (0,51-1,69)
Genótipo AA 83 (56,1) 95 (54,3) - 1.0 (Ref.) 62 (55,9) 21 (56,8) - 1.0 (Ref.)
Genótipo AG 51 (34,5) 69 (39,4) 0,55 1,18 (0,74-1,88) 38 (34,2) 13 (35,1) 1,00 1,01 (0,45-2,25) Genótipo GG 14 (9,4) 11 (6,3) 0,40 0,69 (0,29-1,59) 11 (9,9) 3 (8,1) 1,00 0,81 (0,20-3,17) AG + GG 65 (43,9) 80 (45,7) 0,82 0,93 (0,59-1,44) 49 (44,1) 26 (43,2) 1,00 1,04 (0,49-2,19)
Para o polimorfismo rs2275913, o grupo controle exibiu 75,7% de indivíduos com o alelo G e 24,3% com o alelo A, sendo que para os genótipos 57,7% foram GG, 36% GA e 6,3% AA. Por sua vez, o grupo dos pacientes transplantados exibiu 70,9% dos indivíduos com o alelo G e 29,1% com o alelo A, as frequências genotípicas foram de 50,7% GG, 40,5% heterozigotos e os 8,8% restantes AA. Não houve diferença estatisticamente significativa na distribuição das frequências entre os grupos (transplante e controle) e subgrupos (com e sem rejeição) comparados. Os grupos também foram estratificados quando a gênero, etnia autodeclarada e natureza do doador, mas não exibiram quaisquer diferenças significativas (não exibido).
Em relação ao polimorfismo rs4819554 observamos no grupo controle 74% dos indivíduos com o alelo A e 26% com o G (AA = 54,3%, AG = 39,3% e GG = 6,3%). Nos pacientes transplantados também houve prevalência do alelo A, 73,3% contra apenas 26,7% portadores do alelo G (AA = 56.1%, AG = 34.5% e GG= 9.4%). Assim como para o polimorfismo na IL-17A, os grupos também foram estratificados quanto ao gênero, etnia autodeclarada e natureza do doador, sem, contudo haver diferença nas distribuições alélicas e genotípicas dos indivíduos (dados não exibidos).
Para os dois grupos foi realizado o teste quiquadrado de aderência (qualidade de ajuste) com a finalidade de verificar se as amostras encontravam-se em equilíbrio de Hardy-Weinberg. Conforme mostrado na tabela 4, observa-se que tanto nos grupos caso e controle, como nos diferentes polimorfismos as amostras obedeceram ao equilíbrio de Hardy-Weinberg.
Tabela 4. Equilíbrio de Hardy-Weinberg verificado pelo teste quiquadro qualidade de ajuste.
IL17A (rs2275913) IL17RA (rs4819554) test P valor test P valor
Grupo transplantado 0,041 0,839 2,110 0,146
Grupo controle 0,078 0,780 0,106 0,744
Os valores de P acima de 0,05 indicam que as amostram encontram-se em equilíbrio.
5.3 Polimorfismos gênicos em IL17A e IL17RA e parâmetros de função renal
presentes. Tendo em vista que tais valores não seguiram uma distribuição normal, foram então expressos como mediana e intervalo interquartílico nas tabelas 5 e 6.
Inicialmente para o polimorfismo da região promotora do IL17A não houve diferenças nos parâmetros bioquímicos da função renal entre os subgrupos comparados, exceto para o período pré-transplante, no qual os indivíduos do grupo sem rejeição portadores do alelo G apresentaram distribuição dos valores da TFG superior aos indivíduos sem rejeição portadores do alelo A (P = 0,022) (tabela 5). Utilizando o teste de Kruskal-Wallis verificou-se haver influência da distribuição genotípica do rs2275913 sobre o valor de creatinina 6 meses após o transplante nos indivíduos que apresentaram rejeição (GG = 1,26 ± 0,41; GA = 1,55 ± 0,40; AA = 1,26 ± 0,57, P = 0,034), bem como houve diferença significativa nos valores da TFG no pré-transplante do grupo sem rejeição (GG = 7,12 ± 2,97; GA = 6,74 ± 3,21; AA = 5,18 ± 2,10, P = 0,036).
Para o polimorfismo rs4819554 da região promotora do IL17RA não houve valores estatisticamente significativos nas comparações entre as distribuições alélicas (tabela 6) e os parâmetros de função renal em diferentes momentos após o transplante tanto no grupo sem rejeição como no grupo rejeição. O teste de Kruskal-Wallis também não forneceu evidências da influência genotípica sobre a função renal.
5.4 Avaliação histopatológica
Do grupo dos transplantados renais (148 pacientes), um “n” amostral de 35 indivíduos que realizaram o procedimento de biópsia por suspeita de rejeição foram selecionados para o estudo da IL-17A e do eixo quimiotático CCR6/CCL20 no microambiente do enxerto renal.
Tabela 5.
Parâmetros de função renal conforme polimorfismo rs2275913 (IL17A) em diferentes períodos após o transplante. Parâmetros
Bioquímicos
Grupo sem rejeição (mediana ± IIQ)
Grupo rejeição (mediana ± IIQ) Alelo G
n = 156
Alelo A n = 66
P valor Alelo G n = 54
Alelo A n = 20
P valor
Ureia mg/dL
Pré-Tx 96,0 ± 53,5 99,0 ± 57,5 0,132 107,0 ± 47,3 109,0 ± 77,8 0,318
3 meses pós-Tx 43,5 ± 21,8 46,5 ± 18,0 0,099 46,0 ± 29,0 58,0 ± 16,5 0,158 6 meses pós-Tx 44,0 ± 14,8 44,0 ± 13,8 0,259 44,5 ± 25,2 49,5 ± 21,8 0,082 1 ano pós-Tx 42,5 ± 15,0 44,0 ± 13,5 0,388 47,0 ± 28,2 47,5 ± 18,0 0,367
Creatinina mg/dL
Pré-Tx 7,90 ± 3,19 8,24 ± 2,30 0,241 7,86 ± 4,59 7,91 ± 4,18 0,661
3 meses pós-Tx 1,11 ± 0,60 1,20 ± 0,51 0,842 1,40 ± 0,58 1,52 ± 0,38 0,214 6 meses pós-Tx 1,10 ± 0,53 1,20 ± 0,55 0,956 1,33 ± 0,42 1,33 ± 0,40 0,509 1 ano pós-Tx 1,10 ± 0,50 1,10 ± 0,51 0,745 1,30 ± 0,50 1,40 ± 0,40 0,825
TFG CKD-EPI (mL/min/1,73m2)
Pré-Tx 6,88 ± 3,04 6,42 ± 2,90 0,022 7,47 ± 4,22 7,19 ± 3,10 0,495
3 meses pós-Tx 67,2 ± 34,7 64,9 ± 33,1 0,187 57,4 ± 18,5 49,8 ± 21,3 0,158 6 meses pós-Tx 66,9 ± 33,9 64,7 ± 32,7 0,259 64,2 ± 21,2 55,8 ± 15,8 0,289 1 ano pós-Tx 72,2 ± 34,0 68,7 ± 39,1 0,224 63,9 ± 26,7 59,1 ± 24,7 0,893
Tabela 6
Parâmetros de função renal conforme polimorfismo rs4819554 (IL17RA) em diferentes períodos após o transplante. Parâmetros
Bioquímicos
Grupo sem rejeição (mediana ± IIQ)
Grupo rejeição (mediana ± IIQ) Alelo A
n = 162
Alelo G n = 60
P valor Alelo A n = 55
Alelo G n = 19
P valor
Ureia mg/dL
Pré-Tx 97,5 ± 56,0 95,5 ± 66,8 0,840 108,0 ± 46,0 93,0 ± 48,0 0,428
3 meses pós-Tx 44,0 ± 19,5 46,0 ± 19,8 0,098 48,0 ± 29,0 55,0 ± 18,0 0,254 6 meses pós-Tx 44,0 ± 15,2 44,0 ± 15,9 0,575 46,0 ± 29,0 47,0 ± 15,0 0,766 1 ano pós-Tx 43,0 ± 13,0 43,5 ± 17,8 0,498 47,0 ± 29,0 47,0 ± 10,0 0,980
Creatinina mg/dL
Pré-Tx 7,92 ± 3,24 8,20 ± 2,43 0,985 7,98 ± 4,89 7,84 ± 2,08 0,360
3 meses pós-Tx 1,17 ± 0,70 1,20 ± 0,57 0,474 1,40 ± 0,50 1,50 ± 0,43 0,843 6 meses pós-Tx 1,10 ± 0,54 1,16 ± 0,44 0,629 1,30 ± 0,50 1,30 ± 0,43 0,709 1 ano pós-Tx 1,10 ± 0,51 1,10 ± 0,44 0,841 1,30 ± 0,50 1,50 ± 0,40 0,699
TFG CKD-EPI (mL/min/1,73m2)
Pré-Tx 6,85 ± 3,01 6,54 ± 2,72 0,496 6,99 ± 4,64 7,80 ± 2,23 0,334
3 meses pós-Tx 67,1 ± 36,8 65,8 ± 26,1 0,192 56,4 ± 19,7 56,4 ± 21,7 0,804 6 meses pós-Tx 66,6 ± 35,1 65,9 ± 27,4 0,545 58,2 ± 22,3 58,0 ± 15,9 0,443 1 ano pós-Tx 72,1 ± 39,1 70,8 ± 36,3 0,785 63,6 ± 22,3 63,6 ± 26,0 0,504 Valores em negrito indicam resultados estatisticamente significativos (P-valor < 0,05) após Teste U de Mann-Whitney.
Figura 5. Principais tipos de rejeição celular aguda conforme classificação de Banff 2007. (A e B) Rejeição celular aguda Banff IA. A) seta: infiltrado mononuclear no epitélio tubular, t2. B) chave: infiltrado inflamatório intersticial de células mononucleares no parênquima renal, i2. C) Rejeição aguda vascular Banff IIB, seta: arterite intimal grave com perda de 25% da áreal luminal, v2. *Imagens gentilmente cedidas pelo prof. Dr. Francisco Pignataro.
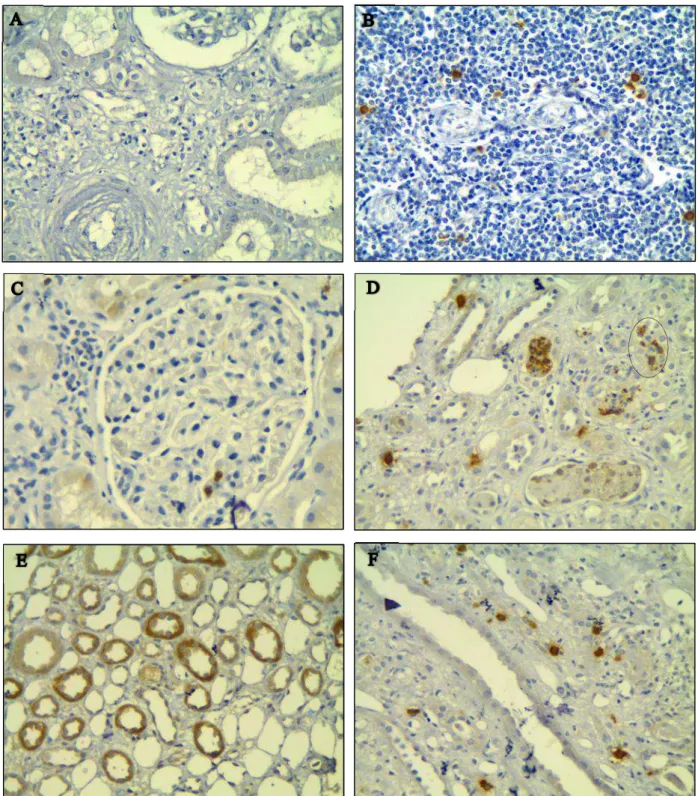
5.5 Imunohistoquímica para interleucina-17A
Após a marcação por imunohistoquímica para IL-17A no microambiente do enxerto renal foram fotografados 10 campos representativos de cada caso (lâmina) com o intuito de quantificar a presença dessa citocina.
Para determinar a influência da IL-17 sobre o desfecho do rim transplantado, as lâminas marcadas por imunohistoquímica foram avaliadas de forma quantitativa por meio do programa Image-Pro Plus o qual fornecia informações a respeito da área marcada e da intensidade/densidade da marcação. A coloração padrão que indicava a presença da interleucina foi obtida a partir do observado no controle positivo (figura 7).
Figura 7. Quantificação da imunohistoquímica para IL-17A. Em (A) controle positivo de tonsila humana com as áreas marcadas e em (B) as regiões consideradas como positivas pelo programa (amarelo). Em (C) marcação no caso 191355 e em (D) as áreas reconhecidas como positivas pelo programa (conforme marcação obtida no controle positivo).
Tabela 7
Área, densidade e número de células marcadas para IL-17 conforme desfecho do transplante.
Ausência de rejeição Rejeição P valor
média ± DP* média ± DP*
Área marcada 1021,0 ± 1988,2 704,4 ± 940,6 0,897
Densidade da marcação 95293,5 ± 174549,6 65541,4 ± 87575,1 0,926
Células marcadas 3,96 ± 7,4 7,56 ± 11,30 0,590
A distribuição dos dados foi não paramétrica e, portanto utilizou-se o teste U de Mann-Whitney. Os valores foram expressos como média e DP (desvio padrão) apenas para melhor entendimento.
Ainda, tendo em vista que estudos anteriores demonstraram a influência do polimorfismo rs2275913 sobre os níveis sistêmicos da IL-17A. Avaliamos se há tal interferência sobre a marcação da IL-17A no microambiente do enxerto renal. Inicialmente foi comparado os parâmetros de marcação quantitativos frente aos alelos G e A do SNP estudado. Como visto na figura 8, as distribuições dos valores quantitativos da área e da densidade foram semelhantes para os dois alelos.
Figura 8. Gráficos de box-plot da quantificação imunohistoquímica para IL-17A frente aos alelos do rs2275913. Em (A) é exibido a área de IL-17A marcada (eixo y) e em (B) densidade da marcação (eixo y) frente aos alelos do polimorfismo (eixo x). Os asteriscos e círculos representam outliers. O valor de P representa o nível de significância da associação entre as variáveis obtida por teste U de Mann-Whitney.
Usando o teste não paramétrico de Kruskal-Wallis, os genótipos também foram verificados frente aos parâmetros quantitativos. Não houve diferença estatisticamente significativa entre os grupos comparados, para a área marcada tivemos um P valor = 0,308, para a densidade obteve-se um P valor = 0,295 e um P valor igual a 0,263 quando se testou os genótipos frente ao número de células marcadas.
P = 0,848
Por último, uma vez que o neutrófilo é o principal tipo celular encontrado no infiltrado celular inflamatório promovido por IL-17A, correlacionou-se o número de polimorfonucleares presentes no tecido renal dos indivíduos que apresentaram marcação para a IL-17A, com os parâmetros quantitativos (área e densidade) da marcação. Os resultados mostrados na figura 9 demonstram não haver correlação estatisticamente significativa entre o número de polimorfonucleares e o nível de marcação da IL-17A no microambiente do enxerto renal.
Figura 9. Gráficos de dispersão de pontos entre parâmetros quantitativos da IL-17A e polimorfonucleares. Em (A) é exibido a área de IL-17A marcada (eixo y) e em (B) densidade da marcação (eixo y) frente a quantidade de polimorfonucleares presentes (eixo x). Cada círculo representa um caso. O valor de ρ (rho) é referente a correlação de spearman entre as variáveis. E o valor de P representa o nível de significância da associação. A linha de ajuste indica a curva da equação do gráfico.
A quantidade de polimorfonucleares no microambiente do enxerto renal também não apresentou quaisquer relação com as distribuições alélica e genotípica ou até mesmo com o status do transplante (dados não exibidos).
5.6 Imunohistoquímica para o eixo quimiotático CCR6/CCL20
Após a marcação por imunohistoquímica para o eixo quimiotático CCR6/CCL20 no microambiente do enxerto renal foram fotografados 10 campos representativos de cada caso (lâmina) com o intuito de quantificar a presença dessas quimiocinas.
Na figura 10 é possível notar que as principais fontes produtoras do CCL20 foram principalmente as células epiteliais tubulares e mais raramente células intersticiais. A expressão do receptor CCR6 também ficou mais restrita a células epiteliais tubulares. Na figura também são exibidos os controles positivo (tonsila humana) e negativo (ausência do
P = 0,899
ρ= 0,038
A B P = 0,495
anticorpo primário). Assim como para IL-17A, devido ao uso do cromógeno 3,3-diaminobenzidina, os locais em que há presença das quimiocinas exibem uma coloração marrom-acastanhado, enquanto que nas regiões negativas a contra-coloração com hematoxilina de Harris (azul) é preservada.
Para determinar a influência do eixo quimiotático CCR6/CCL20 sobre o desfecho do rim transplantado, as lâminas marcadas por imunohistoquímica foram avaliadas de forma quantitativa por meio do programa Image-Pro Plus o qual fornecia informações a respeito da área marcada e da intensidade/densidade da marcação. A coloração padrão que indicava a presença das quimiocinas foi obtida a partir do observado no controle positivo (figura 11).
Figura 11. Quantificação da imunohistoquímica para CCR6. Em (A) controle positivo de tonsila humana com as áreas marcadas e em (B) as regiões consideradas como positivas pelo programa. Em (C) marcação de CCR6 no caso 184734 e em (D) as áreas reconhecidas como positivas pelo programa (conforme marcação obtida no controle positivo). Para o ligante CCL20 foi realizado o mesmo procedimento (não exibido).