Genidens genidens
(Valenciennes) e
Cathorops spixii
(Agassiz) (Siluriformes, Ariidae),
na Baía de Sepetiba, Rio de Janeiro, Brasil
Iracema David Gomes 1 Francisco Gerson Araújo 1 Marcia Cristina Costa de Azevêdo 1 André Luiz Machado Pessanha 1
ABSTRACT. Reproductive biology of the marine catfish Genidens genidens
Valenciennes and Cal"orops spixii Agassiz (Siluriformes, Ariidae) in the Sepetiba
Bay, Rio de Ja neiro, Brazil. The reproductive cycle ofthe marine catfishes Genidens genidens Valenciennes, 1833 and Calhorops spixii Agassiz, 1839 in the Sepetiba Bay,
was assessed by an annual period of sampling from October 1993 to September 1994. The fishes were caught by standardized otter trawl and environmental parameters of tel11perature, salinity and transparency ofwater were recorded at each sampling. Five gonadal phases were described, based in macroscopic observations. Changes in the gonadosomatic index (GS1) and in the percentual of stages of gonadal development showed that G. genidens spawns in Summer/early Autul11n, coinciding with low
salinity and high temperature and transparency. Calhorops spixii spawns in late
Spring/early Summer, coinciding with rising temperature and transparency and low salinity. Total spawning are shown for both species, as indicated by length-trequency of oocytes per stages of l11aturation with two groups synchronic development of oocytes. Fecundity is low (10-23 oocytes, for G. genidens and 24-30 for C. spixii),
when compared with other teleosteans, and was not strongly correlated to the total length (G. genidens, r=0.65, C. spixii, r=0.76). Strategy-k is developed by both species as indicated by high brood and enbrions protection and high body length.
KEY WORDS. Siluriformes, Ariidae, reproduction, Marine Cattish, Sepetiba Bay
Os bagres marinhos pertencentes à família Ariidae ocorrem em zonas litorâneas sendo geralmente mais abundantes em águas costeiras pouco profundas, em fundo lodoso ou arenoso (.ARAúJO 1988; ANDREATA et aI. 1989). São conside-rados como recursos de grande importância econômica na pesca artesanal, princi-palmente na região sul (REIS I 986a). Na época da desova, procuram a desemboca-dura dos rios e regiões lagunares realizando incubação oral com machos e raramente as fêmeas, carregando ovos e formas iniciais da prole até completarem o desenvol-vimento embrionário (Y ANEZ-ARANCIBIA & SANCHEZ-GIL 1988; REIS 1986b).
A biologia reprodutiva deste grupo de peixes é pouco estudada na costa do Brasil e isto faz com que especial interesse seja direcionado para as espécies
Genidens genidens e Cathorops spixii devido sua grande distribu ição em estuários
e lagoas costeiras do sudeste do Brasil (MISHIMA & TANJI 1981); dos poucos
trabalhos sobre o assunto citam-se os de MISHIMA
&
TANJI (1983) e REIS (1986b)para o estuário da Lagoa dos Patos, Rio Grande do Sul; BARBIERI et aI. (1992) para
a Lagoa de Jacarepaguá, Rio de Janeiro e CHAVES (1994) para Baía de Guaratuba, Paraná.
MISHlMA & TANJl (1983) descreveram a biologia reprodutiva de algumas
espécies de bagres na região estuarino-Iagunar no sudeste do Brasil, mas em suas
amostras a quantidade de G. genidens foi pequena, impossibilitando estudos mais
detalhados sobre o período da desova e a fecundidade. BARBIERl et aI. (1992)
determinaram o comprimento de primeira maturação sexual de G. genidens e a
fecundidade; CHAVES (1994) descreveu aspectos da dinâmica de incubação de ovos
e larvas de G. genidens; REIS (1986b) estudou a reprodução de Netuma barba
Lacépede, 1803. O objetivo deste estudo, é descrever aspectos da biologia
reprodu-tiva de G. genidens e
C.
spixii na Baía de Sepetiba, com ênfase na determinação daépoca e tipo de desova, desenvolvimento ovocitário e fecundidade.
MATERIAL E MÉTODOS
A Baía de Sepetiba localiza-se no Estado do Rio de Janeiro entre as latitudes
22°54' e 23°04'S e as longitudes 43°34'e 44°10'W (DHN 1984). Apresenta forma
alongada, limitando-se ao Norte e a Leste pelo continente, ao Sul pela Restinga de Marambaia e a Oeste pela Baía de Ilha Grande. Considerada como um dos mais importantes ecossistemas marinhos do Estado do Rio de Janeiro, perfaz uma área
de aproximadamente 305 Km2. Seu maior comprimento é de 43 km no sentido
leste-oeste e sua maior largura é de 17 km no sentido norte-sul, sendo seu perímetro de aproximadamente 123 km. A bacia hidrográfica apresenta área aproximada de
1800 Km2 (COELHO & CARVALHO 1973). O substrato da Baía é principalmente
lodoso, com formações de silte, argila, e com poucas áreas de areia e cascalho na zona externa.
Os espécimes de G. genidens e
C.
spixii foram coletados e identificados(FIGUEIREDO & MENEZES 1978) em amostragens bimestrais de arrastos de fundo
entre outubro de 1993 a setembro, de 1994. Os arrastos de fundo, de duração padronizada de meia hora, foram realizados por embarcação do tipo arrasteiro de 12 f i de comprimento, que realiza pesca comercial na Baía. Em cada amostragem
foram medidos os parâmetros ambientais de transparência, salinidade e temperatura, além de ter sido feita a biometria, com a posterior conservação de espécimens em formol a 10%.
Os peixes foram pesados (em gramas), medidos (em milímetros) e dissecados em laboratório; das gônadas analisadas foram observados a coloração, o peso (g) e o comprimento (mm). A identificação dos estádios de maturação gonadal, feita através do uso microscópio estereoscópio, foi adaptada através de cinco fases
baseadas na escala proposta de V AZZOLER (1982): imaturo, em maturação inicial,
em maturação final, maduro e desovado (fêmeas) /esvaziado (machos).
O padrão de desenvolvimento ovariano foi determinado através da distribu-ição do diâmetro dos ovócitos por diferentes estádios de maturação. Foram separa-dos 10 ovários pôr fase de maturação, e de cada ovário foram medisepara-dos cerca de 30 ovócitos aleatoriamente selecionados, com as medições sendo realizadas através da
objetiva com escala micrométrica, com precisão O, i mm . Os ovócitos vitelogênicos foram medidos com paquímetro com precisão de I milímetro.
O Índice Gônado Somático (IGS) foi calculado através do percentual do peso das gônadas em relação ao peso total do peixe para cada sexo separadamente de
todos os indivíduos coletados pela seguinte equação: IGS = Wg / Wt .100 .
Os ovócitos, para melhor dissociação, foram conservados em solução de Gilson, o que facilitou na determinação da fecundidade a qual foi determinada através da contagem do número de ovócitos vitelogênicos em fêmeas maduras. Foi determinada a relação entre a fecundidade e o comprimento total utilizando o método dos mínimos quadrados.
RESULTADOS
Estrutura da população
Genidens genidens
A estrutura de tamanho da população compreerideu indivíduos com compri-mento total (CT) entre 115 e 415 mm, com fêmeas predominando nos grupos de menor tamanho (CT< 175 mm) e machos, em sua maioria, em grupos de maior tamanho (CT>200 mm).
Cathorops spixii
Foram amostrados peixes apresentando comprimento total (CT) entre 91 e 325 mm, com fêmeas predominando nos grupos de tamanho de 180 a 210 mm CT, e os machos, nos grupos de tamanho 180 a 190 mm CT.
Estádios de maturação sexual
Foi examinado para G. genidens um total de 208 indivíduos, sendo 95
fêmeas, 44 machos, e 69 indivíduos jovens dos quais não foi possível fazer a
sexagem; para
C.
spixii foram examinados 100 indivíduos sendo 58 fêmeas, 25machos e 17 jovens cujo sexo não foi identificado.
O desenvolvimento gonadal foi descrito de acordo com caracteres macros-cópicos das gônadas tendo sido considerado o peso, comprimento, forma, coloração e ocupação relativa da cavidade abdominal (Tabs I, II). Para as fêmeas das duas espécies foram estabelecidos cinco estádios de desenvolvimento com suas variações também tomando por base a morfologia das gônadas e o diâmetro dos ovócitos.
Desenvolvimento dos ovócitos e tipo de desova
Genidens genidens
O diâmetro dos ovócitos variou de <O, i mm a 20 mm . O estádio maduro
apresentou dois grupos de tamanho: o primeiro grupo de ovócitos não
desenvolvi-dos, cujo diâmetro variou entre 3,5 mm e II mm e o segundo grupo de ovócitos
Tabela I. Características dos estádios macroscópicos dos ovários de fêmeas de G. genidens
e C. spixii.
Estádios de maturação Caracterlsticas
Imaturo Ovários translúcidas, menor que 0,03g; de coloração esbranquiçada. Ovócitos muito pequenos, em desenvolvimento. de forma assimétrica observados com o auxilio do microscópio estereoscópio em amplificação mlnima de 40x. Filiformes e alongados em G. genidens e alongados com tendência à fomna lobulada em C. spixii.
Maturação Inicial Apresentam ovócitos já vislveis a olho nu, muito pequenos e aderidos á parede ovariana e coloração cremosa. Genidens genidens exibiu ovários com pequeno alargamento e peso de aproximadamente 0,03g, enquanto C. spixii apresentou forma semelhante á fase anterior e peso entre 0,03g e 0,2g .
Maturação Final Apresentam um maior alargamento que na fase anterior com coloraçao amarelada. Tendéncia à fomna lobulada com variação de peso de 0,04g a 19 para G. genidens e forma lobulada para C. spixii com variação no peso de 0,2g a 1,6g.
Maduro Lobulares, volumosos, ocupando cerca de 1/3 da cavidade abdominal. Ov6citos de cor alaranjada, heterogéneos de tamanhos pequeno e médio. Parede ovariana fina . O peso máximo encontrado para G. genidens foi de 40,8g , enquanto para C. spixii foi de 6,62g.
Desovado Flácidos, menores que os da fase anterior e apresentam ov6citos heterogêneos pOdendo ser residuais e em degeneração. A variação do peso encontrado para G. genidens foi de 0,3 a 2,1g e para C. spixii foi de 0,1 a 1,7 g.
Tabela II. Características dos estádios macroscópicos dos testículos de machos de G.geni-dens e C. spixii.
Estádios de maturação Caracteristicas
Imaturo Filifomnes, pequenos, de coloração branca, com comprimento menor que 2,0 cm e peso <0,01g . Maturação inicial Apresentam·se mais largos que os da fase anterior, comprimento em torno de 4,5 cm para G.
genidens e 3 cm para C. spixii; o peso encontrado não ultrapassou de 0,04g em ambas espécies. Maturação final Diferenciam-se dos testículos da fase anterior principalmente pelo peso (>0,05g).
Maduro Largos, compridos, de coloração branca opaca, ocupam aproximadamente 2/3 da cavidade corporal
e apenas G. genidens apresentam margem levemente sinuosa. O maior peso encontrado fo i de
0,25g para G. genidens e 0,6g para C. spixii.
Esvaziado Coloração branca e quando manipulados se apresentam flácidos e com peso não ultrapassando de 0,01g.
Cathorops spixíi
O diâmetro dos ovócitos variou de <0,1 mm a 12 mm, e foi observado em todas as fases o diâmetro <0, 1 mm. O estádio maduro apresentou dois grupos de tamanho: o primeiro grupo de ovócitos não desenvolvidos, cujo diâmetro variou entre <0, 1 mm a 4 mm e o segundo grupo de ovócitos vitelogênicos com diâmetro variando de 6 mm a 12 mm. Os ovócitos de maior diâmetro, assim como em G.
genidens, não reapareceram no estádio desovado (Fig. 2), índice gônado somático e períOdO de reprodução
Genidens genidens
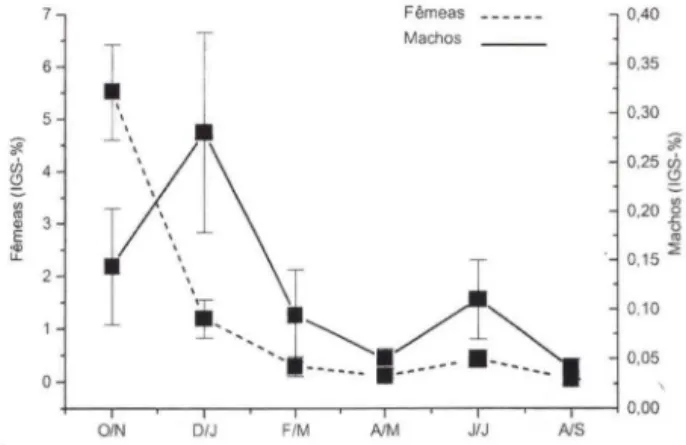
Os valores médios do IGS dos machos, apresentaram aumento considerável em fevereiro/março e atingiram o pico em abril/maio, enquanto para fêmeas, atingiram pico em dezembro/janeiro (Fig. 3). Os menores valores de machos e fêmeas ocorreram entre junho e setembro. Este padrão temporal sugere que as fêmeas a partir de dezembro se encontram prontas para a reprodução, com a maioria dos machos maduros só ocorrendo nos meses subsequentes, principalmente entre fevereiro e maio.
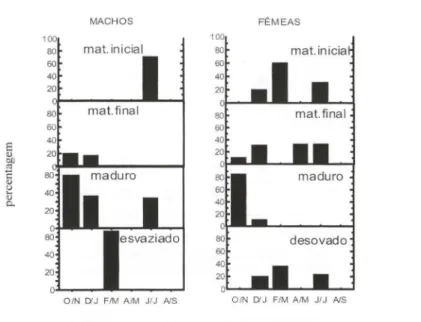
Na fase madura, a maior freqüência de machos ocorreu em fevereiro/março e de fêmeas em dezembro/janeiro, coincidindo com as informações de lGS e sugere
ser uma reprodução durante o verão e iniCIO do outono (Fig. 4). O período
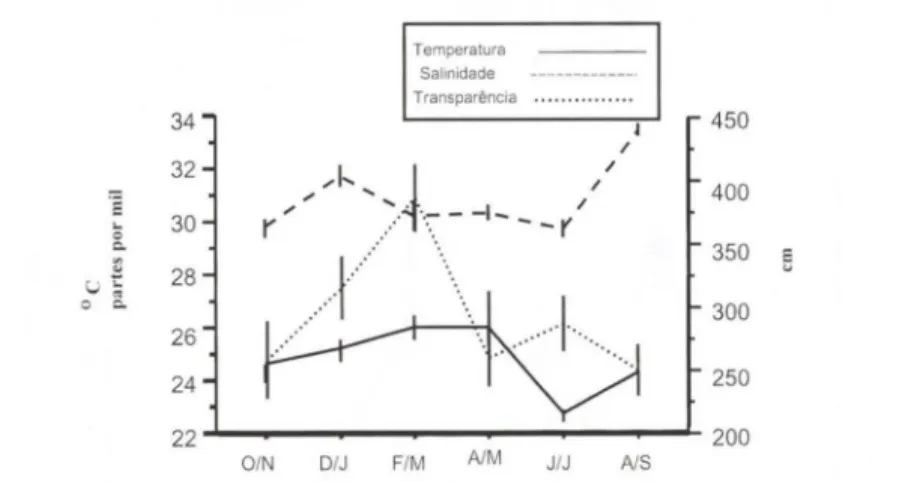
reprodutivo coincidiu com elevadas temperatura e transparência e baixas salinidade da água (Fig. 5).
60 imaturo
NF=10 60 imaturo
40 NO: 30 40 NF=10
20 NO = 300
20
O
60 mal. inicial 60
40 NF:l0 mat. inicial
40 NF=10
NO: 300
20 20 NO : 300
O O
60 mal. final
1ft 60 mat.final
E 40
NF=10 E 40 NF=10
&
2l 20 NO: 300 [Il, 20 NO : 300
c セ@
Q) O
u Q)
iii 60 mad uro セ@ 60 maduro
a. 40 NF= 13 NO: 390 a. 40 NF=11
NO: 330
20 20
60 desovado 60 desovado
N F : 10 NF= 10
40 NO : 300 40 NO = 300
20 20
5.0 10.0 15,0 20,0 5.0 10,0 15.0 20 ,0
1
diâmetro doovócito (mm)2
diâmetro do ovócito (mm)Figs 1-2, Distribuição de freqüências de diâmetro de ovócitos por estádios de maturação de fêmeas, entre outubro-93 e setembro-94, na Baía de Sepetiba, Rio de Janeiro , (1) G, genidens; (2) C, spixii, (NO) Número de ovócitos, (NF) número de fêmeas,
3,0
2,5
2,0 I \
セ@ I \
I
eh I
S2 I
I
1,5 I
<J)
'"
IQl I
E I
'Ql I
li.. 1,0 I
I I
0,5
ゥセ@
0,0
O/N D/J
\ \ \ \ \ \
.----\ \ \
.---FIM AlM
Fêmeas Machos
J/J
セ@
•
AIS
0,16
0,14
Õ
0,12 ;;;:
(fJ
S2
<J)
0,10 セ@
'"
:2 0,080,06
0,04
MACHOS FEMEAS
50 mal i1icial 40 mal ricia l
40
30 30
20 20
10 10
20 E 15 Q)
mat lnal 80
40
Ol 10
2 20
c Q)
セ@
2i
100mac1Jro 30
80
80 20
40
10 20
20 esvaziado 40 00 SO'Jad o
15 30
10 20
10
Cl'N D/J FoM AMo JJ AIS Cl'N D/J FoM AMo JJ fo/S
Fig . 4. Variação bimestral de freqüências de estádios de maturação em machos e fêmeas de G. genidens, entre outubro-93 e setembro-94, na Baía de Sepetiba , Rio de Janeiro.
34
32 Ê
セ@
o 30
c.
" 28 u t:
"
o
"-26
24
22
Temperatura Salinidade
Transparência
... 1....
4
//
"
... /... .' '.- -
-I-r
... ....
--r
... ·l·.... '.
I
/
450
400
350
300
250
セMMMMMMセMMMMMMMMMMMMMMセセ RPP@ O/N D/J FIM NM J/J NS
Fig . 5. Variação bimestral de temperatura , salinidade e transparência da água, entre outubro-93 e setembro-94, na Baía de Sepetiba, Rio de Janeiro.
Cathorops spixii
Os valores médios de I GS de machos, apresentaram aumento em outubro/no-vembro com pico em dezembro/janeiro e as fêmeas apresentaram pico em outu-bro/novembro. Os menores valores de machos e fêmeas ocorreram entre fevereiro e setembro (Fig. 6).
íi
eh 4
g
セ@
セ@ 3
E
Lセ@
"-I
L.
X\
Fêmeas
Machos
! '""",
' •... 1---· •. _-..
I"
A
セ@
O/N DIJ FIM MM JIJ MS
0,40
0,35
0.30
íi
0 ,25 eh
g
0,20 セ@
'"
0,15 ::;
0,10
0,05
Fig . 6. Variação bimestral do Indice Gonado Somático (IGS) em machos e fêmeas de C. spixii, entre outubro·93 e setembro-94. na Baía de Sepetiba, Rio de Janeiro .
Nos meses de outubro/novembro, machos e fêmeas em estádio maduro foram mais freqüentes, enquanto machos no estádio esvaziado e fêmeas no estádio desovado ocorreram em fevereiro/março (Fig. 7). Esses resultados, principalmente de fêmeas coincidem com os valores de IGS sugerindo uma reprodução entre a
primavera e início do verão, portanto, um pouco anterior a de G. genidens. No
período reprodutivo, os valores de temperatura e transparência encontram-se em elevação e a salinidade é baixa (Fig. 5).
Fecundidade
A fecundidade foi avaliada através da contagem do número de ovócitos
vitelogênicos em 13 fêmeas examinadas de G. genidens com número mínimo de
ovócitos por fêmeas de 10 e o número máximo foi de 24, com média de 14,8. Em
11 fêmeas de C. Jpixii, o número de ovócitos por fêmea madura observado foi
superior ao de G. genidens: mínimo 17, máximo 42, média de 25 .
A relação entre a fecundidade e o comprimento total foi considerada a partir
da expressão: y
=
a+
bx, tendo-se obtido as seguintes equações (Fig. 8) :Fecundidade
= -
2,76+
0,077. CT e r=
0,65 - G. genidensFecundidade = - 50, I
+
0,38 . CT e r = 0,76 - C. spixiiCathorops spixii apresentou maior correlação linear (r) entre a fecundidade
e o comprimento total, quando comparada com G. genidens embora para ambos as
espécies não tenha sido detectada correlação altamente significativa. Os maiores
coeficientes de regressão para C. spixii indicam que fêmeas de maior tamanho
apresentam maior número de ovócitos, quando comparados com G. genidens, cujo '
aumento de tam anho não parecer ser tão associado ao aumento da fecundidade.
DISCUSSÃO
Genidens genidens e C. spixii apresentam desova total com desenvolvimento
ovocitário sincrônico em dois grupos para as duas espécies. Este desenvolvimento é definido por evidenciar dois lotes de ovócitos dentro dos ovários (especialmente os maduros): I) o dos ovócitos de estoque de reserva e 2) o dos ovócitos
f セmeas@
E
.,
00 .'9
ii
80 maduroセ@ 60
.,
40
o..
20 O
80 desovado
60
40 20
O/N D'J FIM A/M J/J NS O/N D'J FIM A/M J/ J NS
Fig. 7. Variação bimestral de freqüências estádios de maturação em machos e fêmeas de C. spixii, entre outubro-93 e setembro-94, na Baía de Sepetiba, Rio de Janeiro .
•
"
セ@ Cspixii
g
•
ê) 30
•••
ó
iS
w
•
'" ro
•
'"
••
-g 20
•
セ@
u.
•
10160 180 200 220 240 260 280 300 comprimento total (mm)
Fig. 8. Diagrama de dispersão entre a fecundidade e o comprimento total de G. Genidens e C. spixii, entre outubro-93 e setembro-94, na Baía de Sepetiba, Rio de Janeiro.
Este padrão foi denominado por MARZA in Y AMAMOTO (1970) como
"synchronis-me par groupes", caracterizado por apresentar ovários com nítida diferença entre normais e atrofiados. Este tipo de distribuição dos ovócitos enquadra-se também na
classificação de V AZZOLER (1996) como desenvolvimento sincrônico em dois
grupos, e indica liberação de um único lote de ovócitos maduros durante a
reprodu-ção. MISHlMA & TANn (1983) encontraram este mesmo tipo de desova em bagres
com as espécies apresentando uma única liberação anual de ovócitos em um curto espaço de tempo. Diferenças no padrão de tamanho dos ovócitos foram observados
nas duas espécies; MrSHIMA & TANJI (1983) estabeleceram para G. genidens o
diâmetro médio de ovócitos vitelogênicos de 14,9 mm (máximo de 15,5 mm
mínimo de 14,3 mm); sendo, portanto inferior ao encontrado neste trabalho para a
Baía de Sepetiba. Os mesmos autores encontraram para C. spixii diâmetro médio
de 9, I mm (mín.=8 mm - máx.=1 O mm), coincidindo com os de C. spixii neste
estudo. BARBIERI et aI. (1992) distinguiram em G. genidens três grupos de tamanho
de ovócitos, sendo o primeiro grupo composto por ovócitos não desenvolvidos (1-3 mm); um segundo grupo intermediário (4-7 mm) e o terceiro por ovócitos
vitelogê-nicos (8-13 mm). REIS (1986b) trabalhando Netl/ma barba (outra espécie de
Ariidae) de maior tamanho, também observou três grupos, sendo o primeiro não considerado; o segundo entre 2-4 mm e o terceiro entre 12,3-19,5 mm.
Machos de G. genidens e C. spixii atingiram pico nos valores de lOS no
período posterior ao das fêmeas. Isto pode estar associado a um período de jejum dos machos que encontram-se realizando incubação oral após a desova. O período
reprodutivo de C. spixii coincidiu com o encontrado por MISHlMA
&
TANTI (J 983),enquanto para G. genidens, foi o mesmo de BARBIERI et aI. (1992) para mesma
espécie. Esta separação temporal, com C. 5pixii desovando um pouco antes de G.
genidens, pode ser uma estratégia reprodutiva das duas espécies para evitar compe-tição.
Os valores elevados de lGS em fêmeas de G. genidens e C. spixii coincidem
com aumentos da temperatura, transparência e com baixa salinidade; BARBIERI et
aI. (1992) encontraram maiores IGS de G. genidens em elevadas temperaturas,
porém em baixas salinidades. As elevações de temperaturas, associadas às baixas salinidades de entradas de estuários constituem locais prediletos de reprodução destas espécies (REIS 1986b; ARAÚJO 1988; CHAVES 1994; ARAÚJO 1998).
De acordo com V AZZOLER (1996), o tamanho dos ovócitos está relacionado
ao comportamento reprodutivo e espécies de ovócitos grandes como os bagres marinhos, são migradoras, de fecundação externa com cuidado à prole. A baixa fecundidade observada, comum em bagres marinhos, está associada ao grande tamanho dos ovócitos vitelogênicos. Isto indica um grande esforço reprodutivo das fêmeas caracterizando uma tendência à estratégia-K onde maior parte da energia é direcionada para o processo de desova associado a cuidados parentais bem desen-volvidos. Não foram observados bagres realizando incubação oral, embora tenham sido encontradas evidências do período reprodutivo, com indivíduos apresentando a região da mandíbula bastante dilatada e o corpo afilado (magro). Machos de bagres marinhos foram encontrados realizando incubação oral com ovos e juvenis com o saco vitelínico em absorção por vários autores (GUNTER 1947; ARAÚJO 1988; REIS
1986b; BARBIERI et aI. 1992). Portanto, estes peixes são classificados conforme
V AZZOLER (1996) como "carregadores externos" por carregarem embriões e/ou
jovens na boca, transferindo-os de um local para outro. Considera-se, portanto, a Baía de Sepetiba como área favorável ao processo reprodutivo, por apresentarem condições ambientais propícias à fecundação e desenvolvimento da prole.
REFERÊNCIAS BIBLIOGRÁFICAS
ANDREATA, J.V.; L.R. BARBIERI; A.S.B. SEBILIA; M.H.C. DA SILVA & R.P. DOS
ARAÚJO, F.G. 1988. Distribuição, abundância relativa e movimentos sazonais de bagres marinhos (Siluriformes, Ariidae) no estuário da Lagoa dos Patos (RS),
Brasil. Revta bras. Zoo I. 5 (4): 509-543.
- - - o 1998. Maturação e desova do bagre marinho Genidens genidens
Valenciennes, 1833 (Siluriformes, Ariidae) na Baía de Sepetiba, RJ. Acta Biol. Leopoldensia 20 (1): 109-122.
BARBlERI,L.R.; R.PJ. DOS SANTOS&J.V. ANDREATA. 1992. Reproductive biology
of the marine catfish, Genidens genidens (Siluriformes, Ariidae), in the
Jacarepaguá lagoon system, Rio de Janeiro, Brazil. Environ. Biol. Fishes 35: 23-35.
CHAVES, P.T.c. 1994. A incubação de ovos e larvas em Genidens genidens
(Valenciennes) (Siluriformes, Ariidae) da Baía de Guaratuba, Paraná, Brasil. Revta bras. Zool. 11 (4): 641-648.
COELHO, V.M.B. & R.R. CARVALHO. 1973. Levantamento sanitário da Baía de Sepetiba e suas possibilidades como corpo receptor de cargas poluidoras da
região. Publ. A vuls. FEEMA, 87p.
DHN. 1984. Baía de Sepetiba. Carta náutica. Rio de Janeiro, Diretoria de Hidrografia e Navegação, N. 1621.
FIGUEIREDO, 1.1. & N .A. MENEZES. 1978. Manual de peixes marinhos do sudeste
do Brasil. II. Teleostei (1). São Paulo, Museu de Zoologia da Universidade de
São Paulo, 11Op.
GUNTER, G. 1947. Observations on breeding ofthe marine catfish, Galeichlhysfelis
(Linneaus). Copeia 1947: 217-223.
MISHIMA, M. & S. TANJI. 1981. Distribuição geográfica dos bagres marinhos (Osteichthyes, Ariidae) no complexo lagunar de Cananéia (25°S, 48°W). Boletim Instituo de Pesca 9: 131-40.
- --o 1983. Maturação e desova dos bagres marinhos (Osteichthyes, Ariidae)
do complexo lagunar de Cananéia (25°S, 48°W). BoI. Inst. Pesca 10: 129-141. REIS, E.G. 1986a. A pesca artesanal de bagres marinhos (Silurifornes, Ariidae) no estuário da Lagoa dos Patos (RS), Brasil. Rio Grande, FURG, Documentos técnicos 5, 22p.
- - - o 1986b. Reproduction and feeding habits of the marine catfish Neluma
barba (Siluriformes, Ariidae), in the estuary or Lagoa dos Patos, Brasil. Atlântica, Rio Grande, 8: 35-55 .
VAZZOLER, A.M.A. DE M. 1982. Manual e métodos para estudos biológicos de populações de peixes. Reprodução e crescimento. Brasília, CNPq/Programa Nacional de Zoologia, 108p.
- - - o 1996. Biologia da reprodução de peixes teleósteos: teoria e prática. Maringá, Editora Universidade Estadual de Maringá e Sociedade Brasileira de lctiologia, 169p.
YAMAMOTO, K. 1970. Reproduction, p. 233-371 . ln. N. KAWAMOTO (Ed.). Gyorui
seiri (Fish physiology). Tokyo, Koseisha-Koseikaku, 482p.
YAI'JEZ-ARANClBIA, A. & P. SÀNCHEZ-GIL. 1988. Ecologia de los recursos demersales marinos. México, AGT Editor S.A. , 228p.
Recebido em 27.V.1998; aceito em 19.X!.1999.