UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS
DEPARTAMENTO DE FISIOLOGIA
PROGRAMA DE PÓS GRADUAÇÃO EM PSICOBIOLOGIA
MAISA DE SOUZA LIMA
USO DE HABITAT E COMPORTAMENTO DO BOTO CINZA
EM UMA ZONA ESTUARINA DO ESTADO DE SERGIPE, NORDESTE DO BRASIL
Dissertação apresentada ao programa de Pós Graduação em Psicobiologia do Departamento de Fisiologia, Universidade do Rio Grande do Norte, como parte dos requisitos para obtenção do título de mestre.
Orientador: Prof. Dr. Flávio José de Lima Silva
“Temos não apenas o infinitamente grande e o infinitamente pequeno, mas também o infinitamente complexo. As intricadas relações da vida representam bem este último infinito”.
AGRADECIMENTOS
Certa vez, navegando na internet, li o breve texto a seguir:
!" #
$ % & ' ( ) *
+ + + ! ,- .
+ $ %
-$ %/ ' (- + $ %) , .+
0 ' + ' - 1 2
A partir daí, comecei a confiar mais em mim e acreditar que somos capazes de alcançar
nossos objetivos quando realmente queremos algo, mesmo quando há várias pedras ou buracos
em nosso caminho, ou ainda passamos por situações que nos fazem pensar em desistir de tudo.
Mas, talvez, sozinha eu poderia não ter conseguido e o apoio e a contribuição de muitas pessoas
importantes foram essenciais. Por isso, nada mais justo que agradecer...
Aos meus pais, Maria Helena e Gladston Lima, pelo amor, compreensão e
enorme apoio (pessoal e financeiro) que sempre me deram, principalmente quando decidi sair de
Aracaju e vir a Natal cursar esta pós graduação. Sei que de alguma forma estão sempre comigoi
Aos meus irmãos, Mayka e Gledson. Afinal de contas, somos irmãosi E a verdadeira
família não é só aquela unida pelo sangue, mas também pelo espírito.
Ao meu namorado, Leandro, pela força e também por todo o carinho, amor e também
por suportar meus momentos de desabafo. Lembro que desde a seleção do mestrado você
sempre me disse: “Mai, você vai conseguiri Eu acredito em vocêi”. Amo você Leoi Agradeço
também à sua família.
Aos amigos verdadeiros, Acácia “Mirra” e Marcus Vinícius “Marvin”, que apesar da
distância sempre estiveram presentes em minha vida e compreenderam a minha ausência. À Bia,
minha grande amiga que fiz em Natal.
A todos da minha família que sempre acreditaram em mim como bióloga, tios (as),
primos (as), especialmente a Kellynha, Keite, Catiane e meu primo Clevison por eu ter morado
Ao meu orientador, Dr. Flávio José de Lima Silva, pela orientação e confiança e por
aceitar a orientar esta pesquisa mesmo que realizada em outro estado, além de compreender os
meus problemas pessoais.
Aos professores do programa de pós graduação em Psicobiologia, que contribuíram
com seu conhecimento para minha formação: Arrilton, Maria Emília, Maria de Fátima, Daniel e
principalmente a Fívia, pelas conversas nos momentos em que mais precisei. A Ana Claudia da
secretaria pela ajuda e todos os funcionários.
Ao amigo Wall Hattori, pelos em estatística, esse “meu bicho de 7 cabeças”. Te
devo essa hein carai Hugs For Youi
Aos amigos do Instituto Mamíferos Aquáticos de Sergipe (IMA SE): Adolfo, Amanda,
Rodrigo, Eduardo e Ernesto. Também às estagiárias: Sabrina, Isadora, Kamila, Laisinha e Laís
Paula, que estiveram envolvidas na coleta dos dados utilizados aqui neste trabalho, e acima de
tudo foram minhas companheiras durante as várias horas em que ficamos observando os
golfinhos.
Aos amigos da turma de pós graduação Luciane, Cristiana, Dalila, Ricardo, Daniela,
Thiago “Kutaco” e Samuel.
A Orestes e sua família, pelo apoio durante o período que residi em Natal.
Aos donos e professores da Nativa Academia de Ginástica, por autorizar a utilização da
sacada da academia como ponto fixo de observação.
A CAPES, pela bolsa de mestrado concedida.
Aos meus queridos companheiros do dia a dia e também das madrugadas em claro,
meus inseparáveis cães (Lucky, Milly, Minnie, Meg e Rex ), que não deixaram a
solidão tomar conta de mim.
Agradeço àquelas pessoas que de alguma forma estiveram envolvidas na realização
deste trabalho, mesmo que não citadas aqui. Este espaço é muito curto para agradecer a todos.
Assim, termino este agradecimento com a frase: “Cada pessoa que passa em nossa vida,
passa sozinha, é porque cada pessoa é única e nenhuma substitui a outrai Cada pessoa que passa
em nossa vida passa sozinha e não nos deixa só porque deixa um pouco de si e leva um
pouquinho de nós. Essa é a mais bela responsabilidade da vida e a prova de que as pessoas não
SUMÁRIO
RESUMO X
ABSTRACT XI
INTRODUÇÃO GERAL 12
ARTIGO 1 – Caracterização do uso de hábitat e do orçamento comportamental diurno do boto cinza, , na zona estuarina do Rio Sergipe,
Nordeste do Brasil 17
RESUMO 18
INTRODUÇÃO 19
MATERIAL E MÉTODOS 22
Área do Estudo 22
Delineamento Observacional 23
Definições Adotadas 25
Análise dos Dados 26
RESULTADOS 28
DISCUSSÃO 35
AGRADECIMENTOS 39
REFERÊNCIAS 40
ARTIGO 2 Tamanho e composição dos agrupamentos do boto cinza,
, e relação com o comportamento, na zona estuarina do Rio Sergipe,
Nordeste do Brasil 47
RESUMO 48
INTRODUÇÃO 49
MATERIAL E MÉTODOS 52
Área do Estudo 52
Delineamento Observacional 53
Definições Adotadas 55
Análise dos Dados 56
RESULTADOS 58
DISCUSSÃO 65
AGRADECIMENTOS 69
DISCUSSÃO GERAL 77
CONSIDERAÇÕES FINAIS 81
REFERÊNCIAS BIBLIOGRÁFICAS (Introdução e discussão geral) 82
RESUMO
Para esclarecer os mecanismos funcionais do uso do habitat é preciso analisá lo conjuntamente ao comportamento realizado pelos animais. A ocorrência, distribuição e uso do espaço são características de uma espécie decorrentes da seleção do habitat que esta faz em busca das condições favoráveis à sua sobrevivência. Podem se relacionar os fatores físicos e biológicos do ambiente com as características ecológicas da espécie, já que estes fatores atuam regulando o sucesso ecológico dos organismos, e a partir disso é possível obter importantes informações sobre o uso de habitat e do comportamento dos indivíduos. Assim, este estudo objetivou caracterizar o uso de habitat e o comportamento diurno expresso pelo boto cinza, na zona estuarina do Rio Sergipe, nordeste do Brasil, analisando a influência do estado da maré e hora do dia sobre a ocorrência dos animais e dos estados de comportamento, bem como verificar o tamanho e composição dos agrupamentos nesta espécie de cetáceo. Para isso, de Março de 2009 a Fevereiro de 2010, observações focais dos agrupamentos de botos foram feitas a partir de ponto fixo e os registros instantâneos dos dados efetuados a cada 5 min., no intervalo das 6:00h as 18:00h, em turnos alternados. Os resultados mostraram que a constante presença dos animais na zona estuarina do Rio Sergipe indica que esta é uma importante área de ocorrência de . , os quais usam a região principalmente no turno da manhã, em níveis baixos de maré e como área de alimentação. Como em outras regiões do nordeste do Brasil, pequenos agrupamentos foram mais comuns, formados por 2 a 12 indivíduos de ambas as classes de idade, adultos e imaturos. A alta freqüência de animais imaturos pode indicar que esta área do estuário seja utilizada como área de cria e cuidado parental dos filhotes e animais jovens, já que os imaturos estiveram bastante associados aos adultos e o acompanhamento nas atividades de forrageio/ alimentação pode estar relacionado a uma forma de aprendizagem ou treinamento desse comportamento.
ABSTRACT
To clarify the functional mechanisms of habitat use is necessary to analyze it in conjunction with the conduct performed by animals. The occurrence, distribution and use of space are characteristic of a species resulting from habitat selection that is in search of conditions favorable to its survival. One can relate the physical and biological factors of the environment with the ecological characteristics of the species, since these factors act by regulating the ecological success of organisms, and from there you can get important information about the habitat use and behavior of individuals. This study aimed to characterize the use of habitat and diurnal activity expressed by the Guiana dolphin, in an estuarine area of Sergipe state, Brazil, analyzing the influence of tide and time days on the occurrence of animals and behavior’s state, and group’s size and composition in this cetacean species. From March 2009 to February 2010, focal groups observations of dolphins were made from fixed point and records snapshots of data taken every 5 min. in the interval from 6 a.m to 6 p.m, in alternating shifts. The results showed that the constant presence of animals in the area of the Sergipe River estuary indicates that this is an important area of occurrence of
, which use the region mainly in the morning, at low tide and as a feeding. As in other regions of northeastern Brazil, small groups formed 2 12 individuals were most common, with adults and immatures. The high frequency of immature animals may indicate that this area of the estuary is used as brood area and parental care of pups and young animals, since the immature animals were very associated with adults and monitoring the activities of foraging / feeding may be related to a form of learning or training of such behavior.
INTRODUÇÃO GERAL
Animais constantemente tomam decisões: eles escolhem os parceiros, escolhem um lugar para viver ou forragear, e decidem se envolver ou não em atividades que os exponham aos riscos de predação. Esta tomada de decisões é vista como o resultado dos custos e benefícios dos vários comportamentos que os indivíduos apresentam, buscando a opção que tenha o efeito mais positivo sobre a sua aptidão reprodutiva (Krebs & Davis, 1996; Cassier . 2000; Danchin ., 2005). Por sua vez, a expressão destes comportamentos está intimamente relacionada às condições ecológicas do habitat, as quais atuam determinando quais padrões comportamentais são favorecidos durante a evolução (Krebs & Davies, 1996). Aliás, somente através da análise conjunta dos fatores comportamento e ecologia da espécie em cada tipo de habitat, os mecanismos funcionais que estão por trás do uso que os animais fazem de uma área podem ser esclarecidos (Well ., 1999; Hastie , 2004).
De fato, as características ecológicas das espécies como a ocorrência, a distribuição e uso do espaço são conseqüência da seleção do habitat que estas fazem, preferindo determinados locais em detrimento de outros, em busca das melhores condições e recursos para sua sobrevivência. Já que os fatores físicos e biológicos do ambiente são capazes de regular o sucesso ecológico dos organismos, é possível obter importantes informações sobre o uso de habitat de uma espécie relacionando estes fatores às suas características ecológicas (Abramsky 2002; Wedekin e Rossi Santos, 2008). Dessa forma, para encontrar um habitat adequado, os animais usam as informações ou pistas espalhadas no ambiente e também vindas de outros animais, as quais possibilitam avaliar a qualidade potencial de um habitat particular (Souza & Silva, 2007; Snowdon, 2007).
De uma forma geral, o padrão de comportamento das espécies animais apresenta oscilações ao longo do dia, e em alguns casos em momentos específicos do ano, como uma forma de adequação às variações das condições climáticas e ambientais (Krebs & Davis, 1996; Alcock, 2001). Estas mudanças no ambiente atuam como pressão seletiva, e nos cetáceos (baleias, botos e golfinhos) influenciam movimentos diários, uso do habitat e regime de alimentação, entre outros (Guilherme Silveira & Silva, 2009).
As variações de fatores ambientais (como disponibilidade e distribuição de alimento durante o dia, presença de predadores e competidores) bem como as características físicas do habitat (ocorrência de chuvas, variações do fotoperíodo, nível de maré e temperatura) são exemplos de fatores que causam estas oscilações no comportamento de um indivíduo (Wells ., 1991; Krebs & Davis, 1996; Geise ., 1999; Goodenough , 2000; Azevedo ., 2007; Guilherme Silveira & Silva, 2009; Silva & Silva, 2009). Entre as diferentes categorias de comportamento, a organização social dos animais sofre intensa influência destas pressões seletivas. Isso pode ser detectado nas mudanças diárias e sazonais do tamanho e da composição dos grupos na natureza (Goodenough , 2000).
Desse modo, as atividades realizadas pelos indivíduos numa área nas diferentes estações do ano podem determinar o tamanho e a composição do grupo, tendo a obtenção de energia como a principal pressão seletiva atuante nesta característica (Danchin ., 2005; Grigg & Markowits, 1997; Pryor & Shallenberger, 1991). Sendo assim, o tamanho do grupo na maioria das espécies sociais é uma compensação para a otimização da eficiência do forrageio e a minimização dos ricos de predação (Krebs & Daves,1996). Dessa forma, a ecologia comportamental da maioria dos golfinhos reflete estratégias adaptativas específicas moldadas pelas condições ecológicas nas quais uma população vive (Defran & Weller, 1999).
Nos delfinídeos, o comportamento pode ser influenciado por diversos fatores ecológicos e as respostas comportamentais (flutuações do tamanho, composição das agregações e a forma de uso de área) podem apresentar diferenças consideráveis dependendo do habitat onde os animais são estudados (Shane, 1990). Estas respostas são flexíveis e apresentam se relacionadas tanto à diversidade das áreas geográficas como a outros fatores, a exemplo da pressão de predação exercida sobre a espécie em um local (Ballance, 1992).
agrupamentos depende de comportamentos específicos (Silva Jr., 2008). Segundo Bel’kovich (1991), a estrutura de grupo dos golfinhos é um mecanismo muito sensível para otimizar o uso espacial e temporal do ambiente e para adequar o método de caça às condições ambientais.
A opção dos animais pela vida em grupo ocorre pela relação de custo e benefício desta estratégia social em função da diminuição do risco de predação, aumento das chances de reprodução e obtenção de alimento (Silva Jr., 2008). Em algumas espécies os indivíduos podem formar grupos por causa dos benefícios que obtêm, até mesmo pela presença ou comportamento do outro indivíduo (formação de grupo mutualístico), e essa formação de grupo só é favorável quando os benefícios superam os custos (Connor , 2000). No caso dos cetáceos, os indivíduos podem aprender entre si as áreas onde o alimento ocorre, já que são animais que vivem em áreas muito extensas e imprevisíveis, sem refúgios aparentes, onde a maioria dos recursos está distribuída de forma desigual no espaço e tempo e são difíceis de defender (Connor , 2000; Tyack
., 2000)
O boto cinza é um cetáceo que possui uma distribuição contínua ao longo da costa do atlântico tropical e subtropical da América do Sul e Central, desde Florianópolis, Santa Catarina (Simões Lopes, 1986; Flores, 2002) até Honduras (Carr & Bonde, 1993; Da Silva & Best, 1996). Esta espécie apresenta preferência por águas costeiras e áreas protegidas como próximas a estuários, baías ou enseadas de águas calmas, (Flores, 2002; Flores & Bazzalo, 2004; Flores & Da Silva, 2009).
2003, Flores & Bazzalo, 2004; Rossi Santos , 2006; Carvalho & Rossi Santos, 2008).
Tais características de distribuição desta espécie, aliadas às particularidades geográficas de determinadas regiões (pontos de relevo elevado como costões rochosos e falésias), favorecem a realização dos estudos com esta espécie de cetáceo principalmente através de observações em terra. Desta forma, observações do comportamento de têm sido feitas em diferentes ambientes ao longo da costa brasileira para adquirir mais informações sobre a espécie a fim de auxiliar o seu manejo e conservação (Gondim & Yamamoto, 2008).
As informações obtidas através destas pesquisas indicam que é um delfinídeo que apresenta um repertório comportamental variado (Nascimento, 2006; Nascimento ,2009), além de que não há um padrão de organização social definido, pois tem sido notada uma variação no tamanho dos grupos ao longo da sua distribuição (Hetzel & Lodi, 1993). Grupos pequenos de dois a dez animais, parecem ser mais comuns no nordeste (Link ., 2000; Meirelles , 2008) enquanto que grupos maiores ou com mais de 100 indivíduos foram registrados para a região sudeste e sul do Brasil (Araújo ., 2008; Azevedo ., 2005; Dias , 2009; Geise . 1999; Lodi 2003; Santos ., 2010). As flutuações na disponibilidade de presas parece ser um fator condicionante na freqüência, tamanho e composição dos agrupamentos de boto cinza em diferentes áreas de estudo (Geise . 1999; Araújo . 2003; Daura Jorge . 2004, 2005, 2007; Flores & Bazzalo, 2004) .
Embora os estudos desenvolvidos em Sergipe indiquem a ocorrência do boto cinza ao longo da extensão do litoral sergipano (Jesus ., 2002), sobretudo nos estuários dos rios Sergipe e Vaza Barris, muitos aspectos sobre seu comportamento e ecologia, incluindo o uso de habitat, ainda não estão bem definidos. No entanto, sabe se que as desembocaduras destes rios são as principais áreas de concentração para a espécie no litoral centro sul do Estado (Jesus ., 2002).
sobreporem intensivamente com núcleos urbanos e áreas de atividades humanas potencialmente impactantes (Wedekin & Rossi Santos, 2008).
Estudos com mamíferos aquáticos no litoral sergipano possuem grande importância devido à carência de informações sobre estes animais e ainda ao crescimento das atividades econômicas como pesca, turismo e produção petrolífera, as quais representam riscos potenciais de impactos ambientais. Essa condição levou o IBAMA classificar no Plano de Ação de Mamíferos Aquáticos do Brasil, o Estado de Sergipe como área prioritária no desenvolvimento de tais pesquisas. Neste contexto, fica clara a importância da investigação de aspectos ecológicos e comportamentais do uso do hábitat pelo boto cinza, principalmente para levantar subsídios para ações de preservação da espécie e dos habitat onde ocorre (Leszek , 2000).
! "
1
Programa de Pós graduação em Psicobiologia, Departamento de Fisiologia. Universidade Federal do Rio Grande do Norte (UFRN). Campus Central. Caixa postal 1511 CEP: 59078 970. Natal, RN. Brasil.
E mail:maisa_lima@yahoo.com
2
Universidade do Estado do Rio Grande do Norte (UERN). Laboratório de Sistemática e Ecologia Animal. Dept. de Ciências Biológicas – Fac. De Ciências Naturais. Av. Prof. Antônio de Campus, s/n. Campus Central – UERN. CEP: 59600 970. Mossoró, RN. Brasil.
E mail:flaviogolfinho@yahoo.com.br
RESUMO
A ocorrência, distribuição e uso do espaço são características de uma espécie decorrentes da seleção do habitat e esta tomada de decisões é resultado dos custos e benefícios das ações dos indivíduos. A expressão do comportamento está intimamente relacionada às condições ecológicas do habitat, e os fatores físicos e biológicos do ambiente podem atuar regulando o sucesso ecológico dos organismos. A partir disso, buscou se caracterizar o uso de habitat e o comportamento diurno expresso pelo boto cinza, em uma zona estuarina do estado de Sergipe/Brasil (10º55’37.02’’S e 37º02’34.43’’W) analisando a influencia do estado da maré e hora do dia sobre a ocorrência dos animais e os estados de comportamento desta espécie de cetáceo. De Março de 2009 a Fevereiro de 2010, observações dos grupos focais de botos foram feitas a partir de ponto fixo e os registros instantâneos dos dados efetuados a cada 5 min., no intervalo das 6:00h as 18:00h, em turnos alternados. A partir dos resultados obtidos foi possível verificar a constante presença de S na zona estuarina do Rio Sergipe, mostrando se como uma importante área de ocorrência da espécie. O período do dia e também o estado da maré influenciaram esta ocorrência, sendo maior durante o turno da manhã e durante o estado de maré vazante. Apesar disso, a variação da maré não exerceu influência significativa sobre o comportamento. Mesmo assim, o forrageio reduziu durante a maré alta, enquanto que a socialização foi maior neste estado de maré. Inclusive, o alto índice dos comportamentos de deslocamento e forrageio indica o principal uso da região como área de alimentação, o que pode estar relacionado às condições ecológicas e a disponibilidade de alimento na região.
As características ecológicas das espécies como: a ocorrência, a distribuição e uso do espaço são conseqüência da seleção do habitat que estas fazem, preferindo determinados locais em detrimento de outros, em busca das melhores condições e recursos para sua sobrevivência. Os fatores físicos e biológicos do ambiente no qual a espécie está inserida podem ser relacionados às suas características ecológicas, já que estes fatores são capazes de regular o sucesso ecológico dos organismos, e a partir disso é possível obter importantes informações sobre o uso de habitat (Abramsky 2002; Wedekin & Rossi Santos, 2008).
Na definição de Rosenzweig (1981), o uso de habitat representa a maneira como uma espécie utiliza os recursos e as condições de uma determinada área, caracterizando em muitos casos um padrão de interação dos indivíduos com o ambiente onde vive, estando geralmente relacionado com a heterogeneidade do ambiente e os requerimentos biológicos da espécie. Já o comportamento representa a parte de um organismo através da qual ele interage com o ambiente, consistindo dos atos que o animal exibe, e a descrição e interpretação da mudança na seqüência e freqüência de suas exibições pode ser traduzida em ações com funções distintas (Snowdon, 1999; Del Claro & Prezoto, 2003).
De uma forma geral, o padrão de comportamento das espécies animais apresenta oscilações ao longo do dia, e em alguns casos em momentos específicos do ano, a fim de ajustá lo às variações das condições climáticas e ambientais (Krebs & Davis, 1996; Alcock, 2001). Estas mudanças atuam como pressão seletiva, agindo também sobre os cetáceos (baleias, botos e golfinhos), influenciando movimentos diários, uso do habitat e regime de alimentação, entre outros (Guilherme Silveira & Silva, 2009).
As variações de fatores ambientais (como disponibilidade e distribuição de alimento durante o dia, presença de predadores e competidores) bem como as características físicas do habitat (ocorrência de chuvas, variações do fotoperíodo, nível de maré e temperatura) são exemplos de fatores que causam estas oscilações no comportamento de um indivíduo (Wells ., 1991; Krebs & Davis, 1996; Geise ., 1999; Goodenough , 2000; Azevedo ., 2007; Guilherme Silveira & Silva, 2009; Silva & Silva, 2009).
Central, desde Florianópolis, Santa Catarina (Simões Lopes, 1986; Flores, 2002) até Honduras (Carr & Bonde, 1993; Da Silva & Best, 1996). Esta espécie apresenta preferência por águas costeiras e áreas protegidas como próximas a estuários, baías ou enseadas de águas calmas, (Flores, 2002; Flores & Bazzalo, 2004; Flores & Da silva, 2009).
Apesar do hábito costeiro, há ainda o registro oceânico pelágico para a espécie na região sul do estado da Bahia, onde grupos de botos foram avistados a uma distancia de 27,75km na direção da costa da Baía de Camamú (Carvalho & Rossi Santos, 2008) e também a 70 km da costa, na região do rio Caravelas, utilizando hábitats de recifes de corais na direção do Arquipélago dos Abrolhos, sendo este o registro mais distante da costa para a espécie (Rossi Santos , 2006). A ocorrência desta espécie tanto em águas rasas como em áreas oceânicas pode indicar uma possível flexibilidade adaptativa destes animais para as condições e características de cada local, incluindo o tipo de presas que são consumidas, assim como as estratégias utilizadas na captura (Geise . 1999; Lodi 2003, Flores & Bazzalo, 2004; Rossi Santos , 2006; Carvalho & Rossi Santos, 2008).
As informações obtidas através das pesquisas com indicam que este é um delfinídeo que apresenta um repertório comportamental variado (Nascimento, 2006; 2009), além de que não há um padrão de organização social definido, pois tem sido notada uma variação no tamanho dos grupos ao longo da sua distribuição (Hetzel & Lodi, 1993). Assim, grupos pequenos de dois a dez animais, parecem ser mais comuns no nordeste (Link ., 2000; Meirelles , 2008) enquanto que grupos maiores ou com mais de 100 indivíduos foram registrados para a região sudeste e sul do Brasil (Araújo ., 2008; Azevedo ., 2005; Dias , 2009; Geise . 1999; Lodi 2003; Santos ., 2010).
impactos ambientais. Neste contexto, fica clara a importância da investigação de aspectos ecológicos e comportamentais do uso do hábitat pelo boto cinza, principalmente para levantar subsídios para ações de preservação da espécie e dos hábitats onde ocorre (Leszek , 2000).
#
$% & '()&*
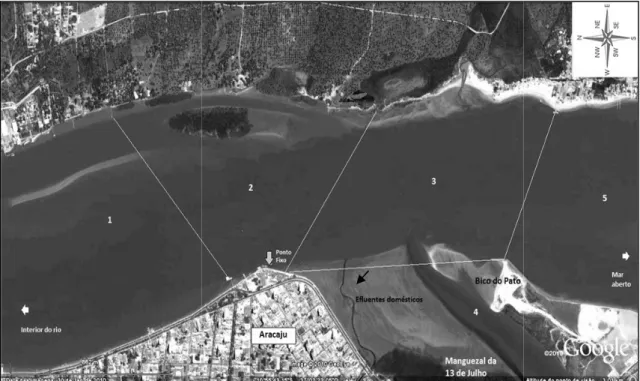
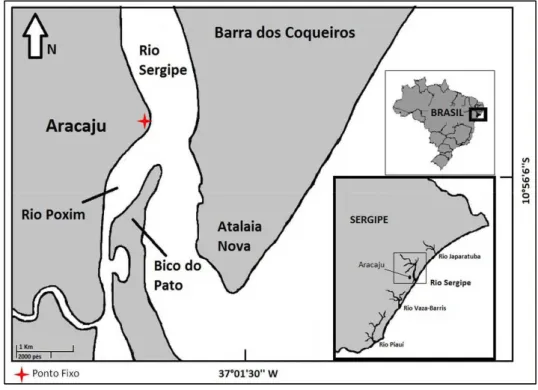
Esta pesquisa foi conduzida na área da foz do Rio Sergipe (10º 55’ 37.02’’ S e 37º 02’ 34.43’’W), localizado na porção central do litoral do estado, separando a capital Aracaju do município Barra dos Coqueiros (Figura 1). Possui uma extensão de aproximadamente 7,5km de superfície entre a ponte Construtor João Alves (no centro da capital) e a linha da foz com o mar. A largura máxima da região pode ser encontrada entre a Coroa do Meio e a Praia Atalaia Nova, sendo em torno de 1,26km. Enquanto que a mínima (em torno de 0,7km) na porção em frente ao Iate Clube de Aracaju. No entanto, durante a maré baixa há formação de canais estreitos com cerca de 50m largura ou menos, como no deságüe do Rio Poxim, um dos tributários da Bacia do Rio Sergipe.
Nesta localidade, os ventos alísios são predominantes e variam de SE para NE. A pluviosidade constitui o principal elemento diferenciador do clima em Sergipe, já que as variações térmicas são pouco expressivas (Carvalho & Fontes, 2007). Desta forma, ocorrem no litoral sergipano duas estações bem definidas: uma chuvosa de abril a agosto, concentrando, geralmente, mais de 70% das precipitações, e outra em que o período de estiagem ocorre de setembro a março (Amâncio, 2001).
Já o regime das marés é caracterizado por um padrão semidiurno, com dois picos de marés altas (preamar) e dois de marés baixas (baixa mar) a cada dia, separadas por um intervalo de pouco mais de seis horas, num período total de 24 horas e 50 minutos. A amplitude pode variar entre 1,4m e 2,3m (mesomarés), sendo que a amplitude máxima ocorre nos equinócios de março e setembro (Carvalho & Fontes, 2007).
A topografia subaquática desta área é constituída tanto por sedimento lamoso, já que se trata de um ecossistema estuarino com remanescentes de manguezais, como também por arenito proveniente das praias adjacentes. Próximo aos manguezais ocorre planícies de maré, as quais são organicamente enriquecidas por dejetos domésticos, principalmente na margem da cidade de Aracaju (Almeida & Couto, 1994).
Apesar de ser uma zona estuarina que apresenta condições ecológicas favoráveis à ocorrência de diversas espécies aquáticas, existe também forte desenvolvimento urbano, e uma das conseqüências é o constante escoamento de efluentes residencial sem tratamento diretamente no estuário. Mais ainda, há freqüente tráfego de embarcações de pequeno, médio e grande porte, as quais utilizam a região como principal rota de navegação ou desenvolvem atividades de pesca artesanal e turismo ao longo do dia.
Figura 1: Localização geográfica da área do estudo, com o Estuário do Rio Sergipe em destaque.
+ +(* ,' % - *+
Em relação às técnicas empregadas na coleta dos dados, utilizou se a o método de grupo focal e amostragem por meio de registro instantâneo dos estados comportamentais apresentados pelos botos, a intervalos de cinco minutos, marcados por dois sinais sonoros de um cronometro digital em função regressiva (Altman, 1974). A coleta destes dados foi realizada por dois observadores treinados que utilizaram protocolos específicos (planilhas) para o registro (Freitas & Nishida, 2007) e binóculos 10 x 50 mm e 12 x 60 mm, quando necessário. A contagem do número de indivíduos nos agrupamentos foi realizada de forma constante, a cada reavistagem dos animais no momento em que emergiam para respirar, e havendo consenso entre os observadores da quantidade de animais. Ressaltando ainda, que a apresentação de sincronismo comportamental da espécie foi importante no processo de contagem em diversos momentos.
Para auxiliar a localização dos animais, bem como a análise do uso de habitat, foram traçadas linhas imaginárias entre pontos referenciais localizados nas duas margens do rio para delimitar cinco subáreas (Figura 2). Nesta divisão a profundidade não foi considerada, somente e as características ecológicas da região. Assim, temos:
Área1 – parte mais interna do estuário, ao norte do ponto de observação, com presença de banco de areia na margem oposta a Aracaju;
Área 2 – em frente ao ponto de observação e ocorrência de ilha de manguezal na margem oposta a Aracaju, onde há formação de planície de maré;
Área 3 – região central, com limite na Praia Pico do Pato. Nesta área, é onde termina a formação de planície de maré do rio Poxim, que recebe os efluentes domésticos.
Área 4 – Fox do Rio Poxim, onde há formação de um canal estreito e planície de maré desde o manguezal do Bairro 13 de Julho;
Figura 2: Imagem de satélite da localização do ponto fixo utilizado
. + /0 ' &*( & '
Agrupamento: qualqu vínculo, rigidez, estabilidade de parentesco e que estão ex indivíduos de qualquer faixa mais adequada para não oco numa determinada área, pode
Classe etária: As cl tamanho aproximado dos ani (2002) e ainda a seq Nascimento (2009). Dessa fo filhotes animais com cerca
da área do estudo com as linhas imaginárias da div
ilizado para as avistagens dos botos. Fonte:3 4
qualquer agregação de indivíduos da mesma espéci ilidade ou duração definida, que podem ou não apr
tão executando o mesmo comportamento, e ainda p r faixa etária (Mann, 2000; Silva Jr., 2008). Esta ão ocorrer generalização dos comportamentos, já q
podem se subdividir e realizar comportamentos d s classes etárias foram definidas por estimat os animais, de acordo com as classificações descri
a seqüência de exposição do corpo a superfíci essa forma, sendo categorizados em adultos e imat
cerca de 1/2 a 3/4 do tamanho do adulto).
da divisão das áreas e
42010
Estados comportamentais:
– os animais deslocam se de uma direção para outra, sendo que a natação apresenta uma direção fixa, pode ocorrer com velocidades distintas (lenta, rápida, em velocidade ou com saltos) e não apresentam o corpo arqueado.
5 – animais realizam natação sem direção fixa, interrompida por eventos de perseguição e bote na presa, podendo ter sucesso de captura ou não, além da procura de alimento e estratégia de encurralar as presas.
' + – dois ou mais indivíduos nadam na superfície, bem próximos uns dos outros, com constante contato físico, podendo ocorrer comportamentos aéreos, agressão e brincadeira.
– estado no qual um ou mais indivíduos deslocam se lentamente seguindo uma trajetória regular, subindo a superfície somente para respirar. Os animais apresentam se coesos, sincronizados e menos que um corpo de distância entre eles e nadando lado a lado (Gnone , 2001; Lusseau, 2003; Constantine , 2004).
%*- & +(* & +1 ' &*' &*'
Os dados coletados foram transcritos para planilhas do programa Microsoft Excel e organizados para se obter as freqüências diárias de ocorrência dos botos, dos registros dos comportamentos, da ocorrência por área de uso e por nível de maré. Nas comparações em função da hora do dia, os turnos foram analisados separadamente devido ao número de dias de esforço pela manhã ter sido diferente do turno da tarde. Nas análises por hora do dia, por maré e área de ocorrência foi considerado o total de dias de esforço efetivo. Já nas análises do orçamento comportamental e dos comportamentos em função da área e maré, foi considerado o total de ocorrências obtido por registros instantâneos.
níveis e horários das marés foram obtidos das tábuas de marés disponíveis no site do Departamento de Hidrografia da Marinha do Brasil – DHM, tomando por base o Terminal Marítimo Inácio Barbosa (Estado de Sergipe).
Entre os meses de mar registros instantâneos em durante a tarde. Isto gerou efetivo, o que corresponde presentes na área em questão
7 &
A presença dos botos estudo, sendo 61 dias pela m horária dos registros mostrou ao longo do dia. No entan indivíduos por hora, verific turno da manhã (N=61; Fr= foram significativamente dife
Na análise entre as animais no intervalo das 6:0 10:00 (N= 61; Z= 3,010; p=
Figura 5: Média diária d período de março de 2009 a fevere
e março de 2009 a fevereiro de 2010, foram 144 dias de observação, sendo 75 dias pel erou 789,63 horas de esforço amostral e 190 ho ponde a 24,06 % do tempo das observações co
uestão.
s botos foi registrada em 113 dias (78,5%) durant pela manhã e 52 dias no turno da tarde (Figura 4
ostrou que os animais estiveram presentes em tod entanto, quando comparamos a freqüência de o verificamos que houve diferença significativa par = 44,17; gl= 5; p= 0,001). Já as horas do turn te diferentes (N= 52; Fr= 10,134; gl= 4; p= 0,072) re as horas da manhã, foi demonstrada que a o
as 6:00 foi significativamente menor que as 7:00 10; p=0,003) (Figura 5).
iária de ocorrência dos botos no estuário do Rio Sergipe
fevereiro de 2010. (Ndias=113).
ram coletados 2483 pela manhã e 69 horas de esforço com os animais
durante o período do 4). A distribuição em todos os horários a de ocorrência dos va para as horas do o turno da tarde não
,072).
ue a ocorrência dos s 7:00, 8:00, 9:00 e
& 0 &
A presença de animais pôde ser registrada em todos os níveis de maré. No entanto, a relação entre a ocorrência dos indivíduos quanto à maré mostrou que durante a maré vazante (M2) houve o maior valor percentual de registro dos botos (55,92%). Nos demais níveis as taxas de ocorrência foram: 16,14% na maré enchente (M4), 15,88% na maré baixa (M3) e 12,06% na maré alta (M1). A freqüência de ocorrência dos animais em cada nível de maré mostrou se significativamente diferente (N=113; Fr= 43,638; gl= 3; p= 0,001), sendo significativamente maior durante a M2 (Z= 4,762; p=0,001) (Figura 7). Os demais níveis não se mostraram diferentes entre si.
Figura 7: Média diária da ocorrência dos animais na área do estudo em relação aos níveis de maré,
no período de março de 2009 a fevereiro de 2010 (Ndias= 113).
7
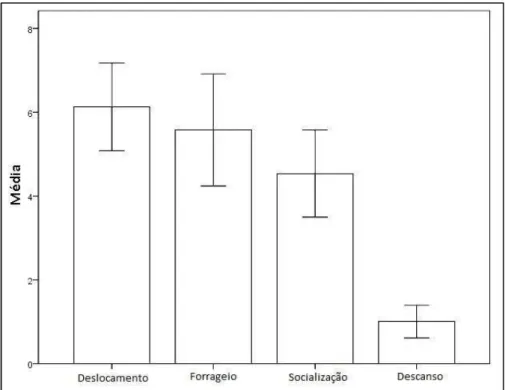
ocorrência do descanso obteve um valor de apenas 5,84% do total de registros (Figura 8).
Pela análise estatística, estas freqüências são significativamente diferentes (N=113; Fr= 112,117; gl= 3; p=0,001). Quando comparadas entre si, não houve diferença entre o deslocamento e o forrageio (ZDL FO= 1,798; p=0,072) e nem entre o
forrageio e socialização (ZFO SO= 1,268; p=0,205). Por outro lado, o deslocamento foi
significativamente maior que a socialização e o descanso (ZDL SO= 3,688; p=0,001; ZDL DS= 8,301; p=0,001). Enquanto que o forrageio e socialização mostraram se maiores
que o descanso (ZFO DS= 6,620; p=0,001) (ZSO DS= 7,227; p=0,001).
Figura 8: Média diária dos estados comportamentais do boto cinza no
Estuário do Rio Sergipe no período de março de 2009 a fevereiro de 2010. Onde: (DL) deslocamento; (FO) forrageio; (SO) socialização; (DS) descanso. (N=2483)
8 + 9
p=0,014). O forrageio foi relativamente importante no final da manhã e início da tarde, apresentando se maior no intervalo das 12:00h e 13:00h (Z= 2,079; p=0,038) (Figura 9).
Referente à socialização, apesar de um maior número de registros deste estado comportamental ter sido obtido no meio da manhã, nos intervalos das 08:00h e 9:00h, estas freqüências foram consideradas iguais estatisticamente (p>0,05). A socialização as 8:00h ainda mostrou se significativamente maior do que as 10:00h e 11:00h (Z= 2,329; p=0,020). Semelhante, no intervalo das 9:00h a socialização também foi maior que no intervalo das 11:00h (Z= 2,404; p=0,016). No entanto, as horas vespertinas não mostraram diferença significativa entre si (p=0,623). O descanso, apesar de apresentar valores mais expressivos no primeiro e ultimo horários do período de avistagem, as 6:00h e as 17:00h, não mostrou se diferente ao longo do dia (pmanhã= 0,119; ptarde=0,153).
Figura 9: Orçamento das atividades realizadas pelo boto cinza no estuário do Rio Sergipe por hora do dia, no período de março a maio de 2009. Onde: (DL) deslocamento; (FO) forrageio; (SO)
socialização; (DS) descanso (Nregistros=2483).
8 + .* : 0
pM1=0,071; ZM2= 1,332; pM2=0,183; ZM3= 0,576; pM3=0,565; ZM4= 0,741 ; pM4=0,459)
(Figura 10). No entanto, o deslocamento foi significativamente maior que a socialização durante a maré enchente (Z= 3,884; p=0,001).
Já os comportamentos de socialização foram avistados principalmente durante a maré alta (M1= 29,59%) e maré vazante (M2= 27,75%). Este comportamento mostrou se maior estatisticamente apenas que o descanso durante todos os níveis de maré (Z= 4,934; p=0,001). O descanso, apesar dos baixos índices, ocorreu mais freqüentemente durante a maré vazante (M2= 8,20%). Mesmo assim, foi significativamente menor que todos os outros comportamentos em todos os níveis de maré (Z= 2,962; p=0,003).
Figura 10: Freqüência dos comportamentos (DL: Deslocamento; FO: Forrageio; SO: Socialização; DS:
Descanso) apresentados por em relação aos níveis de maré (N= 2483).
; 9
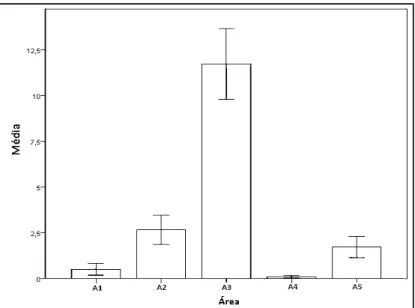
Poxim. Na porção da planíc durante as marés altas, não h Estatisticamente, a fr 113; Fr= 278,429; gl = 4; p= os animais foram mais avista p2 3=0,001; Z3 4= 9,146; p3 4
foi significativamente o men Detalhadamente, foi significativamente menor qu freqüência foi considerada m não houve diferença em re significativamente do que na
Figura 11: Média da oco na zona do estuário do Rio Sergipe
Quanto ao comporta mostraram diferentes es principalmente nas áreas A comportamento foi mais inte à socialização, ocorreu de fo foi mais representativo na (Figura 12).
planície de maré desta área, mesmo quando encob não houve registro dos animais.
, a freqüência de uso entre as áreas mostrou se 4; p=0,001), sendo que a A3 foi significativamen avistados durante o estudo (Z1 3= 9,112; p1 3=0,00
4=0,001; Z3 5= 8,587;p3 5=0,001). Enquanto qu
o menor (NDias= 113; Z= 2,973; p=0,003).
e, foi possível verificar que a ocorrência dos anim or que na A2, A3 e A5 e maior que na A4 (p<0,05 rada menor significativamente que a A3 e maior qu
em relação a A5 (p>0,05). O uso da A5 mo que na A1 e na A4 (p<0,05).
corrência do boto cinza, , em relação às su
ergipe no período entre março de 2009 a fevereiro de 2010.
portamento, as freqüências de uso de cada ár s estatisticamente (p=0,001). O deslocam reas A1(43,24%) e A5 (43,20%). Quanto ao
is intenso nas áreas A3 (35,23%), A5(35,60%) e de forma semelhante em todas as áreas. Por ultim
A2, apresentando 15,68% do total da ativid
encoberta pela água
diferente (NDias=
ivamente a área onde 0,001; Z2 3= 8,429;
nto que o uso da A4
s animais na A1 foi 0,05). Para a A2 a aior que a A1 e A4, e 5 mostrou se maior
o às subáreas de estudo, 2010. (N= 2483)
Na comparação entre as áreas, somente para a área A4 as análises não mostraram diferença estatística entre as freqüências dos comportamentos (NA4=16; Fr=
6,054; gl= 2; p>0,05). Já para as demais áreas, na Área 1 o descanso foi significativamente menor (Z= 2,043; p=0,041) e o deslocamento foi maior que a socialização (Z= 1,970; p =0,048). Na área 2, o deslocamento foi maior que o forrageio (Z= 4,244; p=0,001) e o descanso (Z= 3,595; p=0,001). A socialização também foi significativamente maior que o descanso (Z= 2,835; p=0,005) e o forrageio (Z= 2,121; p=0,034).
Na Área 3 o deslocamento e o forrageio mostraram se iguais estatisticamente (p>0,05). No entanto, o deslocamento foi maior que a socialização (Z= 2,424; p=0,015) e o descanso (Z= 8,110; p=0,001). O forrageio e a socialização só mostraram se maiores significativamente que o descanso (Z= 6,574; p=0,001) (Z= 7,252; p=0,001). Na Área 5, tanto o deslocamento (Z= 3,906; p=0,001) como o forrageio (Z= 2,276; p=0,023) foram maiores que a socialização e o descanso. A socialização só mostrou se maior significativamente que o descanso (Z= 3,376; p=0,001).
Figura 12: Freqüências de utilização das subáreas pelos botos no período entre março de 2009 a fevereiro de 2010. Onde: (DL) deslocamento; (FO) forrageio; (SO) socialização; (DS) descanso. (N=2483)
0 10 20 30 40 50 60 70
A1 A2 A3 A4 A5
Fr
e
q
r
u
ê
n
ci
a
%
Área
DL
FO
SO
Como observado em outras localidades nas quais vem sendo estudada, na zona estuarina do Rio Sergipe esta espécie pôde ser avistada diariamente, apoiando os dados de Jesus (2002) que consideram esta região como área de concentração dos animais, mesmo não tendo sido confirmada a presença dos indivíduos em todos os dias de observação, fato também registrado em algumas áreas de ocorrência da espécie ao longo da sua distribuição (Ananias, 2006; Silveira, 2006; Collaço, 2008; Reis ., 2008).
Os dias onde houve total ausência de avistagem dos botos podem ser explicados pelo fato dos cetáceos ocuparem áreas de vida extensas, que variam de acordo com as necessidades biológicas da espécie (Simões Lopes, 2005). Além do que, a região foco deste estudo é somente parte da área de vida que os agrupamentos de
podem apresentar no litoral do Estado de Sergipe, já que há registros da espécie em água interiores dos estuários como também próximas da costa (Jesus ., 2004).
Outro ponto importante é que a ocorrência e permanência dos golfinhos em uma determinada área estão relacionadas principalmente a disponibilidade dos recursos a as características ecológicas do hábitat (Defran & Weller,1999), bem como ao movimento das presas. Como conseqüência, os animais deslocam se entre áreas em função das variações quanto à disponibilidade das presas ao longo do tempo, o que ocorre freqüentemente em diferentes espécies de delfinídeos costeiros. Por sua vez, estas espécies geralmente exploram estoques pesqueiros que apresentam migrações sazonais, sendo que a abundancia do alimento pode variar drasticamente em determinadas localidades (Boyd, 1996; Daura jorge ., 2004).
(Reis ., 2008) e Baía do Pontal, Ilhéus (Santos ., 2008). A concentração dos registros dos botos nas primeiras horas da manhã, principalmente no período entre as 6:00h e 10:00h, foi semelhante aos resultados apresentados por Geise (1999) que também observaram que a presença de foi mais registrada nesta faixa de horário, na região estuarina de Cananéia, São Paulo. Adicionalmente, Araujo . (2001) citam que o número de animais na Baía dos Golfinhos em Pipa, Rio Grande do Norte, também foi maior durante o turno matutino. Porém, no Porto de Maceió em Alagoas a maior freqüência de animais foi vista durante a tarde (Collaço, 2008). Uma possível explicação para esta preferência dos animais em usar as áreas mais intensamente num período específico pode estar relacionada à flutuação diária das presas que ocorrem em cada região.
Em relação ao nível de maré, a constatação de maior ocorrência dos animais durante níveis baixos de maré segue o mesmo padrão descrito para os agrupamentos de boto cinza que utilizam a praia de Iracema (Fortaleza Ceará) (Oliveira ., 1995) e na enseada do Curral (Pipa –RN)(Silveira, 2006). Segundo os autores, a menor quantidade de água no ambiente durante o refluxo da maré aumenta a densidade de peixes e facilita a busca pelo alimento, ou seja, quando o nível das águas está baixando os cardumes teriam um menor espaço para fugir dos predadores, forçando a se concentrarem, e assim favorecendo a captura das presas (Araújo ., 2001; Silveira, 2006). Entretanto, há informações que mostram uma relação contrária, como verificada por Rossi Santos (2006) no estuário do Rio Caravelas sul da Bahia, onde os botos foram mais avistados durante a maré enchente. Este padrão foi sugerido como uma estratégia também associada à alimentação, mostrando uma maneira oportunista dos botos explorarem as direções e velocidades das correntes de maré, forrageando por vezes a favor e por outras contra o sentido das correntes.
A maior ocorrência do boto cinza em determinadas fases da maré, deve estar relacionada à disponibilidade local de peixes, cujas movimentações diferentes em cada fase de maré, atraem os seus predadores (Geise, 1989; Oliveira ., 1995; Rossi Santos, 2006). Estas diferenças encontradas entre as áreas distintas também pode estar relacionada à metodologia utilizada em cada pesquisa, já que não há uma padronização nos intervalos de tempo estabelecidos para cada nível de maré nos estudos envolvendo
.
ocorrência concordam com dados já publicados onde relatam que estas categorias comportamentais são as mais freqüentemente observadas quanto ao uso dos habitats costeiros e de estuários (Geise, 1999; Edwards & Schnell, 2001; Lodi, 2002; Simão & Poletto, 2002; García & Trujillo, 2004; Santos, 2004; Daura Jorge ., 2005; Santos ., 2008; Cremer ., 2009). A importância das atividades de alimentação está amplamente associada à produtividade do local e as grandes migrações de presas, o que fica evidente em ambientes de estuário, já que estes são locais de grande concentração de nutrientes e que sustentam uma considerável cadeia alimentar, desde pequenos filtradores até grandes predadores como os golfinhos (Simões Lopes, 2005).
O alto índice de deslocamento também pode ser um reflexo da disponibilidade e distribuição dos recursos alimentares, estando relacionado aos comportamentos exploratórios e de procura de presas, bem como a migração para área mais internas do estuário ou saída para o mar aberto. Ressaltando que a procura e obtenção de alimento representam, em conjunto, a maior parcela do orçamento temporal da fase ativa de um animal (Silva ., 2008). Desse modo, os animais dispensam várias horas do dia à ingestão dos recursos alimentares, principalmente quando esses se encontram dispersos no ambiente ou são de difícil acesso para os indivíduos (Lemon, 1991).
A socialização, ainda que tenha sido menor quando comparada ao deslocamento e forrageio, pode ser considerada freqüente. Collaço (2008) também avaliou que a ocorrência da socialização foi alta para o Porto de Maceió. O tempo que os animais passam engajados em atividades sociais é proporcional a eficiência do forrageio, a qual está diretamente ligada à riqueza do habitat e abundancia e disponibilidade do alimento. Quanto maior a eficiência, mais rápido a saciedade dos animais é alcançada e menos tempo é gasto procurando presas e, assim, mais tempo é disponibilizado para a realização dos outros comportamentos (Karczkmarski & Cockcroft, 1999; Bearzi 1999; Neumann, 2001).
padrão semelhante foi observado para os botos na Baía de Guanabara e em Cananéia (Geise, 1991; Geise 1999).
Para muitas espécies de mamíferos, o forrageio ocorre concentrado em um longo e contínuo período do dia, quando o indivíduo busca adquirir a maior quantidade possível de alimento para suprir suas necessidades energéticas diárias. Enquanto há outros casos em que os indivíduos intercalam essa categoria com outras atividades de seu repertório comportamental, alimentando se em períodos curtos e reincidentes (Richards, 2002). A divisão horária da atividade alimentar é esperada para espécies fotossensíveis como os mamíferos, uma vez que permite ao animal aproveitar de maneira satisfatória as oscilações diárias das condições do ambiente, inclusive no que se refere à disponibilidade de presas (Malpaux ., 2001).
Assim como Silva . (2008) observaram em estudo realizado no litoral Sul do Rio Grande do Norte, a maior intensidade do comportamento alimentar do botos verificada neste estudo ocorreu nos horários próximos ao meio dia (fim da manhã e inicio da tarde). Pode se considerar que esta intensidade mantenha alguma relação com a elevação da luminosidade nesses horários. Como os golfinhos são fotossensíveis e utilizam a visão, além da ecolocalização, para localizar objetos na água (Herman, 1991) é provável que a maior intensidade dos raios solares que penetram na coluna d’água neste período favoreça a localização das presas com maior eficácia.
Apoiando esta visão,Gubbins (2002) afirmam que asáreas de concentração de uma espécie podem estar relacionadas às características topográficas ou concentração de recursos alimentares. No caso do boto cinza, tem sido reportado que este golfinho utiliza intensamente áreas com relevo de fundo que possibilitam encurralar o cardume e que possam reduzir o custo energético da alimentação (Lodi, 2002; Monteiro Filho, 1995). Além disso, o uso de uma área para a realização das atividades vitais de uma espécie pode demonstrar a forte relação que os animais apresentam com certos tipos de
hábitats, os quais proporcionam condições favoráveis ao seu sucesso ecológico.
A partir dos resultados aqui obtidos foi possível verificar a constante presença de S na zona estuarina do Rio Sergipe, mostrando se como uma importante área de ocorrência da espécie. O período do dia e estado da maré influenciou esta ocorrência, sendo maior durante o turno da manhã e durante o estado de maré vazante. Apesar disso, a variação da maré não exerceu influência significativa sobre o comportamento. Mesmo assim, o forrageio reduziu durante a maré alta, enquanto que a socialização foi maior neste estado de maré. Inclusive, o alto índice dos comportamentos de deslocamento e forrageio indica o principal uso da região como área de alimentação, o que pode estar relacionado às condições ecológicas e a disponibilidade de alimento na região.
Abramsky, Z., Rosenzwig, L., Subbach, A. (2002). Measuring the benefit of habitat selection.< ., vol. 13 Nº 4: 497 502.
Almeida, M.V.O. & Couto, E.C.G. (1994). Variação sazonal da macrofauna bêntica de uma planície de maré organicamente enriquecida por dejetos domésticos, na região
urbana da cidade de Aracajú Sergipe (Brasil). <
= /8 >: 394.
Alcock, J. (2001). Animal Behavior: An Evolutionary Approach. Seventh edition. Arizona State University.
Altmann, J. (1974). Observational study of behavior: sampling methods.< , 49: 227 267.
Amâncio, S. G. (2001). Influência da evolução costeira na ocupação da costa do estado
de Sergipe por grupos Sambaquieiros. + : . Salvador:
IGEO/UFBA.
Ananias, S. M. A. (2006). Fidelidade a área e padrão de associação em baseado na técnica de foto identificação. +
/ Universidade Federal do Rio Grande do Norte. 48pp.
Araújo, J. P., Passavante, J. Z. O., Souto, A. S. (2001). Behavior of the estuarine dolphin, , at dolphin bay – Pipa – Rio Grande do Norte, Brazil.
7 ?,Recife:v.29, n.2, p.13 23
Araújo, J. P.; M. E. Araújo; A. Souto; C. L. Parente & L. Geise (2007). The influence of seasonality, tide and time of activities on the behavior of (Van Bénéden) (Cetacea, Delphinidae) in Pernambuco, Brazil. Revista Brasileira de Zoologia 24 (4): 1122–1130
Araújo, J. P.; Araújo, M. E.; C. L. Parente & L. Geise (2008). Comportamento de botos cinza ( ) em Pernambuco: influência da sazonalidade, maré, horário de atividades e embarcações. In: Rossi Santos, M. R. & Reis, M. S. @ 6
. $ / + . Ilhéus: Editus, p. 211 219.
Azevedo, A.F., Viana, S.C., Oliveira, A.M. & Van Sluys, M. (2005). Group characteristics of marine tucuxi ( ) (Cetacea: Delphinidae) in Guanabara Bay, south eastern Brazil. A : <
; B , 85, 209 212.
Bearzi, G., Politi, E. and Notarbartolo di Sciara, G. (1999). Diurnal behavior of free ranging bottlenose dolphins in the Kvarneric (Northern Adriatic Sea). : :
15(4):1065 97.
Boyd, I.L. (1996). Temporal scales of foranging in a marine predator. ?77:426 434.
Bräger, S. (1993). Diurnal and seasonal patterns of bottleonose dolphin ( ): : . v .9 434 438.
Carr, T., & Bonde, R.K. (1993). Northern distribution record for the tucuxi dolphin. In Abstracts of the 10º Biennial Conference on the Biology of Marine Mammals (p.35). Carvalho, M. E. S. & A. L. Fontes (2007). A carcinicultura no espaço litorâneo Sergipano.8 5 , v.3, n.1, p.87 112.
Carvalho, M. S. & Rossi Santos, M. R. (2008). Avistagens do boto cinza,
, no litoral norte do estado da Bahia, entre 2003 e 2006. In: Rossi Santos, M.
R. & Reis, M. S. S. (Eds) @ 6 . $ / +
. Ilhéus – Editus. 228 234p
Collaço, K. M. S. L. (2008). Uso de habitat, orçamento temporal, e influencia da maré e da geomorfologia do fundo sobre o comportamento do boto cinza Sotalia guianensis, van Benédén 1864 (Cetacea: Delphinidae) no Porto de Maceió Alagoas, Brasil.
+ / Universidade Federal do Rio Grande do
Norte. 90pp
Constantine, R.; Bruton,D. H.; Dennis, T. (2004). Dolphin watching tour boats change
bottlenose dolphin ( ) behavior. < . 117:229
307.
Cremer, M. J.; P. C. Simões Lopes & J. S. R. Pires, (2009) Occupation Pattern of a Harbor Inlet by the Estuarine Dolphin, (P. J. Van Bénéden, 1864) (Cetacea, Delphinidae). Braz. Arch. Biol. Technol. v.52 n.3: pp. 765 774
Da Silva, V.M.F. & Best, R.C. (1996). . Mammalian species, 527, 1 7.
Daura Jorge, F. G., L. L. Wedekin e P. C. Simões Lopes (2004). Variação sazonal da intensidade dos deslocamentos do boto cinza, (Cetacea: Delphinidae), na Baía Norte da Ilha de Santa Catarina. Biotemas 17(1):203 216.
Daura Jorge, F. G., L. L. Wedekin, V. Q. Piacentini e P. C. Simões Lopes (2005). Seasonal and daily patterns of group size, cohesion and activity of the estuarine dolphin, (P.J. van Bénéden) (Cetacea, Delphinidae), in southern Brazil. Revista Brasileira de Zoologia 22:1014 1021.
Defran, R.H. & Weller, D.W. (1999). Occurrence, distribution, site fidelity, and school size of bottlenose dolphins ( ) off San Diego, California. :
Del Claro, K. & Prezoto, F.(2003). As distintas faces do Comportamento Animal. 1. ed. São Paulo: Sociedade Brasileira de Etologia/Editora e Livraria Conceito. v.1. 276 p. De Oliveira, L.V. (2006). Videoidentificação na investigação dos movimentos dos botos cinza, , (Cetacea, Delphinidae) entre as populações presentes nas regiões de Cananéia (SP) e Ilha das Peças (PR2. : , Universidade Federal do Paraná, Curitiba.
Dias, L. I, D. Herzing & L. Flach (2009). Aggregations of Guiana dolphins ( ) in Sepetiba Bay, Rio de Janeiro, south eastern Brazil: distribution patterns and ecological characteristics. Journal of the Marine Biological Association of the United Kingdom, 89(5), 967–973
DNH. Previsões de Maré Terminal Marítimo Inácio Barbosa (Estado de Sergipe). Diretoria de Hidrografia e Navegação. Marinha do Brasil. Carta: 1001. Pode ser acessado em: www.mar.mil.br/dhn/chm/tabuas/index.htm
Edwards, H.H. & Schnell, G.D., (2001). Status and ecology of in the Cayos Miskito Reserve, Nicaragua.: : , 19, 445–472.
Flores, P.A.C. (1999). Preliminary results of a photoidentification study of the marine tucuxi in southern Brasil.: : . 15: 840 847.
Flores, P.A.C. (2002). Tucuxi. In: Perrin, W.F., Würsig, B., Thewissen, J.G.M. (eds.), Encyclopedia of Marine Mammals (pp. 1267 1269). San Diego: Academic Press.
Flores, P.A.C. & Bazzalo, M. (2004) Home ranges and movement patterns of the marine tucuxi dolphin, , in Baia Norte, Southern Brasil. =
A : . 3 (1): 37 52.
Flores, P. A. C & Da Silva, V. M. F (2009) Tucuxi and guiana Dolphin
and $ ? , 2nd Ed. (Perrin WF,
Würsig B, Thewissen JGM, eds.) Academic Press, Amsterdam, pp. 1188 1192.
Freitas, E. G., & Nishida, S. M. (2007). Métodos de estudos do comportamento animal. In: M. E. Yamamoto & G. L. Volpato, $ C D (pp. 39 64). Natal, RN: Editora da Universidade Federal do Rio Grande do Norte.
García, C. & Trujillo, F., (2004). Preliminary observations on habitat use patterns of the marine tucuxis, , in Cispatá Bay, Colombian Caribbean coast.
= A : , 3, 53–60.
Geise, L., Gomes, N., Cerqueira, R. (1999) Behavior, habitat use and population size of (Gervais, 1953) (Cetacea, Delphinidae) in the Cananéia estuary region, São Paulo,< 8 < < ., 59 (2) 183 194.
Gnone, G.; Benoldi, C. ; Bonsignore, B. & Fognani, P. (2001). Observations of rest
behaviours in captive bottlenose dolphins ( ). : . 27
(1):29 33.
Goodenough, J.; Mcguire B.; Wallace, R. (2000) Perspectives on Animal Behavior. 2 ed. New York: John Wiley and Sons. 560pp.
Gubbins, C. (2002). Association patterns of resident bottlenose dolphins ( ) in a South Carolina estuary. Aquatic Mammals, 28(1), 24 31.
Guilherme Silveira, F. R. & Silva, F. J. L. (2009). Diurnal and tidal pattern influencing the behaviour of on the north eastern coast of Brazil.A
< ; B . Publicado " .
Hanson, M.T. & Defran, R.H. (1993). The behavior and feeding ecology of the Pacific
coast bottlenose dolphin, . : 19(3):127 42.
Hardt, F. A. S. (2005). Padrões de residência do golfinho
(CETACEA, DELPHINIDAE) na Baía da Babitonga, litoral norte de Santa Catarina, Brasil. Dissertação de mestrado, Universidade Federal do Paraná, Curitiba, Brasil. 120 pp.
Hayes, A. J. S. (1999). Aspectos da atividade comportamental diurna da forma marinha do tucuxi "Sotalia fluviatilis" (Gervais, 1853) (Cetacea Delphinidae), na Praia de
Iracema (Fortaleza Ceará Brasil). : = + ,
Universidade do Algarve, Faro, Portugal.
Herman, L. M. (1991). What the dolphin knows, or might knows, in its natural world.
In: Pryor, K. & Norris, K. S. (Eds) $ / '' ,
Berkeley:University of California Press. 256p.
Hetzel, B. & L. Lodi (1993). Baleias, botos e golfinhos: guia de identificação para o Brasil. Rio de Janeiro, Nova Fronteira, 279p.
Jesus, A.H. (2004). Perfil comportamental do boto cinza, , (Gervais, 1853) (Delphinidae: Cetacea) no litoral sul do Rio Grande do Norte, Brasil.: , Universidade Federal do Rio Grande do Norte, Natal, Brazil.
Jesus, A.H., Farias, K.L.M., Santos, E.A.P., Silva, E.M., Sobral, I.S., Oliveira, M.A. & Donald, R.D.M. (2002). Análises preliminares da ocorrência do boto cinza (Sotalia
guianensis) no litoral sul de Sergipe, Brasil. EE .
Natal.
de Especialistas em Mamíferos Aquáticos da América Latina.= 8 Quito, Equador.
Karczmarski, L. & Cockroft, V.G., (1999). Daylight behaviour of humpback dolphins
in Algoa Bay, South Africa. A :
< ?, 64, 19–29.
Krebs, J.R. & Davies, N.B. (1996). Introdução à ecologia comportamental. 3ª ed. São Paulo: Atheneu. 420p.
Lemon, W. C. (1991). Fitness consequences of foraging behaviour in the zebra finch. . 352:153 155
Leszek, K.; Cockroft, V. G.; Mclachlan, A. (2000). Habitat Use and Preferences of Indo Pacific Humpback Dolphins in Algoa Bay, South Africa. : : . 16 (1): 65 79.
Link, L., O. (2000). Ocorrência, uso do habitat e fidelidade ao local do boto cinza, , Gervais, 1853 (Mammalia: Cetacea), no litoral sul do Rio Grande do Norte. 75 p. Dissertação de Mestrado. Universidade Federal do Rio Grande do Norte. Lodi, L.F., (2002) Uso do hábitat e preferências do boto cinza,
(Cetacea, Delphinidae) na Baía de Paraty, Rio de Janeiro. : , Universidade Federal Rural do Rio de Janeiro, Brazil.
Lodi, L.F. (2003). Tamanho e composição de grupo dos botos cinza,
(van Bénéden, 1864) (Cetacea, Delphinidae), na Baía de Paraty, Rio de Janeiro, Brasil. F 8 3 25 (2), 135 146.
Lusseau, D. (2003). Effects of tour boats on the behavior of bottlenose dolphins: Using Markov Chains to Model Anthropogenic Impacts. < ?. 17 (6): 1785 1793.
Malpaux, B., Migaud, M., Tricoire, H.& Cheminneau,P. (2001) Biology of mammalian photoperodism and critical role of the pineal gland and melatonin.A < ? 8 ? 16: 336 347.
Mann, J. (2000). Unraveling the dynamics of social life: long term studies and observational methods. In: Mann, J., Connor, R.C., Tyack, P.L. & Whitehead, H. (eds.), Cetacean Societies (pp. 45 64). Chicago: University of Chicago Press. Mann, J., Connor, R.C., Tyack, P.L. & Whitehead, H. (eds.) (2000). Cetacean Societies. Chicago: University of Chicago Press. 433p.
Meireles, A. C. O.; A. A. Campos; Antonio A. Fonteneles Filho; M. E. Yamamoto & S. Chellappa (2008) Fidelidade á área e tamanho de grupo do boto cinza,
, na Praia de Iracema, Fortaleza CE. In: Rossi Santos, M. R. & Reis, M. S. S.
(Eds) @ 6 . $ / + . Ilhéus –
Monteiro Filho, E. L. A. 1991. Comportamento de caça e repertório sonoro do golfinho (Cetacea: Delphinidae) na região de Cananéia, Estado de São Paulo. Tese de Doutorado, Instituto de Biociências. Universidade Estadual de Campinas, Campinas.
Nascimento, L. F (2006). Boto cinza ( , Van Bénédén,1864) (Cetacea: Delphinidae): atividade aérea, forrageio e interações interespecíficas, na Praia de Pipa (Tibau do Sul – RN) e estudo comparativo entre duas populações do nordeste do Brasil. / . Universidade Federal do Rio Grande do Norte. 125pp.
Nascimento, L. F.; . P. I. A. P. Medeiros & M. E. Yamamoto (2009). Descrição do Comportamento de Superfície do Boto Cinza, , na Praia de Pipa – RN. Psicologia: Reflexão e Crítica, 21(3), 509 517. Disponível em www.scielo.br/pr Neumann, D.R. (2001). The activity budget of free ranging common dolphin ( ) in the northwestern Bay of Plenty, New Zealand.
: ,"2, 121–136.
Oliveira, J.A., Ávila, F.J.C., Alves Júnior, T.T., Furtado Neto, M.A.A.; Monteiro Neto, C. (1995) Monitoramento do Boto cinza, (Cetacea: Delphinidae) em Fortaleza, Estado do Ceará, Brasil. Arq. Ciên. Mar. Fortaleza,. 29 (1 2) 28 35.
Reis, M. S. S dos; J. L. Spínola; R.N. G. Batista; T. Foester; L. M. Bauer & L. C. Fernandes (2008). Comportamento do boto na Barra do Paraguaçu – Bahia. In: Rossi Santos, M. R. & Reis, M. S. @ 6 . $ /
+ . Ilhéus: Editus, p. 235 240.
Richards, S. A. (2002) Temporal partitioning and aggression among forangers: modeling the efects of stochasticity and individual state. < ? 13: 427 438.
Rosenzweig, M.L. (1981). A theory of habitat selection. ., 62: 327 335. Rossi Santos, M.R. (2006). Ecologia comportamental do boto cinza,
(Van Bénedén, 1874) (Cetacea: Delphinidae) na região extremo sul do Estado da Bahia,
Nordeste do Brasil. + : G . Universidade Federal do
Paraná. 98pp.
Rossi Santos, M.R., L. L. Wedekin & R. S. Souza Lima (2006). Distribution and habitat use of small cetaceans off Abrolhos Bank, eastern Brazil. Lajam 5(1): 23 28
Rossi Santos, M.R.; L.L. Wedekin & E.L.A. Monteiro Filho. (2007). Residence and site fidelity of in the Caravelas River Estuary, eastern Brazil. A
: < ; B HI$207 212.
Santos, U. A;Y. Le Pendu & M. R. Alvarez (2008). Uso da Baía do Pontal (Ilhéus, Bahia) pelo boto cinza, . In: Rossi Santos, M. R. & Reis, M. S.
@ 6 . $ / + . Ilhéus: Editus,
p. 248 254.
Santos, M. C. O., Oshima, J. E. F., Pacífico, E. S. & Silva, E. (2010). Guiana dolphins, (Cetacea: Delphinidae), in the Paranaguá Estuarine Complex: insights on the use of area based on the photo identification technique.G , 27 (3): 324–330
Shane, S.H. (1990). Behavior and ecology of the bottlenose dolphin at Sanibel Island, Florida. In: S. Leatherwood and R.R. Reeves (Eds.) < . Academic Press, San Diego. pp 42 265.
Silva Jr., J. M. (2008). Ecologia Comportamental de Golfinhos na Natureza: metodologias e objetivos. In: Rossi Santos, M. R. & Reis, M. S. @ 6
. $ / + . Ilhéus: Editus, p. 255 267.
Silva, F. J. L., Souza, V. L. A., & Firmino, A. S. L. (2008) Comportamento e habito alimentar do boto cinza no Rio Grande do Norte. In: Rossi Santos, M. R. & Reis, M. S.
S. (Eds) @ 6 . $ / + .
Ilhéus – Editus. 116 128p
Silva, F. J. L. & Silva, J. M. (2009). Circadian and seasonal rhythms in the behavior of
spinner dolphins ( ).: : , vol. 25, nº1, pp. 176
186.
Silveira, F. R. G. (2006). Variação diária e anual de freqüência e atividade do boto
cinza, em Pipa, nordeste do Brasil. +
/ Universidade Federal do Rio Grande do Norte. 65pp.
Simão, S.M. & F.R. Poletto (2002). Áreas preferenciais de pesca e dieta do ecótipo marinho do boto cinza ( ) na Baía de Sepetiba, RJ.5
J(1): 18 25
Simões Lopes, P.C. (1986). Sobre a ampliação da distribuição do gênero Sotalia Gray, 1886 (Cetacea, Delphinidae) para as águas do Estado de Santa Catarina, Brasil. 2ª Reunião de Trabalho de Especialistas em Mamíferos Aquáticos da América do Sul. Rio de Janeiro.
Simões Lopes, P. C. (2005). O luar do delfim: A maravilhosa aventura da história natural Letradágua, Joinville, 302 p.
), em seu ambiente natural. / Natal – RN, v. 7, n. 1, p. 165 – 171.
Wedekin, L. L. & Rossi Santos, M. R. (2008). Da Área de Vida à Estrutura de Populações: A Distribuição do Boto cinza em Diferentes Escalas Espaciais no Litoral Sul da Bahia e Norte do Espírito Santo. @ 6 . $ /
+ , Ed. M. R. Rossi Santos & M. S. S. Reis. Ilhéus: Editus. p137 143
Wells, R., 1991. The role of long term study in understanding the social structure of a
bottlenose dolphin community. In $ '' (ed. K.
"
! "
1
Programa de Pós graduação em Psicobiologia, Departamento de Fisiologia. Universidade Federal do Rio Grande do Norte (UFRN). Campus Central. Caixa postal 1511 CEP: 59078 970. Natal, RN. Brasil.
E mail:maisa_lima@yahoo.com
2
Universidade do Estado do Rio Grande do Norte (UERN). Laboratório de Sistemática e Ecologia Animal. Dept. de Ciências Biológicas – Fac. De Ciências Naturais. Av. Prof. Antônio de Campus, s/n. Campus Central – UERN. CEP: 59600 970. Mossoró, RN. Brasil.
E mail:flaviogolfinho@yahoo.com.br
RESUMO
A opção dos animais pela vida em grupo ocorre em função da relação de custo e benefício desta estratégia social em função da diminuição do risco de predação, aumento das chances de reprodução e obtenção de alimento. O tamanho e a estabilidade dos agrupamentos animais estão em função direta da espécie, do comportamento e do ambiente. Com o objetivo de averiguar o tamanho e a composição dos agrupamentos de boto cinza, , de acordo com as classes de idade (animais adultos e imaturos) e verificar a existência de uma relação com o repertório comportamental, procederam se com observações dos grupos focais de botos cinza, no período de Março de 2009 a Fevereiro de 2010. As avistagens ocorreram em uma zona estuarina do estado de Sergipe/Brasil (10º55’37.02’’S e 37º02’34.43’’W), a partir de ponto fixo e os registros instantâneos dos dados efetuados a cada 5 min., no intervalo das 6:00 as 18:00, em turnos alternados. Como em outras regiões do nordeste do Brasil, pequenos agrupamentos formados de 2 a 12 indivíduos foram mais comuns, com um único agrupamento por dia. A alta freqüência de animais imaturos pode indicar que esta área do estuário é utilizada como área de cria e cuidado parental dos filhotes e animais jovens, já que os imaturos estiveram bastante associados aos adultos e o acompanhamento nas atividades de forrageio/ alimentação pode estar relacionado a uma forma de aprendizagem ou treinamento desse comportamento. Animais solitários passam mais tempo em deslocamento do que animais em agrupamentos, podendo estar relacionado à busca do alimento. Agrupamentos só de adultos ficaram mais envolvidos em atividades de forrageio / alimentação, enquanto que os agrupamentos somente de imaturos envolvem se em comportamentos sociais mais freqüentemente.
Nos delfinídeos, o comportamento pode ser influenciado por diversos fatores ecológicos e as respostas comportamentais (flutuações do tamanho, composição das agregações e a forma de uso de área) podem apresentar diferenças consideráveis dependendo do habitat onde os animais são estudados (Shane, 1990). A organização social dos animais sofre intensa influência destas pressões seletivas e isso pode ser detectado nas flutuações diárias e sazonais do tamanho e da composição dos grupos na natureza (Goodenough , 2000). Desse modo, as atividades realizadas pelos indivíduos numa área nas diferentes estações do ano podem determinar o tamanho e a composição do grupo, tendo a obtenção de energia como a principal pressão seletiva atuante nesta característica (Danchin ., 2005; Grigg & Markowits, 1997; Pryor & Shallenberger, 1991).
Dessa forma, a ecologia comportamental da maioria dos golfinhos reflete estratégias adaptativas específicas moldadas pelas condições ecológicas nas quais uma população vive (Defran & Weller, 1999). Sendo assim, o tamanho do grupo na maioria das espécies sociais é uma compensação para a otimização da eficiência do forrageio e a minimização dos ricos de predação (Krebs & Daves,1996).
O tamanho e a estabilidade dos agrupamentos animais estão em função direta da espécie, do comportamento e do ambiente, mas, para algumas espécies o tamanho dos agrupamentos depende de comportamentos específicos (Silva Jr., 2008). Segundo Bel’kovich (1991), a estrutura de grupo dos golfinhos é um mecanismo muito sensível para otimizar o uso espacial e temporal do ambiente e para adequar o método de caça às condições ambientais.
A opção dos animais pela vida em grupo ocorre em função da relação de custo e benefício desta estratégia social em função da diminuição do risco de predação, aumento das chances de reprodução e obtenção de alimento (Silva Jr., 2008). Em algumas espécies os indivíduos podem formar grupos por causa dos benefícios que obtêm até mesmo pela presença ou comportamento do outro indivíduo (formação de grupo mutualístico), e essa formação de grupo só é favorável quando os benefícios superam os custos (Connor , 2000).