UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE PROGRAMA DE PÓS-GRADUAÇÃO EM ECOLOGIA
MARIA DA CONCEIÇÃO DE SOUZA
INFLUÊNCIA DAS MUDANÇAS CLIMÁTICAS NA ESTRUTURA FUNCIONAL DA COMUNIDADE FITOPLANCTÔNICA EM UM RESERVATÓRIO DA REGIÃO DO
SEMIÁRIDO
MARIA DA CONCEIÇÃO DE SOUZA
INFLUÊNCIA DAS MUDANÇAS CLIMÁTICAS NA ESTRUTURA FUNCIONAL DA COMUNIDADE FITOPLANCTÔNICA EM UM RESERVATÓRIO DA REGIÃO DO
SEMIÁRIDO
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Ecologia, Universidade Federal do Rio Grande do Norte, como requisito parcial à obtenção do título de Mestre em Ecologia.
Orientadora: Vanessa Becker
Co-orientadora: Luciane O. Crossetti
MARIA DA CONCEIÇÃO DE SOUZA
INFLUÊNCIA DAS MUDANÇAS CLIMÁTICAS NA ESTRUTURA FUNCIONAL DA COMUNIDADE FITOPLANCTÔNICA EM UM RESERVATÓRIO DA REGIÃO DO
SEMIÁRIDO
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Ecologia, Universidade Federal do Rio Grande do Norte, como requisito parcial à obtenção do título de Mestre em Ecologia.
Aprovada em: 07/03/2014
AGRADECIMENTOS
Ao Programa de Pós Graduação em Ecologia da UFRN pela estrutura e oportunidade proporcionada.
À FINEP e CAPES pelo apoio financeiro e pela concessão da bolsa de estudos, respectivamente.
Ao Laboratório de Recursos Hídricos e de Saneamento Ambiental (LARHISA) pela estrutura onde realizei as análises químicas e biológicas deste projeto.
À Professora Dra. Vanessa Becker pela oportunidade de desenvolver meu mestrado sob sua orientação na medida certa, aprendi muito com você.
À professora Dra. Luciane O. Crossetti, a mentora do projeto, mesmo longe sempre muito presente para tirar dúvidas, ajudar na estatística e ainda dar um essencial apoio psicológico.
Ao professor Márcio Zikán Cardoso (UFRN) e ao técnico de laboratório Douglisnilson de Morais Ferreira (IFRN) por permitir que eu utilizasse as incubadoras de seus laboratórios para a execução dos experimentos.
À prestigiosa banca Dra. Renata Fátima Panosso e Dra. Lúcia Helena Sampaio da Silva, pelas contribuições neste trabalho.
À essencial ajuda das minhas colegas de laboratório, Thársia da Silva Pinto e Radmila Salviano Ferreira, que me ajudaram nas análises durante os experimentos, sem vocês não teria conseguido nada.
À Jurandir Junior por todo carinho, companheirismo, apoio, paciência e ajuda braçal durantes os experimentos.
A minhas queridas companheiras de laboratório Mariana Rodrigues, Kátia Miranda, Érika Kalline e Ângela Marília que me ensinaram as análises químicas e ainda proporcionaram muitos momentos de descontração em dias de pós-coleta.
Ao Sr. Assis (Coleguinha), nosso motorista, por tornar as coletas menos cansativas com suas hilárias histórias de vida e por sempre estar disposto a nos ajudar.
À minha família, em especial minha mãe por todo apoio e carinho nessa fase onde ficamos distantes fisicamente, mas unidades no coração.
À Deus, que me permitiu concluir um grande objetivo de vida que foi o mestrado em Ecologia.
RESUMO
“Estás a rir-te de mim, Nunca me riria de quem me fez sair pela porta das decisões, Desculpa-me, E não tornarei a passar por ela, suceda o que suceder.”
RESUMO
O Nordeste é a região do Brasil mais vulnerável aos riscos da variabilidade climática. Para o semiárido brasileiro é esperada uma redução nos índices totais de precipitação e um aumento no número de dias secos. Tais mudanças previstas pelo IPCC (2007) afetarão a intensidade e duração de chuvas e secas que poderão promover a dominância de cianobactérias, afetando assim, a qualidade da água dos reservatórios no semiárido. O objetivo deste trabalho foi avaliar os efeitos do aumento de temperatura combinado ao enriquecimento de nutrientes sobre a estrutura funcional da comunidade fitoplanctônica de um reservatório mesotrófico no semiárido, no cenário mais pessimista de mudanças climáticas previstas pelo IPCC (2007). Foram realizados dois experimentos um no período chuvoso e outro no seco. A água coletada no reservatório foi enriquecida com nutrientes (nitrato e fósforo solúvel reativo) em diferentes concentrações. Os microcosmos foram submetidos a duas temperaturas diferentes, controle (média de cinco anos da temperatura do ar no reservatório) e aquecimento (4 °C acima da temperatura controle). Os resultados deste trabalham mostraram que o aquecimento e o enriquecimento nutricional beneficiaram principalmente os grupos funcionais de cianobactérias, mas também alguns grupos compostos por clorofíceas. No período chuvoso foi verificado o aumento da biomassa de grupos funcionais de algas oportunistas, como o F (algas verdes coloniais com mucilagem) e X1 (algas nanoplanctônicas de sistemas
eutrofizados). No experimento do período chuvoso também foi averiguado um aumento na biomassa total, na riqueza e diversidade da comunidade. No período seco houve uma maior contribuição na biomassa relativa de algas filamentosas, com uma substituição do grupo S1
(cianobactérias filamentosas não-heterocitadas) pelo H1 (cianobactérias filamentosas
heterocitadas) nos tratamentos enriquecidos. Além disso, ocorreu também perda na biomassa total, riqueza de espécies e diversidade da comunidade. Assim, efeitos da manipulação da temperatura e/ou nutrientes sobre a comunidade fitoplanctônica do reservatório Ministro João Alves provocaram mudanças na riqueza de espécies, na diversidade da comunidade e na sua composição funcional, sendo o período seco o que apresentou maior suscetibilidade ao aumento na contribuição de cianobactérias heterocitadas potencialmente tóxicas.
ABSTRACT
The Brazilian Northeast is the most vulnerable region to climatic variability risks. For the Brazilian semi-arid is expected a reduction in the overall rates of precipitation and an increase in the number of dry days. These changes predicted by the IPCC (2007) will intensify the rainfall and droughts period that could promote the dominance of cyanobacteria, thus affecting the water quality of reservoirs, that are most used for water supply, in the semi-arid. The aim of this study was to evaluate the effects of increasing temperature combined with nutrient enrichment on the functional structure of the phytoplankton community of a mesotrophic reservoir in the semi-arid, in the worst case scenario of climate change predicted by the IPCC (2007). Two experiments were performed, one in a rainy season and another in the dry season. In the water sampled, nutrients (nitrate and orthophosphate) were added in different concentrations. The microcosms were submitted to two different temperatures, five-year average of air temperature in the reservoir (control) and 4°C above the control temperature (warming). The results of this study showed that warming and nutrient enrichment benefited mainly the functional groups of cyanobacteria. During the rainy season it was verified the increasing biomass of small functional groups of unicellular and opportunists algae such as F (colonial green algae with mucilage) and X1 (nanoplanktonic
algae of eutrophic lake systems). It was also observed an increasing in total biomass, in the richness and diversity of the community. In the dry season experiment there was a greater contribution in the relative biomass of filamentous algae, with a replacement of the group S1
(non-filamentous cyanobacteria with heterocytes) for H1 (filamentous cyanobacteria with
heterocytes) in nutrient- enriched treatments. Moreover, there was also loss in total biomass, species richness and diversity of the community. The effects of temperature and nutrients manipulation on phytoplankton community of reservoir Ministro João Alves provoked changes in species richness, the diversity of the community and its functional composition, being the dry period which showed the highest susceptibility to the increase in the contribution of potentially toxic cyanobacteria with heterocytes.
LISTA DE ILUSTRAÇÕES
Figura 1 Delineamento experimental. Cada retângulo representa uma incubadora de simulação de temperatura e cada círculo representa um microcosmo (béquer com 1L de água coletada). As letras representam os
tratamentos a partir da média de dois anos de monitoramento. C: controle
sem adição de nutrientes; P2: duas vezes a concentração de fósforo solúvel reativo; N2: duas vezes a concentração de nitrato; P2+N2: combinação de P2 e N2; P4: quatro vezes a concentração de fósforo solúvel reativo; N4: quatro vezes a concentração de nitrato e P4+N4: combinação de P4 e N4. ... 15 Figura 2 Variação (medianas e quartis, n = 8) da biomassa total (mg.L-1)nos
diferentes tratamentos de enriquecimento nutricional e temperatura, para o período chuvoso (a.) e período seco (b.). Barras brancas representam os tratamentos da temperatura controle e as cinzas os tratamentos da temperatura de aquecimento. ... 20 Figura 3 Variação (medianas e quartis, n = 8) da riqueza de espécies (n.º spp)
nos diferentes tratamentos de enriquecimento nutricional e temperatura, para o período chuvoso (a.) e período seco (b.). Barras brancas representam os tratamentos da temperatura controle e as cinzas os tratamentos da temperatura de aquecimento. ... 21 Figura 4 Variação (medianas e quartis, n = 8) da diversidade da comunidade
fitoplanctônica (bits.mg-1) nos diferentes tratamentos de enriquecimento nutricional e temperatura, para o período chuvoso (a.) e período seco (b.). Barras brancas representam os tratamentos da temperatura controle e as cinzas os tratamentos da temperatura de aquecimento. ... 22 Figura 5 Biomassa relativa (%) dos grupos funcionais descritores nos diferentes
LISTA DE TABELAS
SUMÁRIO
1 INTRODUÇÃO ... 11
2 MATERIAL E MÉTODOS ... 14
2.1 Delineamento experimental ... 14
2.2 Análises químicas e fitoplanctônicas ... 16
2.3 Análise Estatística ... 16
3 RESULTADOS ... 17
3.1 Efeito do Aquecimento ... 17
3.2 Efeito do tratamento de nutrientes ... 23
3.3 Efeito do tratamento integrado de temperatura e nutrientes ... 23
4 DISCUSSÃO ... 25
5 CONCLUSÃO ... 29
1 INTRODUÇÃO
O clima é o principal motor de processos biológicos, operando a partir de indivíduos sobre os ecossistemas, afetando vários aspectos da vida humana. Presume-se que as alterações climáticas possam causar impactos potencialmente graves sobre os sistemas ecológicos e sociais. Mudanças na distribuição e abundância das espécies podem aumentar o risco de extinção, alterar a estrutura da comunidade e perturbar interações ecológicas e funcionamento dos ecossistemas (Mora et al., 2013).
Respostas químicas e biológicas induzidas pelo clima em ambientes aquáticos continentais são questões importantes, pois alteram as taxas de reprodução e assimilação de nutrientes da comunidade e, vários estudos ecológicos e biogeoquímicos têm mostrado um acoplamento entre as temperaturas, a química da água, fisiologia dos organismos, a abundância das populações e a estrutura das comunidades (Blenckner et al., 2007).
Globalmente, segundo previsões do Painel Intergovernamental sobre Mudanças Climáticas - IPCC (2007), a temperatura e a precipitação mudarão drasticamente nas próximas décadas. Essas mudanças irão afetar outras condições ambientais, especialmente em ecossistemas aquáticos, tais como a carga de nutrientes e a mistura da coluna d’água (Meehl et al., 2007). Assim, espera-se que a qualidade das águas continentais seja drasticamente alterada, devido às modificações no regime térmico dos ambientes aquáticos que promoverão um maior tempo de estratificação da coluna d’água, agravando a anoxia do hipolímnio e estimulando a liberação de nutrientes do sedimento, alimentando assim florações de algas (Paerl, 1988; Paerl & Paul, 2011).
O Brasil é vulnerável às mudanças climáticas atuais e mais ainda àquelas que se projetam para o futuro, especialmente quanto aos extremos climáticos. Dentre as áreas mais vulneráveis está o Nordeste, região mais exposta aos riscos da variabilidade climática, a uma possível aridização e subsequente desertificação devido às mudanças climáticas (Nobre et al., 2007; Ambrizzi et al., 2007; Morengo et al., 2009). As precipitações nessa região variam entre 400 e 800 mm, com a estação chuvosa ocorrendo geralmente entre janeiro e julho e a estação seca, marcada quase que pela total ausência de precipitação, de agosto a dezembro (Bouvy et al., 1999).
consequências dessas mudanças no clima está a ocorrência de secas mais intensas e frequentes, influenciando diretamente a dinâmica dos ecossistemas aquáticos. Dessa forma, nos reservatórios do semiárido brasileiro que possuem características peculiares, tais como baixo fluxo, alto tempo de residência da água associada a um balanço hídrico negativo e altas temperaturas durante a maior parte do ano, tais mudanças favoreceriam o acúmulo de nutrientes, tornando-os vulneráveis a eutrofização (Bouvy et al., 2000; Eskinazi -Sant’Anna et al., 2007), comprometendo de forma mais intensa a qualidade da água (Morengo et al., 2011). Os impactos das mudanças climáticas sobre o plâncton são observados principalmente como mudanças na dinâmica sazonal, composição de espécies e estrutura de tamanho da população (Winder & Sommer, 2012). De todas as espécies que compõem o fitoplâncton em uma comunidade natural, as espécies do grupo das cianobactérias são as que têm causado maior preocupação e especulações sobre as consequências das mudanças climáticas, devido a seu potencial para florações (Paerl & Huisman, 2008). Ademais, o enriquecimento de nutrientes, especialmente pelo fósforo e nitrogênio, têm aumentado as taxas de produção primária e estimulado a ocorrência de florações de cianobactérias (Steinberg & Hartmann, 1988; Hallegraeff, 1993).
No âmbito das condições climáticas, as temperaturas elevadas favorecem à redução da diversidade funcional da comunidade fitoplanctônica devido ao desenvolvimento de florações de diversos gêneros de cianobactérias fisiologicamente adaptadas às alterações limnológicas impostas (Robarts & Zohary, 1987; Sukenik et al., 2012; O’Neil et al., 2012). Sendo assim, o enriquecimento de nutrientes nos mananciais promove o crescimento de cianobactérias e as mudanças climáticas funcionam como um catalizador na sua expansão (Paerl & Huisman, 2008, Paerl & Paul, 2012; Moss et al., 2011). Contudo, a resposta das cianobactérias a eutrofização de mananciais e aos efeitos das mudanças climáticas requer ainda estudos mais aprofundados para uma boa gestão de mitigação (Hudnell, 2008; O’Neil, 2011).
taxonômico, pois reflete estratégias de adaptações da comunidade segundo as condições ambientais, tolerância e sensibilidade de cada grupo ao ambiente em que se encontram. Além disso, abordagem de grupos funcionais já foi testada com sucesso em ambientes do semiárido brasileiro (Moura et al., 2007; Mosilani et al, 2010 Moura et al., 2012).
Portanto, sendo os corpos aquáticos do semiárido expostos às alterações climáticas (Morengo et al., 2011), torna-se necessário estudar a dinâmica do fitoplâncton frente ao aumento de temperatura e ao enriquecimento de nutrientes previstos pelo IPCC (2007) para as mudanças climáticas globais, afim de subsidiar conhecimento para o desenvolvimento e planejamento de estratégias de gerenciamento e restauração dos ecossistemas aquáticos (Carvalho & Kirika, 2003).
2 MATERIAL E MÉTODOS
2.1 Delineamento experimental
Foram realizadas duas coletas de água na região pelágica, próxima à barragem do Reservatório Ministro João Alves (6°42'38"S 36°36'39"W), também conhecido como Boqueirão de Parelhas, localizado na bacia hidrográfica Piranhas-Assú no semiárido do Rio Grande do Norte. O reservatório possui uma capacidade máxima de 85x106 m3, porém o seu volume não ultrapassa os 10x106 m3 de água e sua profundidade máxima chega a 13 metros, sendo classificado comomesotrófico (Araújo et al., 2007).
Para os experimentos, as coletas de agua foram realizadas, uma no período chuvoso (maio/2013) e a outra no período seco (setembro/2013). A água coletada foi acondicionada em garrafões de 20 L e levadas ao laboratório para início imediato dos experimentos. O experimento foi realizado em béqueres de vidro transparente de 1 litro de volume de água, com quatro réplicas para os tratamentos e controle, agitados diariamente manualmente e submetidos a um foto período 12 claro/escuro. Os experimentos tiveram duração de 12 dias e a cada três dias foram retiradas 60 mL de amostras de água dos microcosmos para realização das análises químicas e amostragem da comunidade fitoplanctônica. A quantificação do fitoplâncton foi realizada para o primeiro e último dia dos experimentos.
Foram utilizadas duas incubadoras para a simulação das temperaturas controle e aquecimento. A temperatura controle foi calculada por meio da média de cinco anos de dados da temperatura do ar da região do reservatório de Boqueirão de Parelhas, fornecidos pela Empresa de Pesquisas Agropecuárias do Rio Grande do Norte (EMPARN). A temperatura de aquecimento simulou o panorama A2, pior cenário de mudanças climáticas previstas pelo IPCC (2007), com um aumento de 4 °C da temperatura média. Para o período chuvoso a temperatura controle foi 27 °C e a de aquecimento 31 °C. Para o período seco a temperatura controle foi 26 °C e a de aquecimento 30 °C. As incubadoras simulavam as temperaturas independentemente.
solúvel reativo (P2), duas vezes a concentração de nitrato (N2), combinação de P2 e N2 (P2+N2), quatro vezes a concentração de fósforo solúvel reativo (P4), quatro vezes a concentração de nitrato (N4) e a combinação de P4 e N4 (P4+N4). A figura 2 representa o delineamento experimental com temperaturas e tratamentos.
TEMPERATURA CONTROLE TEMPERATURA DE AQUECIMENTO Período chuvoso: 27 °C Período chuvoso: 31 °C
Período seco: 26 °C Período seco: 30 °C
Figura 1 - Delineamento experimental. Cada retângulo representa uma incubadora de simulação de temperatura e cada círculo representa um microcosmo (béquer com 1L de água coletada). As letras
representam os tratamentos a partir da média de dois anos de monitoramento. C: controle sem adição
de nutrientes; P2: duas vezes a concentração de fósforo solúvel reativo; N2: duas vezes a concentração
de nitrato; P2+N2: combinação de P2 e N2; P4: quatro vezes a concentração de fósforo solúvel
reativo; N4: quatro vezes a concentração de nitrato e P4+N4: combinação de P4 e N4.
No experimento do período seco a concentração de NO3- variou de 32,00 a 227,00 µg.L-1 (desvio padrão = 36,14) e o PO4- de 0,57 a 27,71 µg.L-1 (desvio padrão de 6,44) na temperatura de 26 °C, considerando os diferentes tratamentos. Na temperatura de 30 °C a concentração de NO3- variou de 24,50 a 317,00 µg.L-1 (desvio padrão de 51,04) e a PO4- de 0,57 a 32,00 µg.L-1 (desvio padrão = 5,26).
2.2 Análises químicas e fitoplanctônicas
Os parâmetros químicos de qualidade de água utilizados no estudo foram as concentrações de fósforo total (Valderrama, 1981), nitrato (Muller & Weidemann, 1955) e fósforo solúvel reativo (Murphy & Rilley, 1962). O pH foi quantificado através de um medidor eletrônico de pH (HOMIS HPH 1002) e concentrações de oxigênio dissolvido com um oxímetro (Intertherm MO-900).
As populações fitoplanctônicas foram identificadas sempre que possível, em nível de espécie, examinadas em microscópio óptico, através da análise de características morfológicas e morfométricas.
Para análise quantitativa, a abundância fitoplanctônica (ind.mL-1) foi estimada segundo Utermöhl (1958) em microscópio invertido, a um aumento de 400X. Os indivíduos (células, colônias, cenóbios, filamentos) foram enumerados em campos aleatórios (Uhelinger, 1964). O biovolume (mm3.L-1) foi calculado a partir de modelos geométricos aproximados (Hillebrand et al., 1999), assumindo a unidade de peso fresco expressa em massa (mg.L-1). A diversidade foi expressa por bits.mg-1, determinada através do índice de Shannon & Weaver (1963).
As espécies abundantes foram definidas como aquelas que contribuíram com mais de 5% para a biomassa total e classificadas de acordo com a abordagem de grupos funcionais fitoplanctônicas estabelecidas a partir das bases propostas por Reynolds et al. (2002) e Padisák et al. (2009).
2.3 Análise Estatística
nutrientes sobre a estrutura funcional da comunidade fitoplanctônica. Em todas as situações significativas o teste de Tukey HSD a posteriori foi aplicado. Para atender a premissas da ANOVA os dados foram transformados em log (x+1). Todas as análises foram realizadas no programa SYSTAT 12®.
3 RESULTADOS
Foram identificadas 28 espécies fitoplanctônicas no experimento do período chuvoso e 27 no experimento do período seco foram identificadas 27. Em ambos os experimentos as espécies encontradas pertenciam apenas a três classes taxonômicas: Cyanobacteria, Chlorophyceae e Bacillariophyceae. Cyanobacteria apresentou maior percentual de táxons encontrados nas amostras, 57 % em ambos os experimentos. Chorophyceae e Bacillariophyceae representaram aproximadamente 28 e 15%, respectivamente.
Em relação aos grupos funcionais foram encontrados 11 grupos (tabela 1) em ambos os experimentos. Para o experimento do período chuvoso sete grupos (H1, L0, M, S1, B, X1 e
F) foram considerados descritores (biomassa acima ≥ 5%) e para o experimento do período seco foram considerados seis grupos (H1, L0, M, S1, B, X1). Os grupos com mais
representantes foram F, L0 e S1 (Tabela 1).
3.1 Efeito do aquecimento
Em resposta à manipulação da temperatura, a biomassa total da comunidade fitoplanctônica não apresentou variação significativa com o aquecimento (P > 0,05), embora tenha sido observada uma tendência a aumento na temperatura de 31°C (figura 1a), com maior valor de biomassa total encontrado no controle (2,29 mg.L-1). Já no experimento do período seco a biomassa total (figura 1b) apresentou significativa redução com o aquecimento (F = 5,71; P = 0,019), alcançando os menores valores no tratamento P4+N4 de 30 °C (0,035 mg.L-1).
significativa (P > 0,05), mas foi observada uma tendência à redução com o aquecimento (figura 2b), em que os menores valores de riqueza foram constatados (três espécies) nos tratamentos de P2 e P4+N4 de 30 °C.
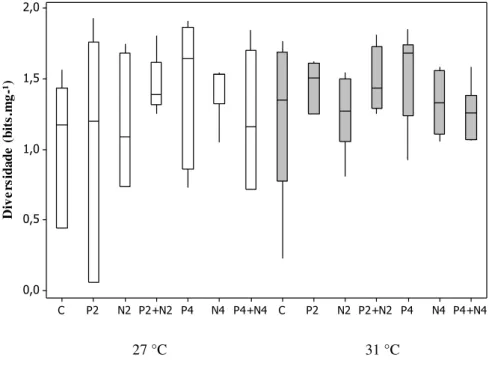
A diversidade no período chuvoso aumentou significativamente (F = 5,08; P = 0,026) com o aquecimento (figura 3a), especialmente no tratamento P4 de 31 °C, chegando a 1,85 bits.mg-1. No experimento do período seco houve uma tendência significativa (F = 13,54; P = 0,00) a redução da diversidade com o aumento da temperatura (figura 3b), chegando ao menor valor de 0,033 bits.mg-1 no tratamento P2 de 30 °C.
O efeito isolado da manipulação da temperatura propiciou alterações na biomassa dos grupos funcionais. No experimento realizado com amostras do período chuvoso, a biomassa aumentou significativamente para os grupos X1 (F = 70,86; P = 0,000) e F (F = 10,38; P =
0,002) e de forma não significante para o grupo H1 (P < 0,05) na temperatura de 31 °C (figura
4a). A biomassa dos grupos S1 e B diminuiu, mas somente de forma significativa para o grupo
B (F = 15,37; P = 0,000). A biomassa dos grupos L0 e M não apresentaram nenhuma
tendência em resposta ao efeito do aquecimento.
Para o experimento do período seco somente a biomassa do grupo L0 mostrou
variação significativa com o aquecimento (F = 10,14; P = 0,002), apresentando tendência à redução. O grupo H1 teve sua biomassa reduzida de forma não significativa (P > 0,05),
enquanto os grupos S1, X1, M e B não variaram suas biomassas com o aumento da
Tabela 1 – Grupos funcionais, espécies descritoras e tolerância/sensibilidade de cada grupo
encontrado nos experimentos do período chuvoso e seco, segundo Reynolds et al. (2002).
Grupo funcional Espécie(s) descritora(s) Tolerância/ Sensibilidade
H1
Dolichospermum planctonica Baixas concentrações de N2/ Mistura da
coluna, limitação de luz e baixas concentrações de fósforo
Aphanizomenon gracile
K Aphanocapsa sp. Sensível a misturas profundas
Aphanotehce sp.
Z Chroococcus sp. Baixas concentrações de nutrientes/ Baixa luminosidade e predação
L0
Coelosphaerium cf. aerogineum Coelosphaerium brasiliensis
Baixas concentrações de nutrientes/ Mistura prolongada da coluna
Radiocystis sp. Gloecocystis sp. Lemmermanniella sp.
M Microcystis aeruginosa Alta incidência de luz/ Escoamento e baixa luminosidade
S1
Pseudanabaena mucicula
Alta deficiência das condições de luz/ Escoamento
Planktolyngbya limnetica Planktothrix isothrix
Pseudonabaenaceae
B Cyclotella sp. Baixa luminosidade/Aumento de pH, estratificação e depleção de Si
D Nitzschia sp. Escoamento/ Depleção de nutrientes
J Crucigenia sp. Sensível ao estabelecimento em condições de pouca luz
Senedesmus sp.
X1 Synechocystis salina Estratificação/ Deficiência de nutrientes e predadores filtradores
Monoraphdium irregulare
F
Kirchneriella lunares
Kirchneriella obesa Baixa concentração de nutrientes, alta
turbidez/ Deficiência de CO2
A.
27 °C 31 °C
B.
26 °C 30 °C
Figura2 – Variação (medianas e quartis, n = 8) da biomassa total (mg.L-1) nos diferentes tratamentos
de enriquecimento nutricional e temperatura, para o período chuvoso (A.) e período seco (B.). Barras brancas representam os tratamentos da temperatura controle e as cinzas os tratamentos da temperatura de aquecimento.
A.
27 °C 31 °C
B.
26 °C 30 °C
Figura 3 – Variação (medianas e quartis, n = 8) da riqueza de espécies (n˚ spp.) nos diferentes tratamentos de enriquecimento nutricional e temperatura, para o período chuvoso (A.) e período seco (B.). Barras brancas representam os tratamentos da temperatura controle e as cinzas os tratamentos da temperatura de aquecimento.
A.
27 °C 31 °C
B.
26 °C 30 °C
Figura 4 – Variação (medianas e quartis, n = 8) da diversidade (bits.mg-1) da comunidade
fitoplanctônica nos diferentes tratamentos de enriquecimento nutricional e temperatura, para o período chuvoso (A.) e período seco (B.). Barras brancas representam os tratamentos da temperatura controle e as cinzas os tratamentos da temperatura de aquecimento.
3.2 Efeito do tratamento de nutrientes
Tanto para o experimento do período chuvoso como para o experimento do período seco a biomassa total da comunidade fitoplanctônica (figura 1a e 1b) não foi influenciada pelo incremento de nutrientes (P > 0,05).
A riqueza de espécies no experimento do período chuvoso mostrou variação significativa entre os tratamentos (F = 3,62; P = 0,003), sendo o tratamento P4 o único estatisticamente diferente do tratamento controle (F= 3,62; P = 0,003), com tendência a recrutar mais espécies (14 espécies, figura 2b). Já para o experimento do período seco não houve variação significativa (P > 0,05) quanto ao incremento de nutrientes (figura 2b).
Em relação às respostas da diversidade em função da manipulação nutricional no período chuvoso, o único tratamento estatisticamente diferente do controle foi N2 (F = 2,56; P = 0,024), apresentando aumento nos valores de diversidade, chegando a 1,55 bits.mg-¹ (figura 3a). No período seco a diversidade não apresentou respostas significativas (P < 0,05) em relação o enriquecimento de nutrientes (figura 3b).
Nas amostras do período chuvoso apenas os grupos X1 e S1 apresentações variações de
biomassa significativa com os tratamentos (figura 4a). Para o grupo X1 apenas o tratamento
P4+N4 foi significativamente diferente do controle com tendência a aumento e para o grupo S1apenas o tratamento P2 foi estatisticamente diferente do controle. No período seco apenas a
biomassa de L0 variou significativamente entre os tratamentos, em que somente N2 foi
diferente do controle (F = 10,41; P = 0,039), com tendência a aumento (figura 4b).
3.3 Efeito do tratamento integrado de temperatura e nutrientes
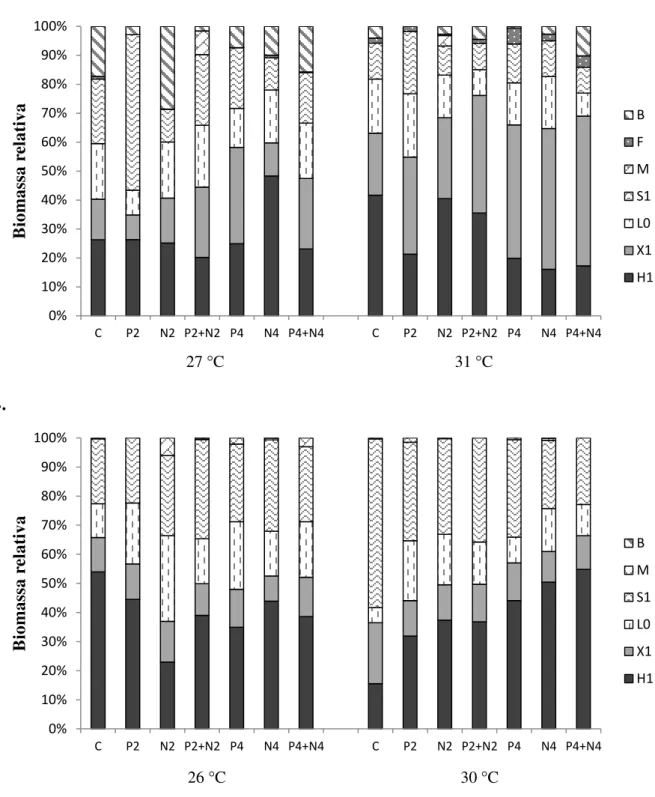
Considerando um efeito combinado temperatura/tratamento o pior cenário qualitativo encontrado neste trabalho tanto para o período chuvoso com seco foi o tratamento de P4+N4 nas temperaturas de 31 e 30 °C. Na temperatura de 31 °C o tratamento P4+N4 apresentou a menor riqueza (sete espécies) e diversidade (0,45 bits.mg-1) dentro todos os tratamentos, além da comunidade nesse tratamento ser composta em mais 80% (0,76 mg.L-1) por grupos funcionais de cianobactérias. Na temperatura de 30 °C o tratamento P4+N4 também apresentou a menor riqueza (três espécies) dentre todos os tratamentos e embora a diversidade (0,064 bits.mg-1) não tenha sido a menor nesse tratamento a comunidade foi composta apenas por quatro grupos funcionais, todos formados por cianobactérias, em que o H1 representou
A.
B.
Figura 5 – Biomassa relativa (%) dos grupos funcionais descritores nos diferentes tratamentos de enriquecimento nutricional e temperatura, para o período chuvoso (a.) e período seco (b.). Barras ao lado esquerdo representam os tratamentos da temperatura controle e ao lado direito os tratamentos da temperatura de aquecimento.
0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100%
C P2 N2 P2+N2 P4 N4 P4+N4 C P2 N2 P2+N2 P4 N4 P4+N4
B
iom
assa
re
lativa
27 °C 31 °C
B F M S1 L0 X1 H1 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100%
C P2 N2 P2+N2 P4 N4 P4+N4 C P2 N2 P2+N2 P4 N4 P4+N4
B
iom
assa
re
lativa
26 °C 30 °C
4 DISCUSSÃO
Os resultados deste trabalham mostraram que a comunidade fitoplanctônica dos experimentos do período chuvoso e seco respondeu de forma distinta aos efeitos do aquecimento e que o enriquecimento beneficiou principalmente os grupos funcionais de cianobactérias.
A biomassa total nos experimentos do período chuvoso e seco não respondeu ao estímulo do enriquecimento de nutrientes, mas quando considerado o efeito isolado do aquecimento a resposta dos experimentos foi divergente. No experimento do período chuvoso a biomassa total apresentou uma tendência ao aumento na temperatura de 31 °C, corroborando com diversos trabalhos que afirmam que o aumento na temperatura da água acelera o metabolismo das algas, aumentando a sua produtividade e consequentemente a sua biomassa (Briand et al., 2004; Reynolds, 2006; Paerl & Paul, 2012). Porém o mesmo não foi observado no experimento do período seco em que a biomassa total diminui significativamente na temperatura de 30 °C, provavelmente pela concentração de fósforo solúvel ter chegado a valores limitantes para o fitoplâncton.
A resposta da riqueza de espécies e da diversidade ao efeito do aquecimento e enriquecimento nutricional também foi diferente para os experimentos do período chuvoso e seco. No período chuvoso constatamos um aumento na diversidade da comunidade, enquanto que no período seco houve uma redução, provavelmente por mudanças na riqueza e abundância nas espécies em cada experimento. A perda de riqueza e diversidade são resultados esperados diante das alterações climáticas (Winder & Sommer, 2012), no entanto a comunidade fitoplanctônica de amostras do período chuvoso beneficiou-se do aquecimento e enriquecimento de nutrientes, conseguindo recrutar espécies novas no tratamento de P4 (quatro vezes a concentração média de PO4 do reservatório) e aumentando a diversidade no N2 (duas vezes a concentração média de NO3- do reservatório).
°C (Robarts & Zohary, 1987; Pearl & Hushiman, 2008; Sukenik et al., 2012; O’Neil et al., 2012). Nesse contexto, foi averiguado que no experimento do período chuvoso houve um aumento na riqueza de espécies, principalmente no tratamento P4. A comunidade nesse tratamento foi composta em mais de 90% por grupos funcionais constituídos principalmente de cianobactérias (H1, X1, L0, S1).
As principais mudanças averiguadas causadas por efeito do aquecimento foram em relação à composição funcional da comunidade fitoplanctônica. Em ambos os experimentos foi notada a persistência do grupo H1 (cianobactérias filamentosas heterocitadas) com o
aquecimento e a redução na biomassa do grupo B (diatomáceas de lagos rasos e polimíticos), possivelmente porque a temperatura de aquecimento era muito acima da ideal para o crescimento ótimo das diatomáceas (Reynolds, 2006). Na temperatura de 31 °C houve um aumento da contribuição na biomassa relativa do grupo F (clorofíceas coloniais com mucilagem) e X1 (clorofíceas e cianobactérias nanoplanctônicas), este último sendo o que
mais contribui com biomassa relativa no tratamento de P4+N4 (quatro vezes a concentração média de PO4 e NO3- do reservatório), concomitante a uma redução do grupo S1
(cianobactérias filamentosas não-heterocitadas), ainda que ele tenha sido beneficiado pela adição de P2 (duas vezes a concentração média de PO4 do reservatório). Algas oportunistas, do tipo r-estrategistas, podem se beneficiar de uma entrada pontual de nutrientes e aumentar sua biomassa na comunidade, mas logo são predadas por herbívoros (Moss et al., 2003). Já no experimento do período seco o grupo S1 aumentou sua contribuição relativa na biomassa total,
enquanto que a biomassa relativa de X1 permaneceu praticamente inalterada. Algas maiores,
como as do grupo S1 são favorecidas por suas habilidades em conseguir nutrientes em
ambientes onde eles são escassos (Lund, 1965), como de fato ocorreu durante os experimentos.
Os grupo funcionais F e X1 mostraram beneficiar-se com o aumento de temperatura no
replicação das cianobactérias e clorofíceas quando submetidas a temperatura de 29 °C (Lurling et al., 2013). Moss et al. (2003) também constataram o em seus experimentos o crescimento de duas espécies de clorofíceas e não ocorrendo mudanças na comunidade no sentido de favorecer a dominância de cianobactérias. Portanto, cianobactérias beneficiaram-se indiretamente do aumento de temperaturas, através do aumento da estabilidade da coluna d’água e não dos efeitos diretos do aquecimento do clima (Wagner & Adrian, 2009).
O grupo H1 apresentou uma tendência a aumento de sua biomassa na temperatura de
31 °C e, na temperatura de 30 °C atentamos para uma tendência de aumento da sua biomassa relativa em todos os tratamentos com adição de nutrientes. Apesar do grupo S1, representado
neste trabalho principalmente pela espécie Planktolyngbya limnetica, também ter apresentado uma tendência ao aumento de sua biomassa na temperatura de 30 °C, mas o que verificamos de fato foi uma substituição deste grupo por H1 em todos os tratamentos com enriquecimento
nutricional. O grupo H1, composto nestes experimentos por Dolichospermum plactonica e
Aphanizomenon gracile, engloba cianobactérias heterocitadas potencialmente tóxicas e formadoras de florações, que se beneficiam de concentrações moderadas de fósforo (Reynolds et al., 2002; Padisák et al., 2009). Florações de cianobactérias com capacidade de produzir toxinas são particularmente preocupantes para a gestão de recursos hídricos, pois afetam toda cadeia alimentar causando mortalidade de peixes e mariscos, encarecendo custos com o tratamento da água para torná-la própria para consumo (Anderson et al, 2002).
Nos últimos séculos, o enriquecimento de nutrientes causados pela ação antrópica, associado ao desenvolvimento urbano, agrícola e industrial, tem acelerado os processos de eutrofização, que por sua vez favorece a proliferação de cianobactérias nocivas (Steinberg & Hartmann, 1988; Paerl & Fulton, 2006). As mudanças climáticas podem intensificar os sintomas da eutrofização em sistemas de água doce, através do aumento da temperatura da água e da concentração de nutrientes, alterações nos padrões de precipitação e aumento no tempo de estratificação da coluna d’água (Paerl et al., 2011). Neste trabalho, o efeito combinado das temperaturas de aquecimento (30 °C e 31 °C) e o tratamento com maior concentração de nutrientes (P4+N4) foi o pior cenário observado, com menores índices de riqueza e diversidade, além de ter favorecido um aumento da biomassa relativa de cianobactérias, principalmente as do grupo H1 no experimento do período seco. Portanto, a
5 CONCLUSÃO
Os efeitos da manipulação da temperatura e ou nutrientes sobre a comunidade fitoplanctônica do reservatório Ministro João Alves provocaram mudanças na riqueza de espécies, na diversidade da comunidade e na sua composição funcional. Os experimentos realizados nos períodos chuvoso e seco responderam de formas distintas, sendo o período seco o que apresentou maior suscetibilidade ao aumento na contribuição de cianobactérias heterocitadas potencialmente tóxicas (H1), especialmente diante do aumento da temperatura e
elevadas concentrações de nutrientes. . Assim, a hipótese deste trabalho foi corroborada para as amostras do período seco. No período chuvoso foi verificado o aumento da biomassa de grupos funcionais de algas oportunistas, como o F e X1, que são grupos constituídos de
6 REFERÊNCIAS BIBLIOGRÁFICAS
AMBRIZZI, T.; ROCHA, R. P.; MARENGO, J. A.; PISNITCHENKO, I.; ALVES, L. M. 2007. Cenários regionalizados de clima no Brasil para o Século XXI: Projeções de clima usando três modelos regionais. Relatório 3, Ministério do Meio Ambiente - MMA, Brasília.
ANDERSON, D. M.; GLIBERT, P. M.; BURKHOLDER, J. M. 2002. Harmful algal blooms and eutrophication: nutrient sources, composition, and consequences. Estuaries, v.25, p. 704-726.
ARAÚJO, M.F.F.; COSTA, I.A.S. 2007. Comunidades microbianas (bacterioplâncton e protozooplâncton) em reservatórios do semiárido brasileiro. Oecol. Bras., 11 (3),p. 422-432.
BELLARD, C.; BERTELSMEIER,C.; LEADLEY, P.; THUILLER, W.; COURCHAMP, F. 2012. Impacts of climate change on the future of biodiversity. Ecology Letters. v.15, p. 365– 377.
BLENCKNER, T.; ADRIAN, R.; LIVINGSTONE, D.M;, JENNINGS, E.; WEYHENMEYER, G.A.; GEORGE, D.G.; JANKOWSKI, T.; JARVINEN, M.; AONGHUSA, C.N.; NOGES, T.; STRAILE, D.; TEUBNER, K. 2007. Large-scale climatic signatures in lakes across Europe: a meta-analysis. Glob. Change Biol. v.13, p. 1314-1326.
BRIAND, J.; LEBOULANGER, C.; HUMBERT, J.; BERNARD, C.; DUFOUR, P. 2004. Cylindrospermopsis raciborskii (Cyanobacteria) invasion at mid-latitudes: selection, wide physiological tolerance, or global warming? Journal Phycologia. v.40, p. 231–8.
BOUVY, M., MOLICA; R., OLIVEIRA, S.D.; MARINHO, M.; BECKER, B. 1999. Dynamics of a toxic cyanobacterial bloom Cylindrospermopsis raciborskii in a shallow reservoir in the semi-arid northeast Brazil. Aquatic Microbial Ecology. v. 20, p. 285-297.
BOUVY, M.; FALCÃO, D.; MARINHO, M.; PAGANO, M.; MOURA, A. 2000. Occurrence of Cylindrospermopsis (Cyanobacteria) in 39 Brazilian tropical reservoirs during 1998 drought. Aquatic Microbial Ecology. v. 23, p. 13-27.
CARVALHO, L.; KIRIKA, A. 2003. Changes in shollow lake functioning: response to climate change an nutrient reduction. Hydrobiologia. v.506, p.789-796.
DESORTOVA, B.; PUNCOCHAR, P. 2011. Variability of phytoplankton biomass in a lowland river: Response to climate Conditions. Limnologica. v.41, p. 160–166.
ESKINAZI-SANT’ANNA, E.M.; MENEZES, R.; COSTA, I.A.S.; PANOSSO, R.; ARAÚJO, M.F.F.; ATTAYDE, J.L. 2007. Composição da comunidade zooplanctônica em reservatórios eutróficos do semi-árido do Rio Grande do Norte. Oecologia Brasiliensis, v. 11, n. 3, p. 345-356.
HILLEBRAND, H.; DÜRSELEN, C. D.; KIRSCHTEL, D. B.; POLLINGHER, U.; ZOHARY, T.. 1999. Biovolume calculation for pelagic and benthic microalgae. Journal of Phycology. v. 35, p. 403–424.
IPCC. Climate Change, 2007: Impacts, Adaptation an Vulnerability. Contribution of Working Group II to the Fourth Assessment Report of the Intergovernamental Painel on Climate Change, M.L.; PARRY, OF.; CANZIANI, J.P.; PALUTIKOF, P.J. VAN DER LINDEN; HANSON, C.E. Eds. Cambridge University Press, Cambridge, UK, 976 pp.
LASSEN, M. K.; NIELSEN, K. D.; RICHARDSON, K.; GARDE, K.; SCHLÜTER, L. 2010. The effects of temperature increases on a temperate phytoplankton community — A mesocosm climate change scenario. Journal of Experimental Marine Biology and Ecology. v.383, p.79–88.
LUND, J.W.G. 1965. The ecology of freshwater phytoplankton. Biological Reviews. v.40, p.231–293.
LÜRLING, M.; ESHETU F.; FAASSEN E.J.; KOSTEN, S.; HUSZAR, V.L.M. 2013 Comparison of cyanobacterial and green algal growth rates at different temperatures. Freshwater Biology .v.58, p.552-559.
KOSTEN, S.; HUSZAR, V.; BECARES, E.; COSTA, L.; VAN DONK, E.; HANSSON, L.-A.; JEPPESSN, E.; KRUK, C.; LACEROT, G.; MAZZEO, N.; DE MEESTER, L.; MOSS, B.; LURLING, M.; NO¨ GES, T.; ROMO, S.; SCHEFFER, M. 2011. Warmer climate boosts cyanobacterial dominance in shallow lakes. Global Change Biology. v.18 , p.118-126.
MOSS, B.; MCKEE,D.; ATKINSON, D.; COLLINGS, S.E; EATON, J.W; GILL, A.B.; HARVEY, I.; HATTON, K.; HEYES, T.; WILSON, D.2003. How important is climate? Effects of warming, nutrient addition and fish on phytoplankton in sallow lake microcosms. Journal of Applied Ecology. v.40, p.782-792.
MOSS, B.; KOSTEN, S.; MEERHOFF, M.; BATTARBEE, R.W., JEPPESEN, E.; MAZZEO, N.; HAVENS, K., LACEROT, G.; LIU, Z.; 8, MEESTER, L.de; PAERL, H.; SCHEFFER, M.. 2011 Allied attack: climate change and eutrophication. International Society of Limnology. p. 101-104.
MEEHL, G.; COVEY, C.; DELWORTH, T.; LATIF, M.; MCAVANEY, B.; MITCHELL, J. F. B.; STOUFFE, R.; TAYLOR, K.. 2007, The WCRP CMIP3 multimodel data set. A new era in climate change research. Bull. Am. Meteorol. Soc,. v.88, n..9, p.1383–1394.
MOLISANI, M. M.; DE SOUSA BARROSO, H.; BECKER, H.; MOREIRA, M. O. P.; HIJO, C. A. G.; DO MONTE, T. M.; VASCONCELLOS, G. H. 2010. Trophic state, phytoplankton assemblages and limnological diagnosis of the Castanhão Reservoir, CE, Brazil. Acta Limnologica Brasiliensia, v.22, p.1-12.
MORENGO, J. A. 2009. Vulnerabilidade, Impactos e adaptação as mudança de clima no semiárido do Brasil, In Parcerias Estratégicas/Centro de Gestão de Estudos Estratégicos-Ministério da Ciência e Tecnologia, v.1, n.1, Brasília DF, p. 149-176.
MORENGO, J.A., 2011. Variabilidade e Mudanças Climáticas no Semiárido. In: MEDEIROS, S. de S.; GHEYI, H.R; GALVÃO, C.de O.; PAZ, V.P. da S. Recursos Hídricos em regiões áridas e semiáridas. Paraíba: INSA, p.383-416.
MOURA, A. D. N.; BITTENCOURT-OLIVEIRA, M. D. C.; DANTAS, Ê. W.; ARRUDA NETO, J. D. D. T. 2007. Phytoplanktonic associations: a tool to understanding dominance events in a tropical Brazilian reservoir. Acta Botanica Brasilica, v.21, p.641-648.
MOURA, A. do N.; NASCIMENTO, E.C.; DANTAS, Ê.W. 2012. Temporal and spatial dynamics of phytoplankton near farm fish in eutrophic reservoir in Pernambuco, Brazil. Revista de Biología Tropical. v.60, p.581-597.
MULLER, R.; O. WIEDEMANN. 1955. Die Bestimmung des Nitrat-Ions in Wasser. Von Wasser. V. 22, p.247.
MURPHY, J.; RILLEY, J.P. (1962). A modified single-solution method for the determination of phosphate in natural waters. Analyt. Chim. Acta 27, 31-36.
NOBRE, C.A.; SAMPAIO, G.; SALAZAR, L. (2007). Mudanças climáticas e Amazônia. Ciência e Cultura 59: 22-27.
O’NEIL, J.M.; DAVIS, T.W.; BURFORD, M.A.; GOBLER. C.J. 2012. The rise of harmful cyanobacteria blooms: The potential roles of eutrophication and climate change. Harmful Algae .v.14, p. 313–334
PADISÁK, J.; CROSSETTI, L.O.; NASELLI-FLORES, L. 2009. Use and misuse in the application of the phytoplankton functional classification: a critical review with updates. Hydrobiologia, v.621, p. 1-19.
PAERL, H.W. 1988. Nuisance phytoplankton blooms in coastal, estuarine, and inland waters. Limnol Oceanogr . v.33, p. 823–47.
PAERL HW, FULTON RS III. 2006. Ecology of harmful cyanobacteria. In: Graneli E, Turner J (eds) Ecology of harmful marine algae. Springer, Berlin, p. 95–107.
PAERL, H.W.; HUISMAN, J. 2008. Climate: blooms like it hot. Science. V. 57, p. 320.
PAERL, H.W.; HALL, N.S.; CALANDRINO, E.S. 2011. Controlling harmful cyanobacterial blooms in a world experiencing anthropogenic and climatic-induced change. Science of the Total Environment. v.409, p.1739-1745.
PAERL, H.W.; PAUL, V.J. 2012. Climate change: Links to global expansion of harmful cyanobacteria. Water Research. v.46, p.349-3633.
PAUL, V.J. 2008. Global warming and cyanobacterial harmful algal blooms. In: Hudnell, H.K. (Ed.), Cyanobacterial Harmful Algal Blooms: State of the Science and Research Needs. Springer, New York, p. 239-257.
PBMC. 2013. Contribuição do Grupo de Trabalho 1 ao Primeiro Relatório de Avaliação Nacional do Painel Brasileiro de Mudanças Climáticas. Sumário Executivo GT1. PBMC, Rio de Janeiro, Brasil. 24 p.
REYNOLDS, C.S. 1997. Successional development, energtics and diversity in planktonic communities. Biodversity: an Ecological Perspective (eds.T.Abe, S.R. Levin and M. Higashi), p. 167-202. Springer, New York.
REYNOLDS, C.; HUSZAR, V.; KRUK C.; NASELLI-FLORES, L.; MELO, S. 2002. Towards a functional classification of the freshwater phytoplankton. Journal of Plankton Research, v. 24, p. 417-428.
REYNOLDS, C.S., 2006. Ecology of Phytoplankton (Ecology, Biodiversity and Conservation). Cambridge University Press, Cambridge, UK.
ROBARTS, R.D.; ZOHARY, T. 1987. Temperature effects on photosynthetic capacity, respiration, and growth rates of bloom-forming cyanobacteria. Mar Freshw Res. v. 21,p.391– 399.
SHANNON, C. E.; WEAVER, W. 1963.“The Mathematical Theory of Communication”. Urbana: University of Illinois Press.
STEINBERG, C.E.W.; HARTMANN, H.M. 1988. Planktonic bloomforming cyanobacteria and the eutrophication of lakes and rivers. Freshwater Biology. v.20, p.279-287.
SUKENIK, A.; HADAS, O.; KAPLAN, A.; QUESADA, A. 2012. Invasion of Nostocales (cyanobacteria) to subtropical and temperate freshwater lakes–physiological, regional, and global driving forces. Frontiers in microbiology. v.3, p.1-9.
UHELINGER, V. 1964. Étude statistique des méthodes de dénobrement planctonique. Arch Sci Arch. Sci.v. 17,p. 121-123.
UTERMÖHL, H. 1958. Zur vervollkommung der quantitativen phytoplankton - methodik. Mitt. Int. Verein. Limnol., v.9, p.1-38.
VALDERRAMA, J.C. 1981. The simultaneous analysis of total N and total P in natural waters. Mar. Chem. v.10, p.109-122.
WAGNER, C.; ADRIAN, R., 2009. Cyanobacteria dominance: quantifying the effects of climate change. Limnol. Oceanogr. v.54, p.2460-2468.