Dissertação de Mestrado apresentada ao Programa de Pós Graduação em Ciências Biológicas do Centro de Biociências da Universidade Federal do Rio Grande do Norte, como requisito parcial à obtenção do título de Mestre em Ciências Biológicas
.
ORIENTADOR: ! ! " " ! "
(DOL/CB/UFRN)
CO ORIENTADORA: #! #! " "
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN / Biblioteca Central Zila Mamede .
Oliveira, Ranielly Karen de.
Estudo comparativo da variação temporal da comunidade fitoplanctônica do Açude Cruzeta inserido no bioma caatinga, Rio Grande do Norte / Ranielly Karen de Oliveira. – Natal, RN, 2010. 81 f.
Orientador: Naithirithi T. Chellappa Co orientador: Sathyabama Chellappa.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Departamento de Oceanografia e Limnologia. Programa de Pós Graduação em Ciências Biológicas. 1. Açude – Cruzeta (RN) – Dissertação. 2. Macrófitas – Dissertação. 3. Fitoplâcton – Dissertação. 4. Mudança climática – Dissertação. I. Chellappa, Naithirithi. T. II. Chellappa, Sathyabama. III. Universidade Federal do Rio Grande do Norte. IV. Título.
Esta versão da dissertação, apresentada pela aluna RANIELLY KAREN DE OLIVEIRA ao Programa de Pós Graduação em Ciências Biológicas, do Centro de Biociências, da Universidade Federal do Rio Grande do Norte, foi julgada adequada e aprovada pelos membros da Banca Examinadora, na sua redação final, para a conclusão do Curso e à obtenção do título de Mestre em Ciências Biológicas.
MEMBROS DA BANCA EXAMINADORA:
$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$ Prof. Dr. Naithirithi T Chellappa (Orientador)
DOL / CB / UFRN
$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$ Profa. Dra. Sathyabama Chellappa (Co Orientadora)
DOL / CB / UFRN
$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$ Prof. Dr. Bhaskara Canan (Examinador Externo)
SENAI /RN
$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$$ Prof. Dr. José Zanon O. Passavante (Examinador Externo)
UFPE / PE
Isaías 25:1
!
" #
$%
&
$
$
"
'
&
%
(
%
" )
*
+"
Pe. Fábio de Melo
,
-
,
$%
-$
$%
$
(
-
"
A execução deste trabalho contou com a ajuda de pessoas e instituições às quais venho aqui prestar meus sinceros agradecimentos:
À CAPES e à FAPERN pela concessão de bolsa de estudo em períodos distintos. À UFRN pela oportunidade proporcionada durante todo o decorrer da realização deste estudo, ao PPgCB pelo apoio concedido por: Maurício, Arrilton e Valter, também à Lasalete e Edna da PPG, por resolverem entraves relacionados á bolsa.
Ao laboratório de Biotecnologia de Microalgas, no qual meu Orientador é responsável e me permitiu a realização das análises, todos do DOL, funcionários e professores. Ao meu orientador, prof. Chellappa, homem ativo, e exemplo de dedicação profissional, que superando as adversidades (saúde) vive a magnitude de um pesquisador respeitado pela sua experiência em Limnologia, foi essencial para a existência desta dissertação.
A profa Bama pela co orientação, sempre disponível para ensinamentos e orientações, exemplo de todos os bons sentimentos que se possa existir, aos dois, sempre lembrarei com muita gratidão por todas as oportunidades proporcionadas desde minha graduação.
Aos amigos do laboratório pela amizade e pelos momentos que partilhamos o convívio com o trabalho no laboratório, Fabiana, pela ajuda com a estatística e revisão do trabalho Emilly, pelos mesmos momentos de alegria e aflição que passamos durante o mestrado, Leila, Patrícia e Talita, pela ajuda com as coleta e análises e Soila, quem me abriu as portas para o LABIMI , as amigas eternas Marianne, Dioceli, Karina e Clébia pela amizade fortalecedora.
Ao Sr. Magal o pescador que auxiliou nas coletas de água no açude Cruzeta, sob sol ou chuva, disponibilizando sua canoa e sua casa como apoio, e pela cordialidade.
Agradecimento mais que especial aos meus pais Raimundo e Dalva, por me proporcionar um lar feliz, no qual aprendi os valores da vida, pelo amor incondicional, sempre me apoiando e sonhando para que esse dia se tornasse realidade. Ao meu marido, Gecione, por seu amor, companheirismo, compreensão com meu trabalho, também por seu total apoio, confiança e paciência; obrigada por entenderem a importância dessa jornada em minha vida e por fazerem parte dela. Obrigada mãezinha, por suas orações a Nossa Senhora.
Agradecimento especial ao meu irmão Riva por ser tão presente, pelo seu carinho e assistência em todos os aspectos, principalmente pelo seu empenho em me ajudar, mesmo estando distante; à minha cunhada Mônica pelo seu carinho.
houve crescimento significativo das macrófitas aquáticas, estas por sua vez, importantes em ecossistemas aquáticos rasos por estabilizar o grau da transparência da água, aumentando assim a penetração de luz e consequente crescimento fitoplanctônico. Ao mesmo tempo as macrófitas aquáticas também competem potencialmente com a comunidade fitoplanctônica por recursos como os nutrientes inorgânicos. Este estudo apresenta uma comparação entre os anos de 2004 2005 durante qual não houve a presença da comunidade de macrófítas aquáticas ou foram apenas restringidas nas margens e nos anos 2008 2009 em que houve um crescimento significativo das macrófitas aquáticas no açude de Cruzeta, RN. O trabalho elucida a presença significativa das macrófitas aquáticas, ' , . / 0/ sp e 1 sp, e sua interferência na estrutura do fitoplâncton. As coletas foram realizadas entre agosto de 2008 até o julho de 2009 entre as 10:00 e 12:00 h da manhã com o auxilio de garrafa de Van Dorn e rede de plâncton de malha de 20 Qm, em três profundidades, superfície, meio e fundo. Os parâmetros físico químicos foram analisados . As amostras para análise de nutrientes e clorofila foram mantidas sob refrigeração para análise. Para análise quali quntitativa do fitoplancton foi ultilizada a câmara de Sedgwick Rafter. Os resultados indicam que houve redução nos valores da clorofila em relação ao período de 2004 2005, no qual as médias variaram entre 5,65 8,08 QgL1 para o período de estiagem e 5,09 6,23 para o período chuvoso. Enquanto que no período de 2008 2009 foi verificado 3,98 5,65 QgL1 da clorofila para o período de estiagem e 3,56 4,36 QgL1 para o período chuvoso. A temperatura apresentou se sempre mais elevada em relação ao estudo de 2004 2005. No presente trabalho, a classe que apresentou maior abundância relativa para ambos os períodos foi a Cyanophyceae, representadas com destaque
as espécies 2 / / Borzy (= 1 / sp), 3 4 5
Brunnthaler e ! Ag. e ./ 4 (Wolosz). Ocorreu
redução na concentração de clorofila e diversidade do fitoplâncton, aumento da transparência e aumento da temperatura da água, durante o período em estudo, estes fatores podem ter sido ocasionados pela elevada biomassa de macrófitas aquáticas quando comparada ao período de 2004 2005 em que houve uma baixa biomassa de macrófitas, neste ecossistema.
period of the study.
89:.%
:9-2% Localização da área de estudo: açude Cruzeta, RN...
:9-2% Vista panorâmica do açude Cruzeta, RN...
:9-2% ; Ocorrência das macrófitas no açude Cruzeta durante o período de estiagem
evidenciando as espécies, ' , . /
0/ sp e 1 sp, nos anos 2008 2009...
:9-2% < Ocorrência das macrófitas no açude Cruzeta durante no período chuvoso, '"
, . / 0/ sp e 1 sp, nos anos
2008 2009... ;
:9-2% = a) Garrafa de Van Dorn em PVC, b) disco de Secci, c) kit multi parâmetro, d)
rede de plâncton de 20 Q... =
:9-2% > Fluxograma para a análise de nitrato, (GOLTERMAN CLYMO; OHNSTAD,
1978)... >
:9-2% ? Fluxograma para a análise de amônio, (GOLTERMAN CLYMO; OHNSTAD,
1978) ... ?
:9-2% @ Fluxograma para a análise do orto fosfato, (APHA, 1985)... @
2&:90
:9-2+ Localization Cruzeta reservoir, Rio Grande do Norte, Brasil... <
:9-2+ Mean and standard deviation of rainfall during periods of drought and in rainy
Cruzeta reservoir , RN……… <=
:9-2% ; Temporal variation of abiotic factors a. pH, b. temperature and c. electrical
conductivity in Cruzeta reservoir……….. <>
:9-2% < Temporal variation of abiotic factors a. dissolved oxygen, b. transparency,
c.nutrientes in Cruzeta reservoir……….. <?
:9-2% = Temporal variation of the concentration of chlorophyll in açude Cruzeta <@
:9-2% > Temporal variation of ecological indices (richness, diversity, similarity and
dominance) in Cruzeta reservoir. ………. <)
:9-2% ? Biplot of the Principal Components Analysis (PCA) applied to the parameters
physico chemical (vectors) and periods studied (♦). E1. dry 2004 2005,
2. 2008 2009 dry, C1. Rainy 2004 2005 and C2. Rainy 2008 2009... =;
:9-2% @ Biplot of Canonical Correspondence Analysis (CCA) illustrate the distribution
of physicochemical parameters with regard to macrophyte biomass and
(CARLSON, 1977 modificado por TOLEDO et al, 1983)...
2&:90
%A+'% Morphometric and hydrological characteristics of Cruzeta reservoir, RN…….. <
%A+'% ANOVA One Way (p<0,5) for the temporal variation of inorganic
nutrients in açude Cruzeta, RN……….. <@
%A+'% ; List of microalgae and Abundance on the Cruzeta resevoir/RN, for
periods of drought and wet years 2004 2005 e 2008 2009………….…... =
B
89:.%
.+C0 Certificado de participação do II Simpósio de Biologia do Rio Grande
do Norte, que ocorreu de 02 a 05 de setembro de 2009, em Natal, RN... >) .+C0 Certificado de participação do II Simpósio de Biologia do Rio Grande
do Norte, que ocorreu de 02 a 05 de setembro de 2009, em Natal, RN... >)
.+C0 ; 12º Congresso Nordestino de Ecologia, que ocorreu de 13 a 16 de
outubro de 2009 em Gravatá/PE... ?
.+C0 < XX congresso de Iniciação Científica, que ocorreu de 19 a 21 de
outubro de 2009, Natal/RN. ... ?
.+C0 = I Simpósio de Biologia do Rio Grande do Norte, que ocorreu de 25 a 29
de novembro de 2008, em Mossoró/RN... ?
.+C0 > XIX congresso de Iniciação Científica, que ocorreu de 20 a 23 de
outubro de em Natal/RN, 2008... ?
.+C0 ? XII Congresso Brasileiro de Limnologia, que ocorreu de 23 a 27 de
agosto, em Gramado/RS... ?
.+C0 @ XII Congresso Brasileiro de Limnologia, que ocorreu de 23 a 27 de
agosto, em Gramado/RS... ?
.+C0 ) XII Congresso Brasileiro de Limnologia, que ocorreu de 23 a 27 de
agosto, em Gramado/RS... ?;
.+C0 XII Congresso Brasileiro de Limnologia, que ocorreu de 23 a 27 de
.+C0 59º Congresso Nacional de Botânica, que ocorreu de 2 a 8 de agosto, em
Natal/RN... ?<
.+C0 59º Congresso Nacional de Botânica, que ocorreu de 2 a 8 de agosto, em
Natal/RN... ?<
... 7
... 9
... 10
B ... 11
! 1.1 RECURSOS HÍDRICOS... 13
1.2 LIMNOLOGIA DO BRASIL... 13
1.3 LIMNOLOGIA DO RIO GRANDE DO NORTE... 14
1.4 MUDANÇAS CLIMÁTICAS... 16
1.5 BIOMA CAATINGA... 18
! E OBJETIVO GERAL... 19
OBJETIVOS ESPECÍFICOS... 19
;! F 3.1 CARACTERIZAÇÃO DA ÁREA DE ESTUDO... 20
3.2 PROCEDIMENTO DE COLETAS... 24
3.3 PLUVIOMETRIA... 24
3.4 ANÁLISE NUTRIENTES INORGÂNICOS... 26
3.5 COMUNIDADE FITOPLANCTÔNICA... 29
3.6 ÍNDICES ECOLÓGICOS... 30
3.7 BIOMASSA DA CLOROFILA ... 31
3.8 ÍNDICE DE ESTADO TRÓFICO (IET) ... 33
3.9 ANÁLISE ESTATÍSTICA DOS DADOS... 34
3.10 NORMALIZAÇÃO DO TEXTO... 34
=! ... 61
>! ... 62
levam aos usos múltiplos dos recursos hídricos, os quais embora variem com a ocupação da bacia de drenagem e com a organização econômica e social da região, geram impactos e deterioram a qualidade da água interferindo também em sua quantidade disponível (LINS, 2006; TUNDISI; TUNDISI, 2008). Diversos eventos que vão desde o aumento populacional, utilização excessiva de recursos, desenvolvimento tecnológico e a globalização cada vez mais intensa, tem causado mudanças globais marcantes (STRASKABA; TUNDISI, 1999) as quais refletem na qualidade dos recursos hídricos para seus mais diferentes usos. Um dos eventos marcantes dos ecossistemas aquáticos e de entrada dos nutrientes de origem antropogênica nos ecossistemas de água doce que têm aumentado consideravelmente durante os últimos dois séculos. Este enriquecimento em nutrientes, ou eutrofização, levaram as mudanças altamente indesejáveis na estrutura e função dos ecossistemas e esse, por sua vez, causa uma quebra no sistema natural da comunidade aquática (SMITH; TILMAN; NEKOLA, 1998).
A recuperação e os usos adequados dos ecossistemas dependem, evidentemente, do conhecimento básico das principais funções de força que determinam sua estrutura e funcionamento (BICUDO et al, 1999). A gestão de reservatórios pode ser considerada como a gestão de sistemas complexos com estados transientes e respostas diversificadas às funções de forças climatológicas e operacionais, acrescidas dos impactos e usos múltiplos nas bacias hidrográficas e das demandas de água (TUNDISI, 1999).
1.2 LIMNOLOGIA DO BRASIL
Construção dos açudes é uma das grandes experiências humanas na modificação dos ecossistemas naturais, que vêm sendo executada pelo homem, desde tempos remotos, com o objetivo de armazenar água para o abastecimento, irrigação, cultivo de vazantes e aquicultura. Durante a seca, principalmente no semiBárido nordestino, muitas comunidades dispõem unicamente da água dos açudes compartilhados com plantas, micróbios e animais (ALBINATI, 2006).
1.3 LIMNOLOGIA DO RIO GRANDE DO NORTE
No Rio Grande do Norte diversos trabalhos destacam a importância do fitoplâncton, produção primária, fatores ambientais e clorofila estes estudos foram realizados em diversos ecossistemas limnéticos dos quais podeBse citar as pesquisas realizadas por (CHELLAPPA, 1990; ARAÚJO, 1997; CHELLAPPA; COSTA, 2003; COSTA, 2003; COSTA, 2006; NASCIMENTO, 2003; SOUZA, 2003; CHELLAPPA; BORBA; ROCHA, 2008; CHELLAPPA; CÂMARA; ROCHA, 2009; CÂMARA et al., 2009). Com base nestes estudos a maioria dos ecossistemas encontraBse ecologicamente comprometido na dominância de cianobactérias tóxicas e não tóxicas com nível trófico variando entre mesotrófico, mesoBeutrófico e eutrófico. A mortandade dos peixes também foi registrada como evento episódico e a presença da toxina microcistina (CHELLAPPA; COSTA; MARINHO, 2000; COSTA et al., 2006 CHELLAPPA; BORBA; ROCHA, 2008). A ocorrência de florações de cianobactérias tem sido atribuída a diversos fatores, como concentração de nutrientes, incidência de luz e regime térmico do corpo d’água. A toxicidade das florações é variável, podendo ser afetada por diversos fatores ambientais, presença de espécies/cepas tóxicas e não tóxicas e condições fisiológicas das células (VÈZIE et al., 2002,JANG et al., 2006, WELKER et al, 2007).
O trabalho realizado por (CHELLAPPA; BORBA; ROCHA, 2008) aborda a comunidade fitoplanctônica e os fatores abióticos do açude Cruzeta em três profundidades, superfície, meio (2m) e fundo (espacial), de setembro, 2004 a junho de 2005, englobando nas estações de seca e de chuvas (temporal). Eles encontraram noventa espécies pertencentes a 06 classes (Chlorophyceae, Bacillariophyceae, Cyanophyceae, Dinophyceae, Chrysophyceae e Euglenophyceae). Dentre estas, a classe Chlorophyceae que apresentou maior riqueza de espécies, com dominância de
, sp. e sp. O grupo das Cyanophyceae foi
representado por 18 espécies de características diversas com dominância de
Dinâmica de nutrientes em ecossistemas de águas doces rasas e polimíticos são diferentes das águas profundas e estratificadas em que as águas rasas não mostram perda de nutrientes nos sedimentos. O contato da água com sedimentos é intenso que garante um rápido retorno do material sedimentado na coluna de água. A resuspensão do sedimento assegura um retorno rápido à perda de nutrientes pela atividade dos peixes bentônicos e ondas induzidas pelos ventos que agitam os sedimentos desprotegidos. Esses dois fatores estimulam resurgirmento de nutrientes para a superfície a fim de tornáBla disponível para a fotossíntese e para a produção de biomassa autotrófica. A situação muda significativamente na presença de vegetação, que altera radicalmente os processos em funcionamento de lagos rasos. Macrófitas aquáticas fornecem um refúgio para pequenos animais contra a predação por outros organismos maiores, muda a dinâmica de nutrientes do sistema e evita a resuspensão dos sedimentos (CASATTI et al., 2003; SCHEFFER, 2004). Abundância e diversidade do fitoplâncton, a dinâmica de nutrientes e a natureza da água rasa do açude de Cruzeta permanecem sem alteração por um longo período de sete anos (1998B 2005) (CHELLAPPA; BORBA; ROCHA, 2008). A situação atual é significativamente alterada com a vegetação emergente, flutuantes e submersa que por sua vez, começaram dominar e competir por os recursos disponíveis de nutrientes.
O presente estudo, na tentativa de compreender a relação entre o meio aquático e as macrófitas aquáticas, possibilitaa expandir o conhecimento de ecossistemas do bioma Caatinga, implicando assim na sua preservação e/ou manejo. O surgimento de macrófitas aquáticas como espécies invasoras, decorrentes de mudanças climáticas e o avanço e aceleração do estado trófico mesoBoligotrófico para mesoBeutrófico pode destacar que as macrófitas aquáticas são um importante componente dos ecossistemas aquáticos, pois contribuem para aumentar a estrutura e a diversidade de habitats, interferem na ciclagem de nutrientes e participam da base das teias alimentares (WETZEL, 2001).
seriamente a abundância (McKEE et al, 2002). Estes autores consequentemente, consideram que as macrófitas são resilientes ao aumento pequeno na temperatura.
Como resultado da integridade física e biótica dos ecossistemas aquáticos encontraBse intimamente ligada à presença de vegetação aquática. Pesquisas com macrófitas apontam enfoques distintos, o primeiro enfoque procura abordar a parte ecológica, identificando padrões de distribuição de espécies, os fatores determinantes do crescimento e da decomposição da biomassa além do papel das macrófitas aquáticas na manutenção do funcionamento e estrutura dos ambientes aquáticos (CAMARGO; PEZZATO; HENRY – SILVA, 2003). A este respeito pesquisas atesta de forma inequívoca a importância da vegetação aquática para a pesca e a diversidade da ictiofauna em reservatórios brasileiros, sendo o manejo dessa vegetação considerado entre as técnicas utilizadas para conservar a biodiversidade e elevar a produtividade pesqueira em reservatórios. (AGOSTINHO; GOMES, 1997); o segundo enfoque encontraBse nas pesquisas que visam a manejar e controlar o crescimento excessivo da vegetação aquática interfere nos usos múltiplos dos ecossistemas aquáticos (MARCONDES; TANAKA; MUSTAFÁ, 2003; MIYAZAKI; PITELLI, 2003). Problemas decorrentes do crescimento de plantas aquáticas em reservatórios brasileiros passaram a ocorrer principalmente nas últimas décadas em diversas bacias hidrográficas(BRAGA el al. 1999;GASTAL JR. et al., 2003; MARCONDES TANAKA; MUSTAFÁ, 2003; MARTINS et. al, 2003).
1.4 MUDANÇAS CLIMÁTICAS
Os agravantes da deteriorização da água é a repercussão na saúde humana, as mundaças globais e climatológicas e a diminuição na biodiversidade dos sistemas aquáticos. O lançamento de efluentes industriais, domésticos e agropastoris, drenagem urbana, deposição atmosférica de nitrogênio, erosão do solo na bacia e a exportação dos nutrientes são causas de impactos ambientais sobre os açudes (TUNDISI, 2005).
acelerado do fitoplâncton (WILHELM; ADRIAN 2008) e, entre os seus representantes, as cianobactérias são muito bem adaptadas em condições de estabilidade da coluna d´água (OLIVER ; GANF, 2000).
1.5 BIOMA CAATINGA
Os ecossistemas aquáticos são analisados de acordo com o bioma ao qual pertencem como segue: Floresta Amazônica, Caatinga, Cerrado e Pantanal, Mata Atlântica e Campos Sulinos e Zona Costeira e Marinha (MINISTÉRIO DO MEIO AMBIENTE, 2002).
O presente estudo teve como objetivo realizar um estudo comparativo da variação temporal da comunidade fitoplânctonica do açude Cruzeta, situado na região semiBárida do Rio Grande Norte, levando em consideração o papel das macrófitas aquáticas frente ao cenário regional de aquecimento das águas, proporcionado pela mudança climática.
Determinar as variáveis ambientais, tais como, temperatura, pH, condutividade elétrica, oxigênio dissolvido e transparência da água;
analisar a concentração dos nutrientes inorgânicos, tais como, nitrato, amônio, ortofosfato; estudar qualitativamente e quantitativamente a comunidade fitoplanctônica, através de índices ecológicos de riqueza, diversidade, dominância e similaridade;
determinar a variação temporal da concentração de clorofila ;
analisar a distribuição da comunidade fitoplanctônica relacionandoBa com as variáveis físicoBquímicas.
verificar a influencia das macrófitas aquáticas na estrutura da comunidade fitoplanctônica.
Os resultados foram apresentados em forma artigo:
As coletas foram realizadas no período de setembro de 2008 a abril de 2009, no açude Cruzeta, localizado no município de Cruzeta, RN, inserido na bacia hidrográfica de PiranhaBAssu, entre as coordenadas 6°24’42”S e 36°47’23” W (Fig. 1 e Fig. 2).
3.1CARACTERIZAÇÃO MORFOMÉTRICA DA ÁREA DE ESTUDO
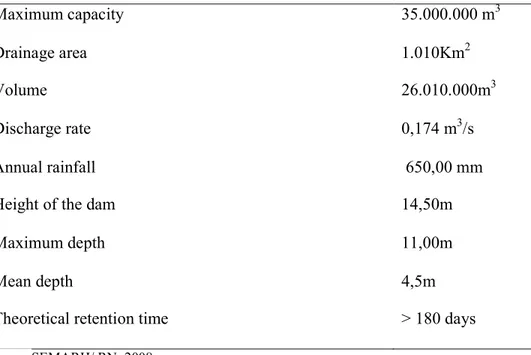
As principais características dos dados hidrográficos deste açude estão apresentadas na Tabela 1.
Tabela 1 – Identificação e caracterização morfométrica do açude Cruzeta, RN.
!"!#$%&'( Bacia hidrográfica: PiranhasBAçu Rio Barrado: Rio São José
$)$# )!*$%&' +! )',-.!#$(
Capacidade: 35.000.000 m3 Área drenada: 1.010Km2
Figura 1 / Localização da área de estudo: açude Cruzeta, RN.
OCORRÊNCIA DAS MACRÓFITAS NO AÇUDE CRUZETA
Foi observada a presença significativa de macrófitas aquáticas, tais como,
, sp e sp no açude Cruzeta, tanto para o
período de estiagem (Figura 3) quanto para o período chuvoso (Figura 4).
Figura 3 / Ocorrência das macrófitas no açude Cruzeta durante o período de estiagem
evidenciando as espécies, , sp e
Figura 4 B Ocorrência das macrófitas no açude Cruzeta durante no período chuvoso, .
3.2 PROCEDIMENTOS DE COLETAS
As coletas de água foram efetuadas entre setembro de 2008 a abril de 2009, entre as 10 e 12 h. As amostras foram coletadas na superfície, meio e fundo do açude e em seguida acondicionadas em recipientes de polietileno lavados previamente em ácido clorídrico 1:3 e enxaguado com água destilada. As análises físicoBquímicas, tais como, pH, temperatura, oxigênio dissolvido e condutividade elétrica foram realizados com auxílio de um Kit multiparâmetro WTW Multi 340i (Fig. 5c). A transparência da água foi medida , utilizandoBse um disco de Secchi, com 30cm de diâmetro, suspenso por uma fita métrica (Figura 5b). As amostras para nutrientes inorgânicos foram submetidas ao congelamento para posterior análise em laboratório.
Para analisar os nutrientes inorgânicos como nitrato (NBNO3) e amônio (NBNH4)
(GOLTERMAN; CLYMO; OHNSTAD, 1978). Para a análise do ortofosfato (P – PO4B) foi
utilizado o método, American Public Health Assciation – APHA, (1985). As leituras das análises foram feitas no laboratório com auxílio de espectrofotômetro digital modelo Biochrom Libra S6.
Para as análises de nutrientes, as amostras de água foram coletadas em triplicatas, com o auxílio da garrafa de Van Dorn em PVC (Figura 5a), com capacidade para 5 l da amostra, e postas em garrafas de polietileno lavadas previamente em ácido clorídrico numa proporção de 1:3 e enxaguadas com água destilada. Em seguida, foram postas em um recipiente isotérmico contendo gelo para posterior congelamento laboratorial, caso as análises não tenham sido realizadas imediatamente.
3.3 PLUVIOMETRIA
Figura 5 B a) Garrafa de Van Dorn em PVC, b) disco de Secci, c) kit multiBparâmetro, d) rede de plâncton de 20 c.
A
B
C
3.4 ANÁLISE DOS NUTRIENTES INORGÂNICOS
Para a análise dos nutrientes inorgânicos como nitrato (NOB3 – N), amônio (NH4 B N) e ortoB
fosfato (P – PO4B) foram analisados, em laboratório, seguindo a orientação de (GOLTERMAN;
CLYMO; OHNSTAD, 1978) e (APHA,1985). As leituras foram realizadas em um espectrofotômetro digital modelo Biochrom Libra S 6 em cubeta de 1mL.
0
Figura 6 B Fluxograma para a análise de nitrato, (GOLTERMAN; CLYMO; OHNSTAD, 1978).
!
" #
$
% &
%
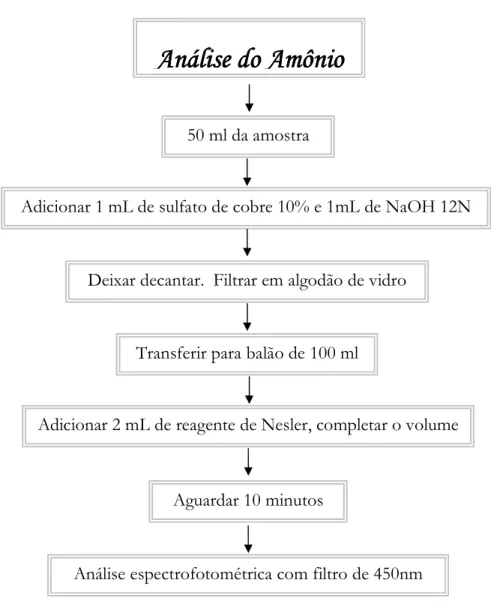
Figura 7 B Fluxograma para a análise de amônio, (GOLTERMAN; CLYMO; OHNSTAD, 1978).
'
*
+
+
+
, -
% .
#
/
'
* #
0 1
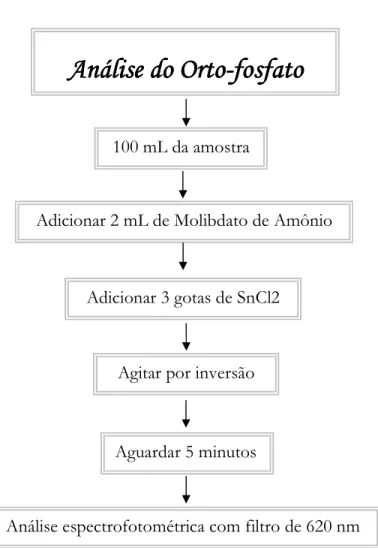
Figura 8 B Fluxograma para a análise do ortoBfosfato, (APHA, 1985).
0
*
1
2
&
#
O estudo das comunidades de microalgas baseouBse em coletas mensais de amostras de água em perfil vertical (superfície, meio e fundo) durante setembro de 2008 a abril de 2009. Para as análises qualitativas, foram filtrados 20 L de água com o auxílio de uma rede fitoplanctônica com abertura de malha de 20 m (Figura 5d), acondicionadas em garrafas de polietileno. As análises qualitativas de fitoplâncton foram realizadas no Laboratório de Biotecnologia Aquática do Departamento de Oceanografia e Limnologia da Universidade Federal do Rio Grande do Norte. Após sedimentação e sifonação das amostras, a análise laboratorial foi realizada com o auxílio do microscópio binocular da marca Taimim TM 800, e a identificação das espécies fitoplanctônicas foi realizada baseada em consultas a literaturas especializadas (SMITH, 1950; DESIKACHARY, 1959; BICUDO; BICUDO, 1970; PRESCOTT, 1970; PARRA; GONZALEZ; DELLAROSA , 1983; WEHR; SHEATH, 2003).
2,!3 45$ ! $ !6$ ' ! '7,8 # '
3.6 ÍNDICES ECOLÓGICOS
Os índices biológicos foram calculados a partir da contagem de organismos encontrados durante o período de estudo, através da metodologia de Margalef (1958) para a Riqueza de espécies (R), para diversidade de espécies (H’) ShannonBWeaver (1949), para a dominância (IBP) BergenBParker (1970) e similaridade (J) de Pielou (1975): onde
A Riqueza de espécies (R) foi calculada segundo a fórmula de (MARGALEF, 1958):
Onde:
R= Riqueza de espécies S= Número de espécies N= Número de indivíduos
A diversidade de espécies (H’) é calculada através do índice de (SHANNONBWEAVER, 1949) pela seguinte fórmula:
Onde:
H’= Índice de diversidade das espécies n = Número de indivíduos de cada espécie N= Número total de indivíduos
A dominância é determinada segundo (BERGENBPARKER, 1970):
R = S – 1
Log N
H’ = B
Σ
(n/N). log(n/N)
S Log
H´ J=
Onde:
H’= Índice de diversidade de ShannonBWeaver Log S = Número de espécies de cada amostra
O índice de riqueza de espécies de Margalef (1958), foi utilizado para calcular a diversidade fitoplanctônica com base no número de espécies (qualitativo) e número de indivíduos (quantitativo) de cada espécie. Este índice é mais expressivo quando há espécies raras ou quando ocorre dominância de espécies. A riqueza de espécies atinge fortemente o índice de similaridade, inclusive quando há espécies raras (PEET, 1974; LUDWIG; REYNOLDS, 1988), A diversidade, portanto, é influenciada pela riqueza de espécies e similaridade (SIMPSON, 1949).
3.7 BIOMASSA DA CLOROFILA
Para a análise da clorofila (cgLB1) foram coletadas amostras em garrafas de polietileno de 600ml, em 0,5m da coluna d’água, meio e fundo. As amostras foram acondicionadas, protegidas da luz e transportadas para o laboratório sob refrigeração. Em laboratório, foi filtrado um volume de 200 mL da amostra de acordo com o material em suspensão existente na água. A filtragem se realizou com auxílio de bomba a vácuo na ausência de luz, utilizando filtro membranoso de 0,22cm de porosidade e 47 mm de diâmetro da Schleicher & Schüll.
AdicionouBse 1 mL de Carbonato de Magnésio (MgCO3) na amostra para evitar a
mL de acetona 90%, envolvidos com papel alumínio a fim de se manter protegidos da luz por cerca de 24h. Após esse período, a amostra foi centrifugada por 10 minutos numa velocidade de 4500 rpm e o sobrenadante foi retirado e colocado em uma cubeta de 5cm para a leitura das absorbâncias em espectrofotômetro digital, modelo Biochrom Libra S 6 em cubeta de 1mL nos comprimentos de onda de 665nm, determinando o pico de absorção da luz pela clorofila e 750nm para uma correção aproximada dos pigmentos coloridos e para a turbidez. Foi obtida a abundância relativa das espécies para os períodos de estiagem e chuvoso.
Foram utilizados valores de absorbância para calcular a concentração de clorofila , através da fórmula de Marker et al. (1980) conforme mostra as equações a seguir:
Onde:
A = Coeficiente de absorção (11,0); K = Índice de correção (2,43);
v = Volume da acetona 90% (10 mL);
Vf = Volume da amostra filtrada em litros (l); L = Caminho óptico da cubeta (1cm);
665 a = Absorbância do extrato não acidificado; 665 d = Absorbância do extrato acidificado;
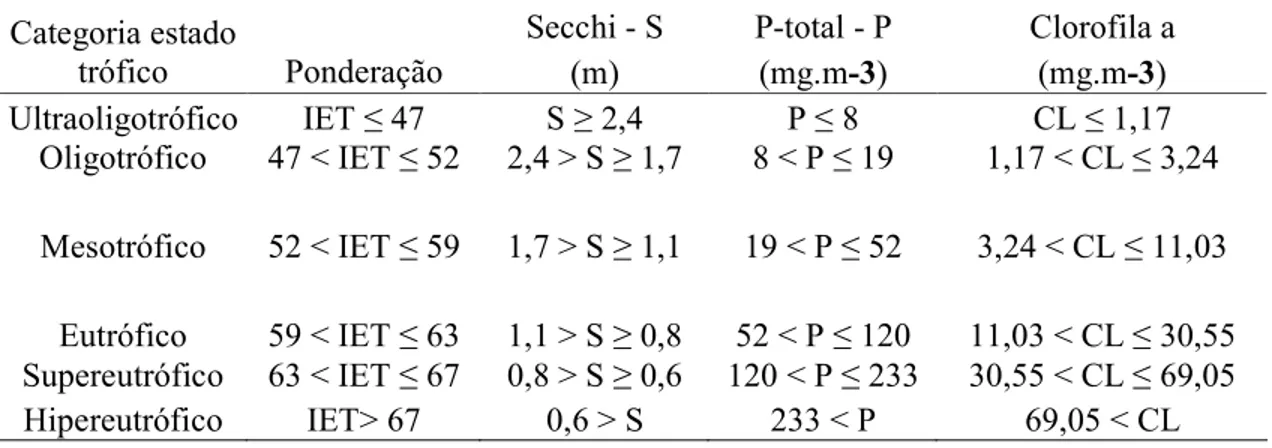
ambientais presentes e passadas. O aumento do conteúdo orgânico determina a substituição da biota primitiva por outra que indica a nova situação; dessa forma o conhecimento das comunidades aquáticas permite identificar alterações da qualidade da água, inclusive depois do desaparecimento do agente poluente. A proposta deste índice foi realizada, através das diversas categorias de discriminadores ambientais que utilizam variáveis físicas, químicas e biológicas na avaliação da qualidade da água, para definir um conjunto de parâmetros indicadores que possibilite a elucidação da tipologia da água do reservatório proporcionando uma adequada e fiel avaliação das condições ambientais do ecossistema. Para este estudo utilizouBse o Índice de Estado Trófico proposto por Toledo Jr et al (1983).
O IET tem a intenção de classificar os corpos da água em diferentes graus de trofia. Consiste em avaliar a qualidade da água quanto ao enriquecimento por nutrientes. O IET foi classificado segundo Carlson (1977), modificado por Toledo Jr et al (1983).
A classificação é feita através de uma expressão que leva em consideração o fósforo total solúvel reativo atribuindo maior peso para o fósforo total, o ortoBfosfato e clorofila e menor peso à transparência, conforme ilustrado a seguir:
IET (S) = 10(6B0,64 + lnS) , onde S = valor do disco de Secchi ln2
IET (P) = 10 [6Bln (80,32/P)], onde P = concentração de fósforo total ln2
IET (PO4) = 10 [6Bln(21,67/PO4)], onde PO4 = concentração de ortoBfosfato
ln2
IET = IET(S) + 2[(IET (P) + IET (PO4) + IET (CHL)]
7
Tabela 2. Valores padronizados de classificação do estado trófico das águas (CARLSON, 1977 modificado por TOLEDO et al, 1983).
Secchi B S PBtotal B P Clorofila a Categoria estado
trófico Ponderação (m) (mg.m/ ) (mg.m/ )
Ultraoligotrófico IET ≤ 47 S ≥ 2,4 P ≤ 8 CL ≤ 1,17
Oligotrófico 47 < IET ≤ 52 2,4 > S ≥ 1,7 8 < P ≤ 19 1,17 < CL ≤ 3,24 Mesotrófico 52 < IET ≤ 59 1,7 > S ≥ 1,1 19 < P ≤ 52 3,24 < CL ≤ 11,03
Eutrófico 59 < IET ≤ 63 1,1 > S ≥ 0,8 52 < P ≤ 120 11,03 < CL ≤ 30,55 Supereutrófico 63 < IET ≤ 67 0,8 > S ≥ 0,6 120 < P ≤ 233 30,55 < CL ≤ 69,05 Hipereutrófico IET> 67 0,6 > S 233 < P 69,05 < CL
3.9 ANÁLISE ESTATÍSTICA DOS DADOS
Para verificar a variação temporal dos nutrientes inorgânicos foi ultilizada a ANOVA One Way (p<0,5). Foi utilizado o programa XLSTAT version 5.2 e análise de correspondência canônica (CCA) para determinar a relação entre os grupos fitoplanctônicos e as variáveis físicoB quimicas (TER BRAAK , VERDONSCHOT, 1995), para ordenação das análises foram feitas com o programa CANOCO versão 4.5, e ultilizado o teste Monte Carlo, com isso foi possível observar a significância das variáveis ambientais e grupos fitoplanctônicos e biomassa de macrófitas no açude Cruzeta. Também foi ultilizado o software Microsoft Office Excel, versão 2003, para os gráficos de comparação.
3.10NORMATIZAÇÃO DO TEXTO
",5 # '" $95$ !# :$#)'7;< 3 $ ,!:$ =$):! . ' ; ;< '7,$ > ' #'::5 ! <
)5# 5) $ "5 # !' '" )5* $ 3 )6'!) '" :!/$)! ') ; $3 )$*!,
? ",5@ #!$ $3 :$#)-"! $3 $952 !#$3 6$)!$%A 3 #,!:2 !#$3 .,'B$!3 #': " ! ' ) .!' $, 3'B)
$ #':5 ! $ "! '7,$ # C !#$ ' $%5 )5* $D ) &' ' :!/E)! ' )$3!, !)'F
Ranielly Karen de Oliveira1, Fabiana Rodrigues A. Câmara2, Naithirithi T. Chellappa & Sathyabama Chellappa1*
!.5) 3(8
$B , 3( 3
) !.' 3 )2 35B: ! ' 7$)$ 75B,!#$%&' $ ) 6!3 $ 95$ !# ' $ <
( G G1/ HHG
6!3 $ 4 ? I F
E) $( !@ #!$3 !',-.!#$3
Artigo I
",5 # '" $95$ !# :$#)'7;< 3 $ ,!:$ =$):! . ' ; ;< '7,$ > ' #'::5 ! <
)5# 5) $ "5 # !' '" )5* $ 3 )6'!) '" :!/$)! ') ; $3 )$*!,
? ",5@ #!$ $3 :$#)-"! $3 $952 !#$3 6$)!$%A 3 #,!:2 !#$3 .,'B$!3 #': " ! ' ) .!' $, 3'B)
$ #':5 ! $ "! '7,$ # C !#$ ' $%5 )5* $D ) &' ' :!/E)! ' )$3!, !)'F
Ranielly Karen de Oliveira1, Fabiana Rodrigues A. Câmara2, Naithirithi T. Chellappa & Sathyabama Chellappa1*
1
Department of Oceanography and Limnology, Federal University of Rio Grande do Norte, Natal, RN, Brazil, karenufrn@yahoo.com.br,*bama@dol.ufrn.br
2
Agricultural school of Jundiaí, Federal University of Rio Grande do Norte, Natal, RN, Brazil, fabirac@gmail.com
Corresponding author: Naithirithi T. Chellappa, Via Costeira, s/ n. Praia de Mãe Luiza CEP 59014B100 Natal/RN. Telephone: +558432154957. eBmail: chellappa@dol.ufrn.br.
Will be submitted for the Aquatic Botany Journal Impact factor 1.129
pressure on freshwater. This background information with which the present study was undertaken in the Cruzeta impoundment, a shallow reservoir, the only source of potable water of Cruzeta city, hinterland of the state of the Rio Grande do Norte state of Brazil. The regional consequence of the global warming and the increased surface water temperature contributed a significant growth of the aquatic macrophytes in the years 2008B2009. The aim of the present study is to understand phytoplankton dynamics in relation to macrophyte dominated ecosystems, with the improved transparency and resourceBrelated competition between these two autotrophic communities. This study presents a comparison of years 2004B2005 and presently dominated by diverse aquatic
macrophytes, sp and sp, and
its possible interference on the ecology of phytoplankton. The samplings had been carried through September of 2008 and April of 2009 always between 10:00 and 12:00 h with the aid of Van Dorn bottle and the plankton net of 20 cm. The collection were made in three depths ie., surface, midB column and bottom. The PhysicalBChemical parameters such as pH, temperature, electrical conductivity and dissolved oxygen had been analyzed . The samples for analysis of nutrients and chlorophyll were kept under refrigeration and analyzed in the laboratory. Phytoplankton samples were preserved in LugolBiodine and qualiBquantitative were made from sediment and counting of phytoplankton cells, colonies and filaments done through SedgwickBRafter counting chamber. Chlorophyll of phytoplankton biomass was analyzed from the samples extracted with cold 90% acetone. The results indicate changes in concentration both on spatial and temporal scale of selected variables, when compared to the values to the 2004B2005 study period. The temperature was always presented higher in relation to the 2004B2005 study. Phytoplankton species showed a relative abundance of the Cyanophyceae for both the period of dry and rainy.
The predominance species are filamentous , ,
and . The concentration of the nutrients such
filamentous cyanobacterial dominance, the increase in temperature and transparency of the water during the period of the study.
J <=') 3(Cruzeta reservoir, Macrophyta, Phytoplankton, Climatic changes
35:'
Os ecossistemas rasos de água doce historicamente têm recebido menos atenção do que pesquisas de lagos profundas e reservatórios, apesar da sua prevalência no mundo. As ameaças crescentes impostas pelas mudanças climáticas, a chegada de espécies exóticas, eutrofização e problemas associados da procura incessante de água doce para consumo e irrigação, agora ganha força de pesquisa em todo o mundo nos últimos 5 e 10 anos. O objetivo deste trabalho foi avaliar a qualidade da água e a ecologia do fitoplâncton no açude Cruzeta, situado na região semiBárida do Rio Grande Norte. Durante o estudo foi levado em consideração o papel das macrófitas aquáticas frente ao cenário regional de aquecimento das águas superficiais, proporcionados pelas mudanças climáticas. Este açude apresenta grande importância, uma vez que representa a única fonte de abastecimento de água do município de Cruzeta, RN. A hipótese mais contundente é a de que o crescimento da vegetação de macrófitas tende a aumentar a transparência da água, reduzindo consequentemente, a biomassa fitoplanctônica. Fato que ocorre principalmente devido às macrófitas aquáticas poderem interagir com a comunidade fitoplanctônica, como potenciais competidores de luz e nutrientes inorgânicos dissolvidos. Os resultados encontrados durante o presente estudo foram comparados com o ano 2004B2005, onde não houve presença expressiva da comunidade de macrófitas aquáticas. O presente estudo vem elucidar as interferências sobre a ecologia da comunidade fitoplanctônica a partir da presença significativa de macrófitas aquáticas
( , , e sp.). As coletas foram
Borzy ( sp), Brunnthaler e
Ag. e (Wolosz). A concentração de nutrientes,
como nitrato e ortoBfosfato apresentaram sempre valores mais elevados durante o período chuvoso e do nitrogênio amoniacal valores moderados no período de estiagem, com leve aumento no período chuvoso. Concluímos principalmente que a redução na concentração de clorofila , na diversidade do fitoplâncton, aumento da transparência e aumento da temperatura da água, durante o período em estudo, podem ter sido ocasionadas pela elevada biomassa de macrófitas aquáticas neste ecossistema quando comparada ao período de 2004B2005 em que houve uma baixa biomassa de macrófitas.
)' 5# !'
Reservoirs are among the dynamic, diverse and productive freshwater ecosystems of the world, and they provide a series of ecosystems services to human (Thornton et al., 1990). The multiple utilities of these ecosystems, particularly for the improvement of inland fisheries in semiarid northeast Brazil is an important costBbenefit project (Chellappa et al., 2006). Reservoir eutrophication is either natural or cultural, and infrequently stimulates or not the growth of macrophytes, which radically alters the structure and functioning of abiotic and biotic components of shallow water reservoirs (Tundisi, Tundsi, 2008; Sayer et al., 2010) Aquatic macrophyte communities are often present along the littoral zone of freshwater water bodies harboring, among other organisms, zooplankton, macroinvertebrates and some fish fauna characterized by small species or juveniles of species. This microhabitat offers faunal biota both shelter and foraging places (Delariva et al., 1994; Mulderij et al., 2007). Besides, they play very important role of in improving water transparency by reducing sediment reBsuspension and nutrient levels (Scheffer, 1998). They provide structurally complex environmental heterogeneity and stimulate numbers and types of niches (Chamber et al., 2008). Laboratory experiments shown that many macrophyte species produce allelopathic substances and inhibit phytoplankton growth (Mulderij et al., 2005; Gross et al., 2007). Furthermore, this microhabitat is also utilized as a spawning site by various fish species (Vazzoler, Menezes, 1992). Fish communities associated with aquatic macrophytes take advantage of the food availability in this microhabitat where the plants form a substratum in which algae and bacteria develop as epiphytes and accumulate detritus, contributing to the abundance of invertebrates (Junk, 1973). Ecological interactions between fish communities and macrophytes in Brazil have been studied in the Amazon (Junk, 1973; AraújoBLima et al., 1986; Soares et al., 1986) and Paraná basins (Delariva et al., 1994; Meschiatti et al., 2000) and São Paulo (Agostinho et al., 1992; Mendes, Cassati et al., 2003) but studies of phytoplankton assemblages (Fonseca, Bicudo, 2010; Sayer et al., 2010) are few and far between.
Brazil; where the last three years witnessed an exaggerated growth of floating and submerged vegetation, a situation greatly altered from the earlier study of 2003B2005 (Chellappa, et al. 2008). Therefore, it was felt imperative to study the ecological interactions between increasing biomass of macrophytes and phytoplankton composition. The aim of the present study is to address two fold interests: 1) the spatial distribution of phytoplankton community and chlorophyll biomass to understand the resourceBcompetition between them for nutrient availability and 2) temporal variability as a solution to stability of species richness among phytoplankton communities.
$ )!$, $ : ;' 3
!"#
'5)# :SEMARH/ RN, 2008
Figure 1.Localization Cruzeta reservoir, Rio Grande do Norte, Brasil.
Table 1. Morphometric and hydrological characteristics of Cruzeta reservoir, RN
Maximum capacity 35.000.000 m3
Drainage area 1.010Km2
Volume 26.010.000m3
Discharge rate 0,174 m3/s
Annual rainfall 650,00 mm
Height of the dam 14,50m
Maximum depth 11,00m
Mean depth 4,5m
Theoretical retention time > 180 days
study period. The field kit of WTW Multi 340i MultiBparameter probe was used in the field to measure pH, temperature, electrical conductivity and dissolved oxygen. Turbidity was analyzed with the help of standard Secchi disc. For analysis of inorganic nutrients, the water samples were refrigerated and transported to the laboratory for analyses. The samples were initially filtered using Whatman GF/F filters, which was followed by analysis of nitrate (Goltermann et al., 1978), orthophosphate (APHA, 1985), and ammonium concentrations (Goltermann et al., 1978).
Water transparency as well as total phosphorous, and chlorophyll concentrations were used to calculate the trophic status index of Carlson (1977), modified by Toledo et al" (1983) for its use in tropical environments.
Information on spatial and temporal changes of the phytoplankton community and the physiological status of its cells were obtained from quantitative analyses of phytoplankton and chlorophyll . Water samples were packed and protected from the light. Filtration was done through 0.7 mm Whatman filters (GF/F) during 24 h to estimate total chlorophyll . After filtration, the pigments were extracted with 90% acetone at 4°C in the dark during 24 h. The samples were analyzed on a Libra S6 spectrophotometer (Biochrom), at wavelengths of 665nm and 750nm. The absorption values corresponding to the analysis of chlorophyll were later inserted in the formula described by Marker et al. (1980) to obtain its concentration in cgLB1.
Phytoplankton samples were preserved in 4% LugolBformaldeyde solution in the field. It was sedimented and analyzed using an optical microscope down to the species level or to the highest possible taxonomic resolution using the specific literature (Barber, Haworth, 1981; Komárek, Anagnostidis, 1999; Sant’Anna, Azevedo, 2000; Wehr, Sheath, 2003 and Bicudo, Menezes, 2005). Phytoplankton was counted through SedgewickBrafter counting cells using an optical microscope .
of volume infestation (PVI) under water (Canfield et al., 1984). The calculus of PVI was done through the following equation:
PVI (%) = MacC x MacL D
Where, McC is the macrophyte coverage (%), MacL is the macrophyte lengh in water column (m) and D is the depth (m). The macrophyte coverage was estimated visually in percentage within 1 m2.
!"$
One Way ANOVA (p<0,5) for temporal variation the nutrients inorganics of Cruzeta reservoir. Principal component analysis (PCA) with the program XLSTAT version 5.2 and canonical correspondence analysis (CCA) to determine the relationships between phytoplankton group composition and physicalBchemical environmental variables (Ter Braak, Verdonschot, 1995). The ordination analyses were performed with the program CANOCO version 4.5. To evaluate the significance of CCA axes and of the variables which defined these axes, Monte Carlo tests were performed with 999 unrestricted permutations. Thus, it was possible to test the significance of the environmental variables in determining the ordination patterns of relative abundance phytoplankton groups and biomass of macrophytes in Cruzeta reservoir.
35, 3
waters of 2008B2009 samples (Fig. 4b). In general, the dissolved inorganic nutrient levels are higher for nitrate and phosphate when compared to ammoniacal nitrogen at the three chosen sites and are particularly more expressive during rainy season (Fig. 4c). Table 2 reveals the results of One Way ANOVA test based temporal distribution for nutrients value between the two different study periods, which was significant (p < 0.05).
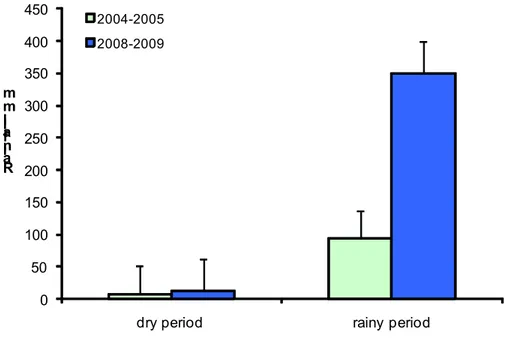
R a in fa ll m m
T e m p e ra tu re ( °C ) E le c tr ic a l c o n d u c ti v it y S .c m 1 p H
Figure 3. Temporal variation of abiotic factors a. pH, b. temperature and c. electrical conductivity in Cruzeta reservoir.
a
b
T ra n s p a rê n c y ( m ) D is s o lv e d o x y g e n m g .L
!"" #" $ % % & %
N u tr ie n ts m g .L 1
Figure 4. Temporal variation of abiotic factors a. dissolved oxygen, b. transparency, c.nutrientes in Cruzeta reservoir.
b
Table 2. ANOVA One Way (p<0,5) for the temporal variation of inorganic nutrients in açude Cruzeta, RN ' (! ) *+ , ' -' -.
!"" #" ' -'
-.
$ %
% & % ' -'
-.
Chlorophyll concentrations used as functional component of ecosystems registered a significant decline compared to the 2004B2005 data. This is due to the interBspecific resource competition on shared common resource between phytoplankton and the increased biomass production of macrophyte registered in the present study. Such decline was marked in both seasons and in vertical profile (Fig. 5).
C h lo ro p h y ll ) g .L 1
number of species was chlorophyceae (21 species), followed by Bacillariophyceae and Cyanobacteria. A total of 37 and 53 taxa were identified for the dry and rainy season for the present study and showed a reduction of 16.6% and an increase 3.8% for temporal variation. There was an overwhelming dominance of cyanobacteria species representing 93.9% in dry season and 68.5% in rainy season for the period of 2008B2009. Phytoplankton species diversity was considerably reduced from 2004B2005 to 2008B2009 period and depicts that the cyanobacterial species assumes the role of superior competitor among the phytoplankton species (Fig. 6). Two important species of filamentous cyanobacterial species such of
and are the most frequent and abundant in 2008B2009 periods
#'
,'
.
!#
$
,
!
!#
3
% && & & " "
Figure 6. Temporal variation of ecological indices (richness, diversity, similarity and dominance) in Cruzeta reservoir
/
Tabela 3.List of microalgae and Abundance on the Cruzeta resevoir/RN, for periods of drought and wet years 2004B2005 e 2008B2009.
+K J I GG1/ GGL GGM/ GGN
) & ) &
+ +K
% Kuetzing 0,71 2 B B
&Teiling) Fott B 2,75 B B
Fott B B 0,05 0,06
sp B B 0,08 0,63
sp B 3,81 B 2,48
sp B 2,00 B B
sp2 B B B 0,81
Adlerstein B B B 0,06
Archer 0,27 0,38 B B
Naegeli 1,31 0,76 0,08 0,69
Nordstedt 1,02 B B B
sp B 0,61 B 0,06
&Naegeli) Komárek 0,54 1,75 B 0,06
sp B 0,42 B B
' &Ralfs) De Bary 1,5 B B B
' sp 3,39 1,01 0,08 1,38
Ehrenberg B 0,67 B B
sp 1,78 1,8 0,13 2,36
Ettl and Gartner 0,47 B B 0,92
sp 1,38 4,78 B 0,58
sp 1,12 1,37 0,03 0,17
sp 2,08 B B B
sp B 1,77 B B
sp B 2,99 B B
B B B 0,29
(Turpin) Kuetzing 0,94 B B B
(Turpin) Brébisson 24,69 30,84 0,39 0,29
sp B B 0,08 0,12
Uherkovich B 0,5 B B
Chodat 0,36 0,67 B B
Nordstedt 1,19 B 0,08 0,06
sp B B B B
( sp1 0,71 0,83 B B
( sp2 B B B 0,23
( sp B B 0,03 B
' $, 1 D1O O DH DG D 1
K +K
Robenhorst ex Bornet et Flahault 0,47 0,33 5,49 3,11
Brunnthaler 0,36 B 6,07 3,40
Klebahn 0,56 B 0,45 0,12
) * + Komarek B B 0,08 1,33
) sp B B 0,19 1,04
- B B 0,03 0,12
- sp B B B 0,40
Ag. 2,88 B 5,70 0,52
(Smith) Echdrateva 0,36 B 0,34 0,86
. sp B 0,67 B B
.sp B B 0,03 B
Lauterborn 0,54 1,27 B B
/ 0 Fritsch and Rich 2,67 B 0,45 1,15
/ sp B B 0,08 3,40
/ 0 sp B 0,67 B B
1 Kutz 0,54 0,67 B B
sp1 B 0,99 B 0,35
sp2 B B B B
( Klebahn 0,36 0,67 B B
( sp 1,54 B B B
2 sp B 1,25 B B
' $, OD GD O N DN OMD1H
+K
0 Kutz B 0,67 B B
sp 1,54 0,54 B B
* Hass B B 0,03 B
&3 - 4Simonsen 0,54 B 2,23 4,73
sp B B 0,24 0,46
Kutz 1,54 B 0,18 0,06
Hilse 0,54 0,83 B B
sp B 0,64 B B
5 Grunow B 1,85 B B
, (Ehr.) Cleve B B 0,03 0,06
, Augir Ehr. 1,08 2,53 B 0,06
, sp B 0,64 B 0,06
, sp B 1,91 0,08 0,46
0 (Ehr.) B B B 0,12
0 Kuetzing B 3,67 B B
0 * Grev. B 0,67 0,08 0,23
0 Krasske 1,35 0,42 B B
0 Kutzing B 1,27 B 0,06
0 sp1 B 0,67 B B
0 sp2 B B B 0,06
) sp 1,54 0,64 0,08 0,35
Hustedt 1,54 B 0,24 B
Gregory B B B B
/ sp 1,54 0,87 B B
Ehr. 11,59 3,02 B B
sp B 0,51 B B
Cont. tab. 2
( sp B B 0,03 B
' $, LDMM D L LDG GDH
+K
sp 0,47 B B 0,06
, sp 1,02 B 0,03 0,06
' $, D1N G GDG GD
+ K +K
- Asmund B 0,87 B B
- Iwanoff 1,53 0,56 B B
' $, DL D1 G G
+K
Stokes 1,53 2,69 B 2,42
sp B B B 4,27
sp B B B 0,17
' $, D1 DON G ODMO
' ' ' '' ' ' ' ' ' $ 01 ) $ ) 2 " #
0
2 &
a xis F 1 ( 4 9 %) >
Figure 7. Biplot of the Principal Components Analysis (PCA) applied to the parameters physicoBchemical (vectors) and periods studied (♦). E1. dry 2004B2005, E2. 2008B2009 dry, C1. Rainy 2004B2005 and C2. Rainy 2008B2009.
Figure 8. Biplot of Canonical Correspondence Analysis (CCA) illustrate the distribution
of physicochemical parameters with regard to macrophyte biomass and phytoplankton groups in Cruzeta resevoir. / / / / % ' % - !
N N O3
N NH 4 Orto fo s OD
pH C on d El.
Tra ns p
-1 !3#533!'
Aquatic macrophytes play an important role in the structure and function of freshwater ecosystems and their role is reduced when climate change and eutrophication threatened freshwaters and favor exotic species at the expense of native species. Besides they provide a structurally complex environment over spatial scale and such environment heterogeneity increase numbers and types of niches (Chambers et al., 2008). The present study shows an increased biomass of macrophytes and the relative abundance of cyanobacterial species. The success of cyanobacterial species and their abundance in both dry and rainy season responded to the warming effect of temperature and the successful outcome of resource competition over other phytoplankton species may be mediated by density of macrophytes for the years 2008B2009. The
presence of filamentous cyanobacterium species, has long been
considered as an invasive species and adapted well to wide range ecosystems and geographical distribution (Padisak, 1997) and this species was dominant and persistent and numerically abundant mediated by dense biomass of macrophytes found both in dry and wet season of 2008B 2009. We considered that this species showed adaptive potential to surface temperature increase combined with the quality of superior competitor among other phytoplankton species and resistant to any allelopathic effect from macrophytes.
There was an agreeable consensus among ecologists that biodiversity is a key factor in ecology and directly related to the regulation and functioning of the ecosystems. Both abiotic and biotic factors contributed to the variability of phytoplankton diversity at different scales with space and time (Chalar, 2009). He correlated that high phytoplankton species diversity to vertical attenuation coefficient values in Salto Grande Reservoir of Uruguay. However, the present study reveals that neither transparency of water or chlorophyll value nor phytoplankton species diversity correlated to light limitation condition.
(Sayer et al., 2010; Fonseca and Bicudo 2010). According to Sayer et al., (2010) broad gradient of nutrients and plant abundance showed clear water situation with low chlorophyll and low total phosphorus (TP), while turbid water bodies exhibited high chlorophyll a high TP and sparse vegetation. They also suggested that the ecosystems exhibit potential alternate state in which the condition switch abruptly between macrophyte dominated state with clear water and a turbid situation with phytoplankton dominated state along with suspended solids reflecting similar condition to the theory of alternate stable state (Moss, 1996;Scheffer, 2004). The other longBterm study conducted in the subtropical water bodies of southern Brazil too indicated how the aquatic vegetation exerted a great impact on shallow lakes metabolism, and shift in phytoplankton species composition, diversity and dominance ratio in the response of macrophyte influence and trophic State index (Crossett and Bicudo, 2008; Fonseca and Bicudo 2010). The present study shows improved transparency, low chlorophyll a, the reduction of 37% in phytoplankton species composition and phytoplankton diversity in the years of 2008B2009 when the reservoir was dominated by diverse and higher biomass of macrophytes compared to sparse lower biomass macrophytes from the data of 2004B2005. Although our study highlights two annual cycle data still our results share some of the conclusions of macrophyteBphytoplankton interaction from the longBterm studies of temperate and subtropical freshwater studies of Sayer et al., (2010), Crossett et al., (2010) and Fonseca and Bicudo, (2010). The Multivariate CCA analyses revealed temporal rather than spatial distribution of phytoplankton was significant.
L ' #,53!'
improved transparency but low chlorophyll biomass and pronounced temporal difference than spatial.
#> '=, . : 3
The authors acknowledge the financial assistance in the form of a Grant from CAPES (Coordination of Perfectioning of Staff of Superior Level)/MCT(Ministry of Scienceand Technology) and CNPq (National Council for Research and Technological Development)/MCT(Ministry of Scienceand Technology) of Brazil.
O " ) # 3
Agostinho, A.A., Júlio JR., H.F., Borghetti, J.R. 1992. Considerações sobre os impactos dos represamentos na ictiofauna e medidas para sua atenuação. Um estudo de caso: Reservatório de Itaipu. Revista UNIMAR, Maringá, 14 (Suplemento): 89B107.
APHA, 1985. American Public Health Assciation. Standard methods for examination of water and wasterwater. 16ªed. 1527 p.
AraújoBLima, C.A., Portugal, L.P.S., Ferreira, E.G. 1986. FishBmacrophytes relationship in the Anavilhanas Archipelago, a black water system in the central Amazon. Journal of Fish Biology, 29, 1B11.
Barber, H.G., Haworth, E.Y. 1981. A guide to the morphology of the diatom frustule. Ambleside: Freshwater Biological Association, 112 p. (Scientific Publication, no. 44).
Bicudo, C.E.M., Menezes, M. 2005. Gêneros de algas de águas continentais do Brasil: chave para identificação e descrições. São Carlos: Rima, 489 p.
Casatti, L.,H.F. Mendes, K.M. Ferreira. 2003. Aquatic macrophytes as feeding site for small fishes in the Rosana Reservoir, Paranapanema River, Southeastern Brazil. Brazilian Journal of Biology, 63, 213B222.
Chalar, G., 2009. The use of phytoplankton patterns of diversity for algal bloom management. Limnologica 39, 200–208.
Chambers, P.A., Lacoul, P., Murphy, K.J., Thomaz, S.M., 2008. Global diversity and aquatic macrophytes. Hydrobiologia, 595, 9B26.
Chellappa, N.T., Chellappa, T., Lima, A.K.A., Medeiros, J. L. ; Souza, P.V.V., Chellappa, S. 2006. Ecology of freshwater phytoplankton assemblages from a tropical of Northeastern Brazil. International Journal of Lakes and Rivers, Inglaterra, v. 01, n. 01, 61B81.
Chellappa, N.T., Borba, J.M. , Rocha, O. 2008. Phytoplankton community and physicalBchemical characteristics of water in the public reservoir of Cruzeta, RN, Brazil. Braz.Jour.Biology., 68, 631B 637.
Chellappa, N.T., Borba, J.M. and Rocha, O., 2008. Phytoplankton community and physicalB chemical characteristics of water in the public reservoir of Cruzeta, RN, Brazil. Braz. J. Biol", 68, 477B494.
Crossetti L.O, Bicudo, D.C., Bicudo, C.E.M and Bini, L.M. 2008. Phytoplankton diversity changes in a shallow tropical reservoir during the hypereuthrophication. Braz. j. biol., 68, 1061B 1067.
Delariva, R.L. et al. 1994. Icthyofauna associated to aquatic macrophytes in the upper Paraná river floodplain. Rev. Unimar, Maringá, 16, 41B60.
Fonseca, B. M., Bicudo, C.E.M., 2008. Phytoplankton seasonal variation in a shallow stratified eutrophic reservoir (Garças Pond, Brazil). Hydrobiologia, 600, 267–282. Freshwater Biol., 52, 1120–1133.
Fonseca, B.M., Bicudo, C.E.D.M., 2010. How important can the presence/absence of macrophytes be in determining phytoplankton strategies in two tropical shallow reservoirs with different trophic status?. Journal of Plankton Research 32, 31B46.
Golterman, H.L., Clymo, R.S., Ohnstad, M.A.M., 2007. Methods for physical and chemical analysis of Freshwaters. IBP Handbook, Blackwell Sci. Publ. Oxford. 215p. 1978.
Gross, E.M., Hilt, S., Lombardo, P. et al., 2007. Searching for allelopathic effects of submerged macrophytes on phytoplankton—state of the art and open questions. Hydrobiologia, 584, 77–88.
Junk, W.J., 1973. Investigations on the ecology and productionBbiology of the "floatingBmeadows" (PaspaloBEchinochloetum on the Midle Amazon). II — The aquatic fauna in the rootBzone of floating vegetation. Amazoniana, IV: 9B102.
Komárek, J., Anagnostidis, K., 1999. Cyanoprokaryota, 1: Chroococcales. In Ettl, H., Gartner, G., Heynig, H. and Mollenhauer, D. (Eds.). 6 * 0 - " Stuttgart: Gustav Fischer Verlag 1B548 p.
89–100.
Mulderij, G., Mooij, W. M. & Van Donk, E., 2005b. Allelopathic growth inhibition and colony
formation of the green alga by the aquatic macrophyte .
Aquatic Ecology 39, 11–21.
Nakamura, K., Kayaba, Y., Nishihiro, J. et al., 2008. Effects of submerged plants on water quality and biota in largeBscale experimental Landscape Ecol. Eng., 4, 1–9.
NaselliBFlores, L. and Barone, R., 2000. Phytoplankton dynamics and structure: a comparative analysis in natural and manBmade water.
O’Farrell, I., Pinto, P.T., Izaguirre, I., 2007. Phytoplankton morphological response to the underwater light conditions in a vegetated of the art and open questions. Hydrobiologia, 584, 77– 88. ponds.
Padisák J. 1997. (Woloszynska) Seenayya et Subba Raju, an
expanding, highly adaptive cyanobacterium: worldwide distribution and review of its ecology. Archiv für Hydrobiologie/Suppl. 107 (Monographic Studies): 563B593.
Reynolds, C.S., Dokulil, M., Padisák, J., 2000. Understanding the assembly of phytoplankton in relation to the trophic spectrum: where are we now? Hydrobiologia, 424, 147–152.
Serhid, Secretaria de Estado do Meio Ambiente e dos Recursos, 2008 Coordenadoria de gestão dos recursos hídricos. Plano estadual de recursos hídricos. Disponível em <http:// www.serhid.rn.gov.br>, acesso em: 20 de janeiro.
Sayer C.D. Burgess A., Kari K" Peglar S" Davidson T.A. Yang H" 8Rose N" 2010"LongBterm dynamics of submerged macrophytes and algae in a small and shallow, eutrophic lake: implications for the stability of macrophyteBdominance. Freshwat Biol 55:565–583
Scheffer, 2004. Ecology of Shallow Lakes. Kluwer Academic Pulblischers, Londres
Scheffer, M. 1998. Ecology of Shallow Lakes. Chapman & Hall, London, 357 pp.
Schriver, P., Bøgestrand, J., Jeppensen, E. et al. 1995. Impact of submerged macrophytes on fishB zooplanktonBphytoplankton interactions: largeBscale enclosure experiments in a shallow eutrophic lakes. Freshwater Biol., 33, 255–270.
Soares, M.G.M., Almeida, R.G.; Junk, W.J., 1986. The tropic status of the fish fauna in lago Camaleão e macrophyte dominated Floodplain Lake in the middle Amazon. ) , 9(4): 511B526.
Søndegaard, M., Moss, B., 1998. Impact of submerged macrophytes on phytoplankton in shallow freshwater lakes. In Jeppensen, E., Søndegaard, M. and Christoffersen, K. (eds), The Structuring Role of Submerged Macrophytes in Lakes. Ecological Studies, vol. 131. Springer Verlag, NY, p. 115–132.
Takamura, N., Kadono, Y., Fukushima, M. et al., 2003. Effects of aquatic macrophytes on water quality and phytoplankton communities
TerBBraak, C.J.F. and Verdonschot, P.F.M., 1995. Canonical correspondence analysis and related multivariate methods in aquatic ecology" " .,vol. 57, no. 3, p. 255B289.
Tundisi, J.G.; Tundisi, T.M., 2008. Limnologia. São Paulo: Oficina de Textos. 631 p.
Vazzoler, A.E.A.; Menezes, N.A. 1992. Síntese de conhecimentos sobre o comportamento reprodutivo dos Characiformes da América do Sul (Teleostei, Ostariophysi). / 0" % " % " 52 ,627B640.