UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
OTIMIZAÇÃO E VALIDAÇÃO DE MÉTODOS ANALÍTICOS PARA A
DETERMINAÇÃO SIMULTÂNEA DE TUBERCULOSTÁTICOS (4-FDC) POR CLAE/DAD E CLUE/DAD
AUTOR DISCENTE: MARCELO VÍTOR DE PAIVA AMORIM ORIENTADOR: PROF. CÍCERO FLÁVIO SOARES ARAGÃO
MARCELO VÍTOR DE PAIVA AMORIM
OTIMIZAÇÃO E VALIDAÇÃO DE MÉTODOS ANALÍTICOS PARA A
DETERMINAÇÃO SIMULTÂNEA DE TUBERCULOSTÁTICOS (4-FDC) POR CLAE/DAD E CLUE/DAD
Dissertação apresentada à Coordenação do Programa de Pós-graduação em Ciências Farmacêuticas, como requisito para obtenção do título de Mestre em Ciências Farmacêuticas.
AGRADECIMENTOS
Aos professores do Programa de Pós-graduação em Farmácia, de fundamental importância para minha formação, especialmente ao meu orientador Prof. Dr. Cícero Flávio Soares Aragão, por toda orientação, apoio e ensinamentos fundamentais. Você contribuiu intensamente para a formação do meu conhecimento. Obrigado!
As funcionárias do Programa de Pós-graduação em Farmácia, Fábia e Aureliana, sempre gentis e prestativas, um apoio fundamental durante todo curso.
Aos colegas do laboratório de Controle de Qualidade do NUPLAM, Dayanne Porto, Ana Angélica, Josinalva Silva, Liliane Cunha e Ingrid Queiroz pela amizade, ajuda e apoio durante a realização deste trabalho.
Aos colegas de trabalho do NUPLAM, Anne, Andreza e Isabel, que me apoiaram e me deram palavras de incentivo. Em especial ao Prof. Dr. Carlos Lima pela amizade, incentivo, força e motivação, além de ter cedido às instalações do laboratório e o apoio para a realização deste trabalho.
Gostaria de agradecer em especial aos meus colegas de laboratório do LCQ, Profa. Dra. Ana Paula, Lilian, Thereza e Regina pelo apoio, amizade e troca de experiências.
Aos meus amigos Bruno Gazola, Juliana Fernandes, Leonardo de Quadros, Diego Dantas, Fabrícia Lima, Jessica Fonseca e Waldemar Alves pelo apoio, companheirismo, amizade e todas as experiências que ajudaram a construir esse caminho.
À minha querida família, pessoas maravilhosas que me acompanharam sempre e me apoiaram. Em especial a João Batista, Juliene, Janaina e Leonardo, meu alicerce e minha vida, que sempre me apoiaram durante toda caminhada. Obrigado por todo carinho e amor, pelo incentivo para não desistir e seguir sempre em frente. O otimismo de vocês me deu forças e me motivou a continuar sempre! Obrigado, amo vocês.
Principalmente à Deus, por ter me concedido a graça da vida e a oportunidade de concretizar mais um objetivo em minha vida.
RESUMO
variação e porcentagem de recuperação dentro dos limites exigidos (98 a 102%). Os métodos mostraram LD e LQ com níveis baixos demonstrando que os métodos possuem elevada sensibilidade aos quarto fármacos. A robustez foi avaliada frente às alterações de temperatura e fluxo, onde os métodos demonstraram-se robustos apenas nas condições previamente estabelecidas de temperatura e fluxo, alterações bruscas podem acarretar influência nos resultados dos métodos.
ABSTRACT
changes, where they showed robustness just with the preview conditions established of temperature and flow, abrupt changes may influence with the results of methods.
Keywords: Isoniazid, Pyrazinamide, Ethambutol, Rifampicin, High Performance
LISTA DE FIGURAS
Figura 1 - Estrutura química dos quatro fármacos tuberculostáticos: isoniazida (A), pirazinamida (B), etambutol (C) e rifampicina (D). ... 23
Figura 2: Esquema de distribuição de espécies ionizadas e não-ionizada de isoniazida conforme alteração de pH. Gráfico gerado pelo MarvinSketcht. ... 24
Figura 3: Esquema de distribuição de espécies ionizadas e não-ionizada de pirazinamida, conforme alteração de pH. Gráfico gerado pelo MarvinSketcht. ... 26
Figura 4: Esquema de distribuição de espécies ionizadas e não-ionizada do etambutol, conforme alteração de pH. Gráfico gerado pelo MarvinSketcht. ... 28
Figura 5: Esquema de distribuição de espécies ionizadas e não-ionizada da rifampicina, conforme alteração de pH. Gráfico gerado pelo MarvinSketcht. ... 30
Figura 6: curva de Van Deemter para diferentes tamanhos de partículas (1,7; 3; 5 e 10 µm) (NOVÁKOVÁ et. al., 2006a). ... 34
Figura 9: Cromatogramas obtido por CLAE (A) Branco, (B) Solução teste dos Excipientes, (C) Solução Padrão Isoniazida, (D) Solução Padrão de Pirazinamida, (E) Solução Padrão de Etambutol, (F) Solução Padrão de Rifampicina, (G) Solução Padrão dos quatros fármacos e (H) Solução teste de comprimido do 4 em 1. Os picos representados como 1, 2, 3 e 4 correspondem a isoniazida, pirazinamida, etambutol e rifampicina, respectivamente. ... 62
comprimido do 4 em 1. Os picos representados como 1, 2, 3 e 4 correspondem a isoniazida, pirazinamida, etambutol e rifampicina, respectivamente. ... 63
Figura 11: Visão 3D dos espectros da solução padrão dos quatro fármacos obtido por CLAE. ... 64
Figura 12: Visão 3D dos espectros da solução padrão dos quatro fármacos obtido por CLUE. ... 64
Figura 13: Curvas analíticas das três injeções da solução padrão de isoniazida, pirazinamida, etambutol e rifampicina por CLAE. ... 68
Figura 14: Gráficos da plotagem de resíduos dos fármacos por CLAE. ... 70
Figura 15 - Curvas analíticas das três injeções da solução padrão de isoniazida, pirazinamida, etambutol e rifampicina por CLUE. ... 73
Figura 16: Gráficos da plotagem de resíduos dos fármacos por CLUE. ... 75
Figura 17: Cromatograma do Limite de Detecção Real pelo método 3 por CLAE. Os picos de 1 a 4 representam isoniazida, pirazinamida, etambutol e rifampicina, respectivamente. ... 78
Figura 18: Cromatograma do Limite de Quantificação Real pelo método 3 por CLAE. Os picos de 1 a 4 representam isoniazida, pirazinamida, etambutol e rifampicina, respectivamente. ... 78
LISTA DE TABELAS
Tabela 1 - Condições cromatográficas para análise dos métodos analíticos 1 e 2 em CLAE. ... 46
Tabela 2 - Condições cromatográficas para análise do método analítico 3 em CLAE. ... 47
Tabela 3 - Condições cromatográficas para análise do método analítico 4 em CLUE. ... 47
Tabela 4 – Concentrações de isoniazida, pirazinamida, etambutol e rifampicina para a linearidade dos métodos 3 e 4 por CLAE e CLUE, respectivamente. ... 51
Tabela 5 - Parâmetros de adequabilidade do sistema de solventes (métodos 1 e 2) por CLAE. ... 57
Tabela 6 - Parâmetros de adequabilidade do sistema da especificidade da solução padrão dos quatros fármacos pelo método 3 por CLAE. ... 65
Tabela 7 - Parâmetros de adequabilidade do sistema da especificidade da solução padrão dos quatros fármacos pelo método 4 por CLUE. ... 65
Tabela 8 - Estudo da linearidade para os fármacos isoniazida e pirazinamida por CLAE. ... 66
Tabela 9 - Estudo da linearidade para os fármacos etambutol e rifampicina por CLAE. ... 67
Tabela 11 - Estudo da linearidade para os fármacos isoniazida e pirazinamida
por CLUE... 71
Tabela 12 – Estudo da linearidade para os fármacos etambutol e rifampicina por CLUE. ... 72
Tabela 13 - Teste da ANOVA dos resultados obtidos na regressão linear dos dados da linearidade das soluções padrão de isoniazida, pirazinamida, etambutol e rifampicina por CLUE. ... 74
Tabela 14 – Estudo do LQ e LD dos quatros fármacos por CLAE e CLUE. ... 77
Tabela 15 - Estudo da repetibilidade da solução padrão dos quatro fármacos por CLAE. ... 79
Tabela 16 - Estudo da repetibilidade da solução padrão dos quatro fármacos por CLUE. ... 80
Tabela 17 - Estudo da precisão intermediária nos dias 01 e 02 da solução teste dos comprimidos por CLAE. ... 81
Tabela 18 - Estudo da precisão intermediária nos dias 01 e 02 da solução teste do comprimido por CLUE. ... 81
Tabela 19 - Estudo da exatidão para isoniazida e pirazinamida por CLAE. ... 83
Tabela 20 - Estudo da exatidão para etambutol e rifampicina por CLAE. ... 84
Tabela 21 - Estudo da exatidão para isoniazida e pirazinamida por CLUE. ... 85
Tabela 23 - Intervalo de recuperação do analito em função de sua concentração na amostra. ... 87
Tabela 24 - Adequabilidade do sistema no estudo da robustez da temperatura do forno da coluna nos métodos 3 e 4 por CLAE e CLUE, respectivamente. ... 88
Tabela 25 - Adequabilidade do sistema no estudo da robustez do fluxo da fase móvel nos métodos 3 e 4 por CLAE e CLUE, respectivamente. ... 89
Tabela 26 - Estudo da validação dos métodos analíticos 3 e 4 para tuberculostáticos por CLAE e CLUE, respectivamente. ... 90
LISTA DE ABREVIATURAS E SIGLAS
ANVISA Agência Nacional de Vigilância Sanitária ANOVA Análise de Variância
AOAC Association of Official Analytical Chemists CDC Center for Disease Control and Prevention CLAE Cromatografia Líquida de Alta Eficiência CLUE Cromatografia Líquida de Ultra Eficiência CV Coeficiente de variação
DAD Detector de arranjo de fotodiodos DMSO Dimetilsulfóxido
DNA Deoxyribonucleic acid
HETP Height Equivalent to a Theoretical Plate ICH International Conference on Harmonisation LD Limite de Detecção
LQ Limite de Quantificação K Fator de capacidade
NUPLAM Núcleo de Pesquisa em Alimentos e Medicamentos RDC Resolução da Diretoria Colegiada
RE Resolução
RNA Ribonucleic acid
r Coeficiente de Correlação
SIDA Síndrome da Imuno Deficiência Adquirida SUS Sistema Único de Saúde
Tr Tempo de retenção
UV Ultravioleta
SUMÁRIO
1 INTRODUÇÃO ... 17
2 FUNDAMENTAÇÃO TEÓRICA ... 21
2.1 A tuberculose: situação atual no Brasil ... 21
2.2 Tratamento Farmacológico ... 22
2.3 Tuberculostáticos ... 24
2.3.1 Isoniazida ... 24
2.3.2 Pirazinamida ... 25
2.3.3 Etambutol ... 27
2.3.4 Rifampicina ... 29
2.4 Métodos de cromatografia líquida ... 31
2.5 Cromatografia Líquida de Ultra Eficiência (CLUE) ... 33
2.6 Adequabilidade do Sistema ... 35
2.7 Validação de métodos analíticos ... 37
3 OBJETIVOS ... 41
3.1 Objetivo Geral... 41
3.2 Objetivos Específicos ... 41
4 MATERIAL E MÉTODOS ... 43
4.1 Materiais ... 43
4.1.1 CLAE para o método 1 e 2 ... 43
4.1.2 CLAE para o método 3 ... 43
4.1.3 CLUE para o método 4 ... 44
4.2 Métodos ... 44
4.2.1 Preparação do Tampão Acetato ... 44
4.2.2 Preparação da solução padrão das substâncias químicas de referência para análise por CLAE do método 1 e 2 ... 44
4.2.3 Preparação da solução padrão das substâncias químicas de referência para análise por CLAE do método 3 e 4 ... 45
4.3 Sistema Gradiente por CLAE ... 45
15
4.4.1 Desenvolvimento do método 3 por CLAE ... 46
4.4.2 Preparação do sistema de fases móveis para métodos 3 e 4 ... 46
4.4.3 CLUE-DAD ... 47
4.5 Desenvolvimento e Validação de Métodos ... 48
4.6 Validação do método analítico ... 48
4.6.1 Especificidade e Seletividade: ... 48
4.6.2 Curva analítica/linearidade: ... 50
4.6.3 Precisão (Repetibilidade e Precisão Intermediaria): ... 51
4.6.4 Exatidão para CLAE e CLUE. ... 52
4.6.5 Limite de quantificação para CLAE e CLUE. ... 52
4.6.6 Limite de detecção para CLAE e CLUE. ... 52
4.6.7 Robustez para CLAE e CLUE... 52
5 RESULTADOS E DISCUSSÃO ... 54
5.1 Métodos 1 e 2 por CLAE ... 54
5.2 Desenvolvimento do método 3 por CLAE ... 57
5.3 Desenvolvimento do método 4 por CLUE ... 60
5.4 Validação do Método Analítico ... 60
5.4.1 Especificidade/Seletividade ... 60
5.4.2 Linearidade/curva analítica ... 66
5.4.3 Limite de Detecção (LD) e Quantificação (LQ) ... 75
5.4.4 Precisão ... 79
5.4.5 Exatidão ... 81
5.4.6 Robustez ... 88
5.6 Comparação entre CLAE e CLUE ... 91
6 CONCLUSÕES ... 94
17 1 INTRODUÇÃO
A tuberculose é uma doença grave, porém curável em praticamente 100% dos casos novos, desde que obedecidos os princípios da moderna quimioterapia. Para assegurar a cura, é necessário que seja feita uma associação medicamentosa adequada em doses corretas, uso por tempo suficiente, com supervisão da tomada dos medicamentos (BRASIL, 2002).
Os esforços para combater a doença por meio do uso de drogas contra a tuberculose não estão livres de problemas. Existe o desenvolvimento da resistência das drogas de primeira linha, rifampicina e isoniazida. Segundo SINGH et. al. (2001), a resistência aos tuberculostáticos ocorre principalmente devido à prescrição inapropriada ou a tomada de medicamentos, resultando em uma monoterapia, por este motivo, a utilização dos fármacos em combinação, poderia possibilitar a redução da prática da monoterapia.
Em virtude da frequência crescente de resistência, os Centers for Disease
Control and Prevention (CDC) nos EUA recomendaram que a terapia inicial consistisse
em um esquema de 4 fármacos (isoniazida, rifampicina, pirazinamida e etambutol ou estreptomicina), enquanto se aguarda os resultados dos testes de sensibilidade (BRASIL, 2002).
O tratamento da tuberculose é longo (mínimo de 6 meses) e por este motivo há vários quadros de abandono do tratamento. Um estudo feito em 2002 (RABAHI et. al.,
18 Devido a isso, o Ministério da Saúde recomenda modificações no tratamento para a tuberculose implementado pelo Programa Nacional de Controle da Tuberculose (PNCT)/Ministério da Saúde (BRASIL, 2009).
A primeira mudança consiste na introdução do etambutol como o quarto fármaco na fase intensiva de tratamento (dois primeiros meses) do esquema básico, e tem como justificativa a constatação do aumento da resistência primária à isoniazida (de 4,4 para 6,0%) e a resistência primária à isoniazida associada à rifampicina (de 1,1 para 1,4%), observado no II Inquérito Nacional de resistência aos fármacos anti-TB realizado em 2007-2008, em comparação com os resultados do I Inquérito Nacional, realizado no período de 1995 a 1997 (BRASIL, 2009).
A segunda mudança consiste em introduzir a apresentação em comprimidos com dose fixa combinada dos 4 fármacos (conhecidos como 4 em 1) para a fase intensiva do tratamento. Os comprimidos são formulados com doses reduzidas de Isoniazida e Pirazinamida em relação às atualmente utilizadas no Brasil.
O esquema básico do 4 em 1 é mundialmente utilizado, com excelentes resultados quanto à efetividade, em particular pela maior adesão ao tratamento. Espera-se que a introdução do quarto fármaco (etambutol) possibilite o aumento do sucesso terapêutico e possa evitar o aumento da multirresistência (resistência a rifampicina + isoniazida), além de fomentar um maior conforto ao paciente, pela redução do número de comprimidos a serem ingeridos (BRASIL, 2009).
De acordo com USP 33 - NF28 (2010) as análises cromatográficas para os fármacos pertencentes ao medicamento 4 em 1 duram em média 15 minutos, para a detecção de três fármacos (isoniazida, pirazinamida e rifampicina) em um método analítico e mais 10 minutos para a detecção do quarto fármaco (etambutol) em outro método analítico. O mesmo ocorre com a monografia, para os quatro fármacos, existente na Farmacopeia Internacional (WHO, 2006), a qual também relata a existência de dois métodos analíticos de separação para um mesmo produto, o que os tornam demorados, em aplicação de rotina, especialmente quando muitos lotes do 4 em 1 precisam ser analisados em curto período de tempo, o que normalmente ocorre nas indústrias de medicamentos presentes nos países em desenvolvimento, os quais a tuberculose é ainda um problema de saúde.
19 Há relatos na literatura da presença de métodos analíticos para identificação e quantificação simultânea dos quatros fármacos em diversas técnicas, como eletroforese de zona capilar (FARIA et. al., 2010), cromatografia em camada delgada de alta performance (SHEWIYO et. al., 2012), entre outros. No entanto, na literatura não foi encontrado nenhum estudo qualitativo e quantitativo por Cromatografia Líquida de Alta Eficiência (CLAE) e Cromatografia Líquida de Ultra Eficiência (CLUE). Por esta razão, com o presente trabalho teve-se o propósito de desenvolver, otimizar e validar um método para determinação simultânea de tuberculostáticos por CLAE e CLUE.
Desta forma considerando a natureza do estudo e os métodos empregados para o seu desenvolvimento, este trabalho foi organizado em quatro partes:
Desenvolvimento e otimização de método por CLAE;
Validação do método por CLAE;
Desenvolvimento e otimização de método por CLUE;
21 2 FUNDAMENTAÇÃO TEÓRICA
2.1 A tuberculose: situação atual no Brasil
A tuberculose pulmonar é uma doença de amplitude mundial, cujo principal agente etiológico é o bacilo da Mycobacterium tuberculosis, identificado em 1882 por Robert Kock. Esta enfermidade pode resultar da reativação de uma primo-infecção passada ou pode ser decorrente de uma infecção recentemente adquirida (FLOXMAN & RILEY, 2001). A predisposição à doença deve-se à interação entre fatores genéticos e ambientais. Desde o início do século XX, a tuberculose se constitui em uma das causas mais frequentes de morte nas regiões geográficas de clima temperado e a segunda, depois da febre amarela, nas regiões tropicais. Após um longo período de latência, a tuberculose pulmonar ressurge nos anos 80, tendo como pano de fundo para explicar o seu retorno, tanto a sua presença em indivíduos com a Síndrome da Imunodeficiência Adquirida (DALCOMO, 2000), quanto os problemas conjunturais ligados à política econômica neoliberal que aumentou a diferença entre países desenvolvidos e em desenvolvimento, favorecendo a sua inserção neste abismo social (SENADO-DUMOY, 1999).
22 2.2 Tratamento Farmacológico
A tuberculose é um dos maiores problemas de saúde global devido a sua fácil forma de contágio, principalmente pelo ar. Embora a doença possa atingir qualquer órgão do corpo, o bacilo se reproduz e cresce rapidamente em áreas com elevadas concentrações de oxigênio, o que explica a maior frequência de ataques nos pulmões (NEVES et al., 2012).
O tratamento da tuberculose pulmonar é longo (mínimo de seis meses). Entre os fatores que podem influenciar o abandono ao tratamento estão as variáveis relacionadas ao serviço de saúde, ao médico e ao doente (RIBEIRO, 2000). Por sua vez, a recidiva tem como principal fator relacionado o esquema terapêutico não aderido pelo paciente (OLIVEIRA & MOREIRA, 2000a).
Estudos feitos constataram que as chances de recidiva eram 17,6 vezes maiores naqueles que abandonavam o esquema, principalmente por efeitos adversos ao medicamento (OLIVEIRA & MOREIRA, 2000b).
Outros estudos mostraram que entre as condições associadas à Tuberculose pulmonar multirresistente, em 45% dos casos, constatou-se o abandono ou irregularidade na terapêutica (MELO et. al., 2003).
23 A
B
C
D
24 2.3 Tuberculostáticos
2.3.1 Isoniazida
A isoniazida é a hidrazida do ácido isonicotínico, descoberta em 1945 por Chorine (MANDEL & PETRI, 1996). Sua fórmula química é C6H7N3O, possui peso
molecular de 137,14 g/mol, sua nomenclatura oficial: 4-hidrazida ácida piridincarboxilica. Apresenta-se como um pó cristalino branco, solúvel em água, ligeiramente solúvel em etanol e praticamente insolúvel em éter e benzeno. Suas soluções em água a 10% possuem pH de 6,0 a 7,5. Apresenta valores de pka de 2,0 e 3,5. É pouco estável em H2O e muito estável em DMSO. Possui absorção máxima em
266, 265 nm (em HCl 0,01N) (MERCK, 2006; USP, 2010; MARTINDALE, 2007).
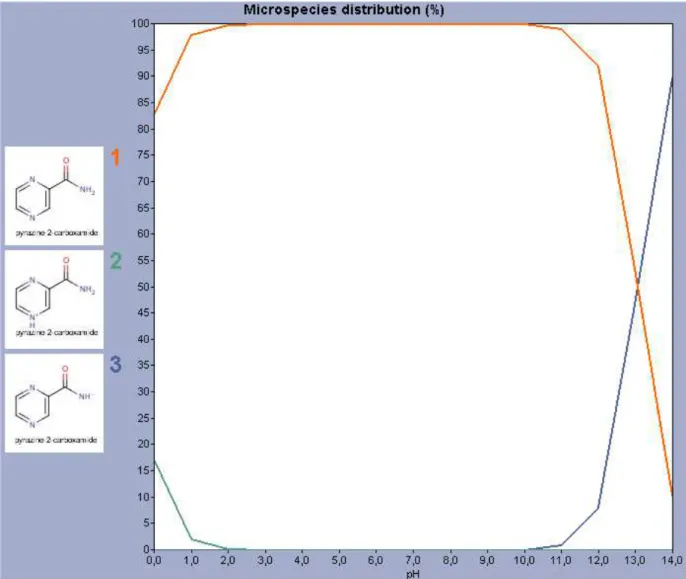
Na Figura 2 são demonstradas as quatro espécies ionizadas e a não-ionizada da isoniazida, quando ocorre alteração de pH.
25 Dentre as formas apresentadas na Figura 2, o gráfico de cor alaranjada representa a forma não-ionizada da molécula de isoniazida.
2.3.1.1 Mecanismo de Ação
Isoniazida é um fármaco conhecido por ser altamente ativo contra o
Mycobacterium tuberculosis e por ter outras atividades contra outras micobactérias
incluindo M. kansaii. É considerado como um bacteriostático contra organismos semi-adormecidos e é menos eficaz do que a rifampicina e a pirazinamida (MARTINDALE, 2007).
Parece atuar pela inibição da síntese de ácido micólico, componente essencial da parede celular das micobactérias, o que explicaria sua elevada seletividade sobre este tipo de bactérias (TAKAYAMA et al., 1975). TIMMINS et al. (2004), sustentam que metabólitos da isoniazida inibem enzimas chaves na respiração da micobactérias aumentando seu poder bactericida.
M. tuberculosis adquire resistência rapidamente se somente a isoniazida for
utilizada no tratamento da infecção clínica. Pode ser ocasionado devido algumas cepas perderem o gene para a produção da catalase. A resistência pode ser retardada se o uso combinado da Isoniazida com outros anti-micobaterianos forem utilizados. A resistência não é adquirida em casos de uso da isoniazida como profilático, provavelmente devido à baixa carga da bactéria (MARTINDALE, 2007).
2.3.2 Pirazinamida
Foi descoberta durante a investigação de análogos da nicotinamida. É um análogo pirazínico sintético da mesma; sua fórmula química é C5H5N3O, seu peso
26 Na Figura 3 são demonstradas as duas espécies ionizadas e a não-ionizada da pirazinamida, quando ocorre alteração de pH.
Figura 3: Esquema de distribuição de espécies ionizadas e não-ionizada de pirazinamida, conforme alteração de pH. Gráfico gerado pelo MarvinSketcht.
Dentre as formas apresentadas na Figura 3, o gráfico de cor alaranjada representa a forma não-ionizada da molécula da pirazinamida.
2.3.2.1 Mecanismo de Ação
27 quase que completamente inativa em pH neutro, mas é eficaz contra bacilos tubérculos persistentes dentro de ambientes intracelulares acidificados dos macrófagos.
As respostas inflamatórias da quimioterapia aumentam o número de organismos em ambientes acidificados. Assim que a inflamação desaparece e o pH aumenta, a atividade esterilizante da pirazinamida diminui. Essa atividade pH dependente explica a efetividade clínica da pirazinamida como parte inicial da fase de 8 semanas em um regime de tratamento de curto prazo. A resistência contra a pirazinamida é adquirida quando somente ela for utilizada no tratamento (MARTINDALE, 2007).
2.3.3 Etambutol
Apresenta-se em forma de pó cristalino branco, livremente solúvel em água e solúvel em álcool etílico e metílico. Levemente solúvel em clorofórmio e éter (USP, 2010).
Etambutol é uma base fraca. A 20°C, apresenta pKa de 6,3, 6,6 e 9,5. Uma solução a 2% em água tem um pH de 3,7 a 4,0 (MARTINDALE, 2007).
28 Figura 4: Esquema de distribuição de espécies ionizadas e não-ionizada do etambutol, conforme alteração de pH. Gráfico gerado pelo MarvinSketcht.
Dentre as formas apresentadas na Figura 4, o gráfico de cor alaranjada representa a forma não-ionizada da molécula do etambutol.
2.3.3.1 Mecanismo de Ação
Etambutol é um bacteriostático ativo contra o crescimento do bacilo M.
tuberculosis. Os ácidos micólicos se agrupam aos grupos 5′-hidroxil dos resíduos de
D-arabinose da arabinogalactano e formam um complexo micolil-arabinogalactano-peptidoglicano localizado na parede da célula. Etambutol inibe a síntese do arabinogalactano pela inibição da arabinosiltransferase, especialmente às ligadas ao
Mycobacterium, impedindo, assim, o aumento da permeabilidade da parede celular
29 2.3.4 Rifampicina
A rifampicina é um fármaco semi-sintético, formado pela reação da 3-formilrifampicina com a 1-amino-4-metilpiperazina em tetrahidrofurano (MERCK, 2006).
Esta molécula é caracterizada por conter uma cadeia alifática formando uma ponte entre duas posições não adjacentes de um núcleo aromático. Sua fórmula química e C43H58N4O12; possui peso molecular de 822.95 g/mol; seu nome oficial é
3-[[(4-metil- 1-piperazinil)imino]metil]rifamicina (MERCK, 2006; MARTINDALE, 2007). Apresenta-se como um pó cristalino, vermelho alaranjado. Pouco solúvel em H2O e acetona, solúvel em acetato de etila, metanol, tetrahidrofurano (THF) e
facilmente solúvel em clorofórmio e DMSO. Apresenta absorção máxima em 237, 255, 334 e 475 nm (0,002 mg/mL em tampão fosfato pH 7,4). Suas suspensões de 1% em água apresentam pH entre 4,5 a 6,5. Possui dois valores de pka, sendo o primeiro de 1,7 referente à hidroxila da posição quatro, e o segundo de 7,9 referente ao “N” 3 da piperazina. Para conservar deve-se armazenar em temperatura que não exceda 40°C e proteger da luz (MERCK, 2006).
30 Figura 5: Esquema de distribuição de espécies ionizadas e não-ionizada da rifampicina, conforme alteração de pH. Gráfico gerado pelo MarvinSketcht.
Dentre as formas apresentadas na Figura 5 o gráfico de cor alaranjada representa a forma não-ionizada da molécula da rifampicina.
A rifampicina possui dois polimorfos, forma I e II, os quais podem ser responsáveis pelas diferentes pontes de hidrogênios, mudanças conformacionais e estados ionizados, os quais permitem formar diferentes estruturas cristalinas (HEWOOD et. al., 2000).
31 2.3.4.1 Mecanismo de Ação
A rifampicina possui atividade bactericida contra uma ampla quantidade de microorganismos e interfere na síntese de ácido nucleico por inibição do RNA polimerase dependente de DNA. Tem a habilidade de promover a morte de microorganismos intracelulares. Inclui atividade contra a M. tuberculosis e a M. leprae. Possui a habilidade de eliminar organismos semi-adormecidos e persistentes. Rifampicina possui ação contra gram-positivos, especialmente estafilococos, porém menos ativo contra gram-negativos, sendo N. meningitidis, N. gonorrhoeae, H.
influenzae e Legionella spp. Também possui atividade contra C. trachomatis e contra
algumas bactérias anaeróbias (MARTINDALE, 2007).
Em elevadas concentrações, possui atividade contra vírus. Não possui atividade contra fungos, no entanto tem sido relatado o aumento da atividade antifúngica da anfotericina B. Uso com outros antimicrobianos pode aumentar ou antagonizar a atividade bactericida da rifampicina (MARTINDALE, 2007).
Cepas de M. tuberculosis, M. leprae e outras bactérias susceptíveis tem demonstrado resistência, no inicio e durante o tratamento. Portanto, no tratamento da tuberculose, a rifampicina é utilizada em combinação com outro antimicrobiano para retardar ou prevenir a resistência (MARTINDALE, 2007).
2.4 Métodos de cromatografia líquida
Cromatografia é um método comum empregado para separar uma fração constituinte de uma mistura. A técnica de separação é normalmente baseada na diferença de afinidade dos constituintes de uma amostra que flui através de uma fase móvel, em comparação a uma fase estacionária. Desde 1906 quando a cromatografia foi primeiramente definida, diversas técnicas têm sido usadas com sucesso na pesquisa e na indústria, com diferentes tipos de usos e objetivos (THERMO, 2006).
32
sido utilizado em amplo campo, mas especificamente em análises farmacêuticas. A cromatografia em fase reversa é o tipo mais comum de CLAE e é amplamente utilizada para separar constituintes muito similares. Essa técnica geralmente emprega colunas não-polares, comumente C-18, com solventes polares constituintes da fase móvel (THERMO, 2006).
Quando se fala em análises farmacêuticas, a CLAE tem sido considerada líder das tecnologias por mais de 30 anos. Tem como característica sinais quantitativos com precisão e exatidão confiáveis, versatilidade, poder de resolução, robustez, de fácil uso e boa compatibilidade com detectores UV e de espectrometria de massa (PIETERS et. al., 2010).
Outras aplicações que a cromatografia pode ser usada na indústria farmacêutica incluem: proteômica, desenvolvimento de fármacos, formulação de medicamentos e métodos de controle de qualidade (THERMO, 2006).
O uso da CLAE para análise de fármacos vem sendo alvo de pesquisas durante anos e vem sendo relatadas em artigos científicos, bem como em monografias nas farmacopeias, por ser considerada uma técnica sensível e com elevada precisão e exatidão.
SHEWIYO et. al. (2012) relata que métodos quantitativos validados baseados em CLAE, cromatografia em camada delgada de alta eficiência (CCDAE) e espectrofotometria UV/Vis vem sendo relatadas na literatura para a identificação e doseamento dos fármacos pertencentes ao 4 em 1 em formulações e em fluidos biológicos. No entanto, a maioria dos métodos destacam apenas estudos individuais, ou apenas em combinação de dois ou três fármacos, não havendo ainda publicações de métodos para a determinação simultânea dos quatros fármacos.
Eficiência e velocidade tem se tornado de grande importância na área de cromatografia líquida, tanto para Farmácia, Toxicologia ou Análises Clínicas, as quais necessitam de melhorar o rendimento e reduzir os custos das análises (NOVÁKOVÁ et. al., 2006a).
33 análise mais rápida com alta eficiência, porém o lado negativo é a elevação da pressão a valores superiores àqueles aceitáveis em sistemas de CLAE e colunas convencionais. Fases estacionárias feitas de sílicas podem resistir a pressões acima de 30 MPa. Um terceiro modo é aumentar a temperatura. A viscosidade da fase móvel é reduzida quando a temperatura é elevada e desta forma reforça a difusividade e a coluna opera com níveis de fluxos maiores, assim, colunas mais longas e partículas menores poderiam ser utilizadas. A desvantagem desta técnica seria a baixa estabilidade de alguns compostos em temperaturas elevadas (NOVÁKOVÁ et. al.,
2006a).
Uma das alternativas para solucionar o problema seria a de utilizar a Cromatografia Líquida de Ultra Eficiência.
2.5 Cromatografia Líquida de Ultra Eficiência (CLUE)
Um sistema de Cromatografia Líquida de Ultra Eficiência (CLUE) é um dos avanços mais recente das técnicas de separação, baseia-se nos mesmos princípios da cromatografia líquida de alta eficiência, porém utiliza fases estacionárias com partículas menores que 2 µm. O uso destas partículas juntamente com a alta velocidade linear da fase móvel aumentam a resolução, a detecção e diminuem o tempo das análises (WU
et. al., 2008). Os ajustes nos sistemas envolvem uma bomba binária de alta fluidez, a
qual será capaz de trabalhar com pressões acima de 100 MPa (15.000 psi ou 400 kgf) (NOVÁKOVÁ et. al.,2006b; PIETERS et. al.,2010).
As modificações requeridas em um sistema de CLUE são: capacidade de trabalhar a pressões muito altas (100 MPa), volumes internos muito menores (conexões, alça de amostragem, cela do detector, bombas), celas do detector sem dispersão e com alta taxa de aquisição, melhoramento no sistema de controle e de dados, colunas resistentes para trabalharem com altas pressões e com baixo volume morto, injetores com precisão na faixa de volumes pequenos (MALDANE & JARDIM, 2009).
34 De acordo com a equação de Van Deemter, a eficiência da cromatografia é proporcional à diminuição do tamanho de partícula. De acordo com este modelo (Figura 6), o qual descreve a relação entre a altura equivalente dos pratos teóricos (HETP) e a velocidade linear, um dos termos é dependente da granulometria da coluna analítica. Diâmetros de partículas menores podem significativamente reduzir o HETP, produzindo resultados de maior eficiência e um perfil mais plano da curva de Van Deemter. Consequentemente, o aumento do fluxo da fase móvel não influencia negativamente a eficiência, como observado em colunas para uso em CLAE, as quais possuem
diâmetro interno de partículas em torno de 5 a 10μm (NOVÁKOVÁ et. al., 2006a). E quando se utiliza colunas de menor diâmetro interno em CLAE, o mesmo eleva muito a pressão, deixando o sistema instável e diminuindo o tempo de utilidade das colunas.
Figura 6: curva de Van Deemter para diferentes tamanhos de partículas (1,7; 3; 5 e 10 µm) (NOVÁKOVÁ et. al., 2006a).
35 transferido para o CLUE e que o tempo poderia ser reduzido ainda mais se o método fosse utilizado com elevadas temperaturas (90°C).
No entanto, as farmacopeias ou monografias oficiais ainda não relatam o uso de aparelhos mais sensíveis em análises farmacêuticas, como o CLUE. Desta forma, propõe-se utilizar o CLUE-DAD para validar um método inovador na detecção em plasma humano de fármacos tuberculostáticos (Isoniazida, Pirazinamida, Etambutol e Rifampicina) e seus produtos de degradação frente a alterações físico-químicas com o intuito de obter resultados mais confiáveis e eficientes, tendo em vista a grande influência que os fármacos apresentam em contato com agentes externos e internos.
2.6 Adequabilidade do Sistema
Adequabilidade do sistema é amplamente conhecido como um componente crítico em análises químicas e é frequentemente referenciado em guias e documentos das agências regulatórias (BRISCOE et. al., 2007). Testar a adequabilidade do sistema é parte integrante de muitos procedimentos analíticos. Os testes são baseados no conceito de que o equipamento, a parte eletrônica, operações analíticas e as amostras são analisadas e constituem um sistema integral que pode ser avaliado. Os parâmetros de adequabilidade do sistema são estabelecidos a partir de procedimentos que dependem do tipo de análise que está sendo validada (ICH, 1995).
Eficiência aparente, fator de retenção, resolução, retenção relativa, fator de cauda são parâmetros geralmente empregados para assegurar o desempenho da coluna. Os critérios de adequabilidade do sistema são requeridos nos procedimentos cromatográficos e, estes dependem de diversos fatores, tais como a frequência do uso do método, bem como o uso frequente do sistema cromatográfico. Dessa forma o analista deve escolher uma forma adequada de monitorar os critérios (BRITISH, 2010).
36 Onde:
t = tempo de retenção do pico; W = largura do pico;
Wh/2 = largura à meia altura do pico.
A resolução, R, é o parâmetro cromatográfico que indica o grau de separação entre duas substâncias em uma mistura (BRASIL, 2010a; BRITISH, 2010), devendo a mesma apresentar valores acima de 2. A resolução é calculada seguindo a fórmula:
Onde:
t1 e t2 = tempo de retenção das duas substâncias na mistura;
W1 e W2 = larguras dos picos na linha de base;
W1,h/2 e W2,h/2 = às larguras dos picos à meia altura.
O fator de cauda, T, indica a simetria do pico, apresentando valor igual a 1 quando o pico for perfeitamente simétrico (BRASIL, 2010a; BRITISH, 2010). Valores acima de 2 torna o pico inadequado. Este fator pode ser calculado pela expressão:
Onde:
W0,05 = largura do pico a 5% da altura;
f = valor da porção anterior do pico, em relação à largura a 5% da altura.
37 Onde:
k = fator de retenção; t0 = tempo morto;
t = tempo de retenção da substância analisada.
2.7 Validação de métodos analíticos
Cada vez mais são reconhecidos e exigidos aspectos como comparabilidade, rastreabilidade e confiabilidade, para apontar a qualidade das medições realizadas no laboratório, já que resultados não confiáveis podem acarretar em decisões errôneas acerca das características do produto ocasionando prejuízo à saúde do usuário (RIBANI et. al., 2004). Para garantir que métodos analíticos e bioanalíticos gerem informações confiáveis e interpretáveis sobre a amostra testada, ele deve sofrer uma avaliação denominada validação (LIMA, 2006).
Validação de métodos analíticos e bioanalíticos constitui-se como um ato documentado que atesta se qualquer procedimento, processo, equipamento, material, operação ou sistema realmente conduza aos resultados esperados. Portanto a validação de procedimentos analíticos e bioanalíticos tem por objetivo demonstrar que os métodos de ensaio utilizados apresentam resultados que permitam avaliar a qualidade dos medicamentos, conforme os parâmetros especificados (BRASIL, 2003; SWARTZ & KRULL, 1997).
A RDC N°17/2010, conceitua a validação como “ato documentado que atesta
que qualquer procedimento, processo, equipamento, material, atividade ou sistema
realmente e consistentemente leva aos resultados esperados”. Direcionando para os
métodos analíticos, a validação objetiva demonstrar que o método é adequado para a finalidade a que se destina, assegurando assim a confiabilidade dos resultados (BRASIL, 2010b; BRASIL, 2003).
38 ferramentas estatísticas capazes de comprovar a veracidade das respostas analíticas obtidas (BARROS, 2002). Diversas organizações nacionais e internacionais disponibilizam diretrizes para a validação de métodos analíticos.
De acordo com a resolução (RE) N° 899/2003 (BRASIL, 2003), a validação deve garantir através de estudos experimentais que o método atenda às exigências das aplicações analíticas. Contudo, para realização da validação de um método analítico, alguns parâmetros ou características de desempenho devem ser atendidos de acordo com o método a ser analisado. Dentre eles temos: linearidade; faixa de trabalho; intervalo; precisão; sensibilidade; exatidão; limite de quantificação e detecção; robustez (BRITO et. al., 2003; INMETRO, 2003; BRASIL, 2003; RIBANI et. al., 2004).
Nos ensaios de linearidade, recomenda-se na RE N° 899/2003 que sejam analisadas no mínimo cinco concentrações diferentes, variando de 80 a 120% da concentração teórica do teste para determinação quantitativa do analito em matérias-primas e formas farmacêuticas. Deve ser determinado o coeficiente de correlação, cujo critério mínimo aceitável é de 0,99, e as respectivas curvas.
O intervalo ou faixa de trabalho é a faixa entre os limites de quantificação superior e inferior de um método analítico onde foi demonstrado ser possível a determinação com precisão, exatidão e linearidade exigidas, sob as condições especificadas para o ensaio (BRASIL, 2003; INMETRO, 2003).
Pela precisão avalia-se a dispersão dos resultados entre ensaios independentes, repetidos de uma mesma amostra, amostras semelhantes ou padrões, em condições definidas (INMETRO, 2003). É considerada em três níveis: repetibilidade, feita em 3 concentrações (alta, média e baixa) e cada concentração em triplicata; precisão intermediária, onde se recomenda um mínimo de dois dias diferentes com analistas diferentes; e reprodutibilidade, em laboratórios diferentes (BRASIL, 2003).
A exatidão é expressa pela proximidade dos resultados obtidos com o valor verdadeiro, sendo determinada após a linearidade. A robustez de um método é avaliada durante o seu desenvolvimento, constatando a susceptibilidade do método frente a pequenas e deliberadas variações nas condições analíticas (BRASIL, 2003).
39 analíticos representa um fator significante no processo de desenvolvimento de um medicamento, portanto, a validação acarreta impacto direto na qualidade desses dados (VALENTINI et. al., 2009).
41 3 OBJETIVOS
3.1 Objetivo Geral
Desenvolver, otimizar e validar método para determinação simultânea de isoniazida, pirazinamida, etambutol e rifampicina (4-FDC) por CLAE/DAD e CLUE/DAD.
3.2 Objetivos Específicos
Desenvolver sistema gradiente para detecção dos fármacos em CLAE/DAD;
otimizar e desenvolver método analítico para detecção simultânea de tuberculostáticos por CLAE/DAD;
43 4 MATERIAL E MÉTODOS
4.1 Materiais
As substâncias químicas de referência farmacopéica de isoniazida (pureza 100%), pirazinamida (pureza 99,5%), etambutol (pureza 100%) e rifampicina (pureza 98,5%) foram adquiridos da USP. Os reagentes grau-CLAE: metanol e acetonitrila foram adquiridos da VETEC e J.T.BAKER, respectivamente. O Acetato de Amônio, Acetato de Cobre II Monohidratado e Ácido Acético PA foram adquiridos da VETEC. Água ultra-purificada foi obtida com o purificador de água Milli-Q Advantage® A10 do NUPLAM/UFRN. Os comprimidos do 4 em 1 foram obtidos pelo NUPLAM/UFRN.
4.1.1 CLAE para o método 1 e 2
Os cromatogramas foram obtidos em um cromatógrafo Shimadzu, sistema de bomba quaternário LC-20AT (Shimadzu, Tóquio, Japão) equipado com um degaseificador (DGU-20A5), auto-amostrador SIL-20A, forno da coluna CTP-20A,
detector DAD SPD-M20A. A coluna do HPLC inicialmente utilizada foi uma Nucleosil C18 da Macherey-Nagel (250 x 4.6 mm d. i.; diâmetro da partícula 5 m; granulometria de 100 Å) com coluna guarda C-18 (Shimadzu Corporation, Tóquio, Japão).
4.1.2 CLAE para o método 3
Os cromatogramas foram obtidos em um cromatógrafo Shimadzu, sistema de bomba quaternário LC-20AT (Shimadzu, Tóquio, Japão) equipado com um degaseificador (DGU-20A5), auto-amostrador SIL-20A, forno da coluna CTP-20A,
44 4.1.3 CLUE para o método 4
O cromatógrafo utilizado foi o UFLC XR SHIMADZU equipado com degaseificador DGU-20A3, sistema de bombas binário LC-20AD XR, auto amostrador
SIL-20AC XR, forno da coluna CTO-20AC, sistema de detecção DAD SPD-M20A e módulo de comunicação com o computador CBM-20A. Foi utilizado uma coluna Shim-pack com grupos octadecilsilano, modelo XR-ODS 30 mm x 2 mm (diâmetro interno) x 2,2 µm.
4.2 Métodos
4.2.1 Preparação do Tampão Acetato
Para preparar o Tampão Acetato, 50 g de Acetato de Amônio PA e 0,2 g de Acetato de Cobre II Monohidratado foram dissolvidos em 1000 mL de água purificada, com correção de pH para 5,0 com Ácido Acético PA (WHO, 2006).
4.2.2 Preparação da solução padrão das substâncias químicas de referência para análise por CLAE do método 1 e 2
45 4.2.3 Preparação da solução padrão das substâncias químicas de referência
para análise por CLAE do método 3 e 4
Para o desenvolvimento do método analítico, os padrões foram pesados nas respectivas quantidades 8 mg de isonazida, 43 mg de pirazinamida, 30 mg de etambutol e 16 mg de rifampicina. Após pesagem, os pós foram transferidos para balão volumétrico de 100 mL. 50 mL de acetonitrila foram adicionadas ao balão para solubilizar a mistura das substâncias químicas de referência, uma vez que a rifampicina mostrou-se com baixa solubilidade em solventes aquosos. Posteriormente o balão foi levado ao banho de ultrassom por 1 minuto e água purificada foi adicionada até completar volume e homogeneizadas. Alíquota de 5 mL da solução foi retirada com o auxílio de uma pipeta volumétrica de 5 mL e transferida para um balão volumétrico de 50 mL. Água purificada foi adicionada até completar volume. As amostras foram filtradas em filtro de seringa LCR em PTFE 0,45µm e injetadas no cromatógrafo imediatamente.
4.3 Sistema Gradiente por CLAE
46 Tabela 1 - Condições cromatográficas para análise dos métodos analíticos 1 e 2 em CLAE.
Gradiente da concentração dos screenings
Tempo, min Fase móvel A, % * Fase Móvel B, % (1 e 2)**
0 100 0
60 0 100
* Tampão Acetato;
** 1 – Metanol = Método 1. 2 – Acetonitrila = Método 2.
4.4 CLAE – DAD
4.4.1 Desenvolvimento do método 3 por CLAE
A partir dos resultados obtidos nos métodos 1 e 2, foi possível avaliar que todos os fármacos eram obtidos através sistema de fase móvel em forma de gradiente. Desta forma o método 2 foi otimizado para uma análise mais rápida gerando o método 3, conforme Tabela 2. O método foi desenvolvido com temperatura controlada de 30°C, fluxo de 0,8 mL.min-1, volume de injeção de 12 µL e comprimento de onda de 270 nm.
4.4.2 Preparação do sistema de fases móveis para métodos 3 e 4
47 Tabela 2 - Condições cromatográficas para análise do método analítico 3 em CLAE.
Gradiente de Concentração
Tempo, min
Fase Móvel A Tampão Acetato e Metanol (94:6, v/v), %
Fase Móvel B Tampão Acetato e Acetonitrila (55:45, v/v), %
0 100 0
6 100 0
7 0 100
20 0 100
4.4.3 CLUE-DAD
4.4.3.1 Desenvolvimento do método 4 por CLUE
O método analítico 4 foi desenvolvido com o auxílio do “software” SHIMADZU
Method Transfer Program, versão 1.0 da SHIMADZU Coorporation ®, como descrito na
Tabela 3. Para a preparação das fases móveis, as soluções foram misturadas em suas proporções, como descrito no item 4.4.2. O método foi desenvolvido com temperatura controlada de 30°C, fluxo de 0,5 mL.min-1, volume de injeção de 2 µL e comprimento de onda de 270 nm.
Tabela 3 - Condições cromatográficas para análise do método analítico 4 em CLUE.
Gradiente de Concentração
Tempo, min
Fase Móvel A Tampão Acetato e
Metanol (94:6), %
Fase Móvel B Tampão Acetato e Acetonitrila (55:45), %
0 100 0
1.9 100 0
2 0 100
48 4.5 Desenvolvimento e Validação de Métodos
Os parâmetros de validação dos métodos analíticos foram: especificidade / seletividade, intervalos da curva analítica, linearidade, limite de detecção, limite de quantificação, exatidão, precisão (repetibilidade, precisão intermediária) e robustez.
4.6 Validação do método analítico
A validação do método analítico foi realizada em CLAE e CLUE para os seguintes parâmetros:
4.6.1 Especificidade e Seletividade:
o Solução Branco
o Solução padrão de tuberculostáticos separados;
o Solução padrão isoniazida + pirazinamida + etambutol + rifampicina; o Solução teste dos Excipientes, fabricante A;
o Solução teste do comprimido de isoniazida + pirazinamida + etambutol + rifampicina, fabricante A.
4.6.1.1 Preparação das Soluções para Especificidade e Seletividade
A preparação das amostras para a especificidade e seletividade, tanto por CLAE e CLUE, foi realizada em triplicata.
a) Solução Branco para avaliação da especificidade/seletividade por CLAE e CLUE
49 b) Solução padrão de tuberculostáticos separados para avaliação da
especificidade/seletividade por CLAE e CLUE
Foram pesados 8 mg de isoniazida, 43 mg de pirazinamida, 30 mg de etambutol e 16 mg de rifampicina, e transferidos, separadamente, cada um para um balão volumétrico de 100 mL. Alíquota de 50 mL de acetonitrila foram inseridas em cada balão volumétrico, os quais foram levados ao banho de ultrassom por 1 min. Posteriormente, foi água purificada adicionada até completar volume. 5 mL de cada solução foram transferidas para balões volumétricos de 50 mL e água purificada foi adicionada até completar volume. As amostras foram homogeneizadas, filtradas em filtro de seringa de PTFE 0,22 µm e injetadas no cromatógrafo imediatamente.
c) Solução padrão de isoniazida, pirazinamida, etambutol e rifampicina para avaliação da especificidade/seletividade por CLAE e CLUE.
Foram pesados 8 mg de isoniazida, 43 mg de pirazinamida, 30 mg de etambutol e 16 mg de rifampicina e transferidos para balão volumétrico de 100 mL. 50 mL de acetonitrila foram inseridas ao balão volumétrico e, em seguida foi levado ao banho de ultrassom por 1 min. Posteriormente, foi adicionada água purificada até completar volume. Alíquota de 5 mL da solução anterior foram transferidas para um balão volumétrico de 50 mL e água purificada foi adicionada até completar volume.. As amostras foram homogeneizadas, filtradas em filtro de seringa de PTFE 0,22 µm e injetadas no cromatógrafo imediatamente.
d) Solução teste de excipientes para avaliação da especificidade/seletividade por CLAE e CLUE
50 filtrada em filtro de seringa de PTFE 0,22 µm e injetada no cromatógrafo imediatamente.
e) Solução teste do comprimido de isoniazida, pirazinamida, etambutol e rifampicina para avaliação da especificidade/seletividade por CLAE e CLUE.
10 comprimidos de isoniazida, pirazinamida, etambutol e rifampicina foram pesados, triturados em graal e homogeneizados. Foi pesado uma quantidade equivalente à 8 mg de isoniazida e transferido para balão volumétrico de 100 mL. 50 mL de acetonitrila foram inseridas e o balão volumétrico foi levado ao banho de ultrassom por 1 min. Posteriormente, foi adicionada água purificada até completar volume. Alíquota de 5 mL da solução anterior foi transferida para um balão volumétrico de 50 mL e água purificada foi adicionada até completar volume. As amostras foram homogeneizadas, filtradas em filtro de seringa de PTFE 0,22 µm e injetadas no cromatógrafo imediatamente.
4.6.2 Curva analítica/linearidade:
A linearidade corresponde à capacidade do método em fornecer resultados diretamente proporcionais à concentração da substância analisada, dentro de uma determinada faixa de aplicação. A estimativa dos coeficientes de uma curva analítica a partir de um conjunto de medições experimentais pode ser efetuada utilizando o método matemático conhecido como regressão linear, adotado na validação desta metodologia (THOMPSON et al., 2002; RIBANI et al., 2004).
É possível calcular, a partir dos pontos experimentais, o coeficiente de correlação “r”. Este parâmetro permite uma estimativa da qualidade da curva obtida, pois quanto mais próximo de 1,0, menor a dispersão do conjunto de pontos experimentais e menor a incerteza dos coeficientes de regressão estimados, garantindo maior linearidade da curva obtida (RIBANI et. al., 2004).
51 Tabela 4 – Concentrações de isoniazida, pirazinamida, etambutol e rifampicina para a linearidade dos métodos 3 e 4 por CLAE e CLUE, respectivamente.
Conc., % Isoniazida µg.mL-1
Pirazinamida µg.mL-1
Etambutol µg.mL-1
Rifampicina µg.mL-1
70 5,60 30,10 21,00 11,20
80 6,40 34,40 24,00 12,80
90 7,20 38,70 27,00 14,40
100 8,00 43,00 30,00 16,00
110 8,80 47,30 33,00 17,60
120 9,60 51,60 36,00 19,20
130 10,40 55,90 39,00 20,80
4.6.3 Precisão (Repetibilidade e Precisão Intermediaria):
4.6.3.1 Repetibilidade para CLAE e CLUE.
Foram efetuadas 6 determinações de uma mesma solução padrão contendo 100% da concentração nominal de isoniazida, pirazinamida, etambutol e rifampicina, conforme item 4.6.1.1 e subitem “c”.
4.6.3.2 Precisão intermediária para CLAE e CLUE.
52 4.6.4 Exatidão para CLAE e CLUE.
Foi determinada utilizando-se três concentrações (baixa, média e alta, sendo 80, 100 e 120%), contemplando a faixa de variação do procedimento, realizando-se três determinações da solução padrão contendo os quatros ativos e seis determinações por concentração da solução teste de excipientes com contaminação dos padrões de isoniazida, pirazinamida, etambutol e rifampicina nas suas respectivas concentrações utilizadas na solução padrão para validação analítica por CLAE e CLUE, conforme item 5.6.1.1 e subitens “c” e“e”.
4.6.5 Limite de quantificação para CLAE e CLUE.
Foi estimado pela divisão da média do desvio padrão residual do intercepto com o eixo Y (coeficientes lineares) das três curvas de calibração dos ensaios de linearidade, pela média da inclinação das três curvas de calibração (média dos coeficientes angulares), multiplicado por 10. Foi confirmado pela preparação de uma solução com concentração estimada e avaliação visual do cromatograma obtido.
4.6.6 Limite de detecção para CLAE e CLUE.
Foi estimado pela divisão da média do desvio padrão residual do intercepto com o eixo Y (coeficientes lineares) das três curvas de calibração dos ensaios de linearidade, pela média da inclinação das três curvas de calibração (média dos coeficientes angulares), multiplicado por 3. Foi confirmado pela preparação de uma solução com concentração estimada e avaliação visual do cromatograma obtido.
4.6.7 Robustez para CLAE e CLUE.
54 5 RESULTADOS E DISCUSSÃO
5.1 Métodos 1 e 2 por CLAE
O desenvolvimento dos métodos 1 e 2 foi proposto com o objetivo de avaliar se o sistema de fase móvel poderia ser capaz de promover afinidade dos fármacos com os solventes e com a fase estacionária, ocasionando a separação dos compostos.
Para isso, uma solução contendo substâncias químicas de referência de isoniazida, pirazinamida, etambutol e rifampicina (80,0 µg.mL-1, 430,0 µg/mL mg.mL-1, 300,0 µg.mL-1 e 160,0 µg.mL-1, respectivamente) foi injetada no cromatógrafo,
utilizando metanol ou acetonitrila como fase móvel B.
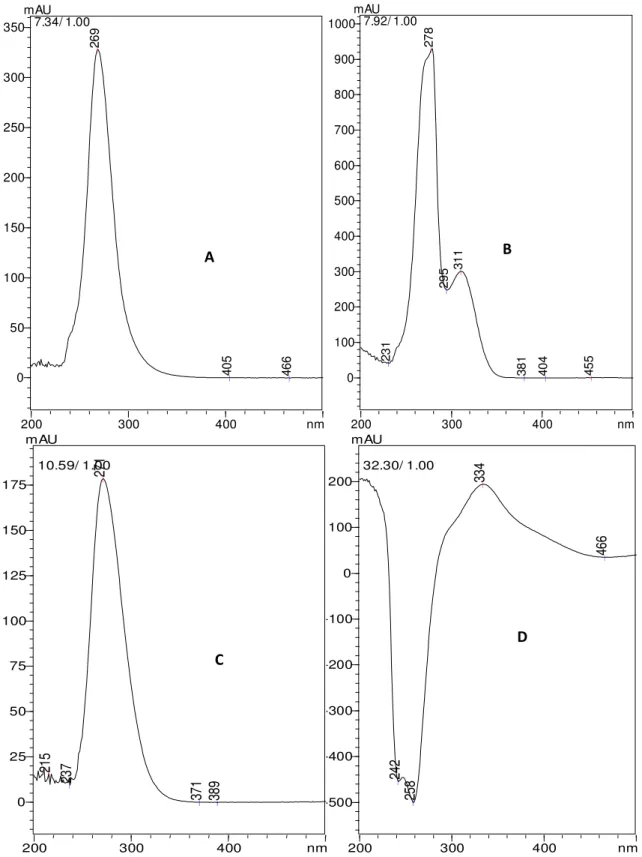
Para avaliar se o sistema de gradiente realmente gerasse melhores condições no comprimento de onda de 270 nm, os espectros dos quatros fármacos foram obtidos através do DAD e estão representados na Figura 7.
Pode-se observar que os fármacos apresentam picos de absorção máxima próximo de 270 nm, exceto a rifampicina, que apresenta no valor de 334 nm. No entanto, mesmo não apresentando absorção máxima, a rifampicina absorve nesta região, confirmando que o mesmo comprimento de onda adotado por WHO (2006) foi adotado nas validações dos métodos 3 e 4.
Ambos os métodos foram capazes de realizar a separação, porém como observado na Figura 8, houve uma grande queda da linha de base, o qual não tornava o sistema de gradiente favorável para ser adotado como método analítico.
55
200 300 400 nm
0 50 100 150 200 250 300 350 mAU 7.34/ 1.00 40 5 46 6 26 9
200 300 400 nm
0 100 200 300 400 500 600 700 800 900
1000mAU 7.92/ 1.00
29 5 23 1 38 1 40 4 27 8 31 1 45 5
200 300 400 nm
0 25 50 75 100 125 150 175 mAU 10.59/ 1.00 23 7 37 1 38 9 27 1 21 5
200 300 400 nm
-500 -400 -300 -200 -100 0 100 200 mAU 32.30/ 1.00 46 6 24 2 25 8 33 4
Figura 7: Espectros da solução padrão de isoniazida (A), pirazinamida (B), etambutol (C) e rifampicina (D) obtido por CLAE a partir do método 2.
A B
C
56 Figura 8: Cromatogramas obtidos por CLAE do método 1 (A) e do método 2 (B). Os picos de 1 a 4 referem-se à isoniazida, pirazinamida, etambutol e rifampicina, respectivamente.
57 Tabela 5 - Parâmetros de adequabilidade do sistema de solventes (métodos 1 e 2) por CLAE.
Método 1 Temp,R (min) Área Largura teóricos Pratos Fator de cauda Resolução K
Isoniazida 8,111 2066527 0,368 7768,72 2,580 - 7,08 Pirazinamida 8,989 12047264 0,437 6768,69 2,869 2,180 9,89 Etambutol 14,332 3099707 0,884 4204,23 3,734 8,088 16,98 Rifampicina 43,869 2700288 0,370 224697 1,572 47,098 32,82
Método 2 Temp,R (min) Área Largura teóricos Pratos Fator de cauda Resolução K
Isoniazida 7,340 2000440 0,195 22705,87 1,563 - 5,87 Pirazinamida 7,919 8012365 0,246 16587,26 1,322 2,627 8,33 Etambutol 10,59 2513334 0,318 17707,13 2,553 9,472 15,81
Rifampicina 32,30 3545577 0,360 128890,7 1,432 64,019 30,34
Após a análise dos resultados obtidos na adequabilidade do sistema (tabela 5), pôde-se verificar que o método 2 em que se utiliza a acetonitrila como solvente orgânico presente nas fases móveis, mostrou-se mais eficiente, uma vez que a resolução apresentou valores acima do limite mínimo (> 2) e foi superior ao método 1, ou seja, os picos estão mais separados no métodos 2. O fator de cauda apresentou valores abaixo do limite máximo (< 2), excluindo-se o etambutol, possibilitando a formação de picos mais simétricos. Os pratos teóricos mostraram-se acima do limite mínimo especificado (> 1000) para ambos os métodos, no entanto quando comparados os métodos, o método 2 apresenta maior número de pratos teóricos, consequentemente maior a sua eficiência da análise.
Além disso, o tempo de retenção dos fármacos foi menor, propiciando uma análise mais rápida, principalmente para a Rifampicina.
5.2 Desenvolvimento do método 3 por CLAE
58 para análise simultânea de isoniazida, pirazinamida e etambutol e outra para a rifampicina.
A escolha da proporção do sistema de fase móvel foi realizada com auxílio do WHO (2006), o qual relata um método capaz de obter isoniazida, pirazinamida e etambutol simultaneamente.
SHEWIYO et. al., (2012) e WHO (2006) relatam que o método de isoniazida, pirazinamida e etambutol usa uma coluna de 15 cm x 4,6 mm empacotada com sílica quimicamente ligada ao grupamento octadecilsianol (tamanho de partícula de 5 µm). A fase móvel é preparada dissolvendo 50 g de acetato de amônio e 0,2 g de acetato de cobre II monohidratado em 1000 mL de água purificada, com correção de pH para 5,0 com ácido acético glacial. Misturar 940 mL desta solução com 60 mL de metanol, que será usada como fase móvel e programador o comprimento de onda para 270 nm.
A utilização do acetato de cobre II é devido ao fato de que o etambutol não absorve na luz ultravioleta, no entanto, com a adição deste reagente à fase móvel, o etambutol forma um complexo com o cobre tornando-o absortivo na luz ultravioleta. (SHEWIYO et. al., 2012)
SHEWIYO et. al., (2012) e WHO (2006) relatam ainda que o método para o doseamento de rifampicina utiliza uma coluna de 25 cm x 4,5 mm com o mesmo empacotamento da coluna utilizado no método anterior e a fase móvel é composta por metanol e tampão fosfato 0,01 mol/L pH 7,0, numa razão de 6:4 (v/v), com detecção a 254 nm.
Desta forma, o desenvolvimento do método 3 foi realizado pela obtenção do sistema de fase móvel proposto pelos métodos 1 e 2 e com comprimento de onda em 270 nm, devido ao fato deste ter mostrado ser o mais seletivo, quando comparado aos demais, tanto com relação à resolução picos como a adequabilidade da linha da base, concordando com o WHO (2006).
59 melhor resolução e simetria entre os picos de isoniazida e pirazinamida foi a de 94:6 de tampão acetato e metanol.
Já para o sistema de fase móvel B, não foi necessário promover diversas mudanças nas proporções dos solventes, no entanto, foi verificado que o sistema na proporção de 55:45 de tampão acetato e metanol não era capaz de eluir a rifampicina da fase estacionária. O inverso foi observado quando a acetonitrila foi utilizada. O metanol era capaz de eluir a rifampicina, se fosse utilizado uma maior proporção de metanol no sistema, no entanto, com adição de mais solvente orgânico, a mistura do sistema de fase móvel B gerava bastantes bolhas, o qual mesmo com a degaseificação, poderia formar falsos picos.
A proporção de 55:45 de sistema de fase móvel B foi determinada através do tempo de retenção da rifampicina nos métodos 1 e 2. O que confirma com o sistema de fase móvel proposto por MOHAN et. al., (2003), onde o mesmo relata que nesta proporção há um aumento no tempo de retenção da rifampicina, porém ocorre uma melhor separação das impurezas existentes na formulação.
Com a obtenção dos sistemas de fase móvel A e B, era necessário desenvolver um novo gradiente para que ocorresse sucesso na análise. Desta forma, diversas tentativas de gradiente foram utilizadas com base na formação da rampa do método 1 e 2. Análises com tempo acima de 20 minutos foram desenvolvidas, porém a grande dificuldade encontrada era na obtenção do pico do etambutol sem que houvesse interferência da alteração da linha de base devido ao gradiente de concentração da fase móvel A para a B.
60 5.3 Desenvolvimento do método 4 por CLUE
O desenvolvimento do método 4 por CLUE foi proposto a partir da inserção do
método 3 no “software” Method Transfer Program versão 1.0 da SHIMADZU Coorporation®, o qual gerou um possível método 4.
O método 4 proposto pelo software foi programado no CLUE e foi injetado uma amostra, no entanto, não houve tempo suficiente para a detecção dos 4 fármacos e o tempo necessário para a queda da linha de base promovido pelo gradiente de concentração de fase móvel foi cortado ao meio, mesmo aumentando o fluxo da fase móvel. Dessa forma, diversas tentativas para conseguir uma melhor estabilização da linha de base e detecção de todos os fármacos foram realizadas, sem que houvesse necessidade em alterar a proporção dos solventes no sistema de fase móvel A e B.
Da mesma maneira que no CLAE, um gradiente de fase móvel composto por zona isocrática e de gradiente também foi gerado para o CLUE, com tempos mais curtos na mudança de fase móvel e mais longos nas zonas isocráticas, conforme tabela 3, com diminuição do volume de injeção da amostra e fluxo da fase móvel, o qual propiciou uma análise com adequabilidade do sistema dentro dos limites requeridos.
Com o desenvolvimento dos métodos 3 e 4, as validações de ambos os métodos foram realizadas em sequência.
5.4 Validação do Método Analítico
5.4.1 Especificidade/Seletividade
A validação do método analítico foi realizada em CLAE e CLUE para os seguintes parâmetros:
o Solução Branco
o Solução padrão isoniazida; o Solução padrão pirazinamida; o Solução padrão etambutol; o Solução padrão rifampicina;
61 o Solução teste dos Excipientes, fabricante A;
o Solução teste do comprimido de isoniazida + pirazinamida + etambutol + rifampicina, fabricante A.
Como observado nos cromatogramas obtidos por CLAE e CLUE nas Figuras 9 e 10, não foi observado nenhum pico na solução do branco e solução teste dos excipientes no mesmo tempo de retenção dos picos dos padrões dos fármacos demonstrando que os constituintes que compõem a fase móvel, os diluentes, bem como os excipientes presentes na forma farmacêutica não interferem na identificação e quantificação dos fármacos.
62 5.4.1.1 Cromatogramas da Especificidade por CLAE
63 5.4.1.2 Cromatogramas da Especificidade por CLUE
64 Figura 9: Visão 3D dos espectros da solução padrão dos quatro fármacos obtido por CLAE.
65 Um estudo dos parâmetros da adequabilidade do sistema (Tabelas 6 e 7) foi realizado com o propósito de verificar se o método encontra-se dentro dos padrões exigidos para ser validado. Admitiram-se os mesmos limites requeridos dos parâmetros de adequabilidade do sistema para uma análise cromatográfica usados na CLAE e na CLUE.
Tabela 6 - Parâmetros de adequabilidade do sistema da especificidade da solução padrão dos quatros fármacos pelo método 3 por CLAE.
Tabela 7 - Parâmetros de adequabilidade do sistema da especificidade da solução padrão dos quatros fármacos pelo método 4 por CLUE.
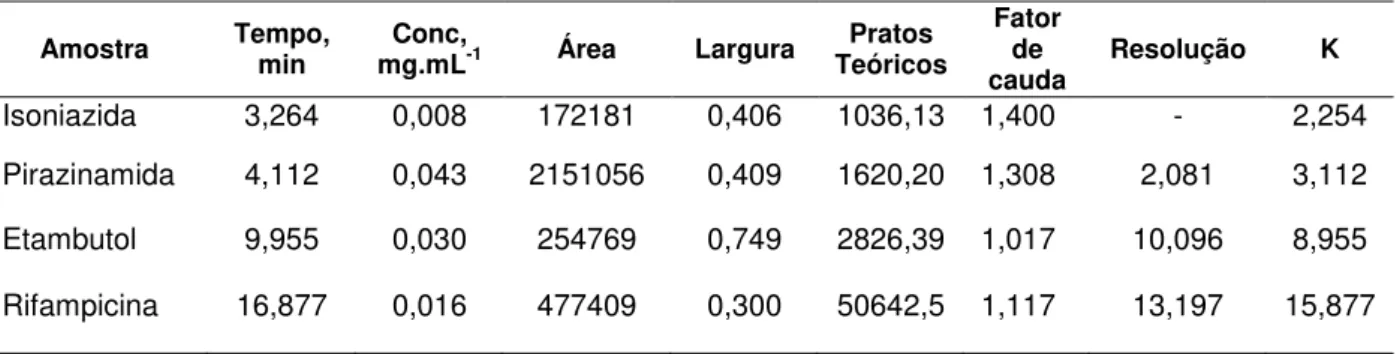
De acordo com a Tabela 6, pode-se observar que todos os fármacos apresentaram os parâmetros de adequabilidade do sistema dentro dos limites exigidos para uma análise cromatográfica por CLAE. O mesmo foi observado para a análise cromatográfica por CLUE (Tabela 7), onde todos os fármacos apresentaram pratos teóricos, fator de cauda e resolução dentro dos limites exigidos, demonstrando, assim, que ambos os métodos foram capazes de gerar resultados que garantem a análise.
Amostra Tempo, min mg.mLConc, -1 Área Largura Teóricos Pratos
Fator de
cauda Resolução K
Isoniazida 3,264 0,008 172181 0,406 1036,13 1,400 - 2,254 Pirazinamida 4,112 0,043 2151056 0,409 1620,20 1,308 2,081 3,112 Etambutol 9,955 0,030 254769 0,749 2826,39 1,017 10,096 8,955
Rifampicina 16,877 0,016 477409 0,300 50642,5 1,117 13,197 15,877
Amostra Tempo, min mg.mLConc, -1 Área Largura Teóricos Pratos
Fator de
cauda Resolução K