UNIVERSIDADE PRESBITERIANA MACKENZIE
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA DE MATERIAIS
KELLY CRISTINI BERTACHINI
ESTUDO DO USO DE PSEUDOBOEMITA NA LIBERAÇÃO DE ACICLOVIR
São Paulo
KELLY CRISTINI BERTACHINI
ESTUDO DO USO DA PSEUDOBOEMITA NA LIBERAÇÃO DE ACICLOVIR
Dissertação de mestrado apresentado ao Programa de Mestrado Profissional em Engenharia de Materiais da Universidade Presbiteriana Mackenzie, como requisito parcial à obtenção do título de Mestre Profissional em Engenharia de Materiais.
Aprovada em:
BANCA EXAMINADORA
____________________________________
Prof. Dr. Antonio Hortêncio Munhoz Júnior
Universidade Presbiteriana Mackenzie
____________________________________
Leila Figueiredo de Miranda
Universidade Presbiteriana Mackenzie
____________________________________
Leonardo Gondin Andrade e Silva
KELLY CRISTINI BERTACHINI
ESTUDO DO USO DE PSEUDOBOEMITA NA LIBERAÇÃO DE ACICLOVIR
Dissertação de mestrado apresentado ao Programa de Mestrado Profissional em Engenharia de Materiais da Universidade Presbiteriana Mackenzie, como requisito parcial à obtenção do título de Mestre Profissional em Engenharia de Materiais.
ORIENTADOR: PROF. DR. ANTONIO HORTENCIO MUNHOZ JÚNIOR São Paulo
B536e Bertachini, Kelly Cristini
Estudo do uso de pseudoboemita na liberação de Aciclovir / Kelly Cristini Bertachini - 2015.
61f.: il., 30 cm
Dissertação (Mestrado em Engenharia de Materiais) – Universidade Presbiteriana Mackenzie, São Paulo, 2015. Orientação: Prof. Dr. Antônio Hortêncio Munhoz Junior Bibliografia: f. 53-61
1. Pseudoboemita. 2. Aciclovir. 3. Liberação controlada. I. Título.
AGRADECIMENTOS
A Deus sobre todas as coisas, pois a Fé e a esperança não foram perdidas.
À Universidade Presbiteriana Mackenzie e à Escola de Engenharia por me proporcionar um excelente curso de pós-graduação.
Ao Dr. Antônio Hortêncio Munhoz Júnior, pela oportunidade dada e acreditada.
Ao MackPesquisa pela concessão da bolsa de pesquisa e pelo apoio aos estudos.
A Juliana Aparecida da Silva pelo apoio nos estudos em São Paulo e apoio na vida cotidiana, pelo companheirismo e dedicação.
Ao Valentin Gabriel pelo companheirismo nas viagens, pelo gosto de viajar e conquistar novos horizontes, pela sua dedicação, demonstração de amor, afeto e carinho. Obrigada.
A minha família em especial pelo incentivo aos estudos, a minha mãe Ana Mariza Sbrana Bertaquini, meu pai Paulo Roberto Bertaquini e meu irmão Paulo Fernando Bertachini, minha madrinha Jane Mary Ferrari e Sidney Ferrari.
Dedicatória
“No meio da dificuldade encontra-se a oportunidade”. Albert Eistein
“Triste época! É mais fácil desintegrar um átomo do que um preconceito”. Albert Eistein
RESUMO
A pseudoboemita é um nanomaterial do tipo cerâmica fina, usada em sínteses farmacêuticas e nanosistemas para liberação de moléculas. É um material que foi obtido pelo grupo de engenharia de materiais da Universidade Presbiteriana Mackenzie por diferentes métodos, precipitação e polimerização inorgânica. Este trabalho pesquisou a liberação controlada de aciclovir com o uso de pseudoboemita, dando ênfase na determinação do teor de aciclovir em ensaios realizados pela técnica de Cromatografia Líquida de Alta Eficiência (CLAE). Foram realizados ensaios “in vivo”, demonstrando o efeito da adição da pseudoboemita na liberação controlada do fármaco. Sua liberação controlada foi avaliada pelos resultados da análise de concentração do fármaco aciclovir no plasma sanguíneo de “wistar rats”, determinada por CLAE em função do tempo de administração do fármaco nos ensaios “in vivo”. Concluiu-se que a pseudoboemita teve um papel importante na liberação controlada em relação ao tempo, demonstrando que teve maior eficiência comparando-se com a administração do fármaco em
“wistar rats” sem a pseudoboemita. Os resultados mostraram que a concentração de aciclovir
é menor nos ratos em que a gavagem foi com pseudoboemita.
ABSTRACT
The pseudoboehmite is a nanomaterial of fine ceramics type, used in pharmaceutical synthesis and nanosystems to release molecules. It is a material that was obtained by the Mackenzie University materials engineering group by different methods, precipitation and inorganic polymerization. This study investigated the controlled release acyclovir using pseudoboehmite, with emphasis on the determination of acyclovir content in tests carried out by liquid chromatography High Performance (HPLC). Assays were performed "in vivo," demonstrating the effect of addition of pseudoboehmite in controlled drug release. Its controlled release was assessed by the results of analysis of the drug concentration of acyclovir in plasma of "wistar rats", determined by HPLC according to the administration time of the drug in the tests "in vivo". It was concluded that the pseudoboehmite has a role in the controlled release over time, showing that it has higher efficiency compared with the drug administration "wistar rats" without pseudoboehmite. The results showed that the concentration of acyclovir is lower in rats that were gavage with pseudoboehmite.
LISTA DE ILUSTRAÇÕES
Quadro 1 Sistema de Classificação Biofarmacêutica (SCB) de Amidon (1995). 7 Espectro 1 Espectro FT-IR espectro Captopril (a), EC (b) captopril – EC (1:1)
mistura (c)... 9 Cromatograma 1 Solução padrão à concentração de 1 mg.mL de aciclovir. Fonte:
(NOVICKIS, 2009) 12
Esquema 1 Fórmula estrutural do fármaco aciclovir,
9-[(2-hidroxietoxi)metil]guamina. Fonte: Soares (2003). 15 Micrografia 1 Microscopia eletrônica de varredura de amostra da
pseudoboemita. 16
Esquema 2 Difusão por solubilização e liberação de fármacos 18
Quadro 2 Principais diferenças entre adsorção física e adsorção química 18
Fotografia 1 HPLC, CLAE (Cromatógrafo Líquido de Alta Resolução) TSP com detector UV.vis.
28 Gráfico 1 C Comparação entre as energias envolvidas na adsorção física e
química. 18
Cromatograma 2 R Relação de cromatogramas identificados nas devidas concentrações 32
Gráfico 2 C Dados obtidos da tabela de curva linear. 33
Cromatograma 3 Concentrações de aciclovir com pseudoboemita 34 Cromatograma 4 Concentração de aciclovir no plasma sanguíneo 35 Cromatograma 5 Concentração de aciclovir com pseudoboemita no plasma sanguíneo 35
Cromatograma 6 Limite de concentração próximo ao campo amostral 36
Gráfico 3 Linearidade das concentrações de ACV 37
Gráfico 4 Linearidade da concentração em relação ao tempo 38
Gráfico 5 Gráfico da linearidade da concentração 39
Difratograma 1 Difratograma de raio-X da pseudoboemita 30
Termograma 1 DTA e TG da pseudoboemita 31
LISTA DE TABELAS
Tabela 1 Distribuição dos 20 ratos em grupos n 26
Tabela 2 Concentração de aciclovir x área do pico dado 33
Tabela 3 Concentração de ACV em plasma sanguíneo 37
Tabela 4 C Concentração DO ACV em soro sanguíneo em mg.L-1 38
LISTA DE SIGLAS ABC Associação Brasileira de Cerâmica
ACV Aciclovir
AIDS Síndrome da Imunodeficiência Adquirida
LCAP Alumino Calcium Phosphorous Oxide Ceramics
ANVISA Agência Nacional de Vigilância Sanitária
CEUA Comitê de Ética no Uso de Animais
CLAE Cromatografia Líquida de Alta Eficiência
EDTA Ethylenediamine Tetraacetic Acid
FDA Food and Drugs Administration
OECD Organization for Economic Cooperation and Development
PSG Processo Sol-Gel
TCP Tricálcio de fosfato
UPM Universidade Presbiteriana Mackenzie
UV Vis Espectroscopia no Ultravioleta Visível
LOQ Limite de Quantificação Obtido
LOD Limite de Detecção Obtido
SUMÁRIO
1 INTRODUÇÃO... 3
1.1 OBJETIVO GERAL... 4 1.2 OBJETIVO ESPECÍFICO... 4
1.3 JUSTIFICATIVA... 5
1.4 METODOLOGIA... 5
2 REVISÃO BIBLIOGRÁFICA... 6
2.1 EXCIPIENTE (Liberação controlada de fármacos.)... 8
2.2 Utilização de Polímeros na liberação controlada de farmacos... 8
2.3 Liberação e Dissolução... 9
2.3.1 Ensaios “in vitro”... 11
2.3.2 Ensaios “in vivo” (Regulamentação das pesquisas em animais no Brasil)... 13
2.4 Aciclovir... 14
2.5 Pseudoboemita... 15
2.6 Adsorção, Biodisponibilidade e Solubilidade... 17
2.6.1 Biodisponibilidade... 19
2.6.2 Solubilidade... 20
2.6.3 Difusão de Fármacos... 20
2.7 FARMOCINÉTICA... 21
2.8 Liberação Controlada na forma farmacêutica... 21
3 MATERIAIS E MÉTODOS... 23
3.1 Materiais... 23
3.1.1 Poli(álcool vinílico) (PVAI)... 23
3.1.2 Nitrato de Alumínio hexahidratado... 23
3.1.3 Hidróxido de amônio (NH4OH)... 23
3.1.4 Pseudoboemita... 23
3.1.5 Fármaco aciclovir... 24
3.2.1 Estabelecimento das doses de ensaio e administração. Preparo para quantificação
por CLAE em ensaio “in vivo”... 25
3.2.2 Obtenções de amostras (plasma), avaliação bioquímica – ensaio quantitativo pelo método de CLAE. Determinação da presença do fármaco Aciclovir no plasma sanguíneo... 27 3.2.3 Método de preparo e análise por CLAE in vivo 28 4 RESULTADOS E DISCUSSÕES... 30
4.1 Curva de calibração do aciclovir ... 32
4.2 Resultados das análises de aciclovir no plasma dos ratos... 34
4.3 Limite de detecção e quantificação... 36
5 CONCLUSÕES... 41
1 INTRODUÇÃO
A liberação controlada do fármaco é avaliada por meio de análises “in vitro” e “in vivo”. No processo “in vitro” é definido um modelo matemático preditivo que descreve a relação entre a propriedade in vitro de uma forma farmacêutica e uma resposta “in vivo”.
No processo “in vitro”, a concentração do fármaco é determinada em função do tempo utilizando um dissolutor com condições determinadas de pH e temperatura. Já no estudo “in vivo”, são administrados aos animais (por exemplo, ratos), concentrações variadas de aciclovir em pseudoboemita e analisados o teor de aciclovir no plasma animal dos ratos por Cromatografia Liquida de Alta Eficiência (CLAE), considerando o estudo de biodisponibilidade do fármaco. Neste trabalho, para analisar qual o efeito gerado pela pseudoboemita, também foi administrado aos animais, aciclovir sem a presença de pseudoboemita.
No estudo “in vivo” foi quantificada e determinada a concentração do fármaco no metabolismo dos animais utilizado no presente estudo. Na liberação controlada de fármaco, utilizando pseudoboemita na administração do aciclovir como ativo espera-se que a adição de pseudoboemita promova a disponibilização controlada na dose certa e constante, facilitando a dissolução do aciclovir no plasma animal em função do tempo. Assim pretende-se melhorar a metabolização do aciclovir em presença da pseudoboemita no organismo “in vivo”. Esse processo evita a excreção do mesmo, dando maior eficiência do princípio ativo no organismo, diminuindo os problemas terapêuticos crônicos, melhorando o uso em terapias como doenças da imunodeficiência (NOVICKS, 2009). O aciclovir é utilizado no tratamento de várias patologias como no tratamento de pacientes com aids (HIV - Human Immunodeficiency Virus), os tipos I e II de herpes simples e vírus de varicela zoster, dentre outros. (COUVREUR., 2006; VAUTHIER, 2006; MUNHOZ JÚNIOR et al., 2010).
4
características físicas e químicas quanto a estequiometria, porosidade, estrutura cristalina e tamanho das partículas (MUNHOZ JÚNIOR, MIRANDA, UEHARA, 2006). Por meio da análise dessas nanopartículas, observou-se que a pseudoboemita é constituída por uma superfície bastante porosa e viável como sistema de liberação controlada dos fármacos.
Utilizando o processo sol gel, a partir de reagentes de pureza alta, é possível obter pseudoboemita pura, com área específica elevada e com total ausência de contaminantes, tornando-a, portanto, promissora para aplicações como a liberação controlada de fármacos (MUNHOZ JÚNIOR, MIRANDA, UEHARA, 2006; MUNHOZ JÚNIOR et al., 2010). Demonstrou-se por meio de análises “in vitro”, que a pseudoboemita formada pelo precursor nitrato de alumínio e obtida pelo processo sol gel é bastante porosa e viável como sistema de liberação controlada dos fármacos aciclovir e atenolol (NOVICKS, 2009). Neste presente estudo, a pseudoboemita será utilizada para a liberação controlada do fármaco aciclovir em ensaios “in vivo”. Será obtido o teor de aciclovir no plasma sanguíneo de ratos machos “wistar rats”.
As concentrações de aciclovir liberado pela pseudoboemita são determinadas por meio de um padrão de aciclovir em solvente alcoólico, onde cinco concentrações são analisadas em equipamento HPLC pelo método CLAE para obter a curva de calibração que relaciona unidade de área com o teor de aciclovir na solução. Preparou-se dois padrões com proximidades ao campo amostral das concentrações encontradas em plasma sanguíneo de ratos machos. O ensaio utilizando CLAE favoreceu o aumento da precisão do teor de aciclovir no plasma animal em ensaios “in vivo”.
1.1 OBJETIVO GERAL
Em vista da possível utilização da pseudoboemita como excipiente para liberação controlada de fármacos, este trabalho teve como objetivo determinar a adsorção e dessorção em pseudoboemita de um fármaco para verificar a possibilidade de utilizar pseudoboemita na liberação controlada de fármacos.
1.2 OBJETIVO ESPECÍFICO
1.3 JUSTIFICATIVA
Novicks (2009) e Munhoz Júnior et al. (2010) demonstraram por meio de análises “in vitro”, que a pseudoboemita obtida pelo processo sol gel era viável como sistema de liberação controlada dos fármacos aciclovir e atenolol. Souza (2013) deu continuidade ao estudo demonstrando que o material nanoparticulado utilizado não é tóxico realizando ensaios in vivoem” wistar rats”. Portanto torna-se importante o estudo do uso de pseudoboemita em aciclovir como liberação controlada e ampliando a investigação “in-vitro”para “in vivo”. A quantificação do aciclovir no sangue de “wistar rats” será realizada por CLAE em ensaios “in vivo”.
No laboratório de Engenharia de Materiais do Mackenzie já se encontra em estudos a obtenção de micro e nanopartículas de pseudoboemitas obtidas por tecnologia de Cerâmica Fina, via processo sol gel.
1.4 METODOLOGIA
Para o desenvolvimento deste trabalho foi realizado um levantamento bibliográfico pela consulta em livros, periódicos, anais de congressos e em sites especializados da internet.
Na parte experimental foram produzidas e caracterizadas pseudoboemitas pelo processo sol gel.
Com relação aos procedimentos experimentais, a metodologia consistiu na realização de ensaios em roedores “in vivo” utilizando ratos machos “wistar rats”.
Foi comparado o teor de aciclovir no sangue do grupo de ratos controle com o teor de aciclovir no grupo dos ratos em que o aciclovir foi administrado com pseudoboemita. No grupo de ratos controle foi administrado somente aciclovir.
6
2 REVISÃO BIBLIOGRÁFICA
Dando continuidade ao estudo de excipientes e liberação controlada de fármacos com o uso de aciclovir e pseudoboemita são apresentadas duas importantes citações que definem a importância de suas funções, que são dados para as determinações associadas a este conteúdo.
A primeira citação de Soares (2003) que resume as funções dos excipientes farmacêuticos:
Os produtos de uso farmacêutico, excipientes ou ativos, precisam atender a um número de requerimentos com respeito a segurança de seu uso, estabilidade e eficácia terapêutica. Em termos dos excipientes farmacêuticos, a propriedade fundamental destes produtos se refere a sua inocuidade química, microbiológica e ausência de atividade farmacológica, enquanto que alguns atributos físicos podem ter importância, como sabor e cor que afetam a aceitação pelo paciente, ou ainda a textura e o conteúdo de água que afetam os processos de fabricação.
A segunda citação refere-se a (ANVISA, 2003), glossário de denominações comuns brasileiras, que define os excipientes farmacêuticos da seguinte forma:
EXCIPIENTES – 1) Os excipientes são substâncias que, em concentrações presentes em algumas formas farmacêuticas, não apresentam atividade farmacológica. Contudo, isso não exclui a possibilidade de que determinados excipientes possam causar reações alérgicas ou efeitos indesejáveis. Os excipientes são empregados para dotar as formas farmacêuticas de características que assegurem a estabilidade, biodisponibilidade, aceitabilidade e facilidade de administração de um ou mais princípios ativos. Na medida que os excipientes afetam a liberação do princípio ativo, eles podem modificar a magnitude (efetividade)potência) e o perfil temporal (farmacocinética) das ações farmacológicas dos produtos farmacêuticos através de modificações na sua estabilidade. Os excipientes servem, além disso, para dar uma forma ou consistência adequada a uma preparação. 2) Certas farmacopéias não aceitam o uso de excipientes que possam interferir nas provas e avaliações farmacopeicas descritas nelas, tal como acontece com a
Farmacopéia Britânica. 3) Os termos “ingrediente inativo” e “substância agregada” são
Segundo o glossário de denominações comuns brasileiras (ANVISA, 2012), os excipientes são substâncias que, em concentrações presentes em algumas formas farmacêuticas, apresentam inocuidade química, microbiológica e ausência de atividade farmacológica, segundo Novickis (2010), suas funções são de otimizar a estabilidade do fármaco, favorecer a biodisponibilidade (liberação do fármaco e farmacocinética) e fornecer a melhor consistência para facilitar na manufatura dos produtos farmacêuticos.
Em 1995 Amidon e colaboradores, elaboraram o chamado Sistema de Classificação Biofarmacêutica (SCB), que subdivide os fármacos em 4 classes distintas, levando em conta a relação solubilidade e a permeabilidade pelas membranas do Trato Gastro Intestinal TGI (Quadro 1). Segundo o Sistema de Classificação Biofarmacêutica (SCB), a dissolução e a permeação intestinal do fármaco podem limitar a absorção e, conseqüentemente, a ação terapêutica. A classificação SCB auxilia para se prever o comportamento ”in vivo” de um fármaco levando-se em conta o ensaio de dissolução deste, ”in vitro” sendo também decisivo no desenvolvimento de metodologias para os
testes de dissolução (AMIDON et al; 1995 apud LIRA, 2004). O Quadro 1 apresenta o sistema de classificação biofarmacêutica (SCB) de Amidon (1995).
Quadro 1 – Sistema de Classificação Biofarmacêutica (SCB) Amidon et al. (1995).
Classe Sulibilidade/Permeabilidade
I
II
III
IV
Solubilidade alta e permeabilidade alta
Solubilidade baixa e permeabilidade alta
Solubilidade alta e permeabilidade baixa
Solubilidade baixa e permeabilidade baixa
8
2.1 EXCIPIENTES E LIBERAÇÃO CONTROLADA DE FÁRMACOS
Na definição de excipientes, as substâncias que podem ser sólidas, líquidas e semi sólidas, em forma de géis em diversos estados, utilizados em medicamentos e manipulação, ocorre a presença de excipientes que têm a função de somente diluir, dissolver ou avolumar os princípios ativos em suas respectivas formas farmacêuticas. Esses estão inseridos na concepção tradicional de excipiente. Entretanto, ocorre também outra função mais importante, que é a melhoria do desempenho desses princípios ativos dos fármacos, em termos de assegurar sua estabilidade, biodisponibilidade (liberação controlada), aceitabilidade, facilidade de administração de um ou mais princípios ativos, direcionamento e absorção em sítios específicos. (PIFFERI; SANTORO; PEDRANI, 1999; LIRA, 2004 ).
A pseudoboemita estudada no presente trabalho é um excipiente modificador da liberação de fármacos (NOVICKS, 2009; MUNHOZ JÚNIOR et al., 2010), que controla a liberação do fármaco ativando o processo de solubilização do aciclovir.
2.2 UTILIZAÇÃO DE POLÍMEROS NA LIBERAÇÃO CONTROLADA DE
FÁRMACOS
A utilização de polímeros e matrizes poliméricas na esfoliação homogênea de frações mássicas baixas (0,2 a 10% em massa) de lamelas de argilas dentro de matrizes poliméricas, modificando as propriedades mecânicas, térmicas de barreira a gases dos polímeros, resultando em materiais com propriedades melhoradas para diversas aplicações, mantendo boas propriedades ópticas (evitando a opacificação de materiais). A esfoliação de lamelas de argilas dentro de matrizes poliméricas é facilitada pela sua organofilização, que promove melhoras na compatibilização entre as fases das lamelas inorgânicas de argila e a matriz polimérica orgânica (SOARES, 2003).
manter a integridade do material durante o processo de liberação do fármaco, faz com que sua biodegradação no plasma e citoplasma do corpo humano não seja comprometida. Essas partículas são acumuladas nas células ou circularão pelo plasma, ou serão metabolizadas (CUNHA et al., 2009; CALLISTER, JUNIOR, 2008; RING, 1996).
Um exemplo de medicamentos revestido com blendas poliméricas é o Captopril, com Etilcelolose (EC) (LEE, LIN; 2004).
No Espectro 1 são mostrados os espectros infravermelho com transformada de Fourier de captopril, EC e da mistura EC e captopril onde são observados os picos de 1747 e 1590 cm-1 correspondente a espectro FT-IR Captopril.
Espectro 1: Espectros FT-IR Captopril (a), EC (b) mistura captopril – EC (1:1) (c).
No estado vibracional para o EC é mostrado o pico característico a 3478 cm-1, observa-se um pico característico do grupo hidroxila. Na possível distinção dos picos espectrais na diferença das misturas pela determinação da intensidade na sensibilidade do espectro IR nas bandas do Captopril (1747 cm-1) e EC (3478 cm-1).
10
É constituído por um conjunto de fenômenos entre a relação da administração de um ativo fármaco com excipiente, nos quais são estudadas a intensidade e o tempo de absorção, ocorrendo a dissolução e a liberação ativa no organismo por absorção. No ensaio in vitro o fármaco deve ser liberado em dissolutor sendo observada a concentração do fármaco em função do tempo e desintegração do comprimido. A liberação controlada ocorrerá em pH estável coerente a digestibilidade gastrointestinal. Neste processo a substância solubilizará em um solvente sendo determinada a concentração do fármaco por diferentes tempos no dissolutor.
O Fluxograma 1 apresenta o fármaco indicando o percurso e a distribuição do fármaco disponibilizado no organismo O Fluxograma 1 apresenta as diferentes fases do fármaco durante a disponibilização no organismo.
Fluxograma 1: O percurso e a distribuição do fármaco disponibilizado no organismo nas diferentes fases.
1ᵃ. Fase Farmacêutica 2ᵃ. Fase Farmacocinética 3ᵃ. Fase Farmacodinâmica
As três fases dos processos os quais fazem parte do percurso da disponibilidade de ativos, são relativos ao organismo que será quantificado pela distribuição “in vivo”, no qual o meio depende totalmente da interação veicular entre o fármaco e seu sítio receptor com as alterações moleculares e celulares correspondentes ao efeito farmacológico.
No sistema de dissolução “in vitro” é decisivo no desenvolvimento de metodologias para os testes de dissolução (AMIDON et al., 1995 apud LIRA, 2004).
Desintegração e desagregação, liberação e dissolução do fármaco
Absorção, distribuição, biotransformação e excreção
A adsorção em superfícies podem melhorar a biodisponibilidade de fármacos de solubilidade baixa em água (Classe II e IV da classificação SCB). aumentando a área superficial do adsorvente responsável pela adsorção do fármaco, melhorando a dissolução do meio. Esta técnica foi descrita inicialmente por Monkhouse e Lach em 1972. Alguns adsorventes são: celulose microcristalina, compostos de magnésio, alumínio, silicatos e caulim.
A liberação de fármacos a partir de cerâmicos, antiácidos, carbonato de cálcio, carbonato de magnésio e sais de alumínio, podem diminuir a biodisponibilidade de fármacos em função da adsorção do ativo ou do efeito quelante (“chelation”), exceto o bicarbonato de cálcio (DUREJA; PHARAM ; MADAN, 2007).
No Quadro 1, tem-se a classificação de fármacos de um excipiente ideal.
Quadro 1: Características de um excipiente ideal Fonte: Pifferi, Santoro; Pedrani (1999).
Fármaco toxicologicamente inativo
Quimicamente e fisicamente inerte à droga
Compatível com outros componentes da formulação Incolor e sem sabor
Alta fluidez
Alta compressibilidade
Disponibilidade mundial e econômico Garantia de qualidade
Fácil armazenamento
Desempenho consistente com fármaco específico
2.3.1 – Ensaios in vitro de pseudoboemita com aciclovir
Ensaio “in vitro” é determinado pela dissolução do Aciclovir e pseudoboemita que é definido pelo fator tempo, pelo ganho ou perda de concentração.
No processo in vitro, Richard Novickis (2009) analisou o teor de aciclovir em função do tempo para condições semelhantes (pH, temperatura) à dos ensaios “in vivo”.
12
aciclovir liberado. Nos primeiros 15 minutos, resultando a absorbância praticamente nula após este tempo.
Nos resultados determinados por UV-vis, Novickis, (2009) mostrou que teve um aumento da concentração do aciclovir no pH = 7 .
As concentrações do aciclovir tornaram-se relativamente constantes, acima do esperado, foi observado um aumento da solubilização de aciclovir pela presença da pseudoboemita, o que pode ser colocado como hipótese o processo de filtração da pseudoboemita, retendo partículas não solubilizadas do fármaco. A pseudoboemita sendo levemente turva promoveu uma posterior solubilização do aciclovir, resultando aparentemente um aumento de concentração de aciclovir no ensaio.
Neste caso segundo Novickis, (2009) os interferentes provocados pela turbidez demonstraram aumento da concentração acima do esperado.
Novickis (2009) analisou o aciclovir por Cromatografia Líquida de Alta Eficiência apresentados no cromatograma 1, onde utilizou um padrão de aciclovir referência de 1 mg.mL-1 para comparação do mesmo.
Em uma solução de aciclovir em presença de pseudoboemita foi identificado por comparação dos tempos de retenção a presença de aciclovir. No cromatograma 1 observa-se que o tempo de retenção de aciclovir para as condições de análise estudadas é de 7,6 minutos.
Nas identificações, Novickis (2009) obteve o tempo de retenção para aciclovir, de acordo com normas e dados da literatura (STULZER, et al., 2008)
A comparação destes cromatogramas utilizando a literatura (KULKAMP, 2003), permitiu dizer que o fármaco ainda está presente mesmo após as dessorções do substrato da pseudoboemita, sendo este um indício de que se manteve a estabilidade química.
2.3.2 – Ensaios ” in vivo”
Segundo norma da Anvisa para a administração por via oral do fármaco em ratos por ensaios “in vivo”, segue o mesmo procedimento inicial da toxicidade em ratos machos. O teste de toxicidade aguda é um pré requisito para agências reguladoras dos países, como a Food and Drugs Administration (FDA) e (ANVISA) Agência
Nacional de Vigilância Sanitária, para a aprovação de novos fármacos aditivos
alimentares e outros. Para a realização deste teste, é necessário conduzí-lo de acordo com protocolos internacionais preconizados por organizações como a Organization for
Economic Cooperation and Development: OECD (OGA; OGA; CAMAREO;
BATISTUZZO, 2008; ANVISA, 2010) Agência Nacional de Vigilância Sanitária e
Centro de Estudos com Animais. O comitê de ética no uso de animais da Universidade
Presbiteriana Mackenzie aprovou os procedimentos éticos do referido projeto pelo documento CEUA No 120/11/2014.
Para o estudo “in vivo” da pseudoboemita em roedores, segue-se as diretrizes do Guia OECD 423 (OECD, 2001; SOUZA, 2013), pois seus protocolos são de grande aceitação pelos órgãos reguladores e atendem requisitos de experimentação e critérios de bem estar animal.
14
Cooperation and Developmente: OECD, no qual serão seguidas diretrizes do Guia 407
(OECD, 2001). Seus protocolos são de grande aceitação pelos órgãos reguladores e atendem requisitos de experimentação e critérios de bem estar animal.
Em relação ao número de animais, conforme, foram utilizados 2 grupos (teste e controle), sendo cada grupo composto por 5 animais (ratos machos). Os grupos teste são aqueles em que a gavagem foi realizada com a pseudoboemita e aciclovir. O grupo controle é aquele em que o aciclovir foi administrado somente em água.
Em determinação a resolução da ANVISA (2010) , as pesquisas clínicas no Brasil com medicamentos e produtos para a saúde, com a finalidade de registro futuro devem ser submetidas à avaliação da (ANVISA) e dados pré clínicos e de estudos clínicos de fases anteriores ao protocolo devem ser apresentados para dar subsídio à esta avaliação. Portanto, as pesquisas em modelos animais fundamentam as pesquisas clínicas. Sem pesquisa pré-clínica, não há a realização de ensaio clínico, não havendo, conseqüentemente, nem a aprovação nem a liberação de medicamentos novos e produtos para a saúde em nosso país. Há rigor na avaliação de protocolos de pesquisa envolvendo seres humanos.
A regulamentação das pesquisas em animais no Brasil se iniciou em 1934. A primeira lei que regulamentou a utilização de animais em pesquisa no mundo foi publicada em 1876, no Reino Unido. Quase 60 anos depois, em 10 de julho de 1934, o Chefe do Governo Provisório dos Estados Unidos do Brasil, o Sr. Getúlio Vargas, publicou o Decreto Lei nº 24.645, regulamentado posteriormente pelo Decreto Lei nº 3.688 de 3 de outubro de 1941. Esta lei determina que todos os animais existentes no país são tutelados pelo estado e penaliza quem aplicar ou fizer aplicar maus tratos aos animais. O artigo 3º apresenta 31 incisos, que conceituam o que são maus tratos aos animais.
sofrimento prolongado a todo animal cujo extermínio seja necessário para consumo ou não.
2.4 ACICLOVIR
Aciclovir é um fármaco denominado 9-[(2-hidroxietoxi)metil]guamina similar, porém sintético, aos nucleosídeos purínicos com atividade antiviral. É considerado um dos agentes antivirais mais eficazes e mais seletivo contra todos os tipos de herpes simples, tipo 1(HSV1) e tipo 2(HSV2) e também contra o vírus Varicella Zoster
(VZV), sendo as atividades bastante seletivas para as células infectadas (ELION, 1982). Sendo de natureza hidrofílica e anfótera, o aciclovir possui valores de pKa=2,4 para a protonação e pKa=9,2 para a desprotonação em razão do potencial hidrogeniônico e hidroxiliônico (OH-) e (H+). A via oral é preferida em relação a parental em razão dos riscos de toxicidade local, entretanto, quando administrado via oral é pouco absorvido pelo trato gastrintestinal, com uma biodisponibilidade variando entre 15 - 30 %. Assim, para a garantia de uma maior eficiência de absorção muitas vezes são utilizados métodos com doses excessivas e, desta forma, muitas vezes atingindo o intervalo tóxico. O Esquema 2 apresenta a fórmula do aciclovir.
Esquema 1 Fórmula estrutural do aciclovir, 9-[(2-hidroxietoxi)metil]guamina. Fonte: Soares (2003).
16
O aciclovir é um fármaco de Classe IV do sistema de classificação biofarmacêutica segundo Amidon (1995). Um dos principais alvos de estudos em tecnologia farmacêutica, por apresentar problemas de dissolução, são aqueles para melhorar sua solubilidade, sem partir para modificações moleculares (LIRA, 2004).
2.5 PSEUDOBOEMITA
A pseudoboemita é um material sintético com estrutura muito próxima ao do mineral boemita. Pseudoboemita e pseudoboemita fibrilar são caracterizáveis por difração de raios X e por expalhamento de elétrons utilizando microscopia eletrônica de transmissão. (SANTOS et al., 2009).
A produção de nanoparticulados inclui grande variedade de métodos físicos, químicos e mecânicos. Dentre as diversas técnicas utilizadas para a síntese de pós nanoparticulados de cerâmicas, o processo sol gel é o mais utilizado e estudado. Novicks (2009) e Munhoz Júnior et al. (2010), realizaram análises microscópicas da pseudoboemita em microscópio eletrônico de varredura, a fim de caracterizar a morfologia de suas partículas. Em análise de microscopia eletrônica de varredura utilizando detector de elétrons secundário (Micrografia 1), Novicks (2009) observou que a pseudoboemita é constituída por uma superfície bastante porosa que aparenta ter uma morfologia homogênea, o que favorece a adsorção quanto a sua maior superfície em função do material ser microscopicamente amorfo. Esta porosidade alta do material também foi confirmada pela obtenção de sua área específica pela técnica BET 277,5 m2/g (KLOPROGGE et al., 2006; MACEPO et al., 2006)
Mazalli (2005), demonstrou que no processo de obtenção de cerâmicas pelo processo sol gel, utilizando precursores alcóxidos após a hidrólise, ocorreu o fenômeno de formação do gel por reação de policondensação.
Kloprogge e colaboradores (2006), em estudo entre a boemita e pseudoboemita mostraram que a diferença entre elas era que a célula unitária da pseudoboemita é levemente maior que a boemita, podendo entender que sua forma estrutural é do Al+3“mal cristalizado” na composição de Al
2O3.xH2O (2,0 > x >1,0) com espaçamentos inter planares aumentados na direção [020] até o valor de 0,67 nm (6.7 Ā) em comparação com 6.12 Ā para boemita (COELHO et al., 2008).
Segundo Novickis (2009) e Munhoz Júnior (2009), a pseudoboemita quando calcinada pode fornecer as seguintes fases cristalinas da alumina:
Pseudoboemita gamma-alumina delta-alumina theta-alumina alpha-alumina.
18
tetrâmeros e octâmeros, formando então um polímero linear da pseudoboemita também chamado de pseudoboemita fibrilar (ALMEIDA FILHO et al., 1999).
2.6ADSORÇÃO, BIODISPONIBILIDADE E SOLUBILIDADE
A adsorção é um processo similar ao de absorção, por meio da qual uma substância no estado gasoso ou líquido torna-se ligado a um sólido. A superfície de contato é determinada pelas ligações secundárias ou cruzadas sem sofrer reação química, onde forma-se uma camada de interface. Sendo a superfície maior do material sólido, maior será a natureza adsorvente (DUREJA; PHARAM; MADAN, 2007). A adsorção pode ser física ou química sendo que a diferença entre elas é apresentada na Quadro 2.
Quadro 2 Principais diferenças entre adsorção física e adsorção química. Fonte: MUNHOZ JUNIOR et al. (2010).
Adsorção física Adsorção química
Causada pela força de van der Walls Causada pelas forças eletrostáticas e ligações covalentes Não há transferência de elétrons Há trasferência de elétrons
Calor de adsorção = 2 – 6 kcal/mol Calor de adsorção = 100 – 200 kcal/mol Fenômeno geral para qualquer espécie Fenômeno específico e seletivo
A camada adsorvida pode ser removida por A camada adsorvida só é removida por aplicação aplicação de vácuo de vácuo e aquecimento por temperatura acima Formação de multicamadas da temperatura Somente a formação de monocamadas crítica
Acontece somente abaixo da temperatura Acontece também a altas temperaturas crítica
Lenta ou rápida Instantânea
Adsorvente quase não é afetado Adsorvente altamente modificado na superfície
A + B = A.B (Equação 1)
Em que A é o adsorbato, B é o adsorvente e A.B é o composto adsorvido ligado a forças químicas. A comparação entre as energias envolvidas na adsorção química e física é apresentada no Gráfico 1.
Gráfico 1. Comparação entre as energias envolvidas na adsorção física e química.
+
As mudanças de estados e reações são sempre exotérmica em relação as entalpias em que a ΔH acompanha a adsorção. Este fenômeno de superfície está ligado a tensão superficial das soluções, onde depende da temperatura de mudança de estado e adsorção entre as concentrações de adsorvato e adsorbato juntamente com o fluído de contato com o adsorvente. A fórmula representativa da variação de entalpia em relação a troca de energias é sempre negativa, sendo no final maior que zero. (Equação 2)
ΔHads= ΔGads + TΔSads, (-ΔHads) >0 ( Equação 2 )
Em que: ΔHads éa variação de entalpia do adsorvente, ΔGads é a energia de Gibbs de adsorção que é negativa e TΔSads é a variação do adsorbato sendo necessariamente negativa.
20
Os efeitos das forças de van der Walls são chamados de fisiosorção ou fenômeno físico, sendo exotérmico e reversível, as forças de atração são consideradas interações fracas, a energia produzida é fisicamente adsorvida e na condensação é liberada. Neste processo a interação é eletrostática entre o particulado e o sólido superficial.
2.6.1 Biodisponibilidade
A biodisponibilidade é a medida da quantidade de medicamento, contida em uma fórmula farmacêutica, que chega à circulação sistêmica e a velocidade na qual ocorre esse processo. Na farmacologia, o termo biodisponibilidade é usado para descrever a fração de uma dose administrada de um fármaco que atinge a circulação sistêmica. É uma das principais propriedades farmacocinéticas dos fármacos.
A biodisponibilidade é uma das ferramentas essenciais da famarcocinética, já que seu valor deve ser considerado quando se calcula as doses para administração de drogas por vias não intravenosas. Por definição, quando uma medicação é administrada intravenosamente, sua biodisponibilidade é 100%. Entretanto, quando uma medicação é administrada por outras vias (como a via oral, por exemplo), sua biodisponibilidade diminui (em razão da absorção incompleta e ao metabolismo de primeira passagem).
Esse fenômeno de biodisponibilidade se expressa em relação à administração intravenosa do princípio ativo (biodisponibilidade absoluta) ou a administração, por via oral, de um produto de referência (biodisponibilidade relativa ou comparativa).
A biodisponibilidade de um medicamento não deve ser confundida com a fração biodisponível, a menos que se refira à biodisponibilidade absoluta (ANVISA, 1998).
O fenômeno de biodisponibilidade indica a velocidade e a extensão de absorção de um princípio ativo em uma forma de dosagem, a partir de sua curva concentração/tempo na circulação sistêmica ou sua excreção na urina. (ANVISA, 1999)
2.6.2 Solubilidade
soluto e da temperatura. O efeito de solubilidade entre um soluto e solvente são principalmente relacionados às moléculas apolares e polares (MASTERTON; SLOWINSKI; STANITSKI,1990).
2.6.3 Difusão de fármacos
O Esquema 2 apresenta a difusão entre o fármaco, o solvente e o soluto tendo em vista as modificações de um material polimérico e a solubilização sem mudança de estado químico.
Esquema 2: Difusão por solubilização e liberação de fármacos por meio da solubilização de polímero e fármaco. Fonte: Martins Lopes, 2006.
A substância é contida na parte interna do polímero em tempo igual a zero e após esse tempo determinado igual a t, o fármaco (soluto) difunde no solvente, ocorrendo a solubilização.
O processo de difusão na liberação controlada de fármacos é descrito pela primeira lei de Fick (Equação 3 )
J = - DKΔC (Equação 3) L
em que, no caso de liberação de fármacos ;
22
D = coeficiente de difusão (cm2/tempo);
K = constante conforme a geometria do dispositivo de liberação (obs: originário da segunda lei de Fick que calcula a cinética de liberação pela forma).
ΔC = fluxo proporcional ao gradiente (delta concentração/distância em cm); A difusão entre os fármacos é demonstrada pela lei de Fick, no qual o movimento browniano, fundamentam os aspectos entre o soluto e o solvente.
2.7 FARMOCINÉTICA
A farmacocinética estuda a atividade do antimicrobiano no interior do organismo a partir dos parâmetros de velocidade de absorção, distribuição e eliminação do fármaco e de seus metabólitos. Com os conhecimentos de farmacocinética e das características do microrganismo frente ao antimicrobiano é possível adequar posologia, via deadministração e intervalo entre cada dose, visando melhorar o resultado terapêutico e, ao mesmo tempo, reduzir a probabilidade de desenvolver efeitos tóxicos potenciais.
2.8 LIBERAÇÃO CONTROLADA NA FORMA FARMACÊUTICA
A liberação de formas farmacêuticas também conhecida como farmocinética, tendo como principal motivo intuito a não desagregação e a liberação do fármaco lentamente (mudança de área quase nula não atingindo as condições de equilíbrio) é expressa pela Equação 4.
W0 – Wt = Kt ( Equação 4 )
Da Equação 4 quando dividida por W0 obtem-se a Equação 5.
ƒt = K0t ( Equação 5 )
Sendo ft =1 - (Wt/W0), em que ft representa a fração de fármaco liberado no tempo t e K0 a constante de velocidade aparente de dissolução ou constante de liberação de ordem zero.
Desse modo, um gráfico da fração liberada do fármaco versus tempo será linear se as condições previamente estabelecidas forem cumpridas.
Esta relação pode ser utilizada para descrever a liberação controlada de fármacos por vários tipos de formas farmacêuticas de liberação controlada. (Equação 6)
Qt = Qo + K0 t ( Equação 6 )
sendo Qt a quantidade de fármaco liberada no tempo t, Q0 a quantidade inicial de fármaco na solução (na maior parte das vezes, Q0= 0) e K0 a constante de liberação de ordem zero. Para achar a velocidade da reação divide-se a variação na concentração do material pelo período de tempo no qual a variação ocorreu. Em razão do fato do material estar sendo consumido nesta reação, obtem-se um resultado negativo. Por convenção os dados de velocidade são colocados com o sinal positivo, nestes casos.
3 MATERIAIS E MÉTODOS
3.1 MATERIAIS
3.1.1 Poli(àlcool vinílico) (PVAI)
O PVAI tem a função de aumentar a viscosidade do meio na solução precursora do nitrato de alumínio, a solução utilizada foi de 8 % em massa de PVAI em água deionizada (fornecedor: LabSynth).
3.1.2 Nitrato de alumínio (AlNO3.9H2O)
24
3.1.3 Hidróxido de Amônio (NH4OH)
Para obtenção da pseudoboemita por polimerização inorgânica, com o aumento do pH, formando um gel. A solução utilizada foi de NH4OH, 28 % em massa de NH3 (fornecedor: LabSynth)
3.1.4 Pseudoboemita
Os géis de pseudoboemita foram sintetizados via processo sol gel utilizando-se como precursores soluções de nitrato de alumínio nono-hidratado, Al(NO3)3·9H2O (950 g/L) e hidróxido de amônio, NH4OH (28 % em massa). O uso bem sucedido desses reagentes como precursores da pseudoboemita já havia sido reportado por Moroz et al
(2006). Segundo Moroz et al (2006), as pseudoboemitas obtidas a partir de nitrato de alumínio são as que apresentam maior área específica.
Com o auxílio de uma bureta, o nitrato de alumínio foi gotejado sobre um béquer contendo hidróxido de amônio com constante agitação até se atingir pH 7. A solução de nitrato de alumínio foi adicionada a solução de álcool polivinílico (8 % em massa).
As condições de manuseio e temperatura no preparo da reação de síntese foi de (-5° C), sem utilizar agitação no meio. Após a formação do gel, foi envelhecido e lavado durante a filtração com água destilada para a retirada dos subprodutos (NH4NO3). O material particulado resultante da síntese do gel foi seco a 70 °C em estufa por 12 horas, finalmente o material foi moído e peneirado em peneira com abertura de malha de 90 micrometros.
As pseudoboemitas foram caracterizadas por análises térmicas utilizando razão de aquecimento de 20 º C/minuto em atmosfera de nitrogênio e difração de raios X utilizando radiação cobre kα.
3.1.5 Fármaco Aciclovir
3.2 RATOS MACHOS PARA EXPERIMENTAL “IN VIVO”
Os animais utilizados no processo “in vivo” foram adquiridos na Universidade de São Paulo – SP, ao todo foram 20 ratos, levados e mantidos no Biotério Central da Universidade Presbiteriana Mackenzie, em condições especiais controladas de umidade, temperatura (21º ± 2º C) e ciclo de claro/escuro de 12 horas.
No processo em que os animais passaram pelo experimento, foram alimentados com ração comercial própria para a espécie (ração para animais de laboratório, marca Nuvital) e água.
A manutenção, alimentação, tratamento e eutanásia dos animais utilizados seguiram normas éticas recomendadas. No procedimento de administração via oral até o tempo de metabolização do Aciclovir e pseudoboemita, esses animais, no total 20 ratos machos sofreram eutanásia, livre de sofrimento e dor, por sobrecarga anestésica de Cetamina.
Foram tomadas medidas e procedimentos experimentais adotados para o estudo, onde obedeceram às normas estabelecidas pela comissão de pesquisa e ética da Universidade Presbiteriana Mackenzie. Estes foram aprovados pelo Comitê de Ética no uso de animais da Universidade Presbiteriana Mackenzie – processo (CEUA) Comissão de Ética no uso de Animais 120/11/2014.
3.2.1 Estabelecimento das doses de ensaio e administração.
Para o ensaio “in vivo” no teste proposto foram utilizados 20 ratos “wistar
machos”. Os animais após a chegada ao Mackenzie ficaram 5 dias de quarentena no biotério da Universidade. Após esse período eles foram pesados e marcados. Caso o peso estivesse abaixo do ideal, esperava-se uma semana e repetia-se a pesagem.
Eles foram alimentados com ração e água. No dia do procedimento a alimentação permaneceu a mesma.
26
No final do intervalo determinado (1, 2 ou 3 horas) cada rato era levado para sala separada em uma gaiola individual enquanto os demais permaneciam no biotério. A anestesia era administrada com agulha própria para insulina e seringa de 1 mL.
Os anestésicos admistrados foram uma mistura de cetamina, um anestésico que atua nas viceras e xilazina, um relaxante muscular.
Após a administração do anestésico, se esperou o tempo adequado para total sedação do animal e só então iniciou-se o processo de eutanásia.
Em uma tábua de madeira, o animal sedado foi preso pelas patas com fita crepe. Com auxílio de tesoura e pinça cirúrgicas, o tronco do animal foi aberto, de modo a revelar sua veia cava, localizada abaixo do fígado.
Com o auxílio de uma agulha de 0,70x30 mm e uma seringa de 5 mL, foi coletado 4 mL de sangue do animal. Em alguns casos, quando não era possível coletar esse volume, um pouco de sangue foi coletado diretamente do coração. O sangue foi transferido para um tubo hemo roxo com EDTA e após a adição do sangue este era armazenado em uma geladeira.
Ao final da eutanásia, o rato era colocado em um saco plástico branco para material infectante e colocado no freezer para encaminhamento do próprio biotério.
No final da eutanásia de todos os animais, o sangue foi centrifugado para separação do soro. Esse foi armazenado em eppendorfs e colocado em um freezer para posterior análise.
Os ratos foram divididos em 4 grupos e separados 5 em 5 com dose de aciclovir e pseudoboemita, que foram administradas oralmente por gavagem com doses de ensaio predeterminadas, conforme apresentado na Tabela 3. Foram administrados 16,4 mg de aciclovir/kg de rato em 1 ml de água destilada. Utilizou-se 100 mg de pseudoboemita em gel.
Após a administração, os animais foram observados por um período total de 8 horas, o teor de aciclovir no plasma foi analisado pela técnica de CLAE em função do tempo. Os períodos propostos tiveram efeito da concentração em função do tempo, demonstrando uma diminuição da concentração por CLAE.
Tabela 1: Distribuição dos 20 ratos em grupos, n = número de animais; procedimento de gavagem e método CLAE para ensaio “in vivo”
Na tabela 1 são apresentados os grupos grupos para a gavagem e os ensaios “in
vivo”.
ENSAIOS No DE RATOS DATA ADMINISTRAÇÃO aciclovir
GRUPO 1 (n=5)
5 06/06/2015 16,4 mg/kg
GRUPO 2 (n=5)
5 06/06/2015 16,4 mg/kg+Pseudoboemita
GRUPO 3 (n=5)
5 23/06/2015 16,4 mg/kg
GRUPO 4 (n=5)
5 23/06/2015 16,4 mg/kg +pseudoboemita
3.2.2 Obtenção das amostras (plasma): avaliação bioquímica – ensaio quantitativo pelo método de CLAE. Determinação da presença do fármaco aciclovir no plasma sanguíneo.
Foi realizado o teste para detecção e quantificação do aciclovir no plasma dos ratos.
Neste teste foram utilizados 20 ratos wistar, machos. Estes foram divididos em 4 grupos todos tratados com dose única de aciclovir (ACV) (16,4 mg/kg) + água destilada e outro grupo tratado com dose única de uma mistura de ACV + pseudoboemita + água destilada por gavagem. O peso de cada rato foi em torno de 300 gramas.
28
anticoagulantes (EDTA 1 mg/ mL) e centrifugadas a 1500 rpm para obtenção do plasma. As amostras foram agitadas em agitador magnético da marca Vortex por 15 segundos e filtradas com auxílio de cartuchos acoplados em uma cuba coletora de amostra, onde foi efetuado o vácuo.
O tempo de retenção do ACV puro e sua concentração plasmática foi determinada por CLAE para sua comparação e detecção.
Os procedimentos descritos anteriormente foram realizados individualmente e em local isolado, a fim de evitar qualquer estresse nos demais animais. Em todos os grupos foi realizado jejum prévio às coletas.
As amostras foram analisadas imediatamente com o preservante e o preparo com (E.D.T.A) em temperatura de 20 °C em análise por CLAE.
As amostras de plasma dos animais de todos os grupos posteriormente foram analisadas por CLAE com detector de UV vis para determinação da quantidade do aciclovir no plasma em função do tempo de absorção no organismo como um todo.
Nas análises por CLAE, para a determinação de aciclovir foram utilizados kits de SPE (Extração por Fase Sólida) comerciais da marca Strata Phenomenex e extraídos em microvials com tampa de teflon. Os valores foram determinados por equipamento automatizado por software da marca TSP, capaz de medir com exatidão na absorbância de 254 nm (Fotografia 1) a qual é a banda característica para detecção de aciclovir. Foram analisados padrões de aciclovir nas mesmas condições para construir uma curva de calibração para determinar o teor de aciclovir no plasma dos “wistar rats”.
Fotografia 1: Cromatógrafo Líquido de Alta Resolução (CLAE) TSP com detector UV-vis. Fonte: UPM – Mackenzie
Para a determinação da curva de concentração de aciclovir no plasma, fez-se um gráfico em função do tempo de administração nos “wistar rats”.
3.2.3 Método de preparo e análise por CLAE, para ensaios “in vivo”.
A análise por Cromatografia Líquida de Alta Eficiência(CLAE), ocupa uma grande gama de fármacos, por ter uma seleção de métodos nas Farmacopeias Brasileiras e Europeias e é utilizado com freqüência em ensaios de validação farmacêutica, possui boa robustez, sensibilidade e é utilizado para análise de instabilidade de materiais.
A Cromatografia Líquida de Alta Eficiência (CLAE), como um método de comparação, tem sido aplicado à determinação quantitativa de analitos nas amostras. A aplicação da metodologia Cromatografia Líquida de Alta Eficiência clássica, consiste no uso de cromatogramas obtidos de um único comprimento de onda. A fase estacionária consiste em um meio, sólido adsorvente empacotado em uma coluna de metal do tipo inoxidável, com diâmetros e comprimentos diferentes e a fase móvel consiste em solventes aquosos, para a formação de um gradiente de separação, podendo ser isocrático, onde este eluente é bombeado por meio de uma bomba unitária, binária ou quaternária, no caso para fármacos, a melhor é a quaternária pela formação do gradiente e eficiência alta, pressurizada, fornecendo uma vazão de fase móvel adequada para a análise (LANÇAS, 2006).
Os experimentos foram feitos no Laboratório do Mackenzie, com os equipamentos iniciais de preparo e dissolutor no laboratório de química. O Cromatógrafo utilizado foi da marca Thermo Separation Products (TSP) com software acoplado, no estilo robótico com amostrador automático para melhor repetibilidade, com fase reversa C-18 (nano octadecilsiloxano) da marca NST (Nano Separation Technologies) de 25 cm, 0,5 nm e detector UV vis de duplo feixe.
30
do aciclovir foi de 7,5 min com pico simétrico, para fluxo isocrático (STULZER, et al. 2007).
4. RESULTADOS E DISCUSSÕES
Difratograma 1. Difratograma de raios X da pseudoboemita
A análise térmica diferencial-DTA e termogravimétrica-TG (Termograma 1) mostraram que o material apresentou uma perda de massa em torno de 100 º C em razão da água adsorvida e uma perda de massa em torno de 438 º C de acordo com a DTG (Termograma 2) devido a transformação de fase de pseudoboemita em gamma alumina. Ainda de acordo com o Termograma 1, observou-se em torno de 1200º C a última transformação de fase da alumina com a formação da fase alpha alumina.
32
4.1 CURVA DE CALIBRAÇÃO DO ACICLOVIR
A curva de calibração foi obtida em função da área do pico para as seguintes concentrações: 1,0 g.L-1, 2,0 g.L-1, 3,0 g.L-1, 4,0 g.L-1 e 5,0 g.L-1 . Também foram obtidos os respectivos tempo de retenção, tr0.
No Cromatograma 2 são apresentados os resultados das análises de aciclovir utilizados para a confecção da curva de calibração do teor de aciclovir.
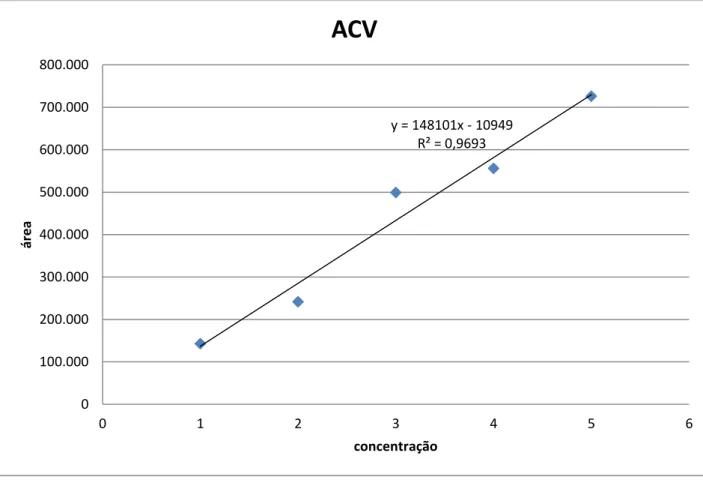
No gráfico 2 são mostrados os resultados dos teores de aciclovir para a confecção da curva de calibração e apresentados na Tabela 4. No Gráfico 2 observou-se que foi obtida uma linearidade 0,96 dos dados experimentais.
Cromatograma 2: Relação dos cromatogramas identificados nas devidas concentrações de 1,0, 2,0, 3,0, 4,0 e 5,0 g.L-1 de aciclovir com as respectivas áreas dos picos.
34
Tabela 2. Concentração do aciclovir x área do pico dado. Resultados das análises por Cromatografia Líquida de Alta Eficiência (CLAE).
Concentração de aciclovir (g.L-1). Área do pico (unidades)
1 142.965
2 241.796
3 499.521
4 556.234
5 726.250
A linearidade obtida da curva de concentração para análises de aciclovir foi de 0,96.
Gráfico 2. Curva de calibração de aciclovir na concentração em função da área do pico.
y = 148101x - 10949 R² = 0,9693
0 100.000 200.000 300.000 400.000 500.000 600.000 700.000 800.000
0 1 2 3 4 5 6
ár
e
a
4.2 RESULTADOS DAS ANÁLISES DE ACICLOVIR NO PLASMA DOS RATOS.
Foram obtidos os resultados para análise de aciclovir utilizando a técnica de CLAE com e sem a peseudoboemita.
No cromatograma 3 está indicando a concentração padrão do aciclovir no plasma dos ratos após 1 hora de injeção
Cromatograma 3: concentração de aciclovir padrão após 1 hora, injeção 1. Tr0: 6,891.
A partir das análises do soro sanguíneo foram determinadas as concentrações de aciclovir no plasma dos ratos analisados, para os ratos que foram administrados por gavagem aciclovir com e sem o excipiente pseudoboemita.
36
Cromatograma 4: Resultado da concentração de aciclovir no plasma sanguíneo da amostra de sangue do rato 5 após 2 horas de gavagem no dia 23/06/2015.
Cromatograma 5 Concentração de aciclovir no plasma sanguíneo da amostra de sangue do rato 5 após 3 Horas de gavagem no dia 23/06/2015
No cromatograma 5 são apresentados os resultados ensaio de aciclovir com pseudoboemita em ratos por análise do plasma sanguíneo após tempo de gavagem de 3 horas
No mesmo campo amostral demonstrou-se áreas muito próximas, desvio padrão de 0,7 % em unidade de área a 4 mg. L-1 , comparando com esses dados determinou-se o campo amostral entre padrões e as amostras de soro e plasma sanguíneo. Nos ensaios em plasma sanguíneo houve uma dificuldade na detecção pela quantidade de matéria orgânica presente no sangue, 80% de orgânico e biológico.
Alguns picos sobrepostos e entupimentos atrapalharam as resoluções, pois não é um ensaio indicado para sangue concentrado pelo método de Cromatografia Líquida de Alta Eficiência (CLAE), houve um grau elevado de dificuldade na análise. Neste caso utilizou-se filtros porosos e diluições para avaliação dos resultados.
4.3 LIMITE DE DETECÇÃO E QUANTIFICAÇÃO
Na Tabela 3 estão representados os resultados a partir da determinação em CLAE e o tempo do padrão de comparação nas proximidades do campo amostral do aciclovir, com concentração de 4 mg. L-1.
No cromatograma 6 são mostrados o tempo de retenção igual a 7,119 próximo ao campo amostral das amostras de soro e plasma sanguíneo.
Cromatograma 6:. Limite de Quantificação próximo ao campo amostral, concentração 4 mg.L-1
38
Tabela 3: Concentração de ACV em plasma sanguíneo em mg/l-1, ensaios (17/06/2015).
Ensaios Horas Concentração T. ret. ACV Diluição
rato 1(ACV) 1 5,400 7,000 1:1
rato 3(ACV) 2 4,125 6,795 1:1
rato 4(ACV) 3 4,000 7,188 1:1
rato 1(ACV+PSEU) 1 2,780 7,674 1:1
rato 2(ACV+PSEU) 2 1,920 6,210 1:1
rato 5(ACV+PSEU) 3 1,215 6,213 1:1
No gráfico 3, apresenta-se a curva de concentração em relação ao tempo de gavagem do ACV e a liberação controlada do fármaco. Observa-se que para os casos em que a gavagem foi realizada com pseudoboemita o teor de aciclovir no plasma sanguíneo é menor.
Gráfico 3: Concentrações de ACV em plasma sanguíneo (pontos azuis: gavagem com aciclovir e água; pontos laranjas: gavagem com acicolvir e pseudoboemita).
Na tabela 4, as concentrações de aciclovir para gavagem com pseudoboemita iniciaram com 5,84 mg.L-1 e finalizaram com 2,24 mg. L-1, monstrando
0 1 2 3 4 5 6
0 0,5 1 1,5 2 2,5 3 3,5
que o tempo de adsorção no plasma sanguíneo com pseudoboemita mais eficaz. Com os dados da Tabela 4 foi obtido o Gráfico 4.
Tabela 4: Concentração de aciclovir em soro sanguíneo em mgL-1, ensaios realizados dia 22/06/2015
Ensaios Horas Concentração T. ret. ACV diluição
Rato 1(ACV) 1 5,380 6,943 1:1
Rato 2(ACV) 2 5,360 6,790 1:1
Rato 3(ACV) 3 4,140 6,213 1:1
Rato 4(ACV+PSEU) 1 5,840 6,989 1:1
Rato 5(ACV+PSEU) 2 4,480 7,000 1:1
Rato 6(ACV+PSEU) 3 2,240 6,948 1:1
No Gráfico 4, obtido a partir dos dados da Tabela 4, apresenta-se a curva de concentração em relação ao tempo de gavagem do ACV e a liberação controlada do fármaco.
Gráfico 4: Concentração de aciclovir em relação ao tempo de gavagem no plasma (pontos azuis: gavagem com aciclovir e água; pontos laranjas: gavagem com acicolvir e pseudoboemita).
0 1 2 3 4 5 6 7
0 0,5 1 1,5 2 2,5 3 3,5
40
Na tabela 5 analisados o soro preparado com perclórico, aciclovir e pseudoboemita com aciclovir demonstraram maior liberação pela maior absorção.
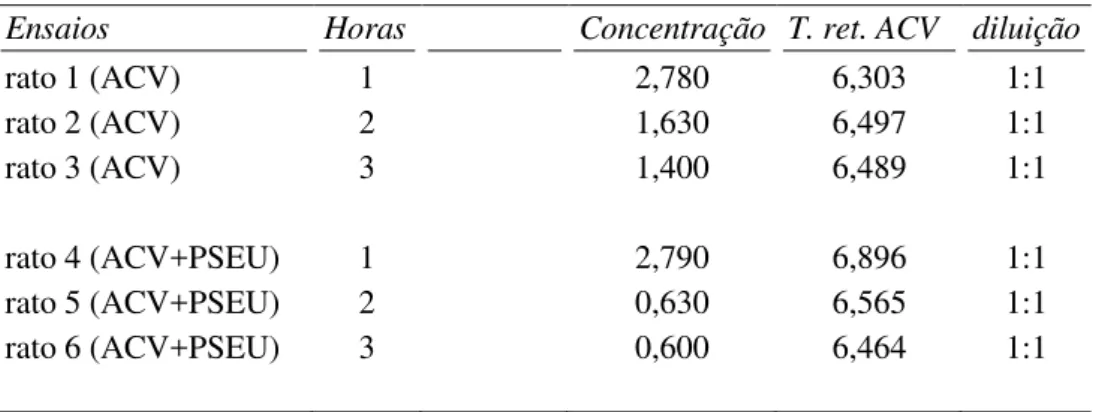
Tabela 5: Concentração do ACV em soro sanguíneo com preparo de ácido Perclórico após centrifugação na data 06/07/2015.
Ensaios Horas Concentração T. ret. ACV diluição
rato 1 (ACV) 1 2,780 6,303 1:1
rato 2 (ACV) 2 1,630 6,497 1:1
rato 3 (ACV) 3 1,400 6,489 1:1
rato 4 (ACV+PSEU) 1 2,790 6,896 1:1
rato 5 (ACV+PSEU) 2 0,630 6,565 1:1
rato 6 (ACV+PSEU) 3 0,600 6,464 1:1
No grafico 5 apresenta-se a concentração em relação ao tempo em horas de gavagem do aciclovir e aciclovir com a pseudoboemita (dados da Tabela 5).
.
Cabe observar que as concentrações de aciclovir no plasma dos diferentes grupos de wistar rats para um mesmo intervalo de tempo não são iguais.
Os ratos dos diferentes grupos possuem idades diferentes e portanto metabolismo diferente segundo Andreollo e colaboradores (2012), na idade adulta a cada mês do animal é equivalente a 2,5 anos humanos. Assim sendo uma diferença de alguns meses na idade dos ratos significa uma grande diferença de idade e consequentemente de metabolismo.
0 0,5 1 1,5 2 2,5 3
0 0,5 1 1,5 2 2,5 3 3,5
con
ce
n
tra
ção
d
e a
ci
cl
ov
ir
(m
g/L)
42
5. CONCLUSÕES
O método de cromatografia líquida de alta eficiência mostrou-se adequado para quantificar o teor de aciclovir nas concentrações estudadas. A curva de calibração de teor de aciclovir em função da área do cromatograma mostrou uma linearidade com coeficiente de correlação de 0,96.
A análise de aciclovir no soro dos “wistar rats” embora tenha apresentado um grande número de picos permitiu a quantificação de aciclovir em função do tempo de retenção observado em torno de 7 minutos.
Nos ensaios “in vivo”, concluiu-se que, a concentração do fármaco aciclovir com o excipiente pseudoboemita mostrou uma concentração menor do fármaco no plasma dos “ wistar rats”. Tal fato sugere que a presença de pseudoboemita tenha promovido a melhor adsorção do aciclovir pelos ratos reduzindo a concentração do aciclovir no plasma sanguíneo.
6 REFERÊNCIAS BIBLIOGRÁFICAS
ALMEIDA FILHO, C. et al Síntese de alumina ativada via sol-gel. In: 43º
CONGRESSO BRASILEIRO DE CERÂMICA, Florianópolis-SC, 1999. Anais... São Paulo:ABC, 1999, p.24-901-13-10.
AMIDON, G.L; LENNERNAS, H; SHAH, V.P.; CRISON, J.R. A theoretical basis for a biopharmaceutical drug classification: the correlation of in vitro drug product
dissolution: the correlation of in vitrodrug product dissolution and “in vivo”
biovailability. Pharmaceutical research, v.12, p. 413-420, 1995.
ANDREOLLO, N.A.; SANTOS, E.F.; ARAÚJO, M.R.; LOPES, L.R. Idade dos ratos versus idade humana: Qual é a relação? ABCD Arq. Bras. Cir. Dig. 2012; 25(1); 49-51.
ANVISA – AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA
(http://portal.anvisa.gov.br/wps/portal/anvisa/home), acesso em 14/novembro/1998.
44
AGÊNCIA NACIONAL DE VIGILANCIA SANITÁRIA (ANVISA). Guia para a condução de estudos não clínicos de segurança necessárias aos desenvolvimentos de medicamentos. Agência Nacional de Vigilância Sanitária, Brasil, mar. 2010. Disponível em ‹http://www.anvisa.gov.br›. Acessado em 21 jan. 2012.
ANVISA. Glossário de Denominações Comuns Brasileiras da ANVISA. Disponível em ‹http://www.anvisa.gov.br/medicamentos/dcb/glossário.pdf›. Acessado em 25 jan. 2012. Forma farmacêutica e apresentações do aciclovir. Disponível em ‹http://www. ANVISA.gov.br/base/visadoc/bm/BM[25871-1-0]. pdf›. Acessado em 5 nov. 2012. ANVISA - GUIA PARA A CONDUÇÃO DE ESTUDOS NÃO CLÍNICOS DE SEGURANÇA NECESSÁRIOS AO DESENVOLVIMENTO DE MEDICAMENTOS, ANVISA, 2010.
CALLISTER JÚNIOR, W. D. Ciências e Engenharia de Materiais: uma Introdução. Rio de Janeiro: Ed. LTC, 2008.
CEUA, ( N ). Comissão de Ética no uso de Animais 120/11/2014
CHEREMISINOFF, P.N.; ELLERBUSSCH, F. Carbon Adsorption Hand Book, Ann Arbor Sci. Publ. Michigan, 1978
COELHO, V. C. A Avaliação Crítica de Pesquisas Realizadas no Laboratório de Matérias-Primas Particuladas e Sólidos Não-Metálicos (LMPSol) sobre Hidróxidos e Óxidos de Alumínio, Ano de obtenção: 2008
COUVREUR, P.; VAUTHIER, C. Nanotecchnology: Intelligent Design to Treat Complex Diesease. Pharmaceutical Research, v. 23, n. 7,p.1417-1450, jul. 2006.
CUNHA, L. C.; AZEREDO, F.S.; MENDONÇA, A. C. V.; VIERIRA, M. S.; PUCCI, L. L.; VALADARES, M. C.; FREITAS, H. O. G.; LINO JUNIOR, R. S. Avaliação da
toxicidade aguda e subaguda, em ratos, do extrato etanólico das folhas e do látex de
Synadenium umbellatum Pax. Rev. Bras. Farm., n.19, v. 2A, p. 403-411, 2009.
‹http://www.drugdeliverytech-online.com/drugdelivery/2000709/?pg60›. Acessado em: 20 mai. 2012.
ELION, G.B. Mechanism of action and selectivity of acyclovir Am J Med. 1982 Jul 20;73(1A):7-13
KLOPROGGE, J. T.; DUONG, L. V., WOOD, J. B.; FROST, R. L. XPS study of the major minerals in bauxite: gibbsite, bayrite and (pseudo-) boehmite, v. 296, p. 572-576, 2006.
KULKAMP, I.C. As características do princípio ativo. Universidade Federal de Santa Catarina, Florianópolis, 2003
LANÇAS, F.M., OLIVARES, I., Gestão de Qualidade em Laboratórios, Editora Átomo, 2006;
LEE, T.; LIN, S. Microspectroscopic FT-IR mapping system as a tool to assess blend homogeneity of drug–excipient mixtures, European Journal of Pharmaceutical Sciences, Volume 23, Issue 2, October 2004, Pages 117–122.
LIRA, L. M. Avaliação de Sistemas Nanoparticulados baseados em bentonita sódia purificada como incrementadores de dissolução em comprimidos preparadospor
granulação úmida e compressão direta. Dissertação (Mestrado em Ciência