KAMILLE DALECK SPERA
AVALIAÇÃO DA ATIVIDADE ANTIOXIDANTE, FOTOPROTETORA
E ANTIGLICAÇÃO DOS EXTRATOS DE FOLHAS E FRUTOS DE
ESPÉCIES DA FAMÍLIA ANNONACEAE
KAMILLE DALECK SPERA
AVALIAÇÃO DA ATIVIDADE ANTIOXIDANTE, FOTOPROTETORA
E ANTIGLICAÇÃO DOS EXTRATOS DE FOLHAS E FRUTOS DE
ESPÉCIES DA FAMÍLIA ANNONACEAE
Dissertação apresentada à Faculdade de Ciências e Letras de Assis – UNESP – Universidade Estadual Paulista para a obtenção do título de mestre em Biociências (Área de conhecimento: Caracterização e Aplicação da Diversidade Biológica)
Orientador(a): Profº Drº Regildo Márcio Gonçalves da Silva
AGRADECIMENTOS
A Deus por me amparar nos momentos difíceis, me dar força interior para superar as dificuldades e clarear os caminhos.
Ao meu orientador Profº Drº Regildo Marcio Gonçalves da Silva, que desde o primeiro contato demonstrou confiança no meu trabalho, e com a sua dedicação e segurança, fez do nosso laboratório, nossa segunda casa.
Aos meus amigos de mestrado Pamela, Gustavo, Vanessa e Larissa, por estarmos juntos desde o primeiro momento, dividindo as angústias e alegrias, e principalmente as dúvidas e descobertas, especialmente à Patrícia Aparecida Figueiredo, por não medir esforços em compartilhar seus conhecimentos; minhas realizações são compostas por um pouco de cada um deles.
Ao pessoal do Fitolab, Valter, Gustavo Martins, Aníbal, Amábile, por ajudar sempre que possível e pela amizade durante a realização dos trabalhos.
Ao Profº Drº Rondinelli Donizetti Herculano, do Departamento de Ciências Biológicas da Faculdade de Ciências e Letras da UNESP de Assis pela liberação do seu laboratório para utilização sempre que necessário.
À Profª Drª Wilma Aparecida Spinosa, do Laboratório de Análise de Alimentos do DCTA e a Universidade Estadual de Londrina, pela disponibilidade da utilização do espectrofluorímetro.
Ao Profº Drº Vitório dos Santos Junior, Profº Drº André de Oliveira Dorini e Profª Drª Lucineia dos Santos que durante a graduação, foram os primeiros a me mostrar que a certeza do sucesso profissional e acadêmico se dá com esforço e dedicação, e me dedicaram sua ajuda sempre que possível.
Aos funcionários e pesquisadores da Floresta Estadual de Assis, pelo auxílio nas coletas, em especial a Dr. Elaine Akiko Honda, pela orientação, e por permitir que eu, acompanhando o seu trabalho sempre muito dedicada dentro da pesquisa, decidisse seguir pela carreira acadêmica.
Aos meus pais Julio e Katia, e ao meu irmão Allain, que são a minha razão, todos os meus passos dados, são por eles, e todas minhas conquistas são deles. Porque “enquanto houver vocês do outro lado, aqui do outro, eu consigo me orientar”.
Aos meus amigos, que durante esses dois anos sempre estiveram do meu lado, com paciência, ouviram muitas vezes ‘não’, suportaram minha angústia, sempre tentando tirar um sorriso do meu rosto, aos que restaram firmes e fortes comigo nessa caminhada, meu muito obrigada.
Spera, Kamille Daleck; Silva, Regildo Márcio Gonçalves. AVALIAÇÃO DA ATIVIDADE ANTIOXIDANTE, FOTOPROTETORA E ANTIGLICAÇÃO DOS EXTRATOS DE FOLHAS E FRUTOS DE ESPÉCIES DA FAMÍLIA ANNONACEAE. 2014. 55f. Dissertação (Mestrado em Biociências). – Faculdade de Ciências e Letras, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Assis, 2014.
RESUMO
O efeito oxidante provocado por radicais livres provenientes do metabolismo do O2, ocorre naturalmente no organismo. O estresse oxidativo, aumento dessa condição, está correlacionado ao aparecimento de doenças, e pode ser intensificado devido à exposição a fatores externos, como a radiação solar, causando assim danos celulares significativos, que podem levar ao envelhecimento acelerado das células. Estudos com extratos vegetais têm demonstrado que os mesmos contêm compostos de interesse farmacológico para tratar e/ou prevenir os danos celulares causados pelo estresse oxidativo, resultando em uma ação fotoprotetora e antiglicante. Entre as espécies vegetais, a família Annonaceae possui representantes que apresentam compostos bioativos com diferentes atividades farmacológicas, tornando-as importantes para a análise de sua capacidade antioxidante e a relação com o potencial fotoprotetor e antiglicante. Partindo desse pressuposto, este estudo tem por objetivo avaliar o potencial antioxidante, fotoprotetor e antiglicante com ensaios in vitro, além de
quantificar fenóis e flavonoides totais presentes nas amostras, e também realizar a caracterização por cromatografia de camada delgada para flavonoides, terpenoides e alcaloides dos extratos. Os resultados obtidos mostraram que A. crassiflora e A. cacans
apresentaram os melhores valores na maioria dos testes de avaliação da capacidade antioxidante e entre os tipos de extratos avaliados, bem como para potencial fotoprotetor. O extrato da folha de A. crassiflora apresentou os melhores resultados para teste antiglicação,
bem como para quantificação de fenóis. Dentre as polpas A. muricata que obteve o melhor
resultado antiglicação. Para flavonoides tanto na quantificação, quanto na CCD, os melhores resultados foram encontrados na folha de A. squamosa e na polpa de A. cacans.
Spera, Kamille Daleck; Silva, Regildo Márcio Gonçalves. EVALUATION OF ANTIOXIDANT, PHOTOPROTECTIVE AND ANTIGLYCATION ACTIVITY OF LEAFS AND FRUITS EXTRACTS IN SPECIES OF THE ANNONACEAE FAMILY. 2014. 55f. Dissertation (Master in Bioscience). – Faculdade de Ciências e Letras, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Assis, 2014.
ABSTRACT
The oxidative effect caused by free radicals derived from O2 metabolism occurs naturally in the human body. The oxidative stress, the increase of this condition, is correlated with the disease's appearance and can be intensified by the exposure of extern factors, like solar radiation, thus causing significant cellular damage and also may cause faster aging of cells. Researches with plant extracts have shown that they may have compounds with pharmacological interesting to healing and/or preventing cellular damages caused by oxidative stress, those may results a photoprotective and antiglicant activity. Among the plant species, the Annonaceae family has representatives that contain bioactive compounds with different pharmacological activities, making them important to the study of antioxidative capacity and its relation with photoprotective and antiglicant potential. Then, this project is designed to measure the oxidative, photoprotective and antiglicant potential in in vitro assays, and also to quantify the total phenols, flavonoids and condensed tannins in the samples. Another target is also to characterize by phytochemistry the extracts with higher antioxidant activity. The results showed that A. crassiflora and A. cacans are best in most tests of
antioxidant capacity and between types of extracts evaluated, as well as potential sunscreen. The leaf extract of A. crassiflora showed the best results for anti-glycation test, as well as
quantification of phenols. Among the pulps A. muricata we got the best anti-glycation result.
To quantify both the flavonoids, as in CCD, the best results were found in the leaf of A. cacans, and in the pulp of A. squamosa.
SUMÁRIO
INTRODUÇÃO GERAL ... 8
REFERÊNCIAS ... 16
Capítulo 1 - Atividade antioxidante e fotoprotetora de espécies de Annonaceae 1 Introdução ... 24
2 Materiais e métodos ... 25
3 Resultados e discussão... 27
4 Conclusões ... 33
Capítulo 2 – Potencial antiglicante de extratos de espécies da família Annonaceae. 1 Introdução ... 38
2 Materiais e métodos ... 39
3 Resultados e discussão... 42
4 Conclusões ... 51
1. INTRODUÇÃO GERAL
1.1 Estresse oxidativo e antioxidantes
A oxidação é um processo metabólico que leva à produção de energia necessária para
as atividades celulares (ROESLER et al., 2007), entretanto, o metabolismo do oxigênio nas
células vivas também desencadeia a produção de radicais livres (POURMORAD et al., 2006;
NAGMOTI et al., 2012), que se não for controlada pode causar danos ao organismo
(ROESLER et al., 2007).
Em sistemas biológicos existe um equilíbrio entre os fatores que promovem a
oxidação e os mecanismos de defesa antioxidantes (GONÇALVES, 2008). Porém, o acúmulo
desses radicais, chamado estresse oxidativo, tem sido associado ao desenvolvimento de
doenças crônicas e degenerativas, incluindo o câncer, doenças cardíacas e Alzheimer (AMES
et al., 1993, 1995; DIAZ, 1997; LANG e LOZANO,1998; CHRISTEN, 2000).
Os antioxidantes são enzimas ou substâncias orgânicas capazes de agir contra os danos
da oxidação (GONÇALVES, 2008; NIKI, 2010). Os mecanismos de ação antioxidante
incluem: suprimir a formação de espécies reativas de oxigênio, ou pela inibição enzimática ou
por quelar elementos envolvidos na produção de radicais livres; eliminar espécies reativas de
oxigênio, ou apenas manter o mecanismo de defesa antioxidante regulado e protegido
(HALLIWELL e GUTTERIDGE, 1998; ANDALLU et al., 2014).
1.2 Atividade fotoprotetora
O estresse oxidativo pode afetar o DNA em consequência da exposição à radiação
ultravioleta (UV) (SHAAL et al., 2011) pois induz a formação de espécies reativas de
oxigênio (ROS), incluindo peróxido de hidrogênio e radicais superóxido, proteínas e
membranas celulares. Esse estresse é considerado a essência da mutagênese por radiação
UVA, porém, pode ser causado também por UVB e luz visível(DAR e FRIDOVICH, 1994;
Como consequência deste processo ocorre um aumento na síntese de melanina e da
peroxidação lipídica da célula. Além de iniciar a ativação de matrizes metaloproteinases
(MMP) e a liberação de citocinas pró-inflamatórias, esse aumento altera o colágeno e a
elastina presente na matriz extracelular, o que culmina na degradação da integridade estrutural
da pele (KULLAVANIJAYA e LIM, 2005; CHEN et al., 2012; JANSEN et al., 2013).
A radiação proveniente da luz solar é dividida em UVC (270-290nm), que não atinge a
superfície da Terra, pois é filtrada pela camada de ozônio, UVB (290-320nm) e UVA,
subdividida em UVA1 (340-400nm) e UVA2 (320-340nm) (KULLAVANIJAYA e LIM,
2005). Os filtros solares são substâncias com capacidade de refletir e/ou absorver as radiações
ultravioletas que atingem a pele, podendo ser químicos, físicos ou de origem natural
(VIOLANTE et al., 2008). Há uma necessidade crescente da utilização desses compostos
como com capacidade de filtrar e proteger contra os danos provocados por esta exposição.
1.3 Envelhecimento e a formação de AGES
A pele expressa de forma visível a ação de fatores intrínsecos e/ou extrínsecos. Os
fatores extrínsecos são os estímulos ambientais ou aqueles introduzidos pelo próprio
indivíduo, entre eles, a exposição à radiação (PEREIRA, 2008; LANDAU, 2007). Já o
envelhecimento intrínseco da pele, é o resultado de alterações biomoleculares no decorrer da
vida biológica do indivíduo, como exemplo, o dano às fibras colágenas (MONTAGNER e
COSTA, 2009).
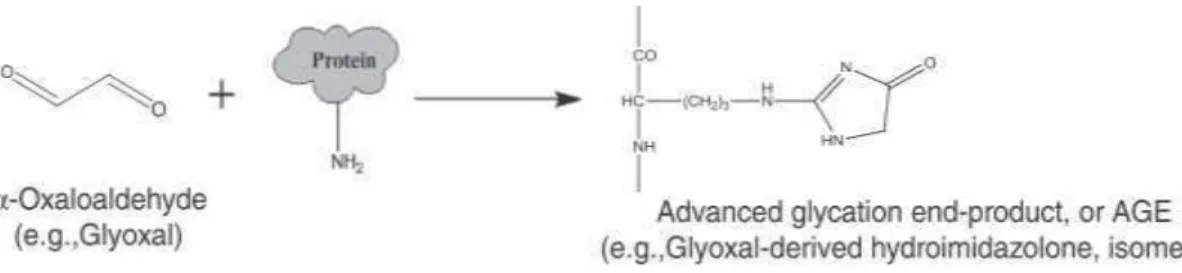
A glicação ocorre com a adição enzimática de açúcares redutores e/ou seus produtos
degradados reativos em grupos de proteínas (MAILLARD, 1912; THORNALLEY et al.,
1999). É composta por dois diferentes estágios: no primeiro, o grupo amino da proteína reage
com o grupo aldeído do açúcar fisiológico para iniciar a formação da base Schiff, que, com o
tempo, é rearranjado, e forma os chamados produtos Amadori (HO et al., 2010). O segundo
produtos Amadori em dicarbonil intermediários reativos, como metilglioxal (MGO) (HO et
al., 2010).
FIGURA 1. Representação do primeiro estágio de glicação (ANGUIZOLA et al., 2013).
FIGURA 2. Representação do estágio avançado de glicação (ANGUIZOLA et al., 2013).
Os AGES causam modificações nos sítios de adesão celular (REKHTER, 1999), e
essas alterações envolvendo aminoácidos provocam mudanças no perfil de distribuição de
carga e nas interações dependentes de ligações eletrostáticas, como a fibrinogênese do
colágeno (PROCKOP e FERTALA, 1998). Essas modificações químicas e estruturais, sendo
reações com as cadeias laterais dos aminoácidos arginina, lisina e o aspartato, presentes no
colágeno tipo I, e resultam na redução da renovação das células, promovendo e/ou acelerando
o processo de envelhecimento (CHAPMAM et al., 1990; REISER et al., 1992).
Compostos bioativos provenientes de vegetais, podem auxiliar na prevenção e
tratamento de doenças degenerativas, principalmente às correlacionadas com o
antioxidante, fotoprotetora e antiglicante (BOUSOVA et al., 2005; LUNCEFORD e
GUGLIUCCI, 2005).
O envelhecimento é um processo natural e inevitável de todos os seres vivos. As
pesquisas podem contribuir significativamente com a descoberta de novos compostos ativos
capazes de minimizar ou retardar este processo natural (COSTA el al., 2012), principalmente
quando o mesmo é acelerado e/ou agravado por fatores extrínsecos.
1.4 Compostos naturais bioativos
Extratos vegetais podem ser considerados antioxidantes naturais (ANDALLU et al.,
2014), e possuem aplicabilidade principalmente devido ao potencial antioxidante
proporcionado pelos flavonoides (ROSA et al., 2008; ZAID et al., 2009), e sua capacidade de
sequestrar radicais livres, atuando como doadores de hidrogênio, e quelante de metais
(RICE-EVANS et al., 1996; GONZALO e ALONSO, 2002). Os flavonoides agem como protetores
de células vegetais por sequestrar espécies reativas de oxigênio produzidas pela radiação UV
necessária à fotossíntese (PIETTA, 2000).
Outros compostos naturais que possuem atividade antioxidante incluem a classe de
fenóis, ácidos fenólicos e seus derivados, tocoferóis, fosfolipídios e esteróis (ROESLER,
2007). Compostos com capacidade antioxidante, como polifenóis, tem sua ação fotoprotetora
comprovada em análises fisiológicas (KIM e KIM, 2003; RUDNICKI et al., 2007; HUANG
et al., 2008);
A analogia entre princípios ativos naturais e fotoprotetores sintéticos, apontando uma
possível ação de filtro solar, foi comprovada, e partindo desse pressuposto, Violante et al.
(2008) propuseram que os mesmos podem agir em sinergismo com filtros solares sintéticos,
DNA, que além do fotoenvelhecimento, podem desenvolver potencial cancerígeno ((RAMOS
et al., 1996; WULF et al., 2004).
Compostos vegetais também apresentam propriedades antioxidantes e
hipoglicemiantes, no qual pode estar baseado sua atividade antiglicante (HSIEH et al., 2005,
2007). As investigações de compostos naturais, principalmente de origem vegetal, já
consagrados na literatura científica pelo seu potencial terapêutico, podem auxiliar
significativamente nesse processo, fornecendo meios de evitar o envelhecimento precoce e/ou
minimizar os danos provocados pela idade, além da possível descoberta de novos compostos
antioxidantes e fotoprotetores (ROESLER et al., 2007).
1.5 Annonaceae
A família Annonaceae é uma família pantropical de árvores, arbustos e lianas, que
desempenham um papel ecológico importante em termos de diversidade de espécies,
principalmente em ecossistemas de floresta tropical (COUVREUR et al., 2012). Até o
momento são validamente descritos e reconhecidos cerca de 130 gêneros e mais de 2000
espécies (JOLY, 1979; LORENZI e MATOS, 2002), sendo o gênero Annona um dos mais
representativos (NUNES et al., 2012). No Brasil ocorrem 29 gêneros (sendo um endêmico) e
cerca de 386 espécies, distribuídos predominantemente na Amazônia, e secundariamente na
Mata Atlântica (LOBÃO et al., 2005).
Economicamente a família é de importância considerável, como fonte de frutos
comestíveis (LEBOUEF et al., 1982) sendo as mais exploradas Annona muricata L.
(graviola), Annona squamosa Delile (fruta-do-conde), Annona reticulata Sieber ex A.DC.
(condessa), Annona crassiflora Mart. (marolo), e o híbrido atemoia (A. cherimola x A.
squamosa) (TELLES et al., 2003), devido às propriedades nutricionais dos frutos que são
consumidos in natura, e ao fato de apresentarem como característica, sabor adocicado e
silvestres dessa família, como por exemplo, a espécie nativa do cerrado Annona cacans
Warm., que apesar de não serem consideradas de importância relevante ao mercado são bem
conhecidas em comunidades locais.
Cerca de 320 produtos naturais secundários provenientes de 150 espécies pertencentes
a 41 gêneros foram catalogados (LEBOUEF et al., 1982). Na formação da biodiversidade de
substâncias químicas das Annonaceae estão: substâncias aromáticas, ácidos fenólicos, taninos,
flavonoides, substâncias benzênicas, catequinas, proantocianidinas, óleos essenciais, terpenos,
esteroides, carboidratos, lipídios, proteínas, lactonas, vitaminas, carotenos, saponinas, entre
outros (LUNA, 2006; LIMA, 2007; REIS, 2011).
Flavonoides encontrados no gênero Annona foram flavonas (luteonina) e flavonóis
(canferol, quercetina, ramnetina, rutina e isorramnetina) (RINALDI, 2007). Na China,
algumas Annonaceaes são amplamente cultivadas e utilizadas como inseticidas e parasiticidas
(CHEN et al., 2004). Existem comprovadas atividades anti-helmíntica, antimalárica,
antimicrobiana, antiprotozoária, pesticida e antioxidante devido às acetogeninas (ALALI et
al., 1999; JULIÁN-LOAEZA et al., 2010).
Estudos farmacológicos utilizando espécies de annonáceas se intensificaram, em
grande parte, devido à descoberta das acetogeninas, classe de compostos naturais com grande
variedade de atividades biológicas (RUPPRECHT et al., 1990). Foi detectada citoxicidade
seletiva das acetogeninas especificamente em células cancerosas (WU, 2006), e caracterizadas
como promissoras no potencial leishmanicida (NOVA, 2008). As acetogeninas atuam como
potentes inibidoras da respiração mitocondrial e, interferindo na produção de ATP induzem a
apoptose (ZENG et al., 1996, YANG et al., 2009).
1.5.1 Annona muricata
A. muricata, ou graviola, tem sua importância principalmente devido a diversos
água, e açúcares, sendo cerca de 67,2-69,9% de sólidos totais presentes (SÁNCHEZ-NIEVA,
1970), além de vitaminas, pectina, potássio, sódio, cloreto de cálcio e citrato (BADRIE e
SCHAUSS, 2009).
Devido ao sabor adocicado, é amplamente comercializada na forma de sucos (AWAN
et al., 1990). A. muricata demonstrou atividade farmacológica em suas diferentes partes
(SÓLIS-FUENTES et al., 2011); a decocção das folhas é utilizada para matar piolhos e
percevejos; o chá, é bem conhecido por ter propriedades sedativas; a polpa utilizada como
antiespasmódico, emético, e sudorífico, e o suco da fruta, administrado por via oral para
hematúria, problemas no fígado e uretrite (PADMA et al., 1997, 2001).
1.5.2 Annona squamosa
Popularmente conhecida como fruta-do-conde, não é nativa brasileira e sim, das ilhas
do Caribe, onde era chamada de “anón” pelos espanhois que se encantaram com a sua polpa
no século XVI (BRITO et al., 2008), devido ao fato de apresentar aroma agradável e doce, o
que a tornou atrativa para a industrialização e apropriada para elaboração de bebidas
fermentadas, além de muito aceita na fabricação de sorvetes (KAVATI et al., 1997). Alguns
trabalhos relatam que na polpa da fruta e sementes há a presença de açucares, ácidos
orgânicos e ácido ascórbico, sendo a maioria dos compostos monoterpenos e sesquiterpenos
(ANDRADE et al., 2001). Nas sementes, uma concentração muito alta de óleos voláteis foi
encontrada (ANSARI et al., 1985), identificados e isolados 6 componentes desses óleos com
comprovada atividade antimicrobiana (CHAVAN et al., 2006; RAHMAN et al., 2005).
1.5.3 Annona crassiflora
O Marolo (A. crassiflora) (Figura 3) apresenta grande apelo sensorial, tais como cor,
vitaminas do complexo B, como a tiamina (0,04mg/100g) e riboflavina (0,07mg/100g), bem
como ácido ascórbico (21mg/100g) e carotenoides (5,9µg/g) (AGOSTINI et al., 1995).
FIGURA 3. Frutos de A. crassiflora (SPERA, 2013)
Apesar destas características, o marolo fresco na fase maduro ainda é pouco
consumido, porém já comprovado que apresenta características físico-químicas adequadas
para a utilização como ingrediente alimentar nas preparações de sucos, doces e sorvetes,
promovendo a sua disponibilidade para uma parcela maior de pessoas (LAGE et al., 2014).
Além de ser conhecido pela riqueza em compostos antioxidantes, marolofornece fibras
alimentares, o que torna este fruto benéfico para a saúde (CORRÊA et al., 2011).
1.5.4 Annona cacans
Na alimentação humana, o fruto do araticum-cagão (Figura 4) não é muito apreciado
in natura, por ter efeito diarreico (SAITO et al., 1994). No entanto, são aromáticos, com polpa
doce e abundante (MATTOS, 1978). Os frutos são saborosos, mas a ação pode ser tão
drástica, que essa propriedade específica lhe ficou consagrada até na denominação popular
FIGURA 4. Frutos de A. cacans (SPERA, 2013)
2. OBJETIVO
O presente trabalho tem por objetivo avaliar o potencial antioxidante nos extratos da
polpa do fruto e folhas de Annona crassiflora M., Annona muricata L., Annona squamosa L.
e Annona cacans W. por meio dos testes DPPH, FRAP, (TBARS), e avaliar in vitro a
capacidade fotoprotetora, de acordo com análise espectrofotométrica Ainda é objetivo deste
trabalho, avaliar o potencial antiglicação pelos testes (BSA)/glicose e pelo teste de mobilidade
reativa de proteínas por eletroforese (MRE); realizar a quantificação de fenóis e flavonoides
totais, e a análise cromatográfica quanto à flavonoides, alcaloides e terpenoides dos extratos
que apresentarem melhores resultados.
3. REFERÊNCIAS
AGOSTINI, T. D.; CECCHI, H. M.; BARRERA, A. D. Chemical characterization of the oil and pulp of marolo (Annona coriaceae). Archivos Lationamericanos de Nutricíon, v. 45, p. 237-241, 1995.
ALALI, F. Q.; LIU, X.; MCLAUGHLIN, J. L. Annonaceous Acetogenins: Recent Progress. Journal of Natural Products, v. 62, n.3, p. 504-540, 1999.
AMES, B. N.; GOLD, L. S.; WILET, W. C. The causes and prevention of cancer. Proceedings of the National Academy of Sciences, v. 92, p. 5258-5265, 1995.
ANDALLU, B.; SHANKARAN, M.; ULLAGADDI, R.; IYER, S. In vitro free radical scavenging and
in vivo antioxidante potential of mulberry (Morus indica L.) leaves. Journal of Herbal Medicine, v.
4, p. 10-17, 2014.
ANDRADE, E. H. A.; ZOGHBI, M. D. G. B.; MAIA, G. S; FABRICIUS, H.; MARX, F.
Chemical characterization of the fruit of Annona squamosa L. occurring in the amazon. Journal of
Food Composition and Analysis, v. 14, n. 2, p. 227-232, 2001.
ANGUIZOLA, J.; MATSUDA, R.; BARNABY, O. S.; HOY, K. S.; XA, C.; DEBOLT, E., KOKE, M.; HAGE, D.S. Glycation of human serum albumin. Clinica Chimica Acta, v. 425, p. 64-79, 2013. ANSARI, M. H.; AFAQUE, S.; AHMAD, M. Isoricinoleic acid in Annona squamosa seed oil.
Journal of the American Oil Chemists’ Society, v. 62, n. 10, p. 1514, 1985.
AWAN, J. A.; KAR, A.; UDOUDOH, P. J. Preliminary studies on the seeds of Annona muricata Linn.
Plant Foods for Human Nutrition, v. 30, p. 163–168, 1980.
BADRIE, N.; SCHAUSS, A. G. Soursop (Annona muricata L.): Composition, Nutritional Value,
Medicinal Uses, and Toxicology In : WATSON, R. R.; PREEDY, V. R. (eds.). Bioactive Foods in Promoting Health. Academic Press, Oxford. p.621-643, 2009.
BAILEY, A. J.; PAUL, R. G.; KNOT, L. Mechanisms of maturation and ageing of collagen. Mechanisms of Ageing and Development, v. 106, n. 12, p. 1-56, 1998.
BOUSOVA, I.; MARTIN, J.; JAHODAR, L.; DUŠEK, J.; PALIČKA, V.; DRŠATA, J. Evaluation of
in vitro effects of natural substances of plant origin using a model of protein glycosylation. Journal of
Pharmaceutical and Biomedical Analysis, p. 937-957, 2005.
BRITO, H. O.; NORONHA, E. P.; FRANÇA, L. M.; BRITO, L. M. O.; PRADO, M. S. A. Análise da composição fitoquímica do extrato etanólico das folhas da Annona squamosa (ATA). Revista
Brasileira de Farmácia, v. 89, n. 3, p. 180-184, 2008.
BROWNLEE, M. Negative consequences of glycation. Metabolism, v. 49, n.1, p. 9–13, 2000.
CHAPMAN, J. A.; TZAPHLIDOU, M.; MEEK, K. M. The collagen fibril: a model system for studing the staining and fixation of a protein. Electron Microscope Review, Oxford, v. 3, n.1, p. 143-182, 1990.
CHAVAN, M. J.; SHINDE, D. B.; NIRMAL, S. A. Major volatile constituents of Annona squamosa
L. Natural Products Research, v. 8, p. 754-757, 2006.
CHEN, C. H.; HSIEH, T. J.; LIU, T. Z.; CHERN, C. L.; HSIEH, P. Y.; CHEN, C. Y. Annoglabayin, a novel dimeric kaurane diterpenoid, and apoptosis in Hep G2 cells of annomontacin from the fruits of
Annona glabra. Journal of Natural Products, n. 67, p. 1942-1946, 2004.
CHRISTEN, Y. Oxidative stress and Alzheimer’s disease. The American Journal of Clinical Nutrition, v. 71, n. 2, p. 621S-629S, 2000.
CORRÊA, S. C.; CLERICI, M. T. P. S.; GARCIA, J. S.; FERREIRA, E. B.; EBERLIN, M. N.; AZEVEDO, L. Evaluation of dehydrated marolo (Annona crassiflora) flour and carpels by
freeze-drying and convective hot-air freeze-drying. Food Research International, v. 44, p. 2385-2390, 2011.
COSTA, D. A.; OLIVEIRA, G. A. L.; SOUSA, D. P.; FREITAS, R. M. Avaliação do potencial antioxidante in vitro do compost ciano-carvona. Revista de Ciências Farmacêuticas Básica e Aplicada, v. 33, n. 4, p. 567-575, 2012.
COUVREUR, T. L. P.; MAAS, P. J. M.; MEINKE, S.; JOHNSON, D. M.; KESSLER, P. J. A. Keys to the genera of Annonaceae. Botanical Journal of the Linnean Society, v. 169, p. 74–83. 2012. DARR, D.; FRIDOVICH, I. Free radicals in cutaneous biology. Journal of Investigative Dermatology, v. 102, p. 671-675, 1994.
DIAZ, M. N.; FREI, B.; KEANEY, J. F. Jr. Antioxidants and atherosclerotic heart disease . The new England Journal of Medicine, v. 337, n. 6, p. 408-416, 1997.
GONÇALVES, A. E. S. S. Avaliação da capacidade antioxidante de frutas e polpas de frutas nativas e determinação dos teores de flavonoides e vitamina C. 2008. 88 f. Dissertação (Mestrado) - Faculdade de ciências farmacêuticas - Pós-graduação em Ciência dos Alimentos, São Paulo, 2008. GONZALO, J. C. R.; ALONSO, M. G. Flavonoides en alimentos vegetales: estructura y actividad antioxidante. Alimentación, Nutrición y Salud, v.9, n.2, p.31-38, 2002.
HALLIWELL, B.; GUTTERIDGE, J. M. C. Free Radicals in Biology and Medicine. Oxford: Oxford University Press, Londres, 1998.
HO, S. C.; WU, S. P.; LIN, S. M.; TANG, Y. L. Comparison of anti-glycation capacities of several herbal infusions with that of green tea. Food Chemistry, v. 122, p. 768-774, 2010.
HSIEH, C. L.; LIN, Y. C.; KO, W. S.; PENG, C. H.; HUANG, C. N.; PENG, R. Y. Inhibitory effect of some selected nutraceutical herbs on LDL glycation induced by glucose and glyoxal. Journal of Etnopharmacology, p.102-357, 2005.
HSIEH, C. L.; PENG, C. H.; CHYAU, C. C.; LIN, Y. C.; WANG, H. E.; PENG, R. Y. Low-densitylipoprotein, collagen, and thrombin models reveal that Rosemarinus officinalis L. exhibits
potent antiglycative effects. Journal of Agricultural and Food Chemistry, p. 2855-2884, 2007. HUANG, S. M.; CHUANG, H. C.; WU, C. H.; YEN, G. C. Cytoprotective effects of phenolic acids on methylglyoxal-induced apoptosis in Neuro-2A cells. Molecular Nutrition & Food Research, p. 932-940, 2008.
JANSEN, R.; WANG, S. Q.; BURNETT, M.; OSTERWALDER, U.; LIM, H. W. Photoprotection : Part I. Photoprotection by naturally occurring, physical, and systemic agentes. Journal of the American Academy of Dermatology, v. 69, p. 853e1–853e12, 2013.
JULIÁN-LOAEZA, A. P.; SÁNCHEZ, N. S. F.; VALADEZ, R. B.; GUZMÁN, B. S. S.; SALAS-CORONADO, R. Chemical composition, color, andantioxidant activity of three varieties of Annona diversifolia Safford fruits. Industrial Crops and Products, v. 34, n. 2, p. 1262-1268, 2010.
KAVATI, R. Melhoramento em fruta-do-conde. In: SÃO JOSÉ, A. R.; SOUZA, I. V. B.; MORAIS, O. M.; REBOUÇAS, T. N. H. Anonáceas-Produção e mercado. Universidade Estadual do Sudoeste da Bahia: Vitória da Conquista, 1997, p.47-54.
KIM, H.Y.; KIM, K. Protein glycation inhibitory and antioxidative activities of some plant extracts in vitro. Journal of Agricultural and Food Chemistry, p. 1551-1586, 2003.
KUHLMANN, M.; KUHN, E. A flora do Distrito de Ibiti. 221p. São Paulo: Instituto de Botânica, 1947.
KULLAVANIJAYA, P.; LIM, H. W. Photoprotection. Journal of the American Academy of Dermatology, v. 52, n. 937-958, 2005.
LAGE, G. A.; MEDEIROS, F. S.; FURTADO, W. L.; TAKAHASHI, J. A.; SOUZA-FILHO, J. D.; PIMENTA, L. P. S. The first report on flavonoid isolation from Annona crassiflora Mart. Natural
Product Research, 2014.
LANDAU, M. Exogenous factors in skin aging. Current Problems in Dermatology, v. 35, p. 1-13, 2007.
LANG, A. E.; LOZANO, A. M. Parkinson’s disease. First of two parts. The New England Journal of Medicine, v. 339, n. 16, p. 111-114, 1998
LEBOUEF, M.; CAVÉ, A.; BHAUMIK, K.; MUKERJEE, B.; MUKERJEE, R. The phytochemistry of the Annonaceae Phytochemistry, v. 21, n. 12, pp. 2783–2813, 1982.
LI, H.; NAKAMURA, S.; MORITA, T.; SUZUKI, M.; PISCHETSRIEDER, M.; NIWA, T. N2-carboxyethyl-2′-deoxyguanosine, a DNA glycation marker, in kidneys and aortas of diabetic and uremic patients. Kidney International, v. 69, p. 388–392, 2006.
LOBÃO, A. Q.; ARAUJO, D. S. D.; KURTZ, B.C. Annonaceae das restingas do estado do Rio de Janeiro, Brasil. Rodriguésia, v. 56, n. 87, p. 85-96, 2005.
LORENZI, H.; MATOS, F. J. A. Plantas Medicinais do Brasil. São Paulo: Nova Odessa, Instituto Plantarum, 2002, 544 p.
LIMA, M. D. Perfil cromatográfico dos extratos brutos das sementes de Annona muricata L. e Annona squamosa L. através da cromatografia líquida de alta eficiência. 2007. 102f. Dissertação
(Mestrado) - Universidade Federal de Alagoas, Alagoas, 2007.
LUNA, J. S. Estudo de Plantas Bioativas. 2006. 254f. Tese (Doutorado) - Universidade Federal de Pernambuco, Pernambuco, 2006.
LUNCEFORD N.; GUGLIUCCI A. Ilex paraguariensis extracts inhibit AGE formation more
MAILLARD, L.C. Action des acides amines sur les sucres: formation des melanoidines par voie methodique. Comptes Rendus de l'Académie des Sciences, v. 154, p. 66–68, 1912.
MATTOS, J.R. Frutos indígenas comestíveis do Rio Grande do Sul. 37p. Porto Alegre: Instituto de Pesquisa de Recursos Naturais Renováveis" AP", 1978.
MONTAGNER, S.; COSTA, A. Bases biomoleculares do fotoenvelhecimento. Anais Brasileiros de Dermatologia, v. 84, p.263-269, 2009.
NAGMOTI, D. M.; KHATRI, D. K.; JUVEKAR, P. R.; JUVEKAR, A. R. Antioxidant activity and free radical-scavenging potential of Pithecellobium dulce Benth. Seed extracts. Free radicals and antioxidants, v.2, n.2, 2012.
NIKI, E. Assessment of antioxidant capacity in vitro and in vivo. Free Radical Biology and
Medicine, v. 49, p. 503-515, 2010.
NOVA, N. S. V. N. Ação leishmanicida de alcalóides e acetogeninas extraídas de Annonaceae do Estado de Ceará. 2008. 70 f. Dissertação (Mestrado) – Universidade Estadual do Ceará - Pós-graduação em Ciências Veterinárias, Ceará, 2008.
NUNES, C. R.; BÉRNARDES, N. R.; GLÓRIA, L. L.; OLIVEIRA, D. B.; Flavonoides em Annonaceae: ocorrência e propriedades biológicas. Vértices, v. 14, n. 1, p. 38-57, 2012.
PADMA, P.; CHANSOURIA, J. P. N.; KHOSA, R. L. Effect of alcohol extract of Annona muricata
on cold immobilization stress induced tissue lipid peroxidation. Phytotherapy Research, v. 11, p. 326–327, 1997.
PADMA, P., CHANSAURIA, J. P. N., KHOSA, R. L.; RAY, A. K. Effect of Annona muricata and
Polyalthia ceradoides on brain neurotransmitters and enzyme monoamine oxidase following cold immobilization stress. Journal of Natural Remedies, v. 1, p. 144–146, 2001.
PEREIRA, S. Dermatoses no idoso. In: ROTTA, O. Guia de Dermatologia: clinica, cirurgica e cosmiatrica. São Paulo: Manole, p. 567-591, 2008.
PIETTA, P. G. Flavonoids as antioxidants. Journal of Natural Products, v. 63, p. 1035-1042, 2000. POURMORAD, F.; HOSSEINIMEHR, S. J.; SHAHABIMAJD, N. Antioxidant activity, phenol and flavonoid contents of some selected Iranian medicinal plants. African Journal of Biotechnology, v.5, n. 11, p. 1142-1145, 2006.
PROCKOP, D.J.; FERTALA, A. Inhibition of the self-assembly of collagen into fibrils with synthetic peptides. Demonstration that assembly is driven by specific binding sites on the monomers. Journal of Biological Chemistry, v. 273, n. 25, p. 15598-15604, 1998.
RAHMAN, M. M.; PARVIN, S.; HAQUE, M. E.; ISLAM, M. E.; MOSADDIK, M. A. Antimicrobial and cytotoxic constituents from the seed of Annona squamosa. Fitoterapia, v. 76, n. 5, p. 484-489,
2005.
REIS, C. N. Annona muricata: análise química e biológica dos frutos de gravioleira. 2011. 105f.
Dissertação (Mestrado) – Uiversidade Estadual do Norte Fluminense Darcy Ribeiro, Rio de Janeiro, 2011.
REISER, K. M.; AMIGABLE, M. A.; LAST, J. A. Nonenzymatic glycation of type I collagen: the effects of aging on preferential glycation sites. Journal of Biological Chemistry, v. 267, n. 34, p. 24207-24216, 1992.
REKHTER, M. D. Collagen synthesis in atherosclerosis: too much and not enough. Cardiovascular Research, v. 41. n. 2, p. 376-384, 1999.
RICE-EVANS, C.; MILLER, N. J.; PAGANGA, G. Structure-antioxidant activity relationships of flavonoids and phenolic acids. Free radical Biology & Medicine, v. 20, p. 933-956, 1996.
RINALDI, M. V. N. Avaliação da atividade antibacteriana e citotóxica dos alcalóides isoquinolínicos de Annona hypoglauca Mart. São Paulo, 125p. Dissertação (Mestrado) -
Universidade de São Paulo, São Paulo, 2007.
ROESLER, L.G.; MALTA, L.C.; CARRASCO, L.C.; HOLANDA, R.B.; SOUSA, C.A.S.; PASTORE, G.M. Atividade antioxidante de Frutas do Cerrado. Ciência e Tecnologia de Alimentos, v.27, n.1, p. 53-60, 2007.
ROSA, M. B.; OLIVEIRA, T. G.; CARVALHO, C. A.; SILVA, F. D.; CARVALHO, L. M.; NASCIMENTO, P. C.; PERES, R. L. Estudo espectrofotométrico da atividade fotoprotetora de extratos aquosos de Achillea millefolium, Brassica oleracea var. capitata, Cyperus rotundus, Plectranthus barbatus, Porophyllum runderale (Jacq.) cass e Sonchus. Revista Eletrônica de
Farmácia, v. 5, n. 1, p. 101-110, 2008.
RUDNICKI, A. M; OLIVEIRA, M. R.; PEREIRA, T. V.; REGINATTO, F. H.; DAL-PIZZOL, F.; MOREIRA, J.C.F. Antioxidant and antiglycation properties of Passiflora alata and Passiflora edulis
extracts. Food Chemistry, p.100-719, 2007.
RUNGER, T. M.; KAPPES, U. P. Mechanisms of mutation formation with long-wave ultraviolet light (UVA). Photodermatology Photoimmunology & Photomedicine, v. 24, p. 2-10, 2008.k
RUPPRECHT, J. K.; HUI, Y. H.; MCLAUGHLIN, J. L. Annonaceous Acetogenins: A review. Journal of Natural Products, v. 53, p. 237-278, 1990.
SAITO, M. L.; ALVARENGA, M. A. Alkaloids from Annona cacans. Fitoterapia, v. 65, n. 1, p. 87,
1994.
SÁNCHEZ-NIEVA, F. Frozen soursop puree. Journal of Agriculture University, Puerto Rico, v. 54, p. 220–226, 1970.
SHAAL, L. Al.; SHEGOKAR, R.; MÜLLER, R. R.; Production and characterization of antioxidant apigenin nanocrystals as a novel UV skin protective formulation International Journal of Pharmaceutics, v. 420, pp 133-140, 2011.
SÓLIS-FUENTES, J. A. S.; HERNÁNDEZ-MEDEL, M. R.; DURÁN-DE-BAZUÁ M. C. Soursop(Annona muricata L.) Seeds, therapeutic and possible food potential. Nuts and seeds in
TAKAHASHI, L. M. Identificação de Colletotrichum gloeosporioides de atemóia (Annona cherimola x Annona squamosa), por meio de caracterização patogênica, cultural e morfológica.
2008. 46f. Dissertação (mestrado) – Faculdade de Ciências Agronômicas, Universidade Estadual Paulista, Botucatu, 2008.
TELLES, M. P. C.; VALVA, F. D.; BANDEIRA, L. F.; COELHO, A. S. G. Caracterização genética de populações naturais de araticunzeiro (Annona crassiflora Mart. - Annonaceae) no Estado de Goiás.
Revista Brasileira de Botânica, v. 26, n. 1, p. 123-129, 2003.
THORNALLEY, P. J.; LANGBORG, A.; MINHAS, H. S. Formation of glyoxal, methylglyoxal and 3-deoxyglucosone in the glycation of proteins by glucose. Biochemical Journal, v. 344, p. 109–116, 1999.
VIOLANTE, I. M. P.; SOUZA, I. M.; VENTURINI, C. L.; RAMALHO, A. F. S.; SANTOS, R. A. N.; FERRARI, M. Estudo preliminar da atividade fotoprotetora in vitro de extratos vegetais do cerrado de
Mato Grosso. Revista Brasileira de Farmácia, v. 89, n. 3, p. 175-179, 2008.
WIDMER, R.; ZIAJA, I.; GRUNE, T. Protein oxidation and degradation during aging: Role in skin aging and neurodegeneration. Free Radical Research, v. 40, n. 12, p. 1259-1268, 2006.
WU, Y. New research and development on the Formosan Annonaceous plants. Studies in Natural Products Chemistry, v. 33, p. 957-1023, 2006.
WULF, H. C.; SANDBY-MOLLER, J.; KOBAYASI, T.; GNIADECKI, R. Skin aging and natural photoprotection. Micron, v. 35, p. 185-91, 2004.
YANG, B.;YANG, H.; LI, X.; TANG, Y.; ZHANG, N.; CHEN, J. Supercritical fluid CO2 extraction and simultaneous determination of eight annonaceous acetogenins in Annona genus plant seeds by
HPLC-DAD method. Journal of Pharmaceutical and Biomedical Analysis. v. 49, n. 1, p.140-144, 2009.
ZAID, M. A.; AFAQ, F.; SYED, D. N.; MUKHTAR, H. Botanical Antioxidants for Protection Against Damage from Sunlight. Nutritional Cosmetics, p. 161-183, 2009.
ZENG, L.; WU, F. E.; OBERLIES, N. H.; MCLAUGHLIN, L. Five New Monotetrahydrofuran Ring Acetogenins from the Leaves of Annona muricata. Journal of Natural Products, v. 59, p. 1035-1042,
CAPÍTULO I
___________________________________________________________________________
Atividade antioxidante e fotoprotetora de espécies de Annonaceae
Kamille D. Speraa, Regildo M. G. Silvaa
aUniversidade Estadual Paulista (UNESP), Departamento de Ciências Biológicas –
Laboratório de Fitoterápicos, Faculdade de Ciências e Letras de Assis, Avenida Dom Antônio 2100, CEP 19806-900, Assis, São Paulo, Brasil.
RESUMO
O estresse oxidativo corresponde a um desequilíbrio entre a taxa de produção de agentes oxidantes e sua degradação. A radiação ultravioleta é uma das responsáveis por causar danos cumulativos à pele podendo evoluir para patologias mais severas como, por exemplo, o câncer de pele. Estudos com extratos vegetais têm demonstrado que estes podem conter metabólitos capazes de tratar e/ou prevenir esses danos provocados pela exposição crônica a radiação ultravioleta e ao aumento do número de radicais livres. A família Annonaceae possui representantes que apresentam compostos bioativos com diferentes propriedades farmacológicas. No presente trabalho foi determinada a capacidade antioxidante, por meio dos testes de Sequestro do radical livre DPPH, Redução do Ferro (FRAP) e Inibição da peroxidação lipídica (TBARS), e realizada a análise da capacidade fotoprotetora, com a varredura dos extratos em espectrofotômetro no comprimento de onda de incidência da região UVB (290-320), de extratos hidroetanólicos e etanólicos de folhas e polpa do fruto de Annona crassiflora, Annona squamosa, Annona muricata, Annona cacans. Os resultados obtidos
mostraram que A. crassiflora e A. cacans apresentaram os melhores valores na maioria dos
testes de avaliação da capacidade antioxidante e entre os tipos de extratos avaliados, bem como para potencial fotoprotetor.
1 Introdução
A família Annonaceae compreende cerca de 128 gêneros e 2.300 espécies, sendo
Annona o gênero mais representativo, com cerca de 120 espécies, distribuídas nas regiões
tropicais e subtropicais do mundo (Joly, 1979; Maas et al., 2001; Lorenzi e Matos, 2002). É considerada economicamente importante, devido espécies como Annona muricata (graviola) e Annona squamosa (fruta-do-conde) terem seus frutos consumidos in natura (Telles et al.,
2003; Araya, 2003). Além destas, espécies silvestres menos conhecidas como Annona crassiflora (marolo) e Annona cacans (araticum cagão) (Lorenzi e Matos, 2002) apresentam
possível potencial nutricional e farmacológico para serem empregadas na busca de compostos ativos.
Estudos fitoquímicos da família Annonaceae já catalogaram cerca de 320 produtos secundários, das mais variadas partes da planta, oriundos de 150 espécies desta família (Alali et al., 1999). Os principais grupos de compostos químicos presentes em extratos preparados de cascas (Chen et al., 2000), folhas e frutos (Chang et al., 1998) são acetogeninas, alcaloides isoquinolínicos e os diterpenos (Oliveira et al., 2002).
A oxidação é um processo metabólico que leva à produção de energia necessária para as atividades celulares (Roesler et al.,2007). Entretanto, o metabolismo do oxigênio nas células vivas também leva à produção de radicais livres (Ferreira e Matsubara, 1997, Pourmorad et al., 2006; Nagmoti et al., 2012). O estresse oxidativo, aumento do número desses radicais, está diretamente relacionado a doenças degenerativas, câncer, doenças cardiovasculares, porém em sistemas biológicos existe um equilíbrio entre os fatores que promovem a oxidação e os mecanismos antioxidantes de defesa (Roesler et al., 2007; Gonçalves, 2008).
A radiação solar, proveniente principalmente da luz solar, é dividida em UVC (270-290nm), UVB (290-320nm) e UVA - UVA1 (340-400nm) e UVA2 (320-340nm) (Kullavanijaya e Lim, 2005). Os danos do estresse oxidativo ocorrem principalmente na membrana celular, e podem afetar o DNA também através da exposição à radiação UVA e UVB (Ferelli e Dedalo, 2006). Para evitar e/ou amenizar os impactos da exposição, que além do foto-envelhecimento, pode ocasionar câncer de pele, é recomendado a utilização de filtros solares, para evitar que estes tipos de radiações sejam absorvidos pela pele (Wulf et al., 2004).
também promover a proteção, a prevenção ou redução dos efeitos causados pelo estresse oxidativo (Pietta, 2000; Huang et al, 2005).
Estudos in vivo confirmam o potencial antifotocarcinogênico em polifenóis e foi
verificada diminuição em eritemas, induzidos por UV, em mulheres que consomem chá-verde (Katiyar e Elmets, 2001; Katiyar, 2003; Heinrich et al., 2011). O consumo humano do chocolate, por ser rico em flavonoides, também mostrou proteção contra raios ultravioletas (Williams et al., 2009; Jansen et al., 2013).
Este trabalho teve por objetivo avaliar extratos da polpa do fruto e folhas de A. crassiflora, A. muricata, A. squamosa e A. cacans, quanto ao seu potencial antioxidante por
meio dos testes de Sequestro de radical livre estável DPPH, Método deRedução do Ferro (FRAP) e TBARS, e avaliar in vitro a capacidade fotoprotetora, de acordo com análise
espectrofotométrica.
2 Materiais e Métodos
2.1 Coleta e preparação do material vegetal
As folhas e frutos de Annnona crassiflora M., Annona muricata L., Annona squamosa
L. e Annona cacans W. foram coletadas no município de Assis/São Paulo/Brasil (latitude:
22º39 '42''S, longitude: 50º24'44''W, altitude: 546m), com colaboração do Instituto Florestal do Estado de São Paulo, localizado na cidade de Assis/SP. As folhas das espécies avaliadas foram submetidas a secagem em estufa de ar circulante (±40°C), logo após pulverizado em moinho de facas. Os frutos foram despolpados e as polpas congeladas a -18ºC e liofilizadas.
2.2 Preparação dos Extratos
Os extratos hidroetanólicos (70%) e etanólicos foram preparados na proporção de 1:10 (p/v) em água destilada, submetidos à agitação mecânica por um período de 24 horas em temperatura ambiente. O resíduo vegetal foi retirado por filtragem a vácuo e reextraído por duas vezes. Os extratos obtidos foram levados ao rotaevaporador para eliminação completa do álcool. Para o preparo do extrato hidroetanólico, a solução aquosa resultante foi congelada e posteriormente liofilizado para obtenção do extrato seco. Ambos foram armazenados em frasco de vidro âmbar, protegidos da luz.
2.3 Atividade Antioxidante
A atividade antioxidante dos extratos para o radical estável DPPH (2,2-difenil-1-picrilhidrazil) utilizaram metodologia descrita por Maniam et al., 2008. Os experimentos foram realizados em triplicata para fins estatísticos, utilizando a solução de 1mL de tampão acetato (pH 5,5 e 100mM), 1,25mL de etanol P.A., 250μL de solução de DPPH (500μM) e 50μL das amostras. Os extratos reagiram com o radical DPPH por um período de 30 minutos em ambiente de pouca luminosidade e em seguida foram submetidos ao espectrofotômetro UV-Vis a um comprimento de onda de 517nm. O cálculo da atividade antioxidante foi realizado de acordo com a fórmula: Atividade antioxidante (%)= [(ACONTROLE– AAMOSTRA)/ACONTROLE]x100, onde AAMOSTRA é a absorbância das amostras após 30 minutos e ACONTROLE é a absorbância do DPPH, ambos a 517nm.
2.3.2 Capacidade de redução do Ferro (FRAP)
Para a determinação da atividade antioxidante por meio da redução do ferro (FRAP-Ferric Reducing Antioxidant Power) (Rufino et al., 2006), o reagente FRAP foi preparado no momento da análise, por meio da mistura na concentração de 10:1:1 de tampão acetato (300mM, pH 3,6), solução TPTZ (10mM TPTZ em 40mM HCl) e FeCl3 (20mM) em solução aquosa, respectivamente. Uma alíquota de 90μl da solução de extrato foi adicionado a 270μl de água destilada e 2,7mL do reagente FRAP e incubado a 37°C em banho-maria por 30 minutos. As absorbâncias foram medidas após esse tempo a 595nm e o espectrofotômetro zerado com o reagente FRAP. Os resultados foram expressos em μM equivalente de Trolox (ET) por g de extrato seco.
2.3.3 Inibição da peroxidação lipídica (TBARS)
foram medidas a 532 nm utilizando um espectrofotômetro. Os resultados foram expressos em porcentagem de TBARS: (ACONTROLE-AAMOSTRAx100/ACONTROLE). Onde ACONTROLE é a absorbância obtida apenas com AAPH sozinho e AAMOSTRA, a absorbância das amostras com extrato ou com controle positivo.
2.4 Atividade Fotoprotetora
2.4.1 Determinação do comprimento de onda máximo (λ max.) e da absorbância máxima (A max.) dos extratos de folhas e polpa das espécies
Para determinação do comprimento de onda máximo (λ max.) e da absorbância máxima (A max.), os extratos secos foram diluídos em álcool etílico absoluto PA na concentração de 1000µg/mL e foi realizada a varredura entre os comprimentos de onda de 290 a 320nm com intervalos de 5nm em espectrofotômetro com cubeta de quartzo (1,0cm caminho óptico), para verificar a absorção na região ultravioleta B (UVB).
Foi utilizado álcool etílico absoluto PA como branco. Logo após foi realizada a análise das áreas sob as curvas encontradas na varredura dos extratos em comparação com área de varredura do filtro padrão (Metoxicinamato de Octila, Sigma®) de acordo com o descrito por Rosa et al. (2008) e Velasco et al. (2011).
3 Resultados e Discussão 3.1 Avaliação antioxidante
3.1.1 Sequestro do radical livre estável DPPH
Para a avaliação da porcentagem de atividade sequestradora do radical DPPH (Tabela 1) foram analisados os resultados dos extratos na concentração de 250μg/mL.
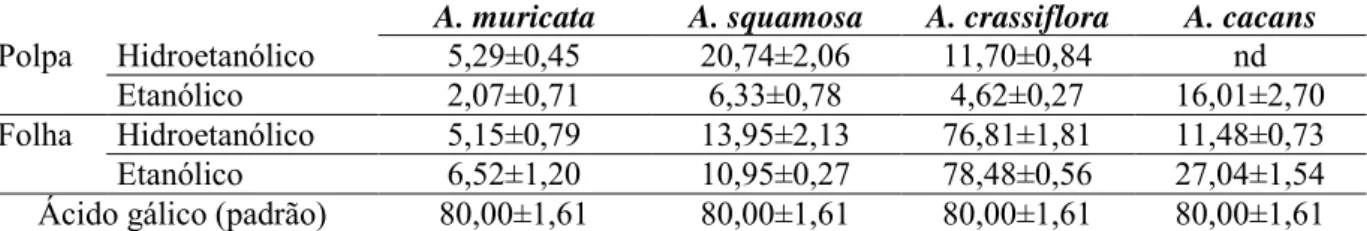
Em A. muricata, a maior atividade foi apresentada em ambos os extratos
hidroetanólicos, tendo como resultado o da polpa, 5,29%, e o da folha, 6,52%, considerada baixa atividade antioxidante como já havia sido relatada por Luna et al. (s.d.). Quanto à A. squamosa, esta, apresentou melhores atividades nos extratos hidroetanólico da polpa, com
20,74%, sendo o melhor resultado apresentado entre as polpas das espécies avaliadas, e hidroetanólico da folha, 13,95%.
Em A. crassiflora, o extrato hidroetanólico da polpa apresentou melhor resultado, com
DPPH e β-caroteno. Entre os metabólitos secundários já encontrados ou detectados no gênero que possuem atividade antioxidante, destacam-se os flavonoides, tais como a quercetina, as acetogeninas, isoramnetina, canferol e seus derivados C- ou O- glicosídeos (Lage, 2014).
A. cacans teve como melhor potencial antioxidante ambos os extratos etanólicos,
tendo a polpa apresentado 16,01% e a folha 27,04%. O extrato hidroetanólico da polpa de A. cacans não mostrou atividade detectada pelo teste.
TABELA 1. Atividade antioxidante pelo método de sequestro do radical DPPH (%) dos extratos hidroetanólico e etanólico da polpa de A. muricata, A. squamosa, A. crassiflora e A. cacans. (média e desvio padrão)
A. muricata A. squamosa A. crassiflora A. cacans
Polpa Hidroetanólico 5,29±0,45 20,74±2,06 11,70±0,84 nd
Etanólico 2,07±0,71 6,33±0,78 4,62±0,27 16,01±2,70
Folha Hidroetanólico 5,15±0,79 13,95±2,13 76,81±1,81 11,48±0,73
Etanólico 6,52±1,20 10,95±0,27 78,48±0,56 27,04±1,54
Ácido gálico (padrão) 80,00±1,61 80,00±1,61 80,00±1,61 80,00±1,61 nd=atividade não detectada pelo teste até a concentração máxima utilizada.
Substâncias antioxidantes presentes nos extratos reagem com o DPPH, que é um radical estável, e converte-o em 2,2-difenil-1-picril hidrazina. O grau de descoloração indica o potencial antioxidante do extrato. Um extrato que apresenta alto potencial em seqüestrar radicais livres possui baixo valor de EC50, ou seja, de inibir a oxidação do radical em 50% (Roesler et al., 2007).Com o cálculo do EC50 a partir da equação da reta de cada extrato, os extratos que apresentaram menor valor de EC50 entre as amostras analisadas (Tabela 2), de cada espécie, foram os extratos hidroetanólico da folha de A. crassiflora (EC50= 151,80), e
entre as polpas, etanólico de A. cacans (EC50=1202,40), sendo o valor do padrão de
referência Trolox (EC50= 118,37).
TABELA 2. Atividade antioxidante pelo método de sequestro do radical DPPH (EC50) dos extratos hidroetanólicos e etanólicos da polpa e folhas de A. crassiflora, A. squamosa, A. muricata e A. cacans e do
padrão Ácido Gálico.
A. muricata A. squamosa A. crassiflora A. cacans
Polpa Hidroetanólico 3197,71 1940,18 2061,05 *
Etanólico * * 3478,83 1202,40
Folha Hidroetanólico 3411,16 668,63 151,80 857,11
Etanólico 2723,88 851,04 144,57 793,28
Ácido Gálico (padrão) 43,81
Trolox (padrão) 118,37
* O extrato não apresentou atividade mínima necessária para cálculo do EC50.
Os extratos etanólicos das polpas de A. muricata e A. squamosa e o hidroetanólico da
DPPH, portanto não foi possível a realização do cálculo do EC50. Os demais extratos das quatro espécies analisadas apresentaram valores de EC50 superiores ao padrão ácido gálico. 3.1.2 Capacidade de redução do Ferro (FRAP)
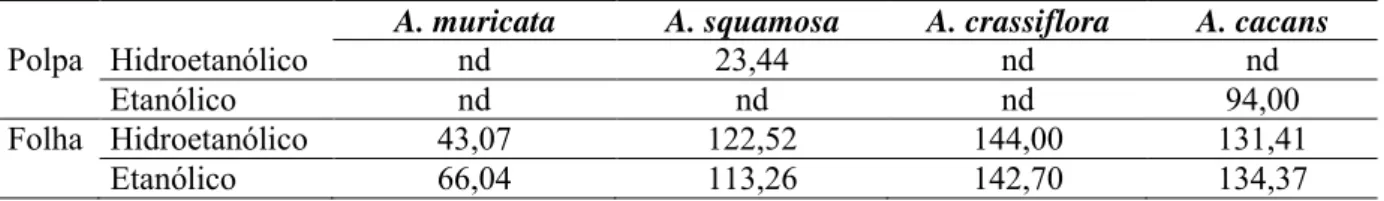
Em A. muricata nenhum dos extratos da polpa apresentou resultado, e o melhor
resultado para a folha foi no extrato etanólico, de 66,04μM ET/g de extrato (Tabela 3). Já para
A. squamosa, os melhores resultados foram em ambos os extratos hidroetanólicos, polpa
(23,44μM ET/g de extrato) e folha (122,52μM ET/g de extrato). Em A. crassiflora, nenhum
dos extratos da polpa apresentou resultados para o teste, e para a folha o melhor resultado foi de 144,00μM ET/g de extrato, sendo o melhor entre todos os extratos avaliados. Para A. cacans o maior potencial de redução do Fe3+ foi em ambos os extratos etanólicos, sendo o da
polpa 94,00μM ET/g de extrato, e o da folha 134,37μM ET/g de extrato).
TABELA 3. Atividade antioxidante pelo método de redução do Ferro FRAP dos extratos hidroetanólicos e etanólicos da polpa e folhas de A. crassiflora, A. squamosa, A. muricata e A. cacans
A. muricata A. squamosa A. crassiflora A. cacans
Polpa Hidroetanólico nd 23,44 nd nd
Etanólico nd nd nd 94,00
Folha Hidroetanólico 43,07 122,52 144,00 131,41
Etanólico 66,04 113,26 142,70 134,37
Resultados expressos em μM ET/g de extrato. nd=atividade não detectada pelo teste até a concentração máxima utilizada.
3.1.3 Inibição da peroxidação lipídica (TBARS)
O teste de TBARS avalia a inibição de peroxidação lipídica em sistemas biológicos (Costa et al., 2012). Os extratos foram utilizados na concentração de 1000µg/mL (Figura 1).
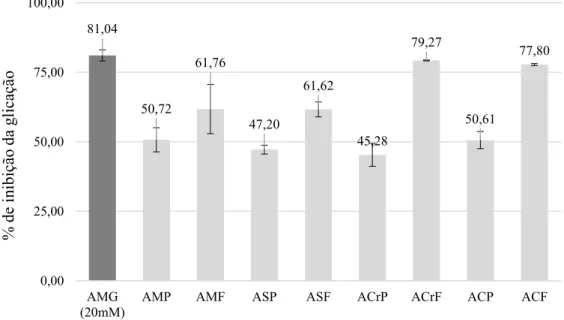
62,86 37,14 0 46,67 0 54,29 10,61 53,33 39,39 0 10 20 30 40 50 60 70 80 90 100
Trolox 150 A. muricata
POLPA A. muricataFOLHA A. squamosaPOLPA A. squamosaFOLHA A. crassifloraPOLPA A. crassifloraFOLHA A. cacansPOLPA A. cacansFOLHA
FIGURA 1. Inibição da formação de TBARS in vitro pelos extratos e controle positivo (Trolox -150µg/mL). (A. muricata-Polpa-Hidroetanólico, A. muricata- Folha-Etanólico; A. squamosa-Polpa-Hidroetanólico, A. squamosa-Folha-Hidroetnáolico; A. crassiflora-Polpa-Hidroetanólico, A. crassiflora-Folha-Etanólico; A. cacans
-Polpa-Etanólico, A. cacans-Folha-Etanólico)
Obteve-se que a polpa de A. muricata o valor de 37,14% de inibição (Figura 1). Em A. squamosa a polpa apresentou 46,67%. Já para A. crassiflora os resultados para polpa e folha
foram 54,29% e 10,61%, respectivamente. A. cacans apresentou os melhores valores sendo
53,33% para a polpa e 39,39% na polpa. Os extratos das folhas de A. muricata e A. squamosa
não apresentaram resultados detectados pelo teste na concentração utilizada. Sendo os resultados mais próximos do controle positivo Trolox (62,86%) os extratos de polpa de A. crassiflora, e de folha de A. cacans.
De acordo com Sreelatha e Padma, (2009), durante o processo oxidativo, ocorre a doação de um átomo de hidrogênio a partir de uma cadeia de ácidos graxos insaturados de fosfolipídios da membrana. O processo de peroxidação lipídica se inicia, e nele são gerados peróxidos lipídicos e finalmente peróxidos cíclicos, que em última análise são fragmentos de aldeídos combinados como malonaldeído. Os extratos das Annonaceaes testadas inibiram a quantidade de TBARS gerado pelo meio reacional AAPH, indicando um efeito protetor contra a peroxidação lipídica. Conforme descrito por Luna, (2006) e Costa et al., (2012), resultados positivos sugerem que os extratos podem exercer uma proteção antioxidante em biomoléculas, como fosfolípidos, triacilgliceróis e ácidos graxos polinsaturados, os quais são lipídeos essenciais para a função da membrana celular.
3.2 Atividade Fotoprotetora
3.2.1 Determinação da determinação do comprimento de onda máximo (λ max.) e da absorbância máxima (A max.) dos extratos de folhas e polpa das espécies
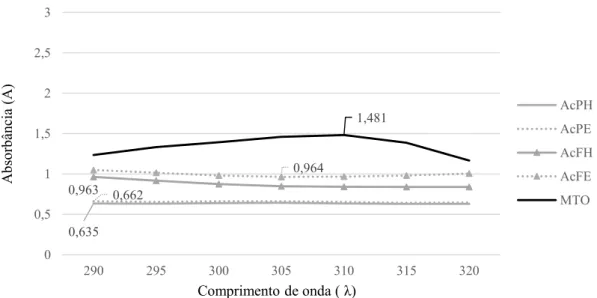
A varredura do composto fotoprotetor padrão Metoxicinamato de Octila (Sigma®), obteve pico de absorbância em 1,481 no comprimento de onda 310nm. Para análise das varreduras dos extratos foram consideradas as menores diluições com absorbância positiva.
O extrato hidroetanólico da folha de A. crassiflora, e o extrato etanólico da folha de A. muricata, atingiram, em todo seu comprimento de onda, valores de absorção maiores do que o
do padrão analisado Metoxicinamato de Octila (Sigma®) (Figura 2 e 4).
O extrato da folha hidroetanólico de A. crassiflora (Figura 2) atingiu o pico máximo
FIGURA 2. Espectros de absorção UV-visível e Comprimento de onda máximo (λ) e Absorbância (A) dos extratos de A. crassiflora em comparação com o padrão (Metoxicinamato de Octila, Sigma®) – MTO=
Metoxicinamato de Octila, AcrPH= extrato polpa hidroetanólico A. crassiflora (1000 μg/mL), AcrPE= extrato
polpa etanólico A. crassiflora (1000 μg/mL),AcrFH= extrato folha hidroetanólico A. crassiflora (500 μg/mL),
AcrFE= extrato folha etanólico A. crassiflora (500 μg/mL).
Em A. squamosa, nenhum dos extratos obteve absorbância maior que padrão, os picos
de absorbância foram atingidos no comprimento de onda de 290nm, e os valores para o extrato hidroetanólico da folha foi de 0.819, e etanólico de 0.810 (Figura 3).
FIGURA 3. Espectros de absorção UV-visível e Comprimento de onda máximo (λ) e Absorbância (A) dos extratos de A. squamosa em comparação com o padrão (Metoxicinamato de Octila, Sigma®) – MTO=
Metoxicinamato de Octila, AsPH= extrato polpa hidroetanólico A. squamosa (1000 μg/mL), AsPE= extrato
polpa etanólico A. squamosa (1000 μg/mL), AsFH= extrato folha hidroetanólico A. squamosa (250 μg/mL),
AsFE= extrato folha etanólico A. squamosa (250 μg/mL).
0,707 0,425 2,482 2,156 1,481 0 0,5 1 1,5 2 2,5 3
290 295 300 305 310 315 320
AcrPH AcrPE AcrFH AcrFE MTO A bs or bân cia
Comprimento de onda ( λ)
0,794 0,327 0,819 0,810 1,481 0 0,5 1 1,5 2 2,5 3
290 295 300 305 310 315 320
AsPH AsPE AsFH AsFE MTO
Comprimento de onda ( λ)
A
bs
or
bân
A varredura do extrato etanólico da folha de A. muricata atingiu pico de absorbância
em 290nm com valor de 1.730, porém, em todos os comprimentos de onda, foram obtidos valores maiores do que os do padrão (Figura 4).
FIGURA 4. Espectros de absorção UV-visível e Comprimento de onda máximo (λ) e Absorbância (A) dos extratos de A. muricata em comparação com o padrão (Metoxicinamato de Octila, Sigma®) – MTO=
Metoxicinamato de Octila, AmPH= extrato polpa hidroetanólico A. muricata (2000 μg/mL), AmPE= extrato
polpa etanólico A. muricata (2000 μg/mL), AmFH= extrato folha hidroetanólico A. muricata (1000 μg/mL),
AmFE= extrato folha etanólico A. muricata (1000 μg/mL).
O extrato etanólico da folha de A. cacans, obteve pico de absorbância em 305nm, com
valor de 0.964 (Figura 5).
FIGURA 5. Espectros de absorção UV-visível e Comprimento de onda máximo (λ) e Absorbância (A) dos extratos de A. cacans em comparação com o padrão (Metoxicinamato de Octila, Sigma®) – MTO=
Metoxicinamato de Octila, AcPH= extrato polpa hidroetanólico A. cacans (500 μg/mL), AcPE= extrato polpa
etanólico A. cacans (500 μg/mL),AcFH= extrato folha hidroetanólico A. cacans (250 μg/mL), AcFE= extrato
folha etanólico A. cacans (250 μg/mL).
0,586 0,595 0,902 1,730 1,481 0 0,5 1 1,5 2 2,5 3
290 295 300 305 310 315 320
AmPH AmPE AmFH AmFE MTO
Comprimento de onda ( λ)
A bs or bân cia 0,635 0,662 0,963 0,964 1,481 0 0,5 1 1,5 2 2,5 3
290 295 300 305 310 315 320
AcPH AcPE AcFH AcFE MTO
Comprimento de onda ( λ)
A busca por possíveis resultados positivos, se fundamenta com o proposto por Tedesco et al. (1997) e Agar e Young (2005), de que a exposição aguda à radiação ultravioleta, principalmente a UVB (290-320nm), além de provocar queimaduras na pele, pode levar ao aumento da melanogênese. Petrova et al. (2011) e Oberley (2002) relatam que a exposição a UVB gera espécies reativas de oxigênio (ROS), que reagindo com moléculas fotossensíveis, resulta num desequilíbrio entre as ROS e promove danos para as estruturas moleculares.
Embora Annona cacans não tenha obtidos melhores resultados quando comparados as
outras espécies analisadas, tem significativo potencial fotoprotetor e antioxidante, como já foi descrito por Saíto (1990), que isolou flavonoides e os glicosideos rutinas, das folhas, e o ácido p-cumárico, nas formas mono e dimetiladas, em frutos.
Matsumura e Ananthaswamy (2002) e Guinea et al. (2012) demonstraram que a exposição crônica ou repetida à radiação UVB promove tanto o fotoenvelhecimento da pele, quanto a fotocarcinogênese, e assim ao aumento da busca e o desenvolvimento de fotoprotetores, de origem natural e presentes na alimentação. No presente trabalho foram detectados que extratos das Annonaceae, tem potencial fotoprotetor, já que apresentaram, em espectro de varredura, absorbância significativa na região de incidência da radiação UVB (290-320nm) (Figuras 2 a 5).
Os resultados obtidos tornam as espécies de Annonaceaes avaliadas no presente estudo, promissoras para fornecer compostos afim de potencializar, também com seu efeito antioxidante, os filtros para prevenção aos danos causados pela radiação UVB.
4 Conclusões
Diante dos resultados obtidos neste estudo foi possível constatar que para o teste de DPPH, os melhores resultados encontraram foram no extrato de A. crassiflora folha etanólico, A. squamosa polpa hidroetanólico com EC50 menores em A. crassiflora folha etanólico e A.
cacans polpa etanólico. Para o teste FRAP, os melhores resultados apresentados foram no
extrato de A. crassiflora folha hidroetanólico e A. cacans polpa etanólico, já para o TBARS,
os melhores resultados obtidos foram nos extratos hidroetanólico de A. crassiflora e no
etanólico da folha de A. cacans. De acordo com o potencial fotoprotetor, os mais promissores
A. crassiflora e A. cacans apresentaram os melhores resultados na maioria dos testes
para antioxidantes e entre os tipos de extratos avaliados, bem como para potencial fotoprotetor.
5 Referências
Agar, N., Young, A.R. (2005). Melanogenesis: a photoprotective response to DNA damage?. Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis, 571, 121-132.
Alali, F.Q., Liu, X., McLaughlin, J.L. (1999). Annonaceous Acetogenins: Recent Progress. Journal of Natural Products, 62, 3, 504-540.
Araya, H. (2003). Studies on Annonaceous tetrahydrofuranic acetogenins from Annona squamosa seeds. Tese Doutorado, Meiji University, Tokyo.
Chang, F.R., Yang, P.Y., Lin, J.Y., Lee, K.H., Wu, Y.C. (1998). Bioactive kaurane diterpenoids from
Annona glabra. Journal of Natural Products, 61, 437-439.
Chen, C.Y., Chang, F.R., Cho, C.P., Wu, Y.C. (2000). ent-Kaurane diterpenoids from Annona glabra. Journal of Natural Products, 63, 1000-1003.
Costa, D.A., Oliveira, G.A.L, Sousa, D.P., Freitas, R.M. (2012) Avaliação do potencial antioxidante in vitro do composto ciano-carvona. Revista de Ciências Farmacêuticas Básica e Aplicada, 33, 4,
567-575.
Ferelli, C., Dedalo, M.F.N. (2006). Avaliação da Capacidade Antioxidante dos Extratos de Graviola (Annona muricata) e Suas Frações. Dissertação mestrado, Universidade Metodista de Piracicaba, São
Paulo.
Ferreira, A.L.A., Matsubara, L.S. (1997). Radicais livres: conceitos, doenças relacionadas, sistema de defesa e estresse oxidativo. Revista da Associação Médica Brasileira, 43, 61-68.
Gonçalves, A.E.S.S. (2008). Avaliação da capacidade antioxidante de frutas e polpas de frutas nativas e determinação dos teores de flavonoides e vitamina C. Dissertação mestrado, Faculdade de ciências farmacêuticas - Pós-graduação em Ciência dos Alimentos, São Paulo.
Guimarães, A.G., Oliveira, G.F., Melo, M.S., Cavalcanti, S.C., Antoniolli, A.R., Bonjardim, L.R., Silva, F.A., Santos, J.P.A., Rocha, R.F., Moreira, J.C.F., Araújo, A.A., Gelainn, D.P., Quintans-Júnior, L.J. (2010). Bioassay-guided evaluation of antioxidante and antinociceptive activities of carvacrol.
Basic & Clinical Pharmacology & Toxicology, 107, 6, 949-57.
Guinea, M., Franco, V., Araujo-Bazán, L., Rodríguez-Martín, I., González, S. (2012). In vivo UVB- photoprotective activity of extracts from comercial marine macroalgae. Food and Chemical Toxicology, 50, 1109-1117.
Heinrich, U., Moore, C.E., De Spirt, S., Tronnier, H., Stahl, W. (2011). Green tea polyphenols provide photoprotection, increase microcirculation, and modulate skin properties of women. Journal of Nutrition, 141, 1202-1208.