FÁBIO CAMPOS
Influência do Recebimento de Lixiviado de Aterro
Sanitário Sobre o Tratamento de Esgoto em
Processo de Lodo Ativado e Reator Integrado de
Lodo Ativado com Biofilme em Leito Móvel
Influência do Recebimento de Lixiviado de Aterro
Sanitário Sobre o Tratamento de Esgoto em
Processo de Lodo Ativado e Reator Integrado de
Lodo Ativado com Biofilme em Leito Móvel
Influência do Recebimento de Lixiviado de Aterro
Sanitário Sobre o Tratamento de Esgoto em
Processo de Lodo Ativado e Reator Integrado de
Lodo Ativado com Biofilme em Leito Móvel
Tese apresentada ao Programa
de Pós-Graduação em Saúde
Pública, em cumprimento às
exigências para obtenção do
título de Doutor em Ciências.
Área de Concentração:
Saúde
Ambiental
Orientador:
Professor Titular
Roque Passos Piveli
de estudo e pesquisa, desde que citada à fonte.
Catalogação de Publicação
Faculdade de Saúde Pública da Universidade de São Paulo
Campos, Fábio
Influência do recebimento de lixiviado de aterro sanitário sobre o tratamento de esgoto em processo de lodo ativado e reator integrado de lodo ativado com biofilme em leito móvel / Fábio Campos – São Paulo, 2014.
222p.
Tese (Doutorado) – Faculdade de Saúde Pública da Universidade de São Paulo. Departamento de Saúde Ambiental.
1-Lixiviado de aterro sanitário 2. Tratamento conjugado de lixiviado com esgoto doméstico 3. Sistemas Híbridos (IFAS) –
A realização desse trabalho só foi possível, sobretudo, devido à permissão da chefia do Departamento de Engenharia Hidráulica e Ambiental (PHA) da Escola Politécnica da USP, em participar do programa de pós-graduação da Faculdade de Saúde Pública. A esse departamento e a essa universidade, sou enormemente grato!
Com igual importância, agradeço a minha família todo o apoio e força, sobretudo nos momentos onde o desânimo e o receio do fracasso ameaçaram a conclusão dessa obra. Ao prof. Roque Passos Piveli, muito mais do que um chefe imediato ou um orientador, agradeço imensamente o prazer de contar com sua amizade. Um exímio profissional e ser humano, que me serve de inspiração e modelo tanto na vida cotidiana como profissional.
À profa. Suely Ivone Borrely, do Instituto de Pesquisas Energéticas e Nucleares (IPEN-CNEN), pela amizade e por todo apoio estrutural na realização dos ensaios de toxicidade aguda.
Ao Rubens Domenici e a toda equipe da Estação Elevatória do Piqueri/SABESP, por permitir a coleta do lixiviado utilizado na pesquisa, meu muito obrigado.
Aos amigos Rodrigo de Freitas Bueno e Laerte Cícero de Carvalho, meu agradecimento pela ativa participação durante toda a execução desse trabalho, e por terem acompanhado de perto todos os dramas e dificuldades.
Aos demais colegas de pós-graduação: Humberto, Fábio Fujii, Henrique e Jefferson, por participarem do dia a dia de rotinas de análises e trabalhos junto às pilotos.
Agradeço ao Pedro D.B. Alves, em nome de toda a Secretaria de Pós-Graduação do Departamento de Saúde Ambiental, todo o auxílio e orientação ao longo da minha permanência como aluno desse programa.
“Há verdadeiramente duas coisas diferentes: saber e crer que se sabe. A ciência consiste em saber; em crer que se sabe reside a ignorância.”
de esgoto em processo de lodo ativado e reator integrado de lodo ativado com biofilme em leito móvel. 2014, 222p. Tese (Doutorado) – Faculdade de Saúde Pública, Universidade de São Paulo, São Paulo, 2014.
O uso de aterros sanitários como forma de disposição dos resíduos sólidos urbanos constitui-se na alternativa mais usual tanto do ponto de vista econômico, como na correta disposição final do lixo. Entretanto, a geração de lixiviados permanece como uma inevitável consequência do uso de tal tecnologia. Das diversas alternativas de controle desse líquido percolado, destaca-se seu envio para estações de tratamento de esgoto sanitário. No presente estudo, avaliou-se o impacto causado pela introdução de cargas progressivas de lixiviado em conjunto com o esgoto sanitário em dois sistemas pilotos de tratamento: um de lodos ativados convencional e outro, um modelo híbrido do tipo IFAS (Integrated Fixed-Film Activated Sludge). A pesquisa foi dividida
em três fases, mantendo-se as mesmas condições operacionais e alterando, em cada fase, a contribuição de lixiviado na composição da carga afluente, em valores de 5%, 10% e 20% em relação à carga de DBO5,20. Os resultados obtidos a partir da investigação experimental
permitiram concluir que o aumento progressivo da carga advinda do lixiviado não provocou redução na eficiência de tratamento em ambos os sistemas, em nenhuma fase da pesquisa. Obtiveram-se, para o processo IFAS, índices de remoção de matéria orgânica, expressos em DBO, da ordem de 87% com a contribuição de 5% e 10% de lixiviado e de 80% com 20% de lixiviado; no processo de lodos ativados, tanto com 10% e 20% de carga de lixiviado, a eficiência foi de 80%, os resultados referentes à fase de 5%, nesse processo, foram prejudicados em decorrência de problemas operacionais. Em relação à oxidação de compostos nitrogenados, expressos em termos de NTK, observaram-se para o processo IFAS remoções acima de 90% em todas as fases, indicando que a nitrificação ocorreu de forma satisfatória. No processo de lodos ativados, os índices de remoção foram de 72% com 5% de lixiviado e de 65% com 10% e 20%, indicando um rendimento abaixo do esperado. Estudos relativos à composição da biomassa presente em ambos os processos não revelaram aspectos que as diferenciem significativamente em termos quantitativo; tão poucos indicaram alterações provocadas na microfauna em função da adição da carga de lixiviado. Os coeficientes cinéticos referentes ao metabolismo heterotrófico não apresentaram variações em função do aumento da contribuição do lixiviado, mantendo-se semelhantes aos encontrados na literatura; já os valores obtidos para constante máxima de crescimento (µm) das bactérias nitritantes apontaram uma redução em torno de 76%
e 41% para os processos de lodos ativados e IFAS, respectivamente, quando comparados com dados relativos à fase preliminar, sem adição de lixiviado; tal fato, contudo, não provocou interrupção ou inibição no rendimento da nitrificação. Ensaios de toxicidade aguda demonstraram significativa redução deste potencial em relação ao afluente, sobretudo, no processo IFAS, sendo que a técnica Microtox® mostrou-se mais sensível do que o teste com microcrustáceo Daphnia similis. Em linhas gerais, o processo IFAS demonstrou um
desempenho superior em termos de eficiência de remoção tanto de matéria orgânica como nitrogenada, bem como maior estabilidade operacional.
the activated sludge process and integrated fixed-film activated sludge reactor. 2014, 222p. Doctoral Thesis – School of Public Health, University of São Paulo, São Paulo, 2014.
The utilization of landfills as an urban solid waste management technology constitutes an economically viable alternative of final waste disposal. However, the generation of contaminated leachate remains as an inevitable consequence of this technology. Among various treatment alternatives for that percolated liquid, a major one is sending it to a wastewater treatment plant. The present paper evaluated the impact caused by the introduction of progressive leachate loads together with domestic sewage in two pilot scale treatment plants: an activated sludge plant and a hybrid model type IFAS (Integrated fixed-film activated sludge) plant. The research was divided into 3 phases, maintaining the same operation conditions in both pilot plants and changing at each phase the amount of leachate in the composition of the influent to percent values of 5%, 10% and 20%. Results obtained from the experimental investigation demonstrated that the leachate load did not cause inhibition of the treatment process in both pilots, at any phase of the research. For the IFAS process, removal rates of organic matter in terms of BOD were on the order of 87% with leachate contributions of 5% and 10%, and 80% with 20% of leachate contribution. Regarding the activated sludge process, at both 10% and 20% of leachate load, the BOD removal efficiency was 80%. The results from the 5% leachate contribution phase were not available due to operational problems. Regarding nitrogen removal, in terms of NTK, a removal efficiency over 90% was observed for the IFAS process in all phases, showing that nitrification occurred in a satisfactory way; as for the activated sludge process, the removal rates were 72% with 5% of leachate contribution and 65% with 10 and 20% leachate contributions, results lower than expected. The study of the biomass composition did not show aspects that differ significantly in quantitative terms for both processes; and it did not show any changes in the micro fauna due to the leachate addition. The kinetic coefficients related to the heterotrophic metabolism did not present variation due to the increase of leachate addition, being similar to those found in the literature. On the other hand, the obtained values for the maximum growth rate (μm) of nitrifying bacteria pointed to reductions of about 76% and 41% for the activated sludge and IFAS processes, respectively, when compared with data related to the preliminary phase, without leachate addition. This fact, however, did not cause disruption or inhibition to affect the nitrification yield. Acute toxicity assays demonstrated significant reduction of this potential relative to affluent, especially on the IFAS process, and the Microtox® technique appeared to be more sensitive. In a more general way, the IFAS process presented a better performance than the activated sludge process in terms of removal efficiencies of organic and nitrogenous matter, as well as higher operating stability.
Tabela 1: Características físico-químicas dos esgotos ... 29
Tabela 2 - Valores de referência das constantes cinéticas de utilização de material orgânico ... 38
Tabela 3 - Valores do coeficiente de Arrehnius (θ) em função da temperatura ... 44
Tabela 4 - Níveis inibitórios de amônia livre e ácido nitroso para o processo de nitrificação em pH 7 a 20º C. ... 45
Tabela 5 - Comparação entre bactérias nitrificantes e desnitrificantes ... 47
Tabela 6 - Valores de referência da constante de decaimento (b) de Nitrossomonas. .. 52
Tabela 7 - Valores típicos para a constante de meia saturação (Kn) das Nitrossomonas ... 52
Tabela 8 - Valores típicos para a constante de crescimento máximio (µmax) das Nitrossomonas ... 52
Tabela 9 - Parâmetros típicos de projeto para o processo IFAS ... 64
Tabela 10 - Porcentagem de remoção no biofilme esperadas a 15 °C ... 65
Tabela 11 - Destino final dos resíduos sólidos no Brasil ... 71
Tabela 12 - Valores típicos para lixiviados novos, intermediários e velhos ... 81
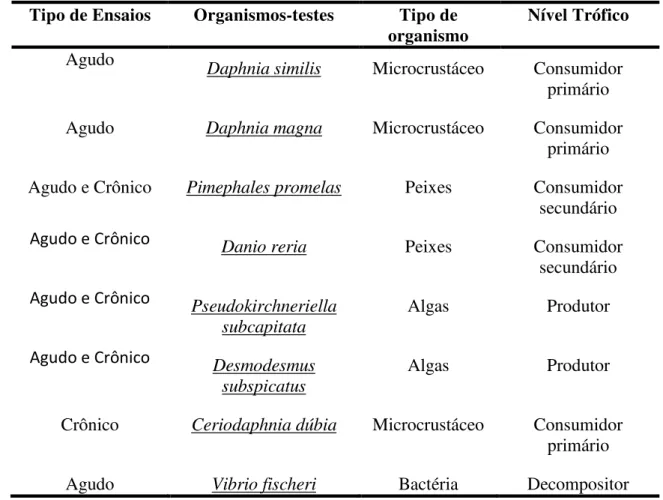
Tabela 13 - Relação de organismos-testes utilizados em ensaios de toxicidade. ... 86
Tabela 14 - Faixas de toxicidade para o sistema Microtox® proposta por Bulich(1982) ... 88
Tabela 15 - Resultados de ensaio de toxicidade aguda no lixiviado do aterro de Gramacho (RS). ... 89
Tabela 16 - Proporção entre esgoto e lixiviado nas ETEs Barueri e Suzano ... 98
Tabela 17 - Volume dos reatores biológicos ... 108
Tabela 18 - Condições operacionais mantidas nos reatores. ... 112
Tabela 19 - Variáveis monitoradas, pontos de amostragem e frequência analítica. .... 115
Tabela 20 - Variáveis monitoradas nos lodos, ponto de amostragem e frequências. .. 116
Tabela 21 - Substratos para os testes respirométricos com bactérias autotróficas nitrificantes ... 123
Tabela 22 - Caracterização do esgoto sanitário decantado antes da adição do lixiviado ao longo de experimento... 127
Tabela 23 - Caracterização do lixiviado ao longo de experimento ... 128
Tabela 24 - Caracterização real do afluente aplicado às pilotos – Principais Variáveis ... 129
Tabela 25 - Quadro resumo dos valores médios das condições operacionais da piloto LAC. ... 130
Tabela 26 - Quadro resumo dos valores médios das condições operacionais da piloto LAI. ... 130
Tabela 27 - Valores médios das cargas orgânicas e nitrogenadas aplicadas ao processo LAC. ... 131
–
Tabela 32 - Valores médios da relação entre STV e ST nos efluentes dos processos. 136
Tabela 33 - Estatística descritiva dos resultados de SST – Fase 1. ... 136
Tabela 34 - Estatística descritiva dos resultados de SST – Fase 2. ... 137
Tabela 35 - Estatística descritiva dos resultados de SST – Fase 3. ... 137
Tabela 36 - Estatística descritiva dos resultados de SSV dos lodos do Tanque de Aeração. ... 141
Tabela 37 - Estatística descritiva dos resultados de SSV dos lodos da linha de Retorno. ... 141
Tabela 38 - Valores médios referentes a quantificação da biomassa aderida... 145
Tabela 39 - Contribuição referente a biomassa aderida... 147
Tabela 40 - Quantidades relativas de biomassa no tanque de aeração. ... 147
Tabela 41 - Composição média da biomassa aderida em termos de NTK e Ptotal. .... 148
Tabela 42 - Correlação entre densidade populacional e SSV ao longo do estudo ... 155
Tabela 43 - Estatística descritiva dos resultados de DBO total – Fase 1. ... 162
Tabela 44 - Estatística descritiva dos resultados de DBO total – Fase 2. ... 163
Tabela 45 - Estatística descritiva dos resultados de DBO total – Fase 3. ... 163
Tabela 46 - Estatística descritiva dos resultados de DBO solúvel... 166
Tabela 47 - Estatística descritiva dos resultados de DQO total – Fase 1. ... 170
Tabela 48 - Estatística descritiva dos resultados de DQO total – Fase 2. ... 170
Tabela 49 = Estatística descritiva dos resultados de DQO total – Fase 3. ... 170
Tabela 50 - Estatística descritiva dos resultados de COD – Fase 1. ... 175
Tabela 51 - Estatística descritiva dos resultados de COD – Fase 2. ... 175
Tabela 52 - Estatística descritiva dos resultados de COD – Fase 3. ... 176
Tabela 53 - Variáveis obtidas através da TCO “inloco”– valores médios. ... 181
Tabela 54 - Balanço de massa do material nitrogenado na piloto LAC – valores médios. ... 182
Tabela 55 - Balanço de massa do material nitrogenado na piloto LAI – valores médios. ... 182
Tabela 56 - Estatística descritiva dos resultados de NTK – Fase 1. ... 183
Tabela 57 - Estatística descritiva dos resultados de NTK – Fase 2. ... 183
Tabela 58 - Estatística descritiva dos resultados de NTK – Fase 3. ... 183
Tabela 59 - Estatística descritiva dos resultados de NH4+– Fase 1. ... 187
Tabela 60 - Estatística descritiva dos resultados de NH4+– Fase 2. ... 188
Tabela 61 - Estatística descritiva dos resultados de NH4+– Fase 3. ... 188
Tabela 62 - Estatística descritiva dos resultados de NO3- e NO2- gerados no Processo LAC. ... 194
Tabela 63 - Estatística descritiva dos resultados de NO3- e NO2- gerados no Processo LAI. ... 194
Tabela 64 - Variação teórica da alcalinidade observado no processo LAC. ... 197
Tabela 65 - Variação teórica da alcalinidade observado no processo LAI... 197
Tabela 69 - Balanço de massa do material nitrogenado na piloto LAI – valores médios. ... 200 Tabela 70 - Valores médios das constantes cinéticas de crescimento e de utilização de matéria orgânica. ... 202 Tabela 71 - Valores de TCO para as bactérias nitritantes. ... 206 Tabela 72 - Valores médios das constantes de crescimento específico máximo (µm) das
bactérias nitritantes. ... 206 Tabela 73 - Valores médios das constantes de meia saturação de Monod (Kn) das
bactérias nitritantes. ... 208 Tabela 74 - Valores médios das taxas máximas de utilização de amônia (rn max) das
Figura 1 - - Microrganismos típicos de Lodos Ativados: (1) Colônia de Protozoários
Penduculados; (2) Tardígrado; (3) Protozoário predador de floco; (4) Rotíferos. ... 31
Figura 2 - Microfotografia do Floco Biológico ... 33
Figura 3 - Esquema de um Sistema Convencional de Lodos Ativados ... 34
Figura 4 - Frações de material orgânico presente no esgoto ... 35
Figura 5 - Variação do número de oxidação do nitrogênio durante a nitrificação ... 41
Figura 6 - Influência do pH na taxa de nitrificação ... 42
Figura 7 - Relação entre taxa de nitrificação e TRS ... 45
Figura 8 - Curva de crescimento microbiano e uso do substrato em função do tempo . 48 Figura 9 - Agitação em reatores (a) aeróbios, (b) anóxicos e anaeróbios. ... 58
Figura 10 - Relação entre a carga de nitrogênio amoniacal e a taxa de nitrificação. .... 59
Figura 11 - Relação entre a Taxa de Remoção de DBO solúvel em função da Taxa de Aplicação de DBO total. ... 61
Figura 12 - Relação entre taxa de nitrificação e concentração de Oxigênio Dissolvido (OD) em sistema com MBBR. ... 62
Figura 13 - Comparação do processo convencional de Lodos Ativados e IFAS ... 63
Figura 14 - Exemplos de modelos e especificações de Biomídias ... 66
Figura 15 - Formação de biofilme no interior de uma biomídia. ... 68
Figura 16 - Geração de Resíduos Sólidos no Brasil (ton./dias). ... 71
Figura 17 - Na sequência: Lixão de Gramacho - RJ (a), Aterro Controlado de Goiânia (b) e Aterro Sanitário Bandeirantes (c)... 72
Figura 18 - Fluxograma do processo de decomposição anaeróbia dos resíduos sólidos urbanos. ... 75
Figura 19 - Esquema de geração de Lixiviado de Aterro Sanitário. ... 78
Figura 20 - Objetos de estudo da Ecotoxicologia. ... 83
Figura 21 - Processos de transporte e transformação envolvendo compostos tóxicos. . 84
Figura 22 - Recebimento de Lixiviado na Estação Elevatória de Esgoto do Piqueri (SABESP). ... 98
Figura 23 - Unidade elevatória de esgoto bruto. ... 102
Figura 24 - Unidades do tratamento preliminar: (a) peneiramento e canal de areia; (b) bomba de transferência do esgoto pré-tratado. ... 102
Figura 25 - Vista geral das Unidades de Tratamento. ... 104
Figura 26 - Painel de interface da instrumentação. ... 104
Figura 27 - Painel de controle dos equipamentos. ... 105
Figura 28 - Biomídia K1 – Anox Kaldnes®, ... 105
Figura 29 - Perfil hidráulico dos sistemas em escala piloto. ... 106
Figura 30 - Desenho esquemático dos reatores biológicos. ... 108
Figura 31 - Desenho esquemático do decantador secundário. ... 109
–
biomídias com biofilme no tubo falcon; (b) detalhe da biomídia com biofilme; (c) biomassa aderida após a soltura; (d) comparação da biomídia antes e após a soltura. 118
Figura 35 - Respirômetro modelo Beluga S32c, do tipo aberto e semi-contínuo. ... 120
Figura 36 - Reator utilizado nos testes respirométricos, (a) reator e haste para mistura, (b) sistema montado para realização do teste. (c) aparato montado para testes simultâneos. ... 121
Figura 37 - Esquema operacional para geração de testes respirométricos. ... 122
Figura 38 - Exemplo de curva para cálculo da Constante de Meia Saturação (Kn). ... 125
Figura 39 - Exemplificação de cálculo de área para validação do teste. ... 126
Figura 40 - Composição histórica da COV nos processos LAI e LAC. ... 132
Figura 41 - Séries Temporais da variável ST. ... 134
Figura 42 - Diagrama Box-Whiskers da variável ST. ... 135
Figura 43 - Séries Temporais da variável SST. ... 138
Figura 44 - Diagrama Box-Whiskers da variável SST. ... 139
Figura 45 - Concentração de SSV nos efluentes ao longo das três etapas. ... 140
Figura 46 - Série histórica da variável SSV dos lodos do Tanque de Aeração. ... 142
Figura 47 - Série histórica da variável SSV dos lodos da linha de Retorno. ... 142
Figura 48 - Diagrama Box-Whiskers da variável SSV dos lodos do Tanque de Aeração. ... 143
Figura 49 - Diagrama Box-Whiskers da variável SSV dos lodos da linha de retorno. 144 Figura 50 - Série histórica dos valores de SSV referentes à biomassa aderida. ... 146
Figura 51 - Densidade populacional referente à biomassa presente na piloto LAC. .. 150
Figura 52 - Densidade populacional referente à biomassa em suspensão presente na piloto LAI. ... 151
Figura 53 - Densidade populacional referente à biomassa aderida presente na piloto LAI. ... 152
Figura 54 - Densidade populacional referente à biomassa total presente na piloto LAI. ... 153
Figura 55 - Valor absoluto da densidade populacional referente à microfauna. ... 155
Figura 56 - Microfotografia dos lodos – Biomassa em suspensão da piloto LAC (aumento de 100x). ... 156
Figura 57 - Microfotografia dos lodos – Biomassa em suspensão da piloto LAI (aumento de 100x). ... 157
Figura 58 - Carga Orgânica Superficial estimada por área de biofilme. ... 158
Figura 59 - Taxa de Aplicação Superficial de Amônia estimada por área de biofilme. ... 159
Figura 60 - Relação entre a Taxa de nitrificação e de aplicação de amônia por área do biofilme. ... 159
Figura 61 - Monitoramento da temperatura ao longo do estudo nas pilotos LAC e LAI. ... 160
Figura 66 - Diagrama Box-Whiskers da DBO solúvel. ... 166
Figura 67 - Correlação entre as variáveis DBO total; DBO solúvel e SSV do efluente da piloto LAC. ... 167
Figura 68 - Correlação entre as variáveis DBO total; DBO solúvel e SSV do efluente da piloto LAI. ... 167
Figura 69 - Correlação da COV proveniente do lixiviado com a eficiência de remoção de DBO. ... 169
Figura 70 - Séries Temporais da variável DQO total. ... 171
Figura 71 - Diagrama Box-Whiskers da variável DQO total. ... 172
Figura 72 - Série histórica da relação DBOtotal.DQOtotal-1. ... 173
Figura 73 - Diagrama Box-Whiskers da variável DQO solúvel... 174
Figura 74 - Séries Temporais da variável COD. ... 177
Figura 75 - Diagrama Box-Whiskers da variável COD. ... 178
Figura 76 - Série histórica de variáveis indicadoras de matéria orgânica – Piloto LAC. ... 179
Figura 77 - Série histórica de variáveis indicadoras de matéria orgânica – Piloto LAI. ... 180
Figura 78 - Séries Temporais da concentração de NTK. ... 184
Figura 79 - Diagrama Box-Whiskers da eficiência de remoção de NTK... 185
Figura 80 - Correlação entre as variáveis nitrogênio orgânico e SSV do efluente do processo LAC. ... 186
Figura 81 - Correlação entre as variáveis nitrogênio orgânico e SSV do efluente do processo LAI. ... 186
Figura 82 - Séries Temporais da concentração de NH4+ nos efluentes dos processos. 189 Figura 83 - Diagrama Box-Whiskers da eficiência de remoção de NH4+. ... 190
Figura 84 - Concentração de amônia convertida ao longo do estudo... 191
Figura 85 - Taxas de nitrificação obtidas ao longo do estudo. ... 192
Figura 86 - Correlação entre amônia convertida e SSV presentes no tanque de aeração do processo LAC. ... 193
Figura 87 - Correlação entre amônia convertida e SSV presentes no tanque de aeração do processo LAI. ... 193
Figura 88 - Série histórica da concentração de NO3- e NO2- gerados no Processo LAC. ... 195
Figura 89 - Série histórica da concentração de NO3- e NO2- gerados no Processo LAI. ... 195
Figura 90 - Capacidade de desnitrificação do processo LAC. ... 196
Figura 91 - Capacidade de desnitrificação do processo LAI. ... 196
Figura 92 - Variação da alcalinidade Teórica e Experimental. ... 199
Figura 93 - Exemplo de Respirograma para determinação de constantes cinéticas das bactérias heterotróficas. ... 201
µm: Taxa específica de crescimento (d-1)
µmáx: Taxa específica máxima de crescimento (d-1)
µmT : Taxa de crescimento máximo das bactérias a uma temperatura T (d-1)
a: Recirculação de liquor misto
ANAMMOX: Anaerobic Ammonium Oxidation
AT: Amplitude total
bh: Decaimento de bactérias heterotróficas (d-1)
bn: Constante de decaimento para as bactérias autotróficas nitrificantes (d-1)
Bn: Balanço de massa de material nitrogenado
Bo: Balanço de massa de material orgânico
CEO: Concentração de Efeito Observado CENO: Concentração Efetiva Média (CE50)
Cr: Massa de lodo ativo presente no sistema por unidade de DQO
CRUSP: Conjunto residencial da Universidade de São Paulo
CTH: Centro Tecnológico de Hidráulica - Escola Politécnica da Universidade de São Paulo
CV: Coeficiente de variação
DBO: Demanda Bioquímica de Oxigênio (mg.L-1)
Dec: Decantador
Dp: Capacidade de desnitrificação com material orgânico particulado (mgN.d-1)
DP: Desvio Padrão
DQO: Demanda Química de Oxigênio (mg.L-1)
Ds: Capacidade de desnitrificação com material orgânico solúvel (mgN.d-1)
Dt: Capacidade de desnitrificação total de um sistema de lodo ativado
dXn/dtc: Taxa de crescimento das bactérias nitrificantes (mgSSV.L-1.d-1)
dXn/dtd: Taxa de decaimento das bactérias nitrificantes (mgSSV.L-1.d-1)
dXn/dte: Taxa de descarga de lodo de excesso (mgSSV.L-1.d-1)
Efluente: Esgoto efluente após tratamento no sistema de lodo ativado
ETE: Estação de tratamento de esgoto
f aeróbia: Fração aeróbia dos sistemas de lodo ativado operados
fbs: Fração biodegradável solúvel de esgoto
fcv: Produção de massa bacteriana (gSSV-1.gDQO-1)
fn: Fração de nitrogênio total Kjeldahl em lodo volátil
fup: Fração de DQO não biodegradável particulada
fus: Fração de DQO não biodegradável solúvel
IFAS: Integrated Fixed-Film Activated Sludge
IVL: Índice volumétrico de lodo
Kd: Constante de desnitrificação
Kla: Constante de transferência de oxigênio
Kn: Constante de meia saturação bactérias autotróficas (mgN.L-1)
Ko: Constante de meia saturação de oxigênio (mg.L-1)
KH: Constante de meia saturação bactérias heterotróficas (mgN.L-1)
KS: Constante de meia saturação de substrato (mgS.L-1)
LAC: Lodo Ativado Convencional
LAI: Lodo Ativado Integrado
MBBR: Moving Bed Biofilm Reactors
MMA: Ministério do Meio Ambiente
MNae: Fluxo de nitrogênio amoniacal efluente (mgN.d-1)
MNC: Fluxo da concentração de amônia nitrificada (gN.d-1)
MNd: Fluxo de nitrogênio utilizado na desnitrificação (mgN.d-1)
MNl: Fluxo de nitrogênio total Kjeldahl no lodo (mgN.d-1)
MNna: Fluxo de nitrato afluente (mgN.d-1)
MNoe: Fluxo de nitrogênio orgânico efluente (mgN.d-1)
MNta: Fluxo de nitrogênio total Kjeldahl afluente (mgN.d-1)
MNte: Fluxo de nitrogênio total Kjeldahl efluente (mgN.d-1)
MO: Matéria orgânica
Moc: Consumo de oxigênio para oxidação de material orgânico (mgO.d-1)
Moeq: Oxigênio equivalente recuperado através da desnitrificação (mgO.d-1)
Mon: Consumo de oxigênio para nitrificação (mgO.d-1)
Mot: Consumo total de oxigênio no reator aeróbio (mgO.d-1)
mSXV: Fração de DQO afluente descarregada no lodo de excesso (mgDQO.d-1)
MXt: Massa de lodo colocado no cilindro para teste de sedimentabilidade
mXv: Produção de lodo (mgSSV-1.mgDQO-1)
N: Nitrogênio
Na: Concentração de amônia (mgN.L-1)
Naa: Concentração de nitrogênio amoniacal afluente (mgN.L-1)
Nae: Concentração de nitrogênio amoniacal efluente (mgN.L-1)
NC: Concentração de amônia nitrificada (mgN.L-1)
ND: Não detectado pelo método padrão utilizado
NDS: Nitrificação e desnitrificação simultânea
NH3: Gás amoníaco (mgN.L-1)
NH4+: Íon amônio (mgN.L-1)
Nl: Concentração de NTK para a produção de lodo de excesso (mgN.L-1)
Nna: Concentração de nitrogênio nitrato afluente (mgN.L-1))
Nne: Concentração de nitrato no efluente (mgN.L-1)
N-NO2-: Nitrito (mgN.L-1)
N-NO3-: Nitrato (mgN.L-1)
No: Material nitrogenado inicial referente a recirculações (mgN.L-1)
Noa: Concentração de nitrogênio orgânico afluente (mgN.L-1)
Noe: Concentração de nitrogênio orgânico efluente (mgN.L-1)
N-Orgânico: Nitrogênio Orgânico (mgN.L-1) Nta: Concentração de NTK afluente (mgN.L-1)
Nte: Concentração de NTK efluente (mgN.L-1)
NTK: Concentração de nitrogênio total Kjeldahl (mgN.L-1)
OD: Concentração de oxigênio dissolvido (mg.L-1)
ODmáx: Valor de oxigênio dissolvido de referência superior (mg.L-1)
ODmin: Valor de oxigênio dissolvido de referência inferior (mg.L-1)
OLAND: Oxygen Limited Autotrophic Nitrification Denitrification
pH: Potencial hidrogeniônico
PROSAB: Programa de Saneamento Básico
q: Volume de liquor misto a ser descartado (L.d-1)
r: Taxa de recirculação de liquor misto
RBS: Reator em bateladas seqüenciais
rd: Taxa de desnitrificação
rdp: Taxa de desnitrificação para material lentamente biodegradável
rds: Taxa de desnitrificação para material rapidamente biodegradável
Rh: Tempo de permanência do líquido (d-1)
rmáx: Taxa de utilização máxima material carbonáceo (mgDQO.mgXa-1.d-1)
rn.máx: Taxa de utilização máxima de amônia, nitrito ou nitrato
Rs: Idade de lodo (d-1)
Rsm: Idade de lodo mínima para que ocorra nitrificação
rus: Taxa de utilização de material rapidamente biodegradável
S: Concentração de substrato (mg.L-1)
S32c: Software do respirômetro Beluga
Sba: DQO biodegradável afluente (mg.L-1)
Sbpa: DQO biodegradável particulada afluente (mg.L-1)
Sbsa: DQO biodegradável solúvel afluente (mg.L-1)
SBR: Lodo Ativado em Bateladas Sequenciais
SHARON: Single-reactor High-activity Ammonium Removal Over Nitrite
SS: Sólidos suspensos (mg.L-1)
SSF: Sólidos suspensos fixos (mg.L-1)
SST: Sólidos suspensos totais (mg.L-1) SSV: Sólidos suspensos voláteis (mg.L-1)
Sta: DQO afluente (mg.L-1)
Ste: DQO efluente (mg.L-1)
Sua: DQO não biodegradável afluente (mg.L-1)
Supa: DQO não biodegradável particulada afluente (mg.L-1)
Susa: DQO não biodegradável solúvel afluente (mg.L-1)
T: Temperatura (°C)
TCO “in loco”: Taxa de consumo de oxigênio real do sistema (mgO2.L-1.h-1)
TCO: Taxa de consumo de oxigênio (mgO2.L-1.h-1)
TCOexo.máx: Taxa de consumo de oxigênio exógena máxima (mgO2.L-1.h-1)
TCOn: TCO total devido à nitrificação (mgO2.L-1.h-1)
TCOn.máxima: TCO total devido à nitrificação máxima (mgO2.L-1.h-1)
TCOtotal: Taxa de consumo de oxigênio total (mgO2.L-1.h-1)
TDH: Tempo de detenção hidráulica (h)
UCT: University of Cape Town
USP: Universidade de São Paulo
UT Unidde de Toxicidade
Vr: Volume do reator (L-1)
VT: Volume total (L-1)
VU: Volume útil (L-1)
X: Concentração ativa das bactérias (mgX.L-1)
Xa: Concentração ativa das bactérias heterotróficas (mgXa.L-1)
Xe: Concentração de resíduo endógeno (mg.L-1)
XF: Concentração de sólidos fixos (mg.L-1)
Xi: Concentração de resíduo inerte (mg.L-1)
Xn: Concentração ativa de bactérias nitrificantes (mgXn.L-1)
Xt: Concentração de lodo (gSTS.L-1)
XV: Concentração de sólidos voláteis (mg.L-1)
Yn: Coeficiente de rendimento das bactérias autotróficas (mgN.L-1.d-1)
1. INTRODUÇÃO ... 25
2. OBJETIVOS ... 27
2.1. Objetivo Geral ... 27
2.2. Objetivos Específicos ... 27
3. REVISÃO DE LITERATURA ... 28
3.1. Caracterização e Tratabilidade do Esgoto Sanitário ... 28
3.1.1. Características dos Esgotos Sanitários ... 28
3.1.2. Tratamento de Esgoto Sanitário ... 29
3.1.2.1. Lodos Ativados ... 30
3.1.2.1.1. Cinética da Remoção de Compostos Orgânicos no Processo de Lodos Ativados ... 35
3.1.2.1.2. Remoção de Compostos Nitrogenados ... 39
3.1.2.1.2.1. Fundamentos da Nitrificação e Desnitrificação ... 39
3.1.2.1.2.2. Cinética da Nitrificação. ... 47
3.1.2.1.2.3. Variação da Alcalinidade nos Processos de Amonificação, Nitrificação e Desnitrificação. ... 53
3.1.2.1.2.4.. Balanço de Massa do Material Nitrogenado ... 55
3.1.2.2. Processos MBBR/IFAS ... 57
3.1.2.2.1. Biomídias ... 65
3.1.2.2.2. Aspectos da Remoção de Material Orgânico e Nitrogenado em Biofilmes. ... 68
3.2. Caracterização e Tratabilidade de Lixiviado de Aterro Sanitário ... 70
3.2.1. Aterros Sanitários ... 70
3.2.1.1. Fatores que Influenciam o Processo de Decomposição da Matéria Orgânica em Aterros Sanitários ... 75
3.2.2. Caracterização de Lixiviado de Aterro Sanitário ... 77
3.2.2.1. Toxicidade de Lixiviado de Aterro Sanitário ... 82
3.2.2.1.1. Conceito de Toxicidade ... 83
3.2.2.1.2. Toxicidade Aguda ... 84
3.2.2.1.3. Toxicidade Crônica ... 85
3.2.2.1.4. Organismos Testes ... 86
3.2.3.1. Processos Físico-Químicos – Coagulação/Floculação ... 90 3.2.3.2. Precipitação Química – Geração de Estruvita ... 91 3.2.3.3. Adsorção em Carvão Ativado. ... 92 3.2.3.4. Tratamento Biológico ... 93 3.3. Co-Tratamento de Lixiviado de Aterro Sanitário com Esgoto Sanitário ... 97 4. MATERIAIS E MÉTODOS ... 101 4.1. Instalação e Configuração das Unidades Experimentais. ... 101 4.2. Descrição das Unidades de Tratamento em Escala Piloto ... 107 4.2.1. Tratamento Primário ... 107 4.2.2. Tratamento Bilógico ... 107 4.3. Lixiviado de Aterro Sanitário Utilizado na Pesquisa. ... 109 4.4. Delineamento Experimental ... 111 4.5. Sistema de Monitoramento ... 114 4.5.1. Monitoramento das Características do Afluente e Efluentes ... 114 4.5.2. Monitoramento das Características dos Lodos dos Reatores Biológicos ... 115 4.5.3. Caracterização da Biomassa Aderida... 116 4.5.4. Respirometria ... 118 4.5.4.1. Testes Respirométricos para Determinação da Atividade de Bactérias
Autotróficas (Nitrificação) ... 122 5. RESULTADOS E DISCUSSÕES ... 126
5.6.2. Balanço de Massa do Material Orgânico. ... 181 5.7. Remoção de Compostos Nitrogenados. ... 182 5.7.1. Avaliação da Remoção de Compostos Nitrogenados ... 182 5.7.1.1. Resultados Referentes a Remoção de NTK ... 182 5.7.1.2. Resultados Referentes à Remoção de Nitrogênio Amoniacal ... 187 5.7.1.3. Resultados Referentes aos Processos de Nitrificação e Desnitrificação ... 191 5.7.1.3.1 Nitrificação ... 191 5.7.1.3.2. Desnitrificação ... 194 5.7.1.3.3. Variação da Alcalinidade nas Etapas de Nitrificação e Desnitrificação ... 197 5.7.1.4. Balanço de Massa do Material Nitrogenado ... 200 5.8 Testes Respirométricos ... 201 5.8.1 Atividade Metabólica das Bactérias Heterotróficas. ... 201 5.8.2 Atividade Metabólica das Bactérias Autotróficas... 204 5.8.2.1. Verificação do Balanço de Massa para Validação do Teste Respirométrico ... 204 5.8.2.2. Determinação das Constantes Cinéticas das Bactérias Autotróficas –
Nitritantes ... 205 5.8.2.3. Determinação das Constantes Cinéticas das Bactérias Autotróficas –
1.
INTRODUÇÃO
O saneamento básico municipal deve ser planejado de forma integrada, envolvendo ações que ultrapassam os limites individuais dos sistemas de abastecimento de água, de esgotamento sanitário ou de limpeza pública. O tratamento de esgoto deve ser concebido de forma a atender não só aos padrões de emissão e de qualidade do corpo receptor, mas tendo também como referência o encaminhamento dos subprodutos gerados. As etapas de tratamento do lodo devem ser definidas com base nas alternativas disponíveis para a utilização ou disposição final. Vários processos de tratamento, aproveitamento ou destinação dos lodos das estações podem ser aplicados conjuntamente com os resíduos sólidos urbanos, como são os casos da co-disposição em aterros sanitários ou incineração. Por outro lado, os aterros produzem líquidos lixiviados de elevada concentração de matéria orgânica e nitrogênio, além de elementos e compostos resistentes ou inibidores da degradação biológica. A sua tratabilidade tem-se demonstrado complexa, quando submetido a tratamento individualmente. Uma alternativa muitas vezes utilizadas é o seu encaminhamento ao sistema de esgoto, a fim de promover um tratamento conjunto.
Há que se destacar que, embora enviar o percolado de aterro para o sistema de esgoto sanitário possa ser uma alternativa viável, há limites práticos para que não ocorram efeitos negativos sobre o tratamento. O processo de lodo ativado, particularmente, possui determinada capacidade para receber tal contribuição ao sistema que, caso venha a ser ultrapassada, poderá haver comprometimento do equilíbrio da floculação biológica do lodo e também da nitrificação do esgoto. A tecnologia dos sistemas MBBR (Moving Bed Biofilm Reactors) na sua concepção híbrida IFAS (Integrated Fixed-film Activated Sludge) pode ser considerado portadora de potencialidades para ser explorada nestas
2. OBJETIVOS
2.1. Objetivo Geral
O objetivo geral do estudo é avaliar a viabilidade do emprego do um processo de lodo ativado convencional e outro híbrido, sob a forma de IFAS (Integrated Fixed-Film Activated Sludge), para a remoção de matéria orgânica e nitrogênio de esgoto sanitário recebendo lixiviado de aterro sanitário.
2.2.Objetivos Específicos
Como objetivos específicos apresentam-se:
Identificar as quantidades de lixiviado de aterro sanitário que podem ser adicionadas ao esgoto sanitário, sem que ocorram prejuízos para a remoção de matéria orgânica e de nitrogênio em sistema de lodo ativado operando na forma convencional e como reator híbrido do tipo IFAS;
Observar o efeito da adição de lixiviado de aterro sanitário sobre a cinética do crescimento biológico e utilização do substrato em sistema de lodo ativado operando na forma convencional e como reator híbrido do tipo IFAS;
3. REVISÃO DE LITERATURA
3.1. Caracterização e Tratabilidade do Esgoto Sanitário
Esgotos Sanitários representam um grande potencial poluidor para o meio ambiente, seu lançamento direto em corpos receptores acarretará em uma série de problemas, tais como: processo de eutrofização em função do excesso de compostos com nitrogênio e fósforo; aumento na demanda por oxigênio dissolvido, que acaba por comprometer a manutenção da vida aquática; introdução de compostos tóxicos, tais como metais pesados, solventes etc..., os quais se acumularão nas cadeias alimentares; entre outros.
Estima-se que no Brasil, boa parte de todo o esgoto sanitário gerado é lançado diretamente em rios, lagos, mananciais ou no mar; observando a Região Metropolitana de São Paulo (RMSP), uma das mais ricas do país, a situação é análoga, causando não só o comprometimento da vida aquática, mas com reflexos diretos e significativos na qualidade de vida da população, seja pela contaminação de manancias de água potável ou através da veiculação hídrica de doenças. Tratar esse resíduo antes do seu lançamento é, acima de tudo, uma questão de Saúde Pública.
3.1.1. Características dos Esgotos Sanitários
Tabela 1: Características físico-químicas dos esgotos
Característica Concentrado Médio Diluído
DBO5,20 (mg.L-1) 400 220 110
DQO (mg.L-1) 1.000 500 250
Carbono Org. Total (mg.L-1) 290 160 80
Nitrogênio total – NTK (mg.L-1) 85 40 20
Nitrogênio Orgânico (mg.L-1) 35 15 08
Nitrogênio Amoniacal (mg.L-1) 50 25 12
Fósforo Total (mg.L-1) 15 08 04
Fósforo Orgânico (mg.L-1) 05 03 01
Fósforo Inorgânico (mg.L-1) 10 05 03
Cloreto (mg.L-1) 100 50 30
Sulfato (mg.L-1) 50 30 20
Óleos e Graxas (mg.L-1) 150 100 50
Sólidos Totais (mg.L-1) 1.200 720 350
Sólidos Dissolvidos (mg.L-1) 850 500 250
Sólidos em Suspensão Totais (mg.L-1) 350 220 100
Sólidos Sedimentáveis (mL.L-1) 20 10 05
Extraído de: Metcalf & Eddy (2014)
Os esgotos sanitários possuem excesso de nitrogênio e fósforo. Isto faz com que, ao serem submetido a tratamento biológico, haverá incorporação desses macronutrientes nas células que tomam parte do sistema, mas o excesso deverá ser ainda grande. Esta é uma importante preocupação em termos de tratamento de esgotos, exigindo tratamento avançado quando se tem lançamento em situações mais restritivas, sobretudo em represas utilizadas para o abastecimento público de água potável, onde o problema da eutrofização poderá ter consequências drásticas.
3.1.2. Tratamento de Esgoto Sanitário
não são empregados por resultarem em maiores custos operacional e menor eficiência na remoção de matéria orgânica biodegradável. Porém, em algumas situações, notadamente quando se tem condições bastante restritivas para as descargas de fósforo, o tratamento físico-químico pode ser aplicado isoladamente ou, principalmente, associado aos processos biológicos.
A seguir serão detalhados os processos de tratamento biológicos empregados nesse trabalho.
3.1.2.1. Lodos Ativados
O processo de lodos ativados se desenvolve em substrato complexo e com reciclagem de células. O esgoto sanitário após tratamento preliminar é encaminhado ao tanque de aeração onde uma massa de microrganismos é responsável pela degradação da matéria orgânica complexa presente nesse despejo.
Podem-se conceber duas formas de operação: um modo de fluxo contínuo e outra em sistema de bateladas sequenciais (SBR).
O sistema SBR é composto, em geral, por quatro etapas, ou ciclos de operação: enchimento, reação, sedimentação e descarte do efluente tratado (VAN HAANDEL e MARAIS, 1999; JORDÃO e PESSOA, 2005). Tal configuração é ideal para o processo de nitrificação-desnitrificação, uma vez que proporciona um regime de operação compatível com a nitrificação e a oxidação da matéria orgânica de forma simultânea (RENOU et al.,2007).
Figura 1 - - Microrganismos típicos de Lodos Ativados: (1) Colônia de Protozoários Penduculados; (2) Tardígrado; (3) Protozoário predador de floco; (4) Rotíferos.
(1) (2)
(3) (4)
De uma forma geral, as reações que ocorrem no interior dos tanques de aeração do processo de lodos ativados podem ser resumidas da seguinte forma:
Remoção inicial de sólidos em suspensão e sólidos em estado coloidal por aglomeração física, floculação e por adsorção dentro do floco biológico. A fração orgânica é, então, biodegradada por processos biológicos aeróbios;
Quando em condições ambientais adequadas (tempo de residência celular, temperatura, concentração de oxigênio dissolvido etc...), ocorrerá processos de Nitrificação.
Dessa forma, o grupo de microrganismos presentes no lodo é um dos grandes responsáveis pelo êxito ou falência do tratamento biológico aeróbio empregado.
Tais microrganismos desempenham nos reatores biológicos o mesmo papel que desempenham no seu habitat natural, com a diferença de que as condições naturais (temperatura, pH, oxigênio dissolvido, substrato etc...) tornam-se variáveis passíveis de serem controladas, visando a criação de um ambiente propício aos objetivos que se quer atingir.
Dentro dos tanques, forma-se, então o floco biológico, uma estrutura heterogênea, formada por duas parcelas: o componente biológico, caracterizado pela diversidade de microrganismos presentes no lodo, e o não biológico, formado por partículas orgânicas e inorgânicas, bem como material inerte, todos oriundos da água residuária (JENKINS, RICHARD e DAIGGER, 1993). A Figura 2 ilustra os flocos biológicos formados no interior do tanque de aeração.
Segundo LA RIVIÉRE (1977) apud VON SPERLING (1996), o tamanho do floco é regulado pelo balanço entre as forças de coesão e a tensão de cisalhamento causada pela aeração superficial e agitação. BARBUSINSKI e KOSCIELNIAK (1995) relacionam o tamanho do floco, sua distribuição, densidade, porosidade, velocidade de sedimentação como parâmetros indicadores da eficiência do processo de floculação.
SEZGIN et al (1978) apud JENKINS, RICHARD e DAIGGER (1993), relata a existência de duas estruturas presentes no floco biológico:
Macroestrutura: formada por bactérias do tipo filamentosa, são consideradas a coluna dorsal do floco, exercendo a função de matriz estrutural, na qual as bactérias formadoras de floco se aderem.
Figura 2 - Microfotografia do Floco Biológico
Existem entre essas bactérias diferenças marcantes em relação à cinética de crescimento. CHUDOBA et al (1973) apud CENENS, SMETS e IMPE (2000) explicaram que há uma diferença entre as constantes de meia saturação (ks) e valor
máximo da taxa de crescimento específica (μmax).
De acordo com o autor e sua equipe, aplicando-se o modelo de Monod, as bactérias filamentosas apresentam um baixo ks e um baixo μmax, portanto, um meio com baixa
concentração de substrato é mais viável ao seu desenvolvimento, ao contrário do que ocorre com as bactérias formadoras de floco.
Dessa forma, manipulando-se a concentração de substrato é possível controlar o crescimento desses grupos de bactérias, de forma o obter um floco biológico de bom tamanho e consistência.
Segundo HORAN (1990) apud VON SPERLING (1996), é necessário um balanço entre a população de bactérias formadoras de floco e filamentosas para que a biomassa gerada tenha boas características de remoção de matéria orgânica e de sedimentabilidade.
circunstâncias, a estabilização e/ou remoção de compostos nitrogenados, por meio da Nitrificação/Desnitrificação, o qual será detalhado mais adiante.
O processo de lodos ativados convencional é composto das seguintes etapas:
Tratamento preliminar: gradeamento e desarenação;
Decantadores primários;
Tanques de aeração;
Decantadores secundários;
Adensadores de lodo;
Digestores de lodo;
Sistema de desidratação de lodo.
A Figura3 ilustra essas unidades operacionais presentes no processo de lodos ativados.
Figura 3 - Esquema de um Sistema Convencional de Lodos Ativados
Grade de areia Caixa Decantador
Prim á rio
Tanque de aeração
Decantador Secundário
Adensamento
Digestão
Secagem Lodo “ Seco ”
Rio Água
3.1.2.1.1. Cinética da Remoção de Compostos Orgânicos no Processo de Lodos Ativados
O material orgânico presente no esgoto sanitário pode ser classificado, genericamente, em duas frações:
Biodegradável: que pode ser metabolizado pelos microrganismos;
Não biodegradável: que não é utilizado pelos microrganismos.
O material orgânico biodegradável pode ainda ser dividido em dissolvido, o qual é rapidamente utilizado, e particulado, que é lentamente utilizado pelos microrganismos. A Figura 4 ilustra essa divisão da matéria orgânica no esgoto.
Figura 4 - Frações de material orgânico presente no esgoto
Nos sistemas de tratamento biológico aeróbio, o substrato orgânico biodegradável é metabolizado por bactérias heterotróficas por meio da respiração celular, gerando energia e síntese de novas células.
Dessa forma, em um sistema de lodos ativados, o lodo biológico é composto por duas frações (MARAIS e EKAMA, 1976 apud PORTO, 2007):
hidráulica etc.. (VAN HAANDEL e MARAIS, 1999). A Concentração de lodo ativo (Xa) pode ser obtida tal qual descreve a Equação (1).
Equação (1)
Onde:
Y = coeficiente de rendimento das heterotróficas (0,45mgXa*mgDQO-1);
Sta = concentração de DQO no afluente (mg.L-1);
bh = constante de decaimento do lodo ativo (mgDQO.mgSSV-1);
Rs = Idade do lodo (d-1);
Rh = tempo de permanência do líquido (d-1).
A constante bh sofre influência da temperatura, portanto, deve ser corrigida
usando o fator: 0,24*(1,04)t-20.
Ressalta-se que a variável Xa pode ser obtida, também, mediante o emprego da
determinação da taxa de consumo de oxigênio (TCO), como descreve a Equação (2).
Equação (2)
Sendo que:
TCOend = taxa de consumo de oxigênio na fase endógena (mgO2.L-1.h-1);
fcv = fator de conversão de DQO para material ativo heterotrófico
(1,5mgDQO.mgSSV-1);
f = fração de lodo ativo que permanece como resíduo endógeno (adotado: 0,2).
Lodo inativo: material orgânico não biodegradável formado pelo lodo inerte e resíduo endógeno.
A cinética de utilização do material orgânico presente no esgoto doméstico pode ser descrito pelo modelo proposto por Monod, onde se deduz que a taxa de utilização de substrato corresponde à velocidade com que os processos oxidativos e de síntese ocorrem em sistemas de lodos ativados.
de primeira ordem em função do consumo de substrato; situações em que o substrato não é limitante, o valor de µ é igual à µmáx, ou seja, o microrganismo cresce na máxima
taxa específica (METCAL & EDDY, 2004). A Equação (15) ilustra a cinética proposta por Monod.
Equação (3)
Onde:
µ = taxa de crescimento dos microrganismos (d-1);
µmax = taxa máxima de crescimento dos microrganismos (d -1);;
S = concentração de substrato (mg.L-1); Ks = constante de meia saturação (mg.L-1).
Partindo-se do pressuposto que o crescimento bacteriano ocorre em função da disponibilidade de material orgânico, e que quando a quantidade de substrato é máxima, de modo a não limitar o metabolismo dos microrganismos (S>>Ks), pode-se considerar
que a taxa de crescimento específica (µm) é igual ao valor da taxa específica máxima de
crescimento (µmax) (VAN HAANDEL e MARAIS, 1999). A Equação (4) descreve esse
fenômeno.
Equação (4)
Sendo que:
Y = coeficiente de rendimento das bactérias heterotróficas (0,45mgXa*mgDQO-1);
rmáx: taxa de utilização máxima do material carbonáceo (mgDQO.mgXa-1.d-1).
A taxa de utilização máxima do material carbonáceo (rmax) pode ser obtida mediante a
determinação da taxa de utilização de oxigênio relativo à fase exógena, levando-se em conta que a DQO oxidada é equivalente a 1/3 dos compostos orgânicos presentes, como demonstra a Equação (5).
TCOexo: taxa de consumo de oxigênio exógena (mgO2.L-1.h-1).
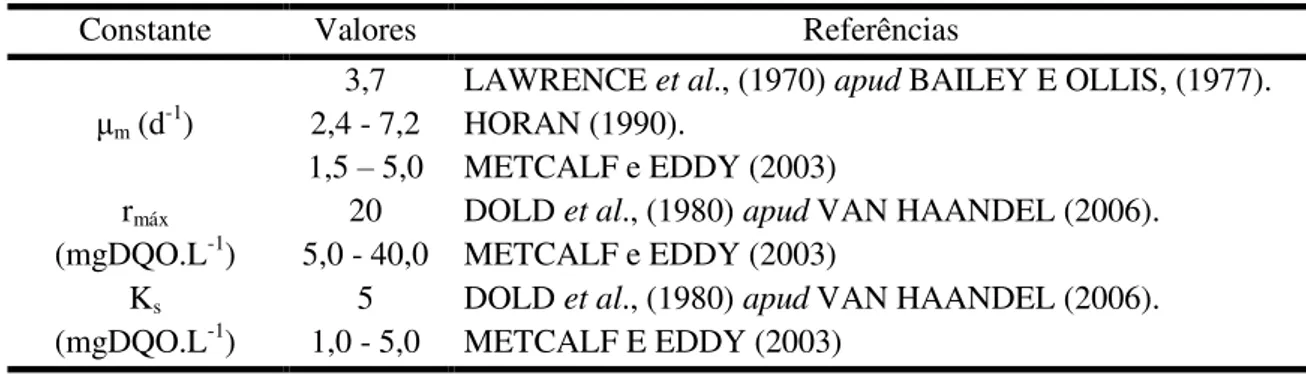
Na Tabela 2 são apresentados valores típicos das constantes cinéticas envolvidas na degradação de compostos orgânicos.
Tabela 2 - Valores de referência das constantes cinéticas de utilização de material orgânico
Constante Valores Referências
μm (d-1)
3,7 LAWRENCE et al., (1970) apud BAILEY E OLLIS, (1977).
2,4 - 7,2 HORAN (1990).
1,5 – 5,0 METCALF e EDDY (2003) rmáx
(mgDQO.L-1)
20 DOLD et al., (1980) apud VAN HAANDEL (2006).
5,0 - 40,0 METCALF e EDDY (2003) Ks
(mgDQO.L-1)
5 DOLD et al., (1980) apud VAN HAANDEL (2006).
1,0 - 5,0 METCALF E EDDY (2003)
Fonte: VAN HAANDEL e MARAIS, 1999; METCALF & EDDY, 2004 (adaptado).
3.1.2.1.1.1. Balanço de Massa dos Compostos Orgânicos
Em um processo de lodos ativados, uma fração do material orgânico presente no afluente (mSta), em termos de DQO, que entra no sistema será oxidada (mSo), outra será
transformada em lodo de excesso (mSxv); e a fração restante será descarregada
juntamente com o efluente (mSte).
O balanço de massa dos compostos orgânicos (BO), em termos de DQO, em um sistema
de Lodos ativados pode ser obtido pela soma das frações envolvidas nas transformações ocorridas com esses compostos, e pode ser descrito pela Equação (6). Segundo VAN HAANDEL e MARAIS (1999), quando Bo = 1, o sistema está sob condições de carga
orgânica constante, e que, portanto, os procedimentos analíticos são confiáveis.
Equação (6)
Onde:
MSta: fluxo de DQO afluente (mgDQO.d-1)
MSte: fluxo de DQO efluente (mgDQO.d-1)
MSxv: fluxo de DQO que sai no lodo de excesso (mgDQO.d-1)
Os fluxos dessas massas de DQO podem ser determinados pelas Equações de (7) a (9).
Equação (7)
Equação (8)
Equação (9)
Sendo que:
Ste = DQO efluente (mg.L-1);
Sta = DQO afluente (mg.L-1);
q = Volume de liquor misto a ser descartado (L.d-1);
TCOc = taxa de consumo de oxigênio referente ao consumo do material carbonáceo
(mgO2.L-1.h-1).
3.1.2.1.2. Remoção de Compostos Nitrogenados
3.1.2.1.2.1. Fundamentos da Nitrificação e Desnitrificação
O nitrogênio orgânico proveniente do esgoto sanitário é transformado em nitrogênio amoniacal através da atividade de microrganismos heterotróficos, em um processo conhecido por Amonificação. A Equação (10) representa a estequiometria dessa reação. R-NH2 + H2O + H+ R-OH- + NH4+ Equação (10)
SILVA FILHO (2009) comenta que esse processo pode ocorrer na própria rede coletora de esgoto, em sistemas com tratamento primário ou em reatores anaeróbios, nos quais boa parte dos compostos nitrogenados é convertida a NH4+ e NH3.
Nitrificação é o termo empregado para descrever o processo biológico de remoção de compostos nitrogenados desenvolvido em dois estágios, onde, primeiramente, a amônia (NH4+) é oxidada a nitrito (NO2-) e, em seguida, o nitrito formado é oxidado a nitrato
Em estações de tratamento, o processo de amonificação é sempre uma etapa limitante da nitrificação, sendo que a principal fonte de nitrogênio orgânico é a ureia presente no esgoto sanitário (SILVA FILHO, 2009).
A necessidade da ocorrência do processo de nitrificação no tratamento de esgoto deve-se, sobretudo, aos seguintes fatores:
Toxicidade da amônia à biota aquática;
Consumo de OD no corpo d’água devido às reações do processo de nitrificação;
Ocorrência de eutrofização;
Toxicidade do nitrato relativa à metemoglobinemia e à possível formação de nitrosaminas, com conhecido efeito carcinogênico.
Durante o primeiro estágio da nitrificação, bactérias autotróficas principalmente do gênero Nitrosomonas, serão as responsáveis pela conversão da amônia a nitrito, sendo conhecidas como Bactérias que Oxidam Amônia – BOA; já no segundo estágio do processo, bactérias autotróficas do gênero Nitrobacter, transformaram o nitrito em nitrato, sendo conhecidas por Bactérias que Oxidam Nitrito – BON (DEZOTTI et al.,2011; SILVA FILHO, 2009; US. EPA, 2009; METCAL & EDDY, 2004).
As reações envolvidas nessas conversões estão descritas nas Equações de 11 a 13 (WEF MOP no.11, 2008).
Geração de nitrito
NH+4 + 1,5 O2→NO-2 + H2O + 2H+ Equação (11)
Geração de nitrato
NO-2 + 0,5O2→NO-3 Equação (12)
Reação global
NH+4 + 2O2→NO-3 + H2O + 2H+ Equação (13)
Tanto o grupo de BOA como de BON são autotróficas e utilizam carbono inorgânico (CO2) para síntese celular; são igualmente quimiolitotróficas uma vez que obtém
Em geral, a etapa de nitratação é mais rápida que a de nitritação, ocasionando um consumo quase imediato do nitrito formado, dessa forma, em sistemas sob condições estacionárias, a concentração desse íon será muito baixa (VAN HAANDEL e MARAIS, 1999). A Figura 5 ilustra os processos oxidativos observados na nitrificação/desnitrificação.
Figura 5 - Variação do número de oxidação do nitrogênio durante a nitrificação
Extraído de: VAN HAANDEL e MARAIS, 1999.
Em ambos os estágios da nitrificação haverá o consumo de oxigênio, caracterizando o processo como aeróbio obrigatório.
Tendo como base a reação global descrita na Equação (13), estequiometricamente são necessários 4,57 gO2.gN-1 oxidado para se completar a processo, sendo que 3,43 gO2
serão destinados ao primeiro estágio, e 1,14 gO2, para o segundo estágio (US. EPA,
2009; METCALF & EDDY, 2014). Vários autores indicam a necessidade de manter a concentração de OD superior a 2 mgO2.L-1 a fim de não comprometer a eficiência do
processo (DEZOTTI, 2011; BUENO, 2011; da COSTA, 1999 apud CAMPOS, 2003;), contudo, pesquisas recentes com diferentes arranjos nos sistemas de Lodos ativados, confirmam que é possível obter eficientes taxas de nitrificação com concentrações de OD na faixa de 0,3 a 0,8 mgO2.L-1 (BUENO, 2011).
Equação (14) Onde:
OD = concentração de Oxigênio Dissolvido (mg.L-1) Ko = coeficiente de saturação para o oxigênio (mg.L-1).
O pH do conteúdo do reator tem importante efeito sobre a taxa de nitrificação, sendo que os valores ótimos estão situados na faixa de pH de 7,2 a 8,0 ( DOWNING, 1978 apud BUENO, 2011; METCALF & EDDY, 2004).
Durante a primeira etapa da nitrificação ocorre a formação do íon H+, o que pode produzir uma queda no pH do meio em função do consumo da alcalinidade disponível, podendo provocar inibição ou até mesmo interrupção total do processo (da COSTA, 1999 apud CAMPOS, 2003). A Figura 6 ilustra o comportamento da nitrificação em função da variação do pH.
Figura 6 - Influência do pH na taxa de nitrificação
Extraído de: Ferreira, 2000
De acordo com a Figura 6, valores abaixo de pH 7,2 tendem a afetar significativamente o µmax das nitrificantes. Essa relação pode ser descrita pela Equação (15).
Equação (15)
Sendo que:
µmax(pH) = taxa de crescimento máxima das bactérias nitrificantes para um dado pH (d-1);
Observando a reação global da nitrificação (Equação 14), a geração dos dois mols de H+ causam, estequiometricamente, uma demanda de 1 mol de alcalinidade – expressa em termos de CaCO3– resultando na relação de 7,14 gCaCO3/gN-NH4+ (WEF MOP no. 11,
2011; US. EPA, 2009; METCALF & EDDY, 2004).
De acordo com VAN HAANDEL e MARAIS (1999), quando o meio conta com uma alcalinidade total superior a 35 mgCaCO3.L-1, o pH não varia significativamente.
A reação de nitrificação pode ser reescrita levando-se em conta o consumo de alcalinidade, como demonstra a Equação (16).
NH4+ + 2O2 + 2HCO3- NO3- + 2CO2 + 3H2O Equação (16)
A temperatura também terá uma grande influência no rendimento da nitrificação; de acordo com VON SPERLING (2002) apud BUENO (2011), para cada 7º C acrescidos na temperatura, a taxa de crescimento das bactérias nitrificantes dobra e, em situação inversa, a queda de 7º C implica na redução da nitrificação pela metade.
O processo de nitrificação ocorre, preferencialmente, numa faixa de temperatura 25º C a 40º C, sendo que a temperatura ótima para as Nitrossomonas é de 35º C e de 35 a 42º C para as Nitrobacter (DEZOTTI et al.,2011; SILVA FILHO, 2009).
De acordo com DOWNING et al (1978), o efeito da temperatura sobre o µmax pode ser
descrito pela Equação (17).
Equação (17)
Onde:
µmax = taxa de crescimento máxima a uma temperatura T (d-1);
θ = coeficiente de temperatura (coeficiente de Arrehnius);
T = temperatura (oC).
O valor da constante de Arrehnius (θ) referente ao µmax das nitrificantes varia entre 1,11
Tabela 3 - Valores do coeficiente de Arrehnius (θ) em função da temperatura
Θ Intervalo (oC) Referência
1,116 19-21 GUJER (1977)
1,123 15-20 DOWNING et al (1978)
1,123 14-20 EKAMA & MARAIS (1976)
1,13 30-30 LIJKELMA (1973)
Extraído de: VAN HAANDEL & MARIS (1999) – adaptado.
Com base nessas observações, pode-se dizer que para cada grama de amônia oxidada são necessários: 4,25 gO2; 7,14g de alcalinidade; 0,08g de carbono inorgânico, o que
resultara na formação de 0,16g de novas células (METCALF & EDDY, 2014).
As bactérias envolvidas no processo de nitrificação apresentam taxa de crescimento celular muito baixa, sobretudo, quando comparada com a de bactérias heterotróficas; em média, a taxa máxima de crescimento das bactérias nitrificantes pode ser de 10 a 20 vezes menores que das heterotróficas carbonáceas (DEZOTTI et al.,2011; US. EPA, 2009).
Figura 7 - Relação entre taxa de nitrificação e TRS
Extraído de: FERREIRA, 2000.
As bactérias nitrificantes são sensíveis a uma grande variedade de compostos orgânicos e inorgânicos, sendo aproximadamente 10 vezes mais sensível que a biomassa heterotrófica carbonácea (JUIASTUTI et al.,2003 apud DEZOTTI et al.,2001; METCALF & EDDY, 2004).
Entre os principais fatores que exercem influência inibitória na taxa de nitrificação, estão: solventes orgânicos, metais pesados, alta salinidade, uma grande variedade de compostos orgânicos e, inclusive, a presença de amônia não-ionizada ou amônia livre (NH3) e ácido nitroso, podem causar inibição do processo dependendo das condições de
temperatura e pH do reator (DEZOTTI et al.,2011; METCAL & EDDY, 2004). A Tabela 4 apresenta alguns valores desses elementos com potencial inibitório.
Tabela 4 - Níveis inibitórios de amônia livre e ácido nitroso para o processo de nitrificação em pH 7 a 20º C.
Composto Concentração inibitória
Amônia livre 10 mg.L
-1 inibe Nitrossomona
0,1 mg.L-1 inibe Nitrobacter
Ácido nitroso livre 0,22 mg.L-1 inibe Nitrificação
No que concerne à desnitrificação, etapa subsequente à nitrificação na remoção biológica do nitrogênio, trata-se de um processo biológico no qual bactérias anaeróbias facultativas reduzem o nitrato ou nitrito a nitrogênio molecular (DEZOTTI et al.,2011). A redução do íon nitrato gerado na nitrificação segue uma série de produtos intermediários, como: nitrito, óxido nítrico e óxido nitroso até chegar ao nitrogênio molecular (US. EPA, 2010). A Equação (18) ilustra essa sequência.
NO3- NO2- NO N2O N2 Equação (18)
Compostos orgânicos solúveis presentes no afluente são consumidos durante a desnitrificação, sendo que os microrganismos atuantes no processo usaram os íons nitrato ou nitrito como aceptores finais de elétrons, de forma que para que o fenômeno ocorra, faz-se necessário a existência de uma câmara com características anóxicas (US.EPA, 2010).
Em geral, estima-se que são necessários cerca de 4g de DBO afluente por grama de nitrato, para completar-se a reação (TCHOBANOGLOUS, 2003 apud US.EPA, 2009).
As reações de desnitrificação podem variar segundo o tipo de substrato introduzido na câmara anóxica, as reações representadas pelas Equações de (19) a (22) ilustram suas respectivas estequiometrias (US. EPA, 2010; METCAL & EDDY, 2004).
Substrato: Esgoto sanitário.
C10H19O3N + 10NO3- 5N2 + 10CO2 + 3H2O + NH3 + 10OH- Equação(19)
Substrato: Metanol.
5CH3OH + 6NO3- 3N2 + 5CO2 + 7H2O + 6OH- Equação (20)
Substrato: Etanol.
5CH3CH2OH + 12NO3- 6N2 + 10CO2 + 9H2O + 10OH- Equação (21)
Substrato: Acetato.
5CH3COOH + 8NO3- 4N2 + 10CO2 + 6H2O + 8OH- Equação (22)
Em todas essas reações, 1 mol de alcalinidade devido a hidroxilas será produzido por cada mol de nitrato consumido, gerando, em termos de CaCO3 o equivalente a 3,57mg
Como efeito da produção de alcalinidade e consequente diminuição do ácido carbônico, observa-se a tendência da desnitrificação reverter parcialmente os efeitos da nitrificação e, portanto, elevar o pH do tanque de aeração (FERREIRA, 2000).
Resumidamente, a Tabela 5 compara valores típicos para alguns parâmetros importantes nos processos de nitrificação e desnitrificação.
Tabela 5 - Comparação entre bactérias nitrificantes e desnitrificantes
Parâmetros
Nitrificação Desnitrificação
Nitrossomonas Nitrobacter
Fonte de Carbono Carbono inorgânico (CO2)
Carbono inorgânico (CO2)
Carbono orgânico
Formato da célula Cocos Bacilos
Tamanho da célula 1,0 – 1,5µm 0,5 – 1,0µm
Necessidade de O2 Aeróbio Aeróbio Anaeróbio facultativo
pH ótimo 5,8 – 8,5 6,5 – 8,5 6,5 – 8,5
Tempo de crescimento 8 – 36h 12 – 60h 0,25 – 0,5h Temperatura ótima 5 – 30º C 5 – 40º C
Extraído de: WIESMANN et al (2007).
3.1.2.1.2.2. Cinética da Nitrificação.
Como demonstrado na seção anterior, o processo de nitrificação ocorre em duas etapas, contudo, diversos autores têm demonstrado que a etapa de nitritação é a mais importante, uma vez que a segunda, a nitratação, ocorre instantaneamente (VAN HAANDEL e MARAIS, 1999).
Segundo DOWNING et al (1978), é possível aplicar a equação de Monod para explicar o crescimento das bactérias nitrificantes.
De acordo com a equação de Monod (Equação 3), a constante µ representa o crescimento bruto dos microrganismos por unidade de tempo, tendo um comportamento de primeira ordem em função do consumo de substrato; situações em que o substrato não é limitante, o valor de µ é igual à µmáx, ou seja, o microrganismo cresce na máxima
taxa específica (METCAL & EDDY, 2004).
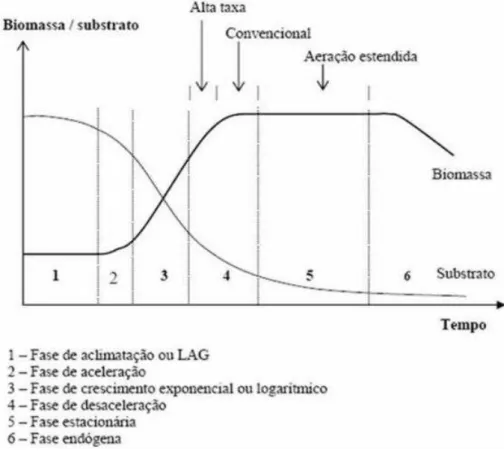
orgânicas, a fim de manter o crescimento da biomassa na fase estacionária. A Figura 8 ilustra o comportamento do crescimento microbiano e do uso do substrato e do tempo.
Figura 8 - Curva de crescimento microbiano e uso do substrato em função do tempo
Extraído: SILVA FILHO, 2009.
A afinidade dos microrganismos em relação a um dado substrato é indicado pela constante de meia saturação, Ks, a qual é obtida quando µ é igual à ½ µmáx. Desse modo
que quanto maior o valor de Ks, menor será o µmáx e a afinidade entre microrganismos
com o substrato.
Equação (23)
Onde:
Equação (24)
Equação (25)
Equação (26)
Equação (27)
= taxa de crescimento de lodo autotrófico (mgSSV.L-1.d-1);
=
taxa de crescimento das bactérias nitrificantes (mgSSV.L-1.d-1);= taxa de decaimento das bactérias nitrificantes (mgSSV.L-1.d-1);
= taxa de descarga de lodo de excesso (mgSSV.L-1.d-1).
Sendo que:
rn = taxa de nitrificação (mgN.L-1.d-1);
µ = taxa específica de crescimento das autotróficas (d-1);
µmax = taxa específica máxima de crescimento das autotróficas (d-1);
bn = constante de decaimento das bactérias autotróficas (d-1);
Kn = constante de meia saturação de Monod (mgN.L-1);
Yn = coeficiente de rendimento das autotróficas (mgN.L-1.d-1);
Rs = idade do lodo do sistema (d);
Xn = concentração de bactérias nitrificantes no reator (mg.L-1).
Rearranjando a Equação (27), tem-se: