ANA PAULA LIMA PERDIGÃO
COMPÓSITO DE HIDROXIAPATITA, FIBROÍNA DA SEDA E ÁCIDO HIALURÔNICO EM DEFEITOS ÓSSEOS EXPERIMENTAIS NA ULNA DE
COELHOS
Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Medicina Veterinária, para obtenção do título de Magister Scientiae.
VIÇOSA
ii AGRADECIMENTOS
Os meus agradecimentos iniciais não poderiam ser para outro senão à Deus que me permitiu estar presente, com saúde e perseverança para a realização dessa pesquisa durante esses dois anos de dedicação.
Dedico esse trabalho aos meus pais, Marcelo e Neuza, pela confiança apoio e amor incondicional, e pela oportunidade de me permitirem lutar pelo meu crescimento profissional, mesmo estando longe, e com todas as nossas dificuldades. Vocês são a base e meu alicerce para toda a vida. Obrigada por estarem sempre ao meu lado, compartilhando momentos de alegrias e de tristezas. Sem vocês eu definitivamente não chegaria aonde cheguei hoje.
Agradeço ao meu irmão Fabrício, por todo companheirismo e principalmente por ser aquele presente na vida da mamãe, todo esse tempo que estive fora de casa e também aos meus irmãos Cristiano e Marcelinho, que mesmo de longe sinto o apoio e a confiança depositada em mim.
Ao meu namorado, Fúlvio, que nesses anos separados pela distância, se manteve presente acima de tudo na minha vida, nunca deixando de acreditar nos meus sonhos, estando sempre ao meu lado em todos os momentos.
À minha orientadora Andréa, que pra mim é como uma mãe que tive em Viçosa. Obrigada pelos ensinamentos, conselhos, paciência e confiança durante todos esses anos de estudos. Seu incentivo e dedicação foram essenciais para o meu crescimento durante toda essa jornada.
Ao Fabrício, uma fonte inesgotável de bondade, paciência e dedicação. Exemplo de profissional dedicado, amigo, conselheiro, companheiro de gordices, agradeço por todo o incentivo e cuidado.
À Professora Emily, que com sua serenidade, paciência e experiência me orientou e me ajudou nesses estudos, sempre me auxiliando nos momentos mais críticos.
iii Às minhas amigas Lê e Tay e Naty, por me oferecerem um lar e ainda sim aguentarem minhas crises de mau humor matinal, e nunca me deixarem desistir, mesmo nos momentos mais difíceis. Amo muito vocês.
Livão, minha irmã mais velha abençoada, que sempre acreditou em mim e mesmo de longe se fez presente para me ouvir e aconselhar.
Às minhas amigas Mo, Nike, Paulistinha, Alice, Fer. Obrigado por encherem parte desse tempo com muitas risadas e companherismo.
Aos meus amigos de infância, Paty, Mari, Luis, Jesus, Babi, Cela, Grampo, que mesmo todo esse tempo longe, também acompanharam de perto essa trajetória, não permitindo em nenhum momento que essa distancia atrapalhasse nossa amizade que perdura a mais de 15 anos.
Aos colegas de pós graduação Rodrigo, Fernando, Dayana, Gustavo, João, Flávia, Luciana e todos os estagiários, por me ajudarem, nos momentos mais críticos de cirurgia e correria nos estudos. Obrigado pela força e dedicação.
À todos os funcionários do Departamento de Veterinária pelo apoio e pela amizade ao longo desse tempo: Maninha, Tatinha, Adão, Claudio, Luis Paulo, Fran. Um agradecimento em especial à Carmem, que se tornou uma grande amiga.
Ao Departamento de Solos, através do Laboratório de Mineralogia da UFV, pelo auxilio na realização da difração de raios-X.
Ao professor José Martins, da Universidade de Sorocaba, por permitir e auxiliar as análises pela microtomografia computadorizada em seu laboratório.
Ao Núcleo de Microscopia e Microanálise da UFV, e ao Professor Renê do departamento de Física, pelo auxílio na realização das análises de microscopia eletrônica.
À UFV por todo o ensinamento e aprendizado adquirido nesses sete anos de estudos e à CAPES pela concessão da bolsa.
À Professora Doutora Sheyla Maria Castro Máximo, ao seu laboratório JHS Laboratório Químico Ltda e ao professor Sergio Yoshioka pelas orientações e fornecimento dos compósitos.
iv SUMÁRIO
LISTA DE FIGURAS... vi
LISTA DE TABELAS... viii
RESUMO ... ix
ABSTRACT ... xi
CAPÍTULO 1 – Engenharia tecidual óssea e os biomateriais: caracterização, aplicação e perspectivas... 1
RESUMO... 1
ABSTRACT... ...,... 2
1. INTRODUÇÃO... 3
2. ENGENHARIA TECIDUAL ÓSSEA...3
3. HIDROXIAPATITA... 6
4. FIBROÍNA DA SEDA... 8
5. ÁCIDO HIALURÔNICO... 9
6. CONSIDERAÇOES FINAIS... 11
7. REFERENCIAS BIBLIOGRÁFICAS... 13
CAPITULO II– Caracterização in vitro e análise de biocompatibilidade in vivo do compósito formado por hidroxiapatita, fibroína da seda e ácido hialurônico...22
RESUMO... 22
ABSTRACT ... 23
1. INTRODUÇÃO... 24
2. MATERIAL E MÉTODOS...25
2.1. Biomaterial...25
2.2. Difração de raios X...25
2.3. Microscopia Eletrônica de Varredura (MEV)... ... 26
v
3. RESULTADOS E DISCUSSÃO...28
4. CONCLUSÕES...40
5. REFERÊNCIAS BIBLIOGRÁFICAS...40
CAPITULO III - Compósitos de hidroxiapatita, fibroína da seda e ácido hialurônico no tratamento de defeitos ósseos experimentais: aspectos clínicos, radiográficos, microtomográficos e histológicos...44
RESUMO...44
ABSTRACT...45
1. INTRODUÇÃO...46
2. MATERIAL E MÉTODOS...47
2.1. Biomaterial...47
2.2. Modelo experimental...47
2.3. Procedimento cirúrgico...48
2.4. Pós- operatório...49
2.5. Exame clínico...50
2.6. Exame radiográfico...50
2.7. Tomografia microcomputadorizad...53
2.8. Microscopia eletrônica de varredura (MEV...53
2.9. Avaliação histológica e histomorfométrica...54
3. RESULTADOS E DISCUSSÃO...54
3.1. Exame clínico...54
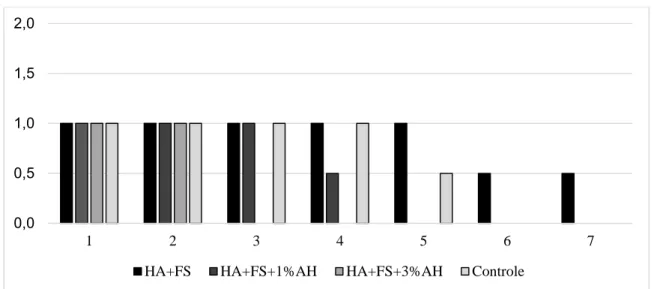
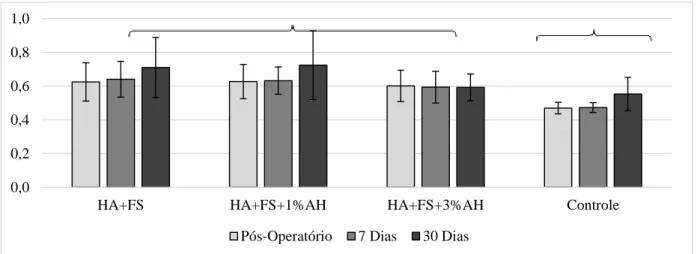
3.2. Avaliação radiográfica...58
3.3. Tomografia microcomputadorizada...63
3.4. Microscopia eletrônica de varredura (MEV)...66
3.5. Avaliação histológica e histomorfométrica...68
4. CONCLUSÕES...76
vi LISTA DE FIGURAS
CAPÍTULO II - CARACTERIZAÇÃO IN VITRO E ANÁLISE DE BIOCOMPATIBILIDADE IN VIVO DO COMPÓSITO FORMADO POR
HIDROXIAPATITA, FIBROÍNA DA SEDA E ÁCIDO
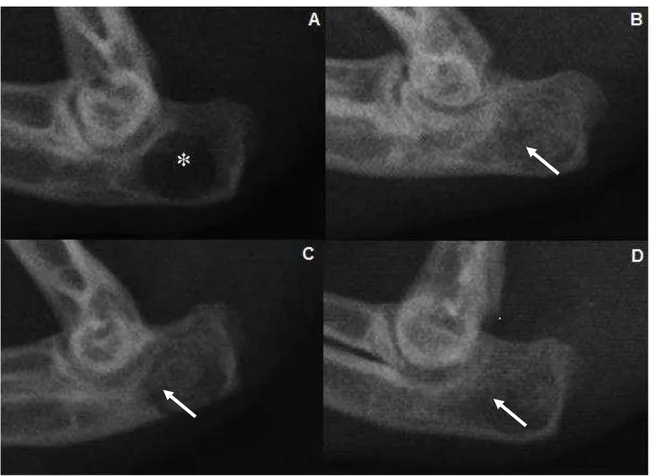
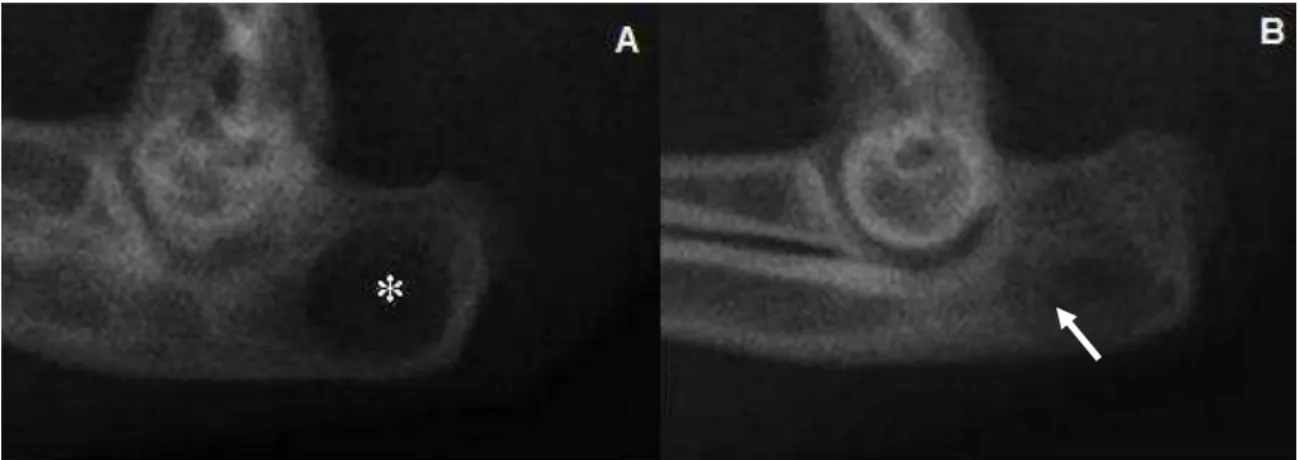
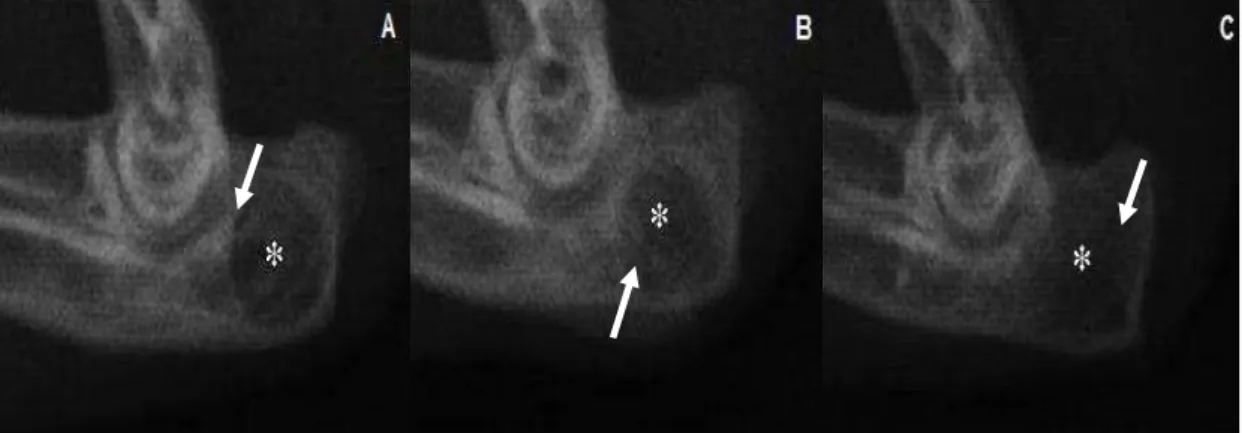
vii Figura 6 - Radiografias mediolaterais do olecrano de coelho submetido à realização de defeito na cortical lateral e implantação de compósitos no pós-operatório imediato...59 Figura 7 - Radiografias mediolaterais do olecrano de coelho submetido à realização de defeito na cortical lateral e implantação de compósitos aos 7 dias após a cirurgia...60 Figura 8 - Radiografias mediolaterais do olecrano de coelho submetido à realização de defeito na cortical lateral referentes ao grupo controle (sem tratamento) aos 30 dias após a cirurgia...61 Figura 9 - Radiografias mediolaterais do olecrano de coelho submetido à realização de defeito na cortical lateral e implantação de compósitos, aos 30 dias após a cirurgia...62 Figura 10 - Representação gráfica das médias e desvios-padrão obtidos na análise radiográfica dos olecranos dos animais tratados e não tratados...63 Figura 11 - Reconstrução em três dimensões das imagens tomográficas das amostras de tecido ósseo retirado do olecrano dos coelhos...65 Figura 12 - Imagem obtida por microscopia eletrônica de varredura pela técnica de retrodispersão referente ao grupo tratado com o compósito hidroxiapatita e fibroína da seda, após 30 dias de cirurgia...66 Figura 13 - Imagem obtida por microscopia eletrônica de varredura pela técnica de retrodispersão referente ao grupo tratado com o compósito hidroxiapatita, fibroína da seda e 1% de ácido hialurônico, após 30 dias de cirurgia...67 Figura 14 - Imagem obtida por microscopia eletrônica de varredura pela técnica de retrodispersão referente ao grupo tratado com o compósito hidroxiapatita, fibroína da seda e 3% de ácido hialurônico, após 30 dias de cirurgia...67 Figura 15 - Imagem obtida por microscopia eletrônica de varredura pela técnica de retrodispersão referente ao grupo controle, após 30 dias de cirurgia...68 Figura 16 - Micrografia representando a região do defeito realizado no olecrano de coelho do grupo controle, sete dias após a cirurgia...69 Figura 17 - Micrografia representando a região do defeito realizado no olecrano sete dias após a cirurgia, submetida à implantação dos compósitos...70 Figura 18 - Micrografia representando a região do defeito realizado no olecrano de coelho do grupo controle, 30 dias após a cirurgia...72 Figura 19 - Micrografia representando a região do defeito realizado no olecrano de coelho do grupo hidroxiapatita e fibroína da seda...73 Figura 20 - Micrografia representando a região do defeito realizado no olecrano trinta dias após a cirurgia, submetida à implantação do compósito hidroxiapatita, fibroína da seda e 1% de ácido hialurônico...74 Figura 21 - Micrografia representando a região do defeito realizado no olecrano trinta dias após a cirurgia, submetida à implantação do compósito hidroxiapatita, fibroína da seda e 3% de ácido hialurônico...74
viii LISTA DE TABELAS
CAPÍTULO II - CARACTERIZAÇÃO IN VITRO E ANÁLISE DE BIOCOMPATIBILIDADE IN VIVO DO COMPÓSITO FORMADO POR
HIDROXIAPATITA, FIBROÍNA DA SEDA E ÁCIDO
ix RESUMO
PERDIGÃO, Ana Paula Lima, M.Sc., Universidade Federal de Viçosa, julho de 2015. Compósito de hidroxiapatita, fibroína da seda e ácido hialurônico em defeitos ósseos experimentais na ulna de coelhos. Orientadora: Andrea Pacheco Batista Borges. Coorientadores: Emily Correna Carlo Reis e Fabrício Luciani Valente.
xi ABSTRACT
PERDIGÃO, Ana Paula Lima, M.Sc., Universidade Federal de Viçosa, July, 2015. Composite of hydroxyapatite, silk fibroin and hyaluronic acid in
experimental bonedefects in rabbits’ ulna. Adviser: Andrea Pacheco Batista Borges. Co-advisers: Emily Correna Carlo Reis and Fabrício Luciani Valente.
The lesions or bone loss are conditions that directly affect the quality of life of
humans and animals. The repair process may not occur efficiently when there
are unfavorable conditions. Some composites, polymers, and proteins are used
to form matrices to promote higher efficiency in this repairing process. However,
the biomaterials used today in the treatment of these diseases still have some
properties so that these biomaterials could suitable for use. The objective of this
work was to evaluate the reparative potential of the composite consisting of
hydroxyapatite (HAP) and fibroin silk (FS) in the presence of hyaluronic acid
(HA) in different concentrations used for the treatment of experimental bone
defects made in the rabbits ulna. First, diffraction of X-rays and scanning
electron microscopy analyzes were performed in order to characterize the
surface topography, porosity and degree of crystallinity of each composite.
Later, in vivo biocompatibility and biodegradability of the composite tests were
performed. To this end, three rabbits were used who received each four
implants into the subcutaneous tissue of the same composite. The number one
rabbit received four implants for the composite 1 (HAP + FS). The number 2
rabbit received four implants for the composite 2 (HAP + FS + 1% AH). Finally,
the rabbit number 3 received four implants for the composite 3 (HAP + FS + 3%
AH). A sample of each animal was collected in each of days 15, 30, 60 and 90
days after surgery and processed for histological evaluation. Finally, we
assessed whether her ability to osteoconductive and osseointegration through
the deployment of composite 1, 2 and 3 in a defect previously created in the
olecranon animals. The implementation of the olecranon surgeries were
performed after division of experimental groups of 10 animals each, in treated
and control group, and the control group not receiving any kind of treatment.
Clinical evaluations were performed 7 days and then at 30 days postoperatively.
X-rays of operated limbs were performed in the immediate postoperative period,
xii histological analyzes were performed by collecting samples at seven and 30
days of composite implantation into bone tissue and scanning electron
microscopy only after 30 days of implantation. The results of the analysis of
diffraction X-rays revealed three composite of high crystallinity, and scanning
electron microscopy pictures show that the composite HAP + FS + 3% HA had
a more complex porous topography another two composites HAP + FS e
HAP+FS+ 1% AH, proving to be an ideal surface for cell adhesion and
proliferation. When biocompatibility test, the three composites showed
integration with the tissue with tissue proliferation, composite fragmentation and
at the end of the evaluation was observed the formation of an organized fibrous
tissue around the biomaterial. Clinical evaluations demonstrated a
biocompatible composite tolerated by the animals, and radiographs of the
treated groups showed decreased bone radiopacity, making it similar to the
adjacent bone at 30 days postoperatively. The microcomputadorizada
tomography demonstrated by means of three-dimensional images, a greater
loss in the defect edge regulariy in the group treated with HAP + FS + 3% HA in
comparison with other groups, suggestive of bone growth and demonstrated to
be the best composite to treating point of view this analysis. Histopathology and
scanning electron microscopy revealed a compositeand tissue interaction with
the formation of bone tissue around the implant and histomorphometric analysis
revealed a greater number of young trabecular bone in the group treated with
PAH + FS + 3% HA, proving to be the best treatment used in this study for
1
CAPITULO I
Engenharia tecidual óssea e os biomateriais: caracterização,
aplicação e perspectivas.
PERDIGÃO, A.P.L. et al.
RESUMO
A hidroxiapatita é um biomaterial com alta biocompatibilidade, sendo largamente explorada pela engenharia de tecidos. Possui também uma compatível taxa de degradação e osteocondutividade. Associada à fibroína da seda, as características mecânicas de ambos os biomateriais se tornam complementares, com o aumento da flexibilidade e resistência fornecida pelo polímero. O ácido hialurônico por sua vez é caracterizado como um importante componente da matriz extracelular e presente em todos os tecidos conjuntivos, exercendo uma função essencial na estrutura, organização e homeostase dessa matriz e das proteínas plasmáticas, importantes no processo de reparação óssea. Com o intuito de melhorar as características físicas e químicas dos biomateriais utilizados no tratamento das lesões ósseas, ele foi incorporado ao compósito por possuir diversas funções dentre elas de sinalizar e recrutar células que participam do processo de reparação tecidual. Este capítulo tem por objetivo descrever, através de uma revisão bibliográfica, as inovações apresentadas nas pesquisas que envolvem estudos na área da engenharia tecidual óssea, bem como caracterizar os biomateriais aplicados em forma de compósito, os quais foram avaliados durante esse trabalho.
2
Bone tissue engineering and biomaterials: characterization, and
application perspectives.
PERDIGÃO, A.P.L., et al.
ABSTRACT
Hydroxyapatite is biomaterials with high biocompatibility, being widely exploited for tissue engineering. It also has a compatible rate of degradation and osteoconductivity. Associated with silk fibroin, the mechanical characteristics of both biomaterials become complementary, with increased flexibility and toughness provided by the polymer. The hyaluronic acid in turn is characterized as an important component of the extracellular matrix and present in all connective tissues, exerting a key role in the structure, organization and homeostasis of this matrix and plasma, important proteins in the bone repair process. In order to improve the physical and chemical characteristics of biomaterials used in the treatment of bone lesions, it was incorporated into the composite by having different functions among them to signal and recruit cells that participate in tissue repair process. This chapter aims to describe, through a literature review, the innovations presented in the research involving bone tissue engineering as well as characterize biomaterials applied in the form of composite, which were evaluated during this work.
3 1. INTRODUÇÃO
Atualmente, os estudos relacionados à ortopedia e regeneração óssea tanto na medicina humana quanto na medicina veterinária estão bastante avançados. Porém, ainda há muitos desafios a serem vencidos e são esses desafios que impulsionam o desenvolvimento nas pesquisas e ampliam as expectativas em se criar um modelo de tratamento ideal que promova a regeneração de maneira eficiente. Dessa forma, os processos de reparação tecidual óssea tem sido o objetivo de diferentes procedimentos cirúrgicos desde a antiguidade até os dias atuais. A multidisciplinar engenharia de tecidos promove a aplicação de princípios e métodos da engenharia e das ciências da saúde para dar suporte e auxiliar o reparo de tecidos defeituosos ou danificados, acelerando esse processo (Tabata, 2009).
O elevado conhecimento diante do comportamento dos tecidos em condições fisiológicas, principalmente a compreensão cientifica sobre a composição natural óssea, fosfatos de cálcio e atuação biológica dos polímeros promovem uma fonte de grande interesse devido a esses méritos biomédicos (Yang et al., 2015).
Assim, este trabalho tem por objetivo, por meio de uma revisão, ampliar os conhecimentos na área da bioengenharia, caracterizando métodos e processos de reparação tecidual na presença de compósitos elaborados, bem como avaliar e comparar as propriedades físico-químicas dos biomaterias descritos durante essa revisão bibliográfica.
2. ENGENHARIA TECIDUAL ÓSSEA
Uma das áreas emergentes no ramo das pesquisas é a engenharia de tecidos que desempenha um papel vital na medicina regenerativa. Trata-se de um campo interdisciplinar e multidisciplinar que visa o desenvolvimento de substitutos biológicos que restauram, mantém ou melhoram a função do tecido bem como ampliam a qualidade de vida tanto na medicina humana quanto na medicina veterinária (Ma, 2008; Guoet al., 2015).
4 ósseos autógenos são considerados os de primeira escolha na regeneração tecidual óssea, devido às suas propriedades osteogênicas, por não transmitirem doenças infecciosas e não desencadearem reações imunológicas. No entanto, a disponibilidade deste tipo de enxerto é restrita, havendo a necessidade de dois procedimentos cirúrgicos, podendo ainda ocorrer infecção no sítio doador, complicação que pode onerar os tratamentos (Zhang et al., 2009). Diante dessas limitações, os aloenxertos (compostos de materiais de outro indivíduo da mesma espécie) e os xenoenxertos (materiais obtidos de outra espécie) surgiram como possíveis substitutos. Entretanto, eles também apresentam limitações importantes, como risco de rejeição ou de transmissão de doenças e quantidade ofertada limitada (Precheur, 2007).
A engenharia de tecidos tem emergido como uma promissora abordagem alternativa no tratamento de tecidos lesionados. Nesse contexto, terapias alternativas, como a utilização de biomateriais, podem ser utilizadas como um substrato que promove tanto a adesão de células implantadas, como um suporte físico para orientar a formação de novos tecidos. Para tal, o biomaterial deve ser biocompatível, biodegradável, altamente poroso, mecanicamente forte, maleável e, dessa forma, facilitar a adesão das células e promover o crescimento celular, (Chen et al., 2002).
5 osteocondução a fim de garantir e promover o resultado esperado com o tratamento utilizado (Liu e Peter, 2004).
Diversos materiais têm sido empregados em defeitos ósseos, como o enxerto mineralizado ou desmineralizado liofilizado (Gomes et al., 2007), as cerâmicas biocompatíveis e os polímeros (Carlo et al., 2009a) além dos vidros bioativos (Tiomiset al., 2010).
O impacto da tecnologia de materiais avançados no campo de biomateriais é triplo. Novos tipos de materiais e compósitos podem ser criados com combinações de propriedades físicas e biológicas não possíveis de se obter anteriormente, novas técnicas de caracterização de biomateriais e suas interfaces estão agora disponíveis e métodos de previsão de tempo de vida em serviço dos materiais e próteses estão se tornando acessíveis. Contudo, permanece o desafio no uso de biomateriais que é a criação de um material que substitua o tecido vivo em sua plenitude, isto é, possua a capacidade de crescimento e reparação (Oréficeet al., 2006).
Neste contexto, por definição, biomaterial é qualquer substância ou combinação de substâncias, naturais ou não, que não sejam drogas ou fármacos, utilizado em aplicações biomédicas e que interagem com sistemas biológicos, que tratam, aumentam ou substituem quaisquer tecidos, órgãos ou funções do corpo (VonRecumet al., 1995). Deve ser implantado e incorporado podendo servir ou não como matriz, veículo, suporte ou estimulador para o crescimento de novo tecido, onde houve perda de matéria viva ou de sua função. Torna-se assim evidente que os requisitos mecânicos de biocompatibilidade e biodegradabilidade variem de aplicação para aplicação (Cao e Wang, 2009).
A biocompatibilidade, o desempenho dos biomateriais e a resposta dos tecidos vivos à presença de materiais estranhos são influenciados pelas características intrínsecas dos materiais, pelas condições do paciente (idade, sexo, estado geral de saúde, estilo de vida, etc.) e pela qualidade das intervenções médicas (Silva, 2008). Por isso, a composição química, estrutura física, e porções biologicamente funcionais são todos atributos importantes dos biomateriais para a engenharia de tecidos (Ma, 2008).
6 crescimento que podem ser empregados juntamente com os compósitos biomiméticos (Guoet al., 2015).
Deste modo, essa ciência objetiva criar e aprimorar novas terapias e desenvolver novos biomateriais que restaurem, melhorem ou impeçam o agravamento da função tecidual comprometida (Kaigleret al., 2001; Sachlos e Czernuszka, 2003; Marins et al., 2004).
3. HIDROXIAPATIA (HAP)
A grande classe de biomateriais, as cerâmicas bioativas, compostas principalmente pela hidroxiapatita (HAP) e fosfatos de cálcio, vem sendo altamente utilizadas nos procedimentos para reparação óssea. Elas apresentam osteocondutividade e biocompatibilidade apropriadas, devido à fase quimica e estrurural similar com a fase mineral óssea. A HAP é um biomaterial osteocondutor, uma vez que a superficie de sua estrutura é irregular e complexa, facilitando a adesão e a proliferação celular. Adicionalmente, possuí caracteristicas que podem ser amplamente exploradas pois é um material extremamente biocompatível já que cerca de 65% em peso de osso é feito de HAP (Okamoto e John, 2013).
A HAP pertence ao grupo das cerâmicas de fosfato de cálcio. Sua estrutura química é representada pela fórmula C10(PO4)6(OH)2, com razão Ca/P de 1,67, podendo ter origem nos corais e algas, ser derivado de mineral ósseo natural ou ainda desenvolvido sinteticamente (Schmitz et al., 1999).
Quando sintetizada em laboratório fica livre de impurezas que retardam a osteogênese. Além disso, o tamanho, a forma e a porosidade do produto podem ser controlados e pré-determinados (Borges, 1998). É uma das cerâmicas mais biocompatíveis devido à semelhança com os constituintes minerais dos ossos e dentes humanos (Fook et al., 2010). É um biomaterial, bioativo e osteocondutor, ou seja, tem a capacidade de servir como suporte para o crescimento de novo osso assim como novos vasos sanguíneos (Borges et al., 2000; Franco et al., 2001; Boer et al., 2003; Duarte et al., 2006; Vital et al., 2006; Silva et al., 2012). Pode ser reabsorvível quando fabricada pela sinterização (Fujita et al., 2003) ou pela calcinação (Borges et al., 2000).
7 materiais biodegradáveis também devem ser considerados, pois são críticos no papel de regeneração óssea. Nesse contexto, a integridade mecânica de um biomaterial será significativamente reduzida se a taxa de degradação for rápida, resultando assim eliminação do biomaterial antes da regeneração tecidual acontecer (Wu et al., 2014). Além da osteocondução, o processo de reabsorção da hidroxiapatita contribui para que ela seja um excelente substituto para o tecido ósseo, uma vez que é realizada por osteoclastos, com as mesmas características que ocorre no processo natural de remodelação óssea (Borges et al., 2000; Rumpel et al., 2006). Quando implantada em tecidos moles, como subcutâneo, ela é encapsulada por tecido conjuntivo fibroso apresentando lenta reabsorção (Carlo et al., 2007), o que pode torná-la útil em cirurgias reconstrutivas para promover correção de depressões congênitas ou traumáticas.
Estudos têm centrado em replicar as propriedades mecânicas da hidroxiapatita que são anisotrópicas ao osso, por meio do uso do biomaterial em forma de placas ou de particulas de HAP (Converse et al., 2007), e também, são feitos estudos com a utilização de nanopartículas para melhorar o reforço mecânico, a distribuição e aumentar a atividade biológica (Shi et al., 2009).
A nanohidroxiapatita (nHAP) pode ter outras propriedades especiais devido ao seu pequeno tamanho e grande área superficial específica. Um aumento significativo de adsorção de proteínas e adesão de osteoblastos sobre os materiais cerâmicos nanométricos foi relatado por Webster et al. (2000).
Os nanocompósitos baseados em partículas e biopolímeros com HAP têm atraído a atenção por sua boa osteocondutividade, osteoindutividade, biodegradabilidade e elevada resistência mecânica (Okamoto e John, 2013). GHANNAM et al. (2004) reproduziram uma escala do tamanho de HAP encontrada nos tecidos ósseos e mostrou que a incorporação de nHAP melhorou as características mecânicas e de adsorção de proteína dos compósitos suportes, mantendo simultaneamente uma elevada porosidade e microarquitetura adequadas.
8 Assim, para minimizar ou até eliminar esses problemas, ou seja, reduzir sua dureza e promover a coesão entre as partículas, a principal abordagem estudada é a formação de compósitos de HAP com polímeros (Carlo et al., 2009(a); Carlo Reis et al.,2012; Li et al., 2013).
4. FIBROÍNA DA SEDA (FS)
As sedas são polímeros protéicos, produzidos na forma de fibras por alguns artrópodes, que as utilizam para diversas funções, como estrutura de suporte, reprodução e captura de alimentos (Altman et al., 2003; Hakimi et al., 2007). As sedas mais estudadas são as produzidas pelo bicho-da-seda domesticado. São produzidas no interior de glândulas especializadas, onde são armazenadas e posteriormente processadas na forma de fibras (Altman et al., 2003). A seda produzida pelo bicho-da-seda domesticado é composta por dois tipos de proteínas: (1) fibroína, apresentada em forma de filamentos de seda e (2) sericina, proteína que envolve os filamentos. A organização estrutural da fibroína possui regiões cristalinas dispostas em folha-β e regiões amorfas, responsáveis pela elasticidade da seda (Altman et al., 2003). Ambas as proteínas apresentam estruturas e propriedades completamente diferentes devido à composição de aminoácidos diferentes. Fibroína da seda, não se dissolve em água, devido aos aminoácidos hidrofóbicos incluindo glicina e alanina, ao passo que a sericina da seda é hidrófilo e mais viscoso (Ko et al., 2013). Alguns casos de hipersensibilidade à seda já foram relatados e atribuídos à sericina, porém sabe-se que se a mesma for retirada, é possível obter amostras adequadas para utilização como biomaterial (Altman et al., 2003).
9 sendo alvo das pesquisas no ramo da engenharia de tecidos (Wang et al., 2006; Correia et al., 2012).
Chao et al. (2010) publicaram dados que sugerem que os hidrogéis de seda podem ser utilizadas como uma ferramenta para o estudo dos fatores e mecanismos relacionados na formação da cartilagem, bem como um biomaterial tolerável e totalmente degradável para engenharia de tecidos de cartilagem. Já em 2011, Saitow et al., utilizaram um biomaterial à base de seda para determinar a capacidade da aplicação de enxertos vasculares heparinizados em promover a formação de elastina. Os biomateriais de seda também têm sido estudados como suporte para a mobilização de enzimas, cicatrização de feridas e na regeneração de ossos (Vepari et al., 2007; Zhang et al., 2012). Adicionalmente, estudos mostram a participação desse polímero na distribuição de medicamentos (Wang et al., 2009), reparação de feridas (Zhou et al., 2013), tratamentos de pele (Bellas et al., 2012), entre outras aplicações.
5. ÁCIDO HIALURÔNICO (AH)
O ácido hialurônico foi descoberto, após o isolamento no corpo vítreo de bovinos (Meyer e Palmer, 1934), mas a sua estrutura foi apenas determinada cerca de vinte anos depois, em 1958. Ambos propuseram o nome, vindo da junção entre o termo grego hialóide (vítreo) e ácido urônico. O AH é frequentemente referenciado por hialuronato. Isso se deve ao fato de que, sob condições fisiológicas, essa molécula está presente na forma de um poliânion (hialuronato de sódio) e não de um ácido (McDonald e Hascall, 2002). Estruturalmente, o AH é descrito como um polissacarídeo linear formado a partir de unidades alternadas dos dissacarídeos N-acetil-glicosamina e ácido D-glicurônico, ligadas entre si por meio de ligações glicosídicas β1,4 e β1,3 e pode atingir um peso molecular que varia entre 104 e 107 DA (Kogan et al., 2007).
10 Em contrapartida, a degradação do AH é regulado por uma classe de enzimas denominadas hialuronidase (HYALs) que podem ser diferenciadas de acordo com suas atividades bioquímicas e seus produtos de degradação (Kreil, 1995).
O AH é um dos glicosaminoglicanos mais onipresentes em nosso corpo. Sob condições fisiológicas, interage com outras macromoléculas tais como o colágeno para promover a formação da matriz extracelular (Tsai et al., 2006). Essas e outras interações ocorrem por meio de diversos receptores de membranas descritos, dentre eles o CD44 e RAHMM (Receptor de AH mediador da mobilidade), sendo o CD44 presente na maioria dos tipos celulares e, portanto, o mais estudado (Turley et al., 2002). Esse receptor, uma vez ativado, é responsável por diversos efeitos biológicos, tais como modulação dos processos angiogênicos (Slevin et al., 2009), indução da expressão de metaloprotease pró-inflamatória (Morra, 2005), e aumento da motilidade e distribuição celular (Lindwall et al., 2013). É um componente essencial da matriz extracelular e exerce muitos papéis importantes na formação e reparo dos tecidos, atuando na proliferação e migração celular (Jha et al., 2011). Também atua na manutenção da homeostase da matriz extracelular e das proteínas plasmáticas (Lisignoli et al., 2005). Durante a fase inicial inflamatória da cicatrização, uma grande quantidade de AH acumula-se na ferida e passa a modular a resposta inflamatória e a atividade dos fibroblastos (Chen e Abatangelo, 1999).
Huang et al. (2006) demonstraram, em cultura de células mesenquimais derivadas da calota craniana de ratos, que o AH foi capaz de induzir a proliferação e diferenciação de células osteoprogenitoras em osteoblastos. Sasaki et al. (1995) observaram que o AH acelerou a formação de novo osso por meio da diferenciação e migração de células mesenquimais, em defeitos ósseos criados em ratos. Aslan et al. (2006), utilizando o modelo de reparo ósseo em tíbia de coelho, verificaram que a associação de enxertos com o gel de AH apresentou maior formação óssea que os defeitos tratados somente com enxerto. Dessa forma e considerando suas características não-imunogênicas, o AH vem sendo utilizado no tratamento de doenças degenerativas e inflamatórias das articulações e dos ossos (Echigo et al., 2006; Nganvongpanit et al., 2013)
11 6. CONSIDERAÇÕES FINAIS
Os grandes defeitos e falhas ósseas ocorrem em situações em que a perda de osso é causada por doença, trauma ou ressecção de tumor e, dessa forma, representam um problema em cirurgias reconstrutivas, principalmente quando os processos de reparação e de remodelação estão prejudicados clinicamente nos pacientes. A necessidade de novos materiais mais acessíveis e novas técnicas para utilização na medicina humana e veterinária é evidente, sendo os modelos experimentais em animais, essenciais para uma aplicação segura e eficaz de tais técnicas.
O objetivo da medicina regenerativa é reparar e regenerar tecidos danificados e, através da elaboração de biomateriais realizada pela engenharia de tecidos, os utiliza, também forma de compósitos, como auxílio no tratamento desses tecidos. Estes são utilizados para mimetizar as funções biológicas da estrutura tecidual e da matriz extracelular que a compõe, ocorrendo naturalmente em condições fisiológicas. Os biomateriais devem desempenhar também um papel importante no quadro estrutural do tecido, conduzindo à adesão celular e a secreção de proteínas da matriz extracelular para apoiar a regeneração do tecido danificado (Kim et al., 2015).
Além disso, a associação de materiais visando o agrupamento de características ideais complementares nos tratamentos para regeneração tecidual óssea está sendo pesquisada a cada dia mais se tornando uma alternativa promissora para a evolução da engenharia de tecidos. Polímeros e cerâmicas, especialmente, têm uma participação abrangente nesses estudos.
12 al., 2009). Tais fatos levantam o interesse dos pesquisadores e o desenvolvimento de
biomateriais que explorem essas associações com o intuito de melhorar a aplicabilidade desses compósitos promovendo pesquisas nessa área do conhecimento.
Estudos demonstram excelentes resultados da regeneração óssea com a associação das propriedades mecânicas da FS (Kim et al., 2005) com as excelentes características de osteocondução e bioatividade da HAP (Dorozhkin e Epple, 2002) em compósitos formados por esses dois biomateriais (Okabayashi et al., 2009; Wei et al., 2011; Kweon et al., 2011). Em 2011, Bhumiratana et al.,criou um modelo experimental no qual incorporou HAP em suportes porosos de seda para avaliar a formação de tecido ósseo, o qual demonstrou a capacidade de adesão celular e osteocondução ao final da análise. Não só para melhorar a resistência mecânica da HAP, mas também por ser biocompatível, a FS pode ser trabalhada juntamente com a HAP para fornecer excelentes resultados para a regeneração tecidual óssea (Chen et al., 2014). Outras pesquisas apresentadas por Yan et al. (2013), mostraram a associação da FS e do fosfato de cálcio na tentativa de produzir biomateriais adequados para aplicações envolvendo engenharia tecidual óssea.
Dessa forma, os estudos de avaliação biológica de compostos FS e HAP também se têm concentrado essencialmente na sua biocompatibilidade, a nível celular, a proliferação e a viabilidade das células a nível de tecido, e o uso como material de absorção e formação de osso novo (Lin et al., 2015).
Além disso, um compósito aplicável utilizado na engenharia de tecidos deve não só possuir propriedades mecânicas apropriadas, estruturas porosas e biocompatibilidade que facilitem a adesão, crescimento e proliferação de células do tecido, mas também possuir capacidade de liberação de fatores bioativos para proporcionar um ambiente mais favorável para a indução do crescimento tecidual (Lu et al., 2007). Dessa forma, os compósitos produzidos deverão também promover um espaço adequado para o crescimento de células e tecidos novos, adesão dos fatores de crescimento envolvidos, bem como uma excelente interação tecidual com as células hospedeiras(Wu et al., 2014). A incorporação de produtos biológicos tais como citocinas e fatores de crescimento em compósitos é uma área de pesquisa em expansão, servindo de interesse para pesquisadores que trabalham na área de regeneração de tecidos. (Fuentes et al., 2009).
13 materiais, acelerando e amenizando efeitos adversos durante a recuperação dos pacientes.
7. REFERÊNCIAS BIBLIOGRÁFICAS
ALTMAN, G.H.; DIAZ, F.; JAKUBA, C.; CALABRO, T.; HORAN, R.L.; CHEN.J.LU, H.; RICHMOND, J.; KAPLAN, D.L. Silk-based biomaterials.Biomaterials, v. 24, p. 401-416, 2003.
ASLAN, M.; SIMSEK, G. e DAYI, E. The effect of hyaluronic acid supplemented bone graft in bone healing: experimental study in rabbits. Journal of Biomaterials Applications, v. 20, p. 209-220, 2006.
BELLAS, E.; SEIBERG, M.; GARLICK, J.; KAPLAN, D.L.In vitro 3D Full- Thickness Skin-Equivalent Tissue Model Using Silk and Collagen.Biomaterials Macromolecules Bioscience, v. 12, p. 1627–1636, 2012.
BHUMIRATANA, S.; GRAYSON, W.; CASTANEDA, A.; ROCKWOOD, D.; GIL, E.S.; KAPLAN, D.L.; VUNJAK-NOVAKOVIC, G. Nucleation and Growth of Mineralized Bone Matrix on SilkHydroxyapatite Composite Scaffolds.Biomaterials, v. 32, p. 2812-2820, 2011.
BOER, F.C.; WIPPERMANN, B.W.; BLOKHUIS, F.J.; PATKA, P.; BAKKER, F.C; HAARMAN, H.J.T.M. Healing of segmental bone defects with granular porous hydroxyapatite augmented with recombinant human osteogenicprotein-1 ou autologous bone marrow.Journal of Orthopaedic Research, v.21, p. 521-528, 2003. BORGES, A.P.B. O efeito da hidroxiapatita sintética na regeneração óssea de defeito
provocado experimentalmente no terço proximal da tíbia de cães: estudo clínico-cirúrgico, radiológico e histológico por microscopia de luz e microscopia eletrônica de retrodisperção. 1998. Tese de Doutorado- Escola de Veterinária, Universidade Federal de Minas Gerais, Belo Horizonte, MG.
BORGES,A.P.B.; REZENDE, C.M.F.; RIBEIRO, M.F.B.; MELO, E.G.; NETO, P.I.N. Hidroxiapatita sintética (HAP-91) como substituto ósseo em defeito experimental provocado no terço proximal da tíbia em cão: aspectos à microscopia eletrônica de transmissão. Arquivos Brasileiros de Medicina Veterinária e Zootecnia, v. 52, p. 616-620, 2000.
CANCEDDA, R.; DOZIN, B.; GIANONNI, P.; QUARTO,
14 CAO, Y. e WANG, B. Biodegradation of Silk biomaterials.International Journal of
Molecular Sciences, v. 10, p. 1514-1524, 2009.
CARLO, E.C.; BORGES, A.P.B.; REZENDE, C.M.F.; MOREIRA, J.C.L.; FONSECA, C.C.; PONTES, K.C.S.;DUARTE, T.S. Avaliação do efeito osteoindutor da hidroxiapatita e do biovidro implantados em tecido subcutâneo de cão. Revista Ceres, v. 54, p. 492-500, 2007.
CARLO, E.C.; BORGES, A.P.B.; DEL CARLO, R.J.; MARTINEZ, M.M.M.; OLIVEIRA, P.M.; MORATO, G.O.; ELEOTÉRIO, R.B.; REIS JÚNIOR, M.S. Comparisonof in vivo propertiesofhydroxyapatitepolyhydroxybutyratecompositesassessed for bonesubstitution. The Journalof Craniofacial Surgery, v. 20, p. 853-859. 2009 (a) CARLO, E.C.; BORGES, A.P.B.; VARGAS, M.V.I.; MARTINEZ, M.M.; ELOTERIO, R.B.;
DIAS, A.R.; RODRIGUES, M.C.D. Resposta tecidual ao compósito 50% hidroxiapatita: 50% poli-hidroxibutirato para substituição óssea em coelho. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v. 61,p. 844- 852, 2009 (b)
CARLO REIS, E.C.; BORGES, A.P.B.; OLIVEIRA, P.M.; BICALHO, S.M.C.M.; REIS, A.M.; SILVA, C.L. Desenvolvimento e caracterização de membranas rígidas, osteocondutoras e reabsorvíveis de polihidroxibutirato e hidroxiapatita para regeneração periodontal. Polímeros, v. 22, p. 73- 79, 2012.
CHAO, P.G.; YODMUANG, S.; WANG, X.; SUN, L.; KAPLAN, D.L.; VUNJAK-NOVAKOVIC, G. Silk hydrogel for cartilage tissue engineering.Journal of Biomedical Materials Research Part B: Applied Biomaterials, v. 95, p. 84-90, 2010.
CHEN, G., USHIDA, T., TATEISHI, T. Scaffold Design for Tissue Engineering.Macromolecular Bioscience., v. 2, p. 67-77, 2002.
CHEN, K.Y.; SHYU, P.C.; DONG, G.C.; CHEN, Y.S.; KUO, W. W.; YAO, C.H. Reconstruction of calvarial defect using a tricalcium phosphate-oligomericproanthocyanidins cross-linked gelatin composite. Biomaterials, v. 30, p. 1682-1688, 2009.
CHEN, L.; HU, J.; RAN, J.; SHEN, X.; TONG, H. Preparation and evaluation of collagen-silk fibroin/hydroxyapatite nanocomposites for bone tissue engineering.International Journal of Biological Macromolecules, v. 65, p. 1-7, 2014.
CHEN, W.Y.J. e ABATANGELO, G. Functions of hyaluronan in wound repair.Wound Repair and Regeneration, v. 7, p. 79-89, 1999.
15 CORREIA, C.; BHUMIRATANA, S.; YAN, L.; OLIVEIRA, A.L.; GIMBLE, J.M.; ROCKWOOD, D.; KAPLAN, D.L.; SOUSA, R.A.; REIS, R.L.; VUNJAK-NOVAKOVICA, G. Development of silk-based scaffolds for tissue engineering of bone from human adipose derived stem cells. Acta Biomaterials, v. 8, p. 2483-2492, 2012.
DOROZHKIN, S.V. e EPPLE, M. Biological and medical significance of calcium phosphates.AngewandteChemie International Edition, v. 41, p. 3130-3146, 2002. DUARTE, T.S.; BORGES, A.P.B.; LAVOR, M.S.L.; FILGUEIRAS, R.; TSIMOIS, A.C.;
OLIVEIRA F.L.; FONSECA, C.C.; PONTES, K.C.S. Osteointegração da hidroxiapatita sintética no processo alveolar da mandíbula de cães: aspectos histológicos. Revista Ceres, v. 58, p. 849-853, 2006.
ECHIGO, R.; MOCHIZUKI, M.; NISHIMURA, R.; SASAKI, N. Mechanisms of action and potential uses of hyaluronan in dogs with osteoarthritis.JournalVeterinary Medicine Sciences, v. 68, p. 899-902, 2006.
ELBATAL, H.A.; AZOOZ, M.A.; KHALI, E.M.A.; MONEM, A.S.; HAMDY, Y.M Characterization of some bioglass-ceramics. Materials Chemistry and Physics, v. 80, p. 599-609, 2003.
FOOK, A.C.B.M.; APARECIDA, A.H.; FOOK, M.V.L. Desenvolvimento de biocerâmicas porosas de hidroxiapatita para utilização como scaffolds para regeneração óssea. Revista Matéria. v. 15, p. 392–399, 2010.
FRANCO, K.L.; BORGES, A.P.B.; VILÓRIA, M.I.C.; FERNANDES, E.S.; FEHLBERG, A.F. Hidroxiapatita sintética pura, hidroxiapatita sintética associada ao colágeno e hidroxiapatita sintética associada ao lipossoma como substitutos ósseos em defeitos provocados na tíbia de cães: aspectos da osteointegração à microscopia de luz transmitida. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v. 53, p. 431-436, 2001.
FUENTES, M.G.; MEINEL, A.J.; HILBE, M.; MEINEL, L.; MERKLE, H.P. Silk fibroin/hyaluronan scaffolds for human mesenchymal stem cell culture in tissue engineering. Biomaterials, v. 30, p. 5068-5076, 2009.
FUJITA, R.; YOKOYAMA, A.; KAWASAKI, T.; KOHGO, T. Bone Augmentation Osteogenesis Using Hydroxyapatite and Tricalcium Phosphate Blocks.Journal of Oral and Maxillofacial Surgery, v. 61, p. 1045-1053, 2003.
16 GOMES, K, PIPPI, N. L.; BRAGA, F.V.A.; KROLIKOWISKI, G.; SOARES, A.V.; PIGATTO, G.M.; POHL, V.H.; NOVOSAT, D.; BERTOLETTI, B.; MÖRSCHBÄCHER, P.D.; SOUZA, S.G.; DALMOLIN, F. Lyophilized inorganic bovine bone cancellous block for iatrogenic oronasal fistula repair in dogs. Ciência Rural, v. 31, p.1 59-164, 2007. GUO, B.; LEI, B.; LI P.; MA, P.X. Functionalized scaffolds to enhance tissue
regeneration.Regenerative Biomaterials, v. 2, p. 47-57, 2015.
HAKIMI, O.; KNIGHT, D.P.; VOLLRATH, F.; VADGAMA, P. Spider and mulberry silkworm silks as compatible biomaterials .Composites: Part B, v. 38, p. 324-337, 2007.
HARDY, J.O.; ROMER, L.M. e SCHEIBEL, R.T. Polymeric materials based on silk proteins.Polymer, v. 49, p. 4309-4327, 2008.
HICKEY, D.J.; ERCAN, B.; SUN, L.; WEBSTER, T.J. Adding MgO nanoparticles to hydroxyapatite–PLLA nanocomposites for improved bone tissue engineering applications.ActaBiomaterialia, v. 14, p. 175-184, 2015.
HO, M.; WANG, H.; LAU, K. Effect of degumming time on silkworm silk fibre for biodegradable polymer composites. Applied Surface Science, v. 258, p. 3948-3955, 2012.
HUANG, W.C.; CHENB, S. e CHENA, T.The role of dissolved oxygen and function of agitation in hyaluronic fermentation.Biochemical Engineering Journal, v. 32, p. 239-243, 2006.
ITANO, N. e KIMATA,K. Mammalian Hyaluronan Synthases. Iubmb Life, v. 54, p. 195-199, 2002.
JHA, A.K.; XU, X.; DUNCAN, R.L.; JIA, X. Controlling the adhesion and differentiation of mesenchymal stem cells using hyaluronic acid-based, doubly crosslinked networks. Biomaterials, v. 32, p. 2466-2578, 2011.
KAIGLER, D., MOONEY, D. Tissue engineering’s impact on dentistry. Journal of Dental Education, v. 65, p. 456-462, 2001.
KIM, B.S.; PARK, K.E.; KIM, M.H.; YOU, H.K.; LEE, J.; PARK, W.H. Effect of nanofiber content on bone regeneration of silk fibroin/poly(εcaprolactone) nano/microfibrous composite scaffolds. International Journal of Nanomedicine, v. 10, p. 485-502, 2015.
17 KIM, H. J.; KIM, U. J.; VUNJAK-NOVAKOVIC, G.; MIN, B. H.; KAPLAN, D.L. Influence of macroporous protein scaffolds on bone tissue engineering from bone marrow stem cells. Biomaterials, v. 26, p. 4442-4452, 2005.
KIRSCHBAUER, K.G. Mineralização in vitro de matrizes colagênicas derivadas de tendões calcâneos bovinos e de avestruz. 2009. 80f. Dissertação de Mestrado. Universidade de São Paulo. Instituto de Química, São Carlos.
KO, J.S. YOON, K.; KI, C.S.; KIM, H.J.; BAE, D.G.; LEE, K.H.; PARK, Y.H.; UM, I.C. Effect of degumming condition on the solution properties and electrospinnablity of regenerated silk solution.International Journal of Biological Macromolecules, v. 55, p. 161-168, 2013.
KOGAN, G.; SOLTÉS, L.; STERN, R.; GEMEINER, P. Hyaluronic acid: a natural biopolymer with a broad range of biomedical and industrial applications. Biotechnology Letters, v. 29, p. 17-25, 2007.
KREIL, G. Hyaluronidases -A group of neglected enzymes. Protein Science, v. 4, p. 1666-1669, 1995.
KUNDU, B. e KUNDU, S.C. Osteogenesis of human stem cells in silk biomaterial for regenerative therapy.Progress in Polymer Science, v. 35, p. 1116-1127, 2010.
KWEON, H.Y.; LEE, K.G.; CHAE, C.H.; BALAZSI, C.; MIN, S.K.; KIM, J.Y.; CHOI, J.Y.; KIM, S.G. Development of nano-hydroxyapatite graft with silk fibroin scaffold as a new bone substitute. Journal of Oral and Maxillofacial Surgery, v. 69, p. 1578-1586, 2011.
LI, X.; WANG, LU.; FAN, Y.; FENG, Q.; CUI, F.; WATARI, F. Nanostructured scaffolds for bone tissue engineering. Journal of Biomedical Materials Research Part A, v. 101A, p. 2424-2435, 2013.
LIN, L.; HAO, R.; XIONG, W.; ZHONG, J. Quantitative analyses of the effect of silk fibroin/nano-hydroxyapatite composites on osteogenic differentiation of MG-63 human osteosarcoma cells. Journal of Bioscience and Bioengineering, v. 119, p. 591-595, 2015.
LINDWALL, C.; OLSSON, M.; OSMAN, M.A.; KUHN, H.G.; CURTIS, M.A. Selective expression of hyaluronan and receptor for hyaluronan mediated motility (Rhamm) in the adult mouse subventricular zone and rostral migratory stream and in ischemic cortex. Brain research, v. 1503, p. 62-77, 2013.
18 grown in a three-dimensional hyaluronan based scaffold. Biomaterials, v. 26, p. 5677- 5686, 2005.
LIU, X. E PETER, X. MA. Polymeric scaffolds for bone tissue engineering. Annals of biomedical engineering, v. 32, p. 477-486, 2004.
LU, Q.; ZHANG, S.; HU, K.; FENG, Q.; CAO, C.; CUI, F. Cytocompatibility and blood compatibility of multifunctional fibroin/collagen/heparin scaffolds. Biomaterials, v. 28, p. 2306-2313, 2007.
MA, P.X., Biomimetic Materials for Tissue Engineering. Advanced Drug Delivery Reviews, v. 60, p. 184-198, 2008.
MARINS, L. V.; CESTARI, T. M.; SOTTOVIA, A. D.; GRANJEIRO, J. M.; TAGA, R. Radiographic and histological study of perennial bone defect repair in rat calvaria after treatment with blocks of porous bovine organic graft material. Journal of Applied Oral Science, v. 12, p. 62- 69, 2004.
MCDONALD, J. e HASCALL, V. C. Hyaluronan mini review series.The journal of Biological Chemistry, v. 277, p. 4575-4579. 2002.
MEYER, K. e PALMER, J.W.The polysaccharide of the vitreous humor.Journal of Biology and Chemistry, v. 107, p. 629–634, 1934.
MORRA M. Engineering of biomaterials surfaces by hyaluronan. Biomacromolecules, v. 6, p. 1205-1223, 2005.
NGANVONGPANIT, K.; BOONSRI, B.; SRIPRATAK, T.; MARKMEE, P. Effects of one-time and two-one-time intra-articular injection of hyaluronic acid sodium salt after joint surgery in dogs. Journal of veterinary science, v. 14, p. 215-222, 2013.
OKABAYASHI, R.; NAKAMURA, M.; OKABAYASHI, T.; TANAKA, Y.; NAGAI, A.; YAMASHITA, K. Efficacy of polarized hydroxyapatite and silk fibroin composite dressing gel on epidermal recovery from full-tchickness skin wounds. Journal of Biomedical Materials Research. Part B, Applied Biomaterials, v. 90B, p. 641-646, 2009.
OKAMOTO, M. e JOHN, B. Synthetic biopolymer nanocomposites for tissue engineering scaffolds.Progress in Polymer Science, v. 38, p. 1487-1503, 2013.
OREFICE, R. L.; PEREIRA, M.M. e MANSUR, H.S. Biomateriais-Fundamentos e Aplicações. Rio de Janeiro, 2006.548p.
19 RUMPEL, E.; WOLF, .E.; KAUSCHKE, E.; BIENENGRBER, V.; BAYERLEIN, T.; GEDRANGE, T.; PROFF, P. The biodegradation of hydroxyapatite bone graft substitutes in vivo. Folia morphologica, v. 65, p. 43-48, 2006.
RUPPRECHT, S.; MERTEN, H.A.; KESSLER, P.; WILTFANG, J. Hydroxyapatite cement (BoneSourceTM) for repair of critical sized calvarian defects- an experimental study. Journal Cranio- Maxillofacial Surgery, v.3, p. 149-153, 2003.
SACHLOS, e CZERNUSZKA, J.T. Making tissue engineering scaffolds work. Review on the application of solid freeform fabrication technology to the production of tissue engineering scaffolds. European Cells and Materials, v. 5, p. 29-40, 2003.
SAITOW, C.; KAPLAN, D.L. e CASTELLOT, J.J.J. Heparin stimulates elastogenesis: Application to silk-based vascular grafts. Matrix Biology, v. 30, p. 346-355, 2011. SASAKI, T. e WATANABE, C. Stimulation of osteoinduction in bone wound healing by
high-molecular hyaluronic acid. Bone, v.16, p. 9-15,1995.
SCHMITZ, J.P.; HOLLINGER, J.O. e MILAM, S. B. Reconstruction of bone using calcium phosphate bone cements: a critical review. Journal Oral MaxillofacialSurgery, v. 57, p. 1122-1126, 1999.
SHI, Z.; HUANG, X.; CAI, Y.; TANG, R.; YANG, D. Size effect of hydroxyapatite nano particles on proliferation and apoptosis of osteoblast-likecells. Acta Biomaterialia, v. 5, p. 338-345, 2009.
SILVA, C.D. Adsorção de Albumina Bovina e Ácido Hialurónico em Cerâmicos de Titânio. 74f. 2008. Dissertação de Mestrado. Universidade Técnica de Lisboa, Lisboa.
SILVA, E.C.; BORGES, A.P.B.; NEVES, C.D.; CARLO, E.C.; BARROS, R.E.; HAGE, M.C.F.N.S.; DE SOUZA, R.L.; BARUD, H.S.; BICALHO, S.M.C.M. Utilização experimental de hidroxiapatita sintética em alvéolos dentários de gatos domésticos (Felis canis): estudo clínico radiográfico e histomorfométrico. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v. 64, p. 873-880, 2012.
SLEVIN, M.; KRUPINSKI, J.; GAFFNEY, J.; MATOU, S.; WEST, D.; DELISSER, H.; SAVANI, R.C. e KUMAR, S. Hyaluronan-mediated angiogenesis in vascular disease: Uncovering RHAMM and CD44 receptor signaling pathways. Matrix Biology, v. 26, p. 58-68, 2009.
TABATA,Y. Biomaterial technology for tissue engineering applications. Journal of the Royal Society Interface, v. 6, p. 311-324, 2009.
20 TIOMIS, A.C.; BORGES, A.P.P.; DAIBERT, A.P.F.; DUARTE, T.S.; PONTES, K.C.S.; CARVALHO, T.B.; CARLO REIS, E.C. Avaliação histológica do biovidro particulado na reparação de defeito experimental em mandíbula de cães. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v. 62, p. 80-85, 2010.
TURLEY, E.A.; NOBLE, P.W. e BOURGUIGNON, L.W. Signaling Properties of Hyaluronan Receptors.The journal of biological chemistry, v. 277, p. 4589-4592, 2002.
VEPARI, C. e KAPLAN, D.L. Silk as a biomaterial.Progress in Polymer Science, v. 32, p. 991-1007, 2007.
VITAL, C.C; BORGES, A.P.B.; FONSECA, C.C.; TSIOMIS, A.C.; CARVALHO, T.B.; FONTES, E.B.; SENA, M.P.; FÓFANO, G. Biocompatibilidade e comportamento de compósitos de hidroxiapatita em falha óssea na ulna de coelhos. Arquivo Brasileiro Medicina Veterinária e Zootecnia, v.58, p. 175-183, 2006.
VON RECUM, A. F. e LABERGE, M. Educational goals for biomaterials science and engineering: perspective view. Journal of Applied Biomaterials, v. 6 p. 137-144, 1995.
WAN, D.C.; NACAMULI, R.P.E e LONGAKER, M.T. Craniofacial bone tissue engineering.Dental Clinics of North America, v. 50, p. 175-190, 2006.
WANG, G.; YANG, H.; LI, M.; LU, S.; CHEN, X.; CAI, X. The use of silk fibroin/hydroxyapatite composite co-cultured with rabbit bone- marrow stromal cells in the healing of a segmental bone defect. The journal of bone and joint surgery, v. 92B, p. 320- 325, 2010.
WANG, X., YUCEL T.; LU, Q.; HU, X.; KAPLAN, D.L. Silk nanospheres and microspheres from silk/pva blend films for drug delivery.Biomaterials, v. 31, p. 1025–1035, 2009. WANG, Y.; KIM, H.; VUNJAK-NOVAKOVIC, G.; KAPLAN, D.L. Stem cell-based tissue
engineering with silk biomaterials.Biomaterials, v. 27, p. 6064-6082, 2006.
WEBSTER, T.J.; ERGUN, C.; DOREMUS, R.H.; SIEGEL, R.W.; BIZIOS, R. Enhanced functions of osteoblasts on nanophase ceramics. Biomaterials, v. 21, p. 1803-1810, 2000.
WEI, K.; LI, Y.; KIM, K. O.; NAKAGAWA, Y.; KIM, B. S.; ABE, K.; CHEN, G. Q.; KIM, I. S. Fabrication of nano-hydroxyapatite on electrospun silk fibroin nanofiber and their effects in osteoblastic behavior. Journal of Biomedical Material Research. Part A, v. 97A, p. 272-280, 2011.
21 YAN, L.; CORREIA, J.S.; CORREIA, C.; CARIDADE, S.G.; FERNANDES, E.M.; SOUSA, R.A.; MANO, J.F.; OLIVEIRA, J.M.; OLIVEIRA, A.L.; REIS, R.L. Bioactive macro/micro porous silk fibroin/ nano-sized calcium phosphate scaffolds with potential for bone-tissue-engineering applications. Nanomedicine, v. 8, p. 359-378, 2013.
YANG, Y.; WANG, H.; YAN, F.; QI, Y.; LAI, Y.; ZENG, D.; CHEN, G.; ZHANG, K. Bioinspired Porous Octacalcium Phosphate/Silk Fibroin CompositeCoating Materials Prepared by Electrochemical Deposition.Applied Materials Interfaces, v. 7, p. 5634-5642, 2015.
ZHANG, Q.; YAN, S. E LI, M. Silk Fibroin Based Porous Materials. Materials, v. 2,p. 2276-2295, 2009.
ZHANG, Y.; WU, C.; LUO, T.; LI, S.; CHENG, X.; MIRON, R.J. Synthesis andinflammatory response of a novel silk fibroin scaffold containing BMP7adenovirus for bone regeneration. Bone, v. 51, p. 704–713, 2012.
22
CAPÍTULO II
Caracterização e análise de biocompatibilidade
in vivo
do compósito
formado por hidroxiapatita, fibroína da seda e ácido hialurônico.
PERDIGÃO, A.P.L. et al.
RESUMO
A engenharia tecidual busca criar e aprimorar novas terapias e desenvolver novos biomateriais que restaurem, melhorem ou impeçam o agravamento da função tecidual comprometida. Para comprovar a eficácia destes biomateriais, análises e testes in vivo podem ser realizados como uma forma adequada de se avaliar a característica de topografia de superfície, cristalinidade e a análise de biocompatibilidade, antes de sua aplicação. Nesse contexto objetivou-se analisar três compósitos formados por hidroxiapatita (HAP), fibroína da seda (FS) e diferentes concentrações de ácido hialurônico (AH), sendo o compósito formado por HAP+FS, o compósito 2 formado por HAP+FS+1%AH e o compósito 3 formado por HAP+FS+3%AH. Foi avaliado o grau de cristalinidade de cada compósito através da difração de raios-X, bem como suas características de superfície através da microscopia eletrônica de varredura (MEV). Além dessas análises, realizou-se também o teste de biocompatibilidade, através da avaliação histopatológica dos tecidos coletados após 15, 30, 60 e 90 dias de implantação no tecido subcutâneo de coelhos. Os três compósitos apresentaram alto grau de cristalinidade. A MEV revelou superfícies complexas dos compósitos. Cristais de hidroxiapatita foram visualizados, bem como filamentos de fibroína da seda e ácido hialurônico, o aumentando assim a complexidade da topografia de superfície do compósito, e facilitando a adesão celular. O teste de biocompatibilidade revelou uma interação tecidual em resposta à presença do compósito, por meio de uma formação de tecido fibroso ao redor do biomaterial ao ultimo dia de avaliação.
23
CHARACTERIZATION AND BIOCOMPATIBILITY IN VIVO ANALYSIS OF THE
COMPOSITE CONSISTING OF HYDROXYAPATITE, SILK FIBROIN AND HYALURONIC ACID.
PERDIGÃO, A.P.L. et al.
ABSTRACT
Tissue engineering seeks to create and improve new therapies and develop new biomaterials that restore, improve or prevent the deterioration of the compromised tissue function. To prove the effectiveness of these biomaterials, analysis and in vivo tests can be performed as an appropriate way of evaluating the surface topography characteristic, crystallinity and biocompatibility analysis before implantation. In this context, this study aimed at analyzing three composites consisting of hydroxyapatite (HAP), silk fibroin (SF) and different concentrations of hyaluronic acid (HA), the composite 1 made of HAP + FS, the composite 2 formed by HAP + FS + 1% HA and the composite 3 formed from HAP + FS + 3% HA. We evaluated the degree of crystallinity of each composite through the diffraction of x-rays as well as their surface features by scanning electron microscopy (SEM). In addition to these analyzes, biocompatibility test was also conducted by histopathologic evaluation of tissues collected after 15, 30, 60 and 90 days of implantation in the subcutaneous tissue of rabbits. The three composites showed high degree of crystallinity. SEM revealed the composite complex surfaces. Hydroxyapatite crystals were visualized as well as the silk fibroin filaments and hyaluronic acid which helps improve the complexity of the topography, and the presence of pores in all three composites. The biocompatibility test revealed little tissue interaction in response to the composite presence, leading to encapsulation of biomaterials by fibrous tissue at the last evaluation date.
24 1. INTRODUÇÃO
A engenharia de tecidos utiliza conhecimentos nos domínios da ciência dos materiais, biologia, química, medicina, e de engenharia para criar materiais que podem servir temporariamente como suporte, veículo ou matriz e atuar de forma estrutural e/ou funcional durante a regeneração de um defeito (Sun et al., 2011).
Algumas estratégias são utilizadas para se produzir um biomaterial com características que forneçam resultados satisfatórios. Para isso, no momento de desenvolvimento desses compósitos, deve-se levar em consideração de vários fatores: a biocompatibilidade e uma interação positiva entre os biomateriais que fazem parte do compósito e entre o compósito e o leito receptor; a porosidade, tamanho de poros apropriados e uma elevada e complexa área de superfície que favorecem a adesão, crescimento e migração celular ao longo do processo regenerativo promovendo a osteointegração e a osteocondução; integridade mecânica, importante para a própria fabricação dos implantes e suporte de carga mecânica in vivo, além da biodegradabilidade e uma taxa de degradação adequada para se igualar a taxa de formação do novo tecido (Ma, 2004).
Diversos materiais hoje são alvos de pesquisas no ramo da bioengenharia. Cerâmicas bioativas, como a hidroxiapatita, têm sido largamente estudadas devido a suas características relacionadas com a reparação de defeitos ósseos. São extremamente biocompatíveis, devido a sua composição semelhante à dos tecidos ósseo, possui propriedades osteocondutoras que permitem o direcionamento do crescimento do tecido ósseo além de ser um biomaterial bioativo (Guastaldi et al.,2010; Mostafa et al., 2015). Adicionalmente, a estrutura porosa e cristalina da hidroxiapatita favorece e auxilia o processo de regeneração caracterizado por sua capacidade de biodegradação e proporciona o crescimento de vasos e transporte celular através dos poros durante o desenvolvimento tecidual em formação (Woodard et al., 2007).
25 componentes essenciais da matriz extracelular, que desempenha um papel preponderante na morfogênese do tecido, migração celular, diferenciação, e adesão devido a presença de receptores celulares que estimulam essas junções (Aslan et al., 2006).
O presente capítulo tem como objetivo caracterizar os compósitos HAP+FS (hidroxiapatita e fibroína da seda); HAP+FS+1%AH (hidroxiapatita, fibroína da seda e 1% de ácido hialurônico) e HAP+FS+3%AH (hidroxiapatita, fibroína da seda e 3% de ácido hialurônico), através da identificação das possíveis fases minerais presentes utilizando a difração de raios X, bem como analisar a topografia de sua superfície com auxílio da microscopia eletrônica de varredura. Adicionalmente, será descrito o processo de análise in vivo, a biocompatibilidade do biomaterial e seu processo de reabsorção.
2. MATERIAL E MÉTODOS
2.1. Biomaterial
Os compósitos estudados foram desenvolvidos pelo JHS Laboratório Químico Ltda., em Belo Horizonte, Minas Gerais, Brasil. Foram avaliados três compósitos, os quais eram constituídos de hidroxiapatita sintética (HAP-91 Plus), fibroína da seda (FS) e
ácido hialurônico (AH). As proporções de AH nas amostras foram de, respectivamente 0, 1 e 3%, sendo então representadas como: HAP+FS+0%AH; HAP+FS+1%AH; HAP+FS+3%AH.
A proporção entre os biomateriais HAP e FS foi de 80% e 20% em peso, respectivamente, em todos os compósitos. O método de fabricação de cada compósito não pode ser informado, pois se encontra em processo de patente.
2.2. Difração de raios X
26
passo a passo em intervalo de 15 a 50° 2θ com 0.05° de incremento e 2 segundos de
contagem de tempo em cada passo.
2.3. Microscopia eletrônica de varredura (MEV)
Para análise morfológica, foi utilizado um microscópio eletrônico de varredura (MEV) da marca LEO 1430VP, a voltagens de 15 kV. Para tal, as superfícies foram cobertas por uma camada de 20 nm de carbono, utilizando um sistema de deposição
“sputtering balzers” (Electron Microscopy Sciences, modelo 550x), e, através de uma fita
dupla face, foram fixados na superfície dos ‘’stubs’’ e colocados no interior do microscópio
para leitura e análise.
Foram obtidos dados qualitativos das fotografias, analisando-se a topografia das superfícies pela: 1) distribuição e formato dos cristais de hidroxiapatita expostos na superfície das amostras, se existentes; 2) presença ou não de poros.
2.4. Análise de biocompatibilidade in vivo
O presente trabalho experimental obteve sua metodologia aprovada pelo Comitê de Ética no Uso de Animais da UFV sob protocolo número 61/14.
Para as análises de biocompatibilidade in vivo, foram utilizados três coelhos da raça Nova Zelândia provenientes da Coelheira do Departamento de Zootecnia da UFV. Os animais obtiveram um mês para aclimatação a adaptação ao ambiente e foram alojados em gaiolas individuais, recebendo ração duas vezes ao dia e água ad libitum.
4-27 0. Após a implantação, a pele foi suturada com fio de náilon 2-0, padrão simples separado.
Tabela 1: Representação esquemática da localização das incisões e posteriores implantações no tecido subcutâneo realizadas no dorso de três animais.
ANIMAL 1 COMPÓSITO HAP+FS
Região crânio-dorsal direita
Incisão 1
Região crânio-dorsal esquerda
Incisão 2
Região dorso-caudal direita
Incisão 3
Região dorso-caudal esquerda
Incisão 4
ANIMAL 2
COMPÓSITO HAP+FS+1%AH
Região crânio-dorsal direita
Incisão 1
Região crânio-dorsal esquerda
Incisão 2
Região dorso-caudal direita
Incisão 3
Região dorso-caudal esquerda
Incisão 4
ANIMAL 3
COMPÓSITO HAP+FS+3%AH
Região crânio-dorsal direita
Incisão 1
Região crânio-dorsal esquerda
Incisão 2
Região dorso-caudal direita
Incisão 3
Região dorso-caudal esquerda
Incisão 4
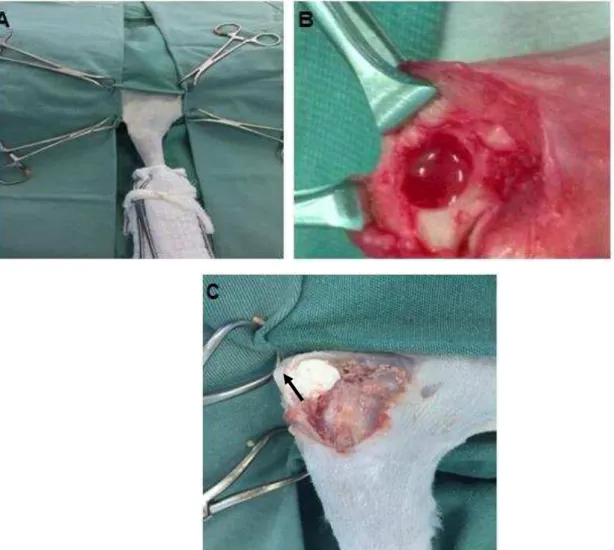
Figura 1: Cirurgia de implantação do compósito HAP+FS+3%AH (seta preta) no tecido subcutâneo do animal 3. A: Compósito implantado na região dorso- caudal esquerda. B: Três dias de pós-operatório de cirurgia de implantação. Observar a disposição das incisões, como esquematizado na tabela 1.
28 encaminhadas para o processamento histológico de rotina (fixação,desidratação, inclusão em parafina, microtomia e coloração por hematoxilina-eosina). Foi avaliada a presença do compósito, sua morfologia e os tecidos e as células em contato com o compósito, os quais foram caracterizados. Foi avaliada e descrita a presença ou ausência da cápsula fibrosa. A presença de infiltrado inflamatório foi caracterizada como discreto moderado ou intenso. Outras características também foram avaliadas e descritas como a irrigação sanguínea, presença de regiões hemorrágicas, infiltração tecidual dentro do biomaterial e evidencias de fagocitose.
3. RESULTADOS E DISCUSSÃO
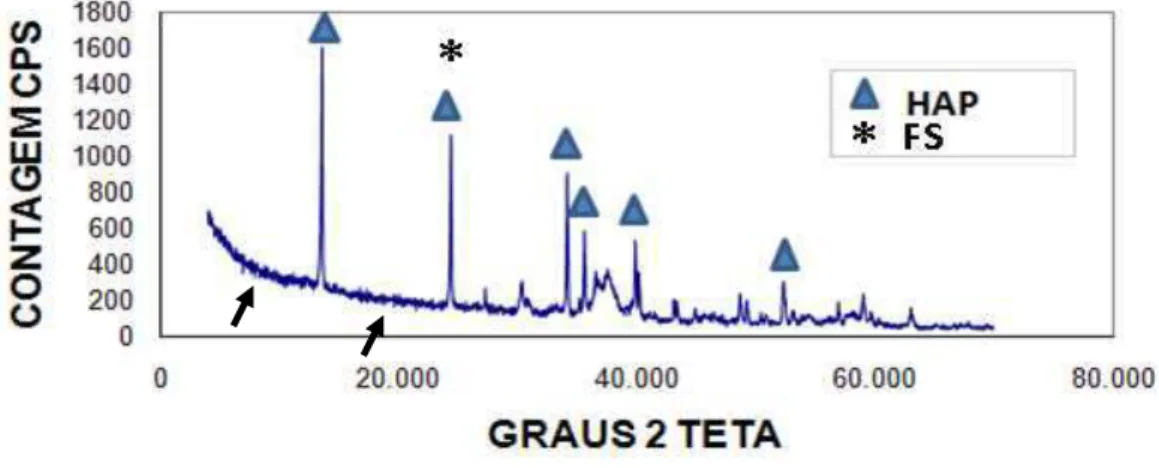
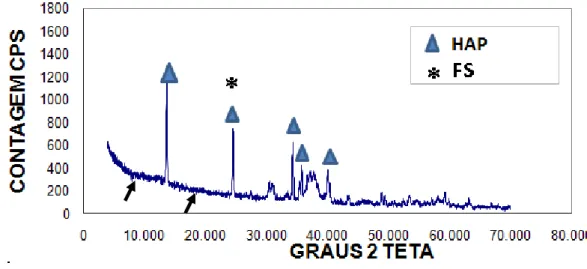
O difratograma de cada compósito está representado na figura 2 (HAP+FS), figura 3 (HAP+FS+1%AH) e figura 4 (HAP+FS+3%AH).
29 Figura 3: Difratograma do compósito de hidroxiapatita sintética associada à fibroína de seda e ácido hialurônico a 1% (HAP+FS+1%AH) na avaliação de sua cristalinidade por difração de raios X. Notar os picos de hidroxiapatita sintética (HAP) representados por e picos de fibroína da seda (regiões folha β) representados por asterisco(*).Notar regiões amorfas (seta preta) representando as fases amorfas dos polímeros presentes nos compósitos (fibroína da seda).
Figura 4: Difratograma do compósito de hidroxiapatita sintética associada à fibroína de seda e ácido hialurônico a 3% (HAP+FS+3%AH) na avaliação de sua cristalinidade por difração de raios X. Notar os picos de hidroxiapatita sintética (HAP) representados por e picos de fibroína da seda (regiões folha β) representados por asterisco(*).Notar regiões amorfas (seta preta) representando as fases amorfas dos polímeros presentes nos compósitos (fibroína da seda).