COMPÓSITOS DE HIDROXIAPATITA E POLIHIDROXIBUTIRATO EM DEFEITOS ÓSSEOS EXPERIMENTAIS NA ULNA DE COELHOS.
VIÇOSA
MINAS GERAIS – BRASIL 2007
Dedico este trabalho aos meus pais,
Murilo e Laisse que,
se eu pudesse ter escolhido,
AGRADECIMENTOS
A Deus por me abençoar com tanto e me levar por seus caminhos. À minha Santa Terezinha que sempre intercedeu por mim.
Aos meus pais, Murilo e Laisse, pelo exemplo, amor e apoio incondicional durante essa e todas as fases de minha vida.
À minha orientadora Andrea Pacheco Batista Borges por todos os ensinamentos, confiança, apoio e disponibilidade em tantos momentos desses estudos e pela amizade construída a cada dia.
Ao Múcio, pela compreensão, carinho e estímulo nos momentos difíceis e é claro, pelo apoio na fase de exames clínicos.
Aos meus irmãos por compartilharem as alegrias por cada conquista durante essa pós-graduação.
Ao Prof. Cláudio Fonseca pela presença constante, apoio e sugestões durante todo o processamento e análises histológicas.
Aos Profs. Ricardo Junqueira e Luís Gonzaga pelos ensinamentos e valiosas sugestões durante todo o curso.
Aos Profs. Marlene Vilória, Maria Cristina, Sérgio da Matta e Eduardo Paulino pelos conhecimentos compartilhados e colaboração neste trabalho.
Aos Profs. José Antônio e José Dantas pela amizade e colaboração com meu crescimento profissional e pessoal.
Aos Profs. Leonardo Muzzi e Paulo Oliveira pela presença e contribuição com esse trabalho.
Aos meus colegas e amigos Mastoby, Renato, Gláucia, Renata e Alexandro por toda colaboração que tornou possível a realização deste trabalho, foram essenciais.
À Tatinha pela amizade e experiência compartilhada em tantos momentos. À Maninha, Alex, Etelvina, Claudiomiro, Paulo, Camilo, Sônia, Aécio, Lucinda, Luís Márcio, Celinho, Valnei, Toninho e Luís Paulo tão atenciosos nas fases de cirurgia, exames clínicos e radiografias, sem os quais tudo teria sido mais difícil.
Aos colaboradores José do Carmo, Vânia, Adão e Cláudio, imprescindíveis no processamento histológico.
À Rose e Geraldinho, pelo carinho, atenção e boa vontade.
Aos colegas da pós-graduação Mastoby, Kelly, Fabrício, Ana Paula, Betânia, Liana, João, Taciana, Lukyia, Evandro, Jair, Maurício, Lívia e Cíntia pela amizade e atenção em cada momento.
À pós-graduação do Departamento de Medicina Veterinária da UFV pela oportunidade.
À JHS Laboratório Químico, na pessoa da Dra. Sheyla Maria de Castro Máximo Bicalho, pelo fornecimento do material testado, confiança e apoio com os trabalhos apresentados.
Ao Prof. Leonardo Muzzi pela presença na banca de defesa e valiosas sugestões. Ao Prof. Paulo Oliveira pela atenção e esclarecimentos técnicos.
À CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior) pela concessão da bolsa que viabilizou meus estudos e pesquisa.
SUMÁRIO
LISTA DE FIGURAS ... v
LISTA DE TABELAS ... viii
RESUMO ... ix
ABSTRACT ... xi
INTRODUÇÃO ... 1
REVISÃO DE LITERATURA ... 2
1. O problema ... 2
2. Enxertos e biomateriais ... 3
3. Hidroxiapatita ... 6
4. Polihidroxibutirato ... 9
5. Compósito de hidroxiapatita e polihidroxibutirato ... 11
MATERIAL E MÉTODOS ... 14
RESULTADOS E DISCUSSÃO ... 21
1. Trans-operatório... 21
2. Exame clínico ... 21
3. Análise radiográfica ... 24
4. Avaliações histológicas e histomorfométricas ... 29
CONCLUSÕES ... 47
PERSPECTIVAS ... 48
LISTA DE FIGURAS
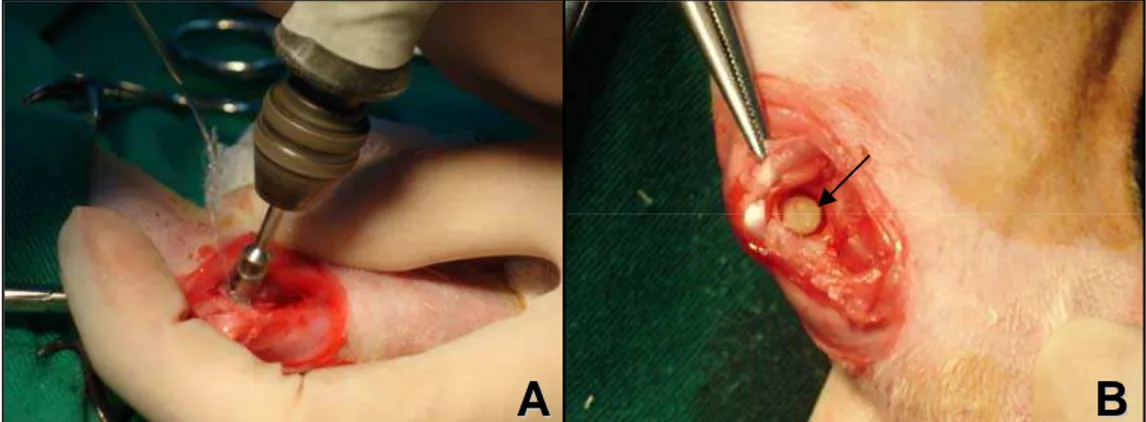
Figura 1. Fórmula estrutural do monômero do polihidroxibutirato. 9 Figura 2. Procedimento cirúrgico para realização do defeito experimental na ulna de coelho. A- Realização do defeito na cortical lateral do olécrano com broca trefina acoplada a perfuratriz elétrica sob irrigação com solução salina. B-
Compósito 1 (seta) dentro do defeito. 16
Figura 3. Representação do esquema da análise radiográfica. Esquema da radiografia mediolateral (A), esquema da divisão em quadrantes em transparência (B) e sobreposição para divisão em quadrantes (C). 18 Figura 4. Sentido de corte do fragmento do olécrano para obtenção da superfície de análise nas vistas lateral e caudo-cranial da ulna e regiões anatômicas em
relação ao defeito. 19
Figura 5. Radiografias mediolaterais do olécrano de coelhos submetidos à realização de defeito na cortical lateral e implantação de compósitos de hidroxiapatita e polihidroxibutirato, no pós-operatório imediato. A- grupo controle, B- grupo 1, C- grupo 2, D- grupo 3. Setas indicam halo radiotransparente ao redor dos compósitos.
28 Figura 6. Radiografias mediolaterais do olécrano coelhos submetidos à realização de defeito na cortical lateral e implantação de compósitos de hidroxiapatita e polihidroxibutirato, aos 8 dias após a cirurgia. A- grupo controle, sem compósito. B- grupo 1. C- grupo 2. D- grupo 3. Setas indicam halo
radiotransparente ao redor dos compósitos. 28
Figura 7. Radiografias mediolaterais do olécrano de coelhos submetidos à realização de defeito na cortical lateral e implantação de compósitos de hidroxiapatita e polihidroxibutirato, aos 45 dias após a cirurgia. A- grupo controle, sem compósito. B- grupo 1. C- grupo 2. D- grupo 3. Ausência do halo radiotransparente entre compósito e osso e o contato direto entre eles (setas). Região de radiopacidade menor do que a do osso vizinho no grupo controle
(asterisco). 28
Figura 8. Radiografias mediolaterais do olécrano de coelhos submetidos à realização de defeito na cortical lateral e implantação de compósitos de hidroxiapatita e polihidroxibutirato, 90 dias após a cirurgia. A- grupo controle. B- grupo 1, C- grupo 2, D- grupo 3. Contato direto entre compósitos e tecido ósseo (setas finas).
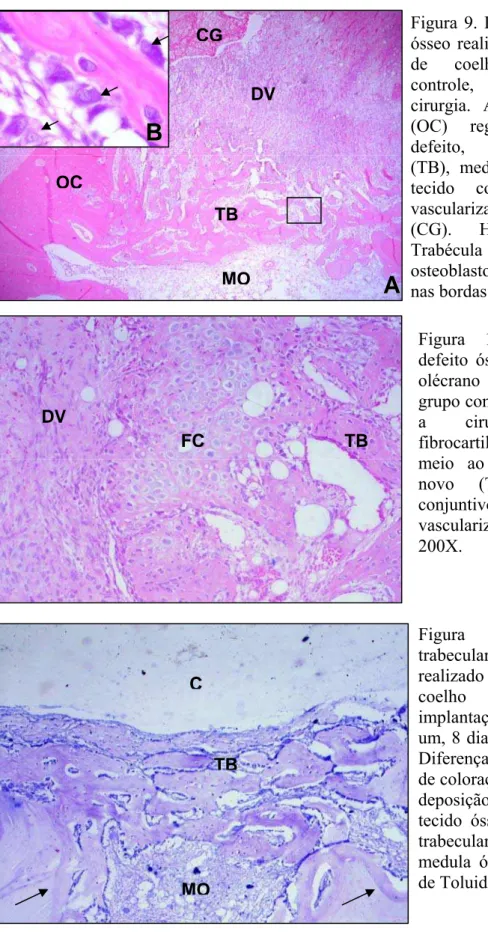
e coágulo (CG). HE, 40X. B- Ampliação de área demarcada em A. Trabécula óssea nova com osteoblastos ativos (setas) nas bordas. HE, 1000X. 32 Figura 10. Região do defeito ósseo do grupo controle realizado no olécrano de coelho, 8 dias após a cirurgia. Tecido fibrocartilaginoso (FC) em meio ao osso trabecular novo (TB) e tecido conjuntivo denso vascularizado (DV). HE, 200X. 32 Figura 11. Região trabecular do defeito ósseo realizado no olécrano de coelho submetido à implantação do compósito um, 8 dias após a cirurgia. Diferença na intensidade de coloração que demarca nova deposição de camadas de tecido ósseo (setas). Osso trabecular novo (TB), medula óssea (MO). Azul de
Toluidina, 100X. 32
Figura 12. Região do defeito ósseo realizado no olécrano de coelho submetida à implantação do compósito três aos 8 dias após a cirurgia. A- Projeção de tecido conjuntivo denso vascularizado (DV) e ósseo (O) para o interior do compósito (C). B- Projeção de tecido conjuntivo (TC) sem conexão aparente com tecidos adjacentes no interior do compósito (C), com vaso sangüíneo no centro (seta).
Azul de Toluidina, 200X. 35
Figura 13. Regiões do defeito ósseo realizado no olécrano de coelho do grupo um, 45 dias após a cirurgia. Região lateral (L) do compósito um envolvida por tecido ósseo trabecular novo. Regiões distal (D) e trabecular com tecido ósseo mais organizado (TO). HE, 40X. B- Grupo dois aos 45 dias. Interface (seta) com contato direto entre tecido ósseo (O) e compósito (C). Azul de toluidina, 200X. 35 Figura 14. Regiões do defeito ósseo realizado no olécrano de coelhos do grupo três, 45 dias após a cirurgia. A-Trabéculas no interior do compósito (setas), próximas à região trabecular do defeito, com osso trabecular mais organizado (TM) do que aos 8 dias. HE, 100X. B- Fragmentos do compósito (C) separados do bloco original em meio ao tecido ósseo (O) na região trabecular do defeito. O contato direto entre osso e compósito é indicado pelas setas. Azul de toluidina,
200X. 35
Figura 15. Região do defeito ósseo realizado no olécrano de coelhos submitdos à implatação de compósitos de hidroxiapatita e polihidroxibutirato. A- Interface (seta) do compósito um (C) com fina camada de tecido fibroso aos 90 dias após a cirurgia. Tecido ósseo (O) e medula óssea associada (MO). HE, 100X. B- Interface (setas) do compósito dois aos 90 dias com tecido ósseo (O) e medula óssea adjacente (MO). Projeções de tecido conjuntivo (asteriscos) no compósito
(C). Azul de toluidina, 100X. 38
Figura 17. Seqüência do desenvolvimento de tecidos para o interior do compósito três até a fragmentação do mesmo a partir do bloco original. A- Tecido conjuntivo denso vascularizado (seta) penetrando no compósito (C) aos 8 dias. Tricrômico de Gomori, 200X. B- Tecidos ósseo (seta larga) e conjuntivo denso vascularizado (setas finas) envolvendo fragmentos do compósito (asteriscos). HE, 100X. Fragmentos do compósito (C) envoltos por tecido ósseo (seta) separado do bloco original. Azul de toluidina, 100X. 39
LISTA DE TABELAS
Tabela 1. Distribuição dos compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de PHB (grupo 2) e 50% de HA e 50% de PHB (grupo3) nos
membros por animal. 16
Tabela 2. Resultado da análise dos parâmetros clínicos de acordo com o número de membros afetados e número de manifestações durante o período de exames, após a realização de defeitos ósseos experimentais na ulna de coelhos e implantação ou não (grupo controle – C) de compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de PHB (grupo 2) e 50% de HA e 50% de PHB
(grupo3). 22
Tabela 3. Médias e desvio padrão das diferenças dos valores de circunferência (cm) dos membros, após a realização de defeitos ósseos experimentais na ulna de coelhos e implantação ou não (grupo controle – C) de compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de PHB (grupo 2) e 50% de HA e
50% de PHB (grupo3). 24
Tabela 4. Porcentagem de quadrantes que apresentaram radiopacidade semelhante à do osso vizinho e porcentagem dos defeitos que diminuíram de tamanho em radiografias realizadas aos 8, 45 e 90 dias após a realização de defeitos ósseos experimentais na ulna de coelhos e implantação ou não (grupo controle – C) de compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de
PHB (grupo 2) e 50% de HA e 50% de PHB (grupo3). 27
Tabela 5. Médias e desvio padrão das porcentagens de tecido ósseo e tecidos moles formados nos defeitos ósseos experimentais na ulna de coelhos aos 8, 45 e 90 dias após a implantação de compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de PHB (grupo 2) e 50% de HA e 50% de PHB (grupo3). 44 Tabela 6. Médias e desvio padrão das porcentagens de tecido ósseo e tecidos moles formados na interface com compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de PHB (grupo 2) e 50% de HA e 50% de PHB (grupo3), de aos 8, 45 e 90 dias após a implantação em defeitos ósseos experimentais na ulna de
coelhos. 44
Tabela 7. Médias e desvio padrão das porcentagens de tecido ósseo e tecidos moles formados no interior de compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de PHB (grupo 2) e 50% de HA e 50% de PHB (grupo3), de aos 8, 45 e 90 dias após a implantação em defeitos ósseos experimentais na ulna de
coelhos. 45
Tabela 8. Média e desvio padrão do número de osteoclastos presentes nos defeitos ósseos na ulna de coelhos aos 8, 45 e 90 dias após a cirurgia com implantação ou não (grupo controle – C) de compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de PHB (grupo 2) e 50% de HA e 50% de PHB
RESUMO
CARLO, Emily Correna, M.Sc., Universidade Federal de Viçosa, outubro de 2007. Compósitos de hidroxiapatita e polihidroxibutirato em defeitos ósseos experimentais na ulna de coelhos. Orientadora: Andrea Pacheco Batista Borges. Co-orientadores: Cláudio César Fonseca, Ricardo Junqueira Del Carlo e Marlene Isabel Vargas Viloria.
ABSTRACT
CARLO, Emily Correna, M.Sc., Universidade Federal de Viçosa, October, 2007. Hydroxyapatite-polyhydroxybutyrate composites in experimentally made bone deffects in rabbits ulna. Adviser: Andrea Pacheco Batista Borges. Co-advisers: Cláudio César Fonseca. Ricardo Junqueira Del Carlo and Marlene Isabel Vargas Viloria.
INTRODUÇÃO
Dois importantes desafios da ortopedia são a perda de tecido ósseo e os
problemas na consolidação de fraturas. Grandes defeitos ósseos resultantes de diversas
afecções como traumas e neoplasias precisam ser preenchidos com algum tipo de
enxerto para manter a continuidade óssea local e auxiliar a regeneração. Quanto às
fraturas, muitas delas necessitam de estabilização interna, o que envolve algum material,
implantado diretamente em contato com os tecidos.
Baseados nessas necessidades, pesquisadores de diversas áreas do conhecimento
vêm por décadas procurando um substituto ósseo ideal e um material que cumpra a
função de estabilização de fraturas sem provocar qualquer alteração local ou sistêmica a
curto e longo prazos.
Esta pesquisa consta de uma análise preliminar para permitir futuramente, de
acordo com os resultados obtidos, diferentes destinos para compósitos fabricados com
matérias-primas e tecnologia nacionais. Esses destinos podem incluir o uso como
material preenchedor de defeitos ósseos capaz de suportar cargas mecânicas e a
fabricação de placas e parafusos para fixação de fraturas e artrodeses. Podem, ainda,
servir como suporte para cultura de células e posterior implantação em defeitos ósseos,
aliando assim a osteoindução, resistência mecânica e osseocondução.
Para tal, deve-se confirmar primeiramente a biocompatibilidade desses
compósitos, necessária para qualquer uma dessas utilizações. Para servir como ponte
entre fragmentos ósseos em um grande defeito, tornando possível a regeneração normal
sem a interposição de tecido fibroso, as características também necessárias são a
osseocondução e biodegradação. Já para a fabricação de placas e parafusos a
osseocondução não é importante, mas sim a biocompatibilidade, biodegradação e
resistência mecânica.
Portanto, este estudo teve por objetivo investigar a resposta a compósitos de
hidroxiapatita e polihidroxibutirato em defeitos provocados na ulna de coelhos,
analisando a biocompatibilidade dos compósitos, avaliando se os mesmos interferem na
formação de novo osso e verificando o tipo de interação osso-compósito, de acordo com
os tecidos e as células envolvidos na resposta do organismo. Objetivou-se, também,
determinar a existência ou não da propriedade osseocondutora, avaliar o potencial de
REVISÃO DE LITERATURA
1. O problema
Doenças e lesões ósseas são condições que afetam diretamente a qualidade de
vida de pessoas e animais de companhia, sendo diversos os processos que podem
resultar na perda de tecido ou na dificuldade de sua reparação (Kokubo et al., 2003).
Em traumatologia, as fraturas cominutivas são um grande problema tanto pela
perda do tecido quanto pela dificuldade de estabilização e, consequentemente, de
regeneração, gerando longos períodos de internamento e podendo levar à união
retardada ou até mesmo à não-união. Grande parte dessas fraturas resulta dos acidentes
automobilísticos, tanto em pequenos animais quanto na espécie humana, além de quedas
e agressões físicas. Existem locais sabidamente predispostos à união retardada e à
não-união como nas fraturas distais no rádio em cães de pequeno porte. Este local também é
um problema na espécie humana, assim como fraturas proximais no úmero e platô tibial
(Boer et al., 2003; Ilan e Ladd, 2003).
Na odontologia, a perda de tecido ósseo é comum devido à reabsorção do osso
alveolar em decorrência da doença periodontal, gerando alterações no contorno facial e
perda dos dentes adjacentes, o que também ocorre em cães e gatos (MacNeill et al.,
1999). Outro problema é a dificuldade na manutenção da borda alveolar após perdas ou
extrações dentárias, afetando a fixação de implantes dentários (Brandão et al., 2002).
No caso das cirurgias na coluna vertebral, implantes são usados para
proporcionar estabilidade imediata permitindo a artrodese de vértebras, intervenção
necessária em conseqüência de processos traumáticos ou doenças degenerativas
(Vaccaro et al., 2003).
A expectativa de vida das pessoas tem aumentado nas últimas décadas e
continua a aumentar, mas a qualidade do tecido ósseo, em termos de resistência e
densidade, diminui progressivamente (Hench, 2000). A osteoporose e o próprio
processo de envelhecimento são mudanças degenerativas que predispõem às fraturas e à
dificuldade na regeneração do osso fraturado (Kawachi et al., 2000; Gruber et al., 2006).
Estima-se que, nos EUA, 16,8 milhões de mulheres (54%) após a menopausa têm
osteopenia e 9,4 milhões têm osteoporose, e que 40% de todas as mulheres e 13% de
todos os homens acima de 50 anos terão fraturas em decorrência disso, dados aplicáveis
As cirurgias craniofaciais corretivas, comuns na espécie humana em decorrência
de traumas, neoplasias ou correção estética, geralmente resultam em defeitos ósseos ou
osteotomias que necessitam de preenchimento ou fixação por placas e parafusos (Klinge
et al., 1992; Walsh et al., 2003).
2. Enxertos e biomateriais
Os biomateriais aplicados na ortopedia podem ser divididos em dois grandes
grupos, os substitutos para o tecido ósseo e os implantes para fixação de fraturas. O tipo
de fratura ou defeito ósseo dita o que se espera de um substituto ósseo ou implante de
fixação (Ilan e Ladd, 2003).
Nos defeitos ósseos, os substitutos têm por função ocupar o espaço, mantendo
redução apropriada e continuidade dos fragmentos ósseos, permitindo adequada
regeneração (Boer et al., 2003). Em face da necessidade de preenchimento recorre-se
aos enxertos autógenos, alógenos, xenógenos e aos biomateriais de origem natural ou
sintética. O enxerto autógeno é considerado o padrão para o tratamento de defeitos
ósseos ou retardo na regeneração por apresentar excelente atividade biológica sendo
osseocondutor e osteoindutor, além de não induzir resposta imune (MacNeill et al.,
1999; Hench, 2000; Boer et al., 2003; Ilan e Ladd, 2003). Entretanto, esses enxertos
possuem desvantagens importantes como disponibilidade e quantidades limitadas,
resistência mecânica inadequada, difícil fixação ao local necessário e ainda a alta
morbidade associada ao local doador, que pode incluir a deformidade deste local além
de dor e infecção (Klinge et al., 1992; Boeree et al., 1993; Hench, 2000; Ilan e Ladd,
2003; Mygind et al., 2007). Essa taxa de morbidade varia dependendo do tipo de estudo
realizado, com um mínimo de 8,6% e máximo de 30% dos casos (Boer et al., 2003;
Vaccaro et al., 2003; Xie et al., 2006).
Os enxertos alógenos, aqueles obtidos de outros indivíduos da mesma espécie do
indivíduo receptor, são boas alternativas. Encontra-se sua principal utilização em
medicina veterinária naquelas fraturas cominutivas da diáfise de ossos longos e na
medicina humana nos casos de fraturas cominutivas e exérese de neoplasias ósseas.
Contudo, apresentam desvantagens que limitam sua utilização, como a possibilidade de
transmissão de patógenos como o vírus da imunodeficiência felina (FIV) e os vírus da
AIDS e hepatites B e C em humanos. Além disso, possui baixa atividade biológica em
envolvidas em alguns casos. Ao contrário do que se imaginaria, já que um doador pode
beneficiar até 30 pessoas, sua disponibilidade é limitada na espécie humana, com tempo
médio de espera na “fila de transplantes” de seis meses no Brasil. No ano de 2006, o
Instituto Nacional de Traumato-Ortopedia do Rio de Janeiro recebeu apenas três
doações quando seriam necessárias de 30 a 40 para atender a demanda. Além desses
problemas na espécie humana, existem relatos de que até 25% das reconstruções
utilizando enxertos alógenos são mal sucedidas devido à infecção, não-união e fraturas
(Hench, 2000; Kokubo et al., 2003; Castro, 2007; Ferraz, 2007; Into, 2007; SC
Transplantes, 2007; Woodard et al., 2007). O problema de disponibilidade seria
eliminado no caso dos enxertos xenógenos, mas ainda existe a possibilidade de
transmissão de doenças e de rejeição devido à reação imunológica (Piermattei e Flo,
1999; Hench, 2000).
Diversos estudos têm sido realizados nas últimas décadas buscando materiais
sintéticos (biomateriais) para o preenchimento de defeitos ósseos. As principais
vantagens dos materiais sintéticos são a disponibilidade, reprodutibilidade,
confiabilidade e a resistência mecânica em alguns casos (Hench, 2000). Como
preenchedor de defeitos ósseos, o objetivo é desenvolver um material que seja
osseocondutor, servindo como suporte para o crescimento de novo osso e que seja
reabsorvido a uma velocidade conhecida, sendo assim, gradativamente substituído pelo
novo osso em crescimento (MacNeill et al., 1999).
Atualmente os implantes ortopédicos mais utilizados são placas e parafusos
fabricados com metais como as ligas de titânio e aço inoxidável. Suas vantagens estão
nas propriedades mecânicas, com grande resistência às diversas forças neles exercidas.
Contudo, essas propriedades mecânicas são muito diferentes das propriedades
mecânicas do osso e, após a consolidação da fratura, esse implante protege o osso das
cargas normalmente impostas durante a movimentação e apoio dos membros. Sabe-se
que essas cargas normais são necessárias à manutenção da densidade e contorno ósseos,
sem elas, o remodelamento ósseo é afetado, levando a osteólise local e conseqüente
enfraquecimento, com possibilidade de novas fraturas (Doyle et al., 1991; Boeree et al.,
1993; Liu e Wang, 2006; Rumpel et al., 2006).
Existe ainda grande preocupação devido à liberação lenta e progressiva de íons
metálicos (debris) no organismo. Esses debris são citotóxicos e responsáveis por
hipersensibilidades, respostas inflamatórias contínuas e progressivas e mesmo
osteossarcoma em cães (Hallab et al., 2000; Pereira et al., 2005; Kleiner e Silva, 2007;
Rasse et al., 2007; Sargeant e Goswami et al., 2007). Essas reações são particularmente
importantes quando os implantes são utilizados na coluna vertebral e face, devido à
proximidade com o tecido nervoso (Vaccaro et al., 2003; Yerit et al., 2005), mas os
debris não se limitam às regiões peri-implante, tendo sido encontrados em linfonodos
regionais e nos pulmões. A presença desses debris e suas conseqüências são
particularmente importantes em crianças e animais jovens já que permanecem no
organismo por longo tempo, além de que a permanência do implante pode afetar
negativamente o crescimento (Gogolewski, 2000; Maurer et al., 2002; Yerit et al., 2005;
Russias et al., 2006; Rasse et al., 2007).
Outras desvantagens de implantes metálicos incluem a interferência com alguns
tipos de técnicas de diagnóstico por imagem, a migração e colapso após algum tempo de
implantação e a sensibilidade ao calor ou frio (Oliveira, 2005; Sargeant e Goswami et
al., 2007). Para eliminar essas desvantagens uma alternativa é a remoção do implante
após a consolidação óssea, procedimento que envolve a realização de nova cirurgia,
com todos seus inconvenientes, custos e potenciais complicações (Weiler et al., 2000).
Nos últimos anos, a engenharia de biomateriais vem mudando a ênfase que dá a
materiais que permanecem completamente estáveis em meio biológico para materiais
que alteram suas propriedades ou biodegradam em resposta ao meio celular ou
extracelular (Doyle et al., 1991; Ni e Wang, 2002).
Os implantes reabsorvíveis eliminam as desvantagens dos implantes metálicos e
fornecem nova alternativa como material preenchedor de defeitos, proporcionando um
arcabouço para o crescimento de tecido ósseo com resistência mecânica. Um material
lentamente reabsorvido, com resistência e elasticidade próximas às do osso e a
capacidade de estimular a regeneração óssea, seria revolucionário no preenchimento de
defeitos ósseos e na fabricação de implantes, eliminando as desvantagens dos enxertos
autólogos e dos implantes metálicos (Rumpel et al., 2006).
A grande vantagem dos implantes reabsorvíveis na estabilização de fraturas é
que conferem resistência mecânica durante a regeneração óssea e, após a
osseointegração, normalmente de 4 a 8 semanas, são gradualmente reabsorvidos quando
não mais são necessários. Esses implantes degradam em meio biológico gerando
produtos de degradação que são incorporados aos processos fisiológicos e bem
tolerados pelo organismo receptor. Além disso, esses materiais possuem módulo de
interferem em exames por imagem e, à medida que são reabsorvidos, as forças
mecânicas são compartilhadas, progressivamente, entre osso e implante (An et al., 2000;
Vaccaro et al., 2003). Outra possível utilização desses implantes reabsorvíveis são os
sistemas de liberação lenta de medicamentos, com implantes contendo antibacterianos
contra osteomielite (An et al., 2000). Em alguns procedimentos na medicina do esporte,
não existe a necessidade de implantes de grande resistência mecânica ou são até
contra-indicados, abrindo caminho para utilização dos implantes biodegradáveis (Weiler et al.,
2000).
Existem disponíveis no mercado internacional, implantes ortopédicos
biodegradáveis fabricados por diferentes processamentos e diversas proporções de ácido
poliláctico (PLA) e ácido poliglicólico (PGA). Esses materiais foram testados como
espaçadores em cirurgias da coluna vertebral e na fixação de fraturas cranio-faciais
(Vaccaro et al., 2003; Pereira et al., 2005). Contudo, suas limitações encontram-se no
alto custo e na baixa resistência mecânica, reservando o uso em locais não submetidos a
grandes cargas, sendo considerados sistemas de fixação interna semi-rígida. Alguns
trabalhos relatam problemas na degradação, com ocorrência de inflamação asséptica e
osteólise associadas aos debris produzidos durante a degradação, e problemas de
instabilidade na interface desses implantes com o tecido ósseo, não ocorrendo
osseointegração, mas sim a formação de tecido fibroso circundante que pode evoluir
para encapsulamento fibrótico hipertrófico (Hench, 2000; Yerit et al., 2005; Lima Júnior
et al., 2006; Russias et al., 2006; Rasse et al., 2007).
3. Hidroxiapatita
A hidroxiapatita natural, representada pela fórmula Ca10(PO4)6(OH)2, é o
principal constituinte da parte mineral da matriz óssea. É uma cerâmica que pode ser
obtida de fonte natural ou sinteticamente (Cobb et al., 1990; Holden e Bernard et al.,
1990; Knowles et al., 1992; Borges et al, 2000; Boskey e Myers, 2004).
Atualmente, a hidroxiapatita tem como principal indicação clínica o
preenchimento de defeitos ósseos, auxiliando a regeneração em diversos locais como
nos seios maxilares, nas diáfises de ossos longos, na borda do osso alveolar e como
adjuvante em artrodeses (Brandão et al., 2002; Dórea Neto et al., 2004; Ajdukovic et al.,
A hidroxiapatita (HA) sintética é um material biocompatível, bioativo e
osseocondutor, ou seja, tem a capacidade de servir como suporte para o crescimento de
novo osso, dentro de seus poros, a partir das margens de um defeito (Cobb et al., 1990;
Holden e Bernard et al., 1990; Knowles et al., 1992; Ayers et al., 1998; Kienapfel et al.,
1999; Borges et al., 2000; Galego et al., 2000; Eid et al., 2001; Tampieri et al., 2001;
Boer et al., 2003; Ilan e Ladd, 2003; Duarte et al., 2006; Imaizumi et al., 2006; Scarano
et al., 2006; Resende et al., 2006; Vital et al., 2006). A HA não apresenta a propriedade
de osteoindução (Borges et al, 2000; Conz et al., 2005; Carlo et al., 2006 b).
A maioria dos materiais sintéticos são geralmente isolados por tecido conjuntivo
fibroso quando implantados no organismo, diferentemente dos bioativos, que formam
ligação fisico-química com o tecido ósseo. Diversos estudos demonstraram a ligação
direta da HA com o tecido ósseo, sem interposição de tecido conjuntivo fibroso. Foi
observado que, ao entrar em contato com fluidos corpóreos como o plasma sangüíneo, o
meio em torno da HA se torna ácido, como ocorre nas lesões cirúrgicas próprias do
processo de implantação, permanecendo sua superfície carregada negativamente, devido
a grupos OH- e PO-34. Esses grupos combinam, seletivamente, com o Ca+2, carregado
positivamente, formando fosfato de cálcio. À medida que o cálcio acumula, a superfície
começa a se tornar positiva, atraindo dos fluidos corporais, íons fosfato carregados
negativamente. Essa camada é instável e transiente e se transforma em camada de
apatita carbonatada, que foi demonstrada por Fujibayashi et al. (2003) por meio da
microscopia eletrônica de varredura. Esta camada é responsável pela bioatividade da
HA e alguns estudos demonstraram que os nanocristais de apatita muito semelhantes à
fase mineral da matriz óssea, que fornecem um ambiente para células precursoras
migrarem, fixarem e diferenciar-se em osteoblastos, produtores de novo osso. Esses
nanocristais também se associam às fibras colágenas da matriz orgânica produzida pelos
osteoblastos e, o recrutamento dessas células precursoras leva à formação de tecido
ósseo. Acredita-se que o plasma sanguíneo, primeira fase orgânica com a qual a HA
entra em contato ao ser implantada, inicie as trocas iônicas com sua superfície. Portanto,
pode-se considerar que a interface HA-tecido ósseo é um produto da combinação de
interações químicas, biológicas e fisiológicas (MacNeill et al., 1999; Rohanizadeh et al.,
1999; Borges et al., 2000; Hench, 2000; Kawachi et al., 2000; Kim, 2003; Kokubo et
al., 2003).
Diversos estudos enfatizam que a formação da camada de apatita na superfície
Kim, 2003). Após a implantação da HA, a seqüência de eventos passa pela
neovascularização, diferenciação de células osteoprogenitoras, formação de novo osso e
remodelamento ósseo (Walsh et al., 2003).
A semelhança da HA com a matriz óssea inorgânica é química, física e estrutural
(Oliveira, 2005; Wang et al., 2005). Sua estrutura apresenta poros que funcionam como
suporte para a migração e deposição de células osteogênicas, permitindo a formação de
novo osso. O contato estabelecido com o tecido ósseo se forma entre os grânulos e no
interior dos poros presentes em sua estrutura, dessa forma, a HA é incorporada ao tecido
ósseo em formação (Borges et al., 2000; Galego et al, 2000; Tampieri et al., 2001; Boer
et al., 2003; Woodard et al., 2007). Acredita-se que o tamanho ideal dos poros para
permitir a migração de células osteoprogenitoras esteja entre 150 e 500 μm (Tampieri et
al., 2001; Ilan e Ladd, 2003).
A HA pode ser reabsorvível, se for sinterizada durante seu processamento, ou
não reabsorvível, se for calcinada (Fujita et al, 2003). A forma de degradação da
hidroxiapatita é mais uma de suas vantagens. Envolve um processo correspondente à
degradação natural do tecido ósseo, por osteoclastos, sugerindo a possibilidade de
completa degradação durante o remodelamento normal do osso, o que seria ideal
(Borges et al., 2000; Rumpel et al., 2006). Foi observado que ocorre mais rapidamente
quando em contato com osso trabecular e medula óssea do que com o osso cortical
(Imaizumi et al., 2006).
A HA possui coesão nem resistência mecânica suficientes para ser usada na
fabricação de implantes (Boeree et al., 1993). Trata-se de um material rígido, com baixa
elasticidade, o que a torna frágil, limitando sua utilização em locais que requeiram
sustentação de peso (Shishatskaya et al., 2006). Além disso, a migração de partículas
para fora do defeito ósseo é um problema comum (Borges et al., 2000; Saba-Chujfi et
al., 2002; Rupprecht et al., 2003).
Para minimizar ou até eliminar os problemas gerados pelas deficientes
propriedades mecânicas da HA, ou seja, reduzir sua rigidez, aumentar sua elasticidade e
promover a coesão entre as partículas, uma das abordagens mais estudadas é sua
4. Polihidroxibutirato
O polihidroxibutirato (PHB) é um polímero (Fig. 1) natural biodegradável,
não-tóxico e biocompatível pertencente ao grupo dos polihidroxialcalonatos (PHAs).
Trata-se de um poliéster sintetizado por diversas bactérias gram-positivas e gram-negativas de
pelo menos 75 gêneros diferentes (Shishatskaya et al., 2002; Reddy et al., 2003;
Shishatskaya et al., 2004; Chen e Wu, 2005; Ray e Bousmina, 2005). O PHB é o PHA
melhor caracterizado até o momento (Reddy et al., 2003; Volova et al., 2003;
Shishatskaya et al., 2004; Chen e Wu, 2005; Oliveira, 2005; Ray e Bousmina, 2005).
Os PHAs têm sido testados como matéria-prima em diversas áreas, desde a
fabricação de embalagens para produtos agrícolas e de higiene, passando por brinquedos
e material escolar, até serem empregados na área médico-farmacêutica na fabricação de
fios de sutura, próteses, membranas para regeneração tecidual guiada, matriz para
cultura celular, cápsulas e sistemas de carreamento de drogas (Boeree et al., 1993;
Kostopoulos e Karring, 1994; Shishatskaya et al., 2002; Oliveira, 2005; Ray e
Bousmina, 2005; Liu e Wang, 2006).
Suas características mais importantes para utilização com biomaterial são a
biocompatibilidade, sua lenta biodegradação e as ótimas propriedades mecânicas
(Knowles et al., 1992; Boeree et al., 1993; Galego et al., 2000). Estudos demonstraram
que a resistência à compressão do PHB é muito semelhante à do osso humano,
sugerindo estudos voltados para sua utilização em ortopedia (Duarte et al., 2004).
Volova et al. (2003) e Shishatskaya et al. (2004) estudaram em ratos fio de
sutura de polihidroxibutirato, analisando parâmetros bioquímicos sangüíneos,
metabolismo protéico, funções renal e hepática e histologicamente, os linfonodos e o
tecido ao redor do implante. Eles demonstraram que o polímero não produz efeitos Figura 1. Fórmula estrutural do monômero do polihidroxibutirato.
H H | |
O —— C—— C—— C —— | | ||
adversos nos tecidos e no organismo como um todo e mantém sua força mecânica até a
cicatrização do tecido. Consideraram a reação inflamatória, observada por outros
pesquisadores, uma conseqüência da falta de pureza de alguns PHAs comercialmente
disponíveis, não preparados com a pureza necessária à utilização médica.
Além de biocompatível, o PHB demonstrou ótima osseointegração (Knowles et
al., 1992; Boeree et al., 1993; Shishatslaya et al., 2002). Doyle et al. (1991) analisando o
PHB, implantado em defeitos no côndilo femoral de coelhos observaram média de 90%
de aposição direta entre tecido ósseo e este polímero após implantação por seis meses.
A topografia da superfície do implante afetou a osseointegração, uma vez que
superfícies rugosas como pode ser a do PHB proporcionam um espaço adequado para
fixação dos osteoblastos, fornecendo locais para ancoragem dos filopódios (projeções
citoplasmáticas) e exercendo influência na adsorção de proteínas séricas (Wang et al.,
2004). O sucesso da implantação de compósitos depende de suas propriedades de
superfície, resistência mecânica, cristalinidade, porosidade e também do estado do osso
receptor e das condições de fixação e estabilização do compósito (Shishatskaya et al.,
2006).
Quando implantado num organismo PHB é biodegradável e pode ser absorvido
(Liu e Wang, 2006). Acredita-se que o PHB degrade em estágios in vivo iniciando por quebra hidrolítica não-específica das ligações ésteres. Isso resulta na formação de
D,L-ß-hidroxibutirato (HB), normalmente presente no sangue e tecidos, convertido a
acetoacetato. Este entra no ciclo do ácido tricarboxílico (Ciclo de Krebs) e é excretado
na forma de CO2 e H2O (An et al., 2000; Weiler et al., 2000; Volova et al., 2003).
Estudo recente, in vitro, relata que o HB não interferiu na progressão do ciclo celular e mais, ainda inibiu a morte celular apoptótica e necrótica (Cheng et al., 2006).
A taxa de biodegradação de um polímero depende de fatores relacionados ao
implante como seu tamanho, o tipo de polímero, seu peso molecular, a fase do material
(amorfa ou cristalina), a presença de aditivos e impurezas e do mecanismo de
degradação. Também depende de fatores relacionados ao indivíduo receptor, como local
de implantação, o estresse mecânico transmitido ao implante e a idade, podendo levar
meses ou anos para se completar (Luklinska et al., 1997; Shishatskaya et al., 2004).
A taxa de degradação de implantes ósseos é fator de extrema importância visto
que alguns polímeros podem perder sua resistência mecânica muito antes de atingida
adequada consolidação ou antes do preenchimento adequado do defeito ósseo (An et al.,
ácido poliglicólico, por exemplo, podendo ser usados para restauração de grandes
defeitos ósseos que demandam maior tempo (Shishatskaya et al, 2006). Além disso, o
PHB degrada gradual e lentamente em meio biológico, retendo sua força mecânica por
longo período (Reddy et al., 2003; Shishatskaya et al., 2004). As informações sobre taxa
de degradação do PHB não são uniformes, o que pode ser explicado por diferentes
ambientes de implantação e nas diferentes formas e tamanhos dos implantes utilizados
(Pouton e Akhatar, 1996).
Esse polímero já é conhecido e estudado nos EUA e Europa, onde seu custo de
produção é alto (Doyle et al., 1991). Pesquisadores brasileiros conseguiram reduzir
consideravelmente o custo de produção do PHB, em função da diferença entre o cultivo
da cana-de-açúcar, matéria-prima utilizada em nosso país, quando comparado com
cultivo do milho e da beterraba utilizados em outros países (Oliveira, 2005).
A produção do PHB se baseia na conversão microbiológica por bactérias que
consomem a sacarose e transformam parte dela em poliésteres armazenados em
grânulos intracelulares. As bactérias são cultivadas em fermentadores até que atinjam
uma quantidade suficiente e então sua alimentação é desequilibrada pela adição
exagerada de açúcar. Isso faz com que as bactérias acumulem o polímero em seu
citoplasma e, em seguida, basta romper sua membrana celular para purificar a resina daí
extraída, podendo-se obter de algumas bactérias até 70% de seu peso seco de PHB
(Reddy et al., 2003; Chen e Wu, 2005).
Esses polímeros podem ter inúmeras aplicações. Nas artrodeses, um substituto
com boa resistência mecânica e osteocondutividade forneceria a estabilidade e o
arcabouço para crescimento de novo osso necessário para o sucesso da cirurgia (Chen e
Wu, 2005).
Muitas questões essenciais sobre os polihidroxialcalonatos ainda necessitam ser
resolvidas, como por exemplo, o seu processamento associando-os a materiais bioativos
e a fármacos e o uso como base para cultura de células osteogênicas. A regeneração de
tecido ósseo em contato com compósitos em processo de biodegradação é um processo
complexo que ainda necessita de estudos aprofundados (Shishatskaya et al., 2006).
5. Compósito de hidroxiapatita e polihidroxibutirato (HA+PHB)
O propósito da associação de uma cerâmica com um polímero é unir a excelente
propriedades mecânicas do último, como resistência e elasticidade, muito semelhantes
às do osso cortical, mas que não possui a excelente bioatividade em relação ao tecido
ósseo (Doyle et al., 1991; Knowles et al., 1992; Boeree et al., 1993; Galego et al., 2000;
Hench, 2000; Shishatskaya et al., 2005).
Oliveira (2005) e Wang et al. (2005) demonstraram que a HA e o PHB são
sinergicamente compatíveis, com grande afinidade entre as fases e boa adesão deste
polímero aos grupamentos de HA, e concluíram que o PHB é eficiente como matriz
para esta cerâmica.
Estudos in vitro demonstraram que a associação HÁ e PHB não é citotóxica, não é imunogênica e é biocompatível (Doyle et al., 1991; Knowles et al., 1992; Shamshuria
et al., 2004; Wang et al., 2004; Shishatskaya et al., 2006).
O compósito HA+PHB é mais bioativo do que o PHB puro (Luklinska e
Bonfield, 1997; Wang et al., 2001; Ni e Wang, 2002). A introdução da HA na matriz de
PHB melhorou a bioatividade do PHB, demonstrada por melhores respostas de
osteoblastos, podendo ser o resultado de alterações na morfologia e química de
superfície (Wang et al., 2005). Estudos in vitro demonstraram a formação da camada de apatita carbonatada sobre a superfície do compósito HA+PHB, quando a quantidade
desses cristais foi diretamente proporcional às diferentes porcentagens de hidroxiapatita
presentes nos compósitos (Ni e Wang, 2002). Guerra Neto et al. (2005) estudaram in vitro um compósito associando PHB ao biovidro e também observaram a formação da camada de apatita. Shishatskaya et al. (2006) observaram maior proliferação de
osteoblastos em compósitos contendo HA associada ao PHB do que apenas o PHB,
aparentemente devido à maior facilidade para adesão das células à superfície mais
hidrofílica dos compósitos. Sabe-se que a adesão celular é geralmente melhorada em
superfícies rugosas e hidrofílicas (Anselme, 2000).
A associação HA+PHB possui propriedades mecânicas muito semelhantes às do
osso, principalmente quando se trata de forças de compressão, sendo compatível com o
uso como enxerto em áreas de tensão (Doyle et al., 1991; Boeree et al., 1993; Luklinska
e Bonfield 1997; Ni e Wang, 2002; Guerra Neto et al., 2005). Boeree et al. (1993)
observaram no teste de compressão que os compósitos com maiores proporções de HA
(40 e 50%) apresentaram mais fratura e ao término do teste se fragmentaram
completamente, o que não ocorreu com compósitos contendo menores proporções de
HA (10 e 20%). Essa observação é particularmente importante para utilização deste
submetidos a grandes cargas mecânicas. A resistência à tração também é inversamente
proporcional ao conteúdo de HA. Resultados semelhantes em testes mecânicos foram
obtidos por Doyle et al. (1991).
Luklinska e Bonfield (1997) demonstraram que o mecanismo de interação entre
compósito de HA+PHB e tecido ósseo ocorre pela degradação da matriz de PHB na
região de contato com o tecido ósseo, onde se formam novos cristais de HA associados
aos cristais já presentes. Osteoblastos penetram nos poros do compósito, se aderem e
proliferam, produzindo matriz óssea. À medida que o material é biodegradado, novos
poros são formados na matriz do compósito, novos osteoblastos irão aderir, e assim,
gradualmente, ocorre a substituição por tecido ósseo (Shishatskaya et al., 2006).
Não seria difícil pensar que esses resultados seriam obtidos associando a HA
com qualquer polímero, mas pequenas mudanças na composição são suficientes para
gerar grandes alterações nas características do compósito (Doyle et al., 1991). Doyle et
al. (1991) demonstraram que a associação HA+ PHB é muito superior em promover o
crescimento de novo osso do que a associação da HA com outros polímeros como o
polipropileno.
Diversos autores sugerem a utilização deste compósito como substituto para
enxertos autógenos, incluindo a preparação de modelos cortico-trabeculares para
reconstrução óssea (Ito et al., 2005; Imaizumi et al., 2006; Shishatskaya et al., 2006).
Essa alternativa surge com a possibilidade de fabricação de implantes em tamanhos e
formas apropriados dependendo da necessidade, onde a estabilidade e a resistência
proporcionadas seriam melhores e ainda continuariam a melhorar à medida que o
MATERIAL E MÉTODOS
A metodologia deste trabalho utilizando animais experimentais foi analisada
pela Comissão de Ética do DVT / UFV, tendo sido aprovada em 01/03/2007 e
protocolada como processo n.° 37 / 2007.
Para este projeto foram utilizados 30 coelhos da raça Nova Zelândia,
esqueleticamente maduros à confirmação radiográfica, com idade de sete meses e
pesando entre 3 e 3,5 kg. Essa espécie é considerada padrão para estudos in vivo de biocompatibilidade, e apresenta taxas de formação e remodelamento ósseos cerca de 3 a
4 vezes maiores do que na espécie humana (An et al., 2000; Kudo et al., 2001). Os
animais tiveram um período mínimo de um mês para aclimatação ao novo ambiente,
foram alojados em gaiolas individuais recebendo no dia de chegada ivermectina1 na
dose de 0,4 mg/kg pela via subcutânea e ração fornecida duas vezes ao dia e água ad libitum.
Previamente à cirurgia, os animais receberam 40.000 UI/kg de penicilina G2 pela
via intramuscular, foram sedados com levomepromazina3 na dose de 2 mg/kg e
anestesiados com associação de tiletamina-zolazepam4 na dose de 30mg/kg, ambos pela
via intramuscular. A região de ambos os membros torácicos, estendendo-se desde a
região proximal da diáfise do úmero até o carpo, foram tricotomizadas e a antissepsia
pré-operatória foi feita de acordo com as normas do DVT-UFV. Em seguida, realizou-se
bloqueio anestésico do plexo braquial com 1,5 ml de lidocaína5, em cada membro.
Foi realizada incisão curva de pele de aproximadamente 3 cm de comprimento
na superfície lateral da articulação umerorradioulnar. Foi realizada incisão na fáscia do
músculo tríceps braquial permitindo assim afastar parte do ventre da cabeça lateral do
músculo tríceps braquial e do tendão do músculo tríceps braquial em direção proximal
ao olécrano, liberando parte da inserção lateral do tendão com uma lâmina de bisturi.
Em seguida, uma incisão uma incisão reta de aproximadamente 3 cm de comprimento
foi realizada na bolsa tricipital, expondo, assim, a superfície lateral do olécrano. Uma
falha óssea circular foi realizada na cortical lateral do olécrano, com o auxílio de uma
1
Ivomec ®- Merial. Campinas-MG, Br.
2
Megacilin® - União Química Farmacêutica Nacional S/A. São Paulo- SP, Br.
3
Neozine®- Sanofi-aventis. São Paulo- SP, Br.
4
Zoletil 50® - Farmavet Produtos Veterinários LTDA. São Paulo- SP, Br.
5
broca trefina6 de 4 mm de diâmetro acoplada a uma perfuratriz elétrica (Fig. 2A).
Durante a perfuração, o local foi irrigado com solução fisiológica estéril para evitar
aquecimento.
Os compósitos foram fabricados com uma mistura dos biomateriais absorvíveis
hidroxiapatita sintética7 e polihidroxibutirato (PHB), em 3 diferentes proporções. O
compósito um foi confeccionado com 10% de HA e 90% de PHB, o compósito dois
com 25% de HA e 75 % de PHB e o compósito três com 50% de HA e 50% de PHB. Os
compósitos foram fornecidos em formato retangular de aproximadamente 15 mm de
comprimento por 6 mm de largura. Para adequar o tamanho e formato dos compósitos
ao defeito, os blocos foram cortados com uma broca trefina8 de 4 mm de diâmetro
acoplada a uma perfuratriz elétrica, com irrigação constante com solução fisiológica
estéril.
Os 30 coelhos foram divididos aleatoriamente em dois grupos sendo o primeiro
o grupo controle, com 12 animais e o segundo, o grupo tratado com 18 animais. Os
animais do grupo controle (C) não receberam qualquer forma de tratamento, ou seja, o
defeito foi preenchido pelo coágulo que se forma normalmente. Esses animais tiveram
ambos os membros operados, sem o preenchimento com compósito. Ambos os
membros dos animais do grupo tratado foram operados, mas cada membro recebeu um
compósito de concentração diferente (Tab. 1), portanto, o grupo tratado foi subdivido
em três grupos. Os membros do grupo tratado 1 receberam o compósito 1 dentro do
defeito provocado experimentalmente na ulna (Fig. 2B). O mesmo foi realizado para os
grupos tratados 2 e 3, onde os membros receberam os compósitos 2 e 3,
respectivamente.
A bolsa tricipital, tendão do músculo tríceps braquial e parte da cabeça lateral do
músculo tríceps braquial foram aproximados em um só plano com sutura em padrão
simples contínuo e em seguida a pele com pontos separados, ambos utilizando fio
não-absorvível de náilon9. Imediatamente após a cirurgia foram realizadas radiografias de
cada membro nas posições mediolateral com a articulação umerorradioulnar flexionada
em aproximadamente 90° e tangencial ao olécrano. Nesta última radiografia, o animal
foi posicional em decúbito dorsal com o úmero paralelo à mesa e a articulação
umerorradioulnar em total flexão.
6
Neodent®- Curitiba- PR, Br.
7
HAP 91®- JHS Laboratório Químico. Sabará- MG, Br.
8
Neodent®- Curitiba, Br.
9
Tabela 1. Distribuição dos compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de PHB (grupo 2) e 50% de HA e 50% de PHB (grupo3) nos membros por animal.
Animais Membro Direito Membro Esquerdo 1 compósito 1 ( grupo1) compósito 2 (grupo 2) 2 compósito 1 (grupo 1) compósito 3 (grupo 3) 3 compósito 2 (grupo 2) compósito 3 (grupo 3) 4 compósito 2 (grupo 2) compósito 1 (grupo 1) 5 compósito 3 (grupo 3) compósito 1 (grupo 1) 6 compósito 3 (grupo 3) compósito 2 (grupo 2)
7 controle controle
8 controle controle
9 controle controle
10 controle controle
Obs.: essa tabela mostra a subdivisão para 10 animais apenas, o mesmo foi realizado para os outros 20 animais.
Os cuidados pós-operatórios incluíram, em todos os animais, a administração de
2 mg/kg de morfina10 no pós-operatório imediato pela via subcutânea e 40.000 UI/kg de
penicilina11 pela via intramuscular a cada 24 horas por dois dias. Os animais foram
avaliados diariamente nos primeiros oito dias e depois aos 45 e 90 dias.
Cada membro foi avaliado quanto à claudicação, de acordo com o apoio da
extremidade do membro com os escores: 0-sem claudicação; 1-apoio com claudicação;
2-ausência completa de apoio. A ferida cirúrgica foi avaliada quanto a presença de
10
Dimorf®- Cristália do Brasil. São Paulo- SP, Br.
11
Megacilin® - União Química Farmacêutica Nacional S/A. São Paulo- SP, Br.
Figura 2. Procedimento cirúrgico para realização do defeito experimental na ulna de coelho. A- Realização do defeito na cortical lateral do olécrano com broca trefina acoplada a perfuratriz elétrica sob irrigação com solução salina. B- Compósito 1 (seta) dentro do defeito.
A
reação inflamatória, deiscência e infecção. Para avaliar a reação inflamatória os
parâmetros analisados foram o edema, avaliado quantitativamente pela mensuração da
circunferência do membro no local da ferida cirúrgica, e a sensibilidade dolorosa,
avaliada pela reação do animal ao toque da ferida cirúrgica e flexão e extensão da
articulação umerorradioulnar, atribuindo-se os escores: 0-quando não existiu qualquer
manifestação do animal; 1-retração do membro sem outra manifestação; 2-retração do
membro associada a vocalização ou tentativa de fuga. A deiscência de sutura foi
avaliada em presente ou ausente assim como a infecção da ferida cirúrgica, observada
pela presença de secreção purulenta proveniente do local.
A avaliação estatística para as variáveis infecção, claudicação, dor e deiscência
consistiu na comparação entre os dias um, quatro e oito dentro de cada grupo para
avaliar a evolução do parâmetro com o passar do tempo e na comparação entre os
grupos em cada um desses dias. Utilizou-se teste estatístico de Kruskal-Wallis com
p<0,05. A variável edema foi avaliada como evolução de um mesmo animal utilizando
o teste de Wilcoxon para amostras não independentes já que o importante não era o
valor da circunferência do membro mas sim a diferença de valores de um dia para o
seguinte. Comparou-se as medidas pré-cirúrgicas e os dias um, quatro e oito após a
cirurgia, com p<0,05.
Quatro animais de cada grupo foram eutanasiados com sobredose anestésica12
em cada um dos dias oito, 45 e 90 após a cirurgia quando foram realizadas duas
radiografias de cada membro, novamente nas posições mediolateral e tangencial ao
olécrano. A técnica radiográfica foi padronizada em todos os momentos para a distância
de um metro do aparelho ao filme, 40 quilovolts e 0,04 segundos de tempo de
exposição. Foram coletadas desses animais duas amostras para processamento
histológico, uma do olécrano direito e a outra do esquerdo, contendo o defeito, nesses
mesmos dias.
As radiografias foram analisadas observando a radiopacidade do defeito em
comparação com a do osso normal. Foram confeccionados esquemas em folhas
transparentes que foram sobrepostos às radiografias permitindo melhor definição dos
locais de radiopacidade semelhante ao osso vizinho (Fig. 3). Esses esquemas tiveram
como resultado a definição de quatro quadrantes, permitindo uma melhor análise da
radiopacidade de cada quadrante caracterizada em menor, semelhante ou maior do que a
12
do osso vizinho. Ainda utilizando esses esquemas, observou-se as bordas do
defeito/compósito, caracterizando se a margem de cada quadrante podia ser facilmente
delimitada ou não, ou seja, se o limite entre osso e compósito podia ser bem distinguido.
A radiografia mediolateral de cada membro obtida no pós-operatório imediato
foi sobreposta à sua radiografia correspondente aos oito, 45 ou 90 dias, para analisar o
tamanho do defeito, observando se existiu contato entre o osso e o compósito. As
radiografias tangenciais ao olécrano foram utilizadas para observação de reação
periosteal.
Radiografias seqüenciais durante o período estudado não foram realizadas para
evitar a freqüente necessidade de sedação dos animais e morte por estresse à
manipulação.
Os fragmentos dos olécranos coletados em cada dia foram fixados em formol
10% tamponado por um tempo médio de três dias. Após esse período os fragmentos
foram descalcificados em ácido fórmico a 10% tamponado com citrato de sódio para pH
4,5 sob vácuo moderado por aproximadamente 20 dias e seccionados no sentido
transversal ao eixo longo da ulna, no centro do defeito (Fig. 4) para se obter a superfície
de análise. Após a descalcificação, foram lavados em água corrente e então desidratados
em álcoois etílicos a 70, 80, 90 e 100% durante 24 horas em cada etapa e repetida a
100%. A seguir, foram diafanizados em dois banhos de xilol por 30 minutos cada e
embebidos em dois banhos de parafina em estufa a 58 °C por 30 minutos cada. Foram
obtidos cortes de cinco μm de espessura, corados pelas técnicas da hematoxilina-eosina,
tricrômico de Gomori e azul de toluidina, para posterior análise à microscopia de luz. Figura 3. Representação da análise radiográfica. Esquema da radiografia mediolateral (A), esquema da divisão em quadrantes em transparência (B) e sobreposição para divisão em quadrantes (C).
tecido ósseo
Figura 4. Sentido de corte do fragmento do olécrano para obtenção da superfície de
análise. Vistas lateral e cranial do fragmento coletado da ulna. A vista
caudo-cranial demonstra as regiões anatômicas em relação ao defeito onde: T- região
trabecular, L-região lateral, P- região proximal e D- região distal. Estas últimas (P e D)
são as regiões ao redor do compósito.
O material foi analisado qualitativa e quantitativamente. Qualitativamente,
foram caracterizados os tecidos e células presentes em toda a amostra.
A análise quantitativa, ou seja, histomorfometria, foi realizada para avaliar a
presença de osteoclastos na região de tecido ósseo em todos os grupos. Apenas nos
grupos tratados foram avaliados também quantitativamente o tecido predominante na
interface com o compósito, a proporção entre os tecidos formados no defeito como um
todo, ou seja, na região trabecular e a proporção entre os tecidos formados no interior do
compósito.
O número de osteoclastos presentes em 10 campos por amostra foi contado em
aumento de 200X nos grupos tratados e controle. Utilizando o teste estatístico de
Kruskal-Wallis seguido pelo teste de comparações múltiplas de Dunn’s, analisou-se a
diferença entre os grupos a cada dia e a diferença entre os dias de um mesmo grupo,
com p<0,05.
Com auxílio de ocular graduada com 18 colunas e 12 linhas correspondendo a
216 pontos eqüidistantes de interseção, foram quantificados percentualmente as
estruturas compósito, tecido ósseo, tecidos moles e medula óssea, em aumento de 40x,
somente nos grupos tratados. A grade foi posicionada de forma que as três primeiras
linhas estivessem completamente sobre o compósito e a quarta linha sobre os tecidos,
apenas na região trabecular, não incluindo as regiões proximal e distal ao defeito,
permitiu a obtenção de dados para verificar se existiu diferença entre a porcentagem de
tecido ósseo formado dentro do defeito em relação à porcentagem de tecidos moles em
cada dia, utilizando o teste de Mann-Whitney com p<0,05. Também pode-se analisar se
existiu diferença entre porcentagem de tecido ósseo formado entre os grupos
comparando cada dia assim como para a porcentagem de tecidos moles. Esse mesmo
tipo de comparação, para tecido ósseo e tecidos moles, foi realizada para verificar se
existiu diferença na formação de cada tecido entre os dias num mesmo grupo. Para essas
comparações entre os grupos e dias foi utilizado o teste de Kruskal-Wallis,
complementado pelo procedimento de comparações múltiplas de Tukey ou Dunn’s com
p< 0,05.
Realizou-se a caracterização dos tecidos presentes na interface com o
compósito, permitindo a obtenção do percentual de tecido ósseo, medula óssea e tecidos
moles. Com uma grade contendo 33 linhas verticais e 25 linhas horizontais, foram
contados apenas o primeiro ponto de interseção imediatamente após o compósito em
cada linha em aumento de 100X. Esses dados permitiram analisar as diferenças na
relação entre tecidos ósseo e moles em cada dia em cada grupo e a diferença para cada
tecido entre os grupos. Os mesmos testes estatísticos citados no parágrafo anterior
foram utilizados para essas comparações.
Para analisar a formação de tecidos dentro do compósito foi utilizada uma grade
contendo 100 pontos eqüidistantes, sobreposta somente no interior do compósito em
cinco campos por amostra em aumento de 100X. A comparação entre os dados seguiu
RESULTADOS E DISCUSSÃO
1. Trans-operatório
O compósito um, contendo 10% de HA, se mostrou mais resistente ao corte e
manipulação do que os compósitos dois e três. O compósito três (50% de HA) se
mostrou frágil, se quebrando algumas vezes, dificultando seu corte para adequação ao
formato do defeito, o que pode limitar sua utilização para a fabricação de parafusos e
placas. Esta observação está de acordo com os achados de Doyle et al. (1991) e Boeree
et al. (1993) que observaram que os valores de resistência à tração e compressão eram
inversamente proporcionais à porcentagem de HA dos compósitos.
Observou-se uma distância de aproximadamente um milímetro entre a margem
do defeito e o compósito à implantação dos compósitos no defeito, que no momento da
cirurgia foi preenchida por coágulo. Essa diferença ocorreu devido à utilização da
mesma broca para fazer o defeito no osso e o corte do compósito, resultando na retirada
do diâmetro externo da broca, ao corte do osso e, do diâmetro interno da broca, ao corte
dos compósitos. Essa distância corresponde à espessura da broca.
2. Exame Clínico
Para análise dos parâmetros clínicos é necessário ressaltar que os dados
apresentados são de 12 membros por grupo, correspondendo a quatro animais
necessários a cada dia de exame histológico (8, 45 e 90 dias). Do total de 30 animais, 18
pertenceram aos grupos tratados, perfazendo 36 membros operados, 12 em cada grupo
um, dois e três. Os 12 animais restantes constituíram o grupo controle, com ambos os
membros operados com a finalidade de eliminar interferências nos dados clínicos,
particularmente na claudicação. Desses animais, apenas as variáveis de um membro,
escolhidas aleatoriamente, foram utilizadas para análise.
Como pode ser observado na tabela 2, nenhuma das variáveis se apresentou em
mais do que quatro membros por grupo, ou seja, 33% deles. São demonstrados dois
valores, o primeiro deles referente ao número de membros que apresentaram o
parâmetro analisado e o segundo o número de dias nos quais o parâmetro foi
apresentado. Exemplificando, enquanto na análise por membro observa-se a existência
dias observa-se que, de um total de 96 observações (8 observações para cada um dos 12
membros), esse parâmetro foi observado em apenas um dia, uma análise mais precisa
para os variáveis dor e claudicação.
Tabela 2. Resultado da análise dos parâmetros clínicos de acordo com o número de membros afetados e número de manifestações durante o período de exames, após a realização de defeitos ósseos experimentais na ulna de coelhos e implantação ou não (grupo controle – C) de compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de PHB (grupo 2) e 50% de HA e 50% de PHB (grupo3).
DOR CLAUDICAÇÃO DEISCÊNCIA INFECÇÃO
n° de membros n° de dias n° de membros n° de dias n° de membros n° de dias n° de membros n° de dias
C 3 8 2 4 1 7 0 0
1 1 1 0 0 3 7 0 0
2 3 12 3 a 8 b 4 13 1 4
3 3 7 2 3 1 3 0 0
Total de observações
em cada grupo
12 96 12 96 12 96 12 96
Variáveis dor e claudicação correspondem ao grau 1 com exceção dos valores assinalados por a
e b. Valor a corresponde a dois membros referentes ao grau 1 e um referente ao grau 2. Valor b
corresponde a cinco dias referentes ao grau 1 e três dias referentes ao grau 2.
A dor foi observada em até três membros por grupo (25%) ou em 12
observações (12,5%), todas classificadas em grau 1. Concentrou-se nos primeiros dias
após a cirurgia, ocorrendo nos últimos dias (seis, sete e oito) em quatro membros, dois
deles associados à deiscência (um grupo controle e um no grupo dois) e dois não
associados a outros parâmetros clínicos. Do grupo um, apenas um membro apresentou
dor grau 1 em apenas um dia de exame. Contudo, não foi observada diferença
significante entre os grupos. A demonstração de dor pelo toque da ferida cirúrgica e
movimentação da articulação umerorradioulnar pode ter sido influenciada pela
proximidade do examinador para o exame clínico, necessária para manipulação do
membro, inibindo ou alterando essa manifestação. Acredita-se que a claudicação seja
um parâmetro melhor para verificação da dor em coelhos, parâmetro esse analisado com
o animal em liberdade, sem manipulação direta durante o exame.
A claudicação se concentrou nos primeiros quatro dias após a cirurgia em todos
os grupos, predominantemente de grau 1. Este sinal clínico foi manifestado por no
grupo dois membro do grupo dois apresentou claudicação grau 2, associada à fratura na
região do olécrano onde foi realizada a cirurgia, estando também associada a dor grau 1.
Não foi observada diferença significante entre os quatro grupos.
Deiscência foi observada em no máximo quatro membros por grupo, se
concentrando nos últimos dias de exame clínico, com exceção de um membro do grupo
controle e um do grupo um. Não existiu diferença entre os grupos. É importante
salientar que deiscência ocorreu devido à interferência do animal em todos os casos com
exceção do membro que apresentou infecção. Apesar da interferência do animal, a
região peri-implante não sofreu influência, já que a deiscência se limitou à sutura de
pele, não afetando o tecido subcutâneo ou fáscia.
Infecção da ferida cirúrgica foi observada em um membro do grupo dois estando
associada a dor grau 1 e deiscência. Nos outros grupos este parâmetro não foi
observado, não existindo diferença entre os quatro grupos.
Não foram observadas diferenças significantes para as variáveis dor,
claudicação, deiscência e infecção entre os dias dentro de cada grupo, além da
comparação entre os grupos já citada. A semelhança dos grupos tratados com o controle
indica que esses sinais clínicos ocorreram devido ao próprio ato cirúrgico e não devido
ao compósito. Observações semelhantes foram realizadas por Borges et al. (2000) com
HA em tíbia de cães e Vital et al. (2006) com HA na ulna de coelhos. A semelhança
entre os grupos tratados indica que o maior conteúdo de PHB não interferiu nos
parâmetros clínicos.
Como esperado, nos quatro grupos existiram diferenças significantes entre os
valores pré-operatórios da circunferência do membro em relação aos valores do
primeiro dia, indicando a existência de edema no primeiro dia, possivelmente devido à
manipulação dos tecidos no ato cirúrgico assim como sugerido por Pouton e Akhtar
(1996). Comparando-se os valores pré-operatórios com o quarto dia, existiu diferença
significante nos grupos controle, dois e três, o que não ocorreu no grupo dois
demonstrando que nos membros deste último grupo o edema não era significativo nessa
data. A diferença entre os valores pré-operatórios e aos oito dias após a cirurgia não foi
significante em nenhum dos grupos. Esses dados corroboram com a possibilidade dos
materiais serem biocompatíveis.
Comparando a média da diferença de circunferência entre os membros (Tab. 3)
observou-se que não existiu diferença significante, indicando que a formação de edema
Um animal do grupo controle aos 90 dias apresentou-se extremamente
emaciado, com porte e peso semelhantes aos que tinha aos sete meses de idade,
diferindo dos demais à eutanásia, então com 10 meses de idade, todos maiores e mais
pesados. Os dados desse animal foram desconsiderados em todas as análises.
Tabela 3. Médias e desvio padrão das diferenças dos valores de circunferência (cm) dos membros, após a realização de defeitos ósseos experimentais na ulna de coelhos e implantação ou não (grupo controle – C) de compósitos contendo 10% de HA e 90% de PHB (grupo 1), 25% de HA e 75% de PHB (grupo 2) e 50% de HA e 50% de PHB (grupo 3).
Grupos Dias
1 2 3 C pré X dia 1 0,9 ± 0,5 a 0,6 ± 0,7 a 0,6 ± 0,4 a 0,6 ± 0,6 a
pré X dia 4 0,5 ± 0,6 b 0,3 ± 0,5 b 0,3 ± 0,8 b 0,4 ± 0,5 b pré X dia 8 0,3 ± 0,7 c 0,1 ± 0,4 c 0,5 ± 0,8 c 0,2 ± 0,6 c
Letras minúsculas iguais na mesma linha não diferem de forma significante pelo teste de Kruskal-Wallis, com p<0,05.
3. Análise radiográfica
As radiografias obtidas no pós-operatório imediato se caracterizaram no grupo
controle por radiopacidade do defeito menor do que a do osso vizinho em todos os
quadrantes, com bordas bem delimitadas e ausência de reação periosteal (Fig. 5A).
Pode-se verificar nas radiografias do pós-operatório imediato dos três grupos tratados
que os compósitos foram devidamente implantados no sítio receptor, sem migração, o
que também foi verificado nos exames clínicos. O compósito um apresentou-se menos
radiopaco do que o osso vizinho. Foi observado um halo menos radiopaco do que o
compósito ao seu redor (Fig. 6B), correspondendo à distância entre a parede do defeito e
o compósito, observada no trans-operatório ocupada pelo coágulo sangüíneo (Fig. 1B).
Sabe-se que os tecidos moles não são radiopacos devido à ausência da matriz
calcificada (Sá et al., 2007). Esse mesmo halo radiotransparente foi observado ao redor
dos compósitos dois e três, contendo 25 e 50% de HA, respectivamente (Fig. 5C e 5D),