TALYTA GALAFASSI ZARPELON
CARACTERIZAÇÃO DE RIZOBACTÉRIAS E EFICIÊNCIA DO
RIZOLYPTUS® NO ENRAIZAMENTO E CRESCIMENTO DE
EUCALIPTO
Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Fitopatologia, para obtenção do título de Magister Scientiae.
VIÇOSA
TALYTA GALAFASSI ZARPELON
CARACTERIZAÇÃO DE RIZOBACTÉRIAS E EFICIÊNCIA DO
RIZOLYPTUS® NO ENRAIZAMENTO E CRESCIMENTO DE
EUCALIPTO
Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Fitopatologia, para obtenção do título de Magister Scientiae.
APROVADA: 21 de março de 2007
_____________________________ Prof. Luiz Antônio Maffia
(Co-Orientador)
_____________________________ Pesq. Poliane Alfenas-Zerbini
(Co-Orientadora)
_____________________________ Prof. Olinto Liparini Pereira
_____________________________ Pesq. Douglas Lau
_____________________________ Prof. Acelino Couto Alfenas
“A grandeza não consiste em receber honras, mas em merecê-las”
(Aristóteles)
As minhas avós Eudócia (in memorian) e Sustena (in memorian), Por acreditarem sempre e representarem a expressão do amor à família.
AGRADECIMENTOS
A Deus pelo dom de vida e por ser presença constante de luz em minha vida.
À Universidade Federal de Viçosa, pela oportunidade de realização dos cursos de graduação em Engenharia Florestal e de pós-graduação em Fitopatologia.
À Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG), pela concessão da bolsa durante o período de pós-graduação.
À Bio Soja Industria Química e Biológica pelo fornecimento do inoculante.
À CAF Florestal Santa Bárbara e Veracel pelo apoio logístico e financiamento de parte deste trabalho.
Ao Prof. Acelino Couto Alfenas pela vibração, orientação e pelo incentivo nos momentos difíceis.
Ao Dr. Eli pela amizade, pelo acompanhamento e pela colaboração na elaboração dos trabalhos.
Ao Prof. Maffia pela valiosa cooperação, atenção e pelos ensinamentos.
À Dr. Poliane pela confiança no trabalho, pelas sugestões e pela disponibilidade em ensinar.
Ao Prof. Olinto e ao Dr. Douglas pela amizade e sugestões que enriqueceram o trabalho.
Ao Dr. Lúcio Guimarães pela paciência em ensinar e reensinar com motivação. Seu estímulo foi decisivo para a conclusão deste trabalho.
Aos amigos Fernanda, Michelle, Marcelo, Léo Batata, Tissiany, Sílvia e Loly que mesmo distantes estão sempre do meu lado.
À amiga Daniela pelo apoio e pelos momentos de alegria vividos na graduação e pós-graduação.
Ao Marcelo, pelo amor, pela paciência e ajuda nas montagens e avaliações dos experimentos.
Aos meus pais José Maria e Claudete, pelo amor e pela dedicação. Ao meu irmão Tiago, pela coragem e força em alcançar seus objetivos e que é fonte de inspiração para mim.
Aos funcionários Alex, Cíntia, Euzébio, Ricardo e Rafael e especialmente ao Renildo pela enorme colaboração e participação durante todo o período de pesquisa.
BIOGRAFIA
Talyta Galafassi Zarpelon, filha de José Maria Zarpelon e Maria Claudete Galafassi Zarpelon, nasceu a 18 de maio de 1978, em Cornélio Procópio, Estado do Paraná.
Ingressou em 1999, no curso de Engenharia Florestal da Universidade Federal de Viçosa (UFV), no qual foi bolsista de Iniciação Científica no Departamento de Fitopatologia, sob a orientação do professor Acelino Couto Alfenas.
SUMÁRIO
RESUMO __________________________________________________ ix ABSTRACT ________________________________________________ xi INTRODUÇÃO GERAL _______________________________________ 1 REFERÊNCIAS BIBLIOGRÁFICAS _____________________________ 4
ARTIGO 1 ____________________________________________________ 6
ARTIGO 2 ___________________________________________________ 37 Eficiência de duas formulações de rizobactérias no enraizamento de miniestacas e crescimento de mudas de eucalipto ___________________ 37 RESUMO __________________________________________________ 37 ABSTRACT ________________________________________________ 39 1. INTRODUÇÃO ___________________________________________ 41 2. MATERIAL E MÉTODOS __________________________________ 43 2.1. Formulações ___________________________________________ 43 2.2. Viabilidade dos isolados de rizobactérias nas formulações líquida e turfosa ___________________________________________________ 43 2.3. Eficiência do produto Rizolyptus® sobre o enraizamento de
miniestacas e crescimento de mudas de eucalipto _________________ 44 2.4. Delineamento experimental e análises estatísticas______________ 45 3. RESULTADOS____________________________________________ 47
RESUMO
ZARPELON, Talyta Galafassi, M.Sc., Universidade Federal de Viçosa, março de 2007. Caracterização de rizobactérias e eficiência do
Rizolyptus® no enraizamento e crescimento de eucalipto. Orientador: Acelino Couto Alfenas. Co-Orientadores: Luiz Antônio Maffia e Poliane Alfenas-Zerbini.
ABSTRACT
ZARPELON, Talyta Galafassi, M.Sc., Universidade Federal de Viçosa, March of 2007. Rhizobacteria characterization and Rizolyptus® efficiency in eucalyptus rooting and growth. Adviser: Acelino Couto Alfenas. Co-Advisers: Luiz Antônio Maffia and Poliane Alfenas-Zerbini.
INTRODUÇÃO GERAL
Dentre 107 isolados de bactérias, obtidos da rizosfera de mudas de diferentes clones de Eucalyptus, nove se destacaram quanto ao potencial de enraizamento de miniestacas de eucalipto e foram identificados sendo três de Bacillus subtilis Cobn, 1872 (S1, S2 e 3918), um de Pseudomonas fulva Lizuga & Komagata, 1963 (Ca), um de Pseudomonas aeruginosa (Schroeter, 1872) Migula, 1900 (FL2), um de Frateuria aurantia Swings et al., 1980 (R1), um de Stenotrophomonas maltophilia (Hugh, 1872) Palleroni & Bradbury, 1993 (CIIb) e dois de Pseudomonas sp. Migula, 1894 (MF2 e MF4) baseando-se nas seqüências parciais da região 16S do DNA ribossomal (Teixeira et al., 2007).
Posteriormente testou-se a mistura de isolados compatíveis “in vitro”, em ensaio realizado em casa de vegetação destacando-se as misturas dos isolados VC2 (não identificado) + Ca (P. fulva) para enraizamento e VC2 + 3918 (B. subtilis) para biomassa radicular (Mafia, 2004). Nestes estudos observaram que as respostas obtidas variavam de acordo com o clone e o isolado empregado. Em um estudo para investigar a especificidade da interação de isolados de rizobactérias e oito clones de eucalipto, não foi observado efeito deletério das rizobactérias na rizogênese do eucalipto, mas os incrementos em enraizamento e biomassa radicular variaram conforme o isolado e o clone testado, evidenciando a especificidade na interação (Mafia, 2004). A forma de veiculação das rizobactérias também foi testada e os resultados variaram de acordo com o clone, forma de aplicação e o isolado empregado. A veiculação direta no substrato é a mais operacional, devido à facilidade de aplicação. A imersão de miniestacas na suspensão de inóculo, ou ainda, as duas formas de veiculação concomitantemente torna-se uma alternativa de inoculação, principalmente quando o objetivo é o biocontrole de patógenos apodrecedores de miniestacas de eucalipto (Mafia, 2004).
Simpson (sin. Sporothrix eucalypti Wingfield, Crous & Swart) (Ladeira, 2004), foi também menor em mudas de eucalipto, multiplicados em substrato rizobacterizado.
Nesses experimentos de rizobactérias com eucalipto (Ladeira, 2004; Mafia, 2004; Mafia et al., 2005; Teixeira, 2001; Teixeira et al., 2005; Teixeira et al., 2007) e outras culturas (Boer et al., 1999; Enebak et al., 1997; Kloepper et al., 1980; Kokalis-Burelle et al., 2002; Shishido & Chanway, 2000) utilizaram-se suspensões bacterianas, produzidas em meio de cultura. Entretanto, este tipo de inóculo é de difícil produção em grande escala e apresenta dificuldades na manipulação, no transporte, armazenamento e baixa sobrevivência ao longo do tempo.
REFERÊNCIAS BIBLIOGRÁFICAS
ALFENAS, A.C., ZAUZA, E.A.V., MAFIA, R.G.; ASSIS, T.F.D. Clonagem e doenças do eucalipto. Viçosa. Imprensa Universitária. 2004.
ASSIS, T.F. Propagação vegetativa de Eucalyptus por microestaquia. Anais, I Conferência sobre silvicultura e melhoramento de eucaliptos, Salvador BA. 1997. pp. 300-304.
BOER, M., VAN DER SLUIS, I., VAN LOON, L.C.; BAKKER, A.H.M. Combining fluorescent Pseudomonas spp. strains to enhance suppression of fusarium wilt of radish. Europan Journal of Plant Pathology 105:201-210. 1999.
ENEBAK, S.A., WEI, G.; KLOEPPER, J.W. Effects of plant growth-promoting rhizobacteria on loblolly and slash pine seedlings. Forest Science 44:139-144. 1997.
KLOEPPER, J.W., SCHROTH, M.N.; MILLER, T.D. Effets of rhizosphere colonization by plant growth-promoting rhizobacteria on potato plant development and yield. Phytopathology 70:1078-1082. 1980.
KOKALIS-BURELLE, N., VAVRINA, C.S., ROSSKOPF, E.N.; SHELBY, R.A. Field evaluation of plant growth-promoting rhizobacteria amended ransplant mixes and soil solarization for tomato and pepper production in Florida. Plant and Soil 238:257-266. 2002.
MAFIA, R.G. Rizobactérias como promotoras do enraizamento, crescimento e como agentes de biocontrole de doenças na propagação clonal do eucalipto. Dissertação de Mestrado. Viçosa MG. Universidade Federal de Viçosa. 2004. MAFIA, R.G., ALFENAS, A.C., FERREIRA, E.M., ZARPELON, T.G.;
SIQUEIRA, L. Crescimento de mudas e produtividade de minijardins clonais de eucalipto tratados com rizobactérias selecionadas. Revista Árvore 29:843-851. 2005.
SHISHIDO, M.; CHANWAY, C.P. Colonization and growth promotion of outplanted spruce seedlings pre-inoculated with plant growth-promoting rhizobacteria in the greeenhouse. Canadian Journal of Forest Research 30:845-854. 2002.
TEIXEIRA, D.A. Promoção de enraizamento e indução de resistência sistêmica à ferrugem e à mancha-de-Cylindrocladium, mediadas por rizobactérias em clones de Eucalyptus spp. Dissertação de Mestrado. Viçosa MG. Universidade Federal de Viçosa. 2001.
TEIXEIRA, D.A., ALFENAS, A.C., MAFIA, R.G., FERREIRA, E.M., SIQUEIRA, L., MAFFIA, L.A.; MOUNTEER, A.H. Rhizobacterial promotion of eucalypt rooting and growth. Brazilian Journal of Microbiology 38:1-6. 2007.
A
RTIGO1
Caracterização de isolados de rizobactérias promotoras de
enraizamento de miniestacas e crescimento de mudas de eucalipto
Talyta G. Zarpelon1; Reginaldo G. Mafia2; Lúcio Mauro da S. Guimarães1; Poliane Alfenas-Zerbini1; Luis A. Maffia1; Eli S. Lopes3; Acelino C. Alfenas1
1Departamento de Fitopatologia, Universidade Federal de Viçosa, Viçosa, Minas Gerais,
Brasil; 2Aracruz Celulose; 3Bio Soja Indústrias Químicas e Biológicas.
RESUMO
forma da colônia, crescimento, consistência, superfície, brilho, coloração e alteração da cor do meio. Avaliou-se também a resistência dos isolados de rizobactérias a antibióticos. Os isolados de Bacillus subtilis e Pseudomonas sp. foram facilmente diferenciados por suas características morfológicas e pela sensibilidade a antibióticos. A análise molecular por PCR-RFLP, do rDNA 16S permitiu a separação entre os isolados CIIb, R1 e FL2 e os grupos de Bacillus (S1, S2 e 3918) e de Pseudomonas (MF2, MF4 e Ca). Os perfis de restrição produzidos por nove enzimas de restrição não diferenciaram os três isolados de B. subtilis, assim como não distinguiram os isolados de Pseudomonas sp. e P. fulva.
ABSTRACT
ZARPELON, Talyta Galafassi, M.Sc., Universidade Federal de Viçosa, March of 2007. Characterization of eucalyptus minicutting root-inducing and seedling growth-promoting rhizobacteria isolates. Adviser: Acelino Couto Alfenas. Co-Adviser: Luiz Antônio Maffia and Poliane Alfenas-Zerbini.
did not differentiate the three isolates of B. subtilis nor the isolates of Pseudomonas sp. and P. fulva.
1. INTRODUÇÃO
A rizosfera é uma estreita zona de solo que circunda a raiz e está sob a influência do sistema radicular (5) Nesta região, predominam bactérias de vida livre ou associadas aos tecidos das plantas (2) e que podem exercer um efeito benéfico, neutro ou deletério sobre elas (5). O grupo de bactérias com características benéficas foi denominado “Plant Growth-Promoting Rhizobacteria – PGPR”, ou ainda, rizobactérias promotoras de crescimento de plantas (3, 14, 15).
Isolados de bactérias, obtidos da rizosfera de mudas de diferentes clones de eucalipto, foram testados e destacaram-se quanto ao potencial em promover enraizamento de estacas e miniestacas de clones de Eucalyptus (28). Em diversos viveiros florestais, localizados em todo o país, os isolados mais promissores foram testados em escala semi-operacional, inoculados em diferentes composições de substrato, obtendo incremento em biomassa radicular e da parte aérea, maior velocidade de enraizamento e controle de doenças como Cylindrocladium candelabrum Viégas e Rhizoctonia solani Kuhn (17), Quambalaria eucalypti (Wingfield, Crous & Swart) Simpson (sin. Sporothrix eucalypti Wingfield, Crous & Swart) (16), e Puccinia psidii Winter via indução de resistência sistêmica (28).
A detecção e identificação de bactérias pode ser realizada por métodos microbiológicos convencionais, como o isolamento, o cultivo de culturas puras em meio seletivos, testes bioquímicos e observação direta feita através de microscópio (20). Entretanto, estes métodos são trabalhosos, demandam tempo e, além disso, a ocorrência de formas intermediárias que dificultam a interpretação dos resultados, impossibilitam muitas vezes a identificação correta dessas bactérias. Métodos de detecção molecular incluindo sondas genéticas, hibridização de DNA, PCR e genes repórteres são utilizados em adição aos métodos convencionais de identificação de bactérias (7).
Os padrões de RFLP (Restriction Fragment Length Polymorphism) foram os primeiros marcadores de DNA usados para se comparar diferentes isolados (29) e têm sido empregados nos estudos de genética de populações (9, 27). A análise por RFLP após a amplificação por PCR (Polymerase Chain Reaction) das seqüências parciais da região 16S do DNA ribossomal é uma técnica apropriada e rápida para diferenciar e caracterizar microrganismos com base nas relações filogenéticas (1). Os genes ribossomais (rDNA) são encontrados em todos os microrganismos e são conhecidos por sua baixa taxa de mutação. Os interespaços entre as regiões altamente conservadas dos genes ribossomais, são regiões que apresentam seqüências variáveis chamadas de regiões espaçadoras. As mutações dentro das regiões espaçadoras ocorrem com maior freqüência que com os genes ribossomais, sendo estas mutações de grande utilidade para a separação entre gêneros e espécies (6, 12, 27). Em DNA bacteriano, o rDNA inclui os locos 16S, 23S e 5S, os quais são separados pela região denominada ITS, espaço interno transcrito. Dessa forma, pode-se utilizar o rDNA para estudo de grupos heterogêneos ou a região espaçadora (ITS) entre genes conservados para o estudo de grupos muito similiares. Assim, a análise PCR-RFLP da região 16S do DNA ribossomal é um método utilizado para diferenciação de espécies (24-26) e a maioria das caracterizações é realizada utilizando um pequeno número de enzimas e uma interpretação visual do padrão de restrição. Além disso, este método é mais rápido do que o seqüênciamento da região 16S do rDNA e menos oneroso.
2. MATERIAL E MÉTODOS
2.1. Isolados de rizobactérias
Foram utilizados nove isolados de rizobactérias que se destacaram quanto ao potencial em promover enraizamento de estacas e miniestacas de clones de Eucalyptus. Os isolados denominados de S1, S2 e 3918 pertencem a espécie Bacillus subtilis Cobn, 1872, o isolado Ca foi determinado como da espécie Pseudomonas fulva Lizuga & Komagata, 1963, o isolado FL2 de Pseudomonas aeruginosa (Schroeter, 1872) Migula, 1900, o isolado CIIb é da espécie Stenotrophomonas maltophilia (Hugh, 1872) Palleroni & Bradbury, 1993, o isolado R1 de Frateuria aurantia Swings et al., 1980 e os isolados MF2 e MF4 foram identificados como Pseudomonas sp. Migula, 1894 (28).
2.2. Caracterização morfológica dos isolados de rizobactérias
Os isolados de rizobactérias foram caracterizados morfologicamente em três diferentes meios de cultura. Para isso, eles foram inicialmente repicados para o meio 523 e em seguida transferidos para placas de Petri, com 9 cm de diâmetro, contendo os meios: 523 (13), YMA (yeast extract-manitol-ágar) e Ágar Nutritivo-Glicose (18), em estado sólido.
quanto aos critérios de crescimento (muito rápido: menos de 1 dia, rápido: entre 1 e 2 dias, médio: entre 2 e 3 dias, lento: 3 e 4 dias e muito lento: mais de 4 dias), consistência (mucosa, fluida e micelial), superfície (lisa e rugosa), brilho (brilhante, translúcida e opaca), coloração e alteração da cor do meio.
h
i
l
p
m
q
j
n
r
k
o
s
a
b
g
c
d
e
f
h
i
l
p
m
q
j
n
r
k
o
s
h
i
l
p
m
q
j
n
r
k
o
s
h
i
l
p
m
q
j
n
r
k
o
s
a
b
g
c
d
e
f
a
b
g
c
d
e
f
a
b
g
c
d
e
f
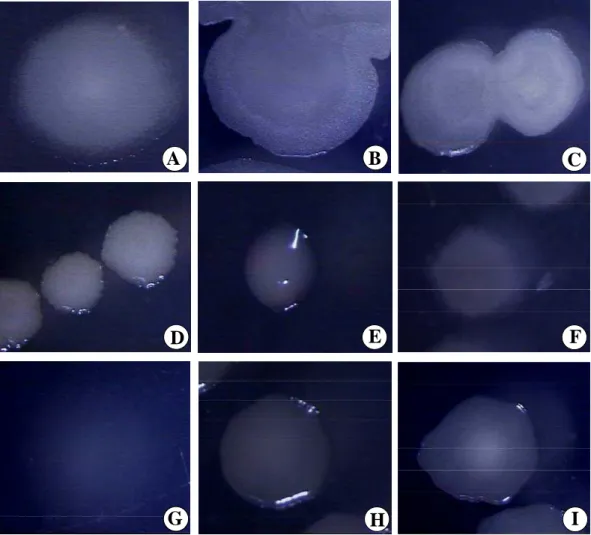
Figura 1. Padrão utilizado na caracterização morfológica dos isolados pré-selecionados de rizobactérias. Quanto à elevação das colônias, temos:
a – chata; b – espraiada; c – convexa baixa; d – convexa alta;
e – umbilicada; f – centro-saliente e g – papilífera. Em relação à forma: h, k, l, m, n e p – circular; i, j, o, q – irregular e r, s – rizóide. A estrutura das colônias: h, l, m, n – amorfa; i, j, k, o – granulosa;
q – cacheada e p, r, s – filamentosa. As bordas das colônias foram classificadas como: h, n – inteiros; i, o, p, q – ondulados;
j, k – lobados; l, m – denticulados e r, s – franjados.
2.3. Sensibilidade dos isolados de rizobactérias a antibióticos
28ºC no escuro. Após 48 h de incubação, obteve-se uma suspensão bacteriana em solução salina de NaCl a 0,85%. Após esta etapa, foram distribuídos 0,1 mL da suspensão (O.D.540 = 0,2) em placas de Petri, onde posteriormente foram
depositados 4 discos de 28 antibióticos posicionados eqüidistantementes entre si (Tabela 3).
O experimento foi composto por três réplicas e a avaliação realizada 48 h após a montagem do ensaio, onde foi determinada a presença do halo de inibição.
2.4. Caracterização molecular dos isolados de rizobactérias
2.4.1. Extração do DNA
isopropanol e centrifugou-se a 12000 rpm por 30 min. Descartado o sobrenadante, o DNA foi lavado duas vezes em etanol 70% e secado por 20 minutos no dessecador. Posteriormente, o DNA foi ressuspendido em 50 µL de tampão TE (Tris 10 mM e EDTA 1 mM, pH 8,0) e incubados por 1 h a 37°C.
Em seguida, o DNA extraído foi quantificado em um espectrofotômetro a 260 nm e 280 nm. A leitura de absorbância a 260 nm permitiu a quantificação, e a relação 260O.D./280O.D. forneceu a avaliação da pureza da extração.
2.4.2. Reação de PCR
As reações de PCR foram constituídas de 10-20 ng de DNA genômico, 2 mM de MgCl2, 50 mM de KCl, 10 mM de Tris-HCl (pH 8,3), 0,1 mM de cada
um dos deoxinucleotídeos (dATP, dTTP, dCTP e dGTP) (Invitrogen, Rockeville, MD, USA), 0,1 μM de cada um dos oligonucleotídeos, 1 unidade da enzima Taq polimerase (Phoneutria) e água estéril (MilliQ) suficiente para atingir o volume final de 50 μL. Foram utilizados oligonucleotídeos específicos para amplificação de um fragmento de 1,6 Kb correspondente à região rDNA 16S de bactérias P1 (5’-AGA GTT TGA TCC TGG CTC AG-3’) e P2 (5’-AAG GAG GTG ATC CAG CCG CA-3’) (30). As reações de PCR foram realizadas em um termociclador Mastercycler® (Eppendorf, Hamburg, Alemanha), com as seguintes condições: desnaturação inicial a 94ºC por 3 min, seguida de amplificação por 35 ciclos, cada qual constituído por uma etapa de desnaturação do DNA por 1 min a 94ºC, anelamento dos oligonucleotídeos por 30 seg a 60ºC e extensão por 1 min e 30 seg a 72°C. Após os 35 ciclos, realizou-se uma extensão final a 72ºC por 7 min. A fim de confirmar a amplificação, 5 μL do produto da PCR foram submetidos à eletroforese em gel de agarose (1,2%) de acordo com técnicas padrão (23).
2.4.3. Análise de restrição dos fragmentos
3. RESULTADOS
3.1. Caracterização morfológica dos isolados de rizobactérias
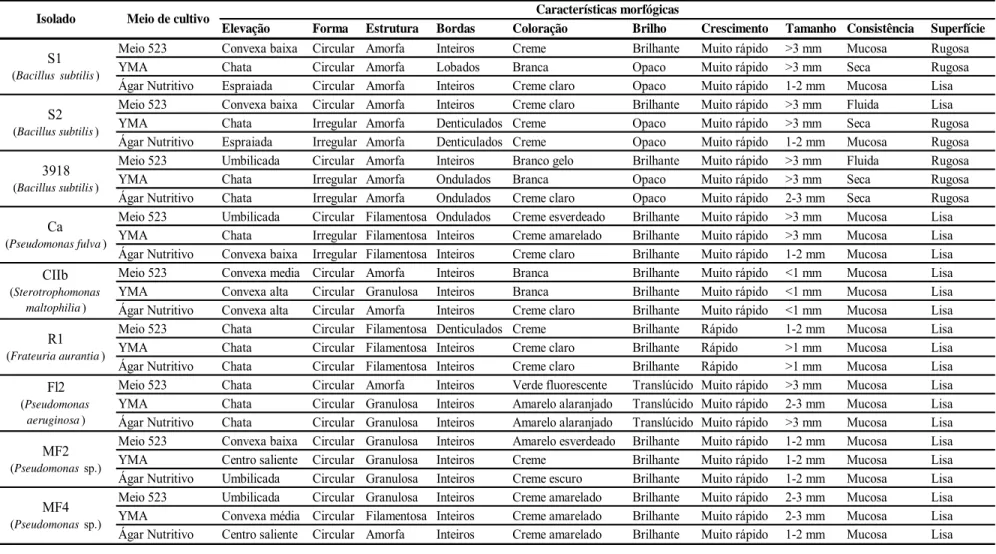
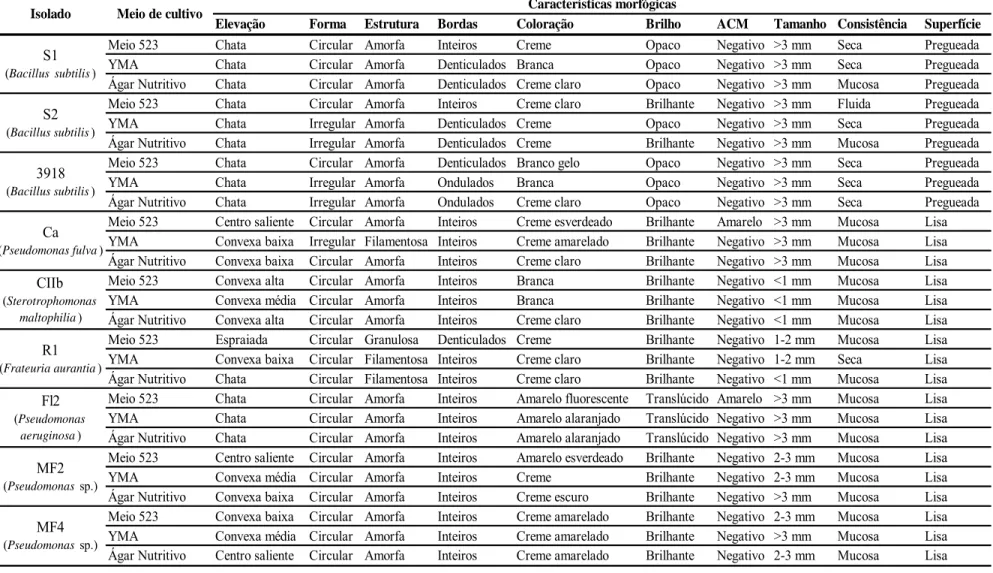
As características morfológicas variaram de acordo com o meio de cultura (523, YMA e Ágar Nutritivo-Glicose) e isolado de rizobactéria. O meio 523 foi o que mais diferenciou entre si os três isolados de Bacillus subtilis e os dois de Pseudomonas sp., principalmente nas características observadas após 24 h de incubação. Entre as características avaliadas, a coloração e a elevação das colônias no meio 523 foi a que mais distinguiu os isolados: creme e convexa baixa para o isolado S1, creme e chata para o R1, creme claro e convexa baixa para S2, branco gelo e umbilicada para 3918, creme esverdeado e umbilicada para Ca, branca e convexa baixa para CIIb, verde fluorescente e chata para FL2, amarelo esverdeado e convexa baixa para MF2 e creme amarelado e umbilicada para o isolado MF4 (Tabela 1).
O isolado R1 diferenciou-se dos demais pela característica de crescimento, pois foi o único que apresentou crescimento rápido, após 24 h de incubação a 28°C, com tamanho de colônias menores que 1 mm, nos três meios utilizados (Figuras 2 e 3 e Tabela 1). Já as colônias do isolado CIIb, diferiram das demais pelo crescimento puntiforme (tamanho <1 mm), inclusive após 48 h de incubação (Tabela 1 e Tabela 2).
separam são: coloração, bordas e superfície. Para o S1, repicado no meio 523, observou-se coloração creme e superfície rugosa nas primeiras 24 h de cultivo, e no meio ágar nutritivo coloração creme claro e superfície lisa. Após 24 h de cultivo, as colônias do isolado S2, repicado para o meio 523, apresentam consistência fluida e superfície lisa, além de uma forma irregular e bordas denticuladas nos meios YMA e ágar nutritivo. Outro Bacillus, o isolado 3918, exibiu quando repicado para meio 523, colônias de coloração branco gelo, elevação umbilicada e superfície rugosa. Estas características, após 24 h de incubação diferenciam estes isolados (Figuras 2 e 3 e Tabela 1). Com 48 h de incubação, a superfície das colônias dos isolados de Bacillus tornam-se pregueada, entretanto as colônias do isolado S2 apresentam-se brilhantes e de consistência fluida, quando cultivadas no meio 523, características que também diferenciam este isolado dos demais Bacillus (Tabela 2).
A B C
F E
D
I H
G A
A BB CC
F F E
E D
D
II H
H G
G
B C
F E
I H
A
D
G
B C
F E
I H
A
D
G G
Tabela 1. Caracterização morfológica dos isolados de rizobactérias, determinada após 24 h de incubação, em meio 523, YMA e ágar nutritivo-glicose, em estado sólido.
Elevação Forma Estrutura Bordas Coloração Brilho Crescimento Tamanho Consistência Superfície
Meio 523 Convexa baixa Circular Amorfa Inteiros Creme Brilhante Muito rápido >3 mm Mucosa Rugosa YMA Chata Circular Amorfa Lobados Branca Opaco Muito rápido >3 mm Seca Rugosa Ágar Nutritivo Espraiada Circular Amorfa Inteiros Creme claro Opaco Muito rápido 1-2 mm Mucosa Lisa Meio 523 Convexa baixa Circular Amorfa Inteiros Creme claro Brilhante Muito rápido >3 mm Fluida Lisa YMA Chata Irregular Amorfa Denticulados Creme Opaco Muito rápido >3 mm Seca Rugosa Ágar Nutritivo Espraiada Irregular Amorfa Denticulados Creme Opaco Muito rápido 1-2 mm Mucosa Rugosa Meio 523 Umbilicada Circular Amorfa Inteiros Branco gelo Brilhante Muito rápido >3 mm Fluida Rugosa YMA Chata Irregular Amorfa Ondulados Branca Opaco Muito rápido >3 mm Seca Rugosa Ágar Nutritivo Chata Irregular Amorfa Ondulados Creme claro Opaco Muito rápido 2-3 mm Seca Rugosa Meio 523 Umbilicada Circular Filamentosa Ondulados Creme esverdeado Brilhante Muito rápido >3 mm Mucosa Lisa YMA Chata Irregular Filamentosa Inteiros Creme amarelado Brilhante Muito rápido >3 mm Mucosa Lisa Ágar Nutritivo Convexa baixa Irregular Filamentosa Inteiros Creme claro Brilhante Muito rápido 1-2 mm Mucosa Lisa Meio 523 Convexa media Circular Amorfa Inteiros Branca Brilhante Muito rápido <1 mm Mucosa Lisa YMA Convexa alta Circular Granulosa Inteiros Branca Brilhante Muito rápido <1 mm Mucosa Lisa Ágar Nutritivo Convexa alta Circular Amorfa Inteiros Creme claro Brilhante Muito rápido <1 mm Mucosa Lisa Meio 523 Chata Circular Filamentosa Denticulados Creme Brilhante Rápido 1-2 mm Mucosa Lisa YMA Chata Circular Filamentosa Inteiros Creme claro Brilhante Rápido >1 mm Mucosa Lisa Ágar Nutritivo Chata Circular Filamentosa Inteiros Creme claro Brilhante Rápido >1 mm Mucosa Lisa Meio 523 Chata Circular Amorfa Inteiros Verde fluorescente Translúcido Muito rápido >3 mm Mucosa Lisa YMA Chata Circular Granulosa Inteiros Amarelo alaranjado Translúcido Muito rápido 2-3 mm Mucosa Lisa Ágar Nutritivo Chata Circular Granulosa Inteiros Amarelo alaranjado Translúcido Muito rápido >3 mm Mucosa Lisa Meio 523 Convexa baixa Circular Granulosa Inteiros Amarelo esverdeado Brilhante Muito rápido 1-2 mm Mucosa Lisa YMA Centro saliente Circular Granulosa Inteiros Creme Brilhante Muito rápido 1-2 mm Mucosa Lisa Ágar Nutritivo Umbilicada Circular Granulosa Inteiros Creme escuro Brilhante Muito rápido 1-2 mm Mucosa Lisa Meio 523 Umbilicada Circular Granulosa Inteiros Creme amarelado Brilhante Muito rápido 2-3 mm Mucosa Lisa YMA Convexa média Circular Filamentosa Inteiros Creme amarelado Brilhante Muito rápido 2-3 mm Mucosa Lisa Ágar Nutritivo Centro saliente Circular Amorfa Inteiros Creme amarelado Brilhante Muito rápido 1-2 mm Mucosa Lisa
R1
(Frateuria aurantia)
Fl2
(Pseudomonas aeruginosa)
MF2
(Pseudomonas sp.)
MF4
(Pseudomonas sp.)
S2
(Bacillus subtilis)
3918
(Bacillus subtilis)
Ca
(Pseudomonas fulva)
CIIb
(Sterotrophomonas maltophilia)
Isolado Meio de cultivo Características morfógicas
S1
Tabela 2. Caracterização morfológica de isolados de rizobactérias, determinada após 48 h de incubação, em meio 523, YMA e ágar nutritivo-glicose, em estado sólido.
Elevação Forma Estrutura Bordas Coloração Brilho ACM Tamanho Consistência Superfície
Meio 523 Chata Circular Amorfa Inteiros Creme Opaco Negativo >3 mm Seca Pregueada
YMA Chata Circular Amorfa Denticulados Branca Opaco Negativo >3 mm Seca Pregueada
Ágar Nutritivo Chata Circular Amorfa Denticulados Creme claro Opaco Negativo >3 mm Mucosa Pregueada
Meio 523 Chata Circular Amorfa Inteiros Creme claro Brilhante Negativo >3 mm Fluida Pregueada
YMA Chata Irregular Amorfa Denticulados Creme Opaco Negativo >3 mm Seca Pregueada
Ágar Nutritivo Chata Irregular Amorfa Denticulados Creme Brilhante Negativo >3 mm Mucosa Pregueada
Meio 523 Chata Circular Amorfa Denticulados Branco gelo Opaco Negativo >3 mm Seca Pregueada
YMA Chata Irregular Amorfa Ondulados Branca Opaco Negativo >3 mm Seca Pregueada
Ágar Nutritivo Chata Irregular Amorfa Ondulados Creme claro Opaco Negativo >3 mm Seca Pregueada
Meio 523 Centro saliente Circular Amorfa Inteiros Creme esverdeado Brilhante Amarelo >3 mm Mucosa Lisa YMA Convexa baixa Irregular Filamentosa Inteiros Creme amarelado Brilhante Negativo >3 mm Mucosa Lisa Ágar Nutritivo Convexa baixa Circular Amorfa Inteiros Creme claro Brilhante Negativo >3 mm Mucosa Lisa
Meio 523 Convexa alta Circular Amorfa Inteiros Branca Brilhante Negativo <1 mm Mucosa Lisa
YMA Convexa média Circular Amorfa Inteiros Branca Brilhante Negativo <1 mm Mucosa Lisa
Ágar Nutritivo Convexa alta Circular Amorfa Inteiros Creme claro Brilhante Negativo <1 mm Mucosa Lisa
Meio 523 Espraiada Circular Granulosa Denticulados Creme Brilhante Negativo 1-2 mm Mucosa Lisa
YMA Convexa baixa Circular Filamentosa Inteiros Creme claro Brilhante Negativo 1-2 mm Seca Lisa
Ágar Nutritivo Chata Circular Filamentosa Inteiros Creme claro Brilhante Negativo <1 mm Mucosa Lisa Meio 523 Chata Circular Amorfa Inteiros Amarelo fluorescente Translúcido Amarelo >3 mm Mucosa Lisa
YMA Chata Circular Amorfa Inteiros Amarelo alaranjado Translúcido Negativo >3 mm Mucosa Lisa
Ágar Nutritivo Chata Circular Amorfa Inteiros Amarelo alaranjado Translúcido Negativo >3 mm Mucosa Lisa Meio 523 Centro saliente Circular Amorfa Inteiros Amarelo esverdeado Brilhante Negativo 2-3 mm Mucosa Lisa
YMA Convexa média Circular Amorfa Inteiros Creme Brilhante Negativo 2-3 mm Mucosa Lisa
Ágar Nutritivo Convexa baixa Circular Amorfa Inteiros Creme escuro Brilhante Negativo >3 mm Mucosa Lisa
Meio 523 Convexa baixa Circular Amorfa Inteiros Creme amarelado Brilhante Negativo 2-3 mm Mucosa Lisa
YMA Convexa média Circular Amorfa Inteiros Creme amarelado Brilhante Negativo >3 mm Mucosa Lisa
Ágar Nutritivo Centro saliente Circular Amorfa Inteiros Creme amarelado Brilhante Negativo 2-3 mm Mucosa Lisa R1
(Frateuria aurantia)
Fl2
(Pseudomonas aeruginosa)
MF2
(Pseudomonas sp.)
MF4
(Pseudomonas sp.)
S2
(Bacillus subtilis)
3918
(Bacillus subtilis)
Ca
(Pseudomonas fulva)
CIIb
(Sterotrophomonas maltophilia)
Isolado Meio de cultivo Características morfógicas
S1
3.2. Sensibilidade dos isolados de rizobactérias a antibióticos
O pefloxacin foi o único dos antibióticos testados que inibiu todos os isolados de rizobactérias. Em contrapartida, os isolados testados foram insensíveis à penicilina, exceto o R1 que apresentou halo de inibição. Este isolado foi insensível apenas aos antibióticos oxacilina, aztreonam e rifampicina.
O isolado FL2 foi o único isolado insensível a amicacina, amonicilina+ác. clavulanico, cefepime, cefotaxima e norfloxacin e o menos sensível, sendo que os antibióticos pefloxacin, ácido pipemidico, estreptomicina, tetraciclina e sulfonamida inibiram o crescimento do isolado.
Sulfazotrim, clindamicina e vancomicina inibiram os isolados S1, S2, 3918, R1 e CIIb, sendo os demais isolados insensíveis. O antibiótico oxacilina inibiu somente o crescimento dos isolados de B. subtilis (S1, S2 e 3918). O isolado S2 demonstrou-se mais sensível aos antibióticos testados, com exceção dos antibióticos penicilina e cefalexina, que não inibiram o seu crescimento.
Os antibióticos rifampicina, tobramicina e tetraciclina inibiu somente o isolado S2, diferenciando-o dos isolados S1 e 3918. Aztreonam, cefalotina e ceftazidima inibiram o crescimento dos isolados S2 e 3918, em contrapartida eritromicina, nitrofurantoína, ampicilina, cloranfenicol, amoxicilina e ácido pipemidico inibiram o crescimento dos isolados S1 e S2.
Treze antibióticos testados inibiram o crescimento dos isolados MF2 e MF4. Os antibióticos nitrofurantoína, amoxicilina e neomicina inibiram somente o isolado MF2. Os antibióticos ácido pipemidico, ticarcilina + ácido clavulanico, tetraciclina, sulfonamida e estreptomicina inibiram o crescimento do isolado MF4 sem afetar a multiplicação do isolado MF2.
Tabela 3. Sensibilidade dos isolados de rizobactérias em relação aos antibióticos testados.
Nome
comercial Código Concentração S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
Pefloxacin PEF 5mcg + + + + + + + + +
Penicilina G PEN 10U - - - - - + - -
-Amicacina AMI 30μg + + + + + + - + +
Amonicilina +
Ác.Clavulanico AMC 30mcg + + + + + + - + +
Cefepime COM 30μg + + + + + + - + +
Cefotaxima CTX 30mcg + + + + + + - + +
Norfloxacin NOR 10μg + + + + + + - + +
Sulfazotrim SUT 25μg + + + - + + - -
-Clindamicina CLI 2μg + + + - + + - -
-Vancomicina VAN 30mcg + + + - + + - -
-Oxacilina OXA 1μg + + + - - - - -
-Rifampicina RIF 5μg - + - - + - - + +
Tobramicina TOB 10μg - + - + - + - + +
Aztreonam ATM 30μg - + + - - - - + +
Cefalotina CFL 30μg - + + - - + - -
-Ceftazidima CAZ 30μg - + + + + + - + +
Cefalexina CFX 30mcg + - + + - + - -
-Ampicilina AMP 10μg + + - + + + - -
-Cloranfenicol CLO 30μg + + - + + + - -
-Eritromicina ERI 15μg + + - - - + - -
-Nitrofurantoína NIT 300μg + + - - - + - +
-Amoxicilina AMO 10μg + + - + + + - +
-Ácido
pipemidico PIP 20mcg + + - + + + + - +
Estreptomicina EST 10mcg + + + + - + + - +
Neomicina NEO 30mcg + + + + - + - +
-Tetraciclina TET 30μg - + - + + + + - +
Ticarcilina +
Ác.Clavulanico TIC 85mcg + + + + + + - - +
Sulfonamida SUL 300μg + + + + + + + - +
Isolado de rizobactéria Antibiótico
Ausência de halo de inibição ( - ); Presença de halo de inibição ( + );
3.3. Caracterização molecular
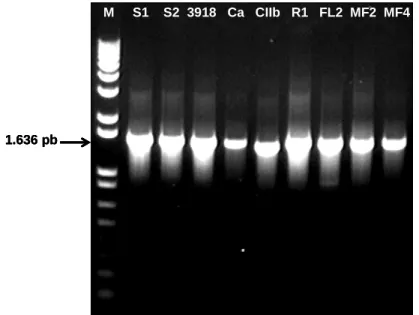
A amplificação por PCR da região 16S do rDNA de rizobactérias, gerou fragmentos de aproximadamente 1,6 kb para todos os isolados (Figura 4). A análise de restrição destes fragmentos, utilizando-se nove enzimas, diferenciou o grupo dos isolados de Bacillus (3918, S1 e S2) e o grupo das Pseudomonas (MF2, MF4 e Ca) dos demais isolados de rizobactérias (Figura 5). Entretanto, a análise não diferenciou entre si os isolados dos grupos formados. Os demais isolados foram diferenciados entre si por pelo menos uma enzima.
Entre os isolados testados, CIIb mostrou-se o mais divergente, sendo que seis das nove enzimas de restrição utilizadas resulta em perfis de restrição que separa dos demais isolados. O isolado FL2 pôde ser diferenciado dos demais, pelas enzimas Sau3AI, MspI, BamHI, DdeI e TaqI (Figuras 5C, E, G e I, respectivamente).
As enzimas Sau3AI e MspI permitiu a separação o maior número de isolados (Figura 5C, E, respectivamente). Os grupos formados por estas enzimas foram o dos isolados S1, S2 e 3918 clivado em várias regiões para ambas as enzimas. Outro grupo diferenciado é composto pelos isolados MF2, MF4 e Ca com a enzima Sau3AI obteve fragmento de 900 bp e na clivagem com a enzima MspI apresentou dois fragmentos de aproximadamente 600 e 500 bp. Os isolados CIIb, R1 e FL2 foram diferenciado em ambas as enzimas.
A enzima de restrição EcoRI separou os isolados em três grupos. Os isolados S1, S2, 3918 e R1 com fragmentos de aproximadamente 900 e 700 bp, diferindo do isolado CIIb que obteve fragmentos de 900 e 600 bp e dos isolados Ca, FL2, MF2 e MF4 na qual a região amplificada não foi clivada pela enzima (Figura 5A). Os mesmos grupos foram também separados através da clivagem dos fragmentos com a enzima SphI (Figura 5D). Já os isolados R1 e CIIb foram agrupados pela enzima RsaI, com três fragmentos próximos de 350 a 550 bp e dois fragmentos com 500 e 850 bp, respectivamente (Figura 5B).
grupos, um os isolados S1, S2 e 3918 e o outro grupo formado pelos isolado Ca, CIIb, MF2 e MF4 (Figura 5I).
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
1.636 pb
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
1.636 pb 1.636 pb
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
A
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
B
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
C
M’ S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
D
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
E
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
F
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
G
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
I
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
H 12,000 5,000 2,000 1,650 1,000 850 650 500 400 300 200 100 12,000 5,000 2,000 1,650 1,000 850 650 500 400 300 200 12,216 3,054 2,036 1,636 1,018 506 396 bp
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
A
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4 M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
A
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
B
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4 M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
B
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
C
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4 M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
C
M’ S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
D
M’ S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4 M’ S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
D
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
E
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4 M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
E
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
F
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4 M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
F
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
G
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4 M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
G
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
I
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4 M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
I
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
H
M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4 M S1 S2 3918 Ca CIIb R1 FL2 MF2 MF4
H 12,000 5,000 2,000 1,650 1,000 850 650 500 400 300 200 100 12,000 5,000 2,000 1,650 1,000 850 650 500 400 300 200 12,216 3,054 2,036 1,636 1,018 506 396 bp 12,000 5,000 2,000 1,650 1,000 850 650 500 400 300 200 100 12,000 5,000 2,000 1,650 1,000 850 650 500 400 300 200 100 12,000 5,000 2,000 1,650 1,000 850 650 500 400 300 200 100 12,000 5,000 2,000 1,650 1,000 850 650 500 400 300 200 12,000 5,000 2,000 1,650 1,000 850 650 500 400 300 200 12,000 5,000 2,000 1,650 1,000 850 650 500 400 300 200 12,216 3,054 2,036 1,636 1,018 506 396 12,216 3,054 2,036 1,636 1,018 506 396 12,216 3,054 2,036 1,636 1,018 506 396 bp
4. DISCUSSÃO
Nove isolados de rizobactérias promotoras de enraizamento de miniestacas e crescimento de mudas de eucalipto, foram avaliados quanto às características morfológicas, molecular e a sensibilidade a antibióticos visando à diferenciação entre os isolados e a detecção de contaminantes no processo de produção do inoculante. A caracterização dos isolados é fundamental para o processo de produção destes microrganismos em larga escala, auxiliando no controle de qualidade do produto Rizolyptus®, garantindo o efeito benéfico da rizobacterização na propagação clonal do eucalipto verificado em experimentos anteriormente realizados.
Todos os isolados foram diferenciados por suas características morfológicas e pela sensibilidade a diferentes antibióticos. As características morfológicas dos isolados variam em relação ao meio de cultura utilizado e ao tempo de incubação, o crescimento dos isolados variam de acordo com o antibiótico e o isolado de rizobactéria testado e em alguns casos, a presença do antibiótico resulta em multiplicação de células resistentes, observado pela formação do halo duplo de inibição.
e antagonismo a patógenos similares aos tipos selvagens de rizobactérias. Após a escolha do mutante, foi monitorada a dinâmica populacional em plantas de ervilhas no campo e observada a estabilidade ao longo do tempo da concentração de bactérias e o alto nível populacional, resultante principalmente da eficiente colonização das raízes (32).
A adição de antibiótico ao meio de cultura utilizado na produção do inoculante é uma alternativa que reduz os riscos de contaminação ou troca de isolados, sendo que para o isolado MF2 a utilização do antibiótico sulfonamida (300μg), inibi o crescimento dos demais isolados. Da mesma maneira o uso de um dos antibióticos amicacina (30μg), amonicilina+ác. clavulanico (30mcg), cefepime (30μg), cefotaxima (30mcg) ou norfloxacin (10μg) não altera o crescimento do isolado FL2. Os antibióticos testados podem ainda serem utilizados para diferenciar os isolados de Bacillus e de Pseudomonas, confirmando através das características morfológicas a identidade de cada isolado.
As características morfológicas dos isolados determinada em três meios de cultura, além de diferenciarem todos os isolados é uma ferramenta adicional para a detecção de microrganismos contaminantes. Entretanto, as características morfológicas e a resistência a antibióticos são técnicas que mesmo sendo essenciais em um programa de qualidade, por caracterizarem rapidamente os isolados e possuírem baixo custo, apresentam resultados subjetivos, como coloração das colônias, forma de bordas e diferentes respostas a inibição em relação às concentrações dos antibióticos. Desta forma, as técnicas moleculares que são mais sensíveis e podem detectar diferenças no genoma devem ser utilizadas como técnica complementar no controle de qualidade.
indivíduos, inclusive, de espécies geneticamente relacionadas (8). Para a caracterização molecular dos isolados de rizobactérias, optou-se pela técnica denominada PCR-RFLP por ser um método sensível e confiável, amplamente utilizado, altamente reproduzível e relativamente de fácil execução.
Os resultados obtidos na análise molecular foram similares aos de outros autores que diferenciaram microrganismos pela técnica PCR-RFLP (4, 6, 10, 22, 25). A clivagem das seqüências parciais da região 16S do DNA ribossomal permitiu diferenciar os grupos de Bacillus (S1, S2 e 3918), de Pseudomonas (MF2, MF4 e Ca) dos isolados CIIb, R1 e FL2. Nenhum dos perfis de restrição observado diferenciou entre si os isolados S1, S2 e 3918, todos da espécie B. subtilis, e os isolados MF2, MF4 e Ca do gênero Pseudomonas, provavelmente devido a região 16S do DNA ribossomal destas espécies ser altamente conservada, não sendo detectada diferenças neste fragmento quando digerida pelas nove enzimas de restrição utilizadas. Tassa e Duarte (26), também não obtiveram sucesso, na separação das subespécies, Pectobacterium carotovorum subsp. brasiliensis, P. carotovorum subsp. carotovorum e outras pectobactérias disponíveis no GenBank, devido à baixa especificidade apresentada pelo gene recA amplificado e digerido por enzimas. No entanto, a clivagem com HhaI e TasI permitiu a separação de 13 grupos distintos e somente a discriminação de P. carotovorum subsp. brasiliensis destes grupos.
Para separação entre os isolados de B. subtilis e de Pseudomonas pode-se utilizar a mesma técnica molecular, entretanto amplificando as regiões espaçadoras (ITS) entre genes rDNA. Como as mutações dentro das regiões espaçadoras ocorrem com maior freqüência que com os genes ribossomais, estas regiões são de grande utilidade para a separação entre espécies (6, 12, 27). Um exemplo é a diferenciação de Xanthomonas axonopodis pv. citri Tipo A de X. axonopodis pv. aurantifolii Tipos B e C e de X. axonopodis pv. citrumela Tipo E, agentes causais de várias doenças em citrus, por meio da amplificação da região ITS entre 16S e 23S e posterior clivagem com enzimas de restrição DdeI, AluI e Sau3AI (4).
principalmente, em relação a brilho e elevação das colônias e também podem ser facilmente diferenciadas pela análise molecular que demonstrou após a clivagem com as enzimas de restrição Sau3AI, MspI, DdeI, BamHI e TaqI diferentes perfis de restrição para a região amplificada do genoma. Estas bactérias pertencem a espécies diferentes de Pseudomonas o que facilita na separação de forma análoga as espécies, Stenotrophomonas maltophilia e Frateuria aurantia, isolados CIIb e R1, respectivamente.
5. REFERÊNCIAS BIBLIOGRÁFICAS
1. Carlotti, A.; Funke, G. (1994). Rapid distinction of Brevibacterium species by restriction analysis of rDNA generated by polymerase chain reaction. Systematic and Applied Microbiology, 17, 380-386.
2. Chanway, C.P., Turkington, R.; Holl, F.B. (1991). Ecological implications of specificity between plants and rhizosphere microorganisms. Advances in Ecological Research, 21, 121-169.
3. Davison, J. (1988). Plant beneficial bacteria. BioTechniques, 6, 282-286.
4. Destéfano, S.A.L.; Rodrigues Neto, J. (2002). Rapid differentiation of Xanthomonas strains causing disease in citrus plants by PCR-RFLP of the 16S-23S rDNA spacer region. Summa Phytopathologica, 28, 167-172.
5. Dobbelaere, S., Vanderleyden, J.; Yaacov, O. (2003). Plant growth-promoting effects of diazotrophs in the rhizosphere. Critical Reviews in Plant Sciences, 22, 107-149.
6. Edel, V., Steinberg, C., Gautheron, N.; Alabouvette, C. (1996). Evaluation of restriction analysis of polymerase chain reaction (PCR) - amplified ribosomal DNA for the identification of Fusarium species. Mycological Research, 101, 179-187.
8. Fernandes, M.F., Fernandes, R.P.M.; Hungria, M. (2003). Caracterização genética de rizóbios nativos dos tabuleiros costeiros eficientes em culturas do guandu e caupi. Pesquisa Agropecuária Brasileira, 38, 911-920.
9. Geiser, D.M., Arnold, M.L.; Timberlake, W.E. (1994). Sexual origins of British Aspergillus nidulans isolates. Proceedings of the National Academy of Sciences of the United States of America, 91, 2349-2352. 10. Gibotti, A., Tanaka, T.L., Oliveira, V.R., Taddei, C.R.; Martinez, M.B.
(2004). Molecular characterization of enteroinvasive Escherichia coli ipa genes by PCR-RFLP analysis. Brazilian Journal of Microbiology, 35, 74-80.
11. Graves, L.M.; Swaminathan, M. (1993). IN Diagnostic molecular microbiology: principles and application (Persing, D. H., Smith, T. F., Tenover, F. C.; White, B. E., Eds.), pp. 325-328, American Society for Microbiology, Washington.
12. Iwen, P.C., Hinrichs, S.H.; Rupp, M.E. (2002). Utilization of the internal transcribed spacer regions as molecular targets to detect and identify human fungal pathogens. Med Myc, 40, 87-109.
13. Kado, E.I.; Heskett, M.G. (1970). Selective media for isolation of Agrobacterium, Corynebacterium, Erwinia, Pseudomonas and Xanthomonas. Phytopathology, 60, 969-976.
14. Kloepper, J.W., Lifshitz, R.; Zablotowicz, R.M. (1989). Free-living bacterial inocula for enhancing crop productivity. Trends Biotechnology, 7, 39-43.
15. Kloepper, J.W.; Schroth, M.N. (1978) IN INTERNATIONAL CONFERENCE ON PLANT PATHOGENIC BACTERIA (ANGERS, Ed.), Vol. 4, pp. 879-882, Angers.
16. Ladeira, M.C.G. (2004) Controle biológico de Quambalaria eucalypti mediado por rizobactérias. Departamento de Fitopatologia, pp. 45, Universidade Federal de Viçosa, Viçosa.
18. Mariano, R.L.R. (2000). Manual de Práticas em Fitobacteriologia. Editora Universitária, UFPE, Recife, PEp.
19. Radu, S., Ling, O.W., Rusul, G., Karim, M.I.A.; Nishibuchi, M. (2001). Detection of Escherichia coli O157:H7 by multiplex PCR and their characterization by plasmid profiling, antimicrobial resistance, RAPD and PFGE analyses. Journal of Microbiological Methods, 46, 131-139.
20. Reis Junior, F.B., Mendes, I.C., Teixeira, K.R.S.; Reis, V.M. (2002). Uso de ferramentas moleculares em estudos da diversidade de microrganismos do solo, Planaltina, DFp.
21. Romeiro, R.S. (2001). Métodos em Bacteriologia de Plantas. Editora UFV, Viçosa, 279pp.
22. Ruiz, A., Poblet, M., Mas, A.; Guillamón, J.M. (2000). Identification of acetic acid bacteria by RFLP of PCR-amplified 16S rDNA and 16S-23S rDNA intergenic spacer. International Journal of Systematic and Evolutionary Microbiology, 50, 1981-1987.
23. Sambrook, J., Fritsch, E.F.; Maniatis, T. (1989). Molecular cloning: a laboratory manual., New York.
24. Shah, S.A.; Romick, T.L. (1997). Subspecies differentiation of Salmonella by PCR-RFLP of the ribosomal operon using universal primers. Letters in Applied Microbiology, 25, 54-57.
25. Sikora, S.; Redzepovic, S. (2003). Genotypic characterization of indigenous soybean rhizobia by PCR-RFLP of 16S rDNA, rep-PCR and RAPD analysis. Food Technology Biotechnology, 41, 61-67. 26. Tassa, S.O.M.; Duarte, V. (2006). Identificação de Pectobacterium
carotovorum subsp. brasiliensis através de PCR-RFLP do Gene recA. Fitopatologia Brasileira, 31, 23-28.
27. Taylor, J.W., Geiser, D.M., Burt, A.; Koufopanou, V. (1999). The evolutionary biology and population genetics underlying fungal strain typing. Clinical Microbiology Reviews, 12, 126-146.
1-29. Vincent, R.D., Geowart, R., Goldman, W.E., Kobayashi, G.S., Lambowits, A.M.; Medoff, G. (1986). Classification of Histoplasma capsulatum isolates by restriction fragments polymorphisms. Journal Bacteriology, 165, 813-818.
30. Weinsburg, W.G., Barns, S.M.; Pelletier, D.A. (1991). 16S ribossomal DNA amplification for phylogenetic study. Journal Bacteriology, 173, 697-703.
31. White, T.J., Bruns, T., Lee, S.; Taylor, J. (1990). Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. New York, 315-322p.
A
RTIGO2
Eficiência de duas formulações de rizobactérias no
enraizamento de miniestacas e crescimento de mudas de
eucalipto
Talyta G. Zarpelon1; Luis A. Maffia1; Poliane Alfenas-Zerbini1; Eli S. Lopes2; Acelino C. Alfenas1
1Departamento de Fitopatologia, Universidade Federal de Viçosa, Viçosa, Minas
Gerais, Brasil; 2Bio Soja Indústrias Químicas e Biológicas
RESUMO
enraizamento entre 21 a 27 dias após o estaqueamento para todos os isolados. O isolado S2, de Bacillus subtilis, destacou-se dos demais tratamentos para os dois clones nas duas formulações testadas, quando se avaliou a biomassa da parte aérea e das raízes. A eficiência dos inoculantes variou de acordo com o clone, tipo de formulação e isolado testado. Em média, o clone de E. grandis respondeu melhor à rizobacterização que o de E. grandis x E. urophylla. A formulação turfosa propiciou maiores incrementos para velocidade de enraizamento, biomassa da parte aérea e do sistema radicular.
ABSTRACT
ZARPELON, Talyta Galafassi, M.Sc., Universidade Federal de Viçosa, March of 2007. Efficiency of two rhizobacteria formulations in eucalyptus minicutting rooting and seedling growth. Adviser: Acelino Couto Alfenas. Co-Adviser: Luiz Antônio Maffia and Poliane Alfenas-Zerbini.
evaluations showed no significant differences. The isolate S2 of B. subtilis stood out from the other treatments, for the two clones with the two tested formulations, when evaluating the biomass of aerial part and roots. On average, the turf formulation was more efficient in inducing eucalyptus minicutting rooting and seedling growth. Inoculant efficiency varied with clone, type of formulation and tested isolate. On average, clones of E. grandis (11) gave better response to rhizobacterization than E. grandis x E. urophylla (409). The turf formulation provided larger increases for the variables rooting speed, biomass of aerial part and root system. The isolates R1, FL2, S1 and S2 stood out as the most efficient in inducing minicutting rooting and the isolate S2 in inducing seedling growth, expressed by the increase in biomass of aerial part and root system.
1. INTRODUÇÃO
Bactérias que exercem efeito benéfico às plantas são denominadas de “Plant Growth-Promoting Rhizobacteria – PGPR”, ou seja, rizobactérias promotoras de crescimento de plantas (8, 13, 14), que inclui diferentes espécies pertencentes a diversos gêneros, como: Bacillus, Pseudomonas, Azotobacter, Arthrobacter, Clostridium, Hydroganophaga, Enterobacter, Serratia e Azospirillum (2).
Além de serem utilizadas para promover o crescimento de plantas (6, 10, 22, 26, 28), alguns outros benefícios incluem o controle biológico de doenças (1, 3, 19), aumento da produção (11, 17, 21, 22) e indução de resistência a patógenos foliares (23, 29).
A partir de uma série de estudos iniciados no final da década de 90, têm sido comprovados os efeitos benéficos das rizobactérias em promover o enraizamento, o crescimento de mudas (20, 21, 27, 28) e o controle biológico de doenças que afetam a propagação clonal do eucalipto (18, 27, 29). Dentre 107 isolados de bactérias, obtidos da rizosfera de mudas de diferentes clones de Eucalyptus, que se destacaram quanto ao potencial de enraizamento de miniestacas de eucalipto, oito foram identificados como pertencentes às espécies de Bacillus subtilis (S1, S2 e 3918), Pseudomonas fulva (Ca), Pseudomonas aeruginosa (FL2), Frateuria aurantia (R1) e Pseudomonas sp. (MF2 e MF4), baseando-se nas seqüências parciais da região 16S do DNA ribossomal (28).
também exerceram efeito positivo sobre a produção de biomassa radicular, produção de brotos para estaquia em minicepas de eucalipto estabelecidas em leito de areia e produtividade de minijardins clonais (número de miniestacas x porcentagem de enraizamento) (21).
Os isolados mais promissores foram testados em escala semi-operacional, em diversos viveiros florestais e inoculados em diferentes composições de substrato, obtendo incremento em biomassa radicular e da parte aérea, maior velocidade de enraizamento e controle de doenças. Nesses experimentos de rizobactérias com eucalipto (18, 20, 21, 27-29) e com outras culturas (3, 9, 15, 17, 25) utilizaram-se suspensões bacterianas, produzidas em meio de cultura. Entretanto, este tipo de inóculo é de difícil produção em grande escala, apresentando dificuldades na manipulação, no transporte, armazenamento e baixa viabilidade da suspensão bacteriana ao longo do tempo.
2. MATERIAL E MÉTODOS
2.1. Formulações
Utilizou-se oito isolados de rizobactérias em duas formulações, líquida e turfosa, preparadas pela Bio Soja Indústrias Químicas e Biológicas (São Joaquim da Barra - SP). Os isolados denominados de S1, S2 e 3918 pertencem a espécie Bacillus subtilis Cobn, 1872, o isolado Ca foi determinado como da espécie Pseudomonas fulva Lizuga & Komagata, 1963, o isolado FL2 de Pseudomonas aeruginosa (Schroeter, 1872) Migula, 1900, o isolado CIIb é da espécie Stenotrophomonas maltophilia (Hugh, 1872) Palleroni & Bradbury, 1993, o isolado R1 de Frateuria aurantia Swings et al., 1980 e os isolados MF2 e MF4 foram identificados como Pseudomonas sp. Migula, 1894 (28).
2.2. Viabilidade dos isolados de rizobactérias nas formulações líquida e turfosa
aparecimento das colônias. Para cada diluição foram realizadas cinco réplicas.
2.3. Eficiência do produto Rizolyptus® sobre o enraizamento de miniestacas e crescimento de mudas de eucalipto
Os inoculantes, nas formulações turfosa e líquida, foram aplicados diretamente e aos poucos na mistura do substrato de enraizamento, previamente homogeneizado, na proporção de 1 g (formulação turfosa) ou 1 mL (formulação líquida) por 50 mL de substrato. Este era composto de substrato agrícola Mec Plant®, vermiculita expandida fina, palha de arroz carbonizada, na proporção de 2:4:4, enriquecido com 21 g de FTE (micronutrientes em fritas), 500 g de superfosfato simples, 21 g de sulfato de amônio e 40 g de cloreto de potássio por m3. O substrato sem a adição de inoculante foi utilizado como testemunha. Miniestacas tratadas na base com ácido indolbutírico (AIB) a 6000 ppm, veiculado em talco, serviu como comparador. Os inoculantes foram testados em dois clones de eucalipto: 409 (híbrido de E. grandis x E. urophylla) e 11 (E. grandis) e as repetições em cada bandeja foram identificadas por clone e tratamento. Após o estaqueamento, as miniestacas foram mantidas em casa de enraizamento com cobertura plástica translúcida, nebulização intermitente e temperatura em torno de 30°C, por 36 dias. Após este período, as mudas foram transferidas para a aclimatação a sombra, onde receberam duas adubações, sendo a primeira aos 47 dias com solução nutritiva (5 mL/tubete), composta por macronutrientes (0,5 kg de MAP (monoamônio fosfato), 0,7 kg de cloreto de potássio, 1,5 kg de cloreto de cálcio, 1,0 kg de sulfato de magnésio por litro) e micronutrientes (50 g de ferrilene, 1,5 g de sulfato de manganês, 3 g de ácido bórico, 0,25 g de sulfato de zinco, 0,20 g de sulfato de cobre e 0,04 g de molibidato de sódio por litro de solução) e a segunda realizada aos 53 dias com solução de Ouro Verde® à base de NPK (15:15:20) (5 mL/tubete).
tubete com raiz exposta de cada avaliações dividida pelo intervalo de tempo entre elas (3 dias). Aos 60 dias avaliou-se biomassa do sistema radicular e da parte aérea.
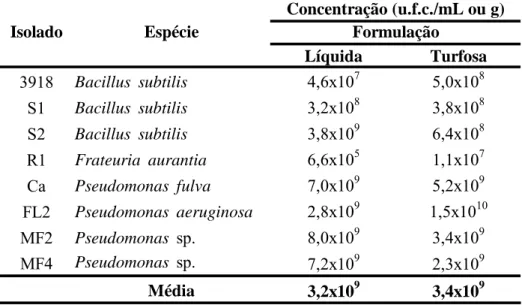
Para atestar a qualidade do inoculante e determinar concentração de bactérias por mL ou g utilizado no experimento, foi realizado a técnica de micro-gotas (24), para as duas formulações (item 2.2.) (Tabela 1).
Tabela 1. Número de unidades formadoras de colônias (u.f.c./mL ou g) dos isolados de rizobactérias veiculados nas formulações turfosa e líquida do lote de inoculante utilizado no experimento
Líquida Turfosa
3918 Bacillus subtilis 4,6x107 5,0x108 S1 Bacillus subtilis 3,2x108 3,8x108 S2 Bacillus subtilis 3,8x109 6,4x108 R1 Frateuria aurantia 6,6x105 1,1x107 Ca Pseudomonas fulva 7,0x109 5,2x109 FL2 Pseudomonas aeruginosa 2,8x109 1,5x1010 MF2 Pseudomonas sp. 8,0x109 3,4x109 MF4 Pseudomonas sp. 7,2x109 2,3x109
Média 3,2x109 3,4x109
Espécie
Concentração (u.f.c./mL ou g) Formulação
Isolado
2.4. Delineamento experimental e análises estatísticas
lateral de água na superfície da bandeja. Os blocos foram dispostos ao longo da casa de enraizamento e separados por clone e formulação. Utilizaram-se dois clones (409 e 11) e duas formulações (turfa e solução estabilizante).
Os dados foram analisados com o auxílio do pacote estatístico SAS V.8 (SAS Institute, Cary, NC, USA).
Efetuou-se análise de regressão linear dos valores de incremento de velocidade de enraizamento obtidos nas oito avaliações realizadas. Os dados ajustaram-se ao modelo monomolecular, em vista da independência de resíduos e pela correlação de Pearson, obtendo os valores de taxa de enraizamento (rv). Para testar a hipótese de semelhança entre as taxas de
enraizamento, determinada pelo incremento a cada três dias, calculou-se o intervalo de confiança (5) em relação à testemunha e ao hormônio AIB.
3. RESULTADOS
3.1. Viabilidade dos isolados de rizobactérias nas formulações líquida e turfosa
Na solução estabilizante observou-se maior viabilidade dos isolados, em média com 1x1010 u.f.c./mL, comparado aos isolados veiculados em turfa, com 6,5x109 u.f.c./g no período de 180 dias. Os isolados S1, S2 e MF2 foram mais estáveis ao longo do tempo nas duas formulações.
A viabilidade dos isolados S2, FL2 e Ca, veiculados em turfa canadense e em solução estabilizante, foi a mesma para ambas as formulações, durante o período de armazenamento. O FL2 destacou-se para as duas formulações dos demais isolados com concentração média de 3x1010 u.f.c./mL. A maior sobrevivência na formulação turfosa foi observada para o isolado MF2, com concentração bacteriana média de 1x1010 u.f.c./mL, e na formulação líquida destacaram-se os isolados S1, 3918, FL2 e MF4 contendo em torno de 1,5x1010 u.f.c./mL ao longo do tempo.
Isolado S 2 6 8 10 12 Isolado R1 6 8 10 12 Isolado FL2 6 8 10 12 Isolado MF2 6 8 10 12
0 20 40 60 80 100 120 140 160 180
Isolado MF4
6 8 10 12
0 20 40 60 80 100 120 140 160 180
Isolado Ca
6 8 10 12
Isolado S 1
6 8 10 12 Isolado 3918 6 8 10 12 C o n c e n tr aç ão (l og u .f .c ./ m L ou g)
Tempo de armaze namento (dias)
3.2. Eficiência das formulações turfosa e líquida sobre o enraizamento de miniestacas e crescimento de mudas de eucalipto
A eficiência dos isolados variaram de acordo com o tipo de formulação, clone utilizado e variável analisada.
Maior emissão de raízes (%) das miniestacas estaqueadas em substrato rizobacterizado foi observada para os dois clones.
Os isolados na formulação turfosa propiciaram maior emissão de raízes do clone 409, comparado á formulação líquida em relação a testemunha. Observou-se que todos os isolados veiculados na formulação turfosa atingiram 60% de enraizamento entre 27 e 33 dias após o estaqueamento, enquanto a testemunha somente atingiu esta porcentagem aos 36 dias, destacando-se o isolado FL2 que aos 36 dias alcançou 81% de emissão de raízes nos tubete (Figura 2). Na formulação líquida, destacaram-se os isolados S1, R1 e MF2 com maior porcentagem de emissão das raízes abaixo do tubete, em relação aos tratamentos testemunha e AIB. Para as duas formulações testadas, o tratamento com AIB aplicado na base das miniestacas obteve maior enraizamento até o 24° dia após o estaqueamento, depois deste período, o incremento de enraizamento tornou-se constante, enquanto que para os tratamentos com os isolados de rizobactéria observou-se aumento na emissão de raízes (Figura 3).
0 20 40 60 80 100
18 21 24 27 30 33 36 39
Tempo (dias)
E
m
is
são de
r
a
iz
es
(
%
)
3918 Ca FL2 MF2 MF4 R1 S1 S2 AIB Test
0 20 40 60 80 100
18 21 24 27 30 33 36 39
Tempo (dias)
E
m
is
sã
o de
r
a
iz
es
(
%
)
3918 Ca FL2 MF2 MF4 R1 S1 S2 AIB Test
0 20 40 60 80 100
18 21 24 27 30 33 36 39
Tempo (dias)
E
m
issã
o
d
e ra
iz
es
(
%
)
3918 Ca FL2 MF2 MF4 R1 S1 S2 AIB Test
Os maiores incrementos foram observados no período entre 18 a 27 dias do estaqueamento, e após este período até a última avaliação, os incrementos foram menores não diferindo dos resultados apresentados pelos isolados em relação à testemunha e o tratamento com AIB (Figuras 5, 6 e 7). Para o incremento de enraizamento entre as avaliações sobre o intervalo de tempo foi observado efeito significativo (P < 0,05) entre as formulações turfosa e líquida do clone 409 (Figuras 5 e 6). Para os tratamentos na formulação turfosa observou-se maiores incrementos no intervalo entre as avaliações realizadas nos dias 21 a 30 após o estaqueamento e menores taxas nas últimas avaliações. O incremento obtido pelo tratamento do isolado FL2 foi o maior observado entre as avaliações realizadas nos dias 24 a 27 após o estaqueamento (Figura 5). Na formulação líquida, o incremento de enraizamento do clone 409 foi maior no intervalo entre as avaliações realizadas no 21º e 24° dias após o estaqueamento para os isolados S1 e R1, respectivamente (Figura 6).
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6
18 21 24 27 30 33 36
Tempo (dias após estaqueamento)
In
cr
em
ent
o
de
enrai
zam
ent
o
3918 Ca Fl2 MF2 MF4 R1 S1 S2 Te st AIB