Anallicy Santos de Paiva
Estudo de complexos de ferro e de cobre com a base de Shiff
3-Meosalen e ligantes de relevância biológica
_______________________________________
Dissertação de Mestrado
Natal/RN, janeiro de 2015
ANALLICY SANTOS DE PAIVA
ESTUDO DE COMPLEXOS DE FERRO E DE COBRE COM A BASE DE SCHIFF 3-MEOSALEN E LIGANTES DE RELEVÂNCIA BIOLÓGICA
NATAL, RN 2015
Dissertação apresentada ao Programa de Pós-Graduação em Química, como um dos requisitos para obtenção do grau de Mestre em Química, pela Universidade Federal do Rio Grande do Norte.
Orientadora: Profa. Dra. Ana Cristina Facundo de Brito Pontes
Divisão de Serviços Técnicos Catalogação da Publicação na Fonte. UFRN
Biblioteca Setorial do Instituto de Química
Paiva, Anallicy Santos de.
Estudo de complexos de ferro e de cobre com a base de Shiff 3-Meosalen e ligantes de relevância biológica / Anallicy Santos de Paiva. - Natal, RN, 2015.
139 p.: il.
Orientador:Ana Cristina Facundo de Brito Pontes Co-orientador: Daniel de Lima Pontes
Dissertação (Mestrado em Química) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
1. Complexo de Ferro - Dissertação. 2. Base de Schiff-Dissertação. 3. Nitro-Dissertação. 4. Dietilditiocarbamato - Nitro-Dissertação. 5. Nitrosil - Nitro-Dissertação. I. Pontes, Ana Cristina Facundo de Brito. II. Pontes, Daniel de Lima. III. Universidade Federal do Rio Grande do Norte. IV. Título.
AGRADECIMENTOS
Nesses dois anos de mestrado foram momentos de muitos esforços, empenhos, aprendizados e estudo em busca de uma concretização de um sonho e um melhor almejo profissional. Gostaria de agradecer a algumas pessoas especiais que me acompanharam e contribuíram para a finalização desta pesquisa.
Primeiramente, agradeço a Deus por essa força maior que me ilumina, rege a minha vida e me faz superar cada desafio e obstáculo ao decorrer dessa caminhada. Obrigada meu Deus por tudo que sou e tenho.
Aos meus queridos pais, Maria Goretti Santos de Paiva e Arlindo Nascimento de Paiva pelo amor, carinho, motivação incondicional, repreensões e profundo apoio. E também por estar presente quando preciso, por ter confiança nas minhas escolhas e desejarem sempre o melhor pra mim. A minha linda irmã, Amanda Santos de Paiva, por está sempre disposta a me ajudar, ter paciência comigo e estímulos para superar os desafios. A todos meus bichinhos de estimação que sempre me deram momentos de alegria e descontração.
A toda minha família que sempre torcem pelas minhas conquistas e me incentivam para lutar pelos meus sonhos. A minha vó, Maria da Dores que nos deixou a quase dois anos que tem olhado por mim e contribuiu totalmente para as realizações da minha vida.
Ao Prof. Dr. Daniel de Lima Pontes que me abriu as portas e me deu a oportunidade de participar do grupo de pesquisa LQCPol, mesmo sem me conhecer direito. Só tenho que agradecer pelos ensinamentos, dedicação, paciência e está sempre disposto a tirar as dúvidas e as inquietações da pesquisa e por compartilhar o seu conhecimento e experiência. Todo crescimento pessoal e profissional adquirido por mim e este trabalho não seria possível sem sua presença. Muito obrigada!!!!
A Profa. Dra. Ana Cristina pelo seu carinho, atenção e suas contribuições e alterações mais que necessárias para a melhoria do meu trabalho. Ao Prof. Dr. Francisco Ordelei pelos esclarecimentos sobre as minhas dúvidas acerca do óxido nítrico. Ao Prof. Dr. Ótom Anselmo de Oliveira pela sua disposição em me ajudar no que eu precisar e pelas sugestões e modificações no meu trabalho.
minha adaptação no laboratório, aprendi demais com nossas convivências diárias e com as trocas de experiências.
A todos meus amigos, principalmente as minhas amigas Isabel, Janiele e Luana Márcia pelos incentivos que tudo daria certo durante as incertezas percorridas pelo caminho e pela amizade adquirida e fortalecida durante esses anos.
A profa. Dra. Grazielle Malcher e prof. Luiz Seixas pelos incentivos e pelos conselhos desde os meus primeiros passos na vida acadêmica.
À central analítica, na pessoa do técnico Joadir e a todos do Instituto de Química da Universidade Federal do Rio Grande do Norte que contribuíram para a realização deste trabalho.
RESUMO
O objetivo estabelecido para este trabalho foi sintetizar e caracterizar novos complexos de ferro e de cobre com a base de Schiff 3-MeOsalen e ligantes de relevância
biológica, cujas fórmulas são [Fe(3-MeOsalen)NO2], [Fe(3-MeOsalen)(etil2-dtc)],
[Fe(3-MeOsalen)NO] e Na[Cu(3-MeOsalen)NO2]. Os compostos foram caracterizados
através da espectroscopia vibracional na região do infravermelho (IV) e da espectroscopia eletrônica na região do ultravioleta e visível (Uv-Vis). A partir das análises dos espectros de infravermelho, comprovou-se a formação dos complexos precursores, evidenciada pelas alterações nas frequências de vibração (C=N) e (C-O) e pelo surgimento de modos vibracionais metal-oxigênio e metal-nitrogênio. Para os nitro complexos de ferro e cobre observaram-se (NO2)ass em torno de 1300 cm-1 e (NO2)sim em 1271 cm-1, indicando que a
coordenação se faz via átomo de nitrogênio. O espectro do complexo [Fe(3-MeOsalen)(etil2-dtc)] exibiu duas bandas, o (C-NR2) em 1508 cm-1 e (C-S) em
997 cm-1, pertinentes a modos vibracionais de coordenação do ligante na forma bidentada. Para o complexo [Fe(3-MeOsalen)NO] foi observado uma nova banda intensa em 1670 cm-1 referente ao (NO). Com os espectros eletrônicos, a formação dos complexos foi evidenciada pelos deslocamentos das bandas de transições intraligantes e pelo surgimento de novas
bandas, como a LMCT (p Cl- d* Fe3+) no [Fe(3-MeOsalen)Cl] e a d-d no [Cu(3-MeOsalen)H2O]. Já para o [Fe(3-MeOsalen)NO2], destacou-se a ausência da banda
LMCT presente no complexo precursor enquanto para o Na[Cu(3-MeOsalen)NO2]
constatou-se o deslocamento hipsocrômico da banda d-d em 28 nm. O espectro eletrônico do [Fe(3-MeOsalen)(etil2-dtc)] apresentou deslocamentos da banda LMCT e alterações nas
transições intraligantes. No que se refere ao [Fe(3-MeOsalen)NO], evidenciou-se transições intraligantes em regiões mais energéticas, proveniente do forte caráter π receptor do NO e uma banda MLCT, da transição dπFe(II)π*(NO).
ABSTRACT
The goal set for this work was to synthesize and to characterize new iron and copper complexes with the Schiff base 3-MeOsalen and ligands of biological relevance, whose
formulas are [Fe(3-MeOsalen)NO2], [Fe(3-MeOsalen)(etil2-dtc)], [Fe(3-MeOsalen)NO] and
Na[Cu(3-MeOsalen)NO2]. The compounds were characterized by vibrational spectroscopy
in the infrared region (IV) and Electronic spectroscopy in the ultraviolet and visible region (Uv-Vis). From the analysis of infrared spectra, they proved to formation of precursor complexes, as evidenced by changes in the vibrationals frequencies (C=N) e (C-O) and the emergence of vibrationals modes metal-oxygen and metal-nitrogen. For nitro complexes of iron and copper were observed (NO2)ass around 1300 cm-1 e (NO2)sim in 1271 cm-1,
indicating that the coordination is done via the nitrogen atom. The complex spectrum [Fe(3-MeOsalen)(etil2-dtc)] exhibited two bands, the (C-NR2) in 1508 cm-1 e (C-S) in
997 cm-1, the relevant vibrational modes of coordinating ligand in the bidentate form. For the complex [Fe(3-MeOsalen)NO] was observed a new intense band in 1670 cm-1 related to the (NO). With the electronic spectra, the formation of complexes was evidenced by shifts of
bands intraligands transitions and the emergence of new bands such as LMCT (p Cl- d* Fe3+)in [Fe(3-MeOsalen)Cl] and the d-d in [Cu(3-MeOsalen)H2O]. As for the
[Fe(3-MeOsalen)NO2] has highlighted the absence of LMCT band present in the precursor
complex as for the [Cu(3-MeOsalen)NO2] found that the displacement of the band
hipsocrômico d-d on 28 nm. The electronic spectrum of [Fe(3-MeOsalen)(etil2-dtc)] presented
LMCT band shifts and changes in intraligantes transitions. With regard to [Fe(3-MeOsalen)NO], revealed a more energetic transitions intraligands regions from the
strong character π receiver NO and MLCT band of transition dπFe(II)π*(NO).
LISTA DE FIGURAS
Figura 1 - Reação representativa da obtenção de uma base de Schiff... 25
Figura 2 - Bases de Schiff: (a) natural, (b) semi-sintética e (c) sintética... 26
Figura 3 - Estrutura Química do (E)-4-cloro-2-((4-fluorobenzilimino)-metil)fenol. 26 Figura 4 - Estrutura química do ligante salen... 27
Figura 5 - Ligantes salen e derivados tetrahidrosalen... 27
Figura 6 - Derivados do ligante salen... 28
Figura 7 - Estrutura química do 3-MeOsalen... 29
Figura 8 - Base de Schiff derivados da Orto-vanilina... 29
Figura 9 - Estrutura química da (a) o-vanilina e (b) vanilina... 30
Figura 10 - Dados cristalográficos para a orto-vanilina com comprimentos de ligação expressos em Å... 31
Figura 11 - Figura 11 - Série de complexos de Pt(II) com etilienodiamina com 1,2-bis(piridil)etano com subunidades como (a) naftataleno, (b) antraceno ou (c) fenazina... 32
Figura 12 - Estrutura química [Cd(C7H4N2O2)(C8H6O2)2]·2H2O... 33
Figura 13 - Estrutura química do íon complexo [Cr(salen)(H2O)2]+... 33
Figura 14 - Estrutura química dos compostos (a) 3-MeOsalen (b) [Ni(3-MeOsalen)] e (c) [Ni(3-MeOsalen)Sm(NO3)3]... 34
Figura 15 - Representação da (a) hemoglobina e (b) grupo heme... 35
Figura 16 - Estrutura química dos complexos: (a) [Fe(salen)Cl], (b) [Fe(salen)Cl]2 e (c) [( -O){Fe(salen)}2]... 36
Figura 17 - Estrutura química do [Fe(5-PPh3ClMesalen)Cl]... 37
Figura 18 - Estrutura química dos (a)[Fe(salen)], (b)[Fe(3-OHsalen)], (c)[Fe(4-OHsalen)] e (d)[Fe(5-OHsalen)]... 38
Figura 19 - Estrutura química dos derivados do [Fe(salen)Cl] com diferentes diaminas... 38
Figura 20 - Estrutura química dos ligantes nitrogenados... 39
Figura 21 - Estrutura química do íon complexo [Cu(phen)2]2+... 41
Figura 22 - Estrutura química do complexo [Cu(3-MeOsalen)H2O]... 42
Figura 23 - Síntese do complexo de [Cusalen] modificado... 42
Figura 25 - Modos de coordenação nitro e nitrito do complexo
[Ni(en)2(NO2)2]... 44
Figura 26 - Estrutura química dos complexos (a) [Ni(diMeen)2(NO2)2] e o (b) [Ni(adiMeen)2(ONO)2] ... 45
Figura 27 - Sistema reacional do complexo [Ru(salen)(PPh3)(NO2)]... 46
Figura 28 - Estrutura química simplificada do íon ditiocarbamato... 46
Figura 29 - Reação geral de síntese do íon ditiocarbamato... 46
Figura 30 - Estruturas de ressonância para o ânion ditiocarbamato... 47
Figura 31 - Modos de coordenação do ligante ditiocarbamato ao centro metálico... 47
Figura 32 - Estrutura química dos complexos de Sn (IV), onde R= -CH3, -C2H5 e CH2=CH2... 48
Figura 33 - Estrutura química generalizada do [Fe(R2-dtc)3]... 48
Figura 34 - Síntese representativa do óxido nítrico... 49
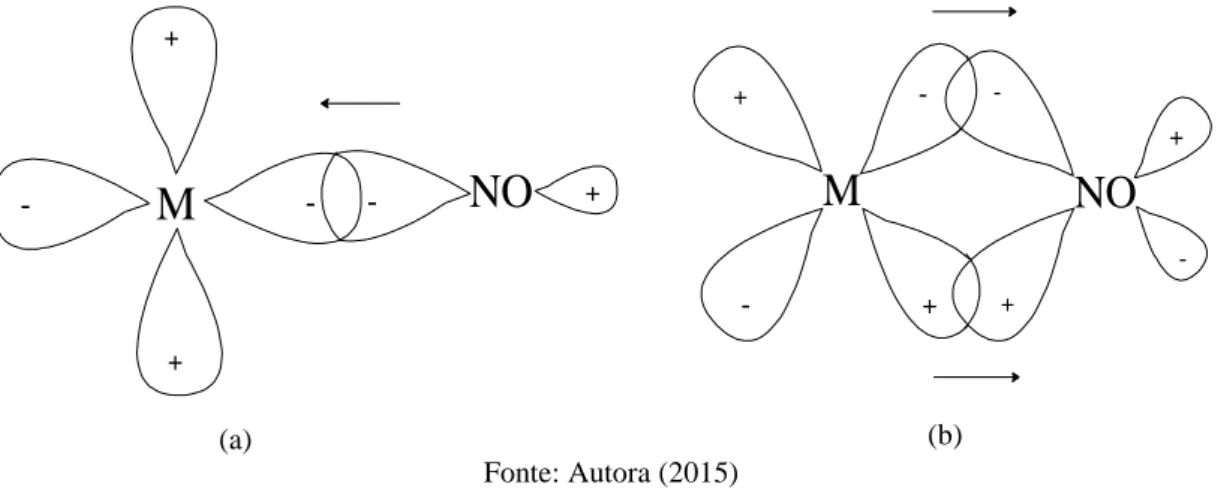
Figura 35 - Diagrama de orbital molecular do NO... 50
Figura 36 - Representação dos orbitais moleculares entre a ligação metal e NO envolvendo as interações (a) d -3 (b) dπ-2π*... 51
Figura 37 - Modos de coordenação do NO a centros metálicos: (a) linear; (b) angular e (c) ponte... 51
Figura 38 - Estrutura química do Íon nitroprussiato... 52
Figura 39 - Reação fotoquímica da solução aquosa do trans-[Ru(NH3)4LNO]3+... 52
Figura 40 - Estrutura química do íon complexo [Ru(terpy)(bdq)NO]3+... 53
Figura 41 - Estruturas químicas de complexos nitrosilos pentacoordenados de ferro (II) com ligantes macrocíclicos... 53
Figura 42 - Reação de síntese do ligante 3-MeOsalen... 55
Figura 43 - Rota sintética para os complexos sintetizados... 56
Figura 44 - Estrutura proposta do complexo precursor [Fe(3-MeOsalen)Cl]... 57
Figura 45 - Estrutura proposta do complexo [Fe(3-MeOsalen)NO2]... 57
Figura 46 - Estrutura proposta do complexo [Fe(3-MeOsalen)(etil2-dtc)]... 58
Figura 47 - Estrutura proposta do complexo [Fe(3-MeOsalen)NO]... 59
Figura 48 - Estrutura proposta do complexo [Cu(3-MeOsalen)H2O]... 59
Figura 49 - Estrutura proposta do íon complexo [Cu(3-MeOsalen)NO2]-... 60
Figura 51 - Espectro de infravermelho da orto-vanilina na região de 4000 a 400 cm-1 em KBr... 63 Figura 52 - Espectro de infravermelho da orto-vanilina na região de 1800 a
400 cm-1 em KBr... 65 Figura 53 - Espectro de infravermelho do 3-MeOsalen na região de 4000 a 400 cm
-1 em KBr... 66
Figura 54 - Ligação de hidrogênio intramolecular da base de Schiff 3-MeOsalen... 67 Figura 55 - Espectro de infravermelho do 3-MeOsalen na região de 1700 a 600 cm
-1 em KBr... 68
Figura 56 - Espectro de infravermelho do [Fe(3-MeOsalen)Cl] na região de 4000 a 400 cm-1 em KBr... 69 Figura 57 - Espectro de infravermelho do [Fe(3-MeOsalen)Cl] na região de 1700 a
900 cm-1 em KBr... 70
Figura 58 - Espectro de infravermelho do [Fe(3-MeOsalen)Cl] na região de 900 a 400 cm-1 em KBr... 71
Figura 59 - Espectro de infravermelho do [Fe(3-MeOsalen)NO2] na região de 4000
a 400 cm-1 em KBr... 72 Figura 60 - Espectro de infravermelho do [Fe(3-MeOsalen)NO2] na região de 1700
a 700 cm-1 em KBr... 73 Figura 61 - Sobreposição dos espectros de infravermelho do [Fe(3-MeOsalen)Cl] e
[Fe(3-MeOsalen)NO2], em preto e vermelho, respectivamente, (a) na
região de 1380 - 1170 cm-1 (b) na região de 900 - 700 cm
-1... 74
Figura 62 - Espectro de infravermelho do [Fe(3-MeOsalen)(etil2-dtc)] na região de
4000 a 400 cm-1 em KBr... 75 Figura 63 - Espectro de infravermelho do [Fe(3-MeOsalen)(etil2-dtc)] na região de
1700 a 700 cm-1 em KBr... 76
Figura 64 - Sobreposição de infravermelho do [Fe(3-MeOsalen)Cl] e [Fe(3-MeOsalen)(etil2-dtc)], em preto e vermelho, respectivamente, (a)
Figura 66 - Espectro de infravermelho do [Fe(3-MeOsalen)NO] na região de 4000 a 400 cm-1 em KBr... 78
Figura 67 - Sobreposição dos espectros de infravermelho do [Fe(3-MeOsalen)Cl] e [Fe(3-MeOsalen)NO], em preto e vermelho, respectivamente na região
de 1750 a 1120 cm-1... 79 Figura 68 - Representação dos orbitais moleculares para complexos [FeNO] com
ligação angular... 81 Figura 69 - Espectro de infravermelho do [Cu(3-MeOsalen)H2O] na região de
4000 a 400 cm-1 em KBr... 85 Figura 70 - Espectro de infravermelho do [Cu(3-MeOsalen)H2O] na região de
1700 a 400 cm-1 em KBr... 86 Figura 71 - Espectro de infravermelho do Na[Cu(3-MeOsalen)NO2] na região de
4000 a 400 cm-1 em KBr... 87
Figura 72 - Espectro de infravermelho do Na[Cu(3-MeOsalen)NO2] na região de
1400 a 1000 cm-1 em KBr... 88
Figura 73 - Espectro eletrônico em metanol da orto-vanilina... 90 Figura 74 - Sobreposição dos espectros eletrônicos da orto-vanilina em diferentes
solventes. O espectro em DMF foi mostrado a partir de 256 nm devido a absorção eletrônica do solvente em comprimentos de onda inferiores a 256nm... 92 Figura 75 - Sobreposição dos espectros eletrônicos em meio aquoso da
orto-vanilina com a variação do pH no intervalo de 2,36 a 10,07 no comprimento de onda de 200 a 500 nm... 93 Figura 76 - Sobreposição dos espectros eletrônicos da orto-vanilina (preto) no pH
2,36 e do íon orto-vanilínico (vermelho), no pH 10... 94 Figura 77 - Estrutura das espécies envolvidas na equação de equilíbrio ácido-base
da orto-vanilina... 94 Figura 78 - Gráficos do pH em função da absorbância correspondente ao
comprimento de onda. (a) Acompanhamento em = 216nm, (b)
Figura 80 - Sobreposição dos espectros eletrônicos do 3-MeOsalen em solventes diferentes... 99 Figura 81 - Sobreposição dos espectros eletrônicos da orto-vanilina e 3-MeOsalen
obtidos em metanol representados em preto e vermelho,
respectivamente... 100 Figura 82 - Espectro eletrônico em metanol do [Fe(3-MeOsalen)Cl]... 101 Figura 83 - Sobreposição dos espectros eletrônicos em metanol do 3-MeOsalen e
do [Fe(3-MeOsalen)Cl] em preto e vermelho, respectivamente... 102 Figura 84 - Sobreposição dos espectros eletrônicos do [Fe(3-MeOsalen)Cl] em
solventes diferentes... 103 Figura 85 - Acompanhamento da redução do [Fe(3-MeOsalen)Cl] com amálgama
de zinco em metanol... 104 Figura 86 - Tabela de caracteres do grupo Cs... 105
Figura 87 - Desdobramentos dos orbitais para o campo para complexos piramidal quadrada com configuração d5 de spin alto... 105
Figura 88 - Estrutura da geometria piramidal quadrada... 106 Figura 89 - Sobreposição dos espectros eletrônicos em meio aquoso do
[Fe(3-MeOsalen)Cl] com a variação do pH no intervalo de 2,24 a 8,4 no comprimento de onda de 200 a 800 nm... 107 Figura 90 - Gráfico do pH em função da absorbância correspondente ao
comprimento de onda do acompanhamento em = 398 nm... 108 Figura 91 - Espectro eletrônico em metanol do [Fe(3-MeOsalen)NO2]... 108
Figura 92 - Sobreposição dos espectros eletrônicos do [Fe(3-MeOsalen)Cl] e [Fe(3-MeOsalen)NO2] obtidos em metanol representados em preto e
vermelho, respectivamente... 109 Figura 93 - Sobreposição dos espectros eletrônicos do [Fe(3-MeOsalen)NO2] em
solventes diferentes... 110 Figura 94 - Espectro eletrônico do [Fe(3-MeOsalen)(etil2-dtc)] em metanol... 111
Figura 95 - Sobreposição dos espectros eletrônicos do [Fe(3-MeOsalen)Cl], etil2
-dtc e [Fe(3-MeOsalen)(etil2-dtc)] obtidos em metanol representados em
preto, vermelho e verde, respectivamente... 112 Figura 96 - Sobreposição dos espectros eletrônicos do [Fe(3-MeOsalen)(etil2-dtc)]
Figura 97 - Acompanhamento da redução do complexo [Fe(3-MeOsalen)(etil2-dtc)] em metanol com amálgama de zinco... 114
Figura 98 - Sobreposição dos espetros eletrônicos do complexo [Fe(3-MeOsalen)(etil2-dtc)] antes e depois da redução em metanol com
amálgama de zinco, nas cores preta e vermelha respectivamente... 115 Figura 99 - Diagrama de Tanabe-Sugano para configuração d5... 116 Figura 100 - Espectro eletrônico em metanol do [Fe(3-MeOsalen)NO]... 116 Figura 101 - Sobreposição dos espectros eletrônicos do 3-MeOsalen, do
[Fe(3-MeOsalen)Cl] e [Fe(3-MeOsalen)NO] obtidos em metanol representados em preto, vermelho e verde, respectivamente... 118 Figura 102 - Espectro eletrônico em metanol do [Cu(3-MeOsalen)H2O] em metanol
a 2,5.10-5 molL-1 e a expansão em 8.10-4 molL-1... 119 Figura 103 - Sobreposição dos espectros eletrônicos do 3-MeOsalen e do
[Cu(3-MeOsalen)H2O] obtidos em metanol representados em preto e
vermelho, respectivamente... 120 Figura 104 - Sobreposição dos espectros eletrônicos do [Cu(3-MeOsalen)H2O] em
solventes diferentes... 121 Figura 105 - Desdobramentos dos orbitais para o campo para complexos piramidal
quadrada com configuração d9... 122 Figura 106 - Espectro eletrônico em metanol do Na[Cu(3-MeOsalen)NO2] a 3.10-5
molL-1 e a expansão em 8.10-4 molL-1... 123 Figura 107 - Sobreposição dos espectros eletrônicos do [Cu(3-MeOsalen)H2O] e
Na[Cu(3-MeOsalen)NO2] obtidos em metanol representados em preto
e vermelho, respectivamente... 124 Figura 108 - Sobreposição dos espectros eletrônicos do Na[Cu(3-MeOsalen)NO2]
LISTA DE TABELAS
Tabela 1 - Valores de IC50 para os derivados de [Fe(salen)Cl] para células MCF7.... 40
Tabela 2 - Reagentes e solventes utilizados no procedimento experimental... 54 Tabela 3 - Atribuições das principais bandas presentes no espectro de
infravermelho da orto-vanilina... 65 Tabela 4 - Dados comparativos entre as frequências de estiramento N-O e
spin... 81 Tabela 5 - Atribuições dos modos vibracionais presentes no espectro de
infravermelho do 3-MeOsalen e [Fe(3-MeOsalen)L1], onde L1= Cl-,
NO2-, etil2-dtc- e NO... 82
Tabela 6 - Atribuições das frequências de (C=N) dos complexos sintetizados... 83 Tabela 7 - Atribuições das principais bandas presentes no espectro de
infravermelho do ligante 3-MeOsalen e complexos [Cu(3-MeOsalen)H2O] e Na[Cu(3-MeOsalen)NO2]... 89
Tabela 8 - Atribuição das transições eletrônicas e absortividades molares das bandas presentes no espectro eletrônico da orto-vanilina em metanol... 91 Tabela 9 - Comparativo entre as bandas de absorção da orto-vanilina em solventes
diferentes... 92 Tabela 10 - Valores de pka obtidos para a orto-vanilina com acompanhamento em
diferentes comprimentos de onda... 96 Tabela 11 - Atribuição das transições eletrônicas e absortividades molares das
bandas presentes no espectro eletrônico do 3-MeOsalen em metanol... 97 Tabela 12 - Comparativo entre as bandas de absorção do 3-MeOsalen em solventes
diferentes... 99 Tabela 13 - Comparativo entre as bandas de absorção da orto-vanilina e 3-MeOsalen
em metanol... 100 Tabela 14 - Atribuição das transições eletrônicas e absortividades molares das
bandas presentes no espectro eletrônico do complexo
[Fe(3-MeOsalen)Cl] em metanol... 101 Tabela 15 - Comparativo entre as bandas de absorção do [Fe(3-MeOsalen)Cl] em
Tabela 16 - Atribuição das transições eletrônicas e absortividades molares das
bandas presentes no espectro eletrônico do complexo
[Fe(3-MeOsalen)NO2] em metanol... 109
Tabela 17 - Comparativo entre as bandas de absorção do [Fe(3-MeOsalen)NO2] em
solventes diferentes... 110 Tabela 18 - Atribuição das transições eletrônicas e absortividades molares das
bandas presentes no espectro eletrônico do complexo
[Fe(3-MeOsalen)(etil2-dtc)] em metanol... 111
Tabela 19 - Comparativo entre as bandas de absorção do [Fe(3-MeOsalen)Cl] e o [Fe(3-MeOsalen)(etil2-dtc)]... 113
Tabela 20 - Comparativo entre as bandas de absorção do [Fe(3-MeOsalen)(etil2-dtc)]
em solventes diferentes... 114 Tabela 21 - Atribuição das transições eletrônicas e absortividades molares das
bandas presentes no espectro eletrônico do complexo
[Fe(3-MeOsalen)NO] em metanol... 117 Tabela 22 - Atribuição das transições eletrônicas e absortividades molares das
bandas presentes no espectro eletrônico do complexo
[Cu(3-MeOsalen)H2O] em metanol... 119
Tabela 23 - Comparativo entre as bandas de absorção do [Cu(3-MeOsalen)H2O] em
solventes diferentes... 121 Tabela 24 - Atribuição das transições eletrônicas e absortividades molares das
bandas presentes no espectro eletrônico do complexo
Na[Cu(3-MeOsalen)NO2] em metanol... 123
Tabela 25 - Comparativo entre as bandas de absorção do Na[Cu(3-MeOsalen)NO2]
LISTA DE ABREVIAÇÕES
3-MeOsalen N,N’-etilenobis(3-Metoxisalicilidenoimina) 3-MeOsalnaphen N,N’naftalenobis(3-Metoxisalicilidenoimina) 3-MeOsalphen N,N’fenilenobis(3-Metoxisalicilidenoimina) 3-OHsalen N,N’-etilenobis(3-Hidroxisalicilidenoimina) 3-OHsalnaphen N,N’naftalenobis(3-Hidroxisalicilidenoimina) 3-OHsalphen N,N’fenilenobis(3-hidroxisalicilidenoimina) 4-MeOsalen N,N’-etilenobis(4-Metoxisalicilidenoimina) 4-MeOsalnaphen N,N’naftalenobis(4-Metoxisalicilidenoimina) 4-MeOsalphen N,N’fenilenobis(4-Metoxisalicilidenoimina) 4-OHsalen N,N’-etilenobis(4-Hidroxisalicilidenoimina) 4-OHsalnaphen N,N’naftalenobis(4-Hidroxisalicilidenoimina) 4-OHsalphen N,N’fenilenobis(4-hidroxisalicilidenoimina) 5-MeOsalen N,N’-etilenobis(5-Metoxisalicilidenoimina) 5-MeOsalnaphen N,N’naftalenobis(5-Metoxisalicilidenoimina) 5-MeOsalphen N,N’fenilenobis(5-Metoxisalicilidenoimina) 5-OHsalen N,N’-etilenobis(5-Hidroxisalicilidenoimina) 5-OHsalnaphen N,N’naftalenobis(5-Hidroxisalicilidenoimina) 5-OHsalphen N,N’fenilenobis(5-hidroxisalicilidenoimina)
5-PPh3ClMesalen N,N’-etilenobis(5-(triphenyl phosphoniummethylsalicilidenoimina)
Ar Aromático
diMeen N,N dimetiletilenodiamina
DMF Dimetilformamida
DMSO Dimetilsulfóxido
dppe Bis(difenilfosfino)etano
en Etilenodiamina
etil2-dtc Dietilditiocarbamato
Hatz 1H-tetrazol-5-amina
Hbimz 1H-benzimidazol
Hbtriz 1H-benzotriazol
Himz 1H-imidazol
Hmtz 5-methyl-1H-tetrazol
im Imina
IV Espectroscopia Vibracional na Região do Infravermelho
OEP Octaetilporfirina
phen 1,10-Fenantrolina
PPh3 Trifenilfosfina
PPNNO2 Nitrito de bis(trifenilfosfina)iminio
salen N,N’etilenobis(salicilidenoimina)
Salnaphen N,N’naftalenobis(salicilidenoimina)
salphen N,N’fenilenobis(salicilidenoimina)
Tch Tiocarboidrazida
Terp Terpiridina, 2,6-bis(2-piridil)piridina
TPP 5,10,15,20-Tetrafenilporfirina
LISTA DE SIGLAS
hCA Isoformo humano da enzima de anidrase carbônica
IC50 Concentração Inibitória para 50% das células
IUPAC União Internacional de Química Pura e Aplicada
LMCT Transferência de Carga do Ligante para o Metal
MCF10A Mama humano não-tumogênica
MCF7 Adenocarcinoma de mama humano
MDA MB 231 Câncer de mama metastático humano
MGTase Transcrição da metilação O-metil-guanina-DNA metiltransferase
MLCT Transferência de Carga do Metal para o Ligante
MNU N-metil-N-nitrosoureia
MTT Brometo de 3-(4,5- dimetiltiazol-2-il)-2,5-difeniltetrazólio
LISTA DE SÍMBOLOS
Comprimento de onda
E Identidade
h Plano de reflexão horizontal
Estiramento
δ Deformação angular no plano
Deformação angular fora do plano
ρ Deformação angular assimétrica no plano
Deformação angular assimétrica fora do plano
SUMÁRIO
1 INTRODUÇÃO... 22
2 OBJETIVOS... 24
2.1 OBJETIVO GERAL... 24
2.2 OBJETIVOS ESPECÍFICOS... 24
3 REVISÃO BIBLIOGRÁFICA... 25
3.1 BASES DE SCHIFF... 25
3.2 PRECURSORES DA BASE DE SCHIFF 3-MEOSALEN... 30
3.2.1 Orto-vanilina... 30
3.2.2 Etilenodiamina... 31
3.3 COMPOSTOS DE COORDENAÇÃO COM BASE DE SCHIFF... 32
3.4 ALGUNS ASPECTOS SOBRE O ELEMENTO QUÍMICO FERRO... 34
3.4.1 Complexos de ferro com bases de Schiff... 35
3.5 ALGUNS ASPECTOS SOBRE O ELEMENTO QUÍMICO COBRE... 41
3.5.1 Complexos de cobre com base de Schiff... 41
3.6 ASPECTOS GERAIS DA QÚIMCA DE COORDENAÇÃO DO ÍON NITRITO. ... 43
3.7 ASPECTOS GERAIS DA QUÍMICA DE COORDENAÇÃO DO ÍON DITIOCARBAMATO... 46
3.8 ASPECTOS GERAIS DA QUÍMICA DE COORDENAÇÃO DO ÓXIDO NÍTRICO... 49
4 PARTE EXPERIMENTAL... 54
4.1 REAGENTES UTILIZADOS... 54
4.2 PROCEDIMENTO DE SÍNTESE DO LIGANTE 3-MEOSALEN... 55
4.2.1 Síntese do ligante 3-MeOsalen... 55
4.3 ROTA SINTÉTICA DOS COMPLEXOS DE BASE DE SCHIFF 3-MEOSALEN... 55
4.4 PROCEDIMENTOS DE SÍNTESES DOS COMPLEXOS DE FERRO... 56
4.4.1 Síntese do complexo precursor [Fe(3-MeOsalen)Cl]... 56
4.4.2 Síntese do complexo [Fe(3-MeOsalen)NO2]... 57
4.4.3 Síntese do complexo [Fe(3-MeOsalen)(etil2-dtc)]... 58
4.5 PROCEDIMENTOS DE SÍNTESES DOS COMPLEXOS DE COBRE... 59
4.5.1 Síntese do complexo precursor [Cu(3-MeOsalen)H2O]... 59
4.5.2 Síntese do complexo Na[Cu(3-MeOsalen)NO2]... 60
4.6 SISTEMA DE BORBULHAMENTO DE NO(g)... 60
4.7 PREPARAÇÃO DA AMÁLGAMA DE ZINCO... 61 4.8 MÉTODOS DE CARACTERIZAÇÃO... 61
4.8.1 Espectroscopia vibracional na região do infravermelho... 61
4.8.2 Espectroscopia eletrônica na região do ultravioleta e visível (UV-Vis).... 62
4.8.2.1 Procedimento utilizado na obtenção dos espectros por espectroscopia eletrônica... 62
4.8.2.1.1 Monitoramento da variação do pH da orto-vanilina e
[Fe(3-MeOsalen)Cl] via espectroscopia eletrônica... 62
4.8.2.1.2 Monitoramento da redução de compostos em estudo via espectroscopia
eletrônica... 62
5 RESULTADOS E DISCUSSÃO... 63
5.1 ESPECTROSCOPIA VIBRACIONAL NA REGIÃO DO
INFRAVERMELHO... 63
5.1.1 Espectro de infravermelho da orto-vanilina... 63
5.1.2 Espectro de infravermelho do ligante 3-MeOsalen... 66
5.1.3 Espectro de infravermelho do complexo [Fe(3-MeOsalen)Cl]... 69
5.1.4 Espectro de infravermelho do complexo [Fe(3-MeOsalen)NO2]... 72
5.1.5 Espectro de infravermelho do complexo [Fe(3-MeOsalen)(etil2-dtc)]... 75
5.1.6 Espectro de infravermelho do complexo [Fe(3-MeOsalen)NO]... 78
5.1.7 Comparações dos espectros vibracionais para os complexos de
[Fe(3-MeOsalen)L1], L1=Cl-, NO
2-, NO e etil2-dtc-... 83
5.1.8 Espectro de infravermelho do complexo [Cu(3-MeOsalen)H2O]... 85
5.1.9 Espectro de infravermelho do complexo Na[Cu(3-MeOsalen)NO2]... 87
5.2 ESPECTROSCOPIA DE ABSORÇÃO NA REGIÃO DO
ULTRAVIOLETA E VISÍVEL (UV-VIS)... 90
5.2.1 Espectro eletrônico da orto-vanilina... 90
5.2.1.1 Estudo do pKa da orto-vanilina... 92
5.2.2 Espectro eletrônico do ligante 3-MeOsalen... 96
5.2.3.1 Estudo do pka do Complexo [Fe(3-MeOsalen)Cl]... 106
5.2.4 Espectro eletrônico do complexo [Fe(3-MeOsalen)NO2]... 108
5.2.5 Espectro eletrônico do Complexo [Fe(3-MeOsalen)(etil2-dtc)]... 111
5.2.6 Espectro eletrônico do complexo [Fe(3-MeOsalen)NO]... 116
5.2.7 Espectro eletrônico do complexo [Cu(3-MeOsalen)H2O]... 118
5.2.8 Espectro eletrônico do complexo Na[Cu(3-MeOsale)(NO2)]... 122
6 CONCLUSÃO... 126
REFERÊNCIA... 129
1 INTRODUÇÃO
Muitos compostos de coordenação são utilizados ou são classificados como substâncias com elevado potencial terapêutico, fato que pode ser evidenciado pelo desenvolvimento e identificação de novas metalodrogas bioativas e pela elucidação do seu envolvimento em reações catalíticas biomiméticas (BOERNER; ZALESKI, 2005; ZHANG; LIPPARD, 2003).
Dentre os compostos de coordenação de grande destaque na química bioinorgânica podem ser citados a cisplatina (cis-[Pt(NH3)2Cl2]), que promove a morte de células
cancerígenas a partir de sua interação com o DNA (BOERNER; ZALESKI, 2005) e o nitroprussiato de sódio (Na2[Fe(CN)5NO]), utilizado no tratamento de doenças
cardiovasculares (BONAVENTURA et al., 2008).
Desta forma, a interação de centros metálicos e ligantes tem se mostrado uma importante área de estudo, em que tanto as características químicas do metal quanto a dos ligantes podem ser modulados de forma a se obter compostos que apresentem as propriedades de interesse.
Entre os ligantes constituintes dos compostos de coordenação, as bases de Schiff têm aplicações bastante amplas e de grande importância, por originar complexos estáveis com diversos metais em estados de oxidação variados (COZZI, 2004). Os complexos da base de Schiff salen e derivados são amplamente estudados devido às suas importantes aplicações como catalisadores em reações de oxidação, redução e polimerização (GHAFFARI et al., 2014; SALOMÃO et al., 2007), estudos também relatam atividades biológicas relacionadas à morte celular em tumores malignos (WOLDEMARIAM; MANDAL, 2008; LEE et al., 2011; ANSARI et al., 2009), bem como a clivagem e interações com DNA (ROUTIER et al., 1999; DEHKORDI; LINCOLN, 2013).
Buscando desenvolver compostos de coordenação que possam apresentar atividades biológicas relevantes, neste trabalho foram sintetizados e caracterizados complexos de ferro e de cobre, tendo a base de Schiff 3-MeOsalen como ligante principal, possuindo ainda na esfera de coordenação do metal as espécies bioativas nitrito, dietilditiocarbamato ou óxido nítrico como ligantes auxiliares.
com íon nitrito e base de Schiff que produzem NO quando na presença de reagentes tais como PPNNO2, NaNO2 e AgNO2 em acetonitrila.
Em várias pesquisas da área medicinal tem sido observado que ditiocarbamatos atuam como agentes antitumorais e bactericidas. Güzel; Salman (2006) relataram estudos com os ésteres de ditiocarbamato que apresentaram atividade in vitro contra bactérias do gênero
Mycobacterium da tuberculose.
Em estudos realizados por Siddiqi et al. (2007) verificaram-se que complexos de metais de transição com grupos ditiocarbamatos, tais como Sn(tch)2{M2(etil2-dtc)4}, tch=
tiocarboidrazida, etil2-dtc= dietilditiocarbamato e M= Mn (II), Fe(II), Co (II), Ni(II) e Cu (II),
apresentam eficácia farmacológica contra bactérias do tipo Escherichia coli e Salmonella
typhi.
2 OBJETIVOS
2.1 OBJETIVO GERAL
O presente trabalho tem como objetivo sintetizar e estudar as características espectroscópicas de novos complexos metálicos de ferro e de cobre tendo como ligante
principal a base de Schiff N,N’etilenobis(3-Metoxisalicilidenoimina), identificada como 3-MeOsalen, e ainda a coordenação de ligantes em posições axiais como o íon nitrito, dietilditiocarbamato e óxido nítrico.
2.2 OBJETIVOS ESPECÍFICOS
• Sintetizar a base de Schiff 3-MeOsalen, a partir da orto-vanilina e etilenodiamina.
• Sintetizar complexos mononucleares de Fe (III) e de Cu (II) com a base de Schiff 3-MeOsalen.
• Sintetizar novos complexos mononucleares de ferro com a base de Schiff 3-MeOsalen coordenados a íon nitrito, dietilditiocarbamato ou óxido nítrico.
• Sintetizar novos complexos mononucleares de cobre com a base de Schiff 3-MeOsalen coordenados a íon nitrito.
3 REVISÃO BIBLIOGRÁFICA
3.1 BASES DE SCHIFF
As bases de Schiff, moléculas contendo o grupo imina ou azometina (C=N), foram descritas inicialmente por Hugo Schiff em 1864. Estes compostos são obtidos a partir da condensação de uma amina primária (R1-NH2) com uma carbonila, proveniente de cetona ou
aldeído (R2R3C=O), sendo o produto caracterizado pela formação do grupo C=N e a
eliminação de água, conforme reação apresentada na figura 1. Os substituintes R1, R2 e R3
podem ser grupos alquil, aril, heteroaril, hidrogênio, entre outros.
Figura 1- Reação representativa da obtenção de uma base de Schiff
R3
R2
O
+
H N2 R1
OH
R2 NH R3
R1 R
2
R3 N
R1
O H2
+
Fonte: Autora (2015)
Compostos possuindo grupos iminas podem ser obtidos a partir de fontes naturais, por exemplo, em plantas, ou por vias sintéticas ou ainda através de vias semi-sintéticas (Figura 2).
Dentre as bases de Schiff de origem vegetal pode ser citado o Ancistrocladidino (Figura 2, a), metabólito secundário do extrato de plantas das famílias Ancistrocladaceae e
Dioncophyllaceae, que é utilizado no tratamento da malária (BUNGARD; MORRIS, 2002;
SILVA et al., 2011).
Um dos exemplos de base de Schiff de origem semi-sintética (Figura 2, b) é o composto formado da reação entre aminas primárias presentes na quitosana com o salicilaldeído, originando uma base de Schiff que apresenta propriedades antifúngicas contra
Botrytis cinérea Pers. e Colletotrichum lagenarium (GUO et al., 2007).
Figura 2 - Bases de Schiff: (a) natural, (b) semi-sintética e (c) sintética
(a) (b) (c) Fonte: QIN et al. (2013, p. 12275)
A base de Schiff (E)-4-cloro-2-((4-fluorobenzilimino)-metil)fenol (Figura 3), sintetizada a partir da condensação do 5-cloro-salicilaldeído com 4-fluor-benzilamina, apresenta atividades antibactericidas relevantes, observadas em ensaios realizados com
Bacillus subtilis, Escherichia coli, Pseudomonas fluorescence e Staphylococcus aureus,
apresentando ainda atividade antifúngica para Aspergillus niger. Frente ao elevado número de bases de Schiff conhecidas e estudadas, foi possível se estabelecer uma relação entre estrutura e atividade biológica, verificando-se que o aumento da atividade antimicrobiana tem relação direta com a hidrofilicidade e aromaticidade. Além disso, já foi observado que a presença de grupos no anel aromático pode influenciar na atividade biológica destes compostos (SHI et al., 2007).
Figura 3- Estrutura Química do (E)-4-cloro-2-((4-fluorobenzilimino)-metil)fenol
Fonte: MUSA et al. (2010, p. 166)
O principal ligante polidentado pertencente à classe das bases de Schiff é o
Figura 4 – Reação de condensação do ligante salen
Fonte: Autora (2015)
Derivados do salen, cujas estruturas são apresentadas na figura 5, exibem atividades biológicas relevantes, como por exemplo, atuando na inibição da enzima anidrase carbônica, associada a tumores do tipo hCA XII. Sabe-se que a multiplicação das células malignas acontece em meio alcalino. No entanto, a partir da proliferação celular ocorre a produção do ácido lático devido ao intenso metabolismo anaeróbico, dificultando assim a divisão celular ocasionado pela acidez do meio.
Desta forma, essas células intensificam o uso da enzima anidrase carbônica, responsável pela reação catalítica de conversão de gás carbônico e água a ácido carbônico, dissociados como H+ e HCO3-. A partir da troca iônica, há a liberação de excesso de íons H+,
permitindo a alcalinização do meio e contribuindo para uma maior replicação celular. Por esse motivo, destacou-se a pertinência da busca por compostos que venham atuar sobre a enzima anidrase carbônica, inibindo assim o desenvolvimento tumoral (CARRADORI et al., 2013).
Figura 5 - Ligantes salen e derivados tetrahidrosalen
Na figura 6 é apresentada a estrutura base do ligante salen e as suas diferentes possibilidades de modificações estruturais, destacando a viabilidade de alterações nos substituintes no anel benzênico e alterações ou substituições na cadeia do composto diamínico.
Figura 6- Derivados do ligante salen
OH N
O H
N
OH N
O H
N
tBu
tBu
tBu
tBu OH
N
O H
N
OH N
O H
N H H
OH N
O H
N H H
OH N
O H
N Ar Ar
Ph Ph
Fonte: Autora (2015)
A base de Schiff utilizada neste trabalho é o
Figura 7- Estrutura química do 3-MeOsalen
Fonte: Autora (2015)
Na figura 8 são mostradas rotas sintéticas para a obtenção de diferentes bases de Schiff, derivadas da orto-vanilina, com alterações somente nas diaminas utilizadas no procedimento de síntese, salientando as diversas possibilidades de modificações estruturais.
Figura 8- Base de Schiff derivados da orto-vanilina
Fonte: Autora (2015)
O H OH O CH3 N N O H OCH3
N N HO
OCH3
N NH
N OH
H3CO
N O OH C H3 N O O H CH3 N N OH H3CO
3.2 PRECURSORES DA BASE DE SCHIFF 3-MEOSALEN
3.2.1 Orto-vanilina
A orto-vanilina, C8H8O3, é um composto orgânico encontrado em extratos e óleos
essenciais de diversas plantas (SAM et al., 2012), cuja nomenclatura da IUPAC dessa substância é 2-hidroxi-3-metoxibenzaldeído. Sua estrutura consiste de um anel benzênico substituído com o grupo aldeído na posição 1, o grupo hidroxila, -OH na posição 2 e o grupo metóxi, -OCH3 na posição 3.
Esta substância difere do seu isômero vanilina (Figura 9, b) devido à presença da hidroxila na posição para em relação ao grupo aldeído enquanto que na orto-vanilina (Figura 9, a), a hidroxila está na posição orto.
Figura 9- Estrutura química da (a) o-vanilina e (b) vanilina
Fonte:Autora.
Fonte: Autora (2015)
A orto-vanilina foi isolada pela primeira vez pelo químico alemão Ferdinand Tiemann em 1876, porém apenas em 1910 Francis Noelting desenvolveu uma metodologia para sua purificação.
Estudos cristalográficos mostram que a orto-vanilina apresenta uma estrutura planar e a presença do grupo hidroxila na posição orto ao aldeído possibilita ainda uma forte ligação de hidrogênio intramolecular entre o hidrogênio do grupo hidroxila e a carbonila proveniente do aldeído, proporcionando, portanto, uma estabilidade adicional em relação à vanilina (IWASAKI et al., 1976). Na figura 10 são apresentados os dados cristalográficos obtidos para a orto-vanilina.
O H
OH
O CH3
O H
O CH3 OH
Figura 10- Dados cristalográficos para a orto-vanilina com comprimentos de ligação expressos em Å
Fonte: CCDC Conquest (2015)
A orto-vanilina tem sido bastante investigada em razão das suas propriedades antimutagênicas. Os agentes mutagênicos estão relacionados ao desenvolvimento de doenças causadas por mudança na sequência de nucleotídeos ou arranjo do DNA, mutações cromossômicas e mutações gênicas. Assim, buscam-se por compostos antimutagênicos para inibir um ou mais estágios no processo de mutação (SANTOS et al., 2008).
Estudos apontaram a orto-vanilina como inibidor da capacidade de promover a transcrição da metilação O-metil-guanina-DNA metiltransferase (MGTase) do agente mutagênico N-metil-N-nitrosoureia (MNU). O MNU é um agente alquilante e exibe sua toxicidade transferindo o grupo metil para nucleobases em ácido nucleícos, provocando mutações (TAKAHASHI et al., 1989, WATANABE et al., 1989; TAKAHASHI et al., 1990).
3.2.2 Etilenodiamina
A etilenodiamina é um líquido incolor com cheiro similar ao da amônia e com fórmula molecular C2H4(NH2)2.Esta substância é um importante ligante na química de coordenação,
podendo se coordenar de forma bidentada a diferentes átomos metálicos.
mais eficazes na intercalação do DNA, devido ao seu tamanho da superfície do plano aromático ser superior do que o naftaleno. Em relação à fenazina, a diferença se deve a substituição do átomo de carbono pelo átomo de nitrogênio na posição 9, 10 que provoca uma diminuição na seletividade na intercalação do DNA.
Figura 11- Série de complexos de Pt (II) com etilienodiamina com 1,2-bis(piridil)etano com subunidades como
(a) naftataleno, (b) antraceno ou (c) fenazina
Fonte: DUSKOVA et al. (2012, p. 7113)
3.3 COMPOSTOS DE COORDENAÇÃO COM BASE DE SCHIFF
Na química de coordenação, os ligantes de bases de Schiff são considerados “ligantes
privilegiados”, devido sua capacidade de formar complexos bastante estáveis, podendo se coordenar a diferentes metais de transição e com estes em vários estados de oxidação (COZZI, 2004).
Estudos sobre complexos metálicos, tendo bases de Schiff como ligante, mostraram resultados que indicam a potencialidade desses complexos no tratamento de câncer ou como agente bactericida e antiviral. Esta classe de complexos apresenta ainda outras aplicações tais como adsorção e transporte de oxigênio, como pesticidas e em catálise homogênea e heterogênea ocasionando a oxidação e polimerização de compostos orgânicos (ARANHA et al., 2007).
O complexo de Cd (II) com a base de Schiff gerada a partir da condensação do ácido 3,5-diaminobenzóico e orto-vanilina, ilustrado na figura 12, apresentou uma relevante capacidade de inibição da atividade proteassoma celular e consequente indução da apoptose (morte celular programada ou auto-destruição celular de forma ordenada) das células do
câncer de mama. O complexo em questão inibiu a proliferação do câncer de mama MDA MB 231 enquanto as células não tumogênicas MCF10A foram menos sensíveis a ação do complexo (ZHANG et al., 2013).
A atividade proteassoma regula uma série de processos celulares importantes, incluindo a proliferação celular e a morte através da degradação de proteínas específicas. Assim, estudos sobre novos inibidores de proteassoma são de grande relevância, principalmente, devido a sua potencial utilização na quimioterapia para diversos tipos de tumores.
Figura 12- Estrutura química [Cd(C7H4N2O2)(C8H6O2)2]·2H2O
Fonte: Autora (2015)
Uma das aplicações de complexos com o ligante salen é relatado por Aranha et al. (2007), a partir de testes realizados com ratos diabéticos. Nesses testes, eles verificaram que o cloreto de N,N’-etilenobis(salicilideno-iminato)diaquocromo(III), [Cr(salen)(H2O)2]Cl
(Figura 13) potencializa a ação da insulina, reduzindo sintomas como hiperglicemia e colesterol. Partindo dessas observações, eles concluiram que este complexo pode ser usado como modelo de subtâncias com potencial para aplicações no tratamento dessa disfunção orgânica.
Figura 13- Estrutura química do íon complexo [Cr(salen)(H2O)2]+
Fonte: Autora (2015)
Cr
N N
O O
OH2
OH2
+ N
O O
CH3 N
O O
C H3
O O H
O ligante 3-MeOsalen apresenta o grupo metoxila na posição 3, o que possibilita a obtenção de complexos binucleares, devido à viabilidade de coordenação de um segundo metal através do grupo metoxila, conforme ilustrado na figura 14. Xiao e colaboradores (2011) mostraram que o Samário (Sm), por exemplo, pode se coordenar aos oxigênios dos grupos metóxidos do ligante 3-MeOsalen já coordenados a um complexo de níquel. Uma das potenciais aplicações observadas para este composto binuclear está relacionada à sua atividade catalítica na polimerização do ácido lático.
Figura 14 - Estrutura química dos compostos (a)3-MeOsalen (b) [Ni(3-MeOsalen)] e
(c) [Ni(3-MeOsalen)Sm(NO3)3]
Fonte: Autora (2015)
3.4 ALGUNS ASPECTOS SOBRE O ELEMENTO QUÍMICO FERRO
O ferro é o elemento químico de número atômico 26 e massa atômica 55,845 gmol-1,
sendo classificado como pertecente ao grupo 8 da tabela periódica. A configuração dos orbitais mais externos deste metal são 3d6, 4s2, apresentando como principais estados de
oxidação +2 e +3.
Diferentemente do ouro, o ferro é muito abundante na natureza, e apresenta potencial de redução baixo, razão pela qual raramente ocorre na natureza na sua forma pura. Este metal é normalmente encontrado em um de seus estados oxidados em compostos como hematita (Fe2O3), magnetita (Fe3O4), siderita (FeCO3), limonita (Fe2O3.H2O) e pirita (FeS2)
(MEDEIROS, 2010) e pelas suas propriedades e abundância, assume papel de grande relevância nos meios econômicos e industriais, além de se constituir em elemento de fundamental importância em vários processos biológicos.
O ferro está presente em várias moléculas de sistemas biológicos, tais como os grupos hemes, cujo são encontrados na hemoglobina, miglobina e nos citocromos, grupos estes
N N O OH O O H C
H3 CH3
Ni O O C H3 N N O O CH3 Sm Ni O O C H3 N N O O CH3 O O N O 3
formados mediante interações de íon ferro (II) com biomoléculas, principalmente as porfirinas (TOMA, 1984). Estes sistemas apresentam algumas funções biológicas importantes, como o transporte de oxigênio, a transferência de elétrons e certos processos de catálise enzimática.
A hemoglobina atua no transporte do oxigênio dos pulmões para os tecidos celulares nos mamíferos. Neste processo, o (O2) se liga ao Fe2+ da hemoglobina nos pulmões, e a
medida que esta circula pelo organismo vai liberando o O2 para os tecidos celulares e se
ligando ao dióxido de carbono, voltando aos pulmões, onde este gás é substituído pelo oxigênio, iniciando um novo ciclo. Portanto, a hemoglobina conduz o oxigênio para o organismo e retira o CO2 resultante do metabolismo celular, eliminando-o através dos
pulmões. Na figura 15 são ilustrados a hemoglobina e o grupo heme.
Figura 15- Representação da (a) hemoglobina e (b) grupo heme
Fonte: http://misodor.com/HEMOGLOBINA.php
3.4.1 Complexos de ferro com bases de Schiff
Os complexos de ferro III formados com ligantes tetradentados como o salen ou seus derivados, normalmente apresentam configuração alto spin (S = 5/2).
Outra característica importante observada nos complexos de [Fe(salen)Cl] (Figura 16, a) é que a partir deste composto pode-se obter uma diversidade de possibilidades estruturais como os complexos binucleares de [Fe(salen)Cl] nas formas diméricas ou em ponte com oxigênio, dependendo dos procedimentos experimentais nas sínteses.
A obtenção do composto dimérico [{Fe(salen)Cl}2] (Figura 16, b) pode ser realizada
através da recristalização do [Fe(salen)Cl] em acetona, tendo-se como resultado a formação do dímero assegurada por interações intermoleculares entre o par de oxigênios fenólicos da base de Schiff e os átomos de ferro (GULOTTI et al., 1977).
O complexo em ponte [ -O{Fe(salen)}2] (Figura 16, c) é obtido a partir da reação de
Fe(OH)3 com a base de Schiff ou através da hidrólise do complexo monomérico [Fe(salen)Cl]
com NaOH ou KOH (HOBDAY; SMITH, 1972; JANA et al., 2012).
Figura 16 - Estrutura química dos complexos: (a) [Fe(salen)Cl], (b) [Fe(salen)Cl]2 e (c) [( -O){Fe(salen)}2]
Fonte: Adaptado HOBDAY; SMITH (1972, p. 317)
A coordenação de ligantes biologicamente ativos a centros metálicos podem fazer com que sua atividade seja intensificada. Desse modo, complexos com base de Schiff apresentam relevância científica e social por estarem envolvidos em pesquisas sobre intervenções terapêuticas como no tratamento de câncer, nas atividades antibacterianas e intercalações com o DNA.
Particularmente, o complexo [Fe(salen)Cl] mostrou-se como uma importante nuclease sintética, induzindo a fragmentação do DNA de células humanas em estudos in vitro quando na presença do agente redutor ditiotreitol. As espécies reativas de oxigênio geradas a partir da redução do centro metálico causam danos às células, levando-as a morte por apoptose. Para a compreensão do percurso para a ocorrência da apoptose, realizou-se estudo de imuno-coloração com anticorpo anti-citocromo c.
Estudos complementares detectaram que a presença do complexo promove uma maior difusão do citocromo c da mitocôndria para o citosol. Tal processo é uma via importante de
(b) (c)
indução da morte celular por apoptose, indicando assim que a atuação deste complexo pode estar também relacionada à atividade da mitocôndria (WOLDEMARIAM; MANDAL, 2008).
Os complexos de ferro com ligantes derivados do salen, como por exemplo, o composto [Fe(5-PPh3ClMesalen)Cl], ilustrado na figura 17, também demonstraram forte
capacidade de interação com DNA. Através do acompanhamento espectrofotométrico (Uv-Vis) da reação entre o complexo e DNA foram detectadas alterações consideráveis do perfil do espectro eletrônico do complexo. Estas alterações foram caracterizadas principalmente pelo efeito hipercrômico nas absorções acima de 300 nm, indicando a ocorrência de interações eletrostáticas do complexo com as bases do DNA. O efeito hipocrômico foi observado em bandas com comprimento de onda menores que 300 nm, representando a interação hidrofóbica resultante da interação entre o DNA com os anéis fenílicos do grupo fosfino (DEHKORDI; LINCOLN, 2013).
Figura 17- Estrutura química do [Fe(5-PPh3ClMesalen)Cl]
Fonte: DEHKORDI et al. (2013, p. 814)
Estudos realizados com os compostos [Fe(II)(salen)] e [Fe(II)(bishidroxisalen)], figura 18, também indicaram uma elevada afinidade entre esses complexos e o DNA. Adicionalmente, foi possível constatar que a posição dos grupos hidroxi na base de Schiff salen tem efeito sobre as propriedades biológicas dos respectivos complexos. Foi observado para este sistema que o complexo com grupos hidroxi na posição para apresenta maior afinidade pelo DNA do que os isômeros com grupos -OH nas posições orto e meta (ROUTIER et al., 1999).
Figura 18- Estrutura química dos (a) [Fe(salen)], (b) [Fe(3-OHsalen)], (c) [Fe(4-OHsalen)] e
(d) [Fe(5-OHsalen)]
Fonte: Autora (2015)
Ansari e seus colaboradores (2009) avaliaram a citotoxicidade do [Fe(salen)Cl] e de derivados desses complexos via MTT (Brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio) na célula de câncer de mama MCF7. Os derivados estudados apresentaram as seguintes diaminas para formação da base de Schiff: a etilenodiamina, o-fenilenodiamina ou o 2,3 diaminonaftaleno (Figura 19) e também alteraram os substituintes dos anéis aromáticos pelo grupo -OH ou pelo grupo –OCH3 na posição 3, 4 e 5.
Figura 19- Estrutura química dos derivados do [Fe(salen)Cl] com diferentes diaminas
Fonte: Autora (2015)
A variedade de compostos estudados por Ansari e seus colaboradores (2009) teve como finalidade encontrar alguma associação entre as estruturas e atividades biológicas, tendo sido observado que a citotoxicidade dos compostos está relacionada com o modo de interação, o transporte, o potencial de captação celular, a estrutura e a reatividade desses compostos.
Efetuou-se um estudo comparativo da citotoxicidade via MTT para todos os derivados de [Fe(salen)Cl] e notou que a atividade se mostrou dependente da estrutura da diamina e dos substituintes dos anéis benzênicos.
Fe O N N O O H OH Fe O N N O Fe O N N O O H OH Fe O N N O OH O H (a) (b)
(c) (d)
Os compostos [Fe(salen)Cl], [Fe(salphen)Cl] e [Fe(salnaphen)Cl] apresentaram os seguintes valores de IC50: 22,0; 1,3 e 0,5 M, respectivamente. Estes resultados indicam que
o aumento do número de anéis aromáticos na diamina intensifica a citotoxicidade do material. Analisando-se os resultados obtidos para os compostos com substituições do grupo hidroxila e metoxila, verificou-se que o grupo metoxila é mais bioquimicamente ativo, por apresentar maior carácter hidrofóbico, o que faz aumentar a permeabilidade celular e a eficiência desses compostos. Por tais observações, concluiu-se que tanto o anel aromático quanto as posições dos substituintes interferem na citotoxicidade dos complexos (ANSARI et al., 2009 ANSARI et al., 2011).
Estudos realizados por Herchel e colaboradores (2009) abordaram sobre a determinação da citotoxicidade de complexos ferro-salen com ligantes nitrogenados nas posições axiais, tais como 1H-imidazol (Himz), 1H-tetrazol-5-amina (Hatz), 5-metil-1H-tetrazol (Hmtz), 1H-benzimidazol (Hbimz), 1H-1,2,4-triazol (Htriz), 1H-benzotriazol (Hbtriz), visualizado na figura 20.
Através de ensaios de citotoxicidade nas células de câncer de mama MCF7, constatou-se que a substituição do íon cloreto pelo ligante nitrogenado potencializa a ação da apoptose das células cancerígenas em alguns complexos, acarretando numa diminuição nos valores de IC50 comparado com [Fe(salen)Cl)].
Figura 20- Estrutura química dos ligantes nitrogenados
Na tabela 1 são relatados os valores de IC50 para os derivados de [Fe(salen)Cl] para
células MCF7.
Tabela 1- Valores de IC50 para os derivados de [Fe(salen)Cl] para células MCF7.
COMPOSTO IC50 ( M) –MCF7 Referências
[Fe(salen)Cl] 22 ANSARI et al., 2009
[Fe(3-OHsalen)Cl] >60 ANSARI et al., 2011
[Fe(4-OHsalen)Cl] >60 ANSARI et al., 2011
[Fe(5-OHsalen)Cl] >60 ANSARI et al., 2011
[Fe(3-MeOsalen)Cl] >60 ANSARI et al., 2011
[Fe(4-MeOsalen)Cl] 12 ANSARI et al., 2011
[Fe(5-MeOsalen)Cl] 4,5 ANSARI et al., 2011
[Fe(salphen)Cl] 1,3 ANSARI et al., 2009
[Fe(3-OHsalphen)Cl] 0,3 ANSARI et al., 2011
[Fe(4-OHsalphen)Cl] >60 ANSARI et al., 2011
[Fe(5-OHsalphen)Cl] >60 ANSARI et al., 2011
[Fe(3-MeOsalphen)Cl] 4,1 ANSARI et al., 2011
[Fe(4-MeOsalphen)Cl] 0,7 ANSARI et al., 2011
[Fe(5-MeOsalphen)Cl] 3,1 ANSARI et al., 2011
[Fe(salnaphen)Cl] 0,5 ANSARI et al., 2009
[Fe(3-OHsalnaphen)Cl] 0,2 ANSARI et al., 2009
[Fe(4-OHsalnaphen)Cl] >100 ANSARI et al., 2009
[Fe(5-OHsalnaphen)Cl] >100 ANSARI et al., 2009
[Fe(3-MeOsalnaphen)Cl] 1,5 ANSARI et al., 2009
[Fe(4-MeOsalnaphen)Cl] 0,5 ANSARI et al., 2009
[Fe(5-MeOsalnaphen)Cl] 1,3 ANSARI et al., 2009
[Fe(salen)(Himz)]n 23,7 HERCHEL et al., 2009
[Fe(salen)(Hatz)]n 13,1 HERCHEL et al., 2009
[Fe(salen)(Hmtz)]n 20,6 HERCHEL et al., 2009
[Fe(salen)(Hbimz)]n >1 HERCHEL et al., 2009
[Fe(salen)(Htriz)]n 18,3 HERCHEL et al., 2009
[Fe(salen)(btriz)]n 16,9 HERCHEL et al., 2009
3.5 ALGUNS ASPECTOS SOBRE O ELEMENTO QUÍMICO COBRE
O cobre é o elemento químico de número atômico 29 e massa atômica 63,546 gmol-1. A configuração eletrônica dos orbitais mais externos para este metal é 3d10, 4s1, podendo ser encontrado principalmente nos estados de oxidação +1 e +2.
O cobre exerce funções essenciais no meio biológico, atuando no transporte de elétrons, no metabolismo do oxigênio, na oxidação de catecóis e fenóis e nas atividades metabólicas no fígado e nos rins (RODRIGUEZ et al., 2012).
Um dos compostos de coordenação com destaque na área biológica é o complexo formado pelo Cu (II) e a 1,10-fenantrolina (phen), [Cu(phen)2]2+, representado na figura 21.
Esse composto é reduzidoin situ, originando a espécie [Cu(phen)2]+, o qual se liga ao sulco
menor do DNA, reduzindo o oxigênio molecular, gerando espécies oxidantes, como por exemplo, radicais livres como o superóxido e o radical hidroxilo que causam a quebra da fita do DNA (DEY et al., 2008).
Devido a essa habilidade do Cu (II) - fenantrolina em gerar espécies radicalares, muitos complexos com esse sistema têm sido testados como potenciais fármacos anticancerígenos.
Figura 21- Estrutura química do íon complexo [Cu(phen)2]2+
Fonte: Autora (2015)
3.5.1 Complexos de cobre com base de Schiff
Odabaşoğlu e colaboradores (2007) descreveram uma síntese diferenciada para o
N,N’etilenobis(3-Metoxisalicilidenoiminato)aquacobre(II), conforme ilustrado na figura 22, com geometria piramidal de base quadrada, número de coordenação cinco e que apresenta em sua estrutura o ligante 3-MeOsalen. A síntese deste complexo foi realizada a partir do
N
N N
N Cu
cis-aquabis(o-vanilinato)cobre(II) e em seguida adicionado etilenodiamina para a obtenção do
complexo proposto.
Figura 22- Estrutura química do complexo [Cu(3-MeOsalen)H2O]
N N
O O
O O
C
H3 CH3
Cu O
H H
Fonte: Autora (2015)
A síntese de um novo complexo derivado do cobre e salen, ilustrado na figura 23, teve como objetivo investigar a interação deste composto com o DNA. Este complexo induziu a clivagem do DNA na presença de um agente redutor. Com isso, a cadeia lateral do butilamino teve como finalidade facilitar o transporte celular e o reconhecimento do DNA (ROUTIERet al., 1996).
Figura 23- Síntese do complexo de [Cusalen] modificado
3.6 ASPECTOS GERAIS DA QUÍMICA DE COORDENAÇÃO DO ÍON NITRITO
O íon nitrito (NO2-) é um oxiânion de nitrogênio com estrutura simples que ocorre na
natureza, podendo ser gerado pela oxidação da amônia presente no solo através das bactérias dos gêneros Nitrossomonas e Nitrossococcus, numa das etapas do ciclo do nitrogênio (MEURER, 2004).
Com a evolução do conhecimento químico a respeito do nitrito, sua função e atividade em sistemas biológicos tem se mostrado bastante controverso, do lado positivo pelo seu uso, como conservante de alimentos (principalmente carnes e peixes), e do lado negativo, pela sua ação como causador de certos tipos de câncer, devido à formação de nitrosamina a partir da reação do nitrito com aminas em certas condições de acidez. Mais recentemente, seu uso está associado a uma pró-droga para liberação de óxido nítrico, importante agente de proteção celular e vasodilatador.
Por essa última razão, o íon nitrito é atualmente considerado uma importante fonte de óxido nítrico a partir de sua conversão biológica a NO em certas condições bioquímicas (ZAHRAN et al., 2008). Neste contexto, compostos de coordenação com íon nitrito podem atuar como pró-droga para liberação de NO em meio biológico (BRYAN, 2006).
Nos compostos de coordenação, os íons nitritos podem se coordenar ao metal de diversas maneiras, como visualizado na figura 24, podendo atuar como ligante monodentado ou bidentado. Quando monodentado, a coordenação pode ocorrer através do átomo de nitrogênio (Figura 24, a), originando os nitro complexos ou através do átomo de oxigênio dando origem aos nitrito complexos (Figura 24, b). A forma de coordenação bidentada ocorre através da ligação ao metal através dos dois átomos de oxigênio simultaneamente (Figura 24, c).
Figura 24- Diferentes modos de coordenação do íon nitrito
Fonte: NAKAMOTO (1997, p.48)
Nos nitro complexos, os elétrons π do íon nitrito estão deslocalizados entre as duas ligações de N-O, assim favorecendo a recepção de eletrons π. Enquanto na forma nitrito, os eletrons π estão localizados sobre uma ligação N-O, desta forma o oxigênio apresenta uma leve característica de doador. Na figura 25 são exibidos as estruturas do complexo [Ni(en)2(NO2)2] nas duas formas de isomeria em que se observa a deslocalização eletrônica do
íon nitrito.
Como o ligante nitro é mais forte tem maior tendência para aceitar elétrons π, tornando a ligação metal-ligante mais estável, justificando a predominância de complexos com esse ligante na isomeria nitro.
Figura 25- Modos de coordenação nitro e nitrito do complexo [Ni(en)2(NO2)2]
Fonte: FABBRIZZI; POGGI (2013, p.1696)
(a) Nitro complexos (b) Nitrito complexos (c) Complexos quelato
Através de modificações estruturais na etilenodiamina no complexo [Ni(en)2(NO2)2],
adicionando substituintes no átomo de carbono ou nitrogênio da diamina, pode-se observar que a isomeria nitro apresenta um maior impedimento estérico entre os substituintes da etilenodiamina e o íon nitrito. Desta forma, o nitrito complexo é preferível, pois apresenta menor repulsão entre os grupos envolvidos.
Como relatado por FABBRIZZI; POGGI (2013), no caso de complexos com duas diaminas isoméricas diMeen e adiMeen, a coordenação do íon nitrito ao [Ni(diMeen)2(NO2)2]
(Figura 26, a) a ocorre na forma nitro. Já o [Ni(adiMeen)2(ONO)2] (Figura 26, b), a
coordenação se faz na forma nitrito, devido ao forte efeito repulsivo que os dois grupos metil ligados a um mesmo átomo de nitrogênio da amina exerceriam sobre o NO2- na presença da
isomeria nitro.
Figura 26 – Estrutura química dos complexos (a) [Ni(diMeen)2(NO2)2] e o (b) [Ni(adiMeen)2(ONO)2]
Fonte: FABBRIZZI; POGGI (2013, p.1696)
O composto [Ru(salen)(PPh3)(NO2)], figura 27, foi estudado e analisado perante o
interesse do íon nitrito ser capaz de apresentar um armazenamento intravascular de óxido nítrico, assim enfatizando o potencial biológico de nitros complexos (BIRKMANN et al., 2009).
Figura 27 - Sistema reacional do complexo [Ru(salen)(PPh3)(NO2)]
Fonte: BIRKMANN et al. (2009, p. 239)
3.7 ASPECTOS GERAIS DA QUÍMICA DE COORDENAÇÃO DO ÍON
DITIOCARBAMATO
O íon ditiocarbamato é um ligante aniônico com dois átomos de enxofre doadores de densidade eletrônica cuja fórmula molecular simplificada é R2NCS2-, onde o R pode
representar grupos alquila ou o hidrogênio. A estrutura geral para esta classe de compostos é apresentada na figura 28.
Figura 28- Estrutura química simplificada do íon ditiocarbamato
N R
R
S
S
Fonte: Autora (2015)
Estes compostos podem ser preparados a partir da reação de uma amina, primária ou secundária, com o dissulfeto de carbono na presença de uma base, conforme mostrado na Figura 29.
Figura 29- Reação geral de síntese do íon ditiocarbamato
Fonte: Autora (2015)
N H
R
R
+ S C S + NaOH N
R
R
S
S
![Tabela 1- Valores de IC 50 para os derivados de [Fe(salen)Cl] para células MCF7.](https://thumb-eu.123doks.com/thumbv2/123dok_br/15576847.102377/42.892.135.798.241.1110/tabela-valores-para-derivados-salen-para-células-mcf.webp)


![Figura 57- Espectro de infravermelho do [Fe(3-MeOsalen)Cl] na região de 1700 a 900 cm -1 em KBr](https://thumb-eu.123doks.com/thumbv2/123dok_br/15576847.102377/72.892.237.711.446.821/figura-espectro-infravermelho-fe-meosalen-cl-região-kbr.webp)
![Figura 63- Espectro de infravermelho do [Fe(3-MeOsalen)(etil 2 -dtc)] na região de 1700 a 700 cm -1 em KBr](https://thumb-eu.123doks.com/thumbv2/123dok_br/15576847.102377/78.892.210.722.175.605/figura-espectro-infravermelho-fe-meosalen-etil-região-kbr.webp)
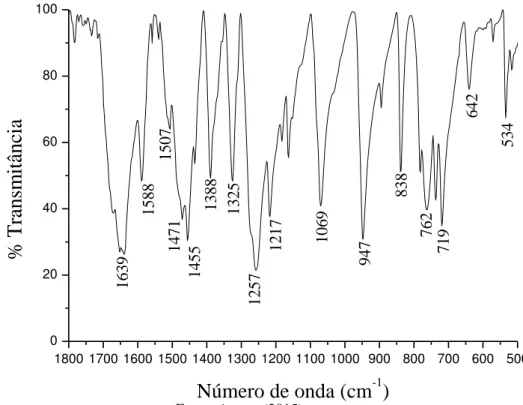
![Figura 66 - Espectro de infravermelho do [Fe(3-MeOsalen)NO] na região de 4000 a 400 cm -1 em KBr](https://thumb-eu.123doks.com/thumbv2/123dok_br/15576847.102377/80.892.235.660.810.1156/figura-espectro-infravermelho-fe-meosalen-no-região-kbr.webp)
![Figura 70- Espectro de infravermelho do [Cu(3-MeOsalen)H 2 O] na região de 1700 a 400 cm -1 em KBr](https://thumb-eu.123doks.com/thumbv2/123dok_br/15576847.102377/88.892.210.742.174.574/figura-espectro-infravermelho-cu-meosalen-região-em-kbr.webp)
