UNIVERSIDADE PRESBITERIANA MACKENZIE Centro de Ciências Biológicas e da Saúde
Programa de Pós Graduação em Distúrbios do Desenvolvimento
ANA MIRIÃ PACIFICO
Avaliação da expressão gênica do sistema ocitocinérgico em ratos expostos ao status epilepticus neonatal
ANA MIRIÃ PACIFICO
Avaliação da expressão gênica do sistema ocitocinérgico em ratos expostos ao status epilepticus neonatal
SÃO PAULO 2016
Dissertação vinculada à linha de pesquisa básica em Neurobiologia e Comportamento no Desenvolvimento e seus transtornos, apresentada ao Programa de Pós-Graduação da Universidade Presbiteriana Mackenzie, como requisito para a obtenção do título de Mestre.
P117a Pacifico, Ana Miriã.
Avaliação da expressão gênica do sistema ocitocinérgico em ratos expostos ao status epilepticus neonatal / Ana Miriã Pacifico – São Paulo , 2016.
50 f. : il. ; 30 cm.
Dissertação (Mestrado em Distúrbio do Desenvolvimento) - Universidade Presbiteriana Mackenzie, 2016.
Dedicatória
AGRADECIMENTOS
Agradeço à Deus, meu senhor, minha fortaleza. Sem Ele não conseguiria enfrentar os desafios e obstáculos que me ocorreram durante o caminho. À Ele toda honra e glória para sempre!
Aos meus pais, Luiz e Silvia. Companheiros de todas as horas, incentivadores e amigos. Eu não teria conseguido sem o apoio e amor de vocês. Amo vocês!
Aos meus queridos avós, Paulo e Valdete, que me incentivaram e torceram por mim em cada etapa do trabalho.
Aos meus irmãos, Rafael e Felipe, que mesmo sem perceber me apoiaram em vários momentos de fraqueza.
A minha cunhada querida, Gabriela, que já considero uma irmã por todas as palavras de incentivo e apoio.
A minha orientadora Profª. Roberta, por todo incentivo. Por ter me acolhido em seu grupo de pesquisa, ter me ensinado e me apoiado em todos os momentos deste trabalho. Agradeço pela amizade e compreensão em vários momentos difíceis que enfrentei durante a minha caminhada. Sem a sua orientação e paciência eu não teria conseguido, os meus mais sinceros agradecimentos.
Aos Professores Miriam Ribeiro e Sérgio Gomes da Silva, integrantes da banca examinadora, por todas as contribuições ao trabalho.
Aos professores Sérgio Tufik, e Mônica Levy Andersen do departamento de Psicobiologia da Universidade Federal do Estado de São Paulo (UNIFESP), por ter cedido o espaço e possibilitado à execução de parte desse trabalho.
Ao meu querido amigo Geraldo, pelo auxilio, amizade e companheirismo durante toda a minha jornada. Obrigada pelas conversas, pelo auxilio nos experimentos, pela solidariedade e apoio.
Aos alunos de iniciação cientifica: Letícia, Dayane, Ingrid, Samuel e Pedro. Obrigada pelas palavras de incentivo, pelas conversas e por todo o companheirismo no laboratório.
Á todos que de alguma forma ajudaram na execução do trabalho no Departamento de Psicobiologia na UNIFESP, em especial ao Hélio, a Sueli e a Laura que sempre foram muito prestativos. Muito Obrigada por todo o auxílio.
As queridas amigas: Ana Paula, Larissa e Lílian por todo incentivo e apoio que sempre me deram.
Aos meus amigos: Bruno, Jônatas, Débora, Camila, Silvia, Mauricio, Martha, Matheus, Fernanda e Lucas por todas as palavras de incentivo, pelo apoio e pela compreensão durante todo o curso. Amo vocês.
Aos queridos amigos de trabalho: Rubens, Luciana, Beatriz, Verônica e Cristiane. Por todo carinho e incentivo que me deram do começo ao fim do curso.
Ao veterinário Alexandre e aos técnicos do Biotério: Domingos e Junior por todo o auxílio prestado durante os experimentos.
Aos técnicos do Laboratório: Lucas e Nathalia por toda a ajuda, que nunca me foi negada em todos os momentos em que precisei.
À Daniele, da secretaria do programa, por todo auxilio prestado durante o curso. Aos colegas do laboratório por toda ajuda.
À todas as pessoas que não foram citadas aqui, mas que de alguma forma contribuíram com o trabalho.
RESUMO
Estudos experimentais mostram evidências de que ratos adultos submetidos às convulsões neonatais apresentam mudanças morfológicas e cognitivas, exibindo também comportamento autista caracterizado pela baixa preferência pela novidade social, déficit de discriminação social e comportamento tipo ansioso. Porém, os mecanismos que respondem por estas alterações ainda não são conhecidos. Várias evidências demonstram que a ocitocina (OT) está presente em regiões importantes para reconhecimento social, tais como a amígdala medial e o hipocampo. Postulamos que a deficiência na sinalização mediada pela OT na rede neural relacionada com o cérebro social responda pelo prejuízo na sociabilidade e pelo aumento da emocionalidade subsequente à convulsão neonatal. Este trabalho tem como objetivo avaliar a memória de reconhecimento social e a expressão gênica da OT e do seu receptor (OTR) em animais submetidos ao status epilepticus neonatal. Foram utilizados ratos Wistar machos adultos submetidos ao status epilepticus no nono dia de vida (P9) pela administração da pilocarpina (350 mg/kg, ip) e os controles receberam salina 0.9% (0,1 mL/10 g). Em P90 foi avaliada a memória social pelo paradigma de habituação/desabituação. Ao fim dos testes comportamentais, os animais foram anestesiados e decapitados para a retirada das estruturas de estudo (amígdala, hipocampo, e hipotálamo). Posteriormente foi realizada a análise da expressão gênica da ocitocina e seu receptor nos tecidos citados, por meio da PCR em tempo real. No teste de memória social os animais experimentais apresentaram menor tempo de investigação social, indicativo de prejuízo no sistema de motivação/recompensa e prejuízo de habituação/desabituação, sugestivo de prejuízo na memória de reconhecimento social. A expressão gênica da ocitocina não diferiu entre os grupos nas estruturas analisadas, mas observou-se uma pequena redução na expressão gênica do receptor de ocitocina no hipocampo. Com isso conclui-se o status epilepticus neonatal em ratos produz déficit na memória de reconhecimento social e do sistema de motivação / recompensa mesolímibico. O presente trabalho mostrou que animais submetidos ao status epilepticus neonatal apresentam redução da exploração da novidade social, sugestivo de prejuízo no sistema de motivação/recompensa mesolímbico e da memória de reconhecimento social que pode estar relacionada a redução da expressão dos receptores da ocitocina no hipocampo.
ABSTRACT
LISTA DE FIGURAS
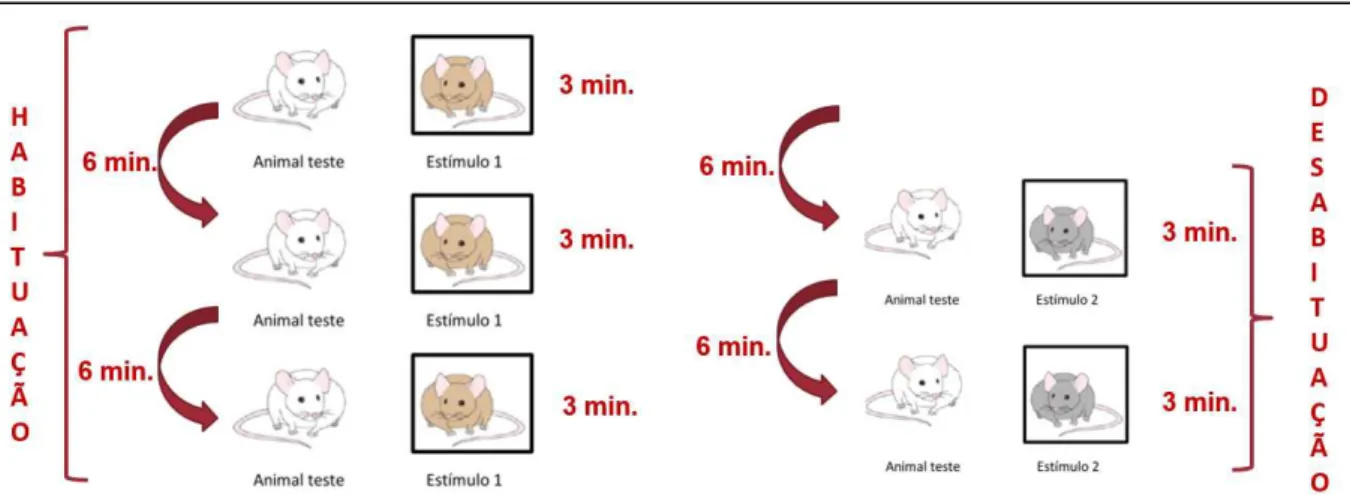
Fig. 1- Protocolo do teste comportamental (habituação/desabituação)...22
Fig. 2 – Representação gráfica do teste comportamental...26
Fig. 3- Expressão do RNAm para o receptor de ocitocina...27
SUMÁRIO
1. Introdução ... 10
1.1 Crises epilépticas neonatais ... 10
1.2. Estudos Clínicos ... 11
1.3 Estudos em Modelos Experimentais ... 13
1.4. Reconhecimento Social ... 14
1.6. Ocitocina ... 16
2. Hipótese ... 21
3. Objetivos ... 22
3.1. Objetivo Geral ... 22
3.2. Objetivos Específicos ... 22
4. Método ... 23
4.1. Animais ... 23
4.3. Teste de memória social ... 23
4.4. Análise de Expressão Gênica ... 24
4.4.1. Extração do RNA Total ... 24
4.4.2. Eletroforese em gel de Agarose e Quantificação ... 26
4.4.3. Transcrição Reversa ... 26
4.4.4. PCR de tempo real ... 27
4.5. Análise Estatística ... 27
5. Resultados ... 28
5.1. Teste de Memória Social ... 28
5.2. PCR em tempo real ... 28
6. Discussão ... 31
7. Conclusão ... 35
10 1. Introdução
1.1 Crises epilépticas neonatais
As crises convulsivas são o distúrbio neurológico mais frequente no período neonatal (WIRRELL et al., 2011; VASUDEVAN; LEVENE, 2013). Apesar de cerca de 40%-50% das crianças afetadas se desenvolverem normalmente, as crises podem causar lesões que afetam funções cerebrais importantes causando epilepsia, prejuízos cognitivos, atraso do desenvolvimento, paralisia cerebral e até mesmo óbito (RONEN et al., 2007; TUCHMAN; CUCCARO, 2011; BERG; PLIOPLYS, 2012; FRIEDMAN; HU, 2014). A interação entre epilepsia e o autismo é sugerida por vários pesquisadores, isto porque, estudos demonstram que a epilepsia está presente em até 46% dos pacientes com autismo e que a co-ocorrência da epilepsia e autismo ocorre em cerca de 30% das crianças com outras desordens (BROOKS-KAYAL, 2010; JENSEN, 2011).
Muitos fatores no período neonatal contribuem para um alto risco de convulsões (NARDOU et al., 2013). As intercorrências perinatais mais frequentes são a encefalopatia hipóxico-isquêmica, trauma no parto, infecções perinatais, hemorragia intracraniana, intoxicação e distúrbios metabólicos (THIBEAULT-EYBALIN et al., 2009; HUANG et al., 2011, FABBRONI; CYSNEIROS, 2014). Além de anormalidades cerebrais congênitas e desordens genéticas que também podem desencadear crises neonatais. Em humanos a etiologia mais comum para convulsões neonatais é a encefalopatia hipóxico-isquêmica, que afeta aproximadamente 1-3 de 1000 nascidos-vivos e é responsável por 60% das convulsões em recém-nascidos (FABBRONI; CYSNEIROS, 2014; SYLVERTSEN, et al., 2015).
Essas crises podem ser sintomáticas ou idiopáticas. As sintomáticas têm etiologia causada no parto ou no pós-parto. Já as crises idiopáticas, quando não há uma etiologia ou fator de risco, na maioria das vezes, as causas são parte de síndromes epilépticas geneticamente determinadas, como convulsões benignas neonatais familiares ou não (HUANG et al., 2011).
11 tipicamente mais duradouras e menos seletivas, caracterizado principalmente por aumento de excitação e redução da atividade inibitória (MOSHE, 1993; SWANN, 2005; BEN-ARI; HOLMES, 2006; NARDOU et al., 2013).
O GABA (ácido gama-aminobutírico), é o principal transmissor inibitório no cérebro adulto, porém exibe atividade excitatória nos neurônios imaturos e isto acontece devido a uma elevada concentração intracelular de íons cloreto levando a um efluxo quando à ativação de receptores do tipo GABAA (BEN-ARI, 2002; BEN-ARI; HOLMES, 2006; NARDOU et al., 2013). Já o glutamato é o principal neurotransmissor excitatório e se expressa depois do GABA nos neurônios imaturos. Isto porque, o receptor NMDA (N-metil D-Aspartato) alcança a maturação no final da primeira semana, e o receptor AMPA (alfa-amino-3-hidroxi-metil-5-4-isoxazolpropiónico) tem o seu pico de expressão em aproximadamente 10 dias de vida (SANCHEZ; JENSEN, 2001) e a maturação da rede inibitória do GABA, acontece durante as primeiras três semanas pós-natais. Essa diferença temporal de expressão cria um desequilíbrio dos receptores excitatório sobre os receptores inibitórios no início do neurodesenvolvimento (THIBEAULT-EYBALIN et al., 2009; NARDOU et al., 2013).
Outros fatores que contribuem para a suscetibilidade do cérebro imaturo para convulsões incluem a arquitetura sináptica imatura, os padrões de voltagem, e as funções das células glia de apoio. O aumento da atividade neural associada com a aprimorada excitação no cérebro imaturo é essencial para numerosas atividades e processos do desenvolvimento, mas predispõe à geração de eventos sincrônicos, o que torna o cérebro mais suscetível às convulsões (NARDOU et al., 2013).
Estudos em animais e em humanos têm mostrado evidências sugerindo que crises convulsivas prolongadas durante o desenvolvimento cerebral podem resultar em sequelas permanentes (GARFINKLE; SHEVELL, 2011; CASTELHANO et al., 2010, 2013, 2015).
12 Como citado anteriormente, as crises neonatais são o sinal clínico mais comum de disfunção cerebral em recém-nascidos (HOLMES, 2005). Essas crises estão relacionadas a fatores etiológicos, associadas a altas taxas de mortalidade e ou prejuízo do desempenho neurológico. Com os avanços na área da neonatologia, a taxa de sobrevivência de recém-nascidos tem aumentado e as técnicas avançadas de investigação ajudaram a descobrir diferentes fatores etiológicos, e assim o espectro de diagnóstico diferencial tem aumentado (YILDIZ et al., 2012). Porém, a asfixia perinatal continua a ser o fator mais comum, sendo a etiologia mais frequente (50-60%) de crises neonatais (RONEN et al., 2007; TEKGUL et al., 2006; YILDIZ et al., 2012). No geral, para os bebês nascidos a termo, a mortalidade após as crises diminuiu na última década, e há registro de 10% de óbitos após as crises, uma queda de 33% em relação aos relatórios dos anos 1990. Em contraste, a prevalência de sequelas adversas no neurodesenvolvimento permanece relativamente estável, tipicamente 46% (URIA-AVELLANAL et al., 2013). Entre as consequências neurológicas adversas associadas às crises neonatais estão: paralisia cerebral, atraso no desenvolvimento global, e crises epilépticas (GARFINKLE; SHEVELL, 2011; LAI et al., 2013). As taxas de presença de sequelas variam entre 25-35%, e não apresentam relação com a idade gestacional (YILDIZ et al., 2012).
13 artéria cerebral anterior, o eletroencefalograma anormal e doenças cardíacas congênitas. Por exemplo, um estudo realizado com bebês nascidos a termo que tiveram convulsões neonatais posteriores à asfixia intraparto mostrou as principais sequelas que podem ocorrer com as crianças. Ao todo foram analisadas 62 crianças, destas 23 (37%) crianças tiveram um resultado normal, 34 (55%) sobreviveram com uma ou mais deficiências do desenvolvimento neurológico (23 paralisia cerebral, 28 atraso no desenvolvimento global, 15 epilepsia, 18 com combinação de dois e 9 com todos os três), além de 5 (8%) que foram à óbito (GARFINKLE; SHEVELL, 2011). Os autores apontam que a semiologia e anormalidades no EEG em crianças que tiveram crises são preditores de prognósticos adversos.
1.3 Estudos em Modelos Experimentais
Considerações éticas se opõem a maioria dos estudos sobre o cérebro de recém-nascidos humanos (NARDOU et al., 2013). Então, estudos com modelos animais são realizados em larga escala, uma vez que as variáveis podem ser controladas, podem-se replicar as evidências observadas em humanos como também permitir a investigação de mecanismos moleculares subjacentes aos danos ocasionados pelas crises neonatais (HOLMES, 2005; CASTELHANOS et al., 2010). Os modelos de crises neonatais em roedores utilizam animais com idades entre P7 e P10, uma idade que se assemelha a maturação estrutural e funcional do cérebro neonatal humano (BERNARD; BENK, 2015; NARDOU et al., 2013).
Em modelos animais, os danos neurológicos de longo prazo decorrentes das crises epilépticas estão relacionados com a idade do animal no momento da convulsão. Comparados com ratos adultos, roedores jovens têm menos perda celular, ao invés disso, apresentam extensa plasticidade e reorganização sináptica (HOLMES et al., 1998; SOGAWA et al., 2001; NISHIMURA et al., 2011; CORNEJO et al, 2007; SAYIN et al., 2015). Esta resistência relativa pode ser devido a menor densidade de sinapses ativas, menor consumo de energia, e, em geral, a imaturidade relativa de cascatas bioquímicas que conduzem à morte celular (HOLMES, 2005).
14 memória viso-espacial (HOLMES et al., 1998; HUANG et al., 1999; LUGO et al., 2014b) e na flexibilidade cognitiva (KLEEN et al., 2011). Além destas, pesquisas conduzidas pelo nosso grupo (CASTELHANO et al., 2010, 2013 e 2015) e por outros pesquisadores (LUGO et al., 2014, BERNARD; BENK,2015; HOLMES et al. 2015) mostram evidências que ratos adultos submetidos às convulsões neonatais exibem comportamento autista caracterizado pela baixa preferência pela novidade social, déficit de discriminação social e comportamento tipo ansioso (SAYIN et al., 2004; SHI et al., 2007; CASTELHANO et al., 2013, 2015; LUGO et al., 2014). Os mecanismos que respondem por estas alterações ainda não são conhecidos.
1.4. Reconhecimento Social
A interação social no início da vida é crucial para o desenvolvimento de respostas fisiológicas e do comportamento animal, uma vez que favorece a reprodução, proteção contra predadores e mudanças ambientais, além de promover o desenvolvimento do cérebro (VIERO et al., 2010, CUSHING, KRAMER, 2005).
A interação social é entendida como a aproximação de dois ou mais indivíduos que compartilham um mesmo ambiente. Os animais tendem a se manter em um mesmo espaço para obter algumas vantagens como, por exemplo: garantir proteção, alimentação, reprodução, facilitando assim a sua sobrevivência (KEVERNE; CURLEY, 2004). Em ratos, os principais comportamentos sociais observados incluem; cheirar o corpo do animal, cheirar a região genital e o lutar de brincadeira, que também inclui o boxear. Tais interações são essenciais para o desenvolvimento das respostas sociais e cognitivas do animal na idade adulta (TODESCHIN, et al., 2009).
15 duração maior que a da memória operacional, mas menor que uma do tipo espacial ou aversiva (FERGUNSON, 2002).
O reconhecimento social foi estudado em roedores ao longo do tempo e tem sido definido como a capacidade de reconhecer um familiar co-específico ao longo de um período relativamente curto de tempo (BIELSKY; YOUNG, 2004). O reconhecimento social permite que o animal possa reagir adequadamente a estímulos sociais através de uma variedade de contextos que envolvem a detecção, incorporação, integração, reconhecimento e processamento de informações sobre indivíduos da mesma espécie. Ele ocorre pelo simples fato de um animal reconhecer o outro como familiar (MARKHAM, JURASKA, 2007; CLIPPERTON-ALLEN, et al., 2012). Esse processo simples envolve uma série de mecanismos como a detecção inicial do sujeito, pela memória, com a lembrança eventual do encontro posterior (MARKHAM, JURASKA, 2007).
Memória de reconhecimento social pode ser definida por uma diminuição na frequência de investigação social depois de repetidas exposições a um co-específico, esse processo pode ser chamado de "habituação" (THOR, HOLLOWAY, 1982). Com isso o animal passa a reconhecer o outro por memória de encontros anteriores e por isso, a necessidade de investigar mais profundamente o familiar co-específico é reduzida. Este processo tem três características principais: aquisição, retenção e transferência de informação, sua contraparte é o processo de desabituação, resultando em uma rápida recuperação da atividade sensorial inicial de investigação (MONNIER, BOHEMER, SCHOLER, 1976; MOURA, XAVIER, 2010). Esta forma de aprendizagem pode ser modulada por uma variedade de neuropeptídios, como a ocitocina e vasopressina, em diferentes espécies de mamíferos, incluindo seres humanos (MEYER-LINDENBERG et al., 2011).
16 Quando um novo estímulo social é posteriormente apresentado, ocorre o aumento da investigação social pelo animal teste (desabituação; passo 2). Esta desabituação permite descartar que a resposta de habituação foi simplesmente devido a uma perda de interesse para todos os estímulos sociais (ENGELMANN et al., 1995; CHOLERIS et al., 2003).
É bem estabelecido que o reconhecimento social é uma forma única de aprendizagem e de memória que utiliza mecanismos neurais distintos específicos para o processamento social, e é um componente importantíssimo para o “cérebro social” (BIELSKY, YOUNG, 2004). Depois de reconhecido o outro indivíduo como familiar, há uma resposta de investigação olfativa. Desse modo, ratos podem diferenciar membros da colônia, de intrusos, sendo assim muito importante para a demarcação do território e formação de grupos (MOURA, XAVIER, 2010; LUKAS et al., 2011). Em roedores, o reconhecimento de um indivíduo co-específico depende principalmente de pistas de natureza olfativa, da sensibilidade para a mescla de odores que define cada indivíduo, conhecida como sua “assinatura olfativa” (THOR, HOLLOWAY, 1982; BURMAN, MOURA, XAVIER, 2010).
No cérebro de roedores, quando essas assinaturas olfativas se ligam aos receptores expressos pelos neurônios sensoriais do principal epitélio olfativo e do órgão vomeronasal, esses neurônios transmitem a informação sensorial para o bulbo olfatório e bulbo olfatório acessório, respectivamente. Estes se projetam para a amígdala medial que transfere a informação até o hipocampo pelo septo lateral, mas a contribuição de cada uma dessas estruturas no processamento da informação social ainda não está clara (BIELSKY, YOUNG, 2004; GUR, TENDLER, WAGNER, 2014).
Há uma ampla evidência que mostra que a amígdala medial é importante para reconhecimento social (BIELSKY; YOUNG, 2004; CHOLERIS et al., 2007), assim, como é uma estrutura onde a OT (ocitocina) é abundante (FERGUSON et al., 2001), é concebível, então, que as ações de estrogênio e da ocitocina dentro desta estrutura estão envolvidas no reconhecimento social.
17 A Ocitocina (OT) é um neuropeptídio formado por nove aminoácidos cíclicos produzida no núcleo paraventricular (PVN) e no núcleo supra-ótico (SON) do hipotálamo dos mamíferos. A OT atua influenciando um imenso número de funções fisiológicas complexas do sistema nervoso central e periférico. Fisiologicamente, ela é liberada na corrente sanguínea pelo lobo posterior da hipófise, principalmente por exocitose, a partir dos terminais dos neurônios magnocelulares em resposta a vários estímulos e é distribuída pelo cérebro de acordo com mecanismos diferentes para cada estímulo (FERGUSON, YOUNG, INSEL, 2002; VIERO et al., 2010). Esses neurônios também podem atingir outras regiões do cérebro, como o sistema límbico via axônios colaterais ou por populações de neurônios parvocelulares no PVN que atingem regiões como: o septo medial, hipocampo, e a amígdala (LUKAS; NEUMANN, 2013). Além de liberar a OT pelos terminais de axônios como uma neurotransmissora, a liberação central da OT como uma neuromoduladora pode ocorrer tanto a partir de dendritos como do corpo celular, explicando os níveis basais no fluido extracelular de regiões distintas do cérebro (NEUMANN; LANDGRAF, 2012).
No cérebro, a OT é projetada ao longo das projeções axonais para diferentes áreas incluindo o núcleo estriado, o núcleo supraquiasmático, a substância negra, área tegmental ventral, núcleo da rafe, o locus coeruleus e densamente ao longo do tronco cerebral e da medula espinhal, podendo atuar como neuromoduladora ou neurotransmissora, e, assim, influenciar a neurotransmissão nestas áreas (MEYER-LINDENBERG et al., 2011; GORDON et al., 2013; CARSON et al., 2013). As dinâmicas temporal de liberação central e periférica de OT podem diferir substancialmente dependendo do estímulo. Além disso, vários fatores de estresse mostraram que provocam a liberação de OT no hipotálamo e nas regiões límbicas, enquanto a secreção do neuropeptídio no sangue permanece praticamente inalterada (NEUMANN; LANDGRAF, 2012).
18 e tubérculo, no neocórtex, no hipocampo, na amígdala, no núcleo acumbens e no hipotálamo ventromedial (GIMPL; FAHRENHOZ, 2001; LEE et al., 2009). Juntamente com a distribuição regional e densidade de OTR, a quantidade de OT liberada em cada local determina, em grande parte, a atividade do sistema ocitocinérgico no cérebro, contribuindo assim, para a regulação do comportamento emocional e social (NEUMANN; LANDGRAF, 2012).
OT é bem conhecida por seu papel na formação de pares e no cuidado parental (DONALDSON, YOUNG, 2008; INSEL et al., 2010; BARTZ et al., 2010). Contudo, pode também desencadear a agressão materna contra indivíduos de mesma espécie, especialmente contra outros do sexo feminino, isto porque, enquanto OT inibe agressão dirigida aos filhotes, ela pode aumentar simultaneamente ataques contra intrusos (DEBIEC; 2005; PEDERSEN; BOCCIA, 2006). A agressão maternal é estudada em roedores, introduzindo um estranho de ambos os sexos na gaiola da mãe, na presença de seus filhotes (ALMEIDA et al., 2014). Essa agressão materna pode estar associada a baixos níveis de medo (GAMMIE et al, 2004;. LONSTEIN; GAMMIE, 2002).
19 A OT também é liberada durante as relações sociais e sexuais, altas concentrações são detectadas no líquido cérebro-espinhal em ratos machos após a ejaculação. Em fêmeas, injeções de OT aumentam a receptibilidade aos machos, enquanto que injeções do antagonista para o receptor de ocitocina (OTRA) inibe o comportamento sexual (CALIGIONI et al., 2007).
As respostas comportamentais, que são dependentes de estímulos sociais, estão relacionadas com a OT. Evidências em estudos sugerem que as respostas mediadas pela OT aos estímulos sociais de um co-específico familiar levam a interação social (BAUMGARTNER, et al., 2008; FERGUSON et al., 2001).
O papel da OT no reconhecimento social foi confirmado em estudos com camundongos knockout para o OTR, que exibiram prejuízo da memória social (CHOLERIS et al., 2003; TAKAYANAGI et al., 2005). Por outro lado a administração intranasal de OT afeta muitos aspectos da sociabilidade humana, podendo aumentar o olhar em direção à região dos olhos (GAMER et al, 2010; GUASTELLA et al, 2010), proporcionando um maior reconhecimento de expressões faciais (DOMES et al, 2007; SAVASKAN et al, 2008) e comportamentos sociais complexos, como: confiança, avaliação de risco social e empatia (BAUMGARTNER et al, 2008; HURLEMANN et al, 2010; KOSFELD et al, 2005).
Atualmente, estudos de administração intranasal de OT foram realizados em pacientes com vários transtornos psiquiátricos, incluindo os Transtornos do Espectro do Autismo (ANDARI et al., 2010; GUASTELLA et al., 2010), Depressão (PINCUS et al., 2010; MAH et al., 2013), Transtorno de Estresse Pós-Traumático (SENG et al., 2013), Esquizofrenia (AVERBECK et al., 2011; GOLDMAN et al., 2011; PEDERSEN et al., 2011) e Fobia Social (GUASTELLA et al., 2009 ; LABUSCHAGNE et al., 2011). A administração de OT em pacientes com esquizofrenia, melhorou o reconhecimento de emoções (GOLDMAN et al., 2011). A OT pode promover a aproximação social e compreensão social, em pacientes com autismo (ANDARI et al., 2010). Estudos em humanos mostraram que a ocitocina pode estar relacionada a esses comportamentos, pois, quando administrada por via intranasal pode reduzir comportamentos repetitivos em indivíduos com autismo (HOLLANDER et al., 2003).
20 predação) ou oportunidades (por exemplo, reprodução, seleção de habitat) e em todos os casos faz-se necessário avaliar a relevância do estímulo externo e integrá-los com o sistema neurofisiológico e experiências anteriores para configurar uma resposta adaptativa a cada uma das situações que são apresentadas. Neste contexto, dois importantes circuitos neurais exercem um papel crucial, a saber, a rede neural do comportamento social e o sistema de recompensa. A rede neural do comportamento social descrita por Newman (1999) é formada por estruturas reciprocamente conectadas, como hipotálamo anterior, area pré-óptica medial, hipotálamo ventromedial, substância cinzenta periaquedutal, septo lateral e amígdala estendida (leito do núcleo da estria terminal e amígdala medial). O sistema de recompensa é também formado por estruturas reciprocamente conectadas tais como, o septo lateral, núcleo accumbens, estriado, ventral pálido, amígdala lateral, área tegmental ventral e hipocampo. Esses dois circuitos estão interconectados pelo septo lateral e pela amígdala estendida (leito do núcleo da estria terminal e amígdala medial) e ambas as regiões desempenham um papel importante no comportamento social, bem como no processamento da recompensa. A partir do conhecimento dos papéis desempenhados pelas diferentes estruturas, isoladamente ou funcionalmente integradas, e da sinalização neuroquímica envolvida com ambos os sistemas ( por exemplo, ocitocina, dopamina e vasopressina), O’CONNELL e HOFMANN (2011) propôs que ambos os circuitos formam uma rede ampla de tomada de decisão social, denominada em inglês de social decision-making (SDM) que regula o comportamento adaptativo. Os comportamentos sociais são complexos porque exigem a integração de processos emocionais, cognitivos e motivacionais ea atividade da rede codifica as informações sociais de uma forma altamente dinâmica, de tal maneira que o comportamento social adaptativo é mais fortemente dependente do padrão de atividade da rede, do que da atividade de locus individuais (GOODSON; KABELIK, 2009).
21 2. Hipótese
22 3. Objetivos
3.1. Objetivo Geral
Avaliar a memória de reconhecimento social e a expressão gênica da ocitocina (OT), do receptor de OT (OTR) em animais submetidos ao status epilepticus neonatal. 3.2. Objetivos Específicos
Comparar a memória de reconhecimento social entre os animais controles e os submetidos ao status epilepticus neonatal.
23 4. Método
4.1. Animais
Foram utilizados ratos Wistar machos adultos submetidos ao status epilepticus neonatal aos 9 dias pós-natal e controles que receberam salina 0.9%. Com o intuito de reduzir o uso de animais, segundo a lei Arouca - nº 11.794, de 8 de Outubro de 2008, foram utilizados os animais do projeto de pesquisa previamente aprovado pelo CEUA (106/02/2014) da Universidade Presbiteriana Mackenzie. Foram utilizados 16 animais do grupo controle e 17 experimentais que foram mantidos no Biotério Central do Centro de Ciências Biológicas e da Saúde (CCBS) da Universidade Presbiteriana Mackenzie.
4.2 Indução de Status Epilepticus (SE)
Ratos Wistar machos com 9 dias pós-natal, que corresponde o período de neonato a termo (HALOPAINEN, 2008) foram divididos aleatoriamente em 2 grupos. O grupo experimental recebeu pilocarpina (350 mg/kg, ip) e grupo controle recebeu salina 0,9% (0,1 mL/10 g) (CASTELHANO et al., 2010, 2013, 2015). Quatro horas após a indução do status epilepticus os animais retornaram para as respectivas gaiolas.
4.3. Teste de memória social
24 uma solução de etanol 5%, a fim de evitar possíveis rastros de odor deixados pelo sujeito anterior.
Fig. 1- Protocolo do teste comportamental (habituação/desabituação).
O protocolo utilizado foi adaptado do descrito por Guan e Dluzen (1994). Para habituação com o ambiente do teste, o animal foi colocado no centro de uma arena circular de acrílico branco com 60 cm de diâmetro x 50 cm de altura (Insight Ltda, Brasil) concomitantemente com uma caixa de acrílico (23.5 cm x 21 cm x 32 cm) contendo pequenos orifícios para permitir detecção das pistas olfativas, vazia. Após esse período, deu-se início ao teste. Para a primeira exposição, um rato adulto, desconhecido (estímulo social), foi introduzido dentro da caixa de acrílico por 3 minutos. O procedimento foi repetido 3 vezes (S1 –S3) com intervalos de 6 minutos. Nos intervalos, o animal teste foi removido da arena, e o equipamento foi limpo com etanol 5%. Nas duas sessões subsequentes (S4-S5), um novo animal estímulo da mesma idade do anterior foi utilizado. Foram mensurados o tempo dos contatos olfativos entre os animais. Ao final do teste de memória social os animais foram anestesiados e decapitados, os cérebros de 5 animais do grupo controle e 5 animais do grupo experimental foram dissecados para a análise da expressão gênica os demais foram armazenados para análises futuras.
4.4. Análise de Expressão Gênica
26 4.4.2. Eletroforese em gel de Agarose e Quantificação
Após a extração do RNA foi realizada uma eletroforese em gel de agarose para a determinação da presença do RNA. Para isso foi preparado o gel de agarose a 1% (1gr de agatose, 100 ml de solução tampão diluída 10x, 1µL de Brometo). O gel foi preparado e deixado polimerizando previamente. Para a corrida em gel foram utilizados 2µl de amostra em 2µl de loading. Para o marcador foi adicionado 2µl de tampão em 2µl de loading. O gel foi acomodado na cuba e as amostras foram colocadas uma em cada poço sendo o primeiro poço do marcador. A fonte de eletroforese (Biotech ESP 301 e ESP 1001) foi acertada para 20 minutos de corrida ( 395 A, 100 W, 9V). Após a corrida, o gel foi levado à um Transiluminador UV (Uvitec Cambridge - software FireReader) onde foi fotografado.
Após a constatação da presença de RNA, foi realizada a quantificação no Nanodrop (ThermoScientific ND-8000). O equipamento foi limpo com H20 MiliQ, e a mesma água foi utilizada para quantificar o branco. Após a quantificação do branco, o software da maquina foi configurado para quantificação de RNA e as amostras foram identificadas. Então, foi utilizado 2µl de cada amostra para a quantificação. Após a quantificação os valores foram salvos. O RNA foi armazenado em freezer -80°C.
4.4.3. Transcrição Reversa
27 os tubos foram colocados no termociclador (Biometra T3000) com a seguintes condições de ciclagem: 10 min à 25°C, 120 min à 37°C, 5 min à 85°C e mantidos a 4°C ao fim da reação. Após o tempo de ciclagem o cDNA foi armazenado no freezer -20°C.
4.4.4. PCR de tempo real
Para a realização do PCR de tempo real as placas (MicroAmp® Optical 96-Well Reaction Plate - Applied Biosystems®) foram montadas da seguinte forma: 18µl de Mix mais 2µl de cDNA. O Mix foi preparado utilizando os seguintes componentes por amostra: 10µl de TaqMan® Universal Master Mix II, with UNG , 1µl TaqMan® Gene Expression Assay, 7µl de H2O RNAse-free. Os primers utilizados foram: A placa foi montada em triplicata para cada amostra, cada placa foi realizada com um tecido para 2 genes (OT e OTR) mais o endógeno (GAPDH). Após a montagem da placa a mesma foi selada e centrifugada (centrifuga Eppendorf 5810) para eliminar possíveis bolhas de ar. Então, o software da máquina foi configurado para os seguintes parâmetros de ciclagem: 2 min à 50°C, 10 Min à 95°C e depois 40 ciclos de: 15 seg à 95°C e 1 min à 60°C. Ao final da ciclagem os dados foram coletados e salvos para análise. Por fim, os valores referentes à amplificação do mRNA de cada um dos genes analisados foram determinados por meio de métodos de fluorescência e quantificados por um termociclador e detector ThermoScientific 7500 Real-time System.
4.5. Análise Estatística
28 5. Resultados
5.1. Teste de Memória Social
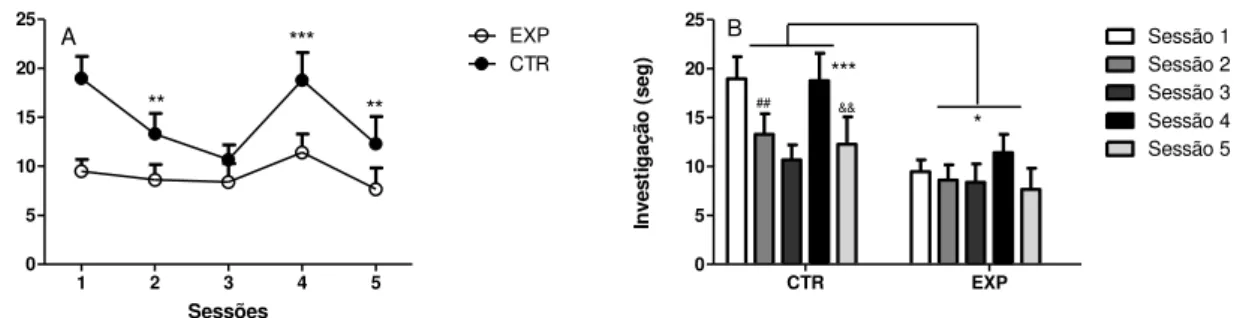
A Anova Mista revelou diferença significante entre os grupos (F(1,124)=5,64, p= 0,0239) e entre as sessões F(4,124)= 7,604, p<0,0001), mas sem interação entre os fatores (F(4, 124) = 2,267, p=0,0657). O grupo controle exibiu memória de reconhecimento social, uma vez que observamos redução gradativa do tempo de investigação mediante a exposição seriada ao mesmo animal (sessão 1-3), e aumento do tempo de investigação na presença da novidade social (sessão 4). O grupo experimental exibiu menor interesse em explorar o animal não familiar comparativamente ao grupo controle, bem como não exibiu redução significante no tempo de investigação no decorrer da exposição seriada ao mesmo animal, tampouco aumento significante da investigação na presença da novidade social. Os dados sugerem que os animais do grupo experimental apresentam menor motivação para iniciar o contato social, bem como prejuízo na memória de reconhecimento social.
1 2 3 4 5
0 5 10 15 20 25 EXP CTR *** ** ** A Sessões In ve st ig aç ão ( se g ) CTR EXP 0 5 10 15 20 25 Sessão 1 Sessão 2 Sessão 3 Sessão 4 Sessão 5 B * ## *** && In ve st ig aç ão ( se g ) Habituação /Desabituação
Fig. 2 –Teste de habituação/desabituação, representada como média + erro padrão, para grupos controle (n=16) e experimental (n=17).
5.2. PCR em tempo real
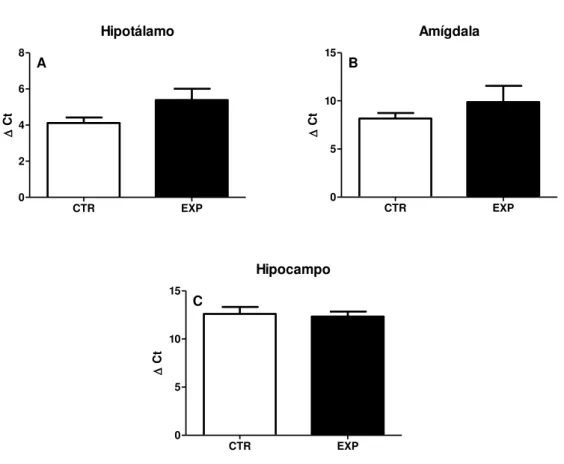
29 , t(8) = 0,53, p=0,61), hipotálamo (t(8) = 0,82, p= 0,10 ) e amígdala (t(8) = 0,81, p= 0,43.), fig 3 A,B e C.
Hipotálamo
CTR EXP
0 2 4 6 8
A
C
t
Amígdala
CTR EXP
0 5 10 15
B
Ct
Hipocampo
CTR EXP
0 5 10 15
C
Ct
Expressão da Ocitocina
Fig. 3- Expressão do RNAm da ocitocina representados como média + epm no hipotálamo (A), amígdala (B) e hipocampo (C) de 5 animais por grupo. Não foram observadas diferenças entre os grupos nas estruturas analisadas.*, p= 0,04.
30 Hipotálamo
CTR EXP
0 2 4 6 8 10
A
Ct
Amígdala
CTR EXP
0 5 10 15
B
Ct
Hipocampo
CTR EXP
0 5 10 15
C
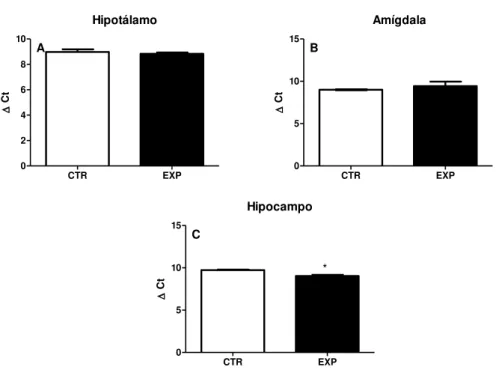
*
Ct
Expressão do Receptor de Ocitocina
31 6. Discussão
Esse trabalho investigou o envolvimento do sistema ocitocinérgico por meio da expressão dos RNAm da ocitocina e do seu receptor em estruturas relevantes desta rede (hipotálamo, hipocampo e amígdala) e a memória de reconhecimento social em animais expostos ao SE neonatal e que exibem comportamento autista de acordo com pesquisas do nosso grupo (CASTELHANO et al., 2010, 2013 e 2015, LEITE et al., 2016) e de grupos independentes (LUGO et al., 2014, BERNARD; BENK,2015; HOLMES et al. 2015). Os resultados monstraram que os animais expostos ao SE neonatal apresentaram menor tempo de exploração e prejuízo de habituação/desabituação frente às repetidas exposições ao estímulo social, sugerindo que a existência de um prejuízo no circuito de motivação/recompensa e na memória de reconhecimento social. Os resultados também demonstraram que a expressão do RNAm da ocitocina não diferiu entre os grupos nas estruturas analisadas, porém observamos uma pequena redução na expressão gênica do receptor somente no hipocampo, sugerindo o envolvimento do sistema ocitocinérgico nos prejuízos observados contudo, realçamos a necessidade de se avaliar a expressão das proteínas nas estruturas analisadas.
32 apresentaram baixa motivação pela novidade, isto porque o tempo de investigação em cada sessão foi menor nos animais experimentais em comparação com os controles.
As experiências emocionais positivas durante a interação social é uma característica importante das relações sociais. A recompensa social e o apego são cruciais para o bem-estar emocional, e deficiências neste domínio constituem um elemento importante nos transtornos psiquiátricos, como o autismo, esquizofrenia e transtornos de personalidade (AMERICAN PSYCHIATRIC ASSOCIATION, 2000). No entanto, os mecanismos neurais que medeiam as propriedades de recompensa das interações sociais não são totalmente compreendidos, apesar do amplo conhecimento
a cerca do papel da dopamina e da ocitocina.
Os déficits na sociabilidade em indivíduos com TEA, tem sido atribuídos a hipótese da baixa motivação social, na qual há falta de motivação para o engajamento em atividades sociais por serem menos gratificantes, uma vez que em indivíduos com autismo as áreas do sistema de recompensa são menos ativadas por estímulos sociais do que no grupo com desenvolvimento típico (STAVROPOULOS; CARVER, 2013). A ocitocina participa deste circuito e interage estreitamente com as vias neurais responsáveis pelo processamento de estímulos motivacionais relevantes (GORDON, et al., 2011). A ocitocina estimula a via dopaminérgica mesocorticolímbica, que é crucial para a recompensa e o comportamento motivado (LOVE, 2014). A alteração na expressão gênica do receptor de OT no hipocampo pode somente ter prejudicado a memória de reconhecimento social bem como ter reduzir a ativação do núcleo accumbens e a relevância do estímulo.
pré-frontal-33 estriado. Menores níveis de dopamina e seus metabólitos foram mensurados no estriado e no córtex pré-frontal. Esse trabalho também demonstrou que os animais submetidos ao SE neonatal apresentaram maior sensibilização a metanfetamina na adolescência, o que é compatível o com prejuízo no sistema de recompensa mesolímbico.
O sistema opioidérgico está também envolvido da rede de tomada de decisão social, embora a sua sinalização seja menos explorada e conhecida comparativamente a ocitocina, vasopressina e dopamina. SMITH et al., (2015) demonstraram que o bloqueio dos receptores opióide do tipo µ, reduziu o tempo de investigação direcionada a novidade social sem alterar o tempo de investigação direcionada a um co-específico do mesmo núcleo social. Argumentamos que o sistema opioidérgico pode estar envolvido nas alterações comportamentais observadas no nosso modelo. Os animais expostos ao SE neonatal apresentam comportamento do tipo ansioso (CASTELHANO et al., 2013, 2015) e recentemente demonstramos que o controle da ansiedade pelo tratamento prévio com diazepam não minimizou o déficit de discriminação social, embora tenha reduzido comportamento relacionado a ansiedade (Leite et al., 2016). Levando-se em conta, que os receptores opióides µ exercem um papel relevante na modulação do medo e da ansiedade, e que a morfina quando administrada no núcleo accumbens, hipocampo ventral ou no septo lateral reduz o comportamento relacionado à ansiedade (LE MERRER et al., 2007, ZARRINDAST et al., 2008) e que o antagonista do receptor quando administrado na amígdala central produz efeito oposto (WILSON e JUNOR, 2008), é lícito argumentar que redução da sinalização media pelo sistema opioidérgico possa contribuir para a expressão do comportamento do tipo ansioso e para o prejuízo da sociabilidade. Corroborando com esta hipótese, BAUSCH e CHAVKIN (1997) relataram redução da imunoreatividade dos receptores opioide µ no hilo e na camada granular no giro denteado no modelo animal de epilepsia do lobo temporal. Estudos futuros precisam ser conduzidos para confirmar ou refutar essa hipótese no modelo do SE neonatal.
34
prejuízo da sociabilidade neste modelo, estudos futuros deveram explorar o sistema opioidérgico, dopaminérgico e vasopressinérgico.
35 7. Conclusão
36 Referências
ACHTERBERG, E.J.M.; VAN KERKHOF L.W.M.; SERVADIO, M.; VAN SWIETEN, M.M.H.; HOUWING, D.J.; AALDERINK, M.; DRIEL, N.V.; TREZZA, V.; VANDERSCHUREN, L.J.M.J. Contrasting Roles of Dopamine and Noradrenaline in the Motivational Properties of Social Play Behavior in Rats. Neuropsychopharmacology, v. 41, n.3, p; 858-68, 2016.
ALBERS, H.E. The regulation of social recognition, social communication and aggression: Vasopressin in the social behavior neural network. Hormones And Behavior, v. 61, n. 3, p.283-292, mar. 2012.
ALMEIDA, R.M.de; FERREIRA, A.; AGRATI, D. Sensory, hormonal, and neural basis of maternal aggression in rodents. Current topics in behavioral neurosciences, v. 17, p. 111-130, 2014.
ANDARI, E.; DUHAMEL, J.; ZALLA, T.; HERBRECHT, E.; LEBOYER, M.; SIRIGU, A. Promoting social behavior with oxytocin in high-functioning autismo spectrum disorders. Proceedings Of The National Academy Of Sciences, v. 107, n. 9, 4389– 4439, 16 de fev 2010.
AVERBECK, B. B.; BOBIN, T.; EVANS, S.; SHERGILL, S.S.. Emotion recognition and oxytocin in patients with schizophrenia. Psychological Medicine, v. 42, n. 02, p.259-266, 11 ago. 2011.
BARTZ, J.A.; ZAKI, J.; OCHSNER, K.N.; BOLGER, N.; KOLEVZON, A.; LUDWIG, N.; LYDON, J.E. Effects of oxytocin on recollections of maternal care and closeness.
Proceedings Of The National Academy Of Sciences, v. 107, n. 50, p.21371-21375,
29 nov. 2010.
BAUSCH, S.B.; CHAVKIN, C. Changes in hippocampal circuitry following pilocarpine-induced seizures as revealed by opioid receptor distribution and activation. J. Neuroscience, v. 17, p. 477–492, 1997.
37
BEN-ARI, Y. Excitatory actions of GABA during development: the nature of the nurture. Nature Reviews Neuroscience, v. 3, n. 9, p.728-739, set. 2002.
BEN-ARI, Y.; HOLMES, G. Effects of seizures on developmental processes in the immature brain. The Lancet Neurology, v. 5, n. 12, p. 1055-1063, 2006.
BERG, A.T.; PLIOPLYS, S. Epilepsy and autism: is there a special relationship? Epilepsy and Behavior, v. 23, n.3, p. 193-198, 2012.
BERNARD, P.B.; CASTANO, A.M.; BEITZEL, C.S.; CARLSON, V.B.; BENKE, T.A. Behavioral changes following a single episode of early-life seizures support the latent development of an autistic phenotype. Epilepsy and Behavior, v. 44, p. 78-85, 2015. BERNARD, P.B.; BENKE, T.A. Early life seizures: evidence for chronic deficits linked to autism and intellectual disability across species and models. Experimental neurology, v. 263, n. 1, p. 72-78, 2015.
BIELSKY, I.F.; YOUNG, L.J.. Oxytocin, vasopressin, and social recognition in mammals. Peptides, v. 25, n. 9, p.1565-1574, set. 2004.
BOS, P.A.; PANKSEPP, J.; BLUTHÉ, R.; VAN HONK, J. Acute effects of steroid hormones and neuropeptides on human social–emotional behavior: A review of single administration studies. Frontiers In Neuroendocrinology, v. 33, n. 1, p.17-35, jan. 2012.
BROOKS-KAYAL, A. Epilepsy and autism spectrum disorders: are there common developmental mechanisms? Brain and Development, v.32, n. 9, p. 731–738, 2010.
CALIGIONI, G.S.; OLIVER, C.; JAMUR, M.C.; FRANCI, C.R. Presence of oxytocin receptors in the gonadotrophin-releasing hormone (GnRH) neurons in female rats: a possible direct action of oxytocin on GnRH neurones. Journal of
Neuroendocrinology, v. 19, n.6, p. 439-448, 2007.
CARSON, D. S.; GUASTELLA, A.J.; TAYLOR, E.R.; MCGREGOR, I.S. A brief history of oxytocin and its role in modulating psychostimulant effects. Journal Of
Psychopharmacology, v. 27, n. 3, p.231-247, 23 jan. 2013.
38 CASTELHANO, A.S.S; RAMOS, F.O.; SCORZA , F.A. Early life seizures in female rats lead to anxiety-related behavior and abnormal social behavior characterized by reduced motivation to novelty and deficit in social discrimination. Journal Of Neural
Transmission, v. 122, n. 3, p.349-355, 2015.
CASTELHANO, A.S.; SCORZA, F.A.; TEIXEIRA, M. C.; ARIDA, R. M.; CAVALHEIRO, E. A.; CYSNEIROS, R. M. Social play impairment following status epilepticus during early development. Journal Of Neural Transmission, v. 117, n. 10, p.1155-1160, 15 ago. 2010.
CELEC, P.; OSTATNIKOVA, D.; HODOSY, J. On the effects of testosterone on brain behavioral functions. Frontiers of Neuroscience, v. 9, n. 12, p. 1-17, 2015.
CHOLERIS, E.; GUSTAFSSON, J.A.; KORACH, K.S.; MUGLIA, L.J.; PFAFF, D.W.; OGAWA, S. An estrogen-dependent four-gene micronet regulating social recognition: A study with oxytocin and estrogen receptor- and - knockout mice. Proceedings Of
The National Academy Of Sciences, v. 100, n. 10, p.6192-6197, 2 maio 2003.
CHOLERIS, E.; LITTLE, S.R.; MONG, J.A.; PURAM, S.V.; LANGER, R.; PFAFF, D.W. Microparticle-based delivery of oxytocin receptor antisense DNA in the medial amygdala blocks social recognition in female mice. Proceedings Of The National Academy Of Sciences, v. 104, n. 11, 2007.
CLIPPERTON-ALLEN, A.E.; LEE, A.W.; REYES, A.; DEVIDZE, N.; PHAN, D.W.; PFAFF, D.W.; CHOLERIS, E. Oxytocin, vasopressin and estrogen receptor gene expression in relation to social recognition in female mice. Pshyology & Behavior, v. 105, n. 4, p. 915-924, 2012.
CORNEJO, B.J.; MESCHES, M.H.; COULTRAP, S.; BROWNING, M.D.; BENKE, T.A.
A single episode of neonatal seizures permanently alters glutamatergic synapses. Annals Of Neurology, v. 61, n. 5, p.411-426, maio 2007.
CRAWLEY, J.N. Mouse behavioral assays relevant to the symptoms of autism.
Brain Pathol, v. 17, n. 4, p. 448-459, 2007.
CRESPI, B.J. Oxytocin, testosterone, and human social recognition. Biological
39 CUSHING, B.S.; KRAMER, K.M. Mechanisms underlying epigenetic effects of early social experience: The role of neuropeptides and steroids. Neuroscience &
Biobehavioral Reviews, v. 29, n. 7, p.1089-1105, 2005.
DEBIEC, J. Peptides of love and fear: vasopressin and oxytocin modulate the integration of information in the amygdala. Bioessays, v. 27, n. 9, p. 869-873, 2005.
DOMES, G.; HEINRICHS, M.; GLASCHER, J.; BUCHEL, C.; BRAUS, D.F.; HERPERTZ, S.C. Oxytocin Attenuates Amygdala Responses to Emotional Faces Regardless of Valence. Biological Psychiatry, v. 62, n. 10, p.1187-1190, nov. 2007.
DONALDSON, Z.R.; YOUNG, L.J. Oxytocin, vasopressin, and the neurogenetics of sociality. Science, v. 322, n. 5903, p. 900-904, 2008.
ENGELMANN, M.; WOTJAK, C.T. NEUMANN, I.; LUDWIG, M.; LANDGRAF, R. Behavioral Consequences of Intracerebral Vasopressin and Oxytocin: Focus on Learning and Memory. Neuroscience & Biobehavioral Reviews, v. 20, n. 3, p.341-358, jan. 1996.
ENGELMANN, M.; WOTJAK, C.T.; LANDGRAF, R.. Social discrimination procedure: An alternative method to investigate juvenile recognition abilities in rats. Physiology & Behavior, v. 58, n. 2, p.315-321, ago. 1995.
FABBRONI, B.L.; CYSNEIROS, R.M. As crises neonatais produzem efeitos neurológicos deletérios de longo prazo: Evidências clínicas e experimentais. Cadernos de Pós-Graduação em Distúrbios do Desenvolvimento, v.14, n. 2, p. 85-94, 2014.
FEBO, M., FERRIS, F.C. Oxytocin and vasopressin modulation of the neural correlates of motivation and emotion: results from functional MRI studies in awake rats. Brain Research, n. 1 5 8 0, p. 8 – 2 1, 2014.
FERGUNSON, J.N,; ALDAG, J.M., INSEL, T.R.; YOUNG, L.J. Oxytocin in the medial amygdala is essential for social recognition in the mouse. Journal of Neuroscience, n. 21, v. 20, p. 8278-8285, 2001.
40 FINK, J.S.; SMITH, G.P. Mesolimbicocortical dopamine terminal fields are necessary for normal locomotor and investigatory exploration in rats. Brain Research, v. 199, n. 2, p. 359-384, 1980.
FRIEDMAN, L.; HU, S. Early-life seizures in predisposing neuronal preconditioning: a critical review. Life sicences, v. 94, n. 1, p. 92-98, 2014.
GAMER, M.; ZUROWSKI, B.; BUCHEL, C.. Different amygdala subregions mediate valence-related and attentional effects of oxytocin in humans. Proceedings Of The
National Academy Of Sciences, v. 107, n. 20, p.9400-9405, 26 abr. 2010.
GAMMIE, S.C.; HASEN, N.S.; STEVERSON, S.A.; BALE, T.L.; D’ANNA, K.L. Elevated
stress sensitivity in corticotropin-releasing factor receptor 2 deficient mice decreases maternal, but not intermale aggression. Behavior and Brain Research, v. 160, n. 1, p. 169-177, 2005.
GARFINKLE, J.; SHEVELL, M. I.. Predictors of Outcome in Term Infants With Neonatal Seizures Subsequent to Intrapartum Asphyxia. Journal Of Child Neurology, v. 26, n. 4, p.453-459, 26 jan. 2011.
GIMPL, G.; FAHRENHOLZ, F. The Oxytocin Receptor System: Structure, Function, and Regulation. Physiological Reviews, v. 81, n. 2, p. 629-683, 2001.
GOLDMAN, M.B.; GOMES, A.M.; CARTER, C.S.; LEE, R. Divergent effects of two different doses of intranasal oxytocin on facial affect discrimination in schizophrenic patients with and without polydipsia. Psychopharmacology, v. 216, n. 1, p.101–110, 2011.
GOODSON, J.L.; KABELIK, D. Dynamic limbic networks and social diversity in vertebrates: from neural context to neuromodulatory patterning. Front Neuroendocrinol. v. 4, p. 429-441, 2009.
41
GORDON, I.; Carina Martin Ruth Feldman , and James F. Leckman. Oxytocin and Social Motivation. Dev Cogn Neurosci. v. 1, n. 4, p. 471-493, 2011.
GORKA, S.M.; FITZGERALD, D.A.; LABUSCHAGNE, I.; HOSANAGAR, A.; WOOD, A.G.; NATHAN, P.J.; PHAN, K.L. Oxytocin modulation of amygdala functional connectivity to fearful faces in generalized social anxiety disorder.
Neuropshychopharmacology, v.40, n.2, 0. 278-286, 2015.
GUAN, X.; DLUZEN, D.E. Age related changes of social memory/recognition in male Fisher 344 rats. Behavior and Brain Research, v. 61, n. 1, p. 88-90, 1994.
GUASTELLA, A.J.; EINFELD, S.L.; GRAY, K.M.; RINEHART, N.J.; TONGE, B.J.; LAMBERT, T.J.; HICKIE, I.B. Intranasal Oxytocin Improves Emotion Recognition for Youth with Autism Spectrum Disorders. Biological Psychiatry, v. 67, n. 7, p.692-694, abr. 2010.
GUASTELLA A.J.; HOWARD A.L.; DADDS M.R.; MITCHELL P.; CARSON D.S. A randomized controlled trial of intranasal oxytocin as an adjunct to exposure therapy for social anxiety disorder. Psychoneuroendocrinology, v. 34, n. 6, p.917-923, jul. 2009.
GUR, R.; TENDLER, A.; WAGNER, S. Long-term social recognition memory is mediated by protein synthesis and oxytocin-dependent LTD in the medial amygdala. Biological Psychiatry, v.76, n.5, p. 377-86, 2014.
HEINRICHS, M; DOMES, G. Neuropeptides and social behaviour: effects of oxytocin and vasopressin in humans. Progress In Brain Research, p.337-350, 2008.
HERNAN, A.E.; ALEXANDER, A.; JENKS, K.R.; BARRY, J.; LENCK-SANTINI, P.P.; ISAEVA, E.; HOLMES, G.L.; SCOTT, R.C. Focal epileptiform activity in the prefrontal cortex is associated with long-term attention and sociability deficits. Neurobiology of disease, v. 63, p. 25-34, 2014.
42 HOLLANDER, E.; BARTZM J.; CHAPLIN, W.; PHILLIPS, A.; SUMNER, J.; SOORYA, L.; ANAGNOSTOU, E.; WASSERMAN, S. Oxytocin Increases Retention of Social Cognition in Autism. Biological Psychiatry, v. 61, n. 4, p.498-503, fev. 2007.
HOLMES, G.L.. Effects of Seizures on Brain Development: Lessons from the Laboratory. Pediatric Neurology, v. 33, n. 1, p.1-11, jul. 2005.
HOLMES, G.L.; GAIRSA, J.L.; CHEVASSUS-AU-LOUIS, N.; BEN-ARI, Y. Consequences of neonatal seizures in the rat: morphological and behavioral effects.
Annals of neurology, v. 44, n. 6, p. 845-857, 1998.
HOLMES, G.L.; TIAN, C.; HERNAN, A.E.; FLYNN, S.; CAMP, D.; BARRY, J. Alterations in sociability and functional brain connectivity caused by early-life seizures are prevented by bumetanide. Neurobiology of disease, v. 77, p. 204-219, 2015.
HUANG, L.; CILIO, M.R.; SILVEIRA, D.C.; MCCABE, B.K.; SOGAWA, Y, STAFSTROM, C.E.; HOLMES, G.L. Long-term effects of neonatal seizures: a behavioral, eletrophysiological, and histological study. Brain Research.
Developmental brain research, v. 118, n. 1-2, p. 99-107, 1999.
HUANG, LT.; TAIN, Y.L.; LAI, MC.; Y, SN. Neonatal seizures: Dialogues between clinic and bench. Journal Of The Formosan Medical Association, v. 111, n. 5, p.239-244, maio 2012.
HUANG, Y.H.; YANG, T.M.; LIN, Y.J.; TSAI, N.W.; LIN, W.C.; WANG, H.C.; CHANG, W.N.; LU, C.H. Risk factors and outcome of seizures after chronic subdural hematoma.
Neurocrit Care, v. 14, n. 2, p. 253-259, 2011.
HURLEMANN, R., PATIN, A., ONUR, O. A., COHEN, M. X., BAUMGARTNER, T., METZLER, S., DZIOBEK, I.; GALLINAT, J.; WAGNER, M.; MAIER, W.; KENDRICK, K.M. Oxytocin enhances amygdala-dependent, socially reinforced learning and emotional e empathy in humans. Journal of Neuroscience, v. 30, n. 14, p.4999–5007, 2010.
43 IVELL, R.; RICHTER, D. Structure and comparison of the oxytocin and vasopressina genes from rat. Proceedings Of The National Academy Of Sciences, v.81, n. 1, p. 2006-2010, abril de 1984.
ISAEVA, E.; ISAEV, D.; SAVRASOVA, A.; KHAZIPOV, R.; HOLMES, G.L. Recurrent neonatal seizures result in long-term increases in neuronal network excitability in the rat neocortex. The European Journal of Neuroscience, v. 31, n. 8, p. 1446-1455, 2010.
JENSEN; E.V.; JACOBSON, H.I. Basic guides to the mechanism of estrogen action. Recent Prog. Horm. Res. n. 18, 1962.
JENSEN, F.E. Epilepsy as a spectrum disorder: Implications from novel clinical and basic neuroscience. Epilepsia, v. 52, Suppl 1, p.1–6, 2011.
JENSEN, F.E. Acute and chronic effects of seizures in the developing brain: experimental models. Epilepsia, v.40, suppl. 1, n. S51–S58, 1999.
KEVERNE, E.B; CURLEY, J.P. Vasopressin, oxytocin and social behaviour. Current
Opinion In Neurobiology, v. 14, n. 6, p.777-783, dez. 2004.
KLEEN, J.K.; WU, E.X.; HOLMES, G.L.; SCOTT, R.C.; LENCK-SANTINI, P.P. Enhanced oscillatory activity in the hippocampal-prefrontal network is related to short-term memory function after early-life seizures. The Journal of Neuroscience, v. 31, n. 43, p. 15397-15406, 2011.
KOSFELD, M.; HEINRICHS, M.; ZAK, P.J.; FISCHBACHER, U.; FEHR, E. Oxytocin increases trust in humans. Nature, v. 435, n. 7042, p.673-676, 2 jun. 2005.
KUIPER, G.G.; ENMARK, W.; PELTO-HUIKKO, M.; NILSSON, S.; GUSTAFSSON, J.A. Cloning of a novel receptor expressed in rat prostate and ovary. Proceedings Of The National Academy Of Sciences, v. 93, n.1, p.5925-5930, Junho de 1996.
LABUSCHAGNE, I.; PHAN, K.L.; WOOD, A.; ANGSTADT, M.; CHUA, P.; HEINRICHS, M.; STOUT, J.C.; NATHAN, P.J. Medial frontal hyperactivity to sad faces in generalized social anxiety disorder and modulation by oxytocin. Int J
44 LAI, Y.H.; HO, C.S.; CHIU, N.C.; TSENG, C.F.; HUANG, Y.L. Prognostic Factors of Developmental Outcome in Neonatal Seizures in Term Infants. Pediatrics &
Neonatology, v. 54, n. 3, p.166-172, jun. 2013.
LAI, W.S.; RAMIRO, L.L.; YU, H.A.; JOHNSTON, R.E. Recognition of familiar individuals in golden hamsters: a new method and functional neuroanatomy. The
Journal of Neuroscience, v. 25, n. 49, p. 11239-11247, 2005.
LEE, H.J.; MACBETH, A.H.; PEGANI, J.H.; YOUNG, W.S.3rd. Oxytocin: The Great Facilitator of Life. Progress In Neurobiology, v.88, n.2, p.127-151, 10 abr. 2009.
LEITE, I.S.; CASTELHANO, A.S.S.; CYSNEIROS, R.M. Effect of diazepam on sociability of rats submitted to neonatal seizures. Data in Brief, n. 7, p. 686-691, 2016. LE MERRER, J.; CAGNIARD, B.; CAZALA, P. Modulation of anxiety by mu-opioid receptors of the lateral septal region in mice. Pharmacol Biochem Behav, v. 83, p. 465–479, 2007.
LEONIBUS, E.DE; VERHEIJ, M.M.M.; MELE, A.; COOLS, A. Distinct kinds of novelty processing differentially increase extracellular dopamine in different brain regions. European Journal of Neuroscience, Vol. 23, pp. 1332–1340, 2006.
LIN, T.C.; HUANG, L.T.; HUANG, Y.N.; CHEN, G.S.; WANG, J.Y. Neonatal Status epilepticus alters prefrontal-striatal circuitry and enhances methamphetamine-induced behavioral sensitization in adolescence. Epilepsy Behav., v.14, n.2, p. 316-323, 2009. LONSTEIN, J.S.; GAMMIE, S.C. Sensory, hormonal, and neural control of maternal aggression in laboratory rodents. Neuroscience and behavioral reviews, v. 26, n. 8, p. 869-888, 2002.
LOVE, T. M. Oxytocin, motivation and the role of dopamine. Pharmacology Biochemistry and Behavior, v. 119, p. 49–60, 2014.
LOWENSTEIN, D.H.; BLECK, T.; MACDONALD, R.L. It’s time to revise the definition
of status epilepticus. Epilepsia, v. 40, n.1, 0. 120-122, 1999.
45 LUKAS, M.; NEUMANN, I.D. Oxytocin and vasopressin in rodent behaviors related to social dysfunctions in autism spectrum disorders. Behavior and Brain Research, v. 251, p. 85-94, 2013.
LUKAS, M.; TOTH, I.; REBER, S.O.; SLATTERY, D.A.; VEENEMA, A.H.; NEUMANN, I.D. The Neuropeptide Oxytocin Facilitates Pro-Social Behavior and Prevents Social Avoidance in Rats and Mice. Neuropsychopharmacology, v. 36, n. 11, p.2159-2168, 15 jun. 2011.
MAH, B.L.; VAN IJZENDOORN, M.H.; SMITH, R.; BAKERMANS-KRANENBURG, M.J. Oxytocin in postnatally depressed mothers: its influence on mood and expressed emotion. Prog Neuropsychopharmacol Biol Psychiatry, v. 40, p. 267-272, 2013. MANDUCA, A.; SERVADIO, M.; DAMSTEEGT, R.; CAMPOLONGO, P.; VANDERSCHUREN, L.J.; TREZZA, V. Dopaminergic Neurotransmission in the Nucleus Accumbens Modulates Social Play Behavior in Rats. Neuropsychopharmacology, 2016.
MARKHAM, J.A.; JURASKA, J.M. Social recognition memory: Influence of age, sex, and ovarian hormonal status. Physiology & Behavior, v. 92, n. 5, p.881-888, dez. 2007.
MATSUZAKI, T.; IWASA, T.; MUNKHZAYA, M.; TUNGALAGSUVD, A.; KAWAMI, T.; MURAKAMI, M.; YAMASAKI, M.; YAMAMOTO, Y.; KATO, T.; KUWAHARA, A.; YASUI, T.; IRAHARA, M. Developmental changes in hypothalamic oxytocin and oxytocin receptor mRNA expression and their sensitivity to fasting in male and female rats. International Journal Of Developmental Neuroscience, v. 41, p.105-109, abr. 2015.
MCCARTHY, M.M.; The two faces of estradiol: effects on the developing brain. The
Neuroscientist, v. 15, n. 6, p. 599-610, 2009.
46
MONNIER, M.; BOEHMER, A.; SCHOLER, A.. Early habituation, dishabituation and generalization induced in the visual centres by colour stimuli. Vision Research, v. 16, n. 12, p.1497-1504, jan. 1976.
MOURA, P.J.; XAVIER, G.F. Memória de Reconhecimento Social em Ratos. Psicologia USP, v.21, n. 2,p.355-389, 2010.
MORGAN, M.A.; SCHULKIN, J,. PFAFF, D.W. Estrogens and non-reproductive behaviors related to activity and fear. Neuroscience & Biobehavioral Reviews, v. 28, n. 1, p.55-63, mar. 2004.
MOSHE, S.L.; Seizures in the developing brain. Neurobiology, n. 43, Suppl. 5, S3-7, 1993.
NARDOU, R.; FERRARI, D.C.; BEN-ARI, Y. Mechanisms and effects of seizures in the immature brain. Seminars In Fetal And Neonatal Medicine, v. 18, n. 4, p.175-184, ago. 2013.
NEUMANN, I. D. Brain oxytocin: a key regulator of emotional and social behaviours in both females and males. Journal of Neuroendocrinology, v. 20, n. 6, p. 858–865, 2008.
NEUMANN, I.D.; LANDGRAF, R. Balance of brain oxytocin and vasopressin: implications for anxiety, depression, and social behaviors. Trends In
Neurosciences, v. 35, n. 11, p.649-659, nov. 2012.
NISHIMURA, M.; GU, X.; SWANN, J.W. Seizures in early life suppresses hippocampal dendrite growth while impairing spatial learning. Neurobiology of Disease, v. 44, n. 2, p. 205-214, 2011.
O’CONNELL, L.A.; HOFMANN, H.A. The Vertebrate Mesolimbic Reward System and Social Behavior Network: A Comparative Synthesis. The Journal of Comparative Neurology, v.519, p. 3599-3639, 2011.
PEDERSEN, C.A.; BOCCIA, M.L.; Vassopressin interactions with oxytocin in the control of female sexual behavior. Neuroscience, v. 139, n. 3, p. 843-851, 2006.
47
psychotic symptoms and improves Theory of Mind and social perception in schizophrenia. Schizophrenia Research, v. 132, n. 1, p.50-53, out. 2011.
PETRULIS, A.; ALVAREZ, P.; EICHENBAUM, H. Neural correlates of social odor recognition and the representation of individual distinctive social odors within entorhinal cortex and ventral subiculum. Neuroscience, v. 130, p. 259–274, 2005. PINCUS, D.; KOSE, S.; ARANA, A.; JOHNSON, K.; MORGAN, P.S.; BORCKARDT, J.; HERBSMAN, T.; HARDAWAY, F.; GEORGE, M.S.; PANKSEPP, J.; NAHAS, Z. Inverse effects of oxytocin on attributing mental activity to others in depressed and healthy subjects: a double-blind placebo controlled FMRI study. Front Psychiatry, v.1, n. 134, p. 1-57, 2010.
PRASAD, A.N.; SESHIA, S.S. Status epilepticus in pediatric practice: neonate to adolescent. Advances in Neurolology, v. 97, p.229–243, 2006.
RONEN G.M.; BUCKLEY, D.; PENNEY, S.; STREINER, D.L. Long-term prognosis in children with neonatal seizures: a population-based study. Neurology, v. 69, n. 19, p. 1816-1822, 2007.
SANCHEZ, R.M.; JENSEN, F.E. Maturational aspects of epilepsy mechanisms and consequences for the immature brain. Epilepsia, v. 42, n. 5, p. 577-585, 2001.
SAVASKAN, E.; EHRHARDT, R.; SCHULZ, A.; WALTER, M.; SCHACHINGER, H. Post-learning intranasal oxytocin modulates human memory for facial identity. Psychoneuroendocrinology, v. 33, n. 3, p. 368-374, 2008.
SAYIN, U.; HUTCHINSON, E.; MEYERAND, M.E.; SUTULA, T. Age-dependent long-term structural and functional effects of early-life seizures: Evidence for a hippocampal critical period influencing plasticity in adulthood. Neuroscience, v. 288, p.120-134, mar. 2015.
SAYIN, U.; SUTULA, T.P.; STAFSTROM, C.E. Seizures in the developing brain causes adverse long-term effects on spatial learning and anxiety. Epilepsia, v. 45, n. 12, p.1539-1548, 2004.
48 exposure and trauma-related hyperemesis gravidarum: a test-of-concept pilot. J Trauma Dissociation, v. 14, n. 1, p. 40-55, 2013.
SHI, X.Y.; WANG, J.W.; LEI, G.F.; SUN, R.P. Long-term effects of recurrent seizures on learning, behavior and anxiety: an experimental study in rats. World Jounal of Pediatrics, v. 3, n. 1, p. 61-65, 2007.
SOGAWA, Y.; MONOKOSHI, M.; SILVEIRA, D.C.; CHA, B.H.; CILIO, M.R.; MCCABE, B.K.; LIU, X.; HU, Y.; HOLMES G.L. Timing of cognitive deficits following neonatal seizures: relationship to histological changes in the hippocampus. Brain Research. Dev. Brain Research, v. 131, n. 1-2, p. 73-83, 2001.
STAVROPOULOS, K. M.; CARVER, L. J. Social motivation and oxytocin in autism – implications for joint attention development and intervention. Journal of Child Psychol Psychiatry, v. 54, n. 6, p. 603-618, 2013.
SYLVERTSEN, M.; NAKKEN, K.O.; EDLAND, A.; HANSEN, G.; HELLUM, M.K.; KOHT, J. Prevalence and etiology of epilepsy in a Norwegian country – a population based study. Epilepsia, v. 56, n. 5, p. 699-706, 2015.
SWANN, J.W. The impact of seizures on developing hippocampal networks. Progress in Brain Research, v. 147, p. 347-354, 2005.
TAKAYANAGI, Y.; YOSHIDA, M.; BIELSKY, I.F.; ROSS, H.E.; KAWAMATA, M.; ONAKA, T.; YANAGISAWA, T.; KIMURA, T.; MATZUK, M.M.; YOUNG, L.J.; NISHIMORI, K. Pervasive social deficits, but normal parturition, in oxytocin receptor-deficient mice. Proceedings Of The National Academy Of Sciences, v. 102, n. 44, p. 16096-16101, 2005.
TEKGUL, H.; GAUVREAU, K.; SOUL, J.; MURPHY, L.; ROBERTSON, R.; STEWART, J.; VOLPE, J.; BOURGEOIS, B.; du PLESSIS, A.J. The current etiologic profile and neuro-developmental outcome of seizures in term newborn infants. Pediatrics, v. 117, n. 4, p.1270-1280,2006.
THIBEAULT-EYBALIN, MP.; LORTIE, A.; CARMANT, L. Neonatal Seizures: Do they damage the brain? Pediatric Neurology, v.40, n.3, p. 175-180, 2009.
49 TODESCHIN, A.S.; WINKELMANN-DUARTE, E.C.; JACOB, M.H.V.; ARANDA, B.C.C.; JACOBS, S.; FERNANDES, M.C.; RIBEIRO, M.F.M.; SANVITTO, G.L.; LUCION, A.B. Effects of neonatal handling on social memory, social interaction, and number of oxytocin and vasopressin neurons in rats. Hormones and Behaviour, v. 56, n. 1, p. 93-100, 2009.
TUCHMAN, R.; CUCCARO, M. Epilepsy and Autism: Neurodevelopmental Perspective. Current Neurology And Neuroscience Reports, v. 11, n. 4, p.428-434, 22 mar. 2011.
TRIFILIEFF, P.; BENG, B.; URIZAR, E.; WINIGER, V.; WARD, R.D.; TAYLOR, K.M.; MARTINEZ, D.; MOORE, H.; BALSAM, P.D.; SIMPSON, E.H.; JAVITCH, J.A.
Increasing dopamine D2 receptor expression in the adult nucleus accumbens enhances motivation. Molecular Psychiatry, v. 18, p. 1025-1033, 2013.
URIA-AVELLANAL, C.; MARLOW, N.; RENNIE, J.M. Outcome following neonatal seizures. Seminars in fetal and neonatal medicine, v. 18, n. 4, p. 224-232, 2013. VAN WIMERSMA GREIDANUS, Tj.B.; MAIGRET, C. The role of limbic vasopressin and oxytocin in social recognition. Brain Research, v. 713, n. 1-2, p. 153-159, 1996. VASUDEVAN, C.; LEVENE, M. Epidemiology and aetiology of neonatal seizures. Seminars in Fetal Neonatal Medicine, v. 18, n.4, p.185-191, 2013.
VIERO, C.; SHIBUYA, I.; KITAMURA, N.; VERJHRATSKY, A.; FUJIHARA, H.; KATOH, A.; UETA, Y.; ZINGG, H.H.; CHVATAL, A.; SYKOVA, E.; DAYANITHI, G. Oxytocin: Crossing the Bridge between Basic Science and Pharmacotherapy. CNS Neuroscience & Therapeutics, v. 16, n. 5, p. 138-156, 2010.
VIVIANI, D.; CHARLET, A.; VAN DEN BURG, E.; ROBINET, C.; HURNI, N.; ABATIS, M.; MAGARA, F.; STOOP, R. Oxytocin selectively gates fear responses through distinct outputs from the central amygdala. Science, v. 333, n. 6038, p.104–107, Junho de 2011.