Abordagens farmacoterapêuticas no tratamento da Obesidade
Texto
(2)
(3) Filipa Rosário de Sousa Gonçalves. Abordagens Farmacoterapêuticas no Tratamento da Obesidade. Universidade Fernando Pessoa Faculdade de Ciências da Saúde Porto, 2011.
(4) Filipa do Rosário de Sousa Gonçalves. Abordagens Farmacoterapêuticas no Tratamento da Obesidade. Declaro que este trabalho foi realizado por mim e que todas as fontes utilizadas foram devidamente referenciadas na sua totalidade _____________________________________________________________ (Filipa Rosário Sousa Gonçalves). Trabalho apresentado à Universidade Fernando Pessoa como parte dos requisitos para obtenção do grau de Mestre em Ciências Farmacêuticas.
(5) Resumo. A prevalência da obesidade tem aumentado progressivamente em todo o Mundo. As comorbilidades e os custos inerentes a esta patologia são preocupantes e demonstram uma necessidade de se estabelecerem medidas efectivas na sua prevenção e tratamento. As abordagens para o tratamento da obesidade compreendem modificações do estilo de vida, farmacoterapia e/ou cirurgia bariátrica. A farmacoterapia para a perda de peso é recomendada para doentes obesos que não conseguem atingir as metas de perda de peso com dieta e exercício e que apresentam um IMC ≥ 30 kg m-2 ou IMC ≥ 27 kg m-2 associados a factores de risco. A terapêutica anti-obesidade foi introduzida no início do século XX com a comercialização de estimulantes metabólicos, e desde então foram vários os princípios activos aprovados para a terapêutica da obesidade. No entanto, apenas um - o orlistato, se encontra actualmente aprovado pela EMA para uso prolongado. Para além deste, a FDA autoriza outras moléculas mas para utilização a curto prazo. A presente monografia tem por objectivo realizar uma revisão cuidada dos fármacos desenvolvidos, até à data, para a terapêutica da obesidade, debatendo a sua eficácia, os seus mecanismos de acção, bem como os seus efeitos secundários. Será dado especial destaque às três moléculas que estão ou já estiveram aprovadas para uso na terapêutica prolongada anti-obesidade: o orlistato - um inibidor da lipase gástrica e pancreática; a sibutramina - um inibidor da recaptação da serotonina, da noradrenalina e da dopamina; e o rimonabanto - um antagonista dos receptores canabinóides de tipo 1. Algumas das novas moléculas que se têm revelado mais promissoras (caso da, tesofensina (inibidor da recaptação pré-sináptica da noradrenalina, dopamina e serotonina), do cetilistato (inibidor da lipase gástrica) e do lorcaserin (agonista selectivo dos receptores 5-HT2c), bem como os fármacos que se encontram aprovados para outros fins, mas que demonstraram também eles contribuir para uma perda significativa de peso, serão igualmente debatidos.. v.
(6) Abstract. The prevalence of obesity is increasing worldwide. The comorbidities and costs inherent to this pathology are alarming and show a need to establish effective measures for its prevention and treatment. Approaches. for. the. treatment. of. obesity. include. lifestyle. modifications,. pharmacotherapy and/or bariatric surgery. Pharmacotherapy for weight loss is recommended for obese patients who fail to meet the goals of weight loss with diet and exercise and who have a BMI ≥ 30 kg m-2 or a BMI ≥ 27 kg m-2 with associated risk factors. The anti-obesity therapy was introduced in the early twentieth century with the commercialization of metabolic stimulants, and since there several drugs were approved for the treatment of obesity. However, only one - orlistat, is currently approved by the EMA for extended use. FDA also authorizes other molecules but only for short term use. The aim of this monography is to provide a careful review of the drugs developed, to date, for the treatment of obesity. It will be focused on the effectiveness, mechanisms of action, and side effects of drugs. Particular emphasis will be done on three molecules that are or have been approved for use in long term therapy: orlistat - an inhibitor of gastric and pancreatic lipase, sibutramine - an inhibitor of serotonin, norepinephrine and dopamine, and rimonabant - a cannabinoid receptor antagonist type 1. The most promising new molecules (such as tesofensine - an inhibitor of presynaptic reuptake of norepinephrine, dopamine and serotonin, cetilistat - an inhibitor of gastric and pancreatic lipase and lorcaserin - selective agonist of 5-HT2c receptors), as well as drugs that are approved for other purposes, but also demonstrated that they contribute to a significant weight loss, will also be discussed.. vi.
(7) Dedicatórias. …. a todos que contribuíram para a minha formação.. vii.
(8) Agradecimentos. Um trabalho académico é sempre executado com grande esforço por parte de quem realiza, orienta e ajuda. Neste sentido, agradeço às professoras orientadoras Rita Catarino e Fernanda Leal, pela orientação científica, disponibilidade, incentivo e conhecimentos transmitidos que tornaram possível a execução e conclusão desta dissertação. Torna-se também imprescindível demonstrar o meu agradecimento a todos os meus professores que ao longo destes cinco anos contribuíram para o aumento dos meus conhecimentos. Por último, e não com menos importância, agradeço à minha família e amigos pelo carinho, compreensão e apoio incondicional em todos os momentos. A todos, que contribuíram para a minha formação, o meu muito obrigado.. viii.
(9) Índice. I.. Introdução.................................................................................................................. 1. II. Obesidade: Abordagem geral .................................................................................... 5 2.1. Prevalência da obesidade ................................................................................... 5. 2.2. Regulação da homeostasia energética ................................................................ 7. 2.3. Causas da obesidade .......................................................................................... 8. 2.4. Complicações da obesidade ............................................................................. 10. 2.5. Custos associados à obesidade ......................................................................... 12. III.. Farmacoterapia .................................................................................................... 14. 3.1. Orlistato (Xenical®, Alli®) ............................................................................... 15. i.. Eficácia do orlistato na perda de peso ............................................................. 16. ii.. Benefícios do orlistato noutras patologias ....................................................... 18. iii. Efeitos adversos do orlistato ............................................................................ 20 iv. Interacções associadas à utilização do orlistato ............................................... 21 v.. Medicamentos aprovados com o princípio activo orlistato ............................. 23. 3.2. Sibutramina (Zelium®, Reductil®, Meridia®) .................................................. 25. i.. Eficácia da sibutramina na perda de peso ........................................................ 27. ii.. Benefícios da sibutramina noutras patologias ................................................. 29. iii. Interacções associadas à utilização da sibutramina ......................................... 31 iv. Efeitos adversos da sibutramina ...................................................................... 32 3.3. Rimonabanto (Acomplia®) .............................................................................. 34. i.. Eficácia do rimonabanto na perda de peso ...................................................... 36. ii.. Efeitos adversos do rimonabanto ..................................................................... 39. IV.. Novos fármacos em investigação ........................................................................ 42. 4.1. Fármacos comercializados que reduzem o peso corporal ................................ 42. 4.2. Cetilistato ......................................................................................................... 45. ix.
(10) 4.3. Tesofensina ...................................................................................................... 46. 4.4. Lorcaserin ........................................................................................................ 47. V. Conclusão ................................................................................................................ 49 VI.. Bibliografia .......................................................................................................... 51. x.
(11) Índice de Figuras. Figura 1 - Resumo da regulação da homeostasia energética. ........................................... 8 Figura 2 - Estrutura química do tetrahidrolipstatin e lipstatin. ....................................... 15 Figura 3 - Estrutura química da sibutramina .................................................................. 26 Figura 4 - Estrutura química do rimonabanto ................................................................. 35 Figura 5 - Estrutura química do orlistato e do cetilistato ............................................... 45 Figura 6 - Estrutura química da tesofensina ................................................................... 46 Figura 7 - Estrutura química do lorcaserin ..................................................................... 47. Índice de Tabelas. Tabela 1 - Classificação do excesso de peso e da obesidade em adultos de acordo com o IMC. ................................................................................................................. 1 Tabela 2 - Fármacos associados ao aumento de peso ..................................................... 10 Tabela 3 - Fármacos desenvolvidos para o tratamento da obesidade desde 1930 até à actualidade ..................................................................................................... 14 Tabela 4 - Perda de peso associada a diferentes dosagens de orlistato. ......................... 17 Tabela 5 - Efeitos adversos observados no estudo clínico CRESCENDO. ................... 40. xi.
(12) Índice de abreviaturas. AgRP - Péptido relacionado a Agouti, do inglês Agouti-related peptide AVC - Acidente vascular cerebral CC - Circunferência da cintura CDC - Centro para Controlo e Prevenção de Doenças, do inglês Centers for Disease Control and Prevention CEA - Antigénio carcino embriogénico DA - Doença de Alzheimer Δ9-THC - Delta-9-tetrahidrocannabinol EMA - Agência Europeia do Medicamento, do inglês European Medicines Agency EUA - Estados Unidos da América FAS - Ácido gordo sintase, do inglês fatty acid synthase FDA - Administração de Alimentos e Medicamentos, do inglês Food and Drug Administration GLP-1 - Péptido semelhante ao glucagon-1, do inglês glucagon-like peptide-1 HDL - Lipoproteína de elevada densidade, do inglês high density lipoprotein IASO - Associação Internacional para o Estudo da Obesidade, do inglês International Association for the Study of Obesity IMC - Índice de massa corporal INFARMED - Autoridade Nacional do Medicamento e Produtos de Saúde LDL - Lipoproteína de baixa densidade, do inglês low density lipoprotein LM - Libertação modificada NPY - Neuropéptido Y OMS - Organização Mundial de Saúde POMC - Proopiomelanocortina. xii.
(13) RPSGB - Sociedade Real Farmacêutica da Grã-Bretanha, do inglês Royal Pharmaceutical Society of Great Britain SNC - Sistema nervoso central SNPs - Polimorfismos num único nucleótido, do inglês single-nucleotide polymorphism SOP - Síndrome dos ovários policísticos. xiii.
(14) I.. Introdução. Actualmente a obesidade é considerada a desordem nutricional mais comum em todo o mundo e os seus efeitos clínicos, psicológicos, sociais e económicos acarretam consequências importantes, suscitando uma preocupação generalizada (Chan e Woo, 2010; Wilding, 2011). As mais recentes projecções da Organização Mundial de Saúde (OMS) indicam que até 2015 cerca de 2,3 biliões de adultos apresentarão excesso de peso e mais de 700 milhões serão obesos (Glandt e Raz, 2011). Segundo a mesma organização a obesidade e o excesso de peso são definidos como uma acumulação de gordura excessiva ou anormal que implica riscos para a saúde (OMS, 2010), sendo comummente avaliados através do índice de massa corporal (IMC), dado este ser um método simples, rápido e de baixo custo (Nguyen e El-Serag, 2010). O IMC é calculado tendo em consideração a altura e o peso do indivíduo [IMC = Peso (Kg) / Altura (m2)]. Para os adultos de ambos os sexos, o excesso de peso é definido por um IMC entre 25 e 29,9 Kg m-2 e a obesidade por um IMC igual ou superior a 30 Kg m-2 (Lobcorzilius, 2007; Li e Cheung, 2009; Nejat, Polotsky e Pal, 2010). A obesidade pode ser dividida, ainda, em obesidade grau 1, com IMC entre 30 e 34,9 Kg m-2, obesidade grau 2, com IMC entre 35 e 39,9 Kg m-2, e obesidade grau 3, com um IMC igual ou superior a 40 Kg m-2, como se pode observar na Tabela 1 (Chan e Woo, 2010).. Classificação. IMC. Risco de comorbilidades. Baixo peso Normal Excesso de peso Obesidade grau 1 Obesidade grau 2 Obesidade grau 3. <18,5 18,5-24,9 25,0-29,9 30,0-34,9 35,0-39,9 ≥40. Baixa Média Aumentada Moderada Elevada Muito elevada. Tabela 1 - Classificação do excesso de peso e da obesidade em adultos de acordo com o IMC (adaptado de Chan e Woo, 2010).. 1.
(15) O IMC em crianças deve ser realizado como rastreio e não como diagnóstico, sendo avaliado utilizando pontos de corte percentil para comparar os valores entre crianças com a mesma idade e sexo a partir de uma amostra nacional (Cunningham, 2004). A nível mundial, o excesso de peso apresenta-se com o percentil 90, mas na Europa está definido como percentil 97 e nos Estados Unidos da América (EUA) como percentil 95. Sendo assim, é necessário tomar estas considerações nas comparações internacionais (Lobcorzilius, 2007). Porém, o IMC não distingue o peso associado ao tecido adiposo ou muscular, sendo que a relação entre o IMC e a gordura corporal varia de acordo com a configuração do corpo e com a proporção. Por exemplo, adolescentes e idosos podem apresentar um IMC com igual valor mas a composição corporal ser muito variável (Li e Cheung, 2009; Chan e Woo, 2010). Além do mais, esta medida varia entre as populações e não reflecte a gordura intra-abdominal que está associada a um síndrome metabólico (relacionado com a presença de três de cinco factores de risco cardiovasculares avaliados: obesidade abdominal, redução da lipoproteína de elevada densidade (HDL, do inglês high density lipoprotein), triacilglicerois elevados, hipertensão arterial e glicose em jejum elevada), não sendo uma medida eficaz da obesidade (Mozlin, 2005; Li e Cheung, 2009; Graves, 2010; Wilding, 2011). Vários estudos têm comparado a adequação de vários índices antropométricos para avaliação da obesidade e previsão dos seus riscos de saúde, incluindo o IMC, a relação cintura-quadril, a circunferência da cintura (CC) e a relação cintura-altura. Apesar de não existir consenso sobre qual o índice que deve ser aplicado a nível universal, no que respeita à avaliação da obesidade abdominal, o índice que melhor se adapta é o da CC (Guh et al., 2009; Chan e Woo, 2010). Actualmente a obesidade é reconhecida como uma condição que necessita atenção médica, especialmente por conduzir ao aparecimento de várias patologias associadas (diabetes, hipertensão, dislipidémia, etc.) (Glandt e Raz, 2011). As abordagens para o tratamento da obesidade compreendem modificações do estilo de vida, farmacoterapia e/ou cirurgia bariátrica (Kloet e Woods, 2010), sendo que o objectivo fundamental da perda de peso em obesos ou em indivíduos que apresentam excesso de peso é melhorar a sua qualidade de vida e reduzir o risco de doenças associadas (Dyson, 2010). Seguindo uma estratégia para incorporar cuidados primários na prática clínica, a Agência de Investigação de Saúde e Qualidade recomendou a construção dos 5 A´s (assessing. readiness. to. change. (avaliar 2. a. vontade. de. mudança),. advice.
(16) (aconselhamento), agree (concordar), assist with a plan (ajudar com esquema), arrange follow-up (organizar o comportamento)) com o objectivo de modificar o comportamento dos pacientes obesos. Inicialmente, pretende-se uma redução do peso corporal em cerca de 10 % durante um período de 6 meses, somente modificando o estilo de vida, sem medicamentos ou cirurgia. Para as mulheres com IMC de 27 a 35 Kg m-2, uma redução da ingestão calórica de 300 a 500 kcal por dia chegaria para o cumprimento desse objectivo assim como uma redução de 500 a 1000 kcal por dia em indivíduos cujo IMC é igual ou superior a 35 Kg m-2. Existem vários estudos que ditam que uma dieta baixa em gordura apresenta melhores resultados de perda de peso corporal, porém, o que irá condicionar os resultados será a adesão do indivíduo à estratégia da dieta (Dyson, 2010). Para além da recomendação de uma dieta, também é necessária a recomendação de actividade física, o qual constitui uma alternativa excelente para perder peso, mas é mais eficaz quando combinado com dieta e terapia comportamental (de realçar que os programas em grupo apresentam-se com maior sucesso em comparação com o aconselhamento individual e as intervenções psicológicas baseadas na família são eficazes em crianças) (Dyson, 2010; Graves, 2010; Kloet e Woods, 2010). A actividade física apresenta como vantagem adicional o facto de melhorar a sensibilidade à insulina e o tónus muscular, independentemente da perda de peso, contudo, é mais complicado a adesão de obesos ou indivíduos com excesso de peso comparativamente à instituição da dieta (Kloet e Woods, 2010). A cirurgia bariátrica promove a perda de peso em indivíduos com obesidade grau 3, através de um procedimento cirúrgico que possibilita a redução ou mesmo tratamento de comorbilidades associadas à obesidade. Porém, é necessária a ponderação do paciente pois existem riscos associados (Khwaja e Bonanomi, 2010). Para a realização da cirurgia é necessário que os indivíduos tenham um IMC maior que 40 Kg m-2 ou então maior que 35 Kg m-2 associado a comorbilidades e em que a perda de peso falhou com tentativas sob supervisão médica (Reedy, 2009). A farmacoterapia para a perda de peso só é recomendada para doentes obesos que não conseguem atingir as metas de perda de peso com dieta e actividade física e com IMC ≥ 30 kg m-2 ou IMC ≥ 27 kg m-2 associados a factores de risco (Graves, 2010; Powell e Khera, 2010). Em pacientes obesos, devem ser considerados os factores etiológicos, a resposta terapêutica, doses adequadas, interacções medicamentosas e contra-indicações médicas e psiquiátricas (Carrasco et al., 2009).. 3.
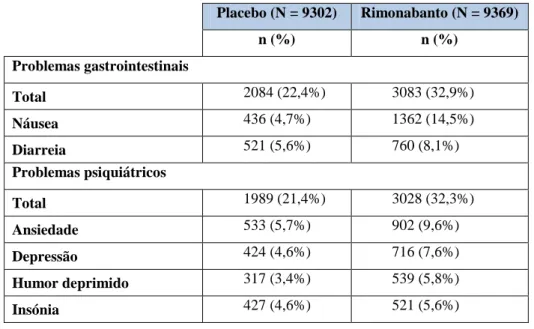
(17) Apesar de toda a investigação que tem vindo a ser conduzida na área da famacoterapia da obesidade, actualmente as opções são muito limitadas. Para a terapêutica prolongada somente o orlistato está aprovado pela Administração de Alimentos e Medicamentos (FDA, do inglês Food and Drug Administration) e pela Agência Europeia do Medicamento (EMA, do inglês European Medicines Agency) (Powell e Khera, 2010; FDA, 2011). Alguns agentes simpaticomiméticos, encontram-se aprovados pela FDA, para um tratamento a curto prazo (≤ 1 ano), como a fentermina, dietilpropion e fendimetrazina (Powell e Khera, 2010; FDA, 2011). Alguns princípios activos tais como a sibutramina e o rimonabanto apresentaram-se eficazes na perda de peso, mas foram retirados do mercado devido a efeitos adversos inaceitáveis (Glandt e Raz, 2011). Recentemente novos princípios activos têm sido testados, encontrando-se em ensaios clínicos de fase III. Destaca-se a tesofensina, um agente farmacológico que inibe a recaptação de noradrenalina, dopamina e serotonina (Ioannides-Demos, Piccenna e McNeil, 2011), o cetilistato, um inibidor das lipases gastrointestinais e pancreáticas e o lorcaserin, um agonista selectivo dos receptores 5-HT2c (Faria et al., 2010). Esta revisão bibliográfica tem por objectivo apresentar dados recentes da literatura científica actualmente publicada sobre as várias abordagens farmacoterapêuticas direccionadas para a prevenção e tratamento da obesidade. Para isso, esta dissertação será dividida em quatro partes: a) abordagem geral da obesidade; b) farmacoterapia: fármacos actualmente comercializados (orlistato) ou recentemente retirados de comercialização (sibutramina, rimonabanto); c) novos fármacos em investigação: fármacos que reduzem o peso corporal mas não licenciados para o mesmo, como a metformina, liraglutide, topiramato e d) fármacos em fase III de ensaios clínicos (lorcaserin, tesofensina e cetilistato).. 4.
(18) II.. Obesidade: Abordagem geral 2.1 Prevalência da obesidade. A prevalência da obesidade a nível mundial é monitorizada pela OMS e pela Base de dados de IMC Global através de colaboradores ou a partir da literatura (Nguyen e ElSerag, 2010). Em 1997, a OMS reconheceu formalmente a extensão global da obesidade. Em 2008, 1,5 biliões de adultos apresentavam excesso de peso, destes 200 milhões de homens e quase 300 milhões de mulheres eram obesos (Nejat, Polotsky e Pal, 2010; OMS, 2010). As projecções para 2015 apontam para a existência de 2,3 biliões de adultos com excesso de peso e mais de 700 milhões de obesos, pressupondo proporções de pandemia, que será manifestada também em países subdesenvolvidos (Nejat, Polotsky e Pal, 2010). De acordo com a Base de dados de IMC Global, existem variações na prevalência da obesidade a nível mundial. Por exemplo, na Índia 1 % ou menos da população é obesa, enquanto em algumas regiões das ilhas do Pacifico a prevalência da obesidade pode chegar aos 80 % (Nguyen e El-Serag, 2010). Nos EUA, entre 1960 e 2004 houve um aumento significativo da prevalência de adultos obesos, de 13,3 para 32,1 %, enquanto os dados de excesso de peso, no mesmo período de tempo, aumentaram de 44,8 para 66 %, sendo que, foi a partir de 1980 que se verificou um maior aumento (Bruce-Keller, Keller e Morrison, 2009). Actualmente, estima-se que aproximadamente 72500 mil adultos nos EUA e mais de um quinto dos adultos nos países ocidentais da Europa são obesos (CDC, 2010; Roberts, Dive e Renehan, 2010). Por exemplo, em Inglaterra cerca de 65 % dos homens e 56 % das mulheres são obesos ou apresentam excesso de peso, tendo a prevalência da obesidade aumentado em quase 400 % desde 1980. As projecções apontam para que em 2020 mais de 40 % dos adultos ingleses tenham excesso de peso e mais de 35 % sejam obesos, ou seja, mais de três quartos da população adulta inglesa terá excesso de peso ou será obesa (Dyson, 2010; Greener, Douglas e Teijlingen, 2010). De acordo com a Associação Internacional para o Estudo da Obesidade (IASO, do inglês International Association for the Study of Obesity), os dados colhidos em Portugal entre 2003 e 2005 demonstraram que numa população de 5123 indivíduos, com idades compreendidas entre os 16 e os 64 anos, a percentagem de homens com. 5.
(19) IMC entre 25 e 29,9 Kg m-2 era de 44,1 % e nas mulheres 31,9 %. Por outro lado, 14,6 % das mulheres e 14,5 % dos homens apresentavam um IMC superior a 30 Kg m -2 (IASO, 2010). Ainda no que respeita a Portugal, um levantamento nacional na população adulta indicou um aumento na prevalência da obesidade de 49,6 % em 19951998 para 53,6 % em 2003-2005. No referido estudo a obesidade abdominal apresentava uma maior prevalência, afectando 23,9 % dos indivíduos da população, nomeadamente 27,0 % das mulheres e 19,1 % dos homens (Camões et al., 2010). Entre 1999-2003 e 2005-2008 foi realizado um estudo por Camões et al (2010), utilizando uma amostra representativa de adultos urbanos, agrupados por sexo, idade e nível de ensino, considerando o IMC e a CC. Concluíram que 10,1 % das mulheres e 5,1 % dos homens se tornaram obesos durante o período de estudo, evidenciando-se um aumento preferencialmente a nível abdominal (aumentos de 29,1 % e 11,4 %, respectivamente para mulheres e homens). Também verificaram um aumento da obesidade mais significativa em níveis socioeconómicos mais baixos, principalmente em mulheres. A taxa de obesidade em crianças e adolescentes também aumentou consideravelmente nas últimas décadas (Lobcorzilius, 2007). Nos EUA, entre 1963-1965 e 2003-2006 as taxas de obesidade em crianças com idades compreendidas entre os 6 e os 11 anos aumentaram consideravelmente de 4 para 17 % e em adolescentes com idades entre 12 e 19 anos aumentaram de 5 para 17,6 % (Mahoney, 2010). A Europa segue a mesma tendência dos EUA, verificando-se, no entanto, algumas diferenças regionais. Por exemplo, enquanto na Holanda cerca de 12 % das crianças são obesas ou apresentam excesso de peso, na Alemanha 6,3 % apresentam obesidade e 15 % têm excesso de peso (Lobcorzilius, 2007; Dyson, 2010). Em Portugal, Marques-Vidal et al. (2008) procederam a um estudo transversal com uma amostra de 2494 rapazes e 2519 raparigas, com idades compreendidas entre os 10 e 18 anos. Cerca de 19,7 e 4,7% das raparigas e 17,4 e 5,3 % dos rapazes apresentaram excesso de peso e obesidade, respectivamente. De realçar que é nos países do Sul da Europa que se verifica uma maior percentagem de obesidade infantil, como por exemplo, em Itália (35 %), não existindo grandes evidências que apoiem a eficácia do tratamento e da prevenção (Lobcorzilius, 2007; Dyson, 2010).. 6.
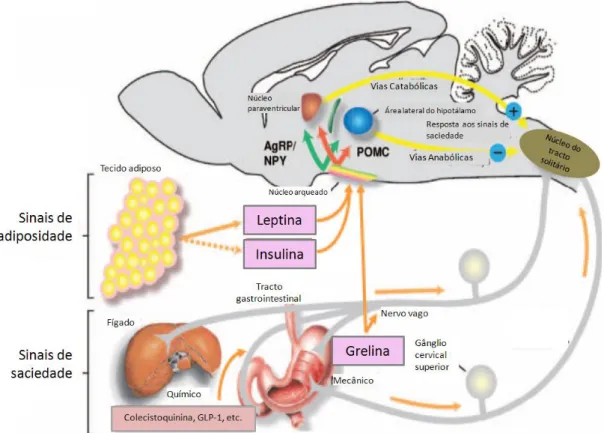
(20) 2.2 Regulação da homeostasia energética. Apesar de, em média, um indivíduo ingerir mais de 700000 Kcal durante um ano, o peso corporal mantém-se regularmente dentro de um intervalo de ± 1 Kg, havendo uma precisão de mais de 99 % na regulação das reservas de gordura a longo prazo, pelo sistema nervoso central (SNC) e pelo sistema digestivo, devido a um mecanismo complexo neuroendócrino de homeostasia energética, como se pode observar na Figura 1 (Hofbauer, Nicholson e Boss, 2007). Os factores periféricos comunicam o estado de reservas corporais de energia ao cérebro, sendo que podem ser anorexigénicos, que promovem a redução na ingestão de alimentos e do peso corporal, ou orexigénicos cujo efeito é antagónico (Cummings, 2006). A hormona grelina é um péptido gastrointestinal secretado pelo estômago entre as refeições, que promove o aumento do apetite pela libertação do neuropéptido Y (NPY), por ligação a neurónios orexigénicos no hipotálamo (Cummings, 2006; Wilding, 2011). Para contrabalançar o efeito da grelina, o péptido YY, a leptina e a insulina, actuam ao nível dos neurónios anorexigénicos, diminuindo o apetite (Wilding, 2011). A leptina e a insulina são libertadas do tecido adiposo e do pâncreas, respectivamente, e inibem o NPY e o péptido relacionado a Agouti (AgRP, do inglês Agouti-related peptide) promovendo uma diminuição na ingestão de alimentos, um aumento do gasto energético e consequentemente perda de peso (Figura 1) (Waseem et al., 2007; Woods e D’Alessio, 2008; Marcelin e Chua, 2010). Quando simultaneamente há uma ingestão calórica em excesso e uma baixa actividade física, ou na presença de determinadas alterações genéticas, o balanço de energia inclina-se para o armazenamento de energia, sendo os ácidos gordos livres esterificados a triacilglicerois e depois incorporados em gotículas lipídicas (Marcelin e Chua, 2010). A sua deposição ocorre preferencialmente a nível abdominal, o que aumenta a CC e promove um maior risco de doenças cardiovasculares e metabólicas. O sexo feminino apresenta uma maior distribuição de gordura subcutânea, enquanto o masculino apresenta proporcionalmente mais gordura abdominal (Kloet e Woods, 2010). O tecido adiposo, responsável pelo armazenamento de gorduras, pode ser de dois tipos morfologicamente diferentes: o tecido adiposo branco e o tecido adiposo castanho. O tecido adiposo branco é o mais abundante, localizando-se preferencialmente nas regiões. 7.
(21) subcutâneas e em órgãos internos, sendo responsável pelo armazenamento de energia e pela secreção de adipocinas, tais como a leptina e a adiponectina, as quais são fundamentais na regulação do equilíbrio energético global. O tecido adiposo castanho funciona da mesma forma que um órgão termogénico e tem sido demonstrado que em adultos normais é funcional na resposta à estimulação β-adrenérgica e produção de calor (Marcelin e Chua, 2010).. Figura 1 - Resumo da regulação da homeostasia energética (adaptado de Woods e D’Alessio, 2008).. 2.3 Causas da obesidade. A obesidade é provocada por uma interacção complexa entre o meio ambiente, o comportamento humano e factores genéticos, sendo os factores ambientais os que, provavelmente, colaboram com maior relevo para a epidemia da obesidade (Nguyen e El-Serag, 2010). Acredita-se que a obesidade seja uma consequência natural de um ambiente que favorece o consumo de elevada quantidade de calorias e baixo gasto das. 8.
(22) mesmas, verificando-se um aumento do peso corporal ao longo do tempo (Hofbauer, Nicholson e Boss, 2007; Kloet e Woods, 2010). Nos países Ocidentais, têm ocorrido mudanças alimentares profundas nos últimos 30 - 40 anos, particularmente por aumento do consumo de alimentos muito energéticos ricos em gordura e/ou açúcar e refrigerantes (Wilding, 2011). A fácil disponibilidade de produtos hipercalóricos e o aumento dos custos associados aos vegetais e às frutas contribuem para a epidemia da obesidade. Alguns investigadores avaliaram o efeito de ganho de peso entre amigos e familiares, descobrindo que o risco de um indivíduo se tornar obeso aumenta em cerca de 57 % se o amigo se tornar obeso, 40 % no caso de irmãos e 37 % em cônjuges. Para além disso, vários estudos apontam que o aumento de horas televisivas e a utilização de automóvel como meio de deslocação promovem a inactividade física (Nguyen e El-Serag, 2010). Além dos factores ambientais, existem variações genéticas que podem predispor ou não ao desenvolvimento da obesidade. É conhecido que variações genéticas comuns ou polimorfismos num único nucleótido (SNPs, do inglês single-nucleotide polymorphism) são importantes na epidemia da obesidade e da diabetes mellitus tipo 2 (Das, 2010; Nguyen e El-Serag, 2010). Devido à elevada frequência dos SNPs, há uma acentuada contribuição a nível populacional e destacam-se os SNPs que conduzem a alterações ao nível do gene FOXC2 (o qual é importante no controlo do peso corporal, na regulação da glicemia e dos níveis de triacilglicerois plasmáticos), do gene FTO, das proteínas desacopladoras (associadas a obesidade infantil em diversas raças) e da adiponectina (Das, 2010; Nguyen e El-Serag, 2010). Os factores genéticos assumem um papel muito importante na obesidade infantil, não sendo no entanto por si só justificação de tal epidemia (dado que as alterações nos genes não foram assim tão marcadas nos últimos 30 anos), sendo os factores ambientais considerados como a causa primária (Mozlin, 2005). No entanto, alguns casos de obesidade infantil grave são característicos de várias síndromes hereditárias, sendo o síndrome PraderWilli o mais comum. As crianças afectadas apresentam falta de desenvolvimento nos primeiros dois anos de vida, desenvolvendo posteriormente um apetite voraz, o que conduz a obesidade severa e ao aparecimento de complicações como diabetes mellitus tipo 2 e apneia obstrutiva do sono (Wilding, 2011). Para além de factores ambientais, de factores genéticos e de problemas endócrinos (tais como o hipotiroidismo e a doença de Cushing), também muitos medicamentos, principalmente os que actuam a nível central (caso dos anticonvulsivantes e dos. 9.
(23) neurolépticos), promovem o aumento de peso (Tabela 2). Embora os mecanismos ainda não se encontrem bem esclarecidos, pensa-se que podem envolver efeitos centrais no apetite (neurolépticos) e efeitos metabólicos periféricos (hipoglicemiantes orais e os inibidores da protease) (Wilding, 2011).. Fármacos associados ao aumento de peso Classe Exemplos Anticonvulsivantes Valproato de sódio, gabapentina Andidepressores Citalopram, mirtazapina, amitriptilina Antipsicóticos Clozapina, risperidona, olanzepina β-bloqueadores Atenolol Corticosteróides Prednisolona, dexametasona Insulina Todas Medicamentos usados na enxaqueca Pizotifeno (antagonistas da serotonina) Esteróides sexuais Acetato de medroxiprogesterona, progesterona, contraceptivos orais combinados Hipoglicemiantes orais Glibenclamida, gliclazida, rosiglitazona, pioglitazona Inibidores da protease Indinavir, ritonavir Tabela 2 - Fármacos associados ao aumento de peso (adaptado de Wilding, 2011).. 2.4 Complicações da obesidade. Hoje em dia, é amplamente aceite que a obesidade é não só um problema de estética, mas também um problema de saúde, responsável pelo aparecimento de doenças graves e pelo aumento da mortalidade e da morbilidade (Hofbauer, Nicholson e Boss, 2007). É reconhecida como um distúrbio inflamatório crónico de baixo grau e vários estudos sugerem que este estado inflamatório favorece o aumento do risco de várias doenças, incluindo doenças cardiovasculares, osteoartrite, gota (Dyson, 2010), doença de refluxo gastroesofágico, pólipos, (Nguyen e El-Serag, 2010), artrite reumatóide, fibromialgia, enxaquecas (Graves, 2010), além de acelerar o processo de envelhecimento (BruceKeller, Keller e Morrison, 2009). De entre os factores de risco para a doença cardiovascular, destacam-se dislipidemia, hipertensão, resistência à insulina, diabetes, glicemia em jejum e intolerância à glicose. Em conjunto, estes factores aumentam o risco de aterosclerose (Dyson, 2010; Graves, 2010).. 10.
(24) De entre estas complicações, a diabetes é a que se relaciona mais fortemente com a obesidade, devido à diminuição de alguns factores importantes para a sua prevenção, como da adiponectina (Dyson, 2010; Kloet e Woods, 2010). Segundo alguns estudos, em países ocidentais cerca de 58 % dos casos de diabetes mellitus tipo 2 estão relacionados com o aumento de peso (Graves, 2010). Existem evidências que a obesidade e a diabetes mellitus tipo 2 predispõem para a Doença de Alzheimer (DA). Vários estudos têm confirmado alterações da morfologia do cérebro em adultos jovens obesos ou com excesso de peso, demonstrando, sobretudo a nível do lóbulo frontal, uma diminuição da massa cinzenta e uma amplificação da massa branca a nível orbitofrontal, podendo reflectir-se na perda de neurónios (Bruce-Keller, Keller e Morrison, 2009; CDC, 2010). Estudos retrospectivos, demonstraram que a elevação de uma única unidade no IMC aumenta em 36 % a probabilidade de desenvolver DA em mulheres, enquanto um estudo prospectivo realizado em Nova Iorque revelou que uma dieta pobre em calorias ou gorduras apresenta expressivamente um risco menor para a doença do que uma dieta excessiva em calorias. Porém, esta questão é ainda controversa (BruceKeller, Keller e Morrison, 2009). A hipertensão associada à obesidade parece resultar do aumento da actividade simpática, por aumento de várias substâncias envolvidas, incluindo o óxido nítrico que actua sobre o músculo liso vascular subjacente (Naderali, 2009). Tem sido demonstrado que uma redução do peso corporal entre 5 a 10 % diminui significativamente a pressão arterial em hipertensos (Hofbauer, Nicholson e Boss, 2007). A Pesquisa Nacional de Análise de Saúde e Nutrição (1999-2004) constatou que a prevalência de dislipidemia em indivíduos com peso normal era de 8,9 % enquanto nos que apresentavam um IMC entre 35 a 39,9 Kg m-2 aumentava para 20,6 %. Um IMC elevado está associado ao aumento de colesterol total e da lipoproteína de baixa densidade (LDL, do inglês low density lipoprotein) e a uma diminuição de colesterol HDL. Um estudo de corte retrospectivo com 5881 voluntários demonstrou que mulheres com IMC superior a 30 Kg m-2 apresentavam 2,1 % mais probabilidade de desenvolver insuficiência cardíaca quando comparadas com mulheres com IMC normal (Graves, 2010). A obesidade para além de complicações cardiovasculares pode induzir complicações respiratórias, como dispneia, apneia do sono, doença pulmonar obstrutiva crónica e asma. Um estudo de corte transversal realizado em crianças, adolescentes e adultos 11.
(25) revela uma associação significativa entre obesidade e asma, demonstrando um risco relativo de desenvolver asma de 1,4 para 2,2 em pacientes obesos, aumentando proporcionalmente a prevalência consoante o IMC (Rabec, Lucas e Veale, 2011). Embora, muitas vezes, se considere que a obesidade é um factor relevante no síndrome dos ovários policísticos (SOP), esta não é um dos critérios de diagnóstico para esta disfunção dos ovários. Entre 30 a 70 % das mulheres com este síndrome são obesas apresentando complicações associadas, tais como, resistência à insulina, diabetes mellitus tipo 2, hiperlipidemia e hipertensão (Graves, 2010). Existe, também, uma associação relevante entre obesidade e vários tipos de cancro, tais como cancro do útero, colorectal, próstata e tiróide, leucemia, adenocarcinoma do esófago, linfoma não-Hodgkin e mieloma múltiplo (Graves, 2010; Roberts, Dive e Renehan, 2010). Estudos recentes, conduzidos ao longo de um período alargado, demonstraram que em mulheres submetidas a cirurgia bariátrica a incidência de vários tipos de cancro diminuiu (Roberts, Dive e Renehan, 2010). Para além das complicações acima referidas, a obesidade também está associada a incontinência, amenorreia e doença da vesícula biliar (Graves, 2010). A obesidade também é um factor de risco para distúrbios psicológicos, tais como depressão, ansiedade e fúria e está associada a uma redução da qualidade de vida, estigmatização social e discriminação, levando a graves precursões na vida privada e profissional, podendo diminuir a expectativa de vida especialmente em pessoas mais jovens (Hofbauer, Nicholson e Boss, 2007; Naderali, 2009; CDC, 2010; Micciolo et al., 2010). Tal como nos adultos, as crianças obesas apresentam maior propensão para o desenvolvimento de hipertensão, aterosclerose, asma e apneia do sono. Um IMC superior ao percentil 95 poderá ser um indicador precoce de doença cardiovascular. Por outro lado, as crianças obesas desenvolvem frequentemente doença de Blount, caracterizada por uma curvatura externa da tíbia e do fémur devido à maior pressão exercida pelo excesso de peso. A pressão conjunta ao longo dos anos é susceptível de provocar outras complicações ortopédicas na idade adulta, tal como osteoartrite, hérnia de disco e dor crónica na coluna vertebral (Mozlin, 2005). 2.5 Custos associados à obesidade. 12.
(26) O aumento da prevalência da obesidade tem como consequência um aumento acentuado dos custos directos relacionados com os cuidados médicos, e indirectos relacionados com a perda de produtividade, colocando um elevado encargo financeiro sobre a economia (Hofbauer, Nicholson e Boss, 2007; CDC, 2010; Nguyen e El-Serag, 2010). Os custos médios nos EUA em doenças associadas à obesidade aumentaram cerca de 27 % entre 1987 e 2001 (CDC, 2010). Alguns investigadores, com base em dados de uma revisão sistemática, estimaram que os custos totais indirectos nos EUA foram de 65,67 biliões de dólares em 1999 e um outro estudo indica que os gastos médicos anuais constituem cerca de 9 % das despesas em saúde (Nguyen e El-Serag, 2010). Nos últimos 20 anos, os custos relativos ao tratamento de morbilidades associadas à obesidade infantil com ou sem diabetes em crianças com idades compreendidas entre 6 e 17 anos, mais que quadriplicou, passando de 35 para 127 milhões de dólares (Mozlin, 2005). Relativamente a Portugal, em 2002 estimaram-se os custos indirectos totais num valor de 200 milhões de euros, sendo que a mortalidade contribuiu com 58,4 %, ou seja, 116,2 milhões de euros e a morbilidade com 41,6 %, mais especificamente cerca de 83,2 milhões de euros (Pereira e Mateus, 2003).. 13.
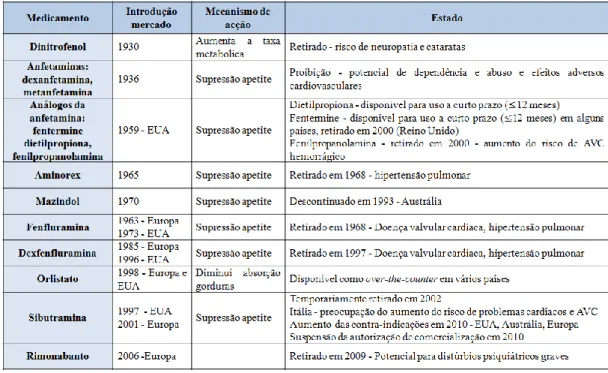
(27) III.. Farmacoterapia. Os medicamentos anti-obesidade actuam por diferentes mecanismos, quer a nível do SNC, quer a nível dos tecidos periféricos. Estes mecanismos incluem: redução da ingestão calórica (inibindo o apetite ou aumentando a saciedade), aumento do gasto energético e da oxidação dos lípidos ou inibição da ingestão e absorção de macronutrientes da dieta (Carrasco et al., 2009; Hainer, 2011). A eficácia destes fármacos depende da capacidade de reduzir a acumulação de gordura, manter a perda de peso, diminuir riscos para a saúde associados à obesidade de forma a reduzir a mortalidade e comorbilidade, e consequentemente melhoria da qualidade de vida (Hainer, 2011). A terapêutica anti-obesidade foi introduzida no início do século XX com a comercialização de estimulantes metabólicos, tais como extractos da glândula tiróide. Desde então foram vários os princípios activos aprovados para a terapêutica da obesidade, tais como dinitrofenol, aminorex, fenfluramina, dexfenfluramina e rimonabanto (Tabela 3). Destes, muitos vieram a ser retirados do mercado devido a problemas de toxicidade (Novotna et al., 2010; Ioannides-Demos, Piccenna e McNeil, 2011).. Tabela 3 - Fármacos desenvolvidos para o tratamento da obesidade desde 1930 até à actualidade (adaptado de Ioannides-Demos, Piccenna e McNeil, 2011).. 14.
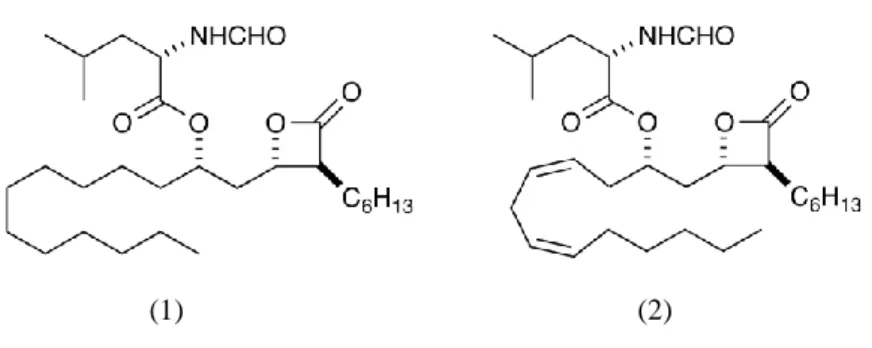
(28) 3.1 Orlistato (Xenical®, Alli®). O tetrahidrolipstatin (Figura 2), comercializado com o nome genérico de orlistato, é uma forma estável saturada do lipstatin natural, um inibidor irreversível da lipase pancreática (Venukadasula et al., 2010). Foi isolado pela primeira vez em 1987 de bactérias do solo Streptomyces toxytricini encontradas nas ilhas Baleares, Espanha (Ballinger e Peikin, 2002; Finer, 2002). A primeira síntese total foi conseguida por Schneider e os seus colaboradores no mesmo ano, através da olefinação de Wittig e condensação aldólica como etapas fundamentais no processo (Venukadasula et al., 2010).. (1). (2). Figura 2 - Estrutura química do tetrahidrolipstatin (1) e lipstatin (2) (adaptado de Venukadasula et al., 2010).. O orlistato é um composto lipofílico que exerce a sua actividade no lúmen do estômago e do intestino delgado através do estabelecimento de uma ligação covalente ao local activo das lipases gástrica e pancreática. Consequentemente, as referidas enzimas são inactivadas, impedindo a hidrólise dos triacilglicerois, provenientes dos alimentos, em ácidos gordos livres e monoacilglicerois. Dado que os triacilglicerois não digeridos não são absorvidos há um défice calórico e um efeito positivo na perda de peso (Ballinger e Peikin, 2002; Derosa et al., 2010a). Assim, o orlistato produz uma redução na absorção intestinal de gorduras da dieta em cerca de 30 %, podendo promover a perda de peso, a manutenção da perda de peso a longo prazo e impedir a sua recuperação em pacientes obesos em conjunto com uma dieta de restrição calórica (Hsu et al., 2010; Powell e Khera, 2010).. 15.
(29) Vários estudos demonstram que a biodisponibilidade do orlistato é inferior a 1 %, devido à sua baixa absorção sistémica e ao metabolismo de primeira passagem, sendo a sua excreção praticamente inalterada nas fezes. Apenas uma pequena fracção de fármaco é absorvido após ingestão oral, o que o torna relativamente seguro (Hsu et al., 2010). Além do mais, devido ao facto deste fármaco ser específico para as lipases, não apresenta efeitos inibitórios significativos noutras enzimas digestivas, tais como a amilase, a tripsina, a quimotripsina e as fosfolipases, e como não interfere com neurotransmissores, não apresenta nenhum potencial para dependência (Ballinger e Peikin, 2002; Hsu et al., 2010; Novotna et al., 2010). Até à data, foram vários os autores que direccionaram a sua investigação para o estudo deste princípio activo, não só no que respeita à sua eficácia, mas também ao seu potencial interesse na terapêutica e na prevenção de diversas patologias e na promoção de mudanças comportamentais. Foram igualmente conduzidos estudos de avaliação da segurança da administração do orlistato conjuntamente com outros princípios activos (Hollywood e Ogden, 2011).. i. Eficácia do orlistato na perda de peso. Relativamente à eficácia do orlistato na perda de peso, vários estudos resumem os resultados obtidos em ensaios clínicos demonstrando perdas de peso significativas (Finer, 2002). Neff e Aronne (2007) realizaram uma revisão de ensaios clínicos randomizados demonstrando que o orlistato é uma terapia eficaz coadjuvante da perda de peso. Em média, os pacientes medicados com orlistato perderam mais 2,7 kg (ou 2,9 %) do que os que receberam placebo, além de que apresentaram uma redução de triacilglicerois e colesterol LDL. Outras pesquisas sugerem, também, que este fármaco estimula a perda de peso, evita ganhos de peso posteriores, reduz os níveis de triacilglicerois e colesterol sanguíneos, melhora a tolerância oral à glicose e diminui a pressão arterial (Hsu et al., 2010). Um estudo a curto prazo, 12 semanas, demonstrou que o aumento das doses de orlistato, juntamente com uma dieta pobre em gordura e hipocalórica produziu uma maior perda de peso, ver Tabela 4 (Finer, 2002).. 16.
(30) Placebo 2,9 Kg. Perda de peso (12 semanas) Orlistato 30 mg/dia 180 mg/dia 3,61 Kg 3,69 Kg. 360 mg/dia 4,7 Kg. Tabela 4 - Perda de peso associada a diferentes dosagens de orlistato (adaptado de Finer, 2002).. Um outro estudo controlado, de 1 ano, com uma dose de 360 mg de orlistato diária em 267 pacientes obesos demonstrou uma perda de peso em 8,5 % comparando com 5,4 % em pacientes tratados com placebo (Finer, 2002). Num estudo de grupo randomizado num multricentro Europeu com 743 pacientes cujo IMC se apresentava entre 28 e 47 Kg m-2, com administrações de 120 mg de orlistato três vezes por dia ou placebo juntamente com uma dieta hipocalórica, verificou-se que, ao final de um ano, a perda de peso no grupo com orlistato foi de 10,2 % e no grupo com placebo 6,1 %. Durante o segundo ano, o grupo que continuou com orlistato apresentou uma perda de 0,9 Kg enquanto no grupo com placebo, verificou-se um ganho de peso de 2,5 Kg (Finer, 2002). A partir da análise de vários estudos clínicos, Finer (2002) conclui que o grupo com orlistato demonstrou uma perda média de peso de 2,90 Kg em relação ao grupo com placebo. Castro et al. (2009) citam um estudo, realizado em centros de saúde nacionais, sobre a redução do excesso de peso e comorbilidades com o orlistato, com o objectivo de comparar os resultados obtidos em meio hospitalar. Os resultados revelaram-se semelhantes a outros já realizados: 87 % dos doentes apresentaram uma redução de pelo menos 5 % do peso e 51 % uma redução de no mínimo 10 %, não se verificando diferenças significativas entre homens e mulheres. Os mesmos autores publicaram em 2009 um estudo com o objectivo de avaliar, em indivíduos obesos com hipercolesterolémia, a eficácia do orlistato na perda de peso e na melhoria do perfil lipídico, incluindo 10 centros portugueses por um período de 6 meses. Dos 106 doentes que completaram a análise, divididos em dois grupos, com orlistato 120 mg e com placebo, apresentaram uma redução média de peso de 5,9 % (5,6 Kg) e 2,3 % (2,2 Kg), respectivamente, tendo a maior diferença de redução ocorrido nas primeiras 4 semanas. No período de tratamento não se observaram diferenças significativas dos níveis de triacilglicerois entre grupos, porém verificaram-se reduções nos valores de colesterol total e colesterol LDL no grupo com orlistato, enquanto no grupo com placebo se. 17.
(31) verificou o inverso, tendo os valores de colesterol total e colesterol LDL aumentado (Castro et al., 2009).. ii. Benefícios do orlistato noutras patologias. No que respeita ao benefício do orlistato noutras patologias, especula-se que o orlistato poderá ser um medicamento útil, quer na prevenção da DA (por reduzir a absorção da gordura da dieta), quer na melhoria dos factores de risco cardiovascular (Du e Wang, 2009). O uso de orlistato em diabéticos obesos ou com excesso de peso, tem também vindo a ser avaliado (Finer, 2002). Por exemplo, Torgerson et al. (2004) conduziram a maior e mais prolongada observação realizada até à data com um medicamento indicado para a perda de peso, designado XENDOS (do inglês, Xenical in the Prevention of Diabetes in Obese Subjects), com 3305 pacientes obesos com tolerância normal ou diminuída à glicose, durante 4 anos. Foi realizado para determinar a segurança, a tolerabilidade e o efeito a longo prazo do orlistato combinado com mudanças no estilo de vida, na redução do peso e progressão de diabetes mellitus tipo 2, assim como avaliar o efeito do tratamento sobre anomalias metabólicas associadas ao aumento do risco de doenças cardiovasculares. O estudo demonstrou uma perda de peso média de 5,8 Kg no grupo orlistato em comparação com 3,0 Kg no grupo controlo e uma redução na ocorrência de diabetes mellitus tipo 2 de 9,0 % para 6,2 %, ou seja, perder peso com o orlistato reduz em 37 % o risco de desenvolver esta patologia, associada a mudanças de estilo de vida. Além do mais, os pacientes tratados com orlistato apresentaram estatisticamente uma redução significativa da CC, pressão arterial, colesterol total e colesterol LDL, e melhorias na concentração sanguínea de glicose e resistência à insulina em comparação com pacientes que receberam apenas placebo e dieta. Por outro lado, demonstrou também segurança e tolerabilidade a longo prazo. Um estudo piloto, em desenvolvimento, apoiado pelo Hoffmann-La Roche Limited que produz o Xenical (orlistato 120 mg), pretende determinar o efeito do uso de medicação para a perda de peso e investigar a eficácia deste medicamento sobre os factores de risco de doença cardíaca, por um período de três meses (Clinical Trials, 2011). Hollywood e Ogden (2011) exploraram a perda de peso acompanhada de mudanças comportamentais durante uma terapia de 6 meses com orlistato em 566 doentes. Concluíram que, ao final. 18.
(32) de 6 meses, a maioria perdeu peso e apresentou melhorias na dieta. Os pacientes que perderam um maior peso demonstraram uma diminuição na crença de soluções médicas, diminuição da alimentação pouco saudável, confiança no controlo de tratamento e uma crença crescente de que as consequências desagradáveis são devidas ao comportamento alimentar e apenas a uma parte do fármaco. Concluíram que o orlistato pode potenciar a perda de peso se usado em conjunto com modificações comportamentais e de estilo de vida. Estes resultados apresentam implicações na atitude dos pacientes e no uso deste fármaco, pois pode encorajar os pacientes, facilitando a promoção de mudanças no comportamento alimentar necessárias para a perda de peso, tanto a curto como a longo prazo, e na sua manutenção. Além do mais, Derosa et al. (2010a) compararam o uso de orlistato com orlistato associado a L-carnitina em pacientes diabéticos obesos, concluindo que a associação de orlistato à L-carnitina apresentou melhores resultados na perda de peso, perfil glicémico e lipídico, resistência à insulina e parâmetros inflamatórios e não se verificaram efeitos adversos significativos. Assim, estes efeitos positivos poderão estar associados a um efeito sinérgico entre os dois fármacos. O orlistato também tem sido estudado em adolescentes. Em 2003, o orlistato foi aprovado pela FDA para o tratamento da obesidade em adolescentes de idade compreendida entre os 12 e os 16 anos (Li e Cheung, 2009). Chanoine et al. (cit. in Li e Cheung 2009) citam um estudo com 539 adolescentes, com a administração de orlistato 120 mg três vezes por dia, durante 54 semanas, em que o IMC diminuiu 0,55 Kg m -2 nos grupos tratados com o fármaco e no grupo com placebo verificou-se um aumento de 0,31 Kg m-2. Concluiu-se que o orlistato melhora significativamente a gestão do peso corporal. em. adolescentes. obesos. juntamente. com. a. dieta,. modificações. comportamentais e exercício em comparação com o placebo. Já Hsu et al. (2010) indicam um estudo randomizado duplo cego efectuado durante 6 meses em 40 adolescentes em que não se verificou uma redução significativa de IMC. Porém, relativamente à obesidade infantil, os efeitos do orlistato ainda não são totalmente compreendidos, sendo necessários mais estudos.. 19.
(33) iii. Efeitos adversos do orlistato. Apesar de ser um princípio activo relativamente seguro, o orlistato também apresenta alguns efeitos adversos, relacionados predominantemente com efeitos gastrointestinais resultantes da deficiente absorção de gorduras (Finer, 2002). Cerca de 15 a 30 % dos pacientes apresentam sintomas que incluem fezes líquidas gordurosas, diarreia, flatulência, dor e distensão abdominal, dispepsia e incontinência anal que são particularmente evidentes após uma refeição rica em gordura. Outros efeitos secundários descritos são a ansiedade, diverticulose, reacções de hipersensibilidade, bolhas na pele, colelitíase e sangramento rectal (Finer, 2001; RPSGB, 2009; Hollywood e Ogden, 2011; Ioannides-Demos, Piccenna e McNeil, 2011). Através de medições da gordura fecal verifica-se que o efeito do orlistato a 120 mg três vezes por dia se observa dois dias após o tratamento. Contudo, com a descontinuação do tratamento, a gordura nas fezes geralmente normaliza dentro de 48 - 72 horas. A inibição da absorção da gordura da dieta depende da dose, sendo que doses superiores a 360 mg por dia inibem pouco a absorção. Assim, através de vários estudos estipulou-se que a dose recomendada seja de 120 mg três vezes por dia (Ballinger e Peikin, 2002). Dados conjuntos de 1 a 2 anos sugerem que 25 % dos pacientes tratados podem relatar efeitos secundários durante o primeiro ano de tratamento, e estes são suficientemente graves para justificar o abandono do tratamento em 1 % dos pacientes. Tem sido sugerido que estes efeitos sejam adicionados à eficácia do fármaco para impôr a mudança, ajudando, o paciente a evitar refeições ricas em gordura, embora não exista uma correlação entre a frequência dos efeitos adversos e a eficácia em estudos clínicos (Finer, 2002). Além dos efeitos adversos citados, Ahmad e Mahmud (2010) relataram dois casos de pacientes que desenvolveram dor aguda abdominal e aumento de enzimas pancreáticas logo após o início do tratamento. Recomenda-se precaução na utilização em pacientes com risco de lesão pancreática, dada a possibilidade do orlistato poder provocar pancreatite aguda. Por outro lado, há alguma preocupação com o facto do orlistato poder estar associado ao risco aumentado de cancro do cólon. Um estudo efectuado em ratos revelou a existência de associação entre o orlistato e o aumento de marcadores préneoplásicos do cólon (Hsu et al., 2010). Pelo contrário, Kridel (2004) descreveu que orlistato apresenta propriedades anti-tumorais por inibir selectivamente a enzima ácido gordo sintase (FAS, do inglês fatty acid synthase) das células tumorais. A expressão da 20.
(34) FAS é alta em células cancerígenas e baixa em células epiteliais normais, sendo implicada na progressão de vários tipos de tumores. O mesmo autor menciona que o orlistato oferece um potente efeito antiproliferativo em muitas células tumorais, incluindo da mama e cólon, além de que também induz a apoptose de células tumorais. Sendo assim, o orlistato poderá ser útil na terapia antitumoral (Kridel, 2004). Fernandes et al. (2010) expuseram um caso de um paciente medicado com orlistato que apresentava aumento dos níveis do antigénio carcino embriogénico (CEA, do inglês carcinoembryonic. antigen),. marcador. do. soro. comummente. utilizado. no. acompanhamento de pacientes com tumores. Curiosamente, o nível de CEA voltou ao normal após a suspensão de orlistato, sendo que o aumento deste marcador pode ser devido à presença de fezes gordurosas no tracto gastrointestinal. Assim, dado o grande número de pacientes que tomam orlistato, pode este ser uma causa importante de falsos positivos na determinação de CEA. Além do mais, devido ao facto de aumentar os ácidos gordos livres no intestino grosso, por inibição da lipase, aumenta a absorção de oxalato, apresentando um aumento do risco de hiperoxalúria e nefropatia. Tal implica que pacientes com problemas renais devam consultar um médico antes da utilização de orlistato (Hsu et al., 2010). Ainda no que se refere a efeitos adversos, Lazic et al. (2011) relataram um caso de vasculite leucocitoclástica cutânea, com bolhas, associado ao orlistato, somente existindo um outro caso descrito na literatura associado à terapêutica com este fármaco mas de menor gravidade. Recentemente foi relatada a associação do uso de orlistato com falência hepática. A FDA recebeu 32 relatórios de lesões hepáticas graves entre 1999 e 2008, incluindo 6 casos de falência hepática. Após revisão de segurança foram identificados 13 casos de lesão hepática grave, incluindo orlistato de venda livre (Ioannides-Demos, Piccenna e McNeil, 2011).. iv. Interacções associadas à utilização do orlistato. Um outro problema associado ao orlistato debate-se com a alteração da absorção de fármacos lipofílicos, tais como o aciclovir, ciclosporina, levotiroxina, amiodarona e varfarina, quando usados concomitantemente com orlistato (Bigham, McGuigan e MacDonald, 2006; Bray, 2010; Powell e Khera, 2010). Relativamente à ciclosporina,. 21.
(35) pensa-se que há uma diminuição da biodisponibilidade clinicamente relevante por um mecanismo ainda não conhecido. Assim, recomenda-se que os transplantados tomem a ciclosporina com pelo menos 2 horas de intervalo em relação à administração de orlistato, de modo a diminuir o risco de uma inadequada imunossupressão (Novotna et al., 2010). As guidelines da Sociedade Real Farmacêutica da Grã-Bretanha contraindicam mesmo o uso concomitante destes dois fármacos. No que respeita à utilização de amiodarona, as mesmas guidelines indicam que os pacientes devem aconselhar-se antes da utilização de orlistato, devido ao facto de se observar uma diminuição dos níveis plasmáticos da amiodarona quando tomada concomitantemente com orlistato, o que poderá implicar um ajuste da dose de amiodarona durante o tratamento com orlistato (RPSGB, 2009). Ainda no que refere a interacções, alguns estudos com orlistato em voluntários saudáveis revelaram que uma dose de 120 mg três vezes ao dia não alterava significativamente a farmacocinética e farmacodinâmica de uma dose única de 30 mg de varfarina oral. Porém os autores MacWalter, Fraser e Amstrong (2003) sugerem a possibilidade de que estes resultados iriam ser alterados com o uso continuado. Os mesmos autores apresentam um caso que sugere que o desequilíbrio entre a vitamina K e a varfarina é alterado pelo orlistato, que pode ser provocado pela diminuição de vitamina K e vitaminas lipossolúveis. Bigham, McGuigan e MacDonald (2006) notificam convulsões em doentes tratados concomitantemente com orlistato e antiepilépticos (lamotrigina 200 mg/dia) não se podendo excluir uma relação casual de interacção. Os mesmos autores sugerem uma redução da absorção de antiepilépticos lipofilicos quando usados concomitantemente com orlistato (Xenical®), sendo que necessitam de acompanhamento pois pode haver um descontrolo da epilepsia. Relativamente à fluoxetina, atenolol, captopril, furosemida e nifedipina não se verificaram alterações da absorção. Quanto aos contraceptivos orais, o orlistato pode reduzir indirectamente a disponibilidade dos mesmos e conduzir a uma inesperada gravidez em alguns casos individuais. Recomenda-se a utilização de um método contraceptivo adicional, no caso de se verificar diarreia grave. A utilização do orlistato também não é recomendada concomitantemente. com. acarbose,. por. ausência. de. estudos. de. interacção. farmacocinética. Por outro lado, o tratamento com orlistato diminui a absorção de vitaminas lipossolúveis (A, D, E e K), sendo recomendada a toma de suplementos. 22.
(36) multivitamínicos preferencialmente ao deitar, ou seja, num horário diferente do da toma de orlistato (RPSGB, 2009). De modo a atenuar os efeitos negativos associados a este fármaco, Dolenc et al. (2010) desenvolveram, recentemente, um novo sistema terapêutico assente numa nanosuspensão. Esta nova formulação pode potencialmente levar a uma diminuição da dose e, consequentemente, dos efeitos adversos dependentes da dose.. v. Medicamentos aprovados com o princípio activo orlistato. As recomendações actuais sugerem que o orlistato deve ser utilizado por pacientes com um histórico de tentativas frustradas de emagrecimento, demonstrando uma perda de peso menor a 2,5 Kg com dieta e exercício no mês antes da sua primeira prescrição (Hollywood e Ogden, 2011). Actualmente existem dois medicamentos aprovados na União Europeia contendo como principio activo orlistato, Xenical® e Alli®. O Xenical® (cápsulas, 120 mg), produzido pela F. Hoffmann-La Roche (Basel, Suiça) e aprovado em 1998 pela EMA para tratamento prolongado (> 12 meses) da obesidade, é utilizado para o tratamento de doentes obesos ou com excesso de peso com um IMC igual ou superior a 30 kg m-2 ou a 28 kg m-2, respectivamente, passível de provocar doença (EMA, 2011). A dose recomendada é de uma cápsula de 120 mg três vezes por dia, durante ou 1 hora após cada refeição principal com gorduras. Estudos demostraram que a administração do orlistato às refeições não interfere significativamente com a sua eficácia: uma dose de 80 mg durante, 1 ou 2 horas depois da refeição produz uma eficácia de 33, 34 e 27 %, respectivamente (Finer, 2002). O Alli® (cápsulas, 60 mg), produzido pela GlaxoSmithKline PLC (Londres, Inglaterra) foi aprovado em 2008 pela EMA, em toda a Europa, sem prescrição médica, coincidindo com a suspensão da autorização de introdução no mercado de dois fármacos inibidores do apetite, sibutramina e rimonabanto, retirados pelos seus efeitos adversos (Neff e Aronne, 2007; Weidmann et al., 2011). Actualmente Alli® é o único medicamento para a perda de peso no mercado internacional que não necessita de prescrição médica (Weidmann et al., 2011). A autorização de comercialização restringe a utilização a adultos com excesso de peso e com um IMC igual ou superior a 28 kg m -2 (Neff e Aronne, 2007; Weidmann et al., 2011). Dados de estudos randomizados. 23.
(37) indicam que o orlistato, na dose de 60 mg é seguro e eficaz para uso em cuidados de saúde primários (Weidmann et al., 2011). Dados de ensaios clínicos sugerem que esta dose mais baixa, embora ligeiramente menos eficaz do que a dose prescrita de 120 mg três vezes ao dia, bloqueia a absorção de ≈ 25 % da gordura ingerida e permite uma perda de peso de ≈ 5 % do peso corporal total, sendo associada a uma incidência ligeiramente menor de efeitos adversos gastrointestinais (Neff e Aronne, 2007; EMA, 2011; Weidmann et al., 2011). Dois estudos envolvendo 1353 pacientes com um IMC igual ou superior a 28 kg m-2, medicados com Alli® 60 mg demonstraram ocorrer uma perda de peso corporal de cerca de 4,8 Kg ao fim de um ano, comparativamente a 2,3 kg no placebo. Contudo, um outro estudo que utilizou Alli® em 391 pacientes com um IMC entre 25 e 28 kg m-2, durante 4 meses, não conseguiu demonstrar uma perda de peso com relevância para os pacientes (EMA, 2011). Schwartz et al. (2008) realizaram um estudo sobre a utilização de orlistato 60 mg sem supervisão médica, verificando que, ao final de 3 meses de estudo, este fármaco pode ser usado em segurança e promove uma elevada satisfação dos consumidores. A maioria dos participantes apresentou mudanças comportamentais na dieta e actividade física, assim como perda de peso durante o período de estudo. Alli® está contra-indicado em pacientes com hipersensibilidade à substância activa ou a qualquer excipiente, pacientes que tomam concomitantemente ciclosporina, varfarina ou outros anticoagulantes orais, pacientes com síndrome de má absorção crónica ou colestase, assim como mulheres grávidas ou a amamentar (EMA, 2011). A perda de peso pode ser acompanhada por uma melhoria dos níveis de pressão arterial ou colesterol, sendo necessário sensibilizar para a possível necessidade. de. ajuste. da. dose. de. medicamentos. para. a. hipertensão. ou. hipercolesterolemia aquando da toma concomitante com orlistato. No caso de esteatorreia é necessário o aconselhamento junto de profissionais de saúde pois não é aconselhado o uso de agentes antimotilidade (RPSGB, 2009). Recentemente, entrou uma prorrogação da Autorização de Introdução no Mercado para incluir uma nova dosagem e uma nova forma farmacêutica, Alli® 27 mg em comprimidos mastigáveis. A dosagem é muito inferior e o facto de ser mastigável melhora a eficiência da mistura da substância activa com as gorduras da dieta (EMA, 2011). Embora a pesquisa indique que o orlistato pode promover a perda de peso, continuam a existir problemas com a adesão e com a grande variabilidade dos resultados entre os. 24.
Imagem


Documentos relacionados
Nessa situação temos claramente a relação de tecnovívio apresentado por Dubatti (2012) operando, visto que nessa experiência ambos os atores tra- çam um diálogo que não se dá
Não obstante a reconhecida necessidade desses serviços, tem-se observado graves falhas na gestão dos contratos de fornecimento de mão de obra terceirizada, bem
Ressalta-se que mesmo que haja uma padronização (determinada por lei) e unidades com estrutura física ideal (física, material e humana), com base nos resultados da
[r]
Além desta verificação, via SIAPE, o servidor assina Termo de Responsabilidade e Compromisso (anexo do formulário de requerimento) constando que não é custeado
De acordo com o Consed (2011), o cursista deve ter em mente os pressupostos básicos que sustentam a formulação do Progestão, tanto do ponto de vista do gerenciamento
Declaro que fiz a correção linguística de Português da dissertação de Romualdo Portella Neto, intitulada A Percepção dos Gestores sobre a Gestão de Resíduos da Suinocultura:
Este desafio nos exige uma nova postura frente às questões ambientais, significa tomar o meio ambiente como problema pedagógico, como práxis unificadora que favoreça