Universidade de Lisboa
Faculdade de Ciências
Departamento de Biologia Animal
VARIAÇÃO GENÉTICA DO TNF-α E A RESPOSTA À
TERAPÊUTICA DA HEPATITE C CRÓNICA
Diana Isabel Viana da Fonseca Campelo
DISSERTAÇÃO
MESTRADO EM BIOLOGIA HUMANA E AMBIENTE
Universidade de Lisboa
Faculdade de Ciências
Departamento de Biologia Animal
VARIAÇÃO GENÉTICA DO TNF-α E A RESPOSTA À
TERAPÊUTICA DA HEPATITE C CRÓNICA
Diana Isabel Viana da Fonseca Campelo
Dissertação orientada por:
Professor Doutor Manuel Bicho, Faculdade de Medicina da Universidade de Lisboa Professora Doutora Deodália Dias, Faculdade de Ciências da Universidade de Lisboa
MESTRADO EM BIOLOGIA HUMANA E AMBIENTE
ii
Agradecimentos
Gostaria de expressar o meu agradecimento e gratidão a todos os que apoiaram e contribuíram para a realização deste estudo.
Ao Professor Doutor Manuel Bicho, Professor Catedrático da Faculdade de Medicina de Lisboa e Director do Laboratório de Genética, pela oportunidade de realizar este estudo sob a sua orientação.
À Professora Doutora Deodália Dias, coordenadora do Mestrado de Biologia Humana e Ambiente, por ter aceite orientar este projecto a partir da Faculdade de Ciências da Universidade de Lisboa.
Ao serviço de Gastrenterologia do Hospital de Santa Maria, na pessoa da Professora Doutora Fátima Serejo da consulta de Hepatologia, por me ter possibilitado desenvolver este trabalho e pela disponibilidade no aconselhamento.
Em memória da Prof. Doutora Cláudia Marinho e um agradecimento especial pelo seu acolhimento entusiasta.
À Dra. Joana Ferreira por todo o apoio e disponibilidade, por todos os ensinamentos e, principalmente, pela confiança demonstrada no meu trabalho. A todos os colaboradores do Laboratório de Genética, Irina Alho, Andreia Matos, Ângela Gil, Conceição Afonso e D. Manuela pelo apoio, disponibilidade e companheirismo. E aos colegas, Joana Pereira, Joana Cardoso, José Albuquerque, Rafaela Cabaça e Leonor Lopes, por todas as horas partilhadas no laboratório, pela entreajuda, troca de conhecimentos e amizade.
Um agradecimento especial à minha família, nomeadamente à minha mãe, por todo o amor, apoio, paciência, esforço e dedicação. Ao meu pai por me ter proporcionado a minha formação superior e aos meus irmãos pelos anos de convivência e aprendizagem juntos e pelo apoio incondicional e incentivo alegre.
Aos meus grandes amigos Filipa Vassallo e Silva, Sara Fernandes, Inês Figueira, e André Marques pela amizade e apoio emocional. Aos meus amigos da paróquia dos Olivais pelo amor fraterno e por me acolherem e acompanharem sempre. E aos meus amigos e companheiros de escutismo do Agrupamento da Portela, pelas vivências e aprendizagens em conjunto e por compreenderem a minha ausência quando o trabalho assim exigiu.
Por fim, aos restantes amigos e colegas com quem me cruzei na Faculdade de Ciências pela ajuda, amizade, convívio e horas de trabalho e estudo partilhadas.
iii
Resumo
A infecção pelo Vírus da Hepatite C (VHC) é a principal causa de Hepatite C crónica (HCC), cirrose hepática e carcinoma hepatocelular. A HCC representa um problema de saúde pública que afecta cerca de 3% da população mundial, estimando-se que em Portugal existam cerca de 150 000 portadores. Em 20-30% dos casos a infecção é eliminada, contudo em 70-80% a infecção progride para a cronicidade, fazendo desta doença uma importante causa de morbilidade e mortalidade.
O TNF-α é uma citocina com uma vasta gama de actividades inflamatórias, apoptóticas e imunomoduladoras, maioritariamente secretado por células do sistema imune, e crítica para a determinação da resposta imune enquanto mediador celular e interveniente no processo inflamatório.
Vários polimorfismos bialélicos foram descritos no gene do TNF-α incluindo sete codões na região promotora. O estudo destes polimorfismos é importante como forma de avaliar a sua relação com o desfecho da doença, bem como averiguar se a resposta à terapêutica anti-viral poderá resultar da variação genética individual.
O polimorfismo na posição -308, caracterizado pela substituição de uma guanina por uma adenina, foi associado a doenças autoimunes como a artrite reumatóide, lúpus eritematoso sistémico, psoríase e doença celíaca, bem como a formas graves de doenças infecciosas. O polimorfismo na posição -238, caracterizado pela mesma substituição de aminoácidos, foi associado a várias doenças e à não eliminação do vírus da Hepatite (B e C).
Os objectivos deste trabalho foram avaliar a frequência da variação genética destes polimorfismos num grupo de doentes com HCC e a importância destas variantes na história natural da HCC.
Os resultados deste estudo apontam para a ausência de uma associação entre a variante -238 G>A e a duração e resposta à terapêutica da HCC; a relação entre o polimorfismo -308A e a resposta à terapêutica da HCC; a relação de vários fenótipos intermédios bioquímicos e características patológicas que influenciam a resposta, nomeadamente a carga viral, enzimas hepáticos, perfil lipídico, fibrose e esteatose hepáticas.
Palavras-chave: Hepatite C crónica, tumor de necrose tumoral, polimorfismos genéticos
iv
Abstract
VHC infection is the leading cause of chronic hepatitis C (CHC), liver cirrhosis and hepatocellular carcinoma. CHC represents a public health problem that affects about 3% of the world population. It is estimated that in Portugal there are aproximately 150 000 patients infected. In 20-30% of the cases the infection is eliminated, yet in 70-80% of the patients the infection becomes chronic, making this disease a major cause of morbidity and mortality.
TNF-α is a cytokine with a broad range of inflammatory, apoptotic, and immunomodulatory activities. This protein is secreted by cells of the immune system, and it is critical to determine the cellular immune response, being a mediator and intervening in the inflammatory process.
Several biallelic polymorphisms have been described in the TNF-α gene including seven codons in the promoter region. The study of these polymorphisms is important in order to assess their relationship with disease outcome and determine whether the response to anti-viral therapy may result from individual genetic variation.
The polymorphism at position -308, characterized by the substitution of a guanine for adenine, was associated with autoimmune diseases such as rheumatoid arthritis, systemic lupus erythematosus, psoriasis and celiac disease as well as severe forms of infectious diseases. The polymorphism at position -238, characterized by the same aminoacid substitution, was associated with non-elimination of hepatitis virus as well as other pathologies.
The purpose of this study was to evaluate the frequency of genetic variation of these polymorphisms in a group of patients with CHC and assess the importance of these variants in the natural history of the disease.
The results of this study suggest the absence of an association between the variant -238 G>A and duration and response to therapy of HCC, the association between the -308A polymorphism and response to therapy of HCC and the influence of various biochemical parameters and pathological features that influence response, such as viral load, liver enzymes, lipid profile, hepatic fibrosis and steatosis.
v
Lista de Abreviaturas
ALT Alanina aminotransferase
APC Célula apresentadora de antigénio
AST Aspartato aminotransferase
BLAST Basic Local Alignment Search Tool
CEU População de Norte-Americanos residentes no Estado do Utah com ancestralidade da Europa Ocidental e do Norte
CD4+ Cluster de diferenciação 4 CD8+ Cluster de diferenciação 8
cDNA DNA complementar
CHC Chronic Hepatitis C
CLDN1 Claudina-1
CTL Linfócitos T Citotóxicos (do inglês: Cytotoxic T Lymphocyte)
IMC Índice de Massa Corporal
dbSNP Single Nucleotide Polymorphism Database
DC-SIGN dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin
dL decilitro
DM Diabetes Melittus
DNA Ácido desoxirribonucleico EDTA Ácido etilenodiaminotetraacético
ELISA Enzyme-Linked Immunosorbent Assay
EUA Estados Unidos da América
FA Fosfatase Alcalina
GAG Glicosaminoglicano
GB Vírus da Hepatite G
GT ɣ-glutamil transpeptidase
GWAS Genome Wide Association Studies
HapMap Haplotype Map of the human genome
HCC Hepatite C Crónica
vi
VHCAg Antigénio da proteína core do vírus da Hepatite C
HDL High Density Lipoprotein
HLA Human leukocyte antigen
HOMA Homeostasis Model Assessment
IFN-α PEG Interferão-α peguilhado IL-10 Interleucina 10
IL-28 Interleucina 28
IMC Índice de massa corporal
IRES Internal Ribossome Entry Site
LD Lipid Droplet
LDL Low Density Lipoprotein
LDLox LDL oxidadas
LDLR Receptor das LDL
LPL Lipoproteína Lipase
L-SIGN Liver/lymph node-specific intercellular adhesion molecule-3-grabbing integrin
mg miligrama
MHC Major Histocompatibility Complex
mL mililitro
mM milimolar
mRNA Ácido ribonucleico mensageiro
NANB Hepatite pós-transfusional não-A, não-B
NCBI National Centre for Biotecnology Information
ng nanograma NK Natural-Killer nm nanómetro NR Doentes HCC Não-Respondedores NS Non-Structural protease OCLN Ocludina
ORF Open-reading frame
pb Pares de bases nucleotídicas PCR Polymerase Chain Reaction
vii
Poli-UC Conserved UC-rich motif
RFLP Restriction Fragment Length Polymorfism
RBV Ribavirina
RdRp RNA dependent RNA polymerase
RE Retículo Endoplasmático
RIBA Recombinant ImmunoBlot Assay
RNA Ácido ribonucleico
RR Doentes HCC com Recidivas
RS Doentes HCC com Resposta Viral Sustentada
Rs number Database SNP number (NCBI SNP Database)
RT-PCR Real-Time Polymerase Chain Reaction RVS Resposta Viral Sustentada
SAA Serum Amyloid A
SNP Single-Nucleotide Polymorphism
SR-B1 Scavenger Receptor class B type 1
TAE Tris-acetato-EDTA
TGF-β Transforming growth factor β
Th1 T helper type 1
Th2 T helper type 2
Tm Temperatura de Melting
TNF-α Tumor Necrosis Factor
TNFA Gene do TNF-α
UTR Região não-codificante do mRNA (do inglês: UnTranslated Region)
VHB Vírus da Hepatite B
VHC Vírus da Hepatite C
VHCpp Pseudo-partículas virais VHC VIH Vírus da Imunodeficiência Humana
VLDL Very Low Density Lipoprotein
wt Alelo Selvagem (do ingles: wild-type)
viii
Índice de Figuras
Figura 1 Organização genómica e processamento da poliproteína de VHC ... 4
Figura 2 Modelo da entrada do VHC no hepatócito ... 6
Figura 3 Ciclo de vida do VHC ... 8
Figura 4 Fisiopatologia da esteatose hepática ... 16
Figura 5 Produtos amplificados para detecção da variante alélica TNF-α -308G>A, visualizados em gel de agarose ... 30
Figura 6 Curva de Melting após RT-PCR para detecção da variante alélica TNF-α G-238A ... 32
ix
Índice de Tabelas
Tabela 1 – Características demográficas e bioquímicas da população HCC estudada (I) ... 25
Tabela 2 – Características demográficas e bioquímicas da população HCC estudada (II) ... 26
Tabela 3 – Polimorfismos em estudo (Adaptado de Boraska et al, 2010) ... 28
Tabela 4 – Primers utilizados para a amplificação dos fragmentos de interesse ... 28
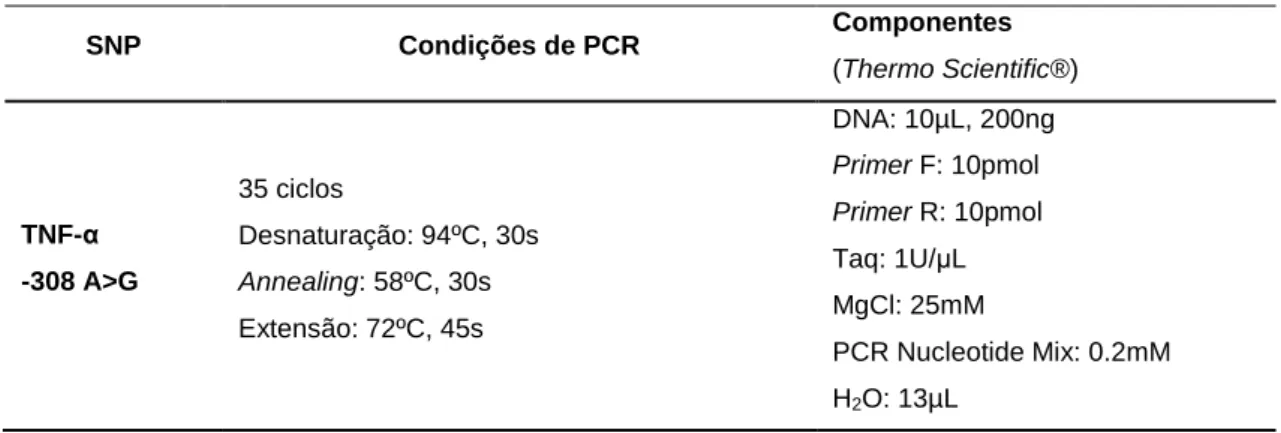
Tabela 5 – Condições de amplificação e componentes utilizados na reacção de PCR. ... 28
Tabela 6 – Metodologia usada e fragmentos de restrição possíveis de obter no estudo do polimorfismo através da técnica de RFLP ... 29
Tabela 7 – Componentes utilizados na reacção de RT-PCR para detecção da variante alélica TNF-α G-238A ... 31
Tabela 8 – Protocolo utilizado na reacção de RT-PCR para detecção da variante alélica TNF-α G-238A (segundo instruções do fabricante) ... 32
Tabela 9 – Frequências alélicas e genotípicas dos polimorfismos G>A nos codões -308 e -238 da região promotora do gene do TNF-α na população HCC estudada ... 34
Tabela 10 – Avaliação da relação do polimorfismo G>A no codão -308 da região promotora do gene do TNF-α na variação dos fenótipos basais estudados na população HCC ... 35
Tabela 11 – Avaliação da relação do polimorfismo G>A no codão -308 da região promotora do gene do TNF-α na variação dos fenótipos patológicos e resposta à terapêutica na população HCC... 36
Tabela 12 – Avaliação da relação do polimorfismo G>A no codão -238 da região promotora do gene do TNF-α na variação dos fenótipos bioquímicos basais estudados na população HCC ... 37
Tabela 13 – Avaliação da relação do polimorfismo G>A no codão -238 da região promotora do gene do TNF-α na variação nos fenótipos patológicos e resposta à terapêutica na população HCC... 38
Tabela 14 – Avaliação da variação dos fenótipos intermédios bioquímicos e patológicos basais na resposta à terapêutica na população HCC total ... 39
Tabela 15 – Diferenças nas características fisiopatológicas dos doentes HCC consoante a resposta à terapêutica ... 40
Tabela 16 – Avaliação da relação da presença do alelo mutante (GA+AA) no codão -308 da região promotora do gene do TNF-α na variação da resposta à terapêutica anti-viral ... 41
Tabela 17 – Diferenças nos fenótipos patológicos dos doentes portadores do alelo mutante (GA+AA) consoante a resposta à terapêutica ... 42
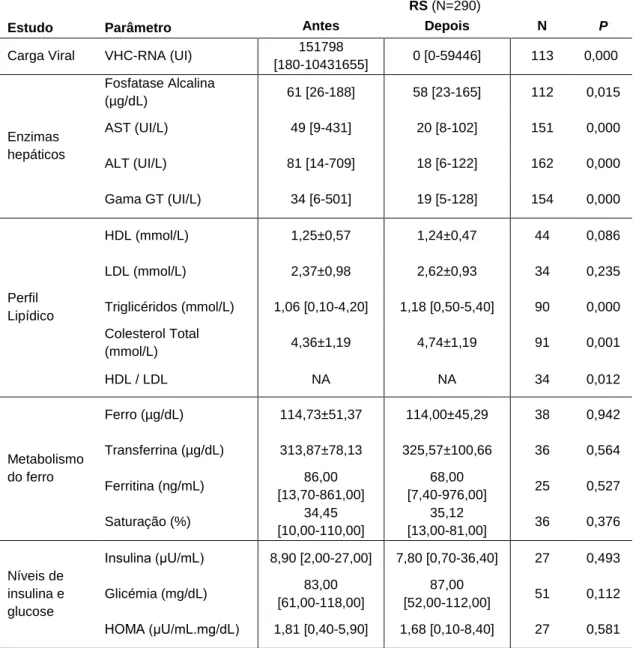
Tabela 18 – Avaliação dos fenótipos intermédios bioquímicos, antes e depois da terapêutica antiviral ... 43
Tabela 19 – Diferenças no fenótipo patológico dos doentes com resposta viral sustentada antes e depois da terapêutica anti-viral ... 44
Tabela 20 – Avaliação dos fenótipos intermédios bioquímicos e patológicos, antes e após a terapêutica antiviral, nos indivíduos portadores do alelo selvagem (TNF-α -308 GG) ... 45
Tabela 21 – Avaliação dos fenótipos intermédios bioquímicos e patológicos, antes e após a terapêutica antiviral, nos indivíduos portadores do alelo mutante (TNF-α -308 GA+AA)... 46
1 ÍNDICE Agradecimentos ... ii Resumo ... iii Abstract ... iv Lista de Abreviaturas ... v
Índice de Figuras ... viii
Índice de Tabelas ... ix
1.Introdução ... 3
1.1.Vírus da Hepatite C ... 3
1.1.1.Classificação e variabilidade do VHC ... 3
1.1.2.Estrutura do virião ... 5
1.1.3.Ciclo de vida do VHC e Metabolismo dos lípidos ... 6
1.1.4.Epidemiologia ... 8
1.2.Hepatite C Crónica ... 10
1.2.1.Padrões de Transmissão e Contágio ... 10
1.2.2.Diagnóstico ... 12
1.2.3.Co-factores da doença ... 13
1.3.Características histológicas do fígado em HCC ... 13
1.4.Factores genéticos do hospedeiro ... 17
1.4.1.Gene do TNF-α ... 18
1.4.2.Polimorfismos genéticos do TNF-α... 19
1.4.2.1.TNF-α -308G>A ... 19
1.4.2.2.TNF- α -238G>A ... 20
1.4.3.O papel dos polimorfismos no desfecho da infecção ... 21
1.5.Terapêutica na HCC ... 21
1.5.1.Critérios de Inclusão ... 22
2.Objectivos ... 24
3.Materiais e Métodos ... 25
3.1.População de estudo ... 25
3.1.1.Características demográficas e bioquímicas ... 25
3.1.2.Características fisiopatológicas e resposta à terapêutica ... 26
3.2.Critérios de Exclusão ... 27
3.3.Extracção de DNA genómico ... 27
2
3.5.Polimorfismos estudados ... 27
3.5.1.Deteção da variante alélica TNF-α -308G>A ... 28
3.5.1.1.Amplificação do DNA genómico ... 28
3.5.1.2.Genotipagem dos indivíduos ... 29
3.5.2.Deteção da variante alélica TNF-α -238G>A ... 30
3.5.2.1.Amplificação do DNA genómico ... 30
3.5.2.2.Genotipagem dos indivíduos ... 31
3.6.Análise Estatística ... 33
4.Resultados ... 34
4.1.Genotipagem do TNF-α e identificação dos polimorfismos ... 34
4.2.Relação do genótipo do TNF-α na variação dos parâmetros estudados ... 34
4.3.Relação da variação dos fenótipos intermédios bioquímicos e patológicos basais na resposta à terapêutica ... 38
4.4.Relação da presença do alelo mutante na resposta à terapêutica ... 40
4.5.Avaliação dos fenótipos intermédios bioquímicos, antes e depois da terapêutica anti-viral ... 43
4.5.1.Genótipo do TNF-α ... 45
5.Discussão ... 48
5.1.Genotipagem do TNF-α e identificação dos polimorfismos ... 48
5.2.Relação do genótipo do TNF-α na variação dos parâmetros estudados ... 49
5.3.Relação da variação dos fenótipos intermédios bioquímicos e patológicos basais na resposta à terapêutica ... 50
5.4.Avaliação dos fenótipos intermédios bioquímicos, antes e depois da terapêutica anti-viral ... 52 6.Conclusões ... 55 7.Referências Bibliográficas ... 56 ANEXOS ... 63 ANEXO I ... 63 ANEXO II ... 64
3
1. Introdução
1.1. Vírus da Hepatite C
O vírus da Hepatite C (VHC) foi identificado em 1989 nos EUA, por immunoscreening, do soro de um doente com Hepatite pós-transfusional não-A, não-B (NANB) e constitui a principal causa de Hepatite crónica (HCC), cirrose hepática e carcinoma hepatocelular em todo o mundo (Choo et al, 1989). No entanto, o vírus não foi visualizado conclusivamente. Os baixos níveis virais no soro e tecido hepático não permitiram a caracterização bioquímica dos produtos virais nativos e, mais importante, não foi possível desenvolver o VHC em cultura in vitro, o que impediu a elucidação do ciclo de vida viral e o desenvolvimento de agentes anti-virais específicos e vacinas preventivas. Apesar destes obstáculos, grandes progressos foram feitos no estudo do VHC nos últimos anos. Através de sistemas de expressão heteróloga, clones de cDNA funcional que são infecciosos in vivo em chimpanzés, um sistema de replicão, pseudo-partículas (VHCpp) - pseudo-partículas retrovirais que sofreram processos de engenharia genética de forma a incluírem proteínas funcionais do envelope de VHC- permitiram o estudo da entrada do vírus na célula em condições reprodutíveis e mensuráveis. Mais recentemente, foram criados sistemas completos de cultura de células (Moradpour et al, 2007).
1.1.1. Classificação e variabilidade do VHC
O VHC está incluído, em termos de classificação, no género Hepacivirus, dentro da família Flaviviridae que inclui os flavivírus (que causam, por exemplo, a febre amarela, o dengue e a febre da carraça) e os pestivírus animais (por exemplo, vírus da diarreia viral bovina) e os vírus GB-A GB-B e GB-C, que infectam humanos mas não causam doença (Thiel et al, 2005).
O VHC contém uma cadeia simples de RNA com aproximadamente 10 000 nucleótidos e é encapsulado por um envelope lipídico externo. O diâmetro do vírus é de 50-60nm (Czepiel et al, 2008). O genoma do virião VHC está inserido numa cápside icosaédrica que é envolvida por uma camada lipídica dupla na qual estão ancoradas duas glicoproteínas diferentes. O genoma contém três regiões distintas. Uma pequena região 5' não codificante que contém dois domínios, uma estrutura em stem-loop e um local interno de entrada do ribossoma (IRES), responsável pela ligação do ribossoma e
4
pela tradução das poliproteínas. Uma open-reading frame (ORF) de mais de 9 000 nucleótidos, que é traduzida para uma poliproteína precursora, clivada secundariamente para dar origem às proteínas estruturais (a proteína da cápside e as duas glicoproteínas do envelope E1 e E2) e as proteínas não estruturais (p7, NS2, NS3, NS4A, NS4B, NS5A e NS5B). As funções das proteínas não estruturais foram elucidadas e apenas as proteínas NS4B e NS5A não têm funções bem definidas até à data (Figura 1). O genoma contám ainda uma região não codificante curta 3'UTR, dividida em três: uma sequência variável de cerca de 40 bases, uma região poli-UC, e uma região altamente conservada de 98 bases (Chevaliez et al, 2007; Friebe et al, 2001; Moradpour et al, 2001; Moradpour et al, 2007).
No plasma de um doente infectado existem aproximadamente 105-107 partículas virais/mL de sangue e em 15% dos doentes pode chegar mesmo a 109 partículas/mL. A quantidade de vírus noutros fluidos corporais e tecidos é bem mais baixa (Czepiel et al, 2008). A infecção pelo VHC é um processo altamente dinâmico com um tempo de meia-vida viral de apenas algumas horas e uma libertação de cerca de 1012 partículas virais por dia num determinado indivíduo (Neumann et al, 1998). Esta actividade replicativa alta, juntamente com a falta de uma função de proof-reading do RdRp viral, é a base da alta variabilidade genética do VHC. Estas propriedades são semelhantes às da infecção pelo vírus da imunodeficiência humana (VIH) e fornecem um forte Figura 1 Organização genómica e processamento da poliproteína de VHC. Os asteriscos (*) nas
regiões E1 e E2 indicam a glicosilação das proteínas do envelope viral. Os losangos (♦) assinalam os locais de clivagem do precursor da poliproteína de VHC pela peptidase de sinal do RE. As setas () indicam os locais de clivagem das proteases NS2-3 e NS3 (Adaptado de Moradpour et al, 2007).
5
argumento para o desenvolvimento e implementação de terapêuticas de combinação anti-viral (Simmonds et al, 2005).
O VHC é um vírus altamente heterogéneo e pode ser agrupado em genótipos e subtipos. Existem pelo menos 6 genótipos do vírus, designados de 1 a 6, e mais de 50 subtipos, designados por letras (ex. 1a, 1b, 2a, 2b) e o seu único hospedeiro conhecido é o Homem. As sequências nucleotídicas dos genótipos individuais do vírus diferem em aproximadamente 31-34%, e entre 20-23% nos subtipos. Devido à elevada variabilidade genómica e mutações frequentes, a população de VHC num doente infectado é heterogénea e auxilia o vírus a sobreviver aos mecanismos do sistema imune do hospedeiro. Como resultado, o VHC com características alteradas não é eliminado do organismo por anticorpos anti-VHC, que confirmam a infecção, como acontece com o VIH (Czepiel et al, 2008; Chevaliez et al, 2007).
Mais de 40 000 sequências de VHC foram identificadas e inseridas em bancos de dados, das quais três são especificamente dedicadas ao VHC: o banco de dados VHC Europeu, o Banco de Dados VHC Los Alamos National Laboratory e o banco de dados japonês do vírus da Hepatite. Estes oferecem vários recursos especializados, incluindo ferramentas úteis para comparações de sequências, análises estruturais de proteínas virais e informação dos epítopos das células T CD4+ e CD8+ (Moradpour et al, 2007).
1.1.2. Estrutura do virião
Embora tenha havido progressos no sentido da determinação das estruturas do virião de alguns alfavírus e flavivírus, por exemplo, o vírus da dengue, o virião de VHC ainda não foi definitivamente visualizado e a sua estrutura ainda não foi esclarecida. Estudos baseados em filtração e microscopia electrónica mostraram que as partículas virais de VHC deverão ter um diâmetro de 40-70nm (Kuhn et al, 2002; Wakita et al, 2005).
Pensa-se que a proteína core e as glicoproteínas E1 e E2 do envelope são os principais componentes proteicos do virião. As E1 e E2 estão presumivelmente ancoradas ao envelope lipídico, de dupla camada, da célula hospedeira que envolve a nucleocápside, composta por múltiplas cópias da proteína core e RNA genómico. O VHC circula em várias formas no hospedeiro infectado e pode associar-se a lipoproteínas de baixa ou muito baixa densidade (LDL, VLDL). Ambas parecem representar uma fracção da infecção e também circulam como viriões ligados a imunoglobulinas ou viriões livres. Esta característica pode explicar a sua densidade
6
extraordinariamente heterogénea e baixa (pico de infectividade próximo de 1,10 g/mL) (André et al, 2005; Moradpour et al, 2007).
1.1.3. Ciclo de vida do VHC e Metabolismo dos lípidos
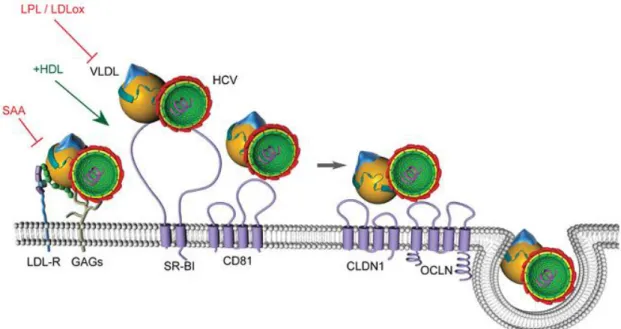
Os hepatócitos são as principais células-alvo do VHC, mas este também pode infectar células B, células dendríticas, entre outros tipos celulares. O ciclo de vida do VHC começa com a ligação a um receptor específico. Já foram sugeridas várias moléculas que têm um papel no complexo receptor, entre elas: a tetraspanina CD81, uma proteína que se encontra na superfície de muitos tipos celulares, incluindo os hepatócitos; o receptor de LDL (LDLR); o receptor scavenger tipo B de classe I (SR-BI) e, mais recentemente, a claudina-1 (CLDN1) e Ocludina (OCLN) (Figura 2) (Burlone et al, 2009; Moradpour et al, 2007; Popescu et al, 2010; Voisset et al, 2005).
As partículas virais circulam no soro sob a forma de partículas ricas em triglicéridos. Consequentemente, as lipoproteínas e os seus receptores têm um papel essencial na internalização do vírus e no início da infecção. O SR-BI é um receptor com múltiplos ligandos para diversas classes de lipoproteínas (HDL, LDL e VLDL) e lipoproteínas modificadas (LDLox e LDL acetiladas). A função essencial do SR-BI é a absorção selectiva de ésteres de colesterol (CE) das HDL. O fluxo de colesterol Figura 2 Modelo da entrada do VHC no hepatócito. A fixação inicial à célula hospedeira pode
envolver glicosaminoglicanos (GAG). Além disso, devido à sua associação com VLDL, os LDLR também podem potencialmente desempenhar um papel no passo inicial de entrada. Após a ligação inicial à célula, a partícula parece interagir com quatro receptores: SR-BI, CD81 e as proteínas tetraspaninas Claudina-1 (CLDN1) e Ocludina (OCLN) (Adaptado de Popescu et al, 2010).
7
mediado pelo SR-BI desempenha um papel importante no transporte reverso de colesterol e aterogénese (Burlone et al, 2009).
Depois da ligação a vários componentes da célula hospedeira, a partícula VHC é internalizada por endocitose mediada por clatrina. Vários componentes do soro podem modular a entrada do VHC. A composição lipídica das membranas dos hepatócitos e do vírus desempenham um papel fundamental no reconhecimento do VHC e na entrada do vírus nas células (Blaising et al, 2013). Com efeito, a apoproteína amilóide sérica segregada pelo fígado (SAA), as LDL oxidadas (LDLox) e a lipoproteína lipase (LPL) parecem inibir a entrada de VHC. Pelo contrário, as HDL, o ligando principal do SR-BI, facilitam a entrada do VHC nos hepatócitos (observou-se um aumento de 3 vezes na eficiência de entrada de VHCpp na presença de HDL), não havendo, no entanto, uma interacção directa entre as HDL e as partículas virais. Além disso, o efeito do aumento das HDL, no momento da entrada de VHC, reduz a sensibilidade do vírus para os anticorpos neutralizantes (Popescu et al 2010; Voisset et al, 2005). As apolipoproteínas (B, E e C1), constituintes das VLDL, são também eficientes reguladores de infecciosidade do VHC, promovendo a fusão da membrana viral com a membrana celular (Burlone et al, 2009).
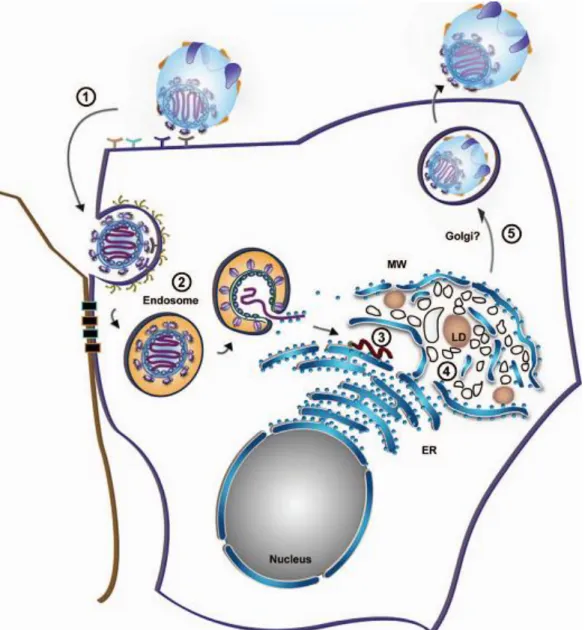
O ciclo de vida do VHC começa pela ligação a um complexo receptor, sendo depois internalizado. Quando entra na célula, o vírus liberta da cápside o genoma viral VHC-RNA, que é usado para traduzir proteínas e para a replicação no citoplasma. A replicação e os processos pós-transducionais parecem ocorrer numa rede membranosa (Mw, membranous web) de proteínas não-estruturais e proteínas da célula hospedeira localizada junto às membranas perinucleares. O encapsulamento da cápside (assembly) parece ocorrer no retículo endoplasmático (RE) e a maturação e formação do envelope no aparelho de Golgi, antes dos recém-produzidos viriões serem libertados para o espaço pericelular por exocitose (Alvisi et al, 2011; Chevaliez et al, 2007) (Figura 3).
8 1.1.4. Epidemiologia
A prevalência de anti-VHC na população geral é difícil de avaliar pelo que têm sido conduzidos estudos em dadores de sangue saudáveis e em alguns subgrupos da população. A prevalência de anti-VHC em dadores de sangue saudáveis é em geral 25-50% menor do que na população total (Marinho et al, 2001).
Figura 3 Ciclo de vida do VHC. (1) Ligação do VHC à superfície celular. A partícula VHC
ligada às glicoproteínas E1 e E2 e às apolipoproteínas celulares, liga-se a um conjunto de moléculas de entrada na superfície do hepatócito. (2) Entrada na célula por endocitose mediada por clatrina. O pH baixo (indicado a cor de laranja) no endossoma pode desencadear a fusão entre o compartimento endossomal e a membrana viral, libertando assim o RNA viral (a vermelho) para o citoplasma. (3) A tradução do genoma viral ocorre no RE rugoso dando origem a um precursor de uma única poliproteína que é clivada por proteases celulares e virais. (4) A replicação do RNA viral tem lugar numa rede membranosa (Mw), que consiste em aglomerados de vesículas induzidas pelo vírus, membranas do RE e gotículas lipídicas (LDs, lipid droplets), que são os locais presumíveis de assembly da partícula viral. (5) A libertação de VHC pode estar associada à via de secreção de VLDL (Adaptado de Alvisi et al, 2011).
9
De acordo com a Organização Mundial de Saúde, 3% da população humana, aproximadamente 170 milhões de pessoas, está infectada com VHC. Em Portugal, serão aproximadamente 150 000 pessoas infectadas. A prevalência da infecção crónica por VHC é de 0,1-26% e varia entre diferentes regiões (Czepiel et al, 2008; Marinho et al, 2001).
Relativamente à distribuição genotípica do VHC, o genótipo 1 é o mais prevalente no mundo e está presente em 40-60% dos doentes com HCC. O genótipo 1 é mais prevalente nos EUA, enquanto os genótipos 2 e 3 são mais comuns na Europa e no Japão. O genótipo 4 é o mais comum no Egipto e Médio Oriente. Na África do Sul prevalece o genótipo 5 e em Hong-Kong e outros países do sudeste asiático prevalece o genótipo 6. Os genótipos 4, 5 e 6 raramente são encontrados fora de África e Ásia (Simmonds et al, 2005).
O Ministério da Saúde português estima que a prevalência de anti-VHC na população portuguesa ronde 1,5%, uma percentagem equivalente à prevalência noutros países mediterrâneos, como França (0,7%), Itália (1,2%) e Espanha (1,0%). Observa-se ainda um gradiente na taxa de incidência, sendo inferior no Norte do país quando comparada com o Centro e Sul. Os doentes HCC em Portugal são maioritariamente do sexo masculino, com idades compreendidas entre os 15-34 anos de idade, o que sugere o uso de drogas intravenosas (Marinho et al, 2001).
A epidemia de VHC na Europa está em constante evolução e os parâmetros epidemiológicos (prevalência, incidência, padrões de doenças de transmissão e distribuição genotípica) têm mudado substancialmente nos últimos anos. Quatro factores principais contribuem para tais mudanças: o aumento da segurança das transfusões de sangue, a melhoria das condições de saúde, a expansão contínua do uso de drogas intravenosas e a imigração para a Europa a partir de áreas endémicas. Como resultado destas alterações, o uso de drogas intravenosas tornou-se o principal factor de risco para a transmissão do VHC, as infecções prevalentes têm aumentado e a distribuição dos genótipos foi alterada e diversificada. Assim, devem ser conduzidos estudos epidemiológicos adicionais, e implementadas novas estratégias de prevenção para controlar esta epidemia silenciosa (Esteban et al, 2008).
10 1.2. Hepatite C Crónica
O decurso da HCC é geralmente bastante lento. Mais de 70% dos infectados não manifesta quaisquer sintomas na fase aguda da doença. O único sinal da doença pode ser a fadiga e, mais raramente, apepsia e prurido. Entre 70- 80% dos casos progride da fase aguda para uma forma persistente de Hepatite. Depois de anos, a infecção leva a sérias complicações incluindo cirrose hepática e carcinoma hepatocelular, e é responsável por 250 000-350 000 mortes por ano (Czepiel et al, 2008; Chevaliez et al, 2007).
Na fase aguda da infecção por VHC observam-se comummente sinais não-específicos e sintomas que podem evoluir para outras infecções virais do fígado, como mal-estar, fadiga, dor abdominal, hépato e esplenomegalia ligeiras e artralgia. Estes sintomas usualmente persistem entre 2 a 12 semanas. Na fase crónica da doença, um subconjunto dos doentes queixa-se de mal-estar, náusea, dor abdominal e prurido.
O desenvolvimento de complicações graves é quase certo se a condição afectar indivíduos jovens com uma esperança de vida potencialmente longa. No decurso de HCC prolongada, vão ocorrendo lesões graduais no fígado. Depois de alguns anos com cirrose hepática, 20% dos doentes sofrem complicações. A mortalidade entre doentes com cirrose hepática, induzida por HCC, resultante do desenvolvimento de hipertensão portal, insuficiência hepática ou cancro primário do fígado, atinge anualmente 2-5% destes doentes, enquanto a prevalência do desenvolvimento de cancro primário do fígado ronda 1-4% por ano (Czepiel et al, 2008).
1.2.1. Padrões de Transmissão e Contágio
A HCC é um dos maiores e mais sérios problemas de saúde actuais no mundo. Isto resulta da disseminação mundial do vírus, das várias vias de transmissão e da falta de uma terapêutica realmente eficaz. O VHC pode ser contraído através do sangue e dos seus produtos, por contacto sexual ou por via vertical (de mãe para filho). Também existem as chamadas “infecções ocasionais”, quando a fonte da infecção é desconhecida, que são responsáveis por até 40% dos casos de HCC. A infecção do sangue pode acontecer por transfusão sanguínea e transplantação de órgãos infectados ou ocorrer durante procedimentos de diagnóstico invasivos (ex. biópsia de órgãos, endoscopias).
11
Entre os doentes com maior propensão para o contágio encontram-se os usuários de drogas intravenosas infectados com VIH, hemofílicos e doentes em hemodiálise. A infecção também pode ser adquirida através de exposição ocupacional a sangue infectado, nomeadamente em trabalhadores da área da saúde, polícias e guardas prisionais (Czepiel et al, 2008). Em Portugal, a prevalência de anti-VHC entre usuários de drogas intravenosas está entre 70-92%, percentagem semelhante à observada noutros países europeus, EUA e Austrália. Esta percentagem alta pode ser explicada pela partilha de material contaminado. Estima-se que em Portugal 1% da população seja usuária de drogas intravenosas e que entre 35 000-58 000 estejam infectados com VIH (Marinho et al, 2001).
Estima-se que aproximadamente 50-90% dos hemofílicos em todo o mundo estejam infectados com VHC devido às inúmeras transfusões de sangue e infusões de produtos sanguíneos que recebem. No entanto, a introdução de novos métodos de diagnóstico em terapêutica sanguínea têm diminuído significativamente o risco de transmissão. A incidência de anticorpos anti-VHC nos doentes em hemodiálise está dependente da duração da diálise e aumenta com a frequência do procedimento. Estima-se que a incidência da infecção por VHC neste grupo esteja entre 10-20%. Quando um dador de órgãos está infectado com VHC a transmissão do vírus ocorre em 50% dos casos de transplante. Quando é incluída imunoterapêutica, depois da transplantação, é frequente ocorrer uma forma crónica ou fulminante de HCC.
A infecção por VHC pode também resultar de exposição perinatal. As vias de transmissão de mãe para filho e a altura do contágio são ainda incertas. Não é claro se a contracção da doença pode ocorrer durante a gravidez, depois do parto ou durante o aleitamento. Não há evidências que indiquem que o vírus possa ser transmitido pelo leite materno. Por ora, não há forma de proteger uma criança contra HCC. O mais comum é a infecção acontecer no terceiro trimestre da gravidez, quando acompanhada pela infecção por VIH. Logo após o parto, os anticorpos anti-VHC podem ser detectados no sangue da criança (persistindo até um ano e meio), passivamente transmitidos pela mãe. No entanto, este fenómeno não tem qualquer significância na patogenicidade da infecção. Quanto à transmissão intrafamiliar, os dados são inconsistentes, mas estima-se que a prevalência de VHC entre cônjuges esteja entre 6- 23% (Czepiel et al, 2008).
12 1.2.2. Diagnóstico
O período de incubação do VHC varia usualmente entre 15- 150 dias desde o momento da exposição, com uma média de 40-50 dias. Os anticorpos podem ser detectados a partir de 4 semanas após a contracção da doença, mas o mais comum é este período exceder as 10 semanas. Em 7% dos doentes os anticorpos não são sequer detectáveis.
O diagnóstico da Hepatite é feito por avaliação bioquímica da função hepática. A avaliação laboratorial inicial deve incluir: bilirrubina total e directa, alanina aminotransferase (ALT), aspartato aminotransferase (AST), fosfatase alcalina (FA), tempo de protrombina, proteína total, albumina, globulina, hemograma e coagulograma. A actividade da ALT está geralmente elevada e pode atingir 100 vezes o valor normal. Com pouca frequência, a ɣ-glutamil transpeptidase (GT), a fosfatase alcalina e os níveis de bilirrubina estão ligeiramente aumentados (Czepiel et al, 2008). A necessidade e a escolha de testes confirmatórios ou complementares dependem da configuração clínica e da probabilidade de um resultado fidedigno. No entanto, não são necessários testes confirmatórios para doentes com doença hepática crónica (Lok et al, 1997).
Os métodos de diagnóstico na infecção por VHC envolvem a determinação de anticorpos anti-VHC no plasma ou soro, detectados 3-8 semanas depois da infecção por imunoensaios Enzyme-Linked Immunosorbent Assay (ELISA) que detectam anticorpos de vários epítopos do VHC (Chevaliez et al, 2007). No entanto, a sua presença não é por si só evidência da infecção, uma vez que os anticorpos anti-VHC podem ser detectados em indivíduos que tenham um histórico de Hepatite C. Para além disso, a infecção pode ocorrer em doentes imunossuprimidos, com anticorpos anti-VHC não detectáveis. Outro tipo de pesquisa que pode confirmar VHC é uma estimativa do material genético do vírus no sangue, VHC-RNA, detectado dentro de 1-2 semanas após o início da infecção, pelo método de Real-Time Polymerase Chain Reaction (RT-PCR). Para uma avaliação quantitativa do vírus, são utilizados ensaios de amplificação de sinal (branched DNA) e PCR, capazes de avaliar o antigénio core de VHC (VHCAg) e úteis na avaliação do diagnóstico dentro do tempo da “janela serológica”.
A primeira geração de testes ELISA (Enzyme-Linked Immunosorbent Assay), introduzidos em 1990, tinha uma sensibilidade de 46%. A segunda geração de ELISA, em 1991, tinha uma sensibilidade de 60% e o teste de RIBA-II (Recombinant Immunoblot Assay) aumentou a sua sensibilidade para 90%. Após a introdução dos
13
testes de 2ª geração (ELISA, RIBA-II), o risco de contracção da infecção diminuiu para 0,6%. A terceira geração de testes ELISA é muito sensível (> 99%) e, com um ensaio adicional de VHC-RNA, limita ainda mais o risco de infecção (Chevaliez et al, 2007; Czepiel et al, 2008).
Procedimentos de diagnóstico mais recentes envolvem a aplicação de testes de 3ª geração de ELISA, contendo antigénios do núcleo e, pelo menos, dois antigénios de proteínas não estruturais. A sensibilidade e especificidade destes testes são de aproximadamente 99% (Marinho et al, 2001). Testes confirmatórios devem ser sempre realizados em dadores de sangue anti-VHC positivo e indivíduos com níveis anormais de aminotransferases. A abordagem mais apropriada é voltar a testar para anti-VHC, usando ensaios RIBA e RT-PCR, para os doentes que são RIBA positivo ou indeterminado (Lok et al, 1997).
1.2.3. Co-factores da doença
São vários os co-factores associados a uma progressão acelerada da fibrose hepática e com aumento da incidência de complicações relacionadas com a doença hepática crónica e carcinoma hepatocelular. Entre estes co-factores encontram-se: sexo masculino, idade avançada no momento da infecção, obesidade, infecção VIH, co-infecção com o vírus da Hepatite B (VHB), e o consumo de álcool. As complicações da doença podem ser alteradas substancialmente pela presença ou ausência relativa destes co-factores. Estes podem ser modificados através de programas de prevenção ao nível da saúde pública, como acontece por exemplo em VIH, VHB e consumo de álcool (Shepard et al, 2005).
A infecção de VHC ocorre geralmente nos primeiros dois anos de utilização de drogas intravenosas, o que é usualmente prévio à infecção por VIH. Uma vez que a eliminação ou persistência da infecção por VHC é determinada durante os primeiros 6 meses a 1 ano depois da infecção aguda ocorrer, o desfecho da infecção por VHC é, portanto, determinado antes da infecção por VIH (Thio et al, 2004).
1.3. Características histológicas do fígado em HCC
As lesões histológicas típicas em HCC são a necrose hepatocelular e inflamação (avaliadas em graus) e a fibrose (avaliada em estadios). O desenvolvimento da fibrose é progressivo e leva, em última instância, à cirrose, tornando-a por isso numa característica chave na história natural da HCC (Marcellin et al, 2002). Anteriormente,
14
pensava-se que a fibrose era um processo irreversível mas hoje essa ideia tornou-se obsoleta. Hoje parece evidente que o desenvolvimento da fibrose é um processo dinâmico e potencialmente bidireccional. A resolução espontânea da cicatrização foi observada em modelos animais e em ensaios humanos em que os estímulos responsáveis pela inflamação hepática crónica ou repetida são removidos com êxito (Pellicoro et al, 2012).
Os factores associados à progressão da fibrose em HCC não estão ainda bem definidos e o papel da necro-inflamação que a acompanha é controvérsia. No entanto, a progressão da fibrose hepática parece ser independente da carga viral e do genótipo do vírus, ocorre mais rapidamente em doentes imunocomprometidos e parece ser agravada pela esteatose hepática, obesidade e diabetes mellitus (DM). Níveis séricos de ALT elevados estão associados a um maior risco para a progressão da fibrose.
A fibrogénese é um processo dinâmico complexo, acompanhado de necro-inflamação e caracterizado pela síntese de constituintes da matriz extracelular, uma mistura complexa de glicoproteínas e proteoglicanos que formam uma rede fibrosa tridimensional, polimérica, insolúvel e resistente a degradação enzimática, que leva à perda da estrutura do fígado. O colagénio que constitui esta rede fibrosa é produzido pelas células estreladas hepáticas que são activadas pela inflamação causada pela infecção viral (Marcellin et al, 2002).
As células estreladas constituem 5-10% das células de um fígado normal. Durante uma doença hepática, aguda ou crónica, passam por uma alteração fenotípica que lhes confere propriedades fibrogénicas de novo que incluem a proliferação e acumulação em áreas de necrose celular, secreção de citocinas e quimiocinas pró-inflamatórias, síntese de proteínas da matriz e inibidores da degradação da mesma, levando à formação progressiva de tecido cicatrizado (Lotersztajn et al, 2005). Assim, o VHC não causa lesões directos no fígado, antes desencadeia a proliferação de linfócitos específicos que levam à apoptose dos hepatócitos através da produção de citocinas inflamatórias.
Outra característica histológica em HCC, reconhecida como uma causa significativa de fibrose e cirrose é a esteatose hepática. Esta é definida como a acumulação excessiva de lípidos no citoplasma dos hepatócitos (Fierbinţeanu-Braticevici et al, 2009). Muitos doentes com HCC apresentam um determinado grau de esteatose nas suas biópsias hepáticas (estadios 0-4: sem esteatose, esteatose ligeira, moderada ou intensa). A esteatose hepática ocorre mais frequentemente em doentes com
15
HCC (40-86%, média 55%) do que na população ocidental total, cuja prevalência se encontra entre 20-30%. A maioria dos doentes apresentam esteatose ligeira (78%), afectando menos de 30% dos hepatócitos (Asselah et al, 2006).
A maioria dos dados clínicos e experimentais sugerem que esta lesão hepática é mediada imunologicamente, e parece que a alteração dos lípidos ao nível dos hepatócitos pode reflectir um efeito citopático directo do vírus. A esteatose, em doentes com Hepatite não alcoólica, está associada ao aumento de fibrose, contudo, só uma minoria dos doentes com esteatose hepática grave progride para um estadio avançado de fibrose ou até cirrose (5%). Os mecanismos para o desenvolvimento da esteatose permanecem incertos. E os factores que relacionam a esteatose com a progressão da fibrose não são claros (Hourigan et al, 1999).
A esteatose hepática em doentes HCC é multi-factorial e relaciona-se com os mesmos factores que causam esteatose em doentes sem a infecção. Estes factores incluem elevado índice de massa corporal (IMC), obesidade, elevado consumo de álcool, idade avançada, diabetes mellitus e hiperlipidémia (Figura 4). No entanto, ainda não foi determinada a relação destas variáveis no desenvolvimento ou gravidade da esteatose, em associação com a infecção crónica por VHC (Asselah et al, 2006; Hourigan et al, 1999; Williams et al, 2006).
Existem duas formas de esteatose presentes em doentes HCC. Na esteatose induzida por VHC, a chamada esteatose “viral”, a infiltração lipídica é directamente provocada pelo vírus. A esteatose metabólica é, por outro lado, normalmente independente do genótipo do VHC e é consequência da disfunção mitocondrial envolvida no processo de β-oxidação dos ácidos gordos e ocorre em quadros de obesidade, dislipidémia e síndrome metabólica (Fierbinţeanu-Braticevici et al, 2009).
Na esteatose “viral”, os mecanismos subjacentes à especificidade para determinado genótipo são desconhecidos. No entanto, a esteatose é mais frequente em doentes com o genótipo VHC-3 do que no VHC-1. A esteatose está presente em 73% dos doentes infectados com o genótipo 3 e em 50% dos doentes infectados com outros genótipos. Em doentes com o genótipo não VHC-3, a presença de esteatose é um factor preditivo para o insucesso do tratamento com agentes antivirais (Asselah et al, 2006; Westin et al, 2002).
No que se refere aos lípidos, os níveis séricos da apolipoproteína B e colesterol estão reduzidos em doentes com esteatose que respondem à terapêutica anti-viral. Assim, o desaparecimento de esteatose correlaciona-se com a normalização da
16
Figura 4 Fisiopatologia da esteatose hepática. Principais razões para a acumulação de ácidos gordos no
fígado: (1,2) Absorção hepática de ácidos gordos aumentada; (3) Aumento da glicólise; (4) Diminuição da eliminação de ácidos gordos devido à diminuição da β-oxidação; (5) Diminuição da exportação de ácidos gordos como VLDL (Adaptado de Asselah et al, 2006).
apolipoproteína B e dos níveis de colesterol. A hipocolesterolemia em doentes HCC, em especial com genótipo VHC-3, foi já referida. Estas observações sugerem que o VHC pode interferir com a secreção de lipoproteínas de densidade muito baixa (VLDL), que é corrigida por terapêutica anti-viral (Asselah et al, 2006) (Figura 4).
A resistência à insulina (RI) também tem um papel chave no desenvolvimento da esteatose hepática. Esta resistência resulta de alterações importantes do metabolismo dos lípidos que contribuem para a acumulação de triglicéridos hepatocelulares. A associação entre a RI e a esteatose é importante devido ao risco acumulado para a fibrose e devido à diminuição na RVS no tratamento anti-viral (Fierbinţeanu-Braticevici et al, 2009) (Figura 4).
O fígado funciona como um importante reservatório de ferro, onde é principalmente ligado à ferritina ou hemossiderina. Cerca de um terço do total de ferro do corpo é armazenado nos hepatócitos e macrófagos. No entanto, a capacidade do fígado de armazenamento fisiológico ferro é limitada, e a sua acumulação excessiva pode levar a lesões hepáticos. A sobrecarga de ferro no fígado induz o stress oxidativo e peroxidação lipídica, levando a lesões na membrana das células, instabilidade do DNA e mutagénese. Devido a esses efeitos, o ferro pode ser considerado um factor
pró-17
fibrogénico e potencialmente cancerígeno. Depósitos de ferro nas células hepáticas têm sido observados em 10-40% dos doentes com HCC e 50% dos doentes que sofrem de carcinoma hepatocelular. O excesso de ferro parece aumentar o nível de ALT, exacerbar o processo inflamatório e a lesão hepática e diminuir a eficácia da terapêutica anti-viral. No entanto, os mecanismos moleculares detalhados de sobrecarga de ferro no fígado ainda não foram completamente elucidados (Pirisi et al, 2000; Sikorska et al, 2011).
1.4. Factores genéticos do hospedeiro
As citocinas têm um papel essencial na regulação da resposta imune. Na infecção por VHC, a produção do factor de necrose tumoral (TNF-α) e IL-10, contribuem para a persistência da infecção e afectam a resposta à terapêutica. Também os níveis séricos de IL-6 e TGF-β aparecem elevados em HCC (Barrett et al, 2003).
O TNF-α é uma citocina com uma vasta gama de actividades inflamatórias, apoptóticas e imunomoduladoras, maioritariamente secretado por células do sistema imune incluindo monócitos, macrófagos, neutrófilos, células natural-killer (NK) e linfócitos T (Al-Rayes et al, 2011; Feng et al, 2011; Santana et al, 2011). Trata-se de uma citocina crítica para a determinação da resposta imune, e importante em vários processos dependentes das células T, incluindo a polarização de uma resposta Th1, indução da apoptose e regulação da proliferação celular.
O TNF-α foi já implicado como uma citocina importante na infecção por VHC já que os linfócitos citotóxicos T (CTL) no fígado segregam TNF-α. Elevados níveis desta citocina podem ser observados no soro e fígado de doentes com HCC. A infecção viral induz a produção de TNF-α nos hepatócitos humanos (Thio et al, 2004). O TNF-α pode ainda estimular a secreção de outras citocinas, aumentar a expressão de moléculas de adesão celular bem como activar neutrófilos. Assim, este factor tem um papel como mediador celular da resposta imune e inflamação. A quantidade de citocina produzida parece ser afectada pelos polimorfismos da região reguladora do seu gene. Portanto, pode haver uma relação entre estes polimorfismos pontuais (SNPs, Single nucleotide polymorphisms) e a inflamação mediada por citocinas. Por seu lado, as citocinas podem por seu lado afectar o desfecho da doença (Xia et al, 2011).
18 1.4.1. Gene do TNF-α
O gene do TNF-α (TNFA), clonado em 1985, está localizado na região do antigénio do leucócito humano (HLA , Human leukocyte antigen) classe III entre os loci HLA-B e DRB3 do MHC, no braço curto do cromossoma 6, 6p21.1-6p21.3, e a sua expressão é fortemente controlada aos níveis transcricional e pós-transcricional (Nedwin et al, 1985; Ragoussis et al, 1988; Wilson et al, 1993).
A região do MHC contém genes cujos produtos têm papéis na resposta imune. A importância desta região prende-se com a longa lista de situações patológicas associadas a alelos do MHC. O desequilíbrio de linkage entre polimorfismos dentro do MHC faz com que seja difícil identificar uma associação directa entre a doença e um alelo específico. A heterogeneidade funcional no gene do TNF-α pode ser responsável pelo papel deste na resposta a doenças infecciosas e auto-imunes. O TNF-α tem um papel fundamental na resposta inflamatória. Numa inflamação descontrolada, o TNF-α está directamente relacionado com a patogénese.
O TNF-α é capaz de aumentar a sua própria produção através de um feedback positivo da expressão génica. Através deste mecanismo, uma diferença mínima na resposta do TNF-α inicial é amplificada num sistema in vivo. Este fenómeno foi exemplificado em estudos com ratos heterozigóticos para a deleção de TNF-α (TNF +/-), que revelou que uma pequena redução de 50% na expressão inicial do gene produz um fenótipo devido a uma resposta não-linear dos níveis de TNF-α.
A produção de TNF-α está dependente do tempo, localização e extensão com que é transcripto. Um controlo apertado da produção de TNF-α pode ser crítico para gerar uma resposta imune apropriada. A regulação da produção de TNF-α é específica para cada tipo de célula e rigorosamente controlada a múltiplos níveis, incluindo transcrição, estabilização do mRNA, tradução e processamento dos percursores. Sequências na extremidade 5’ do gene são cruciais para o controlo da transcrição. Sequências na extremidade 3’ UTR estão envolvidas na regulação da estabilidade e eficiência do mRNA (Kaijzel et al, 1998).
Desde que foi sugerido que a produção do TNF-α estava associada com o MHC, o componente mais responsável pela produção diferencial de TNF-α pode estar entre o locus MHC. Este locus alberga vários genes cujos produtos estão envolvidos na biossíntese de TNF-α. Mutações que afectam a expressão destes genes ou a actividade dos seus produtos podem ter um impacto na expressão de uma larga gama de genes de
19
citocinas, incluindo o gene que codifica para o TNF-α, e consequentemente, contribuir para a susceptibilidade da doença ou determinar a evolução da mesma (Kaijzel et al, 1998).
1.4.2. Polimorfismos genéticos do TNF-α
As grandes diferenças entre indivíduos no que toca à sua capacidade de produção de citocinas foram atribuídas a polimorfismos dentro da região reguladora ou sequências de sinal em genes de citocinas (Kim et al, 2003). Os próprios genes das citocinas são polimórficos em locais específicos e certas mutações foram associadas com alterações nos níveis de produção dessas citocinas. Foram relatadas associações entre polimorfismos nos genes de citocinas e inflamação, síndromes auto-imunes, rejeição de enxertos e doenças infecciosas (Barrett et al, 2003).
Sendo o TNF-α um componente importante na geração de uma resposta imune contra a infecção pelo VHC. As suas funções podem ser alteradas por SNPs no seu gene. Estes SNPs, por seu lado, podem ser importantes na determinação da progressão da infecção por VHC (Thio et al, 2004). Como as variações genéticas no promotor podem regular a produção do TNF-α, os polimorfismos pontuais na zona do promotor foram estudados pelo seu papel na transcrição do gene bem como pela sua possível relação com várias doenças inflamatórias (Feng et al, 2011). Certos SNPs na região do promotor dos genes de IL-10 e TNF-α foram associados a alterações nos níveis em circulação (Ates et al, 2008). A elevação dos níveis desta citocina foi associada à obesidade e resistência à insulina bem como à malária cerebral (Hedayati et al, 2011; Mitchell et al, 2001).
Vários polimorfismos bialélicos foram descritos no gene do TNF-α incluindo sete codões na região promotora: -1031T>C, -863C>A, -857C>T, -376G>A, -308G>A, -238G>A e -163G>A (pb do sítio inicial para transcrição – transcription start site) (Kim et al, 2003) e parecem estar associados a variabilidade no que diz respeito à gravidade da HCC (Yee et al, 2000). O polimorfismo mais importante é caracterizado pela substituição de uma guanina por uma adenina na posição -308 (Santana et al, 2011).
1.4.2.1. TNF-α -308G>A
Dos polimorfismos identificados na região do promotor do TNF-α, a forma bialélica na posição -308, na qual a presença de guanina define a variante comum e a presença de adenina define a mais rara, tem particular interesse dado que o alelo raro
20
-308A foi associado a doenças auto-imunes como a artrite reumatóide, lúpus eritematoso sistémico e doença celíaca, bem como a formas graves de doenças infecciosas. Contudo, existem dados contraditórios quanto à sua funcionalidade (Al Rayes et al, 2011; Hedayati et al, 2011; Oregón-Romero et al, 2008).
Este polimorfismo parece também estar associado a uma progressão mais grave e rápida de aterosclerose coronária e doença de Crohn (Chu et al 2012; Elahi et al, 2008; Santana et al, 2011), à susceptibilidade para doenças hepáticas como a colangite esclerosante primária, colite ulcerosa e cirrose biliar primária (Mitchell et al, 2001) e ao aumento de risco de cirrose em doentes infectados com VHC (Thio et al, 2004). Apesar de não haver associação entre o TNF-α G-308A e a obesidade, considera-se que este seja um importante factor de risco para a obesidade e doença cardiovascular (Hedayati et al, 2011).
Vários estudos demonstram que os polimorfismos na região promotora têm um efeito significativo na actividade transcripcional (Kim et al, 2003). O alelo TNFα -308A provoca uma taxa de transcrição 6-7 vezes mais elevada do que as observadas nos estudos de expressão do alelo selvagem (wt) in vitro (Al Rayes et al, 2011; Feng et al, 2011; Hedayati et al, 2011).
Genericamente, o genótipo GG está associado a um fenótipo com baixa produção de TNF-α enquanto o genótipo AA está associado a uma produção elevada de TNF-α. Os indivíduos heterozigóticos GA produzem quantidades intermédias desta citocina (Santana et al, 2011; Shaff et al, 2011).
1.4.2.2. TNF- α -238G>A
A variante -238A do promotor do TNFA foi associado à não eliminação do vírus, tanto na Hepatite B como na Hepatite C, possivelmente devido à alteração da expressão do TNF-α, causada pela substituição nucleotídica, bem como a outras doenças como o lúpus eritematoso sistémico (Yee et al, 2000; Zou et al, 2010).
O alelo -238A é mais comum entre doentes que sofrem cirrose do que nos doentes sem cirrose. O risco para o desenvolvimento de cirrose hepática para esta variante alélica é 3,2 vezes maior do que para o alelo selvagem (Yee et al, 2000).
Existe uma tendência para o aumento da frequência deste alelo raro em doentes HCC, quando comparados a indivíduos sem doença hepática, embora esta associação não seja significativa (Hohler et al, 1998). Também não parece existir uma correlação
21
entre este locus polimórfico e a gravidade histológica da doença hepática (Bailey et al, 2004; Rosen et al, 2002).
O polimorfismo TNF-α -238 G>A está, no entanto, associado a estadios de fibrose mais avançados (parece induzir a progressão da fibrose em doentes HCC) (Romero-Gomez et al, 2004) e a virémias mais elevadas no pré-tratamento, quando em comparação com doentes homozigóticos para o alelo selvagem (Rosen et al, 2002).
1.4.3. O papel dos polimorfismos no desfecho da infecção
O VHC é eliminado no hospedeiro em aproximadamente 15% dos indivíduos infectados de forma aguda. Vários estudos sugerem que as diferenças na resposta imune do hospedeiro determinam a eliminação viral. Uma resposta forte e policlonal por CTLs parece estar associada à eliminação do vírus. É plausível que uma resposta imune vigorosa seja determinada, em parte, por factores genéticos. Vários estudos imunogenéticos demonstram a importância da variação do HLA no desfecho de uma infecção por VHC. Mais concretamente, os polimorfismos no gene do TNF-α. Estudos funcionais destes SNP e haplótipos podem ajudar a compreender os efeitos do TNF-α durante uma infecção.
Numa população negra, a variante comum -308G parece também estar associada à persistência de VHC. Numa coorte de hemofílicos, os SNPs -308G>A e -238G>A não foram significativamente associados à persistência de VHC. O haplótipo wild-type (wt) -863C/-308G foi significativamente associado à persistência viral enquanto os indivíduos com a variante alélica nas duas posições -863A/-308A têm maior probabilidade de eliminar o vírus (Thio et al, 2004).
1.5. Terapêutica na HCC
Desde a descoberta do VHC, o tratamento para a Hepatite C tem vindo a melhorar consideravelmente. A prevenção das complicações da infecção é feita através de terapêutica anti-viral que envolve a administração de interferão-α peguilado (IFN-α PEG) e ribavirina (RBV), capaz de erradicar o vírus em 55% dos casos. O tratamento é indicado para doentes com fibrose moderada a grave. A tolerabilidade ao tratamento é relativamente baixa, sendo frequente observar-se síndrome gripal, e afecta substancialmente a qualidade de vida dos doentes (Asselah et al, 2009).
22
O tratamento é feito durante um período de 48 semanas para o genótipo VHC-1 e 24 semanas para VHC-2 e VHC-3. Anteriormente era usada uma forma recombinante de interferões que depois foi substituída por um interferão recombinante conjugado com polietilenoglicol. O IFN-α PEG tem um tempo de semi-vida longo e biodisponibilidade melhorada. Devido à introdução da molécula de polietilenoglicol, este permanece mais tempo na corrente sanguínea e o seu nível sanguíneo é mais estável, pelo que a eficácia da terapêutica foi melhorada (Czepiel et al, 2008).
Considera-se que a terapêutica é eficaz quando é atingida uma RVS, isto é, quando não é detectado VHC-RNA no soro 24 semanas após o final do tratamento. A eficácia da terapêutica com IFN-α PEG e RBV atinge 37-42% e está dependente do genótipo do VHC: ocorre em 78% dos doentes com os genótipos VHC-2 e VHC-3 (mais sensíveis à terapêutica), e em 55% dos doentes com genótipo VHC-1 (mais resistente à terapêutica). Esta variabilidade faz com que o desenvolvimento de uma vacina seja difícil (Chevaliez et al, 2007; Simmonds et al, 2005). Apesar do mecanismo de acção da ribavirina ser ainda desconhecido, sabe-se que a combinação de IFN-α PEG e RBV reduz significativamente a velocidade da progressão da fibrose em doentes HCC (Poynard et al, 2002).
A finalidade do tratamento de infecção por VHC é a inibição permanente da replicação do vírus, parar ou abrandar o progresso das lesões histológicas do fígado, e a normalização dos fenótipos intermédios bioquímicos da função hepática. A variabilidade na sequência nucleotídica observada nos genótipos particulares e subtipos de vírus tem um impacto sério na resposta ao tratamento (Czepiel et al, 2008).
Concentrações elevadas de TNF-α no soro parecem dificultar a resposta à terapêutica anti-viral (Romero-Gomez et al, 2004). A ausência de resposta à terapêutica com interferão-α foi associada a níveis mais elevados de TNF-α no pré-tratamento (Thio et al, 2004).
1.5.1. Critérios de Inclusão
Os critérios de inclusão para tratamento anti-viral de doentes com HCC mudou ao longo dos últimos anos. Inicialmente, os doentes com actividade ALT elevada e persistente durante mais de 6 meses, função do fígado compensada, lesões histológicas no fígado (inflamação, fibrose) e sem contraindicações, eram elegíveis para o tratamento. O tratamento durava entre 24-48 semanas, dependendo do genótipo do vírus, e era eficaz em 40% dos casos (Czepiel et al, 2008; Zeuzem et al, 2006).
23
Nos últimos anos, o conceito de que a progressão da doença é muito lenta em doentes com actividade ALT normal foi contestada e há quem sugira que perante uma ALT normal, a abordagem deve ser a mesma. Um ensaio clínico mostrou que doentes com actividade ALT normal, tratados com IFN-α PEG e RBV, atingem uma RVS e exibem uma redução ainda maior na atividade de ALT (Zeuzem et al, 2006).
Actualmente são elegíveis para tratamento doentes com indicações claras de HCC ou presença confirmada de material genético do vírus (VHC-RNA positivo) (Czepiel et al, 2008).
24
2. Objectivos
Desconhece-se porque é que para o mesmo genótipo e carga viral semelhante diferentes hospedeiros têm respostas diferentes ao tratamento contra a infecção de Hepatite C crónica (HCC). Este trabalho tem assim como principal objectivo contribuir para o estudo da susceptibilidade e dos factores do hospedeiro na HCC, e elucidar a possível associação entre genótipos particulares e o fenótipo patológico.
Depois de avaliados diferentes determinantes genéticos envolvidos na polarização da resposta imune, nomeadamente polimorfismos de genes de citocinas - TNF-α (tumor necrosis factor) (G-308A e G-238A), pretende-se estabelecer uma relação com as manifestações clínicas da doença: esteatose, fibrose, genótipo viral e resposta à terapêutica.
Neste estudo, foram ainda avaliadas as características demográficas dos doentes com HCC, que incluem IMC, idade, e a relação com os fenótipos intermédios bioquímicos: perfil lipídico (HDL, LDL, triglicéridos e colesterol total), parâmetros do metabolismo do ferro (ferro, transferrina, ferritina e saturação da transferrina), enzimas hepáticos (fosfatase alcalina, AST, ALT, gama GT), insulina e níveis de glucose (insulina, glicémia, HOMA) bem como a carga viral e a forma de transmissão da infecção.
25
3. Materiais e Métodos
3.1. População de estudo
As amostras de sangue utilizadas neste estudo pertencem a indivíduos com HCC (identificada pela presença de VHC-RNA e anticorpos anti-VHC há mais de 6 meses), seguidos pela Professora Doutora Fátima Serejo na consulta de Hepatologia do Serviço de Gastrenterologia do Hospital de Santa Maria (Centro Hospitalar Lisboa Norte). Todos os doentes incluídos foram submetidos a avaliação clínica e colheita de sangue periférico, com consentimento informado.
3.1.1. Características demográficas e bioquímicas
As características demográficas e bioquímicas dos 187 doentes com HCC, disponíveis e relevantes para este estudo, incluem IMC, idade, carga viral, perfil lipídico (HDL, LDL, triglicéridos e colesterol total), parâmetros do metabolismo do ferro (ferro, transferrina, ferritina e saturação), enzimas hepáticos (fosfatase alcalina, AST, ALT, gama GT), insulina e níveis de glucose (insulina, glicémia, HOMA) (Tabelas 1 e 2). Os valores de referência dos parâmetros estudados encontram-se discriminados no ANEXO I. A população HCC estudada é maioritariamente masculina, incluindo 127 indivíduos do sexo masculino (67,9%) e 60 do sexo feminino (32,1%).
Tabela 1 - Características demográficas e bioquímicas da população HCC estudada (I).
Variáveis normais N Média Desvio-padrão
Idade (anos) 184 43,92 11,14
IMC (Kg/m2) 173 25,25 3,53
Saturação (%) 91 41,61 18,31
Colestesterol Total (mmol/L) 158 4,39 1,05
HDL (mmol/L) 99 1,29 0,52
LDL (mmol/L) 84 2,51 1,00
Glicémia (mg/dL) 108 85,78 12,66
Ferro (µg/dL) 103 125,87 52,11