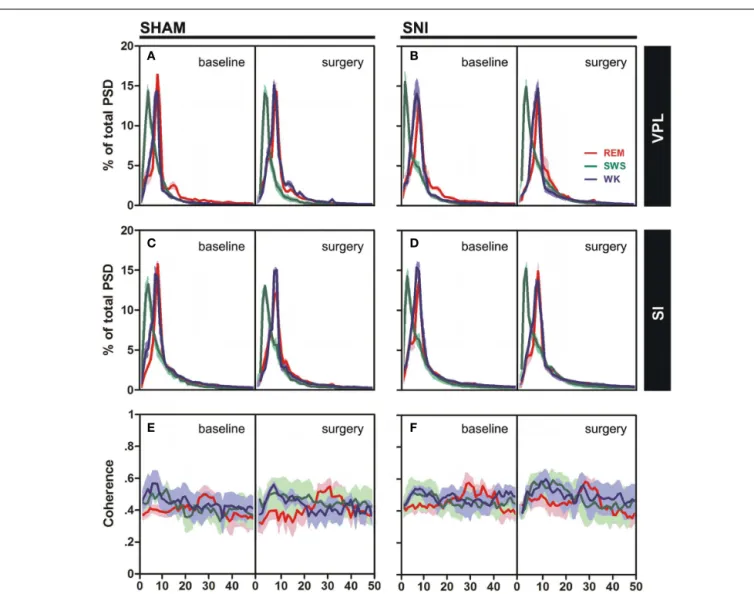
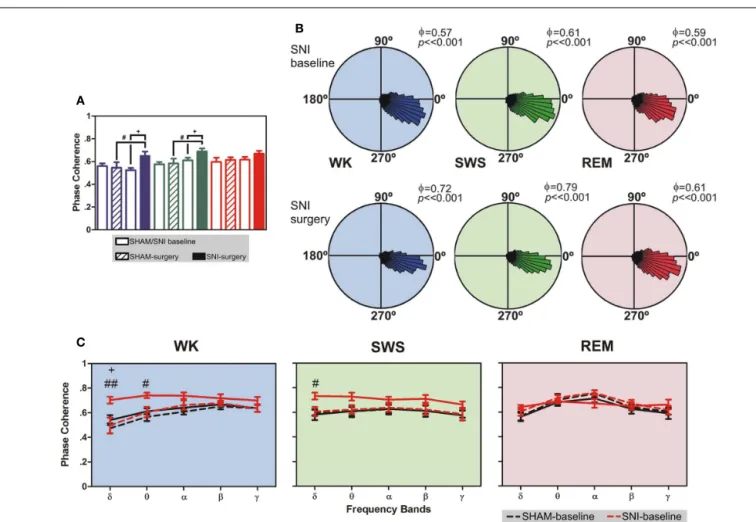
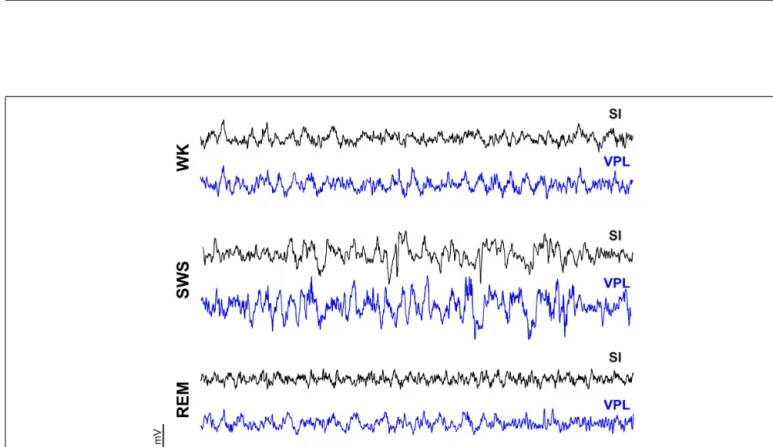
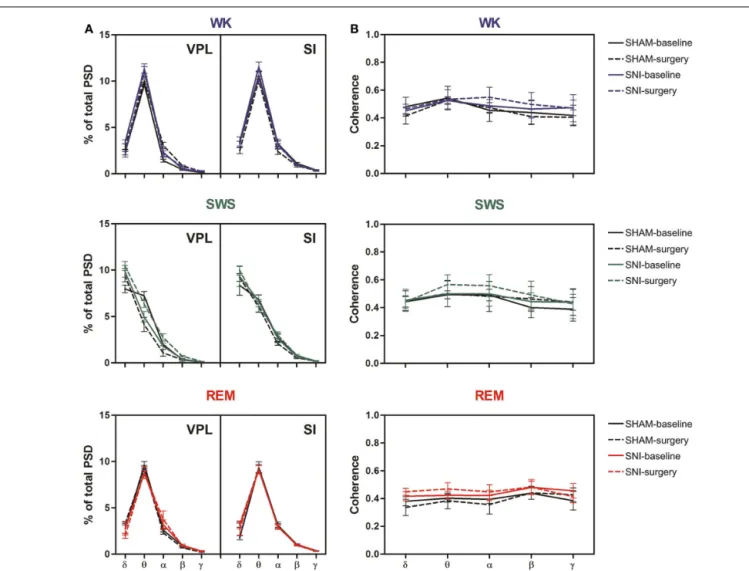
Helder Rui Cardoso da Cruz
DINÂMICA OSCILATÓRIA CORTICAL E SUBCORTICAL NO
PROCESSAMENTO DA INFORMAÇÃO NOCICEPTIVA:
ASPECTOS SENSORIAIS E COGNITIVOS
Orientação do Professor Doutor Vasco Miguel Clara Lopes Galhardo
Dissertação apresentada à Faculdade de Medicina da
Universidade do Porto para a obtenção do grau de Doutor em
Neurociências
Departamento de Biologia Experimental
Faculdade de Medicina da Universidade do Porto
DISSERTAÇÃO DE CANDIDATURA AO GRAU DE DOUTOR EM NEUROCIÊNCIAS
APRESENTADA À FACULDADE DE MEDICINA DA UNIVERSIDADE DO PORTO
Orientação do Professor Doutor Vasco Miguel Clara Lopes Galhardo
HELDER RUI CARDOSO DA CRUZ
DINÂMICA OSCILATÓRIA CORTICAL E SUBCORTICAL NO
PROCESSAMENTO DA INFORMAÇÃO NOCICEPTIVA: ASPECTOS
SENSORIAIS E COGNITIVOS
Artigo 48º, § 3º
“A Faculdade não responde pelas doutrinas expendidas na dissertação”
(Faculdade de Medicina do Porto, Decreto-Lei nº19 337 de 29 de Janeiro de 1931)
JÚRI NOMEADO PARA A PROVA DE DOUTORAMENTO
PRESIDENTE
Reitor da Universidade do Porto
VOGAIS
Deolinda Maria Valente Alves Lima Teixeira
Professora Catedrática da Faculdade de Medicina da Universidade do Porto
João José Oliveira Malva
Investigador Principal da Faculdade de Medicina da Universidade de Coimbra
Rui Costa
Investigador Principal do Champalimaud Centre for the Unknown
Rui Manuel Cardoso Vaz
Professor Catedrático convidado da Faculdade de Medicina da Universidade do Porto
Vasco Miguel Clara Lopes Galhardo
CORPO CATEDRÁTICO
DA FACULDADE DE MEDICINA DO PORTO
Professores Efectivos
Professores Jubilados ou Aposentados
Alberto Manuel Barros da Silva
Altamiro Manuel Rodrigues Costa Pereira Álvaro Jerónimo Leal Machado de Aguiar António Carlos Freitas Ribeiro Saraiva Daniel Filipe Lima Moura
Deolinda Maria Valente Alves Lima Teixeira Francisco Fernando Rocha Gonçalves Isabel Maria Amorim Pereira Ramos
João Francisco Montenegro Andrade Lima Bernardes Jorge Manuel Mergulhão Castro Tavares
José Agostinho Marques Lopes José Carlos Neves da Cunha Areias José Eduardo Torres Eckenroth Guimarães José Henrique Dias Pinto de Barros José Manuel Lopes Teixeira Amarante José Manuel Pereira Dias de Castro Lopes Manuel Alberto Coimbra Sobrinho Simões Manuel António Caldeira Pais Clemente Manuel Jesus Falcão Pestana Vasconcelos Maria Amélia Duarte Ferreira
Maria Dulce Cordeiro Madeira
Maria Fátima Machado Henriques Carneiro Maria Leonor Martins Soares David Patrício Manuel Vieira Araújo Soares Silva Rui Manuel Almeida Mota Cardoso Rui Manuel Lopes Nunes
Abel José Sampaio da Costa Tavares Abel Vitorino Trigo Cabral
Alexandre Alberto Guerra Sousa Pinto Amândio Gomes Sampaio Tavares António Augusto Lopes Vaz António Carvalho Almeida Coimbra António Fernandes da Fonseca
António Fernandes Oliveira Barbosa Ribeiro Braga António Germano Pina Silva Leal
António José Pacheco Palha
António Luís Tomé da Rocha Ribeiro António Manuel Sampaio de Araújo Teixeira Belmiro dos Santos Patrício
Cândido Alves Hipólito Reis Carlos Rodrigo Magalhães Ramalhão Cassiano Pena de Abreu e Lima Daniel Santos Pinto Serrão
Eduardo Jorge Cunha Rodrigues Pereira Fernando de Carvalho Cerqueira Magro Ferreira Fernando Tavarela Veloso
Francisco de Sousa Lé
Henrique José Ferreira Gonçalves Lecour de Menezes Joaquim Germano Pinto Machado Correia da Silva José Augusto Fleming Torrinha
José Carvalho de Oliveira
José Fernando Barros Castro Correia José Luís Medina Vieira
José Manuel Costa Mesquita Guimarães Levi Eugénio Ribeiro Guerra
Luís Alberto Martins Gomes de Almeida Manuel Augusto Cardoso de Oliveira Manuel Machado Rodrigues Gomes Manuel Maria Paula Barbosa
Maria da Conceição Fernandes Marques Magalhães Maria Isabel Amorim de Azevedo
Mário José Cerqueira Gomes Braga Serafim Correia Pinto Guimarães
Valdemar Miguel Botelho dos Santos Cardoso Walter Friedrich Alfred Osswald