Universidade de Lisboa Faculdade de Medicina Instituto Politécnico de Lisboa
Escola Superior de Tecnologia da Saúde de Lisboa
Avaliação da composição corporal e do estado nutricional em doentes com neoplasias gastrointestinais: Bioimpedância Elétrica e Tomografia Axial
Computorizada, que correlação?
Sara Isabel Alegria Moço
Dissertação orientada por:
Professora Doutora Marília Cravo Dra. Sónia Velho
Mestrado em Nutrição Clínica Dissertação
Todas as afirmações efetuadas no presente documento são da exclusiva responsabilidade do seu autor, não cabendo qualquer responsabilidade à Faculdade de Medicina de Lisboa pelos conteúdos nele apresentados.
A impressão desta dissertação foi aprovada pelo Conselho Científico
da Faculdade de Medicina de Lisboa em reunião de 22 de setembro de
2015.
iii AGRADECIMENTOS
Aos meus pais, como sempre e indubitavelmente o meu maior apoio. Obrigada por acreditarem em mim e pelas oportunidades que me têm proporcionado, de modo a que a concretização deste sonho seja possível.
À minha irmã, sempre disponível para ajudar, e que ao longo da vida tem sido um exemplo a seguir.
Ao Filipe e aos meninos, que me fizeram muitas vezes desligar do “modo dissertação”. Ao Emanuel, pela paciência, mas sobretudo pelo incentivo e por me fazer acreditar que estou no caminho certo.
À minha irmã do coração, Marta. Obrigada pelo pilar que tens sido ao longo de todos estes anos.
À Gabi e à Vanessa pela motivação e coragem que me deram nesta reta final.
À Maria e à Ana Paula, as colegas de todas as horas deste mestrado. Foi realmente gratificante poder trabalhar convosco.
À Dra. Vânia Teixeira, pela disponibilidade e apoio que sempre demonstrou.
À Dra. Sónia Velho, para mim um exemplo de excelência na área da Nutrição. Gostaria de salientar a ajuda e o apoio, demonstrados ao longo de todo o projeto e de forma incansável. Muito obrigada pela oportunidade e por partilhar tantos conhecimentos e experiências.
À Professora Doutora Marília Cravo, que prontamente aceitou ser orientadora deste projeto. Obrigada por toda a disponibilidade e por todos os conhecimentos partilhados. A todos os que de algum modo permitiram a realização deste projeto.
v RESUMO
Introdução: A avaliação da composição corporal com a Tomografia Axial Computadorizada (TAC) é um método de avaliação da composição corporal válido e preciso. Este estudo teve por objetivo investigar a associação entre a localização da doença e o estado nutricional (avaliado por TAC, Bioimpedância Elétrica (BIA), medidas antropométricas e pelo The Patient-generated Subjective Global Assessment (PG-SGA)), a ingestão alimentar (IA), a atividade física (AF) e a qualidade de vida (QV).
Metodologia: Estudo observacional analítico transversal, que incluiu 57 doentes com diagnóstico recente de neoplasia gastrointestinal. Foram recolhidos dados sociodemográficos, a localização da doença e parâmetros analíticos. A avaliação nutricional incluiu a realização de medidas antropométricas, da BIA e TAC, e a aplicação do PG-SGA. A avaliação da QV foi realizada pela aplicação do questionário de QV da European Organisation for Research and Treatment of Cancer (EORTC QLQ – C30), a IA por aplicação do Questionário Semi-quantitativo de Frequência de Consumo Alimentar (QSQ-FCA), a AF pela aplicação do Questionário Internacional de Atividade Física (IPAQ) e a performance status (PS) pelo Eastern Cooperative Oncology Group Performance Status (ECOG-PS). A análise estatística foi realizada recorrendo ao software IBM SPSS Statistics versão 22.0 e R.
Resultados: 64.9% (n=37) eram homens e 35.1% (n=20) mulheres. Em relação à localização da neoplasia verificámos que 47.4% (n=27) localizavam-se no cólon, 26.3% (n=15) no estômago, 12.3% (n=7) no esófago, 7% (n=4) no pâncreas e 7% (n=4) no fígado e vias biliares. Nas medidas antropométricas, foram encontradas diferenças significativas para o peso (cólon: 78±16.9, estômago: 62.9±14.3, esófago, pâncreas e vias biliares (EPVB): 65.1±10.8, p= 0.003), Índice de Massa Corporal (IMC) (cólon: 29.4±1.1, estômago: 24.8±1.2, EPVB: 23.4±0.9, p<0.001) e percentagem de peso perdido (cólon: -1.3±5.5, estômago: 1.4±5.3, EPVB: 3.5±6.4, p=0.026). Relativamente à BIA, diferenças significativas foram encontradas entre a massa isenta de gordura (MIG) (cólon: 53.0±12.8, estômago: 44.0±12.1, EPVB: 45.7±10.7, p= 0.048) e massa gorda (MG) (cólon: 30.0±2.3, estômago: 22.8±2.3, EPVB: 20.2±1.6, p=0.008), para as
vi diferentes localizações da neoplasia. A TAC revelou diferenças significativas para a área de tecido adiposo subcutâneo (TAS) (cólon: 224.9±119.0, estômago: 145.2±84.9, EPVB: 129.2±73.4, p=0.015) e índice muscular esquelético (IME) (cólon: 53.2±9.1, estômago: 43±9.1, EPVB: 44.6±7.5, p= 0.034). A prevalência de sarcopénia foi de 23% (n=13) e a prevalência de desnutrição de 71.9% (n=41). Na análise univariada observámos que um aumento nos valores de proteína c-reativa (PCR) (OR:1.10, 95% IC [1.00-1.24], p=0.062) e idade (OR: 1.087, 95%IC [1.01-1.18], p=0.04) estavam associados a um maior risco de sarcopénia, enquanto um aumento da ingestão proteica se associam a uma redução do risco de sarcopénia (OR:0.98, 95%IC [0.96-0.99], p=0.038).
Conclusão: A idade, a ingestão proteica e o valor de PCR revelaram-se fatores preditivos independentes de sarcopénia.
Palavras-chave: composição corporal, estado nutricional, sarcopénia, Tomografia Axial Computadorizada, Bioimpedância Elétrica
vii ABSTRACT
Introduction: Body composition assessment by CT-scan image analysis is a valid and reliable method. The purpose of this study was to investigate the association between tumor location, nutritional status (assessed by CT-scan, BIA, anthropometric measures and The Patient-generated Subjective Global Assessment (PG-SGA)), dietary intake, physical activity and quality of life (QoL) in patients with gastrointestinal tumors. Methods: 57 subjects were enrolled in this cross-sectional study at diagnosis of gastrointestinal cancer. Socio-demographic, disease location and biochemical data were collected. Nutritional assessment was conducted with anthropometric measures, BIA and cross-sectional imaging using CT-scan, as well as by application of PG-SGA. Dietary intake was assessed with a Semi-quantitative Food Frequency Questionnaire, QoL with EORTC-Q30, Physical Activity with the International Physical Activity Questionnaire and performance status with ECOG-PS. Statistical analysis was performed with software SPSS22 and R.
Results: 35.1% were women (n=20) and 64.9% were men (n=37), and disease site was as follows: 26,3% (n=15) stomach, 47.4% (n=27) colon, 12.3% (n=7) esophagus, 7% (n=4) pancreas and 7% (n=4) liver or bile ducts. Sarcopenia prevalence was 23% (n=13) and malnutrition prevalence was 71.9% (n=41). A statistically significant difference according to tumour location was observed for weight (colon: 78±16.9, stomach: 62.9±14.3, esophagus, pancreas and liver or bile ducts: 65.1±10.8, p= 0.003), body mass index (colon: 29.4±1.1, stomach: 24.8±1.2, esophagus, pancreas and liver or bile ducts: 23.4±0.9, p<0.001) and weight loss (colon: -1.3±5.5, stomach:1.4±5.3, esophagus, pancreas and liver or bile ducts: 3.5±6.4, p=0.026). BIA analysis showed a statistically significant difference between free fat mass (colon: 53.0±12.8, stomach: 44.0±12.1, esophagus, pancreas and liver or bile ducts:45.7±10.7, p=0.048) and fat mass (colon: 30.0±2.3, stomach: 22.8±2.3, esophagus, pancreas and liver or bile ducts: 20.2±1.6, p=0.008) for disease site. A statistically significant difference between disease site was found for subcutaneous adipose tissue (colon: 224.9±119.0, stomach: 145.2±84.9, esophagus, pancreas and liver or bile ducts: 129.2±73.4, p=0.015) and skeletal muscle index (colon: 53.2±9.1, stomach: 43±9.1, esophagus, pancreas and liver or bile ducts:
viii 44.6±7.5, p= 0.034) obtained from CT-scan image analysis. An increase of C-reactive protein (CRP) (OR:1.10, 95%CI[1.00-1.24], p=0.062), and age (OR:1.087,95%CI[1.01- 1.18],p=0.04) wasassociated with a higher risk of sarcopenia, whereas an increase in protein intake was associated to a reduced risk of sarcopenia (OR:0.98, 95%IC[0.96-0.99],p=0.038).
Conclusion: Age, protein intake and CRP were found to be independent predictors of sarcopenia.
Key-words: Body composition, Nutritional status, Sarcopenia, Computed tomography, Bioelectrical impedance analysis
ix LISTA DE ABREVIATURAS
AF- Atividade física AngF- Ângulo de fase AM – Atenuação Muscular AMB – Área Muscular do Braço BIA – Bioimpedância Elétrica
DEXA - Absorção de Raio X de Dupla Energia d.p. – Desvio-padrão
ECOG-PS - Eastern Cooperative Oncology Group Performance Status
EORTC QLQ – C30 – Questionário de Qualidade de Vida da European Organisation for Research and Treatment of Cancer
EPVB- Esófago, Pâncreas e Vias Biliares
FMUL – Faculdade de Medicina da Universidade de Lisboa HBA – Hospital Beatriz Ângelo
HU - Unidades de Hounsfield IA – Ingestão alimentar IC – Intervalo de Confiança IMC – Índice de Massa Corporal IME – Índice Muscular Esquelético
IPAQ – short form - Questionário Internacional de Atividade Física – short form L3 – Terceira Vértebra Lombar
x MG – Massa Gorda
MIG – Massa Isenta de Gordura OD - Odds ratio
PB – Perímetro Braquial PC – Perímetro da Cintura PCR- Proteína c-reativa
PCT – Prega Cutânea Tricipital
PG-SGA - The Patient-generated Subjective Global Assessment PS – Performance Status
QSQ FCA - Questionário Semi-quantitativo de Frequência de Consumo Alimentar TAC – Tomografia Axial Computadorizada
TAS - Tecido Adiposo Subcutâneo TAV - Tecido Adiposo Visceral
xi ÍNDICE GERAL AGRADECIMENTOS ... iii RESUMO ... v ABSTRACT ... vii LISTA DE ABREVIATURAS...ix 1. INTRODUÇÃO ... 1 2. OBJETIVOS ... 5 3. METODOLOGIA ... 5 3.1. Considerações éticas... 5 3.2. Amostra ... 6 3.3. Recolha de dados... 6 3.3.1. Medições antropométricas... 6 3.3.2. Bioimpedância elétrica ... 8
3.3.3. Tomografia Axial Computorizada ... 8
3.3.4. Estado nutricional ... 9
3.3.5. Ingestão alimentar ... 10
3.3.6. Qualidade de vida ... 10
3.3.7. Atividade física ... 11
3.3.8. Parâmetros bioquímicos ... 11
3.4. Análise estatística dos dados ... 11
4. RESULTADOS ... 13
4.1. Caracterização da amostra ... 13
4.2. Estilos de vida ... 13
4.3. Capacidade funcional e Qualidade de vida ... 14
xii
4.5. Bioimpedância Elétrica ... 17
4.6. Tomografia Axial Computadorizada ... 18
4.7. Estado Nutricional ... 20
4.8. Ingestão alimentar ... 21
4.9. Parâmetros bioquímicos ... 24
4.10. Correlação entre resultados provenientes da TAC, medidas antropométricas e BIA... ... 24
5. DISCUSSÃO ... 29
6. CONCLUSÃO ... 41
7. BIBLIOGRAFIA ... 43
xiii ÍNDICE DE TABELAS
Tabela 1: Categorias de Classificação de IMC para adultos ... 7 Tabela 2: Categorias de classificação de IMC para indivíduos com idade superior a 65 anos ... 7 Tabela 3: Limites de IME admitidos, por género e IMC, para definição de doentes sarcopénicos ... 9 Tabela 4: Prevalência do consumo de bebidas alcoólicas, por localização da neoplasia. Resultados expressos em percentagem (n) e valor p ... 14 Tabela 5: Pontuação obtida no questionário sobre a QV, por géneros Resultados expressos em média ± desvio-padrão (d.p.) ... 15 Tabela 6: Pontuação obtida no questionário sobre a QV, por localização da neoplasia Resultados expressos em média ± d.p. ... 15 Tabela 7: Medições antropométricas, por géneros Resultados expressos em média ± d.p... 16 Tabela 8: Medições antropométricas, por localização da neoplasia. Resultados expressos em média ± d.p... 17 Tabela 9: Medições obtidas por realização da BIA, por géneros Resultados expressos em média ± d.p. ... 17 Tabela 10: Medições obtidas por realização da BIA, por localização da neoplasia. Resultados expressos em média ± d.p. ... 18 Tabela 11: Medições obtidas por realização da TAC, por géneros Resultados expressos em média ± d.p. ... 19 Tabela 12: Medições obtidas por realização da TAC, por localização da neoplasia Resultados expressos em média ± d.p. ... 19 Tabela 13: Prevalência da sarcopénia, por géneros Resultados expressos em percentagem (n) ... 20 Tabela 14: Prevalência da sarcopénia, por localização da neoplasia. Resultados expressos em percentagem (n) ... 20 Tabela 15: Estado nutricional, por localização da neoplasia. Resultados expressos em percentagem (n) ... 21 Tabela 16: IA por géneros Resultados expressos em média ± d.p. ... 21 Tabela 17: IA por localização da neoplasia. Resultados expressos em média ± d.p. .... 22
xiv Tabela 18: Parâmetros bioquímicos, por géneros. Resultados expressos em média ± d.p. ... 24 Tabela 19: Parâmetros bioquímicos, por localização da neoplasia. Resultados expressos em média ± d.p. ... 24 Tabela 20: Análise univariada de fatores preditivos de sarcopénia Resultados expressos em Odds ratio (OD), Intervalo de Confiança (IC) 95% e valor de p ... 27 Tabela 21: Análise multivariada de fatores preditivos de sarcopénia Resultados expressos em Odds ratio, Intervalo de Confiança 95% e valor de p ... 28 Tabela 22: Medições antropométricas dos vários estudos. Resultados expressos em média ± d.p. ... 32 Tabela 23: Medições obtidas por realização da TAC dos vários estudos. Resultados expressos em média ± d.p... 36
xv INDICE DE GRÁFICOS
Gráfico 1: Ingestão calórica e de macronutrientes, doentes sarcopénicos vs. não sarcopénicos ... 22 Gráfico 2: Ingestão proteica, doentes sarcopénicos vs. não sarcopénicos ... 23 Gráfico 3: Ingestão dos componentes lipídicos, doentes sarcopénicos vs. não sarcopénicos ... 23 Gráfico 4: Avaliação da concordância entre os valores de MIG provenientes da BIA e TAC ... 25 Gráfico 5: Análise multivariada de fatores preditivos de sarcopénia ... 26
1 1. INTRODUÇÃO
O cancro é uma das patologias com maior visibilidade nos dias de hoje, devido ao incremento progressivo da sua incidência, sobretudo nos países desenvolvidos(1),sendo considerado um problema de saúde pública(2).
Embora os dados apontem para uma diminuição do número de mortes por cancro, o número absoluto de novos casos e de mortes por esta causa continua a aumentar(3). Atualmente, o cancro é a principal causa de morte nos países desenvolvidos e a segunda maior causa de morte nos países em desenvolvimento, sendo responsável por uma em cada oito mortes no mundo(4), ou seja, é mais mortífero que o Vírus da Imunodeficiência Humana, a Malária e a Tuberculose em conjunto(2). Em 2012, as estatísticas revelavam 14.1 milhões de casos diagnosticados e 8.2 milhões de mortes por esta doença, mundialmente. Os dados mais recentes estimam que no ano de 2030, cerca de 21.7 milhões de novos casos serão diagnosticados e 13 milhões de mortes serão verificadas, em consequência do aumento da população e do seu envelhecimento, bem como da adoção de estilos de vida menos saudáveis(2).
No ano de 2008 os cancros gastrointestinais (esófago, estômago, cólon e reto, pâncreas, fígado e vias biliares)(5,6) foram responsáveis por 2.3 milhões de mortes, ocupando a categoria de localização de cancro com maior mortalidade(7). Em Portugal, para ambos os sexos, de entre os vários cancros gastrointestinais, os que apresentam maiores taxas de incidência (/100 000) são: estômago (33,7e 21,4), cólon (53,1 e 37,9 ) e reto (30,2 e 16,3 )(8). Ao analisarmos o aparecimento de novos casos por grupos etários, verificamos que na população portuguesa os cancros do estômago e cólon são mais frequentes entre os 75 e 79 anos de idade, enquanto o cancro do reto é mais frequente entre os 70 e os 74 anos de idade(8).
A desnutrição no doente oncológico é de etiologia multifatorial e depende do tipo, da localização e do estadio da doença, bem como da sintomatologia despoletada pelas terapêuticas antineoplásicas(9). A desnutrição afeta entre 20(10) a 70%(11) dos doentes com neoplasias, sendo que os doentes com neoplasias gastrointestinal estão
2 mais predispostos à desnutrição(12) devido à diarreia, malabsorção e sintomas obstrutivos(13).
As neoplasias resultam de vários processos, nomeadamente do crescimento celular descontrolado, resultante da interação entre fatores genéticos e agentes externos(14–16). As células potencialmente tumorais competem com as células saudáveis, por processos de seleção natural e mutabilidade natural, tentando obter vantagem sobre estas últimas. As células saudáveis inicialmente sofrem uma alteração a nível histológico tornando-se tumorais e, eventualmente, metastáticas em processos posteriores(1).
Sabe-se que na presença destas células tumorais há uma resposta imune da parte do hospedeiro que culmina em alterações do metabolismo(17). As alterações metabólicas são várias, estando na sua génese a competição por nutrientes entre células saudáveis e células tumorais (18). No metabolismo dos hidratos de carbono, verifica-se um aumento considerável da neoglicogénese a partir de aminoácidos, bem como uma maior resistência à insulina, o que resulta numa elevação dos níveis de glucose circulante(18,19). Por sua vez, no metabolismo das proteínas, também a proteólise está aumentada, ao contrário da síntese proteica muscular que pode estar reduzida, culminando numa diminuição do turnover proteico e consequente perda de massa magra(14,19). Por fim, o metabolismo lipídico em que se verifica uma diminuição das reservas de tecido adiposo, em consequência do aumento da lipólise e da mobilização de gordura periférica(18). Importa ainda referir que há a ação de citocinas inflamatórias, produzidas por monócitos, que promovem uma maior produção de proteínas de fase aguda, induzindo uma diminuição das reservas de tecido adiposo e massa magra(18).
Além das alterações referidas, devem também ser consideradas as alterações metabólicas induzidas pela ação do próprio tumor(20), já que as células tumorais produzem: citocinas inflamatórias (semelhantes às produzidas pelos monócitos), o fator indutor da proteólise (fundamental no processo de depleção muscular) e o fator mobilizador de lípidos (responsável pelo aumento da oxidação dos lípidos no tecido adiposo)(18). O tumor provoca, ainda, alterações no paladar e no olfato, situação que se reflete fortemente na diminuição da IA(18,21). Estas alterações vão, assim, ter um papel determinante no aumento do risco de desnutrição(18,22) e que nos remete para o conceito
3 de sarcopénia. Este caracteriza-se por uma depleção de massa muscular, independente da adiposidade(23), e que se associa a uma perda das capacidades físicas, pois a força muscular não é suficiente para suportar o peso corporal(24). Esta condição verifica-se frequentemente em doentes com neoplasia gastrointestinal, sobretudo em tumores do pâncreas, esófago e estômago(15).
A depleção de massa muscular nestas condições patológicas é caracterizada não só pela diminuição do músculo, mas também pelo aumento de gordura inter e intra- muscular(25) a nível do músculo esquelético e cardíaco(22,26,27), interferindo diretamente na capacidade funcional. Associado a esse facto pode ocorrer também um aumento do número de infeções, aumento do tempo de internamento(27,28), diminuição da QV(27,29), aumento da toxicidade desencadeada pelos tratamentos e diminuição da sobrevivência(21,23,27). No entanto, é fulcral estar alerta para o facto desta perda de massa muscular poder estar dissimulada nas variações do peso corporal(30), e por não ser uma condição exclusiva dos doentes com baixo peso(23,31). É neste contexto que surge o conceito de obesidade sarcopénica, que se caracteriza pela depleção muscular e MG excessiva(20,31,32), sendo muito frequente em doentes com idade superior a 65 anos(23), e que pode dificultar o diagnóstico de sarcopénia(30). A obesidade sarcopénica está intimamente relacionada com o aumento acentuado da prevalência de excesso de peso e obesidade, do último século, nos países ocidentalizados(30), sendo que em Portugal cerca de 55% da população apresenta excesso de peso e 20% obesidade(33). Na obesidade sarcopénica, o risco de morbilidade é superior já que não só se manifesta a perda de função associada à depleção muscular, como estão presentes os riscos de saúde inerentes à obesidade(23). Não obstante, é então determinante recorrer a métodos de avaliação da composição corporal fiáveis e precisos, que nos permitam desenvolver uma avaliação nutricional individualizada e otimizar a intervenção nutricional, de modo a obter maiores benefícios para o doente(20,34).
Entre os métodos mais usados para avaliar a composição corporal dos doentes oncológicos encontram-se as pregas cutâneas(35), a BIA(36), a absorção de raio X de dupla energia(37,38) (DEXA) e a TAC(23,39), sendo os dois últimos métodos de elevada precisão(40,41).
4 A TAC ganha especial relevo nos doentes oncológicos por ser um método utilizado por rotina em doentes com neoplasias gastrointestinais, para estadiamento da doença(40,41). Nesse sentido, pode ser oportunisticamente aproveitado para discriminar e quantificar, de forma válida e precisa(41,42), os vários componentes da composição corporal(27,40,41), pois permite uma separação concreta entre o tecido adiposo e o tecido muscular(30). Através da análise de imagens obtidas por TAC, ao nível da terceira vértebra lombar (L3), é possível determinar a área do tecido adiposo visceral (TAV) e subcutâneo (TAS), bem como a atenuação muscular (AM) da radiação, que permite avaliar a infiltração de gordura na massa muscular(27). Porém, apesar da sua utilização crescente(41), este é ainda um procedimento cujo potencial está subaproveitado(43). A sua aplicação na avaliação da composição corporal representará um avanço significativo na capacidade de diagnosticar, classificar e avaliar o tratamento da sarcopénia(30).
5 2. OBJETIVOS
Caracterizar o estado nutricional, a ingestão alimentar e a qualidade de vida de doentes com neoplasias gastrointestinais;
Avaliar a correlação entre a BIA e a TAC na avaliação da composição corporal e do estado nutricional;
Avaliar a associação entre composição corporal e ingestão nutricional, exercício físico e estado pró-inflamatório do hospedeiro.
3. METODOLOGIA
3.1. Considerações éticas
O estudo observacional analítico transversal foi aprovado pelo Conselho Científico da Faculdade de Medicina da Universidade de Lisboa (FMUL) e pela Comissão de Ética para a Saúde do Centro Hospitalar Lisboa Norte/FMUL. Este estudo foi realizado no âmbito do estudo “Avaliação do estado nutricional em doentes com neoplasias gastrointestinais com Bioimpedância Elétrica e Tomografia Axial Computorizada e a sua associação com variáveis inerentes às complicações dos tratamentos e ao resultado clínico”, a decorrer no Hospital Beatriz Ângelo (HBA), previamente aprovado pelas Comissões de Investigação Clínica e de Ética da referida instituição.
Todos os participantes foram informados e esclarecidos acerca dos procedimentos, objetivos do estudo, confidencialidade dos dados e possibilidade de poderem desistir em qualquer momento. A confidencialidade dos dados foi garantida através da atribuição de um número associado ao número do processo, de modo a que a identificação do doente pela base de dados não fosse possível. Nesse sentido, todos os participantes preencheram o Termo de Consentimento Informado, que esclarecia todas as informações supramencionadas.
6 A recolha dos dados assumiu as seguintes características: não identificou o individuo e foi realizada em ambiente sigiloso; os dados recolhidos não foram prejudiciais para qualquer um dos participantes; todos os participantes foram esclarecidos acerca de todos os procedimentos usados; e incluídos de forma voluntária.
3.2. Amostra
A amostra foi constituída por doentes do HBA, local onde todas as avaliações e recolhas de dados foram efetuadas. Todos os doentes incluídos foram casos previamente discutidos na Consulta Multidisciplinar, realizada semanalmente.
Foi obtida uma amostra consecutiva de 57 doentes tendo sido definidos os seguintes critérios de inclusão: idade superior a 18 anos e diagnóstico de neoplasia gastrointestinal. Como critérios de exclusão foram considerados: doentes que já tivessem iniciado qualquer tipo de tratamento antineoplásico, mulheres grávidas e indivíduos com compreensão comprometida.
3.3. Recolha de dados
Os participantes foram avaliados num único momento, entre Outubro de 2014 e Março de 2015, após o diagnóstico de neoplasia gastrointestinal e antes de ser iniciado qualquer tratamento antineoplásico. Informações como a data de nascimento, escolaridade, consumo atual de álcool e tabaco foram diretamente questionados ao doente. Os dados respetivos à localização da neoplasia (categorizada em Estômago, Cólon, Esófago, Pâncreas, Fígado e Vias Biliares), Capacidade funcional/PS - ECOG-PS – (numa escala de 0 a 5, em que 0= Totalmente ativo e 5= Morto)(44) e parâmetros bioquímicos foram recolhidos a partir do processo clínico eletrónico. A avaliação da composição corporal, estado nutricional, IA, QV e AF foi efetuada de acordo com os seguintes procedimentos:
3.3.1. Medições antropométricas
O peso corporal e a estatura foram medidos recorrendo a uma balança e um estadiómetro da marca Seca, com uma escala de 0,1kg e 0,1 cm, respetivamente. A
7 medição da estatura foi realizada numa superfície lisa, com o doente descalço, os pés juntos e em posição anatómica, com a cabeça em plano horizontal de Frankfurt(45). A medição do peso foi efetuada com a balança num plano horizontal, com a bexiga e estômago vazio e uso de roupas leves(45). O IMC, ou Índice de Quetelet(45), foi calculado através da aplicação da fórmula (peso corporal/(estatura)2), sendo definidas pela Organização Mundial de Saúde(46) as seguintes categorias (Tabela 1):
Classificação IMC (kg/m2)
Magreza <18.5
Normoponderal Entre 18.5 e 24.9 Excesso de peso Entre 25 e 29.9
Obesidade I Entre 30 e 34.9 Obesidade II Entre 35 e 39.9
Obesidade III ≥ 40
Tabela 1: Categorias de Classificação de IMC para adultos
Para os indivíduos com idade superior a 65 anos de idade, segundo Lipschitz(47), as categorias a considerar são (Tabela 2):
Classificação IMC (kg/m2)
Desnutrição <22
Risco de desnutrição Entre 22 e 23.9 Normoponderal Entre 24 e 26.9 Excesso de peso Entre 27 e 30 ()
Entre 27 e 32 () Obesidade >30 (); >32 ()
Tabela 2: Categorias de classificação de IMC para indivíduos com idade superior a 65 anos
A medição dos perímetros foi realizada com uma fita métrica flexível, com uma escala de 0,1cm, sendo que o perímetro da cintura (PC) foi medido no ponto médio da
8 distância entre a última costela e o rebordo superior da crista ilíaca (em expiração), e o perímetro braquial (PB) no ponto médio entre o acrómio e o olecrânio (determinado com o braço a um ângulo de 90o)(45). Para o cálculo da Área Muscular do Braço (AMB) aplicou-se a fórmula ((perímetro muscular do braço)2/12,56)(45).
Foi, ainda, medida a prega cutânea tricipital (PCT), recorrendo a um adipómetro com uma escala de 1 mm. As medições foram sempre realizadas no braço direito e num conjunto de três medições, sendo que o valor considerado corresponde à média das três medições. A PCT foi medida na parte posterior do braço, sobre o músculo tricipital, ao nível do ponto médio entre o acrómio e o ponto radial(45).
3.3.2. Bioimpedância elétrica
A BIA foi usada para avaliar a MG (em kg), a MIG (em kg), a água corporal (em %) e o ângulo de fase (AngF). O instrumento usado para a realização desta medição foi o Bodystat 1500 MDD, que é um aparelho de medição tetrapolar e duas frequências (5 e 50 kHz). Este aparelho avalia os segmentos corporais superiores e inferiores, através da colocação de quatro elétrodos no lado direito do corpo: na mão, próximo à articulação metacarpo-falângea da superfície dorsal; no pulso, entre as proeminências distais do rádio e do cúbito; no pé, no arco transverso da superfície superior; e no tornozelo, entre os maléolos medial e lateral(48). Esta análise baseia-se na passagem de uma corrente elétrica de baixa amplitude e de alta frequência(48).
3.3.3. Tomografia Axial Computorizada
Por fazer parte do protocolo de diagnóstico, todos os doentes realizaram uma TAC abdominal.
A imagem correspondente à região da apófise transversa da L3 foi a usada para a determinação da área de TAV (cm2), TAS (cm2), massa muscular (cm2), AM média (em unidades de Hounsfield (HU)(30)). O IME foi posteriormente calculado (área múscular2/altura2) assim como a MIG (0.30 x área muscular + 6.06)(40). As medições efetuadas a partir da imagem TAC apresentam uma forte correlação com os tecidos muscular e adiposo a nível corporal em populações saudáveis(24,44) e doentes oncológicos(24). Para obtenção da área dos respetivos tecidos foi utilizado um software específico desenvolvido por Vickie Baracos et al(49). Os tecidos foram identificados de
9 acordo com as suas características anatómicas e demarcadas considerando os limites pré-estabelecidos, em HU(30), para cada um deles: de -29 a 150 HU para o músculo esquelético, de -190 a -30 HU para os tecidos adiposo subcutâneo e intermuscular, e de -150 a -50 HU para o TAV(30,40). Os pontos de corte definidos para o IME são os apresentados na Tabela 3(32); os doentes com valores inferiores aos mencionados foram designados sarcopénicos(30). A recolha das imagens e a validação da análise das mesmas foram realizadas por radiologistas.
IME (cm2/m2)
IMC (kg/m2) Sexo masculino Sexo feminino
<20 <43 <41
Entre 20 e 24.9 <43 <41
Entre 25 e 29.9 <53 <41
≥30 <53 <41
Tabela 3: Limites de IME admitidos, por género e IMC, para definição de doentes sarcopénicos
3.3.4. Estado nutricional
Para a determinação do estado nutricional foi aplicado o questionário PG-SGA, validado para doentes oncológicos(11). Este questionário contempla duas secções distintas: uma preenchida pelo próprio doente e outra pelo profissional de saúde. Na primeira secção o doente faculta informações respeitantes ao seu peso (atual e habitual há 1 e 6 meses), IA (se aumentou, diminui ou permanece igual), sintomas (náuseas, vómitos, xerostomia, alteração do cheiro dos alimentos, entre outros) e atividade (normal ou com limitações). Por sua vez, na segunda secção o profissional de saúde tem de registar dados relativos às necessidades metabólicas (presença e duração de febre e toma de corticoesterois), ao exame físico (panículo adiposo, massa muscular e estado de hidratação) e às necessidades nutricionais associadas à doença (diagnóstico de cancro, SIDA, caquexia cardíaca ou pulmonar, úlcera de decúbito, hérnia aberta ou fístula, existência de traumatismo e idade superior a 65 anos). A cada um destes parâmetros é atribuído uma pontuação que resulta numa avaliação global: PG-SGA A, doente bem nutrido ou anabólico; PG-SGA B, desnutrição moderada ou suspeita de desnutrição; PG-SGA C, desnutrição severa.
10 3.3.5. Ingestão alimentar
O QSQ FCA(50,51) foi aplicado com o objetivo de determinar a IA do último ano. É composto por 86 alimentos/conjunto de alimentos, agrupados em 8 grupos alimentares: I – produtos lácteos; II – Ovos, carnes e peixes; III – Óleos e gorduras; IV – Pão, cereais e similares; V – Doces e pastéis; VI – Hortaliças e legumes; VII – Frutas; VIII – Bebidas e miscelâneas. Para cada um dos alimentos/conjunto de alimentos foi assinalada a frequência de consumo (nunca ou < 1mês, 1-3 por mês, 1 por semana, 2-4 por semana, 5-6 por semana, 1 por dia, 2-3 por dia, 4-5 por dia, 6+ por dia), e a quantidade, comparativamente com uma porção de referência (igual, maior ou menor). O questionário tem, ainda, a possibilidade de incluir outros alimentos que sejam consumidos pelo doente e que não são contemplados na lista pré-definida. No caso de determinados alimentos consumidos apenas em algumas épocas do ano, deve ser também assinalado que se trata de uma ingestão sazonal. Para a obtenção do consumo alimentar, a frequência referida para cada item foi multiplicada pela respetiva porção média padrão, em grama, e por um fator de variação sazonal para alimentos consumidos em épocas específicas (considerada a sazonalidade média de três meses). A conversão dos alimentos foi realizada pelo Instituto de Saúde Pública da Universidade do Porto, recorrendo à ferramenta informática Food Processor Plus.
A ingestão de álcool foi considerada como excessiva quando o consumo diário de etanol ultrapassou as 50g(52).
3.3.6. Qualidade de vida
A avaliação da QV foi realizada através da aplicação do questionário da European Organisation for Research and Treatment of Cancer versão 3.0 (EORTC QLQ – C30). Este questionário é constituído por 30 itens, que incluem uma escala de função (físico, emocional, cognitivo, social, saúde global e QV), uma escala de sintomas (náuseas/ vómitos, fadiga e dor) e uma escala de saúde global (saúde e QV)(53). Nas escalas de função e saúde global, as pontuações mais elevadas remetem para uma melhor condição, enquanto que as pontuações mais altas em escalas de sintomas nos traduzem um aumento da sintomatologia(54). As pontuações originais foram transformadas em pontuações de 0 a 100, de acordo com as guidelines do EORTC(54).
11 3.3.7. Atividade física
O IPAQ – short form foi a ferramenta usada para avaliar a AF (55). A versão é constituída por sete questões, relativas à AF vigorosa (dias e duração) e moderada (dias e duração), marcha (dias e duração) e tempo passado sentado(56). Todas as questões referem-se aos 7 dias anteriores(56). O cálculo da pontuação total é efetuado através da soma da duração (em minutos), frequência (em dias) de marcha e dos tempos de atividade moderada e vigorosa, obtendo-se três níveis de AF: baixa, moderada e alta(56).
3.3.8. Parâmetros bioquímicos
Uma vez que todos os doentes, de acordo com o seu protocolo de diagnóstico, foram sujeitos a colheita de sangue, registaram-se os seguintes parâmetros: albumina, proteínas totais, e proteína c-reativa (PCR). Os valores de referência considerados foram 3.5 a 5.2 g/dl, 6.4 a 8.3 g/dl e <0.5 mg/dl, respetivamente.
3.4. Análise estatística dos dados
A análise estatística envolveu a utilização de medidas de estatística descritiva e estatística inferencial, sendo que na última se usou como referência para aceitar ou rejeitar a hipótese nula um nível de significância p ≤ 0,05.
As diferenças entre géneros e localização da neoplasia para as variáveis contínuas foram analisadas recorrendo a testes paramétricos (teste t-student e ANOVA) e não paramétricos (teste de Man Whitney U e teste Kruskal - Wallis), dependendo do ajuste das variáveis à distribuição normal. As associações entre variáveis categóricas foram realizadas através do teste de independência do Qui-quadrado. As correlações bivariadas foram analisadas com os coeficientes de correlação de Pearson ou Spearman, de acordo com a existência ou não de um adequado ajuste das variáveis á distribuição normal.
A concordância entre a MIG-TAC e a MIG-BIA foi analisada com base no coeficiente de correlação de Pearson, foi testada a hipótese nula de que a diferença entre as duas medições é igual a zero e foi construído um gráfico de Bland e Altman. A transformação logarítmica de MIG da BIA e TAC foi realizada para minimizar o viés proporcional.
12 Na análise de preditores independentes de sarcopénia foi efetuada uma análise univariada e multivariada utilizando modelos lineares generalizados.
A análise estatística dos dados foi realizada recorrendo ao software IBM SPSS Statistics versão 22.0 e R.
13 4. RESULTADOS
4.1. Caracterização da amostra
A amostra incluiu 57 doentes, dos quais 64.9% (n=37) do sexo masculino e 35.1% (n=20) do sexo feminino. A média de idade foi de 69±11.5 anos e de 67.2±9.5 anos para o sexo masculino e feminino, respetivamente. A idade mínima verificada foi de 41 anos e a máxima de 86 anos.
Relativamente à escolaridade, 57.9% (n=33) dos doentes frequentaram apenas o primeiro ciclo do ensino básico, 15.8% (n=9) o segundo ciclo do ensino básico, 10.5% (n=6) o terceiro ciclo do ensino básico, 3.5% (n=2) o ensino secundário e 1.8% (n=1) o ensino superior e 10.5% (n=6) dos doentes reportou não ter frequentado qualquer tipo de ensino.
Quanto à localização da neoplasia verificou-se que 47.4% (n=27) dos tumores se localizavam no cólon, 26.3% (n=15) no estômago, 12.3% (n=7) no esófago, 7% (n=4) no pâncreas e 7% (n=4) no fígado e vias biliares.
4.2. Estilos de vida
No que diz respeito aos hábitos tabágicos no momento do diagnóstico, 86% (n=49) dos doentes negou este hábito, ao contrário dos restantes 14% (n=8). Ao considerarmos os hábitos etanólicos no momento do diagnóstico, 77.2% (n=44) dos doentes responderam negativamente, enquanto que os restantes 22.8% (n=13) mencionaram ingerir bebidas alcoólicas. Relativamente aos hábitos etanólicos do último ano 23.6% (n=13) e 76.4% (n=42) tiveram uma ingestão igual ou superior a 50g de etanol e inferior a 50g de etanol, respetivamente. De acordo com a localização da doença, observou-se uma tendência para uma maior percentagem de doentes com neoplasia do cólon e EPVB apresentarem um consumo excessivo de etanol (≥50g/dia).
14 Cólon Estômago EPVB Valor p Ingestão ≥50g etanol/dia 46.2 (6) 7.7 (1) 46.2 (6) 0.072 Ingestão < 50g etanol/dia 47.7 (20) 33.3 (14) 19.9 (8)
Tabela 4: Prevalência do consumo de bebidas alcoólicas, por localização da neoplasia. Resultados expressos em
percentagem (n) e valor p
Quando avaliada a prática de AF constatou-se que 52.6% (n=30) dos doentes mantinham uma AF moderada, enquanto que os restantes 47.4% (n=27) uma AF baixa, não se verificando uma diferença estatisticamente significativa entre géneros. A análise univariada não revelou uma associação entre a AF após o diagnóstico e a sarcopénia (OR=1.23, 95% IC [0.34-4.50], p=0.747).
4.3. Capacidade funcional e Qualidade de vida
Relativamente à capacidade funcional observou-se que 47.4% (n=27) dos doentes se apresentaram totalmente ativos, 42.1% (n=24) com atividade restrita, 8.8% (n=5) ambulatórios e capazes de se auto-cuidarem e 1.8% (n=1) apenas capazes de se auto-cuidarem. Não se verificou uma diferença estatisticamente significativa entre géneros para esta variável.
No que diz respeito à QV verificou-se que os doentes do sexo masculino tinham uma pontuação média inferior na escala de Sintomas (homens: 17.9±9.6, mulheres: 28±14.7, p=0.009) e uma pontuação média superior na escala Funcional (homens: 65.8±20.1, mulheres: 48.9±24.1, p=0.007). Na escala de Saúde Global é também o sexo masculino que apresenta uma pontuação média superior, apesar de não existir uma diferença estatisticamente significativa (homens: 55.4±20.3, mulheres: 50.4±15.4, p=0.402). Ou seja, o sexo masculino apresentou uma menor sintomatologia, melhor capacidade funcional e melhor saúde global. Não foram encontradas diferenças estatisticamente significativas para nenhuma das dimensões da QV, considerando as diferentes localização da neoplasia. Os dados relativos á QV encontram-se expressos nas Tabelas 5 e 6.
15
Homens (n=37) Mulheres (n=20) Valor p
Funcional 65.8±20.1 48.9±24.1 0.007
Sintomas 17.9±9.6 28±14.7 0.009
Saúde Global 55.4±20.3 50.4±15.4 0.402
Tabela 5: Pontuação obtida no questionário sobre a QV, por géneros Resultados expressos em média ±
desvio-padrão (d.p.) Cólon (n=26) Estômago (n=15) EVPB (n=14) Valor p Funcional 61.2±21.7 56.3±26.7 63.3±21.3 0.722 Sintomas 19.2±11.6 23.4±15.4 19.6±10.7 0.384 Saúde Global 57.1±17.7 53.9±21.3 45.2±17.2 0.169
Tabela 6: Pontuação obtida no questionário sobre a QV, por localização da neoplasia Resultados expressos em média
± d.p.
4.4. Medições antropométricas
Verificaram-se diferenças estatisticamente significativas, entre géneros, para o peso (homens: 74.4±14.6, mulheres: 63.7±17.1, p=0.02) e para a estatura (homens: 1.68±0.1, mulheres: 1.53±0.04, p<0.001), apresentando o sexo masculino valores médios mais elevados para ambos os parâmetros. Relativamente aos valores de IMC não se verificou uma diferença estatisticamente significativa entre os géneros (Tabela 7) No que respeita a PCT, o sexo feminino apresentou uma tendência para valores médios superiores (homens: 20.59±6.6, mulheres: 25.45±10.6, p=0.07). Para as restantes medidas antropométricas o sexo masculino apresentou sempre uma média superior, com exceção da percentagem de peso perdido. Não foram, no entanto, encontradas diferenças estatisticamente significativas entre géneros (Tabela 7).
16 Total
(n=57)
Homens (n=37) Mulheres (n=20) Valor p
Peso 70.6±16.2 74.4±14.6 63.7±17,1 0.021 Estatura 1.63±0.1 1.68±0.1 1.53±0.04 <0.001 IMC 26.6±5.7 26.4±4.9 27.1±7.02 0.674 PCT 22.3±8.5 20.6±6.6 25.45±10.6 0.073 PC 96.4±13.9 97.6±12.3 94.2±16.6 0.374 PB 29.6±10.8 30.2±13 28.6±5 0.661 AMB 49.9±103.6 58.3±12.8 34.4±10.6 0.292 %peso perdido 0.7±6.0 0.5±1.0 0.9±5.6 0.664
Tabela 7: Medições antropométricas, por géneros Resultados expressos em média ± d.p.
Ao analisarmos as medidas antropométricas por localização da neoplasia (Tabela 8), verificou-se que para todas, com exceção do peso, AMB e percentagem de peso perdido, os doentes com tumores do EPVB são os que apresentam valores médios mais baixos. Em oposição, os doentes com tumores no cólon, são os que mostram valores médios mais elevados dos três grupos, para os mesmos parâmetros. Por outro lado, ao considerarmos o peso e a AMB, verificou-se que os doentes com neoplasias do estômago são os que revelam valores médios mais baixos. Relativamente à percentagem de peso perdido, por localização da neoplasia, constatou-se que são os doentes com tumores do EPVB que apresentam perdas ponderais superiores.
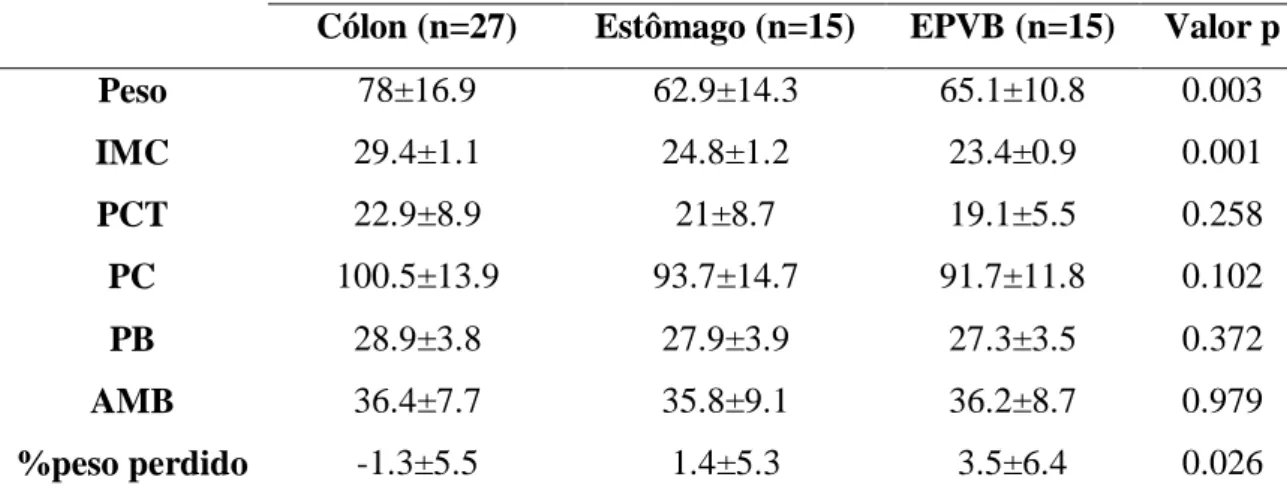
Diferenças estatisticamente significativas foram encontradas, entre os grupos, para o peso (cólon: 78±16.9, estômago: 62.9±14.3, EPVB: 65.1±10.8, p= 0.003), IMC (cólon: 29.4±1.1, estômago: 24.8±1.2, EPVB: 23.4±0.9 (p<0.001) e percentagem de peso perdido (cólon: -1.3±5.5, estômago: 1.4±5.3, EPVB: 3.5±6.4, p<0.026).
17 Cólon (n=27) Estômago (n=15) EPVB (n=15) Valor p
Peso 78±16.9 62.9±14.3 65.1±10.8 0.003 IMC 29.4±1.1 24.8±1.2 23.4±0.9 0.001 PCT 22.9±8.9 21±8.7 19.1±5.5 0.258 PC 100.5±13.9 93.7±14.7 91.7±11.8 0.102 PB 28.9±3.8 27.9±3.9 27.3±3.5 0.372 AMB 36.4±7.7 35.8±9.1 36.2±8.7 0.979 %peso perdido -1.3±5.5 1.4±5.3 3.5±6.4 0.026
Tabela 8: Medições antropométricas, por localização da neoplasia. Resultados expressos em média ± d.p.
4.5. Bioimpedância Elétrica
Diferenças estatisticamente significativas foram observadas, entre géneros, para a MIG, em que se verificou um valor médio superior no sexo feminino (homens: 54.4±10.04, mulheres: 38±9.8, p<0.001), e para a água corporal, onde o sexo masculino apresenta um valor médio superior (homens:56.6±5.3, mulheres: 51.8±9.7, p=0.006).
Constatou-se, ainda, que o sexo masculino apresenta uma média de MG inferior, mas uma média de AngF superior, contudo essas diferenças não se revelaram estatisticamente significativas (Tabela 9).
Total (n=57) Homens (n=37) Mulheres (n=20) Valor p
MG 25.5±10.9 22.8±7.7 29.4±13 0.104
MIG 48.5±12.5 54.4±10.04 38±9.8 <0.001
Água corporal 55±7.5 56.6±5.3 51.8±9.7 0.006
AngF 5.8±2.0 18.9±79.1 6.0±3.1 0.610
Tabela 9: Medições obtidas por realização da BIA, por géneros Resultados expressos em média ± d.p.
Ao analisarmos as várias medições por localização da neoplasia (Tabela 10), verificou-se que os doentes com tumor do estômago são os que apresentam os valores
18 médios mais baixos de MIG em oposição aos doentes com tumores do cólon (cólon:53.0±12.8, estômago:44.0±12.1, EPVB:45.7±10.7, p=0.048). No que respeita a MG, os doentes com tumores do EPVB são os que apresentam valores médios mais baixos, enquanto que os doentes com tumores no cólon apresentam, mais uma vez, uma média mais elevada de entre os vários grupos (cólon:30.0±2.3, estômago:22.8±2.3, EPVB: 20.2±1.6, p:0.008). Relativamente aos valores de AngF não foram encontradas diferenças estatisticamente significativas entre grupos. No entanto, são os doentes com tumores do cólon os que apresentam os valores médios mais elevados, em oposição aos doentes com tumores do EPVB, cujos valores médios são os mais baixos dos três grupos (Tabela 10).
Cólon (n=27) Estômago (n=15) EPVB (n=15) Valor p
MG 30.0±2.3 22.8±2.3 20.2±1.6 0.008
MIG 53.0±12.8 44.0±12.1 45.7±10.7 0.048
Água Corporal 53.2±7.9 56.3±7.0 56.6±6.6 0.275
AngF 6.6±3 5.3±0.7 5.1±0.9 0.063
Tabela 10: Medições obtidas por realização da BIA, por localização da neoplasia. Resultados expressos em média ±
d.p.
4.6. Tomografia Axial Computadorizada
A análise das imagens provenientes da TAC revelou diferenças estatisticamente significativas, entre géneros, para a área muscular (homens: 147.6±22.1, mulheres: 105.7±15.5, p<0.001) IME (homens: 52.2±8.9, mulheres: 45.4±7.3, p=0.007) e MIG (homens: 45.4±7.3, mulheres: 37.7±4.7, p<0.001). Para todos os parâmetros mencionados o sexo masculino apresenta valores médios superiores (Tabela 11).
Apesar de não se encontrarem diferenças estatisticamente significativas para os restantes parâmetros, observou-se que os valores médios da área muscular e a área de TAV no sexo masculino são superiores, ao contrário dos valores médios da área de TAS que se mostram superiores nas mulheres (Tabela 11).
19 Total (n=50) Homens (n=31) Mulheres (n=19) Valor p
AM 29.3±9.0 30.7±8.3 26.9±9.9 0.154 Área Muscular 131.7±28.5 147.6±22.1 105.7±15.5 <0.001 Área TAV 170.2±117.1 185.9±119.6 144.5±111.3 0.229 Área TAS 178.6±105.1 152.6±79.8 221.1±128.1 0.024 IME 49.7±8.9 52.2±8.9 45.4±7.3 0.007 MIG 45.7±8.6 50.3±6.6 37.7±4.7 <0.001
Tabela 11: Medições obtidas por realização da TAC, por géneros Resultados expressos em média ± d.p.
Ao analisarmos as várias medições por localização da neoplasia, constatou-se que apenas há diferenças estatisticamente significativas entre os grupos para a área de TAS (cólon: 224.9±119.0, estômago: 145.2±84.9, EPVB: 129.2±73.4, p=0.015) e para o IME (cólon: 53.2±9.1, estômago: 48.3±9.1, EPVB: 45.2±6.0 p= 0.034). Para a área de TAS são os doentes com tumores do EPVB que apresentam os valores médios mais baixos, em oposição aos doentes com tumores do cólon que possuem os valores médios mais altos (Tabela 12). A mesma tendência verifica-se para os valores médios de IME, pertencendo os valores médios mais baixos aos doentes com tumores do EPVB e os valores médios mais elevados aos doentes com tumores do cólon (Tabela 12).
Cólon (n=21) Estômago (n=15) EPVB (n=12) Valor p AM 26.4±8.6 30.7±9.9 33.8±6.6 0.061 Área Muscular 140.5±28.1 123.1±30.4 128.4±25.0 0.163 Área TAV 194.9±102.0 132.4±110.4 151.4±112.6 0.213 Área TAS 224.9±119.0 145.2±84.9 129.2±73.4 0.015 IME 53.2±9.1 48.3±9.1 45.2±6.0 0.034 MIG 48.2±8.4 43±9.1 44.6±7.5 0.174
Tabela 12: Medições obtidas por realização da TAC, por localização da neoplasia Resultados expressos em média ±
20 Verificou-se também que 23% dos doentes da amostra apresentaram sarcopénia nesta fase precoce de diagnóstico, sendo mais prevalente nas mulheres (36.8%) que nos homens (19.4%) (Tabela 13). Entre estes 23% de doentes sarcopénicos apenas 2 doentes revelaram obesidade sarcopénica.
Ao fazermos uma análise da prevalência da sarcopénia por localização da neoplasia (Tabela 14) constatou-se que são os doentes com tumor no estômago que apresentam valores superiores (33.3%), não se verificando, no entanto, diferenças estatisticamente significativas entre os grupos.
Homens (n=31) Mulheres (n=19)
Doentes sarcopénicos 19.4 (6) 36.8 (7)
Doentes não sarcopénicos 80.6 (25) 63.2 (12)
Tabela 13: Prevalência da sarcopénia, por géneros Resultados expressos em percentagem (n)
Cólon (n=22) Estômago (n=15) EPVB (n=13)
Doentes sarcopénicos 22.7 (5) 33.3 (5) 23.1 (3)
Doentes não sarcopénicos 77.3 (17) 66.7 (10) 76.9 (10)
Tabela 14: Prevalência da sarcopénia, por localização da neoplasia. Resultados expressos em percentagem (n)
4.7. Estado Nutricional
De acordo com o PG-SGA, constatou-se que 71.9% dos doentes estavam desnutridos, sendo 38.6% (n=22) moderadamente desnutridos, 33.3% (=19) gravemente desnutridos, enquanto que apenas 28.1% (n=16) se encontravam bem nutridos. Não se verificaram diferenças estatisticamente significativas entre géneros para esta variável.
Porém, ao analisarmos o estado nutricional considerando a localização da neoplasia (Tabela 15) encontraram-se diferenças estatisticamente significativas entre grupos. De salientar o grupo de doentes com tumor do EPVB cuja prevalência de desnutrição é de 100%. Nos doentes com tumor no cólon a prevalência de desnutrição é de 55.5%, e nos doentes com tumor no estômago este valor sobe para 73.3%, sendo este grupo de doentes o que apresenta uma desnutrição grave mais acentuada.
21 Cólon (n=27) Estômago (n=15) EPVB (n=15) Bem nutridos 44.4 (12) 26.7 (4) 0 (0) Moderadamente desnutridos 37 (10) 20 (3) 60 (9) Gravemente desnutridos 18.5 (5) 53.3 (8) 40 (6)
Tabela 15: Estado nutricional, por localização da neoplasia. Resultados expressos em percentagem (n)
4.8. Ingestão alimentar
Diferenças estatisticamente significativas entre géneros no que respeita a IA foram verificadas para a ingestão calórica (homens: 2839±1235, mulheres: 2084±1028, p=0.019) e lipídica (homens: 135.2±65.2, mulheres: 101.63±55.8, p=0.035), sendo que o sexo masculino apresenta valores médios superiores em ambas.
Também na ingestão proteica e glucídica o sexo masculino apresenta valores médios superiores, no entanto as diferenças não foram estatisticamente significativas (Tabela 16).
Homens (n=36) Mulheres (n=18) Valor p
Ingestão calórica 2839±1235 2084±1028 0.019
Ingestão proteica 101.12±43.9 82.47±42.26 0.102
Ingestão glucídica 264.1±133.3 208.85±83.4 0.107
Ingestão lipídica 135.2±65.2 101.63±55.8 0.035
Tabela 16: IA por géneros Resultados expressos em média ± d.p.
Não foram encontradas diferenças estatisticamente significativas de ingestão entre as diferentes localizações da neoplasia (Tabela 17). Todavia, os doentes com tumores do EPVB apresentaram valores médios de ingestão calórica e proteica superiores e valores médios de ingestão lipídica inferiores (Tabela 17).
22 Cólon (n=25) Estômago (n=14) EPVB (n=14) Valor p Ingestão calórica 2547±1129 2571±1222 2921±1394 0.779 Ingestão proteica 94.3±40.4 94.9±37.2 101.5±53.4 0.917 Ingestão glucídica 248.4±120.5 242.9±93.4 243.2±153.9 0.955 Ingestão lipídica 128.7±58.5 128±61.8 111.6±75.6 0.667
Tabela 17: IA por localização da neoplasia. Resultados expressos em média ± d.p.
Ao analisarmos a IA e considerando o facto de os doentes serem ou não sarcopénicos (Gráficos 1, 2 e 3), verificou-se que para todos os parâmetros os doentes sarcopénicos apresentam valores inferiores. No entanto, apenas se verificaram diferenças estatisticamente significativas entre estes grupos de doentes para a ingestão proteica (sarcopénicos: 100.8±38.2, não sarcopénicos: 104.7±43.1, p=0.035) (Gráfico 2), ingestão de gorduras monoinsaturadas (sarcopénicos: 64.3±33.2, não sarcopénicos: 89.9±31.4), ingestão de gorduras polinsaturadas (sarcopénicos: 13.5±4.4, não sarcopénicos: 16.6±7.3, p=0.038) e ingestão de gorduras saturadas (sarcopénicos: 24.7±11.5, não sarcopénicos: 34.1±14.1, p=0.043). Importa, ainda, salientar que para a ingestão de colesterol há uma tendência que remete para a diferença de ingestão entre estes dois grupos (sarcopénicos: 232.4±107.2, não sarcopénicos: 304±109.4, p= 0.054).
Gráfico 1: Ingestão calórica e de macronutrientes, doentes sarcopénicos vs. não sarcopénicos
0 500 1000 1500 2000 2500 3000
Kcal Proteinas Lípidos Hidratos de carbono
Sarcopénicos Não sarcopénicos
23 98 99 100 101 102 103 104 105 Ingestão proteica Sarcopénicos Não sarcopénicos 0 50 100 150 200 250 300 350 Sarcopénicos Não sarcopénicos
Gráfico 3: Ingestão dos componentes lipídicos, doentes sarcopénicos vs. não sarcopénicos Gráfico 2: Ingestão proteica, doentes sarcopénicos vs. não sarcopénicos
24 4.9.Parâmetros bioquímicos
Não foram encontradas diferenças estatisticamente significativas, entre géneros, para nenhum dos parâmetros considerados (Tabela 18). Porém, verificou-se que os valores médios de PCR são consideravelmente superiores nos homens (Tabela 18). Também para a localização da neoplasia não foram encontradas diferenças estatisticamente significativas, para nenhum dos parâmetros considerados (Tabela 19). No entanto, constatou-se que os valores médios de PCR são consideravelmente superiores nos doentes com tumor no EPVB (Tabela 19).
Homens (n=21) Mulheres (n=12) Valor p
Albumina 3.76±0.62 3.75±0.62 0.952
Proteínas totais 6.62±1.69 6.75±0.75 0.835
PCR 6.29±7.7 4.0±7.8 0.053
Tabela 18: Parâmetros bioquímicos, por géneros. Resultados expressos em média ± d.p.
Cólon (n=11) Estômago (n=9) EPVB (n=9) Valor p
Albumina 3.86±0.36 3.67±0.5 3.78±0.97 0.889
Proteínas totais 7.14±2.11 6.44±1.17 6.22±2.11 0.136
PCR 4.14±4.83 4.22±9.1 8.67±10.08 0.163
Tabela 19: Parâmetros bioquímicos, por localização da neoplasia. Resultados expressos em média ± d.p.
4.10. Correlação entre resultados provenientes da TAC, medidas antropométricas e BIA
Verificou-se uma correlação positiva fraca/moderada entre a MIG-TAC e o IMC (r=0.338, p=0.016), perímetros braquial (r=0.313, p=0.028) e cintura (r=0.346, p=0.014) e AMB (r=0.323, p= 0.024), bem como uma correlação positiva forte entre a MIG-TAC e MIG- BIA (r=0.744, p<0.001).
Além disso, a concordância entre a MIG-TAC e MIG - BIA (Gráfico 4) foi determinada calculando as diferenças entre ambas e posteriormente testada a hipótese
25 nula, em que esta diferença é zero. Uma vez que foi obtido um p= 0.405 assumimos que há uma concordância entre os valores de MIG provenientes da TAC e da BIA.
Na análise univariada (Tabela 20) verifica-se que um aumento nos valores de PCR (OR:1.10, 95% IC [1.00-1.24], p=0.062) e idade (OR: 1.087, 95%IC [1.01-1.18], p=0.04) estão associados a um maior risco de sarcopénia, enquanto que um aumento da ingestão proteica se associa a uma redução do risco de sarcopénia (OR:0.98, 95%IC [0.96-0.99], p=0.038). Esta análise permite-nos também verificar que as medições antropométricas, as medições provenientes da BIA e a determinação do estado nutricional pelo PG-SGA não parecem ser preditores importantes da sarcopénia.
Na análise multivariada (Tabela 21), ajustada para as variáveis precedentes e para a ingestão calórica, observou-se que estas associações se mantiveram estatisticamente significativas, sendo: PCR (OR: 1.19, IC[1.03-1.46], p=0.04), idade
26 (OR: 1.11, 95%IC [1.01-1.26], p=0.05) e ingestão proteica (OR: 0.98, IC [0.95-1.00], p=0.08).
A análise da curva ROC (Gráfico 5) comprova que um modelo que inclua a PCR, idade e ingestão proteica apresenta um poder discriminatório adequado (AUC= 0.841).
27
Sarcopénia Análise univariada
Variável OR IC Valor p Albumina 0.24 0.05-1,03 0.06 Proteínas totais 0.8 0.5-1.33 0.435 PCR 1.10 1.00-1.24 0.062 MIG-BIA 0.966 0.91-1.01 0.224 IMC 0.975 0.86-1.08 0.659 PB 1.06 0.89-1.2 0.49 PCT 1.02 0.94-1.11 0.51 PC 1.03 0.98-1.07 0.19 Score IPAQ 1.2314815 0.34- 4.50 0.7473 Ingestão calórica 0.9995851 0.99-1.00 0.1918 Ingestão proteica 0.9823325 0.96-0.99 0.0517 PG –SGA 0.8665 A 1.00 B 0.64 0.12-3.35 C 0.80 0.16-4.01 Sexo Feminino 1.00 Masculino 0.4114286 0.10-1.49 0.1771 Idade 1.087 1.01- 1.18 0.037
Tabela 20: Análise univariada de fatores preditivos de sarcopénia Resultados expressos em Odds ratio (OD),
28
Sarcopénia Análise multivariada
Variável OR IC Valor p
PCR 1.19 1.03- 1.46 0.0426
Ingestão calórica 1.00 0.99-1.002 0.490
Ingestão proteica 0.98 0.95-1.001 0.0870
Idade 1.11 1.01-1.262 0.0537
Tabela 21: Análise multivariada de fatores preditivos de sarcopénia Resultados expressos em Odds ratio, Intervalo
29 5. DISCUSSÃO
A relevância da avaliação nutricional e da intervenção nutricional tem vindo a ser reconhecida, dada a elevada prevalência de desnutrição nos doentes oncológicos
(57,58)
. A evidência científica é clara quanto às consequências da desnutrição: pior QV(27,29), maior número de infeções e de tempo de internamento(27,28), menor resposta aos tratamentos e maior mortalidade(21,23,27).
Nesse sentido, o diagnóstico precoce de desnutrição é essencial, o que remete para o papel preponderante da avaliação da composição corporal e do estado nutricional do doente não só depois de confirmado o diagnóstico de doença oncológica mas também em todas as fases da doença(20).
A maioria dos estudos que incluem avaliação da composição corporal de doentes oncológicos recorre a métodos que não apresentam uma boa correlação com o DEXA, que é o golden standard na avaliação da massa muscular(40). Em contrapartida a avaliação da massa muscular através da análise de imagens de TAC tem mostrado uma boa correlação com o DEXA(40).
Porém, são escassos os estudos que comparam estes métodos em populações oncológicas assim como estudos que façam uma caracterização da composição corporal, do estado nutricional, da QV e da IA numa fase tão precoce do diagnóstico da doença oncológica, encontrando-se assim a pertinência do presente estudo.
Em termos demográficos, no presente estudo constatou-se que mais de metade dos doentes são do sexo masculino, o que se mostra concordante com outros estudos realizados em populações com tumores gastrointestinais(23,32) e com as estatísticas nacionais(8).
No que diz respeito aos estilos de vida, constatou-se que o consumo de álcool e os hábitos tabágicos, descritos na literatura como fator de risco para este tipo de neoplasias(59), são pouco prevalentes no diagnóstico para a população estudada. Este resultado poderá ser explicado pelo facto de os doentes reduzirem quer os hábitos tabágicos quer os hábitos alcoólicos após o diagnóstico da doença. Relativamente à AF
30 no diagnóstico, apurou-se que cerca de metade da amostra tem uma AF baixa, e que a restante ainda mantém uma AF moderada. Nesse sentido, e apesar do presente estudo não ter encontrado associação entre a prática de AF no diagnóstico e a sarcopénia, torna-se imperativo estimular os doentes quanto à prática da mesma. A literatura sugere que, mesmo após a instalação da doença, a prática regular de AF tem vários benefícios, entre os quais, uma ação potenciadora da síntese proteica, evitando a perda de massa magra e consequentemente a perda de força muscular e capacidade funcional(60). Além disso, verifica-se também uma melhoria na sensibilidade à insulina, que culmina num aumento do metabolismo do músculo esquelético(60). Por outro lado, a AF parece ter um efeito moderador da toxicidade desencadeada pelos tratamentos anti-neoplásicos, visto que atenua muitos dos sintomas e dos efeitos secundários provocados pelos mesmos(61).
Em termos de capacidade funcional, verificou-se que praticamente metade dos doentes ainda se mantêm totalmente ativos no momento do diagnóstico, apesar de um número muito próximo reportar uma atividade restrita. Este resultado é concordante com os estudos realizados por Martin et al(32), numa população com neoplasias gastrointestinais ou do trato respiratório, e Prado et al(23), numa população de doentes com diagnóstico recente de neoplasia gastrointestinal ou do trato respiratório, no grupo de doentes sem sarcopénia, em que a maioria dos doentes apresentava um PS de 0 ou 1.
Relativamente à QV, concluiu-se que nas dimensões funcional e de sintomas há diferenças estatisticamente significativas entre géneros, sendo o sexo masculino o que reporta melhores parâmetros de QV. No entanto, verificou-se que, na presente população, a localização da neoplasia não é uma determinante para diferenças de QV. Resultados contrários foram encontrados por Ravasco et al(62), num estudo que avaliou a QV de doentes com neoplasias gastrointestinais, em que a localização da doença se mostrou uma determinante da QV, e onde os doentes com neoplasias do esófago e do estômago foram os que apresentaram uma QV inferior.
No que diz respeito às medições antropométricas, verificou-se que o peso médio da nossa amostra foi ligeiramente inferior para os homens, mas semelhante para o sexo feminino, quando comparado com o estudo de Baracos et al(30), numa população de doentes com diagnóstico recente de neoplasia do trato respiratório, e com o estudo de Martin et al(32)(Tabela 22). Relativamente à percentagem de peso perdido no último
31 mês, no nosso estudo os valores encontrados mostraram-se inferiores aos descritos por Martin et al(32), e aos publicados por Baracos et al(30) (Tabela 22). As diferenças encontradas podem ser justificadas pelo facto de ambos os autores terem considerado valores de perda de peso aos seis meses, enquanto que no presente estudo foi considerada a perda de peso no último mês. Ravasco et al(62), que também considerou a perda de peso em seis meses, reportou os doentes com tumor no cólon como sendo os que apresentaram maior perda ponderal, em oposição aos doentes com tumor no esófago, sendo estes resultados contrários aos resultados do presente estudo.
Também para o IMC valores diferentes aos descritos na literatura foram encontrados, pois os valores globais de IMC do presente estudo revelaram-se superiores aos reportados por Tan et al(63), num estudo em doentes com diagnóstico de neoplasia pancreática primária, mas inferiores aos encontrados por Prado et al(23) (Tabela 22). Esta diferença pode ser explicada pelo facto deste último ter sido realizado com uma amostra de doentes obesos. Ainda em relação ao IMC, comparativamente com o estudo de Martin et al(32) constatou-se que a nossa amostra apresenta valores de IMC superiores para o sexo feminino, mas semelhantes para o sexo masculino (Tabela 22). Os valores médios de IMC encontrados no presente estudo, 26.4±4.9 e 27.1±7.02, para homens e mulheres respectivamente, revelaram-se ligeiramente superiores aos valores médios de IMC da população saudável portuguesa: 25.7 kg/m2 para os homens e 26.7 kg/m2 para as mulheres(64). Na Tabela 22 encontram-se expressos todos os valores referentes às medições antropométricas, dos vários estudos referenciados.
32
Global Homens Mulheres
Peso Presente estudo 70.6±16.2 74.4±14.6 63.7±17.1 Baracos et al(30) 77.0±13.7 64.0±16 Martin et al(32) 80.1±16.2 65.3±15.7 %peso perdido Presente estudo 0.7±6.0 0.5±1.0 0.9±5.6 Baracos et al(30) 6.39±7.76 5.58±8.06 Martin et al(32) 7.5±7.7 7.1±7.8 IMC Presente estudo 26.6±5.7 26.4±4.9 27.1±7.02 Prado et al(23) 33.9±4.4 34.7±4.3 Martin et al(32) 26±4.9 25.1±5.8 Tan et al(63) 23.9±4.9
Tabela 22: Medições antropométricas dos vários estudos. Resultados expressos em média ± d.p.
Apesar de não haver estudos em populações semelhantes que tenham incluído medições da PCT, PB, PC e AMB, e não obstante o facto de as diferenças não serem estatisticamente significativas entre grupos, importa destacar o facto de os doentes com tumor do EPVB apresentarem os valores médios mais baixos para todos os perímetros considerados. Este dado remete-nos para a necessidade de uma especial atenção com este grupo de doentes, de modo a evitar a depleção não só de MIG mas também de MG. Importa salientar a correlação positiva, ainda que seja fraca/moderada, encontrada entre o IMC, PB, PC e AMB com a MIG-TAC, facto que até aqui não havia sido descrito pela literatura.
A MIG-BIA não se mostrou como um preditor independente de sarcopénia, o que se revela coerente com os dados da literatura, já que as alterações de hidratação e a ascite são fatores que se encontram frequentemente presentes em doentes oncológicos e que influenciam diretamente os valores de MIG obtidos pela BIA(34,48,65,66). No nosso estudo, o valor médio global de MIG foi de 48.5±12.5, enquanto que o valor médio para os homens foi de 54.4±10.04 e para as mulheres de 38±9.8, dados que se revelaram