Aplicação de subprodutos agroindustriais como fontes de nitrogênio para a
produção de soforolipídios por Starmerella bombicola
Application of agro-industrial by-products as nitrogen sources in the production
of sophorolipids by Starmerella bombicola
DOI:10.34117/bjdv6n3-380
Recebimento dos originais: 10/02/2020 Aceitação para publicação: 24/03/2020
Leandro Afonso
Mestrando em Microbiologia pela Universidade Estadual de Londrina (UEL) Instituição: Universidade Estadual de Londrina
Endereço: Departamento de Microbiologia, Rodovia Celso Garcia Cid, PR 445, Km 380 (Campus Universitário), Londrina – PR, Brasil
E-mail: lafonso.bio@gmail.com
Victória Akemi Itakura Silveira
Doutoranda em Biotecnologia pela Universidade Estadual de Londrina (UEL) Instituição: Universidade Estadual de Londrina
Endereço: Departamento de Bioquímica e Biotecnologia, Rodovia Celso Garcia Cid, PR 445, Km 380 (Campus Universitário), Londrina – PR, Brasil
E-mail: victoriiakemi@hotmail.com
Talita De Oliveira Caretta
Doutoranda em Biotecnologia pela Universidade Estadual de Londrina (UEL) Instituição: Universidade Estadual de Londrina
Endereço: Departamento de Bioquímica e Biotecnologia, Rodovia Celso Garcia Cid, PR 445, Km 380 (Campus Universitário), Londrina – PR, Brasil
E-mail: talita_oca@hotmail.com
Dionísio Borsato
Doutor em Ciências de Alimentos pela Universidade Estadual de Londrina (UEL) Instituição: Universidade Estadual de Londrina
Endereço: Departamento de Química, Rodovia Celso Garcia Cid, PR 445, Km 380 (Campus Universitário), Londrina – PR, Brasil
E-mail: dborsato@uel.br
Maria Antonia Pedrine Colabone Celligoi
Doutora em Ciências Biológicas (Biologia Vegetal) pela Universidade Estadual Paulista Júlio de Mesquita Filho (UNESP)
Instituição: Universidade Estadual de Londrina
Endereço: Departamento de Bioquímica e Biotecnologia, Rodovia Celso Garcia Cid, PR 445, Km 380 (Campus Universitário), Londrina – PR, Brasil
E-mail: macelligoi@uel.br
RESUMO
Soforolipídios são biossurfactantes da classe dos glicolipídios e são produzidos pela levedura
processo de produção, a escolha das fontes de carbono e nitrogênio podem direcionar para altos rendimentos e variar a estrutura química dos soforolipídios produzidos, conduzindo assim para aplicações específicas. Para reduzir os custos de produção, o uso de substratos alternativos e a otimização podem viabilizar o processo. O objetivo deste trabalho foi avaliar as fontes alternativas de nitrogênio, proteína de soja, milhocina e soro de leite utilizando o delineamento Box-Behnken na produção de soforolipídios por S. bombicola. As fermentações foram em frascos Erlenmeyer em meio contendo (g.L-1): fontes de nitrogênio, 0,5 a 1,5; ácido oleico, 75 e glicose, 77,5, incubação à
30ºC, 150 rpm por 120 horas. A melhor produção foi de 36,13 g.L-1 na presença de 1,5 g.L-1 de proteína de soja, 0,5 g.L-1 de milhocina e 0,5 g.L-1 de soro de leite. A proteína de soja, milhocina e a interação entre essas fontes foram significativas para a produção (p<0,05) e as fontes de nitrogênio estudadas mostraram ser promissoras para a produção de soforolipídios, como uma proposta para a redução dos custos do bioprocesso.
Palavras-chave: proteína de soja, milhocina, soro de leite, planejamento estatístico,
biossurfactante.
ABSTRACT
Sophorolipids are biosurfactants of the glycolipid class and they are produced by the yeast
Starmerella bombicola, which presents high productivity and no pathogenicity. In the production
process, the choice of carbon and nitrogen sources can lead to high yields and variation of the chemical structure of the produced sophorolipids, thus leading to specific applications. To reduce production costs, the use of alternative substrates and their optimization can make the process feasible. The objective of this work was to evaluate alternative sources of nitrogen, soy protein, corn step liquor and whey using the Box-Behnken design to produce sophorolipids by S. bombicola. Fermentations were carried out in Erlenmeyer flasks in medium containing (g.L-1): nitrogen sources, 0.5 to 1.5; oleic acid, 75 and glucose, 77.5, incubation at 30ºC, 150 rpm for 120 hours. The best production was 36.13 g.L-1 in the presence of 1.5 g.L-1 of soy protein, 0.5 g.L-1 of corn step liquor and 0.5 g.L-1 of whey. The soy protein, corn step liquor and the interaction between these substrates were significant for the production of sophorolipids (p<0.05) and the nitrogen sources studied showed to be promising for the production of sophorolipids, as a proposal to reduce the costs of the bioprocess.
Keywords: Soy protein, corn step liquor, whey, statistical design, biosurfactant.
1. INTRODUÇÃO
Soforolipídios são biossurfactantes formados por uma molécula de soforose unida por ligação β-glicosídica à uma longa cadeia de ácido graxo (ASHBY; SOLAIMAN, 2010; PAULINO
et al., 2016; VAN BOGAERT et al., 2007). Este biossurfactante pode ser produzido por vários
microrganismos, dentre os quais destacam-se Starmerella, Rhodotorula, Cryptococcus,
Cyberlindnera, Pichia, Torulopsis, Wickerhamiella; sendo Starmerella bombicola a levedura mais
estudada devido seus altos rendimentos de produção e reconhecimento como GRAS (Generally
Recognized as Safe), segura para a saúde humana e animal (OLIVEIRA et al., 2015).
A biossíntese de soforolipídios ocorre na presença de fontes de carbono hidrofílicas e hidrofóbicas, ao final da fase exponencial e início da fase estacionária de crescimento do
microrganismo produtor, em condições de nitrogênio limitantes, que elevam a atividade das enzimas envolvidas no processo, estimulando a produção dessa biomolécula (CASAS; GARCÍA DE LARA; GARCÍA-OCHOA, 1997; RAU et al., 2001; ZHOU; KOSARIC, 1995).
Quanto as fontes de nitrogênio, o microrganismo pode utilizar fontes orgânicas (extrato de levedura, extrato de malte, extrato de peptona, peptona de soja), inorgânicas (nitrato de amônio, nitrato de sódio, sulfato de amônio, cloreto de amônio) e fontes complexas (extrato de malte e milhocina). O extrato de levedura é apontado como a melhor fonte para a produção de soforolipídios e biomassa pela levedura, contribuindo com nitrogênio, vitaminas e sais minerais (OLIVEIRA et al., 2014).
Durante a fermentação, os soforolipídios são sintetizados como uma mistura de moléculas relacionadas, classificadas em estruturas acídicas e lactônicas, as quais podem variar em graus de acetilação e ácidos graxos (comprimento da cadeia, saturação e posição da hidroxilação). Essas diferenças estruturais causam variações nas propriedades físico-químicas e biológicas dos soforolipídios que podem direcionar para futuras aplicações (ASHBY; SOLAIMAN; FOGLIA, 2008; ASMER et al., 1988; MA et al., 2019).
As formas lactônicas são mais hidrofóbicas e apresentam atividades biocidas, anticâncer, espermicida, citotóxica e pró-inflamatória, enquanto que as formas acídicas apresentam maiores atividades como antiespumante e também maior solubilidade em água, tendo aplicações no ramo alimentício, de biorremediação e cosmético (NITSCHKE; PASTORE, 2002; OLIVEIRA et al., 2015; PAULINO et al., 2016).
Apesar das diversas aplicações dos soforolipídios, os altos custos da produção em larga escala, ainda são obstáculos para sua competitividade econômica (ROELANTS et al., 2019; WANG et al., 2020). É estimado que cerca de 60% do custo total seja atribuído ao meio de cultura e aos processos de recuperação do produto (MA et al., 2019). Atualmente, as estratégias utilizadas envolvem o emprego de substratos de baixo custo e o desenvolvimento de bioprocessos eficientes e otimizados (KAUR et al., 2019; OLIVEIRA et al., 2014).
O desafio atual é aumentar a produção de soforolipídios e diminuir o custo e o impacto ambiental (CLAUS; VAN BOGAERT, 2017; KAUR et al., 2019; ROELANTS et al., 2019), através da conversão de resíduos agroindustriais em produtos de alto valor, como este biossurfactante (MA et al., 2019; WANG et al., 2018).
Alguns dos principais substratos agroindustriais amplamente produzidos no Brasil são o melaço e caldo de cana-de-açúcar, melaço de soja, proteína de soja, milhocina e soro de leite (PAN
como substratos alternativos em meios de cultivo, reduzindo os custos de produção e gerando biomoléculas de valor agregado.
Neste contexto, o objetivo deste trabalho foi avaliar o efeito dos subprodutos agroindustriais proteína de soja, milhocina e soro de leite, como fontes alternativas de nitrogênio, substituindo o extrato de levedura, visando a diminuição dos custos de produção dos soforolipídios.
2. MATERIAL E MÉTODOS
2.1MICRORGANISMOECONDIÇÕESDEPRESERVAÇÃO
O microrganismo utilizado foi a levedura Starmerella bombicola cepa ATCC 22214, obtida da American Type Culture Collection (ATCC®, Manassas, USA) em 2013, fazendo parte da coleção de microrganismos do Laboratório de Pesquisa em Bioquímica e Biotecnologia da Universidade Estadual de Londrina, Paraná.
A preservação do microrganismo foi realizada em meio composto por (em g.L-1): glicose, 10; extrato de levedura, 3; peptona, 5 e ágar, 20, com pH ajustado à 6,0 ± 0,2. Os repiques da cepa foram realizados a cada 4 semanas e mantidos à 4°C (DAVEREY; PAKSHIRAJAN, 2009).
2.2PRODUÇÃODESOFOROLIPÍDIOSAPLICANDOODELINEAMENTOFATORIAL BOX-BEHNKEN
O microrganismo foi ativado em frasco Erlenmeyer de 150 mL contendo 25 mL do meio de cultura (g.L-1): glicose, 100; extrato de levedura, 10; ureia, 1 (BAJAJ; ANNAPURE, 2015). O
microrganismo foi inoculado por meio de alça de platina esterilizada e a incubação foi realizada em shaker orbital por 48h a 30ºC e 150 rpm, obtendo-se o inóculo que foi padronizado em 10% v/v para as fermentações.
O processo fermentativo foi realizado em frascos Erlenmeyers de 150 mL com 25 mL de meio contendo (g.L-1): ácido oleico, 75; glicose, 77,5 (MINUCELLI et al., 2017) e com as fontes de
nitrogênio variando de 0,5 a 1,5.
As fontes de nitrogênio utilizadas foram: proteína de soja, milhocina e soro de leite, variando as concentrações seguindo o delineamento experimental Box-Behnken (Tabela 1) (MONTGOMERY, 2012). As variações foram em três níveis -1, 0 e +1 equivalentes às concentrações de 0,5, 1,0 e 1,5 g.L-1, respectivamente. Foram realizados 15 ensaios com triplicata do ponto central. As fermentações foram realizadas em shaker orbital a 150 rpm, por 120 horas sob 30°C.
A fermentação foi interrompida por centrifugação a 9000 rpm durante 15 minutos a 4oC, obtendo-se o sobrenadante (extrato livre de células) e a biomassa. A biomassa produzida foi lavada
três vezes com 5 mL de acetato de etila e solubilizada em água destilada, sendo posteriormente seca em estufa a 60°C durante 48h. A biomassa foi quantificada por gravimetria (em g.L-1) e os açúcares
residuais pelo método de Somogyi-Nelson a partir do sobrenadante.
2.3EXTRAÇÃOEQUANTIFICAÇÃODESOFOROLIPÍDIOS
Os soforolipídios foram extraídos do sobrenadante por partição líquido-líquido na proporção de 1:1 v/v (sobrenadante:acetato de etila) realizada três vezes. A fase aquosa, resultante deste processo, foi descartada e a fase orgânica foi concentrada em evaporador rotativo (MINUCELLI et
al., 2017).
A fase orgânica obtida e seca, foi submetida novamente a partição utilizando 25 mL de hexano e 25 mL de uma solução metanol:água (4:1 v/v). Por meio deste sistema de separação obteve-se as fases lipídica residual (hexano) e a fase contendo soforolipídios (metanol) (MINUCELLI et al., 2017). A fase hexânica foi seca em temperatura ambiente e a concentração de lipídios residuais foi estimada para g.L-1 por gravimetria.
Da fase contendo soforolipídios foram removidos açúcares e demais impurezas pela adição de acetato de etila:água destilada (3:1 v/v), por três vezes, mantida a 4ºC por 40 minutos. A fase aquosa resultante foi descartada e a fase orgânica seca para a determinação gravimétrica de soforolipídios (FONTOURA, 2017).
2.4ANÁLISESESTATÍSTICAS
Os resultados da produção dos soforolipídios foram avaliados pela análise de variância (ANOVA) pelo software Statistica® 12 (2013).
3. RESULTADOS E DISCUSSÃO
As respostas de produção de soforolipídios, biomassa, consumos de açúcar e ácido oleico por
S. bombicola estão apresentadas na Tabela 1. As maiores produções foram obtidas nos ensaios 2 e 4
com 36,13 e 35,25 g.L-1, respectivamente.
Tabela 1 – Biomassa, consumos de ácido oleico e glicose e produção de soforolipídios por Starmerella bombicola sob variação de fontes de nitrogênio.
Ensaios
Níveis dos Fatores
x1 x2 x3 Biomassa (g.L-1) Consumo de Ácido Oleico (g.L-1) Consumo de Glicose (g.L-1) Soforolipídios (g.L-1) 1 -1 -1 0 06,51 23,92 33,72 17,86 2 1 -1 0 16,70 34,73 58,85 36,13
A análise de variância (Tabela 2) apontou que a variável proteína de soja foi significativa (p<0,05) na produção de soforolipídios em seus termos linear (p = 0,001276) e quadrático (p = 0,014435), bem como o termo quadrático da variável milhocina (p = 0,026534) e a interação entre proteína de soja e milhocina (p = 0,047635). O modelo obtido pelos dados experimentais pode ser utilizado considerando o valor do coeficiente de determinação (R2 = 93,72%) e a falta de ajuste não foi significativa (p = 0,108429), sugerindo um bom ajuste do modelo aos dados experimentais, confirmando o predito e previsto da produção de soforolipídios.
A variável soro de leite (x3) não apresentou significância ao modelo de produção de soforolipídios, portanto, esta variável foi removida. Foram mantidas nas análises apenas as variáveis com um termo significativo (linear ou quadrático) e interações significativas.
Tabela 2 –Análise de variância (ANOVA) da produção de soforolipídios por Starmerella bombicola sob diferentes fontes de nitrogênio.
Fator Soma dos
quadrados Graus de liberdade Quadrado médio F p-valor Proteína de soja (L) 344,4000 1 344,4000 782,4902 0,001276* Proteína de soja (Q) 29,8323 1 29,8323 67,7802 0,014435* Milhocina (L) 5,2975 1 5,2975 12,0362 0,073981 Milhocina (Q) 15,9301 1 15,9301 36,1939 0,026534*
Proteína de soja (L) x Milhocina (L) 8,5849 1 8,5849 19,5052 0,047635*
Falta de ajuste 26,4065 7 3,7724 8,5710 0,108429
Erro puro 0,8803 2 0,4401 - -
Soma dos quadrados 434,6966 14 - - -
R2 = 0,93723; *Significativo ao nível de 5% (p<0,05); (L) = Linear; (Q) = Quadrático.
3 -1 1 0 08,52 20,02 45,02 22,84 4 1 1 0 16,51 34,70 55,02 35,25 5 -1 0 -1 07,29 22,89 27,43 19,61 6 1 0 -1 16,36 45,30 64,50 28,83 7 -1 0 1 8,31 27,78 38,35 21,34 8 1 0 1 14,63 31,99 60,98 33,93 9 0 -1 -1 10,22 32,23 49,28 30,22 10 0 1 -1 13,14 32,19 55,39 32,36 11 0 -1 1 09,42 31,94 49,46 30,24 12 0 1 1 12,56 34,20 53,02 30,51 13 0 0 0 11,30 27,02 47,80 28,94 14 0 0 0 11,50 33,79 49,83 29,36 15 0 0 0 10,98 21,63 45,02 28,06
Códigos Fatores Níveis (g.L
-1)
-1 0 1
(X1) Proteína de soja 0,5 1 1,5
(X2) Milhocina 0,5 1 1,5
Os ensaios contendo as maiores produções de soforolipídios (2 e 4) foram os que continham as maiores concentrações de proteína de soja, e o efeito quadrático da milhocina é evidenciado devido a diferença da concentração empregada entre eles. Nestes, o consumo de glicose e ácido oleico foram muito próximos, mas não os maiores, o ensaio 6 indicou elevado consumo de glicose (64,5 g.L-1) e ácido oleico (45,3 g.L-1) porém seu rendimento, em termos produtivos, apresentou-se
inferior.
A partir dos resultados experimentais obtidos desenvolveu-se uma equação de regressão (R2 = 0,93723) para estimar a produção de soforolipídios (Equação 1):
Y = 28,77231∗+ 6,56125x1∗− 2,83404x12∗+ 0,81375x2+ 2,07096x22∗− 1,46500x1x2∗
(Eq 1)
Sendo: Y a variável resposta (produção de soforolipídios); x1 e x2 os valores codificados das variáveis proteína de soja e milhocina, respectivamente.; * indica valores significativos.
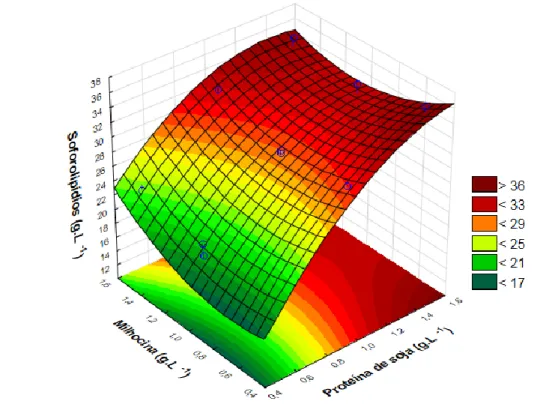
A superfície de resposta (Figura 1) reafirma que o aumento da concentração de proteína de soja promove aumentos na produção de soforolipídios, bem como a utilização de concentrações específicas de milhocina. Assim, a fonte proteína de soja apresenta potencial produtivo frente à produção do biossurfactante.
Figura 1 – Superfície de resposta relacionando as fontes de nitrogênio proteína de soja e milhocina para a produção de soforolipídios por Starmerella bombicola (g.L-1).
Pan et al. (2015) realizaram dosagens de proteínas totais (método de Lowry) do extrato de levedura (117,79 ± 9,81 g.Kg-1), proteína de soja (128,85 ± 0,12 g.Kg-1), milhocina (45,81 ± 7,20
g.L-1) e soro de leite (17,34 ± 0,15 g.Kg-1), as mesmas fontes utilizadas no presente estudo,
confirmando que a proteína de soja apresenta potencial para utilização como uma fonte de nitrogênio alternativa substituindo o extrato de levedura convencionalmente utilizado, como uma proposta de reduzir custos de produção.
O extrato de levedura tem sido descrito como o mais eficaz para a produção de soforolipídios comparado à outras fontes orgânicas, como extrato de malte e peptona, e inorgânicas como acetato de amônio, sulfato de amônio, nitrato de amônio, carbonato de amônio, cloreto de amônio, nitrato de sódio e ureia (BAJAJ; TILAY; ANNAPURE, 2012). Essa eficiência é devido a disponibilidade de vitaminas e outros elementos traços essenciais presentes nesta fonte (CASAS; GARCÍA-OCHOA, 1999), neste trabalho a proposta é a substituição por subprodutos agroindustriais, ricos em nitrogênio e de custo menos elevado.
A produção de soforolipídios é iniciada quando o nitrogênio disponível foi utilizado para o crescimento celular, portanto a quantidade de nitrogênio disponibilizada pela fonte deve ser suficiente apenas para promover o crescimento (ELSHAFIE et al., 2015; KULAKOVSKAYA; KULAKOVSKAYA, 2014).
Ainda, as fontes de nitrogênio utilizadas e suas quantidades podem influenciar diretamente nas proporções dos tipos de soforolipídios produzidos (acídicos/lactônicos), culminando em destinações específicas de suas aplicações (LIU et al., 2016; MA et al., 2011; OLIVEIRA et al., 2014).
A Figura 2 apresenta o modelo de otimização para as variáveis proteína de soja, milhocina e soro de leite para a obtenção máxima de soforolipídios.
Figura 2 – Modelo de otimização da produção de soforolipídios por Starmerella bombicola com as variáveis proteína de soja, milhocina e soro de leite (fontes de nitrogênio).
Soro de leite (g.L-1) Milhocina (g.L-1) Proteína de soja (g.L-1)
A produção máxima de soforolipídios, segundo o modelo, seria de 35,22 g.L-1 utilizando os
fatores nos níveis (em g.L-1) proteína de soja 1,5 (+1) e milhocina 0,5 (-1). O soro de leite não
apresentou diferença nos níveis testados. A condição otimizada pode ser representada pelo ensaio 2, que obteve 36,13 g.L-1 (utilizando [em g.L-1]: 1,5, proteína de soja e 0,5, milhocina), este valor não
diferiu do proposto pelo modelo, sendo a produção de soforolipídios utilizando fontes alternativas de nitrogênio otimizada nas condições testadas.
4. CONCLUSÕES
A aplicação de fontes de nitrogênio de baixo custo, como subprodutos agroindustriais, podem constituir uma estratégia de diminuição dos custos de produção de soforolipídios. A proteína de soja e a milhocina podem ser fontes de nitrogênio substituintes aos substratos convencionalmente utilizados.
Starmerella bombicola atingiu a produção de soforolipídios de 36,13 g.L-1 utilizando (em g.L
-1) 1,5 de proteína de soja e 0,5 de milhocina, valor próximo ao otimizado pelo modelo testado que
foi de 35,22 g.L-1. Assim, essa pesquisa propõe o emprego de fontes alternativas de nitrogênio em substituição ao extrato de levedura, visando reduzir custos e propondo o uso de um subproduto agroindustrial para a produção desse biossurfactante.
AGRADECIMENTOS
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).
REFERÊNCIAS
ASHBY, R. D.; SOLAIMAN, D. K. Y. The influence of increasing media methanol concentration on sophorolipid biosynthesis from glycerol-based feedstocks. Biotechnology Letters, v. 32, n. 10, p. 1429–1437, 2010.
ASHBY, R. D.; SOLAIMAN, D. K. Y.; FOGLIA, T. A. Property control of sophorolipids: influence of fatty acid substrate and blending. Biotechnology Letters, v. 30, n. 6, p. 1093–1100, 2008.
ASMER, H. J.; LANG, S.; WAGNER, F.; WRAY, V. Microbial production, structure elucidation and bioconversion of sophorose lipids. Journal of the American Oil Chemists' Society, v. 65, n. 9, p. 1460–1466, 1988.
BAJAJ, V. K.; ANNAPURE, U. S. Castor oil as secondary carbon source for production of sophorolipids using Starmerella bombicola NRRL Y-17069. Journal of Oleo Science, v. 64, n. 3, p. 315-323, 2015.
BAJAJ, V.; TILAY, A.; ANNAPURE, U. Enhanced production of bioactive sophorolipids by
Starmerella bombicola NRRL Y-17069 by design of experiment approach with successive
purification and characterization. Journal of Oleo Science, v. 61, n. 7, p. 377-386, 2012.
CASAS, J. A.; GARCÍA DE LARA, S.; GARCÍA-OCHOA, F. Optimization of a synthetic medium for Candida bombicola growth using factorial design of experiments. Enzyme and Microbial
Technology, v. 21, n. 3, p. 221–229, 1997.
CASAS, J. A.; GARCÍA-OCHOA, F. Sophorolipid production by Candida bombicola: medium composition and culture methods. Journal of Bioscience and Bioengineering, v. 88, n. 5, p. 488-494, 1999.
CLAUS, S.; VAN BOGAERT, I. N. A. Sophorolipid production by yeasts: a critical review of the literature and suggestions for future research. Applied Microbiology and Biotechnology, v. 101, n. 21, p. 7811–7821, 2017.
DAVEREY, A.; PAKSHIRAJAN, K. Production of sophorolipids by the yeast Candida bombicola using simple and low-cost fermentative media. Food Research International, v. 42, n. 4, p. 499– 504, 2009.
ELSHAFIE, A. E.; JOSHI, S. J.; AL-WAHAIBI, Y. M.; AL-BEMANI, A. S.; AL-BAHRY, S. N.; AL-MAQBALI, D.; BANAT, I. M. Sophorolipids production by Candida bombicola ATCC 22214 and its potential application in microbial enhanced oil recovery. Frontiers in Microbiology, v. 6, n. 1324, p. 1-11, 2015.
FONTOURA, I. C. C. Soforolipídios de Candida bombicola: produção, caracterização e
propriedades antibacterianas contra patógenos humanos. 2018. Dissertação (Mestrado em
Biotecnologia) – Universidade Estadual de Londrina, Londrina, 2018.
KAUR, G.; WANG, H.; TO, M. H.; ROELANTS, S. L. K. W.; SOETAERT, W.; LIN, C. S. K. Efficient sophorolipids production using food waste. Journal of Cleaner Production, v. 232, p. 1– 11, 2019.
KULAKOVSKAYA, E. V.; KULAKOVSKAYA, T. V. Methods for studying yeast extracellular glycolipids. In: KULAKOVSKAYA, E. V.; KULAKOVSKAYA, T. V. Extracellular glycolipids
of yeasts: biodiversity, biochemistry, and prospects. Cambridge: Academic Press, 2014. p.
15-28.
LIU, X.; MA, X.; YAO, R.; PAN, C.; HE, H. Sophorolipids production from rice straw via SO3
micro-thermal explosion by Wickerhamiella domercqiae var. sophorolipid CGMCC 1576. AMB
Express, v. 6, n. 60, p. 1-11, 2016.
MA, X.; LI, H.; SHAO, L.; SHEN, J.; SONG, X. Effects of nitrogen sources on production and composition of sophorolipids by Wickerhamiella domercqiae var. sophorolipid CGMCC 1576.
Applied Microbiology and Biotechnology, v. 91, n. 6, p. 1623-1632, 2011.
MA, X.; MENG, L.; ZHANG, H.; ZHOU, L.; YUE, J.; ZHU, H.; YAO, R. Sophorolipid biosynthesis and production from diverse hydrophilic and hydrophobic carbon substrates. Applied
Microbiology and Biotechnology, v. 104, p. 77-100, 2019.
MINUCELLI, T.; RIBEIRO-VIANA, R. M.; BORSATO, D.; ANDRADE, G.; CELY, M. V. T.; OLIVEIRA, M. R.; BALDO, C.; CELLIGOI, M. A. P. C. Sophorolipids production by Candida
bombicola ATCC 22214 and its potential application in soil bioremediation. Waste and Biomass
Valorization, v. 8, n. 3, p. 743–753, 2017.
MONTGOMERY, D. C. Design and analysis of experiments. 8. ed. Nova York: John Wiley & Sons, 2012.
NITSCHKE, M.; PASTORE, G. M. Biossurfactantes: propriedades e aplicações. Química Nova, v. 25, n. 5, p. 772-776, 2002.
OLIVEIRA, M. R.; CAMILIOS-NETO, D.; ROCHA, C. B.; MAGRI, A., CELLIGOI, M. A. P. C. Biosynthesis and production of sophorolipids. International Journal of Scientific & Technology
Research, v. 3, n. 11, p. 133-146, 2014.
OLIVEIRA, M. R.; MAGRI, A.; BALDO, C.; CAMILIOS-NETO, D.; MINUCELLI, T.; CELLIGOI, M. A. P. C. Review: sophorolipids a promising biosurfactant and it’s applications.
International Journal of Advanced Biotechnology and Research, v. 6, n. 2, p. 161-174, 2015.
PAN, N. C.; VIGNOLI, J. A.; BALDO, C.; PEREIRA, H. C. B.; SILVA, R. S. S. F.; CELLIGOI, M. A. P. C. Agroindustrial byproducts for the production of hyaluronic acid by Streptococcus
zooepidemicus ATCC 39920. International Journal of Scientific & Technology Research, v. 4,
n. 4, p. 114-118, 2015.
PAULINO, B. N.; PESSÔA, M. G.; MANO, M. C. R.; MOLINA, G.; NERI-NUMA, I. A.; PASTORE, G. M. Current status in biotechnological production and applications of glycolipid biosurfactants. Applied Microbiology and Biotechnology, v. 100, n. 24, p. 10265- 10293, 2016.
RAU, U.; HAMMEN, S.; HECKMANN, R.; WRAY, V.; LANG, S. Sophorolipids: A source for novel compounds. Industrial Crops and Products, v. 13, n. 2, p. 85–92, 2001.
ROELANTS, S. L. K. W.; VAN RENTERGHEM, L.; MAES, K.; EVERAERT, B.; REDANT, E.; VANLERBERGHE, B.; DEMAESENEIRE, S. L.; SOETAERT, W. Microbial biosurfactants: from lab to market. In: BANAT, I. M.; THAVASI, R. Microbial Biosurfactants and their
Environmental and Industrial Applications. 1 ed. Boca Raton: CRC Press, 2019. p. 340–362.
VAN BOGAERT, I. N. A., SAERENS, K.; MUYNCK, C.; DEVELTER, D.; SOETAERT, W.; VANDAMME, E. J. Microbial production and application of sophorolipids. Applied Microbiology
WANG, H.; ROELANTS, S. L. K. W.; TO, M. H.; PATRIA, R. D.; KAUR, G.; LAU, N. S.; LAU, C. Y.; VAN BOGAERT, I. N. A.; SOETAERT, W.; LIN, C. S. K. Starmerella bombicola: recent advances on sophorolipid production and prospects of waste stream utilization. Journal of
Chemical Technology and Biotechnology, v. 94, n. 4, p. 999–1007, 2018.
WANG, H.; TSANG, C.; TO, M. H.; KAUR, G.; ROELANTS, S. L. K. W.; STEVENS, C. V.; SOETAERT, W.; LIN, C. S. K. Techno-economic evaluation of a biorefinery applying food waste for sophorolipid production – a case study for Hong Kong. Bioresource Technology, v. 303, n. 122852, p. 1-36, 2020.
ZHOU, Q.; KOSARIC, N. Utilization of canola oil and lactose to produce biosurfactant with